Contents
関連記事
雑記
www.ncbi.nlm.nih.gov/pmc/articles/PMC4694579/
・脳からの老廃物の除去は、血液脳関門(BBB)からが優勢という見解。
・タウもアミロイドβもBBBをそのままでは透過しないため輸送体が必要。
・タウのBBB経路のトランスポーターは同定されていない。
・間質液>脊髄液のバルクフローは明確な経路があるらしい。
アミロイドβの蓄積そのものが、グリンパティッククリアランスを減少させる。
AQP4
バルクフローはアクアポリン4(AQP4)が鍵をにぎる。
マウスではAQP4ノックアウトマウスはアミロイドβクリアランスが6~7割低減
ApoE4
ApoE4はアミロイドβクリアランス効率が悪い。ApoE4キャリアはアミロイドβクリアランスにより焦点をあてた治療対策が重要になってくる。
アミロイドβクリアランスは、トランスポーターの発現活性、リガンドの親和性と競合、血管の完全性に影響される。
高脂肪食
不健康な悪い高脂肪食を摂ることは、血管周囲のクリアランス経路の機能不全を起こす。
睡眠
睡眠中のアミロイドβクリアランスは覚醒中の二倍(マウス)
睡眠中は脳間質液から脳脊髄液への流れが加速しアミロイドβをBBBへ向かって洗い流す可能性。(グリンパティック系)、LRPもアップレギュレートする。
アルツハイマー病、加齢などでAQP1を介して心室への水分分泌が減少し、アミロイドβのリンパ系クリアランスが吸収が障害を受ける。
リンパ系クリアランスの障害は、血液脳脊髄液関門(BCSFB)の構造障害にも影響を与える。さらなるアミロイドβクリアランスの低下
くも膜絨毛からの脳脊髄液流出の抵抗がアルツハイマー病では高まる。→ くも膜絨毛へのアミロイド沈着
若年性アルツハイマー病におけるアミロイドβの過剰産生は、リンパ系のアミロイドβ吸収を増加させる可能性がある。頚部リンパ節、腋窩リンパ節でのアミロイドβの上昇
www.ncbi.nlm.nih.gov/pmc/articles/PMC4694579/
グリンパティック経路の機能障害は外傷性脳損傷のタウ病態を促進する。
www.ncbi.nlm.nih.gov/pubmed/25471560/
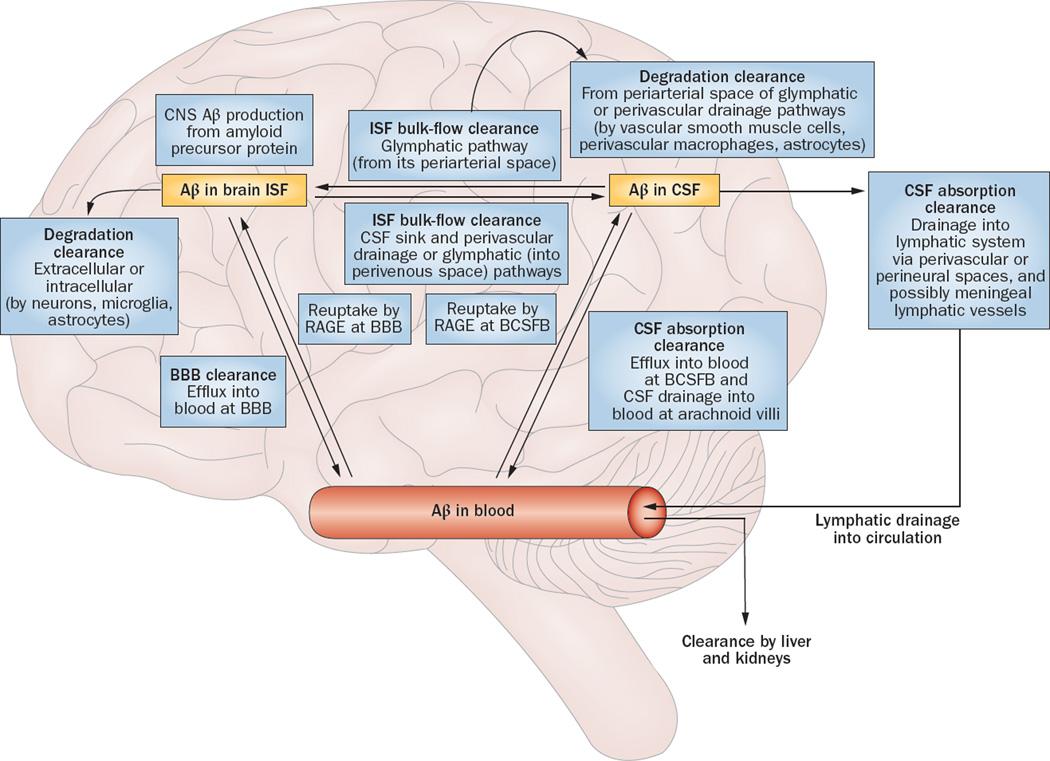
アミロイドβクリアランスのメカニズム
www.ncbi.nlm.nih.gov/pmc/articles/PMC3794520/
アミロイドβによるクリアランス阻害
アミロイドβ産生の最終段階であるγセクレターゼの部分阻害は、アミロイドβ分解経路を阻害することによって逆説的にアミロイドβ産生を増加させる。
アミロイドβは血液とCSFだけでなく、血管周囲の間質液廃液チャネルにそって沈着することが報告されている。> アミロイドβによるアミロイドβクリアランス障害
アミロイドβのリンパ球クリアランスは見過ごされているが、これは重要なクリアランス経路。
アミロイドβオリゴマーは、プリオンタンパク質やA7ニコチン性アセチルコリン受容体に結合し神経障害を引き起こす。
アミロイドβクリアランスの速度を遅らせる因子が、アミロイドβの蓄積を引き起こす可能性がある。
アルツハイマー病患者の90%がアミロイドクリアランス障害
成人のアミロイドβの合成率は7.6% クリアランス率は8.3%と推定されている。そのため正常な脳では蓄積する可能性は低い。
アルツハイマー病患者の90%がアミロイドβクリアランス障害に該当する!
脳内だけでなく、血管壁にアミロイドβが蓄積する可能性もある。
血管壁のアミロイドの蓄積は高齢者の脳室内出血の最も一般的な原因でもある。(脳アミロイド血管症CAA)
細胞外液(ISF)の大量流出によるアミロイドβの産生増加とアミロイドβの廃液閉塞
皮質障害領域のネプリライシンが減少 > 血管壁のアミロイドβ蓄積 > 脳アミロイド血管症
ミクログリアは、可用性および原線維形態のアミロイドβを取り込んで分解する。
ミクログリア細胞はアミロイドβによって活性化され神経毒性分子を分泌、一方でミクログリア細胞は神経栄養因子を産生、貧食によって脳からアミロイドβを排除しもする。
初期の段階ではミクログリアの活性化は疾患の進行を遅延させるが、老化するとアミロイドβなどのストレスから過剰に応答して活性化し、炎症反応を引き起こし、神経損傷を引き起こす。
骨髄由来のミクログリア
常在性ミクログリアと、骨髄由来の新しく分化したミクログリア
両方共アミロイドβ班の近くに見られるが、骨髄由来のミクログリアがアルツハイマー病の進行を遅らせるまたは停止できることが示されている。
幹細胞の移植がアミロイドβクリアランスを促進することで、アルツハイマー病の潜在的な治療戦略と考えられている。
アストロサイト
アストロサイトが、
- 低密度リポタンパク質受容体関連タンパク質1(LRP1)
- スカベンジャー受容体クラスBメンバー1(SCARB1)
- コラーゲン構造を有するマクロファージ受容体(MARCO)
のようなスカベンジャー受容体によりAβに結合して内在化させることが、動物実験で実証されている。
LRPの機能不全
sLRP1(可溶性LRP1)は、血漿のアミロイドβの70~90%と結合する。
シンク活性によりアミロイドβが減少
神経細胞のLRP1発現はアミロイドβクリアランスを媒介しない(in vivo)
アシュワガンダ(Withania somniferaの根)が肝臓のLRP発現、ネプリライシンを増強 アルツハイマー病を改善
クリアランス非酵素経路
- 1 脳脊髄液(CSF)の間質液によるバルクフロー 血管周囲の基底膜を通るISF廃液経路
- 2 ミクログリア、アストロサイトの貧食による取り込み
- 3 血管に横切るLRP、VLDL受容体(超低密度リポタンパク)
アミロイドβクリアランスに関与する因子・分解酵素
- ネプリライシン(NEP)
- インスリン分解酵素(IDE)
- マトリックスメタロプロテイナーゼ(MMP9)
- グルタミン酸カルボキシペプチダーゼII(GCPII)
アミロイドβ分解酵素パラドックスと論争
インスリン分解酵素の活動は、通常の老化では、減少せずむしろ増加する。
ネプリライシンもダウン症患者の脳では上昇する。
アンジオテンシン変換酵素(ACE)活性は、アルツハイマー病において増加している。
アミロイドβ分解酵素活性は老化したtg2576マウスの皮質のおいても増加。
アミロイドβに応答して、アミロイドβ分解酵素(ADE)が代償応答により増加する可能性。
アミロイドβ分解酵素による治療アプローチ
- 1 アミロイドβ分解酵素活性を増強する化合物の投与
- 2 アミロイドβ分解酵素遺伝子を用いた遺伝子治療
- 3 幹細胞移植に基づく細胞両方
アミロイドβ分解酵素活性を増強する化合物
・ミノサイクリン、エリスロポエチン → ネプリライシン増強
・チロシンキナーゼ阻害剤、イマチニブ → APP細胞内ドメインとネプリライシンの両方を増加
・バルプロ酸 → ネプリライシン活性、プラスミン活性
・エストロゲン、緑茶抽出物、赤ワイン → ネプリライシン活性の増加
www.ncbi.nlm.nih.gov/pmc/articles/PMC3794520/
peripheral sink仮説(シンク理論)
アミロイドβの脳脊髄液中と血中の濃度は平衡関係にあり,血中濃度のアミロイドβを下げれば脳内のアミロイドβが減少するという仮説
例えば,アミロイドβに対する抗体であるソラネズマブは,血漿中でアミロイドβと複合体を形成する。
そのことでアミロイドβ濃度の中枢と末梢の間で濃度勾配が生じ、結果的に中枢のアミロイドβが引き抜かれ、脳内のアミロイドβを減少させると考えられている。
ホスファチジン酸、カルジオリピン
マウスにおけるアミロイドβ濃度を低下させる。
www.ncbi.nlm.nih.gov/pubmed/25461285
アシュワガンダ
アシュワガンダ(Withania somnifera)が、肝臓における低密度リポタンパク質受容体関連タンパク質を増強することによってアミロイドβクリアランスを高め、アルツハイマー病病態を逆転させる。
www.ncbi.nlm.nih.gov/pubmed/22308347

www.ncbi.nlm.nih.gov/pubmed/18673201
brain-to-blood efflux transport
アストログリア媒介性間質液(ISF)
アルツハイマー患者の脳のアミロイドβ沈着は、産生と除去のバランスにより増減する。
過剰な活性酸素はアミロイドβのBBB排出輸送機構を低下させる。
in vivo, in vitroの療法において、ビタミンD3(カルシトリオール)が、低密度リポタンパク質受容体関連タンパク質1(LRP1)を調節することによって、脳からの血中へのアミロイドβの排出を増加させ、神経を保護する可能性がある。D3の作用は、ビタミンD受容体経路と関連している可能性がある。
www.ncbi.nlm.nih.gov/pubmed/26820600
ビタミンD3活性型
ゲノムおよび非ゲノム両方の作用を介してBBBでの脳対血液 Aβ(1-40)排出輸送を促進しするための薬剤候補となりえる。
www.ncbi.nlm.nih.gov/pubmed/21740543
ビタミンEの枯渇
マウスのアミロイドβクリアランスを低下させ、アミロイドβの蓄積を増加させる。
www.ncbi.nlm.nih.gov/pubmed/19679659
リポ多糖類(リポポリサッカライド)
脳へのアミロイドβ流入が増加し排出が減少する。
インドメタシン
排出輸送の低下を阻害する。
www.ncbi.nlm.nih.gov/pubmed/19486646
カフェインの長期的な消費
Naの発現増加と関連し、脳脊髄液CSFの生産を増加させCSFの代謝を高めることで、アルツハイマー病のアミロイドβの排出低下のリスクを防ぎうる。
www.ncbi.nlm.nih.gov/pubmed/21660211
ミクログリアのTDP-43枯渇
アミロイドクリアランスを促進するが、シナプスの消失も誘発する。TDP-43(意味性認知症の主要原因となるタンパク質)はミクログリア食作用の強力な調節因子
www.ncbi.nlm.nih.gov/pubmed/28669544
低密度リポタンパク質受容体関連タンパク質1(LRP1)
低密度リポタンパク質受容体関連タンパク質1(LRP1)は、血漿において、可溶性形態のLRP1(sLRP1)は、末梢 アミロイドβの主要な輸送タンパク質。脳内皮および壁細胞におけるLRP1は、血液脳関門(BBB)を通過するアミロイドββの輸送機構を提供することによって、脳からのAβ流出を促進する。
www.ncbi.nlm.nih.gov/pubmed/22820095

アシュワガンダ
アシュワガンダ(Withania somnifera)が、肝臓における低密度リポタンパク質受容体関連タンパク質(LRP)を増強することによってアミロイドβクリアランスを高め、アルツハイマー病病態を逆転させる。
www.ncbi.nlm.nih.gov/pubmed/22308347
アルツハイマー病では、BBBにおける終末糖化産物受容体(RAGE)の濃度が増加、低密度リポタンパク質受容体関連タンパク質-1(LRP1)濃度および、末梢アミロイドβのsLRP1結合能力が低下し、脳へのアミロイドβの蓄積を促進する。
考えられる治療法 LRP1のアップレギュレーション、RAGE活性の低下、


www.ncbi.nlm.nih.gov/pubmed/22048062
血液脳関門 供給輸送系 排出輸送系https://bsd.neuroinf.jp/wiki/%E8%A1%80%E6%B6%B2%E8%84%B3%E9%96%A2%E9%96%80

www.ncbi.nlm.nih.gov/pmc/articles/PMC2872930/
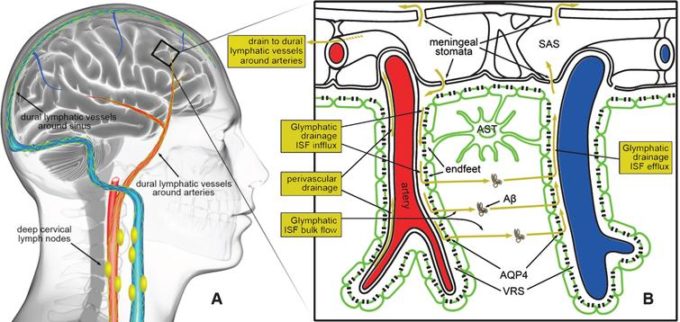
グリンパティック系(GPS)
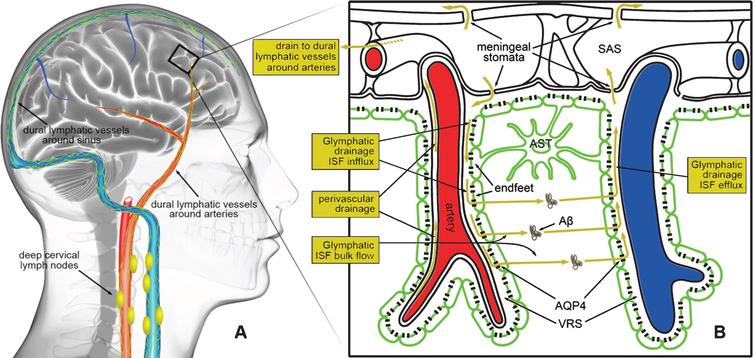
中枢神経系(CNS)のうち脊椎動物が(アミロイドβを含めた)不要な成分を排出するクリアランス経路。
CNS経路は、脳へ流入する脳脊髄液(CSF)と脳と脊髄の間質区画に存在し細胞外の物質を除去するための間質液(ISF)で構成されている。
CSFとISFの溶質交換は、睡眠中に脳の細胞外の空間が拡張したり縮小したりすることによって、調節されている。
脳間質腔において廃棄物などが拡散する決定的な要因は、細胞外区画の寸法と組性
脳脊髄液 CSF
en.wikipedia.org/wiki/Cerebrospinal_fluid
一日430~450mlの脳脊髄液を脈絡業で産生、一時間あたり25ml
CSFは一日に3~4回周遊する。
CSFは血管の外側にそって脳内を移動、末梢リンパ管と機能的に類似している。
アミロイドβの末梢クリアランス
アミロイドβの末梢クリアランスはアルツハイマー病に有効な治療アプローチ
パラビオシスマウスによる研究
パラビオシス後ADマウスのアミロイドβ班は80%減少した。
APPfl、CTF-α、CTF-βの発現には有意な変化がないため、BBBを介するアミロイドβ産生、分解、または輸送の変化が、脳アミロイドββの減少の主要な役割を果たすことはありえそうにない。これらにはBACE1、IDE、NEP、LRP-1、およびRAGEを含む。
パラビオーシス手術によって誘発される炎症または免疫応答は、ADマウス脳のアミロイドβ負荷の大幅な低下の原因ではないことを示唆している。
パラビオーシス手術は、脳のアミロイドββ産生、分解、BBBを介した受容体を介在する輸送、または手術により誘発される炎症によって生じたというよりも、末梢組織および器官によるクリアランスによって脳アミロイドβ負荷を減少させていることを示唆する。
肝臓と腎臓でのアミロイドβ異化作用
脳由来の動脈血中に存在するアミロイドβは抹消器官、組織の毛細血管床を通過するさいに除去され、内蔵(特に肝臓と腎臓)でかなりの量のアミロイドβ42が異化されることが示唆される。
過去の研究で、中程度の腎障害が痴呆発症リスクの上昇と関連していることが示されている。腎不全の患者は血液中のアミロイドβレベルが健常者よりも高いことが示されている。
肝臓、腎臓、または胃腸管などの末梢におけるアミロイドβの異化作用の増強が、アルツハイマー病治療を開発するための有効なアプローチであろう。
www.ncbi.nlm.nih.gov/pmc/articles/PMC4575389/
ApoEの影響
アミロイドβの末梢からのクリアランス速度は、APOEの影響を受ける。in vitro
末梢におけるアミロイドβの半減期は15分
APOEノックアウトマウスでは肝臓および腎臓からアミロイドβが検出されなかった。
www.ncbi.nlm.nih.gov/pubmed/12590160
運動によるアミロイドクリアランス
アミロイドβクリアランスに関与する5つのたんぱく質
ネプリライシン、IDE、MMP9、LRP1、HSP70
www.ncbi.nlm.nih.gov/pubmed/26563933