Contents
- 概要
- はじめに
- カラバ豆からアルツハイマー病治療薬へ、そしてU字型用量反応の発見へ
- フィソスチグミン:記憶への影響(表1,2)-動物実験
- (1)学習反応を最大にするためのACHE阻害の最適な度合い
- (2)学習におけるU字型の用量反応の一般化について
- パフォーマンスと学習
- 病変の回復に関する研究
- フィソスチグミンに対するヒトの反応-一般的なまとめ
- Physostigmineに対する人間の反応/学習/記憶研究 年代別まとめ
- タクリン
- コリン作動性障害の回復
- 成人および高齢者モデルにおけるTacrineと薬剤の併用による能動的回避実験
- 薬物投与のタイミングと用量反応の特徴
- タクリンのメカニズム
- 抗コリンエステラーゼ機構
- アレコリン フィソスチグミンを超える
- ヘプチルホスホスチグミン(HP)
- フペルジン A
- ガンスチグミン
- 記憶の調節とU字型の用量反応:ニューロステロイド、神経ペプチドおよびその他の薬剤
- バソプレシン
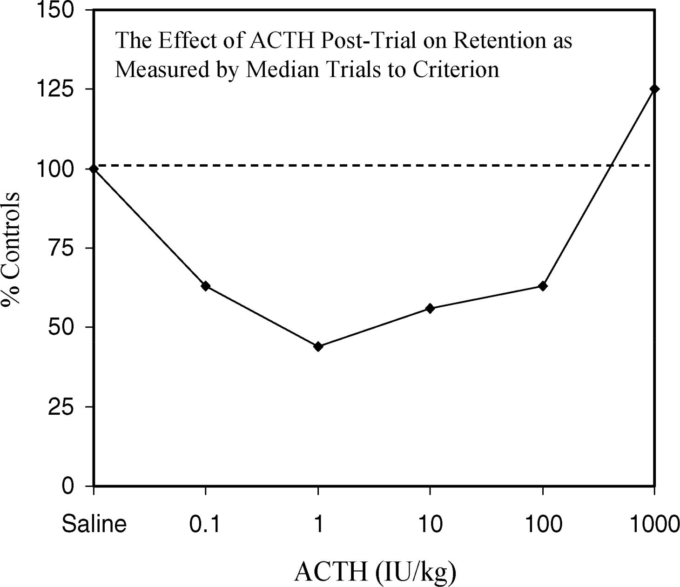
- ACTH
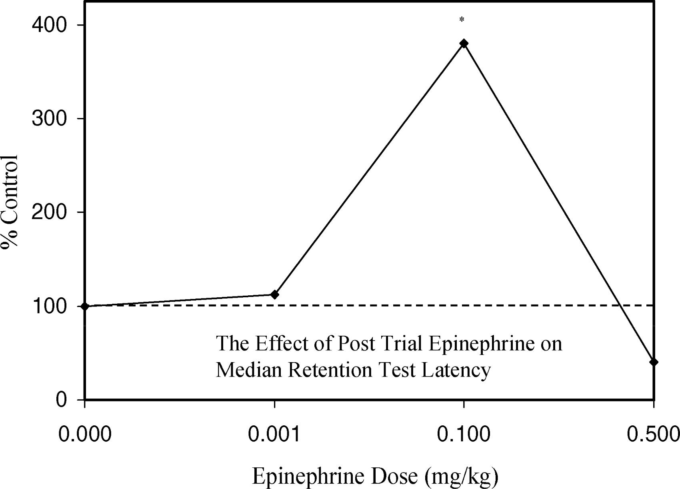
- エピネフリン
- CCK-8
- ニューロペプチドY
- 保持力の加齢による変化
- ニコチン受容体アンタゴニスト メカミラミン
- 血小板活性化因子アンタゴニスト
- シナプスの可塑性
- 考察
pubmed.ncbi.nlm.nih.gov/18568864/
米国マサチューセッツ大学公衆衛生学部環境健康科学課、アマースト、マサチューセッツ州、米国
概要
本稿では、記憶力の向上を目的とした薬剤のうち、アルツハイマー病(AD)の治療に用いられている薬剤の用量反応の特徴を評価している。これらの薬剤に共通する特徴は、逆U字型の用量反応で作用することであり、これはホルミシス用量反応モデルと一致する。
本稿では、アルツハイマー病治療薬の開発に至る歴史的基盤、用量反応の特徴とその定量的特徴が創薬・開発にどのように影響したか、また、前臨床・臨床における成功例と失敗例を紹介する。この物語は、約150年前にカラバ豆の植物からフィソスチグミンという活性物質が発見されたことから始まり、その医療への応用、用量反応関係や記憶力の向上、創薬活動の改善への影響などが紹介されている。
また、神経ステロイド、様々なペプチド(バソプレシン、CCK-8,ニューロペプチドYなど)その他の薬剤(エピネフリン、血小板活性因子やニコチン受容体のアンタゴニストなど)を含む多くの内因性アゴニストを用いた場合に、記憶に対してU字型の用量反応が起こることを示し、ホルミシス二相性の用量反応の一般性を支持している。
最後に、U字型の用量反応の重要性は、治療濃度域を定義するものであり、臨床応用を成功させるために重要である。
キーワード
老化、アルツハイマー病、生物老年学、二相性、用量反応、ホルミシス、記憶、神経ペプチド、フィソスチグミン、治療域、U字型
はじめに
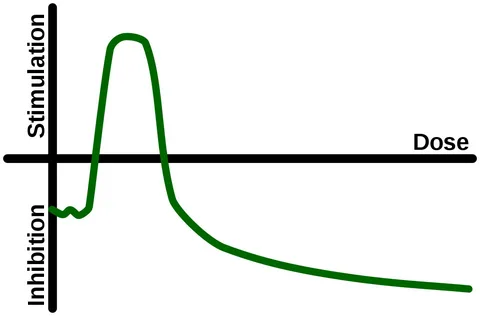
ホルミシスの概念は、毒性学や薬理学における重要な用量反応モデルとして登場している(Calabrese er al)。1999; Calabrese and Baldwin, 2003a; Calabrese 2004, 2005; Calabrese, 2007)。
ホルミシスの認識が高まったのは、主に、閾値モデルなどの従来の用量反応モデルでは、確立された反応閾値以下での非ランダムな生物学的活性の発生を考慮できなかったためである(Calabrese and Bald-win, 2001, 2003b; Calabrese er al)。 このような二相性の用量反応関係は、ここではホルミシスと呼ばれ、低用量の刺激と高用量の阻害を示す。
現在、毒性学界ではホルミシスが注目されているが、定量的に類似したU字型の用量反応が、記憶、学習、パフォーマンスに影響を与える要因に関与していることは、以前から研究者に認識されていた。本稿では、アルツハイマー病に対する抗アセチルコリンエステラーゼ(抗ACHE)化学療法戦略の進化と発展、およびホルミシスの一般的概念への取り込みを中心に、学習と記憶の概念に関するU字型の用量反応関係の発生を評価する。
カラバ豆からアルツハイマー病治療薬へ、そしてU字型用量反応の発見へ
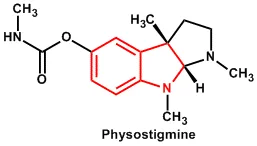
フィソスチグミンの歴史は長く、カラフルで、科学的にも医学的にも興味深いものであった。フィソスチグミンは、ナイジェリアのカラバルという町で栽培されているカラバル豆という植物に含まれている。初期の歴史では、ある人が魔女であるかどうかを判断するために、8粒のカラバの種子をペースト状にしたものを食べて生き延びた場合、その人は魔女ではないと判断された。

「魔女」と疑われた人にとって、この毒物への挑戦は実に厳しいものであり、カラバルの豆は「試練」の豆と呼ばれるようになった(Dragstedt, 1946; Holmstedt, 1972)。このような部族的な過去を持つカラバル植物は、その後、1840年にイギリスに導入され、1846年にはエジンバラで研究対象となったのである。
1863年にトーマス・フレイザーが、ベラドンナのよく知られた作用とは逆に、豆が瞳孔の収縮を引き起こすという重要な観察を行ったことで、様々な目の障害をより効果的に治療する能力についての研究が進められた(Koelle, 1975)。
1864年にJobstとHesseによって精製されたカラバ豆の活性物質は、フィソスチグミンと呼ばれた(Koelle, 1975)。しかし、その1年後にVereとLevenが独立して同じ成分を分離し、それをeserineと呼んだため、二重の意味で使われるようになった(Koelle, 1975)。1877年には眼科医が緑内障の治療のために初めて使用し、現在もその可能性を残している。
* *
フィソスチグミンが医学界で再び脚光を浴びるようになったのは、その約50年後、イギリスの医師メアリー・ウォーカーが、複視や筋力低下などの重症筋無力症(MG)の症状の多くが、内因性の「クラレ様作用」に起因するという仮説を立てたことによる。

彼女は、重症筋無力症の患者が微量の不純なクラーレに非常に敏感であることや、動物モデルにおいてフィソスチグミンがクラーレの影響を防いだり逆転させたりすることを知っていた(Pal, 1900)。これらの観察に基づいて、彼女はフィソスチグミンの投与がMG患者の症状を改善できるかどうかを調べようとした。
よく知られているように(Walker, 1934)1〜2mgのフィソスチグミンを投与された患者は、視力と筋力の両方に著しい改善が見られたが、他の多くの治療法を受けた患者には効果が見られなかった。ウォーカーは、フィソスチグミンが筋神経接合部で抗コリンエステラーゼとして作用すると主張した。このような経緯から、フィソスチグミンは、緑内障やMGの治療だけでなく、アトロピン、スコポラミン、ベラドンナなどによる中枢性コリン依存症の解毒剤としても使用されるようになった。
* *
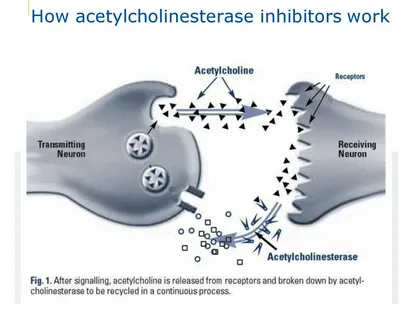
フィソスチグミンは、ノーベル賞を受賞したLoewiとNavratil(1926)の研究(1936年受賞)において、アセチルコリンエステラーゼ(ACHE)を阻害することが示されていた。彼らは、フィソスチグミンがCHEを阻害することでアセチルコリン(ACH)の作用を延長させることを、カエルの単離心臓で実証し、最初のACHE阻害剤として有名になった。

1932年、ステッドマンらは馬の血清からACHを分解する酵素を抽出し、コリンエステラーゼと命名した。1936年、Daleらは、随意筋の運動ニューロンを刺激すると、筋神経接合部でACHが放出されるが、クラーレによってトランスミッションが阻止されることを示し、この基本的な生物学的理解を明確にした。このように、ACHはある種の筋骨格接合部におけるニコチン性伝達物質であることが知られた。
* *
フィソスチグミンのような薬剤(カーバメート系)は、ACHE阻害の可逆性により臨床的有用性が期待されていたが、有機リン系のような不可逆性のACHE阻害剤にも関心が集まった。可逆性とは、化合物がACHE酵素に結合している時間の長さを意味している。
コリン作動系では、ACHEがACHを加水分解し、受容体部位での作用を終了させることがよく知られている。ACHがACHE酵素に結合すると、コリン部分は酵素のアニオン性部位に、アセチル基はエステル性部位に結合する。コリンは分離し、残ったアセチル化されたエステル部位はすぐに水と反応して酢酸を生成し、再活性化された酵素となる。
* *
フィソスチグミンのようなカルバミン酸塩の場合は、ACHEのアニオン性部位とエステル性部位の両方に結合する。フィソスチグミンの一部は速やかに除去されるが、残留する化学成分はACHEのエステル部位に結合したままである。この残ったカルバミン酸塩の化学的断片の加水分解はすぐには起こらず、数分から数時間かかり、ACHEの酵素は不活性または機能しない。
カルバミン酸塩とは対照的に、ほとんどの有機リン(OP)化合物は、エステル部位でのみACHEと結合し、その相互作用の安定性は化合物の構造に依存する。OP化合物はACHEのエステル部位に結合するため、一度占有された部位に次の結合化合物が結合することはできない。
そのため、カルバミン酸塩を事前に投与しておくことで、その後に投与されるOPからACHEを保護することができる。実際、この活性は、神経剤に曝される前にピリドスチグミンやフィソスチグミンなどのカルバミン酸塩を投与するための薬理学的根拠となっている。
このような事前の暴露は、サリンなどの有機リン酸塩神経毒に対して限定的な保護(6-8時間)を提供することができる(Miller et al 1993、Lim et al 1989、So-mani and Dube、1989)。ペルシャ湾岸戦争では、OP神経ガス攻撃から兵士を保護するために、このような根拠に基づいてピリドスチグミンが投与されたのである。
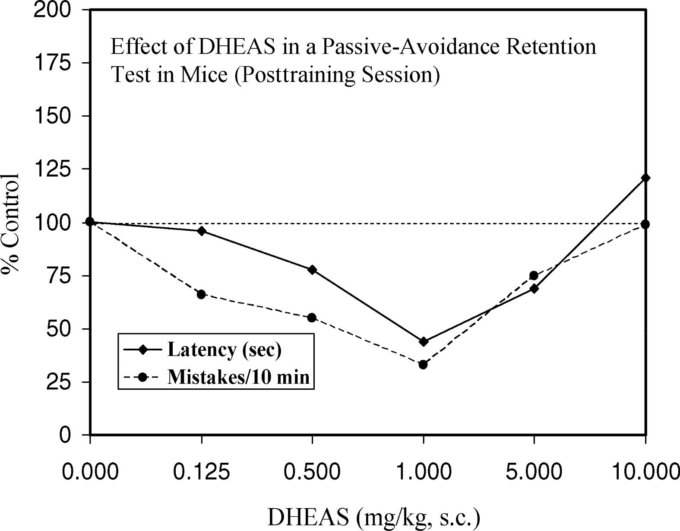
フィソスチグミン:記憶への影響(表1,2)-動物実験
記憶の促進剤としてのフィソスチグミンの評価は、1963年に発表されたLois O. StrattonとLewis Petrinovichの論文に端を発している。彼らのフィソスチグミンに関する研究の基礎は、カリフォルニア大学バークレー校の大学院生だったJames McGaughとPetrinovichの共同活動が先行していた。
McGaugh(2001)は、回想録の中で、Petrinovichと一緒に、彼らのBrain Chemistry and Behavior Seminarのために、学習と記憶に対する薬物の効果について発表されたすべての論文を批判するレビュー論文を作成したことを回想している(McGaugh and Petrinovich, 1965, 彼らの学生セミナー時代から約10年後に出版された)。
彼らの批評の鍵となったのは、20世紀前半に最も影響力のあった物理・心理学者と言っても過言ではないシカゴ大学のカール・ラシュリー教授が、約40年前にストリキニーネで迷路学習が促進されることを報告していたことだった。ラシュリー(1917)がストリキニーネでこの観察を行ったという事実に基づいて、彼らは学習を促進することが知られている薬物は他になく、逆に学習を損なうことが知られている薬物が多かったため、非常に興味を持ったのである。
また、1950年代半ばには、ストリクチニンがACHEを阻害することが示唆されていたため、ラシュリーの発見には理論的なメカニズム上の関心もあった。この分野は、学生たちの指導教員であるDavid Kech(McGaugh, 2001)や、セミナーの指導にあたったMark Rosenzweig教授など、カリフォルニア大学バークレー校の心理学の教授陣にとっても大きな関心事であった。
このような背景から 2人の大学院生は、40年前のLashleyの観察結果を再現し、拡張することに着手した。この実験に成功した2人は、意気揚々と当時の主要ジャーナル(Journal of Com-parative Physiological Psychology)に原稿を投稿した。
その理由の一つは、「あなたの論文の結果は、いかなる薬物も行動を改善しないという薬理学上の基本的な仮定を覆すものである 」というものであった。この「概念的」な拒絶にもかかわらず、マクゴーとペトリノビッチは、学習に対するストリキニーネのさまざまな側面について、それぞれの論文を書き上げた。
しかし、この研究に続いて、1963年にペトリノビッチが、強力な抗ACHE剤であるフィソスチグミンを訓練後に投与すると、明るいラットと鈍いラットのタイロン迷路での学習が促進されるという仮説を初めて検証した。迷路ブライトはダルラットに比べてACH/ACHE比が高いため、ブライトではACHがより長く活動しているという仮説が立てられ、このメカニズムによって「迷路ブライトの優れた学習」が説明された。
* *
さらに、迷路BRIGHTの学習効果を高めるために必要なフィソスチグミンの投与量は、迷路DULLよりも少なくて済み、また、BRIGHTはより早く最適な神経興奮レベルを超えてしまうと予想されるため、DULLよりも少ない投与量で学習障害が起こるという仮説を立てた。
その後に得られた知見(図1)は、これらの仮説と、治療後の薬物投与に基づく記憶の保存-定着理論を強く支持するものであった。さらに、ラットの脳のACH/ACHE比と学習が関連しているという説も支持された。StrattonとPetrinovich(1963)のこれらの衝撃的な発見は、
- (1)学習を最大化するために最適なACHE阻害の程度があるかどうか、
- (2)逆U字型の反応が学習変調に対してどの程度一般化できるか、
- (3)薬物反応が記憶とパフォーマンスのどちらに関係するか、
- (4)ACHEを阻害する薬物がADに関連すると思われる病変の回復にどの程度効果があるか
など、20世紀の残りの数年間に及ぶいくつかの広範な研究の方向性をもたらしたのである。
図1 明るい迷路群と鈍い迷路群の判断基準までの軌跡の中央値
原文参照
Stratton and Petrinovich (1963, Table unnum-bered, p.50 and Figure 1, p.51)より。
(1)学習反応を最大にするためのACHE阻害の最適な度合い
1967年、ロンドン大学のBanksとRussellは、OP系殺虫剤Systoxをラットの脳内コリンエステラーゼを40%阻害する用量で投与すると、ラットの連続問題解決能力が高まることを示した。しかし、脳内ACHEを60%以上阻害するような高用量では、このような問題解決が阻害された。
脳内ACHEを40%阻害する用量では、脳内ACHの増加が明らかになった(Holmstedt, 1967)。Carlton(1968)は、フィソスチグミンのような薬剤の作用は、抑制レベルが低いとコリン作動性が高まり、投与量が増えると作動性が低下するという二相性が予想されると指摘している。
Aprison(1962)の研究とBanksとRussell(1967)の先行研究に基づき、Carlton(1968)は、脳内のACH活性が増加するのは、ACHEが正常値の約40〜60%に減少した後であると指摘した。Carlton (1968)は、このような情報を一連の表現に変換して、正常なACHE活動が40~60%減少するまでは、ACHEの抑制は効果がないと思われ、その時点で機能的なACH活動が増加することを示した。
ACHEがさらに減少すると、急激に低下することが予測された。このように、ACHE活性の増加は、ACHEの抑制が再制限された「最適」な範囲でのみ起こると考えられる。興味深いことに、彼は「学習場面では、コリンエステラーゼ阻害剤を増やせば、40〜60%の範囲でパフォーマンスが促進され、それより低いレベルではパフォーマンスが低下するはずだ」と推測した(図2)。
ACHEを適度に阻害することでパフォーマンスが向上する理由は、生物が膨大な数の感覚入力を最小限に抑えて情報を選択的に処理し、生物学的にデータ処理の優先順位を確立する必要があることに関連していると考えられる(Carlton, 1968)。
* *
その後の研究では、原始モデルにおいてACHEを適度に阻害することで記憶が強化されるという概念が引き続き確認された。1972年に発表されたネズミの研究では、WarburtonとBrownは、StrattonとPetrinovich(1963)およびCarlton(1968)が推定した学習量の増加と、35~55%のACHE阻害とを関連づけ、この範囲は神経促進の40~60%の減少とほぼ一致した。
また、高用量で75%のACHE阻害を起こすと、パーフォーマンスが損なわれることも分かった。WarburtonとBrown(1972)はWistar系ラットで行動実験を行ったが、ACHE活性はSprague-Dawley系ラットで測定した。
したがって、彼らの論文で主張されている顕著な関連性は、信頼性の低い比較に基づいている可能性がある。しかし、WarburtonとBrown(1972)が提案したゾーンでは、認知機能の向上が、理想的な形でのACHEの低下と関連しているという基本的な視点が浮かび上がった。
* *
フィソスチグミン治療によってACHEを阻害する理論的根拠は、シナプス間隙でのACHの代謝(すなわち、加水分解)が減少することで、シナプス後細胞を活性化するためのACHが間隙に多く残される一方で、シナプス前の神経を失ったより遠くの受容体を刺激するために、その場所からさらにACHが拡散することを可能にするというものである。
このような仮定は、アルツハイマー病(AD)患者の認知機能障害の少なくとも一部がシナプス前神経細胞の喪失に起因しており、シナプス後神経細胞のマトリックスは比較的無傷であることから、アルツハイマー病患者にとって有益である可能性を示唆していた(Becker et al 1991)。
その後、認知機能に対するACHE阻害剤の治療効果の一因と思われる薬理作用が次々と報告されている。例えば、ニコチン受容体の活性化を介した神経細胞の変性防止(Janson and Moller, 1993)ムスカリンM1受容体の活性化を介したアミロイド前駆体タンパク質の変化(Nitsch er al)。
ACHE阻害治療後の記憶反応の増強には複数のメカニズムが関与している可能性があることが認識されつつあるにもかかわらず、ShermanとMessamore(1986)は、血中ACHEの阻害が、ヒトの研究におけるACHE阻害剤の効率を示す有用な定量的尺度を提供するとともに、様々なACHE阻害剤を評価するための比較基準を提供する可能性があることを提案した。
実際、Becker and Giacobini (1988)は、フィソスチグミン投与により認知機能が改善した患者を対象としたThal and Fuld (1983)およびThalら (1983)の知見に基づき、ACHE阻害率30%を試験目標とした。
Beckerら(1991)は、続いて、メトリフォネート(MET)という薬剤を用いたアルツハイマー病患者におけるACHE阻害と認知機能向上の間のU字型の用量反応に基づいたモデルを提案した。このモデルは、既に指摘されているフィソスチグミンを用いたThalら(1986)のデータや、他の研究者による同様の知見(Elbleら(1988)Summersら(1986)Chatellier and Lacomblez(1990)Eaggerら(1991)と一致する生物学的モデルである。
Beckerら(1991)は、ACHEの阻害による最大の認知的利益の推定値を示している。METの最適ゾーンの両側の反応は、有害な副作用がなく、アルツハイマー病患者に対するACHE阻害の善意の治療濃度域を示唆している。具体的には、約30~60%の阻害で、約45%の最適目標を設定すると、約50%の性能向上が得られると推定された。
METのようなACHE阻害剤は、フィソスチグミンのような薬剤に比べて、副作用が少なく、作用時間が長く、より大きなACHE阻害効果が得られるという点で、改善された薬物動態学的および薬力学的特性により、第2世代のACHE阻害剤として知られている。このような薬理学的な改良により,ACHEの阻害率は30%を超え,ACH濃度を大幅に上昇させるために必要な値となっている。
* *
Beckerら(1991)のモデルは、4種類のACHE阻害剤に関する数種類の臨床的知見によって裏付けられている。フィソスチグミンの場合、Thalら(1983)は、長期記憶の回復と脳脊髄液(脳脊髄液)のACHE阻害率の関係について、逆U字型の用量反応を見出した。
40~50%のACHE阻害率で最適なパフォーマンスが見られた。METの場合、Beckerら(1991)は同様の結果を示し、58%のRBC ACHE減少で最適な反応が得られたとしている。HEPの場合、ImbimboとLucchelli(1994)も、認知能力と定常状態の赤血球(RBC)ACHE阻害に関連して逆U字型の用量反応を示し、約40%のACHE阻害で最適な効果が得られたと述べている。
最近の知見では、ドネペジルのような他の薬剤では、薬物動態が改善されたことにより、さらに大きなレベルのACHE阻害を引き起こし、認知機能のさらなる向上が期待されている(Becker et al 1991)。
* *
これらのデータは、このような薬剤がアルツハイマー病患者の脳内ACHの増加をもたらし、therapeu-tic windowを増加させることができることを示唆している。もしこれが事実であれば、Beckerら(1991)のモデルの定量的特徴は、それに応じて修正される可能性がある(Giacobini, 2000)。
ACHE阻害後の脳内ACH濃度の変化は、完全にACHE阻害率の直接的な結果ではなく、薬剤自体の特異的な薬理学的特性に影響されるため、GiacobiniとCuadra(1994)は、治療戦略をACHE阻害ではなく、中枢神経系 ACH濃度とACHの定常状態の持続時間で言い換えることができると提案している。
ACHEの阻害度とシナプスのACH濃度という予測上の制限はあるが、ACH濃度は、その機能的活性、合成速度、またはACHの放出速度を含めて薬理学的に変化させることが困難であるため、ACH濃度の上昇を確実にするためには、ACHEの阻害を介した最も効果的なアプローチとなる(Giacobini and Cuadra, 1994)。
(2)学習におけるU字型の用量反応の一般化について
1960年代初頭には、ストリキチン、ニコチン、フィソスチグミンなどの多くの薬剤が、動物モデルにおいて確実に学習を促進する可能性があることが知られていたが、Floodら(1981)は、成体オスのCD-1マウスにおいて、コリン受容体の活性を低下させる6つの薬剤と、コリン受容体の活性を増加させる8つの薬剤の能動的回避学習への影響を調べた。
受容体活性を低下させる薬剤はすべて用量依存的に保持力が低下したが、コリン受容体活性を増加させる8剤はすべてU字型の用量反応を示し、中間の用量域で学習が最適化された。試験デザインは8剤間で多少異なり、4回投与が5剤、5回投与が2剤、6回投与が1剤であった。
対照群と比較して、各治療薬は、最初の回避までの平均時間で測定される忘却を減少させた(すなわち、対照群の値の6.6%から37.0%)。記憶を強化する濃度の用量範囲は、1つの薬剤につき1つの実験しか報告されていないため、慎重に定義されたことはないが、薬剤/研究デザインに応じて、2倍以上から 100倍以上の範囲で変化した。
Floodら(1981)の研究は、同一の実験条件で幅広い用量範囲にわたって異なるタイプのコリン作動性薬剤の役割を評価した点でユニークであった。しかし、Haroutunianら(1985)は、Floodら(1981)が薬剤を脳室内に投与したことから、彼らの知見をより一般的な薬剤投与法に一般化することは困難であると指摘した。
その後、雄のSprague-Dawleyラットに各用量(フィソスチグミン、オックストレモレン、4-アミノピリジン、アレコリン)を腹腔内投与した研究では、薬物反応のパターンはFloodら(1981)のU字型反応と一致した。著者らは、この結果の一般性から、同様のコリン作動性化合物をADのような記憶障害の治療に用いることができるのではないかという疑問が生じたと強調している。
パフォーマンスと学習
1950年代、カリフォルニア大学バークレー校の心理学者エドワード・トルマンは、学習とパフォーマンスを区別する必要性を強調していた。パフォーマンスは観察された現象であるのに対し、学習は推論しなければならない。実験薬の問題の核心は、ある薬剤が、記憶以外にも動機付けなどのパフォーマンスを変化させる様々な効果を持つ可能性があることである。
この問題は、1949年にダンカンが、能動的回避課題の訓練後にラットに電気ショックを与えると逆行性健忘が生じると主張したことで、再び頭角を現した。ダンカンは、能動的回避課題の訓練後にラットに電気ショックを与えると逆行性健忘が生じると主張した。

この結果を受けて、カリフォルニア大学バークレー校の大学院生だったMcGaughは、記憶の定着の初期段階である訓練後に刺激的な薬物を注射すると記憶が増強されるのではないかという仮説を立てた。この仮説が実験的に検証されたことで、記憶の定着に対するさまざまな化学的処理の効果を評価する際に、学習とパフォーマンスの問題を区別する効果的な方法として、トレーニング後の実験が広く用いられるようになった。
* *
記憶定着説を支持する最初の研究はストリクチニンを用いたものであったが、フィソスチグミンの研究がこの問題に関する議論の中心となった。Stratton and Petrinovich (1963)、Doty and Johnston (1966)、Izquierdoら(1973)、そしてHaroutu-nianら(1985a, 1985b)は、フィソスチグミンが記憶の定着プロセスに影響を与えるという結論を支持する実験を、さまざまな課題の事後実験で行った。
CoxとTye(1973,1974)は、成体のSprague-Dawley系雄ラットを用いて、試験後のフィソスチグミンによる増強を確認できなかったが、試験前の投与による促進を示した。これらの知見をもとに、CoxとTye(1973,1974)はStrattonとPetrinovich(1963)の論文の結論に異議を唱えた。
しかし、Cox and Tye (1973, 1974)の研究は、成体オスのSprague-Dawleyラットを用いて行われており、それ以前の研究では他のげっ歯類モデルが用いられていた。Cox and Tye (1973, 1974)と同じモデルを用いた研究はHaroutunianら(1985a, 1985b)だけであり、彼らはCox and Tye (1973, 1974)とは対照的に、フィソスチグミンによる試験後の学習促進の説得力のある証拠を示すことができた。
しかし、Haroutunianら(1985a、1985b)が用いた具体的なテスト(1試行の受動的回避)は、CoxとTye(1973,1974)が用いたテスト(単純位置識別、複合位置識別、単一変化)とは異なっていた。その7年後、Santucciら(1989)は、同じ単一試行の受動的回避行動テストで、フィソスチグミンが成人のSprague-Dawley系男子の記憶の統合と記憶の取り出しを促進する能力を確認した。
* *
Santucciら(1989)は、フィソスチグミンの投与が記憶の定着と検索に影響を与えている可能性が高く、これは薬物がラットの運動、感覚、動機付けのプロセスに干渉しているからではない、と主張した。この結論は、薬物を試験前に投与しても、試験後に投与しても、反応が促進されたことに基づいており、これにより、学習の促進が恐怖や衝撃感受性の増加によるものであるという説明を排除することができた。
第二に、フィソスチグミンは代謝が早いため、訓練後1.25時間に雄を試験した場合でも、訓練後の注射が有意な運動障害をもたらすとは考えられない。
病変の回復に関する研究
フィソスチグミンの研究では、アルツハイマー病患者の大脳皮質や海馬で顕著に減少しているコリンマーカー酵素であるコリンアセチルトランスフェラーゼの著しい減少を引き起こすMeynert基底核(nbM)などの病変を回復させる可能性を評価するバイオメディカルプローブとしての役割が注目されている。
複数の研究において、フィソスチグミンの投与は、受動的回避テスト(Haroutunian et al 1985a, 1985b)水迷路テスト(Dokla and Thal, 1998; Mandel and Thal, 1988)放射状腕迷路評価(Murray and Fibiger, 1985)などの複雑な空間学習タスクなどの幅広い行動領域で、病変誘発ラットの記憶を改善した。
さらに、フィソスチグミンは、中隔病変で誘発された空間記憶障害を回復させることができたが、フィンブラ・フォルメックス切断病変では、ピロカルピンでは回復しなかった(Matsuoka et al 1991)。
フィソスチグミンに対するヒトの反応-一般的なまとめ
1979年、DavisとMohsはNew England Journal of Medicine (NEJM)にアルツハイマー病患者とフィソスチグミンに関する研究の予備的な結果に関する編集者への手紙を発表したが、その結果は1982年まで査読付きの文献には載らなかった(DavisとMohs, 1982)。
しかし、1979年に発表された論文は、5人のアルツハイマー病患者と1人のハンチントン病患者を対象とした記憶パフォーマンスに関する心強い発見を生物医学界と臨床界に知らせただけでなく、この分野の研究の将来に影響を与えることになる方法論的特徴を提供した。
それは、特定の患者の記憶力を高めるための最適な投与量を特定するために、各患者に別々の用量の薬剤を投与したことである。この第1段階のデータ収集に続いて、第2段階のデータ収集が行われた。この第2段階のデータ収集は、無作為化、再現、二重盲検の研究デザインを特徴としており、先の(つまり第1段階の)データ収集で判明した「最適化された」用量による記憶力向上を検証することを目的としていた。
著者は、フィソスチグミンの有効範囲は非常に狭く、今後の研究では投与量の問題に非常に敏感にならなければならないことも強調した。その後、約15年の間に、約200人のアルツハイマー病患者を対象とした約20件の研究が発表された。一般的に、これらの研究結果は、様々な種類の記憶パフォーマンスの測定において、一貫して緩やかな改善を示していた。
この期間に、薬剤の投与方法が注射から経口へと移行し、最近の研究ではほとんどが経口投与であった。薬剤を注射ではなく摂取することで改善が見られたものの、フィソスチグミンの薬物動態特性は、ヒトでの半減期が非常に短いため、ほとんどの被験者が1日5回の投与を必要とした。
この特徴は、維持費が高くコンプライアンス上の問題があるため、重要な制限となっている。この分野の研究者が直面している他の課題としては、治療効果を比較するためのベースラインデータの量が挙げられる。これは、患者を評価する能力に制約があるために問題となることがあるが、患者が自分自身のコントロールとして機能することがよくあるため、患者内変動を適切に定義することは非常に重要だ。
治療効果の反応が控えめであると予想されることから、ベースラインまたはコントロールの反応の変動性を理解する上での制限は、試験の再現性やデータの解釈の問題に不可欠である。このことは、Davisら(1978)が開始した2相プロトコルに関して特に重要である。なぜなら、研究者は一般的に狭い治療域に挑戦しており、同じオプティマル・ドーズが被験者内で一貫して示されることを期待/想定しているからである。さらに、多くの研究では、特にADの比較的初期の段階で、患者の誤診がある程度予想されることが強調されている。
* *
本レビューは、フィソスチグミンに対するアルツハイマー病患者の反応性に関するヒト臨床疫学の詳細な評価を行うことを意図したものではなく、その主な目的は、認知のエンドポイントに関する用量反応関係の性質を評価するという観点から、これらの知見を統合することである。
肯定的(認知機能の向上)な調査結果の全体的な評価は、フィソスチグミンがU字型の用量反応を示し、治療範囲が狭いことを示した初期の研究報告と非常に一致している。さらに、測定された特定の記憶パフォーマンスの種類にかかわらず、パフォーマンスが20〜50%の範囲内でわずかに増加することは、動物モデル試験でも一貫して見られた。
しかし、フィソスチグミンを用いた臨床試験では、患者の治療効果を最大化するという目的から、反応性の用量範囲ではなく、最適な反応性を定義することに重点が置かれてきた。したがって、利用可能なヒトでの研究は、パフォーマンスを向上させる用量範囲ではなく、最大の反応についての洞察を提供している。
アレコリンを用いたSoncrantら(1993)による詳細な研究(アレコリンの項を参照)は、この一般化に対する明確な例外であり、患者の用量反応の全体的な定量的特徴の性質に重点を置いて、第1相の用量範囲のデータに特別な焦点を当てている。
* *
フィソスチグミンは記憶能力を改善する能力があるにもかかわらず、一般的には、穏やかな増加では、患者の生活に劇的な、あるいは実用的な改善をもたらすほどの変化は得られないことが多いと認識されていたが、より高度な自立した生活が見られる観察結果もあった。
重要な考えは、もしACHEを副作用なしに30〜50%の範囲を超えて確実に抑制することができれば、最大応答性をさらに高めることができるのではないかということであった。実際、これは後続の抗コリンエステラーゼ薬に期待されていることでもある。
問題は、これらの研究に参加したアルツハイマー病患者のベースラインの反応性が非常に低いことである。もし反応性がホルミシス枠組みに従っているのであれば、反応性の最大値はベースラインから約2倍の増加に限られると予想され、最も可能性の高い最大値は30〜60%の範囲である。
この限界は、Floodら(1985)による薬物併用研究で示唆されており(トラシンの項を参照)ホルミシス相乗効果は、顕著な最大のパフォーマンスの変化(すなわち、増加)ではなく、むしろ適度な改善が見られるが、非常に低い用量であることを示している。
Floodら(1985)の併用試験で見られたホルミシス相乗効果は、毒性学における新しい概念であり、広く影響を与える可能性がある。しかし、これらのデータは20年以上前のものであるにもかかわらず、薬理学的/ホルミシス相乗効果という修正された概念は、本質的にはまだ検討されていない。
この文脈では、IQ100~140の健常者のように反応性の高いバックグラウンドを持っていれば、10~20%の増加は非常に大きな意味を持つことが明らかになっている。最大応答が実際にベースライン値の関数であるならば、より高いスタートライン値を持つ人々に薬剤が与えられれば、臨床的・社会的に重要な効果が期待できるかもしれない。

Physostigmineに対する人間の反応/学習/記憶研究 年代別まとめ
Slanska et al 1972年:フィソスチグミンが学習過程の異なる段階で投与されると効果が異なることを示すいくつかの研究を引用し、IQ120台の8人の大学生を対象に、ストーリーテリングの想起と視覚的トポグラフィカルテストで学習を比較した。著者らは、フィソスチグミンは学習過程の定着段階を促進すると結論づけている(Davis et al 1976年の考察に引用)。
* *
フィソスチグミンがACHE阻害剤として作用することから、著者は「コリン系を変化させる薬剤を投与した被験者を試験することにより、ヒトの記憶と認知過程における中枢コリン神経系の役割を理解することができると考えるのが妥当であると思われる」と述べている。
このように、理論的根拠はあまり明確ではなかった。著者らは、大学生や大学院生を被験者とし、さまざまなテストを実施した。また、60歳代の高齢者も対象とした。1ミリグラムのフィソスチグミンが投与された。有意な改善は報告されなかったものの、言語性IQ、パフォーマンスIQ、フルスケールIQが約4ポイント改善された。
記憶と認知機能に関するすべてのテストにおいて、統計学的有意性には至らないものの、改善の傾向が見られ、最大の増加はsupraspan digit storage(正常値の112%)であった(Drachman and Sahakian, 1979, reviewで議論)。
この1979年のレビューによると、被験者に高用量の2mgのフィソスチグミンを投与した場合、すべての記憶および認知テストにおいて障害の傾向が見られたが、これは統計的に有意なレベルにまでは達しなかった。最も大きな減少は、やはりsupraspan digit storage(正常値の82%)であった。
これらの結果から、健常者ではコリン作動性機能は最適なレベルに近いのではないかと考えられる。少量のフィソスチグミンを投与すると記憶・認知機能がわずかに改善するが、大量に投与するとノルマル・パフォーマンスに支障をきたす可能性がある。
また、統計的有意性が認められなかったのは、実験デザインの制限によるものではないかとしている。被験者は自分自身のコントロールを行わなかったため、被験者間の分散が比較的大きくなり、サンプルサイズも小さかった。これらの結果の一部はDrach-man and Leavitt (1974)に示されている。認知機能テストはフィソスチグミン投与後30分以内に開始された。
Drachman and Leavitt (1974)
の報告は、加齢に伴う認知機能への影響が抗コリン剤投与の影響と密接に関連していることを初めて正式に提案したものとして知られているが、CrowとGrove-White (1971)は、それ以前に抗コリン剤による記憶喪失とKorsakoffの健忘症との関係を指摘していた。
実際、Popeらは1965年に早くもアルツハイマー病患者の脳ではACHE活性が著しく低下していることを報告している。しかし、このマーカーの特異性とACHE活性低下の潜在的な生物学的意義についてのコンセンサスが得られなかったため、彼らの論文は当初評価されなかった[コリン作動性仮説の歴史的評価についてはBartusら(1984)を参照]。
Davis et al 1976
フィソスチグミンの投与により、躁鬱病の精神病の症状が回復することが理論的に認識されていた。ACHE阻害剤も抑圧を引き起こすと考えられていた。このことから、コリン作動性は躁病では相対的に過小評価され、鬱病では過大評価されることが示唆された。
動物実験では、コリン作動性システムが記憶に影響を与える可能性が示唆されており、フィソスチグミンは投与時期によって記憶を変化させることが示唆されていた。本研究では、記憶と感情の両方の変化に注目した。13名の被験者と10名の対照群に1回(3mg)を静脈内投与した。
フィソスチグミンは短期記憶(STM)を減少させたが、STMから長期記憶(LTM)への定着は減少させなかった。認知機能テストはフィソスチグミンの注入後に実施した。テストは注入後90~120分後に行われた。刺激的な治療関連効果の裏付けは報告されなかった。
Peters and Levin, 1977: Signorelli (1976)
マウス実験で、フィソスチグミンを投与した直後にテストを行うと、以前に学習した情報の検索が促進されることを示したことに基づいた理論的根拠。最適な投与量は0.8mg(sc)で,0.2,0.4,1.3mgは予備試験で効果がなかった。試験は sc 注射の 20 分後に開始され、1 時間以内に終了した。
Davis et al 1978
根拠はコリン作動性プロセスが記憶に関与しているという前提に基づいており、彼らはACHE阻害剤の少量投与がラットの迷路学習を促進したいくつかの研究を引用した。また、Peters and Levin (1977)の報告を引用し、増強の用量範囲は狭いのではないかと述べている。19名の健常人被験者を用い、1mgを60分かけて緩徐に静脈内投与したところ、LTMの改善が見られたが、STMの改善は見られなかった。
最初のSTMテストは,0.15mgを投与した9分後に行われ、LTMはテスト開始後80分後に行われたため、テストは投与中と投与後に行われた。Drachman and Sahakian (1979)のレビューによると、この研究では、過去に学習した単語リストの自由な想起がわずかに改善され、Buschkeの選択的想起テストを用いて新しい単語リストを記憶する能力がより明確に改善されたと報告された。
被験者には、最初に優れた成績を修めた人は含まれていない。1976年に行われた研究(前述の議論を参照)では、著者らはフィソスチグミンを3.0mg投与したが、記憶機能の改善は見られず、数字スパン記憶が若干悪化した。このことは、フィソスチグミンの臨界量と少量の投与で記憶機能が向上し、高用量では性能が低下することを示唆している。
Davis and Berger, 1978
多くの精神病がコリン作動性の低下に関係していると考えられたため、患者にフィソスチグミンを投与した。
* *
村本ら(1979):PetersとLevin(1977)の先行研究を引用し、アルツハイマー病患者の構築課題と記憶課題の遂行に対するフィソスチグミンの効果について、二重盲検法を用いた研究の結果を報告した。これは、アルツハイマー病患者を対象としたフィソスチグミンの最初の研究でした(1978年5月9日に出版が認められた論文)。彼らは、フィソスチグミンの投与によって描画が著しく改善されることを示す予備的な研究を行ったと述べている。フィソスチグミンの投与量は1mg sc.であった。テストは投与後20分後に開始された。
Peters and Levin, 1979
根拠は、1977年の彼らの初期の研究と、海馬傍領域のコリン作動性欠損が記憶に重要であるという証拠を引用している。また、フィソスチグミンがDrachman 1977年の論文のスコポラミンの記憶喪失効果を逆転させることができることも引用している。
このような変化をADの記憶障害と結びつける根拠とした。彼らは5人のアルツハイマー病患者を対象に,0.3〜1.0mgの範囲で投与した(論文は1979年1月28日に受理された)。薬理試験は薬物投与後20分後に開始された。フィソスチグミン単独では記憶反応に影響を与えなかったが、レシチンとフィソスチグミンの併用で記憶の保存と検索が促進された。
Davis and Mohs, 1979
この編集者への手紙(NEJM)の根拠は、アルツハイマー病患者が中枢性コリン作動性機能の障害を持っていることに基づいていた。彼らは、6人の高齢患者にフィソスチグミンを投与して記憶のパーフォーマンスを改善したことを報告した。彼らは、どの用量が最適にパーフォーマンスを向上させるかを決定するために、患者に数回投与することの重要性を述べている。6名の患者のうち、5名はAD、1名はハンチントン病であった。被験者の記憶能力は向上したが、個人差が大きく、最適な反応範囲は狭かった。この論文はブレークスルーとなる可能性があった。
Delwaide et al 1980
その根拠は、過去に報告された記憶に関する動物実験と、PetersとLevin(1977)を含むいくつかのヒトへの暴露実験に基づいている。13人の老人性痴呆症患者に1mg imのフィソスチグミンを投与した。試験はフィソスチグミン投与4時間後に行い、薬物投与48時間後に2回目の試験を行った。フィソスチグミン投与による単語想起への影響は認められなかった。
DrachmanとSahakian、1980
64〜82歳の健常者13名にphysostigmine(0.8mg)を単回sc投与し、sc投与20分後に記憶・認知機能を評価した。検査項目は、記憶力と知的機能を評価するものとした。その結果、記憶の貯蔵量は増加し、平均上桁貯蔵量は15%増加し、パフォーマンスとフルIQは3〜4ポイント増加した。著者らは、「高齢者に見られるゆっくりと進行する知的障害は、限界のある神経要素を薬理学的に刺激することで改善されるかもしれない」と結論づけた。
Ashford et al 1981
理論的根拠はヒトに関する既発表の論文に基づいている。6人のアルツハイマー病患者を対象に、Buschkeの単語リスト学習テストを修正して使用した。試験の20分前に0.5mgのフィソスチグミンを投与した。促進効果は認められなかった。投与量は他の研究に比べて少ないものであった。
Christie et al 1981
ADのコリン作動性障害といくつかの非線形研究(Bartus, 1978a, 1978b, 1979, and Deutsch, 1971の文献)を引用して、理論的根拠をより実質的に発展させた。この研究は、アルツハイマー病患者がフィソスチグミンで改善するかどうかを評価するために計画されたもので、11人の患者を対象とした二重盲検試験で、フィソスチグミンの用量は0.25〜1.0mgで、30分かけて静脈内に注入された。
絵のテストは、フィソスチグミンの効果が低下していると思われる注入15分後、30分後、60分後に行われ、フィソスチグミンを投与された患者の大半は、わずかな改善であった。2名の患者では、顕著かつ再現性のある反応の改善が見られた。
Laurent et al 1981
大脳障害による記憶喪失の患者23名にPhysostigmineを投与した。学習能力を高めるためには、テストの前に薬物を投与する必要があった。
Caltagirone et al 1982
理論的根拠は、ADのコリン作動性障害に基づいていた。Davisら(1978)とDrachmanとSahakian(1980)の先行研究を引用した。8人の患者にフィソスチグミンを1mg q.i.d.の用量で1ヶ月間投与した。8名のうち4名は行動面での改善が見られ、3名は記憶機能の向上が見られたが、統計的には有意ではなかった。
Davis and Mohs, 1982
ADがコリン作動性神経細胞の機能を障害する疾患であることを理論的に認識していた。しかし、ACHの前駆体を食事に加えても、説得力のある記憶力の改善は見られなかったので、新しい戦略が必要であった。そこで、ACHE阻害剤とコリン作動薬を用いて、コリン作動作用を薬理学的に増強する方法が試みられた。
具体的には、健康な若年成人に低用量を投与すると、情報の記憶への保存が促進されることがわかっている、短時間作用型のACHE阻害剤であるフィソスチグミンと、短時間作用型のコリン作動薬であるアレコール・ジンを選択した。本研究では、フィソスチグミンのみを対象とした。
10名のアルツハイマー病患者(男性8名、女性2名)を対象とした。第1期:各患者の至適投与量を決定するため、二重盲検下で0.125,0.25,0.50mgのphysostigmineを静脈注射した。第2段階:最適量を投与。複数の認知機能テスト:有名な顔テスト、デジットスパンタスク、認識記憶テストなど、長期記憶に情報を保存する能力を測定するためのテストを除外し、短期記憶も測定した。
第1期と第2期の試験では、質的にも量的にも一貫した反応が得られる傾向があった。著者らは、今回の結果は、コリン作動性ニューロンが長期記憶を扱う情報の保存に決定的に関与しているという仮説を支持するものであるとしている。また、化学的治療を施すことで、ADの症状が回復する可能性も示唆された。
Peters and Levin, 1979
彼らの過去の臨床研究に基づく理論的根拠;scは慢性投与には「不適」なので経口投与を用いた;経口フィソスチグミンのどの用量で記憶を増強できるかを調べたかった;男性7人、女性2人の記憶障害患者(54-79歳)を用いた;0.5mgから始めて、しばしば3.0mgまで進行した。
記憶力を高める経口フィソスチグミンの投与量を最長18ヶ月間投与し、フィソスチグミン服用後1時間またはフィソスチグミンを一時的に中止した日に記憶力テストを実施した。1ミリグラムでLTSは一貫して増強されたが、LTRには同様の一貫性は見られなかった。これは、経口投与と長時間持続の両方において重要な論文であった。
Wettstein, 1983
根拠は、アルツハイマー病患者に対するコリン作動性治療の併用(レシチンとフィソスチグミン)を模索したものである。軽度から重度のアルツハイマー病患者8名に、フィソスチグミンを1日3〜10mg経口投与し、さらに試験の20分前にフィソスチグミンscを1日1回投与した。
経口摂取は6週間続けられた。行動、最近の記憶、その他の神経心理学的パラメータに改善は認められなかった。著者らは、自分たちの研究と他の肯定的な研究との間の不一致を説明できなかったが、彼らの基準値がかなり高く、限定されすぎていた可能性がある。
彼らの基準値は1つだけだった。4人の被験者は、その測定時間からレシチンのみの最初の観察測定までにパフォーマンスの大きな減少を示し、1人は大きな増加を示した。これらの変化は、測定されたエンドポイントが十分に安定していなかったことを示唆している。
Jotkowitz, 1983
根拠はWettstein (1983)の研究の延長線上にあるが、より長い期間の研究を求めたものである。10名のアルツハイマー病患者(65-80歳)に10-15mgのフィソスチグミンを最長10ヶ月間経口投与した。定期的なインターバルで、被験者は臨床的に評価されるとともに、Blessed dementia scaleとBlessed information memory concentration testの修正版で評価された。改善は報告されなかった。著者らは、認知機能、特に記憶に関する小さな変化を見逃す可能性のある研究方法の限界を認めている。著者らは、彼らの分析の具体的な感度については言及しなかった。
Thal et al 1983
(主要論文)1983年(NEJMへの手紙-ThalとFuld)後に1986年のThalらの論文に以前のデータを含めた大規模な研究として発表された):その根拠は、ヒトでの有益性を示した過去の研究と、フィソスチグミンの経口投与を使用する必要性に基づいていた。
フィソスチグミン(0.5mg)を1日6回、2時間ごとに投与した。副作用が出るまで、あるいは各投与量が4.0mgになるまで、あるいは総量が16mgになるまで、各投与量を0.5mgずつ増やしたが、これはWettstein(1983)で用いられた量よりも多かった。
フィソスチグミンの1日1回目と2回目の投与の30分後に、各患者は記憶力テストを受けた。12名の患者のうち8名が改善を示し、ピーク時のパフォーマンスは1回の投与につき1〜2.5mgのフィソスチグミンと関連していた。盲検下で、この8名の患者に最適量のフィソスチグミンを投与して再試験を行ったところ、改善された所見が再現された。
著者らは、脳脊髄液のACHE阻害作用を測定し、それをパフォーマンスと関連づけた。著者らは、改善を認めたが、5名の患者の長期治療(4〜20ヶ月)において、ほとんどの患者が最初は薬物に反応し続けたが、後にフィソスチグミンに反応しなくなり、認知症が進行したと主張している。
Johnsら1985
1977年のDrachmanの研究を引用し、Davisら(1978)に基づいて、短期記憶や検索の改善はほとんど期待できないが、新しい情報の長期記憶へのエンコードには改善の可能性があることを強調し、臨床的にはフィソスチグミンの経口投与がより実用的であり、静脈内投与の結果が経口投与の試験を後押しすることを示した。
15名のアルツハイマー病患者に、反応性を最適化するために用量を漸増して投与した。静脈内投与に反応した12名の患者のうち、LTMの改善は1.3~18.1%で、平均9.4%であった。また、経口投与でも、6~12%の改善が認められ、良好な結果が得られた。これらのデータは、コリン作動性ニューロンがLTMの保存に重要な役割を果たしているという仮説を裏付けるものであると結論づけている。
* *
6人の患者が評価され、何人かは静脈注射(0.3-0.8mg)1人はフィソスチグミンの経皮投与(1.0mg)もう1人は経口投与(1-3mg)が行われた。6人中3人の患者で幾何学的図形のコピーに改善が見られた。最大の改善効果は投与後30〜60分で得られた。
Mohs et al 1985a、1985b、1985c
根拠は彼らのグループによる健常者を対象とした初期の研究を引用したものであり、アルツハイマー病患者にフィソスチグミンを数日間経口投与した場合の効果を評価しようとしたものである。12名のアルツハイマー病患者に0.5~2.0mg/2時間を3~5日間投与した。試験を完了した10名の患者のうち、3名は最も高いフィソスチグミン投与量で臨床的に有意な改善を示し、4名はわずかに改善した。
同じデータの多くは彼らの3つの論文に転載されている。
Beller et al 1985
フィソスチグミンの経口投与法を開発する必要性を論じたもので、他の研究者による予備的な報告では、経口投与法が有用であることが示唆された。8人のアルツハイマー病患者を治療した。パフォーマンスは2mg/2時間で最も向上した。この向上反応は超短期記憶で最も顕著であり、この向上は長期記憶や検索ではなく注意に関わるのではないかという疑問が生じた。
Blackwood and Christie, 1986
その根拠は、1981年に行われたフィソスチグミンとアルツハイマー病患者の記憶に関する研究のフォローアップに基づくものである。12名の患者(54〜68歳)に0.75mgのphysostigmineを投与した。記憶力テストはphysostigmine投与の0.5時間前と投与開始後30〜45分後に行われた。記憶テストを完了した11人中9人で記憶力の改善が報告された。
Schwartz and Kohlstaedt, 1986
ADの重症度とフィソスチグミン治療の有効性を評価することが目的であったが、これまでの見解とは異なり、重症の被験者ほど記憶力の改善が見られた。これは、重症患者では血液脳関門の伝染性が高いためではないかと推測された。これにはフィソスチグミンの注射が使われた。
Gustafsonら(1987)
アルツハイマー病患者(49〜71歳)に対するフィソスチグミンの影響を従来の心理テストで評価することを目的とし、局所血流と脳波パターンも測定した。10名のアルツハイマー病患者を対象としたこの研究では、いくつかの精神運動パフォーマンスにわずかな増加が見られた。
Levin et al 1987
著者らは、電気けいれん療法(ECT)の記憶に対する効果の一部を、フィソスチグミン治療によって逆転させることができた。被験者はすべて女性で、フィソスチグミンの投与量はECTの10分後から0.5mgを静脈注射した。
Thal et al 1989
外来で治療を受けているアルツハイマー病患者(56-80歳)の記憶力を改善することを求めた根拠。彼らは、記憶力は改善されるが、非記憶力の改善は起こらないと予測した。今回のフィソスチグミンの経口投与による試験では、彼らの仮説が確認された。この試験には16人の患者が参加し、5人が1日16mgまで耐えられた。なぜ一部の患者が反応しないのかについて、優れた考察がなされている。
Stern et al 1987、1988
長期的な研究を行うことが目的であったが、彼らの最初の論文は短期的な知見を発表した。フィソスチグミンの経口投与による短期的な研究では、強い治療効果は認められなかったが、6-8ヶ月の長期的な研究では認められた。短期試験で治療効果が見られなかった被験者でも、改善は明らかで、対照群に比べて50%もの改善が見られたケースもあった。
一部の被験者では、フィソスチグミンを投与して1年以上経過しても改善が認められた。投与量は試験期間中同じで、1日の平均総投与量は約14mgであった。記憶力テストは選択的想起テストで、学習課題のリストを用いて行われた。
タクリン
抗ACHE薬であるtacrineの投与量が学習に及ぼす影響については、これまで多くの研究が行われてきた。これらの研究は、(1)スコポラミンなどのコリン作動性障害を逆転させるタクラインの能力、(2)げっ歯類モデルにおける老化の影響を逆転させるタクラインの能力、(3)他の抗ACHE薬やコリン作動性アゴニスト薬と併用した場合にタクラインの効果が増強または減弱するかどうか、(4)タクライン投与のタイミング(すなわち、トレーニングの前か後か)が学習に及ぼす影響など、5つの一般的な分野から構成されている。5)刺激/増強反応の幅に影響を与える因子を扱うメカニズム関連の研究。
コリン作動性障害の回復
タクリンなどの薬物がコリン作動性障害を回復させることができるかどうかを評価する実験的アプローチは、様々な理由から様々な形で行われてきた。抗ACHE剤やコリン作動薬によって認知障害を回復させることができることから、認知過程にコリン作動薬が関与しているという結論が支持された。
同様に、外科手術によってネズミの脳の特定の部位に生じた障害にもコリン作動性の関与があることが知られている。このような障害を薬物治療で回復させるには、薬物の作用する特定の場所を標的とする方法がとられている。
タクリンを投与することでスコポラミンによる認知障害が回復することを報告した論文は4件あり、そのうち3件は成人の放射状迷路学習を用いたもの(Cheng et al 1996年、Wang and Tang、1998年、Braida et al 1996年)1件は幼若ラットを用いたもの(Smith et al 1996)であった。一般的に、個々の実験はU字型の用量反応を示し、トータルエラーで測定したスコポラミンによる認知障害の約75%を回復させる最適な用量が特定された。
成人および高齢者モデルにおけるTacrineと薬剤の併用による能動的回避実験
1985年、Floodらは、成体オスのCD-1マウスを用いた学習に対するタクリンの詳細な用量反応関係を発表した。この能動的回避実験では、Floodらは10倍の用量範囲で7つの用量を投与した。最初の回避までの平均試行回数をエンドポイントとして測定すると、U字型の用量反応が観察された。
追跡調査では、Tacrineはコリン作動薬であるarecol-ineやoxotremorine、あるいは他の抗ACHE薬であるedrophoniumと組み合わせて使用された。このようなタクラインと薬剤の併用実験では、固定比率投与法を用いて、それぞれ5回、8回、6回の投与実験を行った。
化学物質の組み合わせや投与回数にかかわらず、最適な反応は対照群に比べて約30%大きく、これはタクラインを単独で試験した場合の最適な反応と同様であった。しかし、組み合わせて評価した場合、認知反応性の30%増は、当初の実験で使用した最適用量のわずか5~20%の等量初期投与で達成された。この結果は、2つの理由から重要である。1つ目は、併用実験では改善の程度が上がらなかったこと。
第二に、この実験では、はるかに少ない投与量で同程度の性能向上を達成することができ、それによって相乗効果が得られたことである。このような相互作用は、同じ強化された機能を元の用量の0.2~0.05で達成することができ、それによって起こりうる副作用の発生を抑えることができるため、臨床的に重要であると考えられる。
* *
タクリンとアレコリンの組み合わせが、マウスの記憶保持を相乗的に高める効果があると評価した先ほどの研究から、FloodとCherkin(1988)は、24歳のマウスを使って、この2つの薬剤が記憶保持に影響を与えるかどうかを調べた。
この場合、24歳のマウスが8歳のマウスと同じ記憶保持状態になるには、約2倍の試行回数が必要であった。先行研究と同様、タクラインとアレコリンを別々に投与すると、U字型の用量反応でマウスの記憶保持が改善された。両剤を等量ずつ投与して総投与量を97.5%減少させたところ、各剤の投与による認知機能の改善と同程度の効果が得られた。このように、正常な成体マウスおよび老齢マウスにおいて、同様の用量反応パターンが認められた。
* *
投与した薬剤の総量を大幅に減らしても同程度の効果が得られるという顕著な相乗効果を説明するメカニズムはなかった。1995年に発表されたThorneとPotterの論文は、この問題に関連する洞察を与えてくれるかもしれない。彼らは、電気刺激に対するニコチンの効果に関する逆U字型の用量反応を、約10倍左にシフトさせることができた。
これはまず、成体の雄のSprague-Dawleyラットに、海馬のコリン受容体の機能を変化させる選択的コリン作動性神経毒性物質であるAF64A(エチルコリンマスタードアジリジニウム)を共投与することで達成された。これらの結果は、M2ムスカルニン受容体をアンタゴニストのアトロピンで遮断すると模倣された。
ニコチンに対する反応の増強は、シナプス前の受容体を介したACH放出のフィードバック制御の変化に起因すると考えられた。ムスカリンM2受容体は、通常、ACHの放出を抑制する。M2受容体の活性が低下すると(すなわち、AF64A処理またはアトロピン処理により)フィードバックが減少し、反応の増強につながると考えられる。
Thorne and Potter (1995)によると、これは、アゴニストに対するニコチン受容体の感受性やニコチン受容体を介したシグナル伝達に変化があったのではなく、細胞がより効率的に脱分極された結果であると考えられている。
薬物投与のタイミングと用量反応の特徴
記憶の定着を介して認知に影響を与える薬物と、動機付けなど他のメカニズムで作用する薬物を区別することに大きな関心が寄せられている。これは、少なくとも部分的には、薬物をトレーニングの前または後に投与することによって研究されてきた。
一般的には、どちらの投与方法でも学習効果の向上が認められる。Smithら(1996)の論文は、使用した用量が広範囲に及ぶことから、この分野の研究にユニークな洞察を与えている。タクリンをトレーニングセッションの30分前に投与した場合、狭い用量範囲で学習が促進された。
しかし、トレーニングの直後にタクラインを投与した場合、学習の向上は低用量域に大きくシフトした。つまり、1000倍の低用量で認知を向上させることができたのである。さらに、トレーニング後の投与では、事前に投与した群に比べて反応の大きさが減少していた。
タクリンのメカニズム
刺激反応の幅
U字型の用量反応を評価する上での未解決の問題は、用量反応の刺激成分の幅を説明しうる要因に関するものである。この分野は一般的にあまり検討されていないが、Wanibuchiら(1994)は、ムスカリン(M1)受容体アゴニストであるYM796が、タクラインなどの抗ACHE剤よりもはるかに広い有効用量範囲を示す理由を推測している。
抗ACHE剤は、ムスカリン受容体のサブタイプに対する選択性がないために、狭い用量反応範囲を示す可能性がある。このような選択性の欠如は、有効量で観察される副作用の原因となる。YM796の用量範囲が広いことを説明する仮説として、YM796が部分作動薬であることが挙げられる。部分作動薬は、特定のムスカリン受容体に対する機能的選択性を高めることが報告されている(Freedman et al 1993)。
タクリンによるアセチルコリンの放出
認知機能の変化に関するタクラインの作用機序はACHE阻害に関連しているが、Svenssonら(1996)は、広い濃度範囲でネズミの脳組織でアセチルコリンを放出する能力に注目した。タクリンは二相性の反応を示し,低濃度ではアセチルコリンの放出が促進されたが,高濃度では再放出が減少した。
ムスカリン受容体サブタイプのアンタゴニストの使用に基づき、異なる濃度のタクラインに対するこれらの相反する反応は、それぞれM1およびM2ムスカリン受容体を介していることが決定された。これらの結果は、臨床的に適切な濃度のトラシンでタクラインによるアセチルコリン放出の増加が起こることから、アルツハイマー病患者の治療につながる可能性があると考えられた。
抗コリンエステラーゼ機構
アルツハイマー病患者の脳では、α4サブユニットを含むニコチン性ACHリセプター(nACHRs)が選択的に失われていることが特徴的である(Warpman and Nordberg, 1995; Martin-Ruiz et al, 1999)。
このような構造的な欠陥の結果、アルツハイマー病患者の認知機能は、中枢に作用するACHE阻害剤によるACHの脳内濃度の上昇を介して脳内のニコチン性神経伝達物質を増加させることにより、少なくとも部分的には向上するのではないかという指摘がなされている。
ACHEの阻害に加えて、フィソスチグミンやタクラインなどの化合物は、nACHRチャネルの活性化を介してニューロンのnACHRと直接相互作用する(Perry et al 1988)(Zwart et al 2000参照)。フィソスチグミンやタクラインなどのACHE阻害剤は、非競合的なイオンチャネルブロックと組み合わされた2サイト平衡受容体占有モデルを介して作用し、ACH誘導イオン電流に対するフィソスチグミンやタクラインの二重効果を説明している(Zwart er al)。
低濃度のACHでのみ増強が起こり、高濃度のアゴニストでは増強が弱まり、最終的には抑制性の反応に反転する(図3)。このようなACHE阻害剤は、ACHの認識部位と相互作用し、α4含有ニコチン性ACH再受容体のコ・アゴニストであると考えられる。
中枢神経系におけるニコチン性神経伝達を維持するために、どの程度の残存ACHE活性が必要なのかは不明であるが、Zwart et al 2000)は、ACHEの最大阻害とnACHR機能の最大可能性は同程度の濃度で生じると指摘している。
この文脈において、nACHRが介在する電流のαサブユニットに対する刺激の大きさは、最大反応が対照値の2倍未満、通常は対照値の約30〜50%の大きさであり、刺激反応はゼロ相当点のすぐ下の約100倍の濃度範囲にわたっているという、ホルミシス用量反応の定量的特徴と一致していることに留意することが重要である。
図3. α4β2およびα4β4 nACHRを介した卵細胞のイオン電流に対するフィソスチグミンおよびタクリン(tacr)の効果の濃度依存性
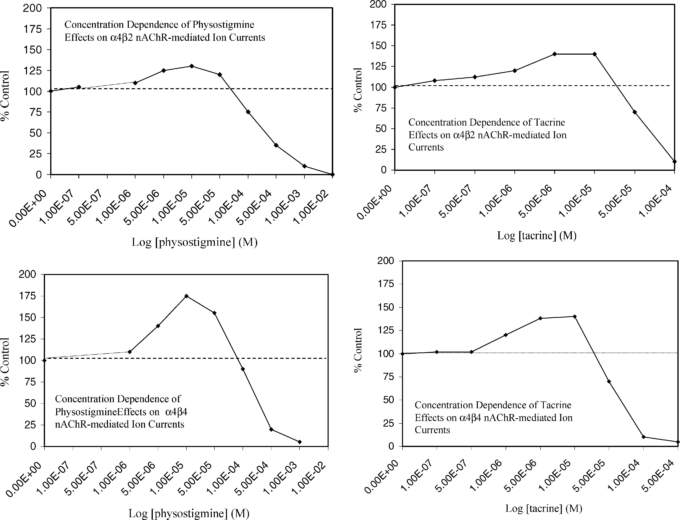
イオン電流は、α4β2 nACHRでは3μMのAchで、α4β4 nACHRでは1μMのAchで誘発された。
Zwartら(2000年、図3、p.2495)より
アレコリン フィソスチグミンを超える
中枢性コリン作動性機構が一般的な学習や記憶に基本的に関与していることは、約40年前にDeutsch(1971)によって広く提唱された。その後、DrachmanとLeavitt(1974)は、高齢者や老人性痴呆患者に見られる特異的な記憶喪失の根本的な原因は、コリン作動性の加齢による障害である可能性を示唆した。
このような見解の根拠となったのは、抗コリン薬であるスコポラミンを若い被験者に投与した研究である。このような研究では、若い被験者の記憶テストの成績は、一般的に高齢者で報告されているものとよく似ていた(Drachman and Leavitt, 1974)。
すなわち、スコポラミンを投与された若いサル(BartusとJohnson、1976)や、薬を投与されていない高齢のサル(Bartus et al 1978)では、最近の記憶に特異的な障害が見られた。その後、人間以外の霊長類を対象とした研究では、末梢性の筋カリン遮断薬であるメスコポラミンも、中枢性のドーパミン遮断薬やBアドレナリン遮断薬であるハロペリドールやプロプラノロールも、同等の記憶喪失効果をもたらさないことが示された(Bartus, 1978a, 1978b; Bar-tus, 1980)。
さらに、スコポラミンによって誘発された障害は、動物モデルおよびヒトでの研究において、抗ACHE薬であるフィソスチグミンでは回復したが、アンフェタミン(Drachman, 1977)やメチルフェニデートなどのカテコールアミン系の刺激剤では回復しなかった(Bartus, 1978a, 1978b)。
これらの結果を総合的に判断すると、加齢に伴う記憶障害にはコリン作動性システムが深く関わっていることがわかる。さらに、中枢のコリン作動性を薬理学的に阻害することで、加齢に伴う記憶障害を模倣できる可能性があると考えられた。この枠組みを支えたのは、加齢した動物モデルや記憶障害のある人の脳内で、ムスカリン受容体の密度とコリンアセチルトランスフェラーゼ活性(CAT)が低下していることを示した神経化学的な調査であった(Bartus and Dean, 1980; Bowen and Davi-son, 1980; Perry and Perry, 1980)。
さらに興味深かったのは、アルツハイマー病患者ではCATの減少がさらに顕著であるという観察結果である。また、錐体細胞のような特定のコリン作動性病変が記憶障害と関連していることが動物モデルで証明され(Lippa et al 1980年)記憶過程におけるコリン作動性システムの役割がより確かなものとなった。
* *
これらの観察結果を受けて、1970年代後半から 1980年代前半にかけて、記憶障害がコリン系の薬理学的な刺激や増強によって回復するかどうか、またどの程度まで回復するのかという疑問が研究者たちの間で持ち上がった(Bartus et al 1980年参照)。
その結果、老人性認知症やADが社会的に重要視されるようになったことから、記憶に関する研究活動が活発に行われるようになった。それまでの記憶に関する研究は、コリンやレシチンなどのコリン前駆体を増やすことを前提に行われてた。これは、前駆体が十分に得られるかどうかが、アセチルコリン製造の主要な律速要因となるからである。
しかし、理論的には十分な根拠があるにもかかわらず、アセチルコリンの合成を自然に促進させようとする研究では、期待された効果が得られないことが明らかになりつつあった(Bartus and Dean, 1980; Ferris et al 1979)。
1970年代後半に深く検討された唯一の代替手段はフィソスチグミンの使用であったが、これは期待できるものの、製薬会社の運動機能の制限や副作用の懸念から問題があった。このような状況の中で、記憶を改善する薬理学的な薬剤を改良するための新しい戦略が生まれ、1978年にSitaramらが「Science」誌に発表した、正常な若年成人の学習能力の向上を示すアレコリンの評価が行われることになった。
* *
アレコリンによって誘発される用量反応の性質の問題は、トラシンで見られたものと類似している点がある。このような研究は、いくつかの一般的なカテゴリーに分類することができる。これらには以下が含まれる。(1) 能動的回避実験の中で用量反応を扱うマウスやラットを用いた研究 (2) 薬物の組み合わせや生化学的メカニズムの裏付けのない領域を評価するための基本的なげっ歯類研究方法として能動的回避法を用いる研究 (3) この方法をさらに拡張して加齢モデルに適用する研究 (4) 特に個体間の変動に関連して非ヒト霊長類を用いた研究 (5) 実験的ヒト臨床研究。
* *
このような研究戦略の一般的なパターンは、先に詳述したように、タクラインのような他の潜在的な神経保護剤についても提案されている。アレコリンに関するこのような多段階の研究戦略のうち、マウスの能動的回避学習を扱った例を簡単に説明する。
Floodら(1981)の研究では、CD-1雄マウスを用いた能動的回避実験プロトコルにおいて、アレコリンが記憶保持を促進することが確認された。彼らの実験では、20倍の用量範囲をカバーする4つの投与量で、1投与量あたり19〜25匹の動物が用いられた。
対照となる被験者は、保持力が低いことを示すように訓練された。この訓練は次のようにして行った。1匹のマウスに4回の訓練試行を行い、訓練試行の間隔は20秒とした。訓練試行では、マウスをスタートボックスに入れた後、ギロチンの扉を上げ、同時にドアベル型のブザーを鳴らした。
5秒以内に正しいゴールボックスに移動しなかったマウスは、正しく反応するまでショックを受けた。最初の訓練試行では、各マウスは最初の選択の反対側、すなわちショックから逃れるための好ましい反応を示す側に進まなければならなかった。
その後の試行では,正しいゴールの箱は,最初は各マウスにとって好ましくない側であった。各試行の終了後、マウスをホームケージに移動させた。その後、スタートボックスに入れた。記憶保持テストはトレーニングの1週間後に行った。記憶保持はU字型の用量反応を示し、最適な反応では、最初の回避を行うための試行回数に関して42%の改善が見られた。
同じ論文で他の7つの化合物についても同様の結果が報告されており,いずれもU字型の用量反応を示し,ほぼ同じ程度の向上が見られた。
ヘプチルホスホスチグミン(HP)
HPは、可逆的な抗ACHE活性を有する合成カルバミン酸塩である。フィソスチグミンの持つ認知機能向上作用を維持しつつ、毒性の副作用を軽減した新しい化合物の開発を目指して合成された。HPの生物学的効果をげっ歯類およびヒトで評価したところ、典型的なU字型の用量反応が報告された。
齧歯類のデータでは、HPはスコポラミンによるエラーの影響をU字型の用量反応で逆転させている(Braida er al)。 また、アルツハイマー病患者を対象とした研究(Imbimbo and Lucchelli, 1994; Canal and Imbimbo, 1996)では、学習に関する4つの測定スコアのそれぞれに逆U字型の用量反応が見られた。
特に重要なことは、アルツハイマー病患者の認知機能および行動の最大の改善は、ACHE阻害率が25〜40%の時に関連しており、ACHE阻害率が50%を超えるとパフォーマンスが低下することから、ACHE阻害率の最適な治療範囲が示唆されたことである。
フペルジン A
Huperzine Aは,中国の伝統的な漢方薬から初めて単離されたもので,強力な可逆的ACHE阻害剤であり,この作用により,認知機能を向上させる可能性のある薬剤として注目されている。Huperzine Aは、他のどのACHE阻害剤よりも熱心かつ特異的にACHEに結合すると考えられており、また、TacrineやDonepezilよりも半減期が長い。
U字型の用量反応が共通の要因であることを示す実験的な研究が多く発表されている。生後1日のヒヨコ(Gao et al 2000年)マウス(Liu et al 1998年)ラット(XiongとTang、1995年、Xiong et al 1995,1998年、WangとTang、1998年、Cheng et al 1996年、TangとHan、1999年、Wang et al 1999年)サル(Ye et al 1999年、Ou et al 2001年)ヒト(Tang et al 1994)を用いた研究が含まれている。
* *
これらの研究の大部分は,ADなどの老人性痴呆症で起こると考えられる状態を模擬して,化学薬品(スコポラミン,AF64A,カイニン酸など)を用いて神経病変を誘発することを目的としている。これらの薬物は、AF64Aのように側心室に注入する方法(Xiong et al 1995年)カイニン酸のように大脳基底核に注入する方法(Xiong et al 1998年)スコポラミンをipで投与する方法(XiongとTang、1995年、Cheng et al 1996年、Ye et al 1999年、WangとTang、1998)などがある。
フペルジンAは、様々な実験環境(ラットの放射状迷路、マウスの水迷路、サルのWisconsin General Testing Apparatusなど、Liu et al 1998年、Ye et al 1999年、Ou et al 2001)で測定された化学療法誘発性障害を回復させる能力を評価する。
部分的に餌を置いた放射状迷路は,ラットが自然に餌を探す状態に比較的近いと思われるため,空間記憶の評価に採用した。フペルジンAを投与するタイミングは、実験の前であった。基本的にすべての実験系および動物モデルにおいて、用量反応は同様の量的特徴を持つU字型を示した。経験的な治療では、化学的に誘発された病変の大きさをほぼ完全には元に戻せない「最適」な投与量が明らかになるのが一般的である。
* *
生後1日目のニワトリの結果のように、huperzine Aはスコポラミンによる障害を完全に克服する一方で、正常な保持力を約50%向上させるケースもあった。ヒューペルジンAの反応性のオプティマルゾーンの幅は一般に狭く、10分の1以下で、多くは5分の1以内であった。唯一の例外は、(Ou et al 2001)のデータで、レセルピン誘発効果の逆転が100倍以上の用量範囲で見られた。この違いの理由については議論されていない。
* *
したがって、U字型の用量反応は、ヒト以外のプリメイトやヒトを含む複数の動物モデルにおいて、認知機能のエンドポイントに対するhuperzine A治療の共通の特徴であり、予想されるものである。これらの知見および用量反応の定量的特徴は、他の抗コリンエステラーゼ薬と同様である。
ガンスチグミン
アルツハイマー型認知症(AD)の治療薬として承認されている薬剤の多くは、抗ACHE活性に基づいている。しかし、近年、いわゆる抗ACHE薬は、様々な補完的なメカニズムで認知機能の改善に影響を与えている可能性があることが次第に明らかになってきた。
Windisch et al 2003)は、抗ACHE戦略を他の可能性のあるメカニズムから区別するために、コリンエステラーゼ阻害活性を持たず、かつブチリルコリンエステラーゼ活性を再活性化したガンスチグミンのエナンチオマーを用いて抗ACHE効果を分離した。このように、ガンスチグミンとエナンチオマーの両方を用いて直接比較したのは、もし両剤が同様に保護作用を示すならば、その保護作用は抗ACHE活性に起因するものではないという考えに基づいている。
* *
今回の研究では、ADに見られる神経変性の発症に関連した2つの実験手法が用いられた。1つは、疾患プロセスの一因である向神経性因子の利用可能性の障害をシミュレーションする方法である。これは、組織培養液への血清添加量を減らすことで実験的に実現できる。
このような血清濃度の低下は、アポトーシスによる細胞死を徐々に減少させる。2つ目のアプローチは、試験管内試験で8日目にあらかじめ凝集したβ-アミロイド25-35を組織培養液に加えることで神経細胞を損傷させ、2日以内に約50%の神経細胞を破壊するという実験である。
* *
向神経性因子を用いた場合は,E9日目のニワトリ胚から脳を取り出した。この時期の脳はほとんどが神経細胞で,グリアは5%以下である。MTTアッセイを用いた結果、両剤とも神経保護作用はほぼ同等であり、3μMの投与量で生存率が約3倍に増加した。最適な3µM濃度のすぐ下と上の濃度でも、わずかな増加が見られた。残りの6つの濃度ではすべて治療効果がなかった。
* *
β-アミロイド誘発性毒性の場合、両薬剤とも神経細胞の保護に同様の効果を示した。すなわち、β-アミロイドが神経細胞の生存率を50%近く低下させたのに対し、2つの薬剤の最適な生存率は約75%であった。しかし、2つの薬剤は全体的にホルミシス二相性の用量反応を示し、低用量で保護反応が起こり、高用量で毒性反応が起こった。
これらの結果から 2剤の神経保護作用は、抗ACHE活性では説明できないことがわかった。実際、神経保護濃度は非常に低く、実質的な抗ACHE活性とはかけ離れていたため、この実験系では抗ACHE活性を介したガンスチグミンの保護効果の可能性はさらに低くなった。
* *
保護効果が抗ACHE活性と関連しないのであれば、そのメカニズムはどうなるのだろうか。著者らは、研究対象とした2つの薬剤以外で得られた知見に基づいて、神経保護に関する研究の可能性を探ったが、その議論は主に推測に基づいたものであった。このようにメカニズムに関する洞察が限られているにもかかわらず、注目すべき神経保護効果が抗ACHE活性から切り離されていたことから、この発見は非常に興味深いものである。
記憶の調節とU字型の用量反応:ニューロステロイド、神経ペプチドおよびその他の薬剤
ニューロステロイド
ステロイドは長い間、生物医学の再研究者を魅了してきた。しかし、ステロイドが脳内で合成され、神経作用を示すことが判明してからは、学習や記憶への影響に焦点が当てられるようになった(Vallee et al 2001a, 2001b)。
神経ステロイドには、プレグネノロン(PREG)デヒドロエピアンドロステロン(DHEA)それらの硫酸エステル誘導体であるPREGとDHEAS、プロゲステロン(PROG)などがあり、これらは5α-DH PROGと3α,5α-テトラヒドロプロゲステロン(3α,5α-TH PROG)に代謝され、アロプレグナノロンとも呼ばれる。
* *
今回の評価で特に興味深いのは、このような神経ステロイドの用量反応の性質である。この分野における重要な洞察は、Floodら(Roberts et al 1987、Flood et al 1988)によるもので、彼らの研究は特にマウスの記憶保持に対するDHEA/DHEASの効果に焦点を当てたものであった。
彼らの研究戦略は、T迷路フットショックによる能動的回避訓練(図4,5)ステップダウンによる受動的回避訓練(図6)外科的脳脊髄腔内投与(図7)神経細胞やアストロサイトを用いた脳組織の培養など、複数の評価項目を用いて、訓練後のモードでDHEAおよびその硫酸誘導体の効果を評価するように設計されている。
研究デザインでは、約6倍から 100倍の範囲で6~13種類の投与量を採用した。一般的に、マウスはさまざまなプロトコルで、ある高いレベルのパフォーマンス基準まで訓練され、訓練後すぐに薬物を投与され、1週間後に保持力を再検査された。
いずれの試験においても、逆U字型の用量反応が観察され、用量反応の特徴は、採用した特定の試験プロトコルによらず、増強の大きさに関して定量的に類似していた。また,DHEAはDHEASよりも広い用量範囲で有効であり,治療の幅が広いことが示唆された。
* *
ReddyとKulkarni(1998b)は、異なる系統の雄性マウスを用いて、Floodらの知見を、ステップダウン受動的回避課題の事前訓練と訓練後の異なる時間間隔を用いて、DHEAとPREGSのsc注射の効果に拡大した。
図4. CD-1雄マウスのT字迷路足裏衝撃回避訓練におけるDMSO誘発健忘症に対するDHEAの効果
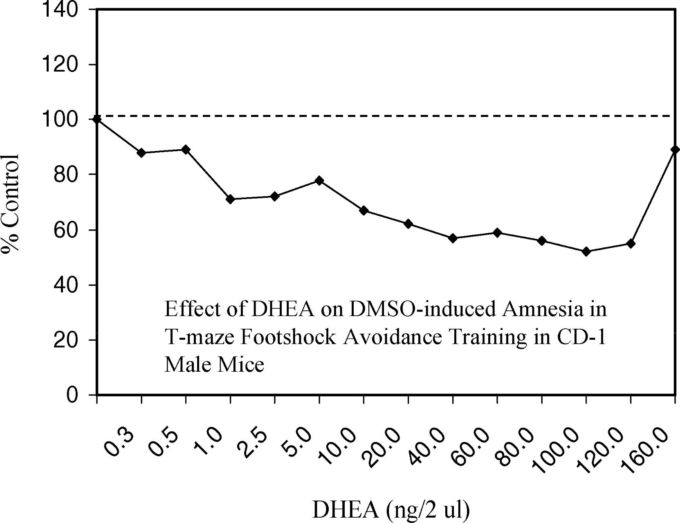
スコアが低いほど保持力が向上したことを示す。Floodら(1988年、表I、p.272)より。
図5. 飲料水に含まれるDHEASがT字迷路フットショック回避訓練の保持力に及ぼす影響
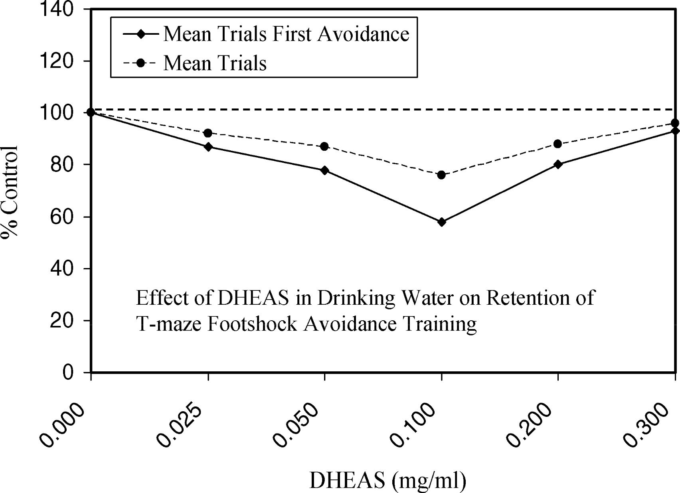
スコアが低いほど保持力が向上したことを示す。
Floodら(1988,表VI、p.275)より
図6. DHEASがステップダウン式受動回避訓練の保持に及ぼす影響
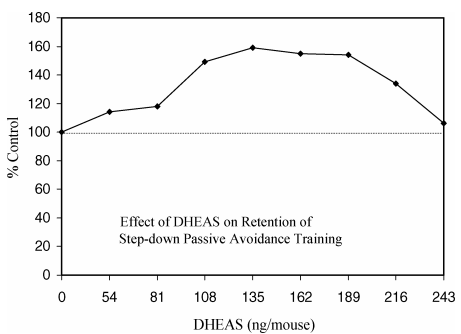
スコアが高いほど保持力が向上する。Flood ら (1988, Table IV, p.274)より。
この一連の実験では、ほぼ8倍の用量範囲で5つの用量を使用した。PREGSまたはDHEASをトレーニングの60分前(図8および9)またはトレーニング後すぐに注射した場合、Floodらの報告と同様に逆U字型の用量反応を示し、24時間後の記憶保持能力が向上した。
MelchiorとRitzmann(1994)の他の研究でも、PREG、DHEA(図10)またはそれらの硫酸塩が逆U字型の用量反応を示すことが明らかにされており、保持能力に影響を与える要因である可能性がある。
図7 DHEASのi.c.v.投与がT字迷路フットショック回避訓練の記憶保持に及ぼす影響
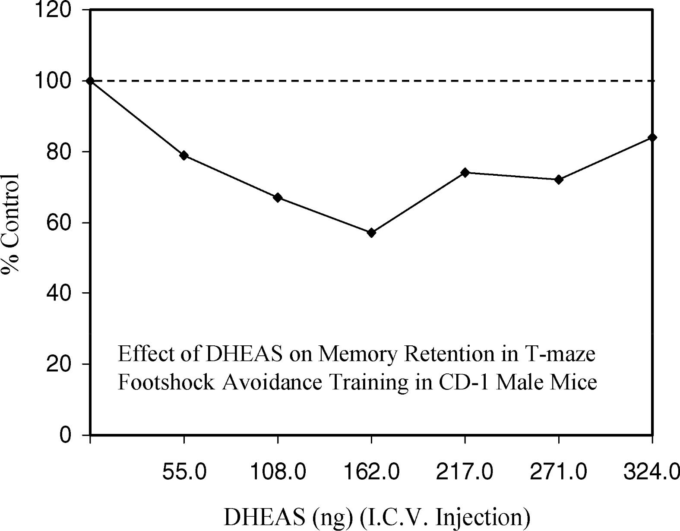
スコアが低いほど保持力が向上している。Floodら(1988, Table II, p.273)より。
図8
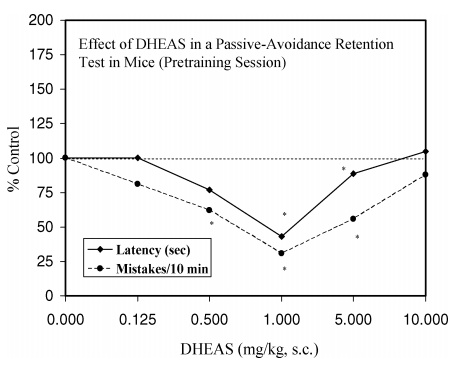
神経ステロイドであるデヒドロエピアンドロステローンスルフェート(DHEAS;0.125〜10mg/kg)を予備訓練の60分前に皮下投与することが、マウスの受動的回避保持試験におけるステップダウン潜伏時間およびミスの数に及ぼす影響。
保持テストはトレーニングセッションの24時間後に行った。スコアが低いほど保持力が向上したことを示す。アスタリスクはコントロールとの有意差を示す(p<0.05)。Reddy and Kulkarni (1998b, Figure 3, p. 111)より。
図9. 神経ステロイドである硫酸デヒドロエピアンドロステロン(DHEAS;0.125〜10mg/kg)を予備訓練の60分前に皮下投与することが,マウスの受動的回避保持試験におけるステップダウン潜時およびミスの回数に及ぼす影響
保持テストはトレーニングセッションの24時間後に行った。スコアが低いほど保持力が向上したことを示す。アスタリスクはコントロールとの有意差を示す(p < .05)。Reddy and Kulkarni (1998b, Figure 3, p. 111)より。
図10. 雄のC57BL/6マウスにおけるデヒドロエピアンドロステロン(DHEA)の投与量の範囲での高架式プラス迷路における開脚回数
各群n=6-12(対照を除く、n=29)。アスタリスクはコントロールとの有意差を示す(p < .05)。Melchior and Ritzmann (1994, Figure 1, p.439)より。
Vallee et al 2001b)は、主要なレビューの中で、「学習と記憶のプロセスに対する鎮痛作用のある神経ステロイドの効果に関して、2つの主要な概念を強調することができる」と結論づけている。1つ目の概念は用量依存性である。
実際、多くの研究では、興奮性ニューロステロイドの効果は二相性であり、非常に低い濃度でも、非常に高い濃度でも、学習や記憶のプロセスを変化させる効果は通常ない。したがって、ニューロステロイドの効果は、記憶増強剤で一般的に報告されているベル型または逆U字型の用量反応曲線に従う。” 2つ目の概念は、学習の獲得、定着、検索の各段階に影響を与える時間依存性である。この2つの概念は別々のものであるが、時間依存性の過程で逆U字型の用量反応が見られるように、相互に依存している。
* *
この解釈は、内因性のニューロステロイドだけでなく、合成されたものについても一貫していて(Akwa er al 2001)マウスやラットにおけるPREGSの合成(-)-エナンチオマーにも見られる。特に興味深いのは、この合成剤はPREGSの10倍の効力があるにもかかわらず、用量反応の定量的特徴は2つの化合物で類似しており、左にシフトしているだけであった。
バソプレシン
過去40年の間に、神経生理学的ペプチドホルモンが、学習した反応の定着や検索に関わる脳のプロセスに影響を与えていることを示す証拠が出てきた。de Wied(1965)によるこの分野での最初の研究では、後葉切除によって、脳の代謝障害とは無関係に、シャトルボックス回避反応の消失が促進されることが示された。
また、下垂体-生理葉組織の粗抽出物であるピトレシン(リジンバソプレシン-LVP)を摂取すると、正常な反応が回復した(de Wied, 1969)。これらの最初の報告に続いて多くの論文が発表され、条件付回避反応の正常な発現にはバソプレッシンが必要であるという結論に達した。
この一般的な見解は、トレーニング後の注射がその後の反応の消去を遅らせること、トレーニング後のバソプレッシン注射の効果はトレーニングと注射の間隔の関数として減少すること、トレーニング後のバソプレッシン注射が記憶統合の何らかの側面を修正することを示す研究によって洗練された。
これらの一般的な発見は、すぐにHaganら(1982)によって用量反応の文脈で設定された。Haganらは、訓練後30分までに注射した場合、シャトルボックス回避絶滅の逆U字型の用量反応を報告した。低用量と高用量の二相性反応は、より高い衝撃レベルでの訓練後にも起こり、知見の一般化を示唆するものであった(図11)。著者らは、LVPによる逆U字型の用量反応のメカニズムは不明であるとしながらも、幅広い学習実験パラダイムにおいて、同様の逆U字型の用量反応が一般的に認識されるようになってきたと述べている。
ACTH
1960年代後半から、記憶のプロセスが薬理作用によって影響を受けることが明らかになってきた。内因性の薬物としては、副腎皮質刺激ホルモン(ACTH)が研究対象となった。Beattyら(1970)は、ACTHを試験前に注射すると、シャトルボックス回避の獲得が容易になることを報告した。
他にも、レバー押し反応(Guth et al 1971)や自由行動回避(Wertheim et al 1967)でもACTHの投与が促進されたことが報告されている。回避課題の獲得が困難な視床下部ラットにACTHを投与すると,受動的回避(Andersonら,1968)および能動的回避(de Wied,1964)のいずれの条件でも,パフォーマンスの低下を補う。
* *
ACTHを投与した実験では、血清中のコルチコステロイド濃度が上昇する。しかし、受動的回避課題中の保持にはコルチコステロンの影響は見られなかった(Gold and Van Buskirk, 1976a)。実際、ACTHは副腎摘出動物にも同様の行動効果があり、回避反応の長時間持続などが認められている(Miller and Ogawa, 1962)。
* *
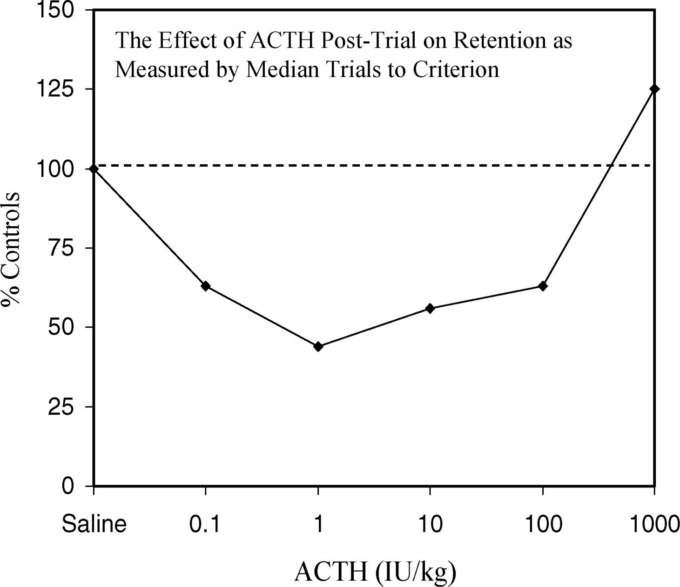
1970年代半ばになると、学習に対するACTHの研究では、研究デザインの影響が明らかになっていた。ブレークスルーとなったのは、GoldとVan Buskirk(1976a、1976b)の研究である。GoldとVan Buskirk(1976a、1976b)は、より広い用量範囲でACTHの保持効果を評価した(受動的回避課題で、試験後に注射して回避制御を行った)。その結果、逆U字型の用量反応が見られ、中程度の用量のACTHでは保持力が向上し、高用量のACTHでは学習力が低下することがわかった(図12)。
* *
GoldとVan Buskirk (1976a, 1976b)の研究結果は、SandsとWright (1979)によって選択識別課題に拡張され、最大5つの用量を使用し、試験後に注射と嫌悪制御を行った。著者らは、観察された効果が動機付けや状態依存的な学習の変化に関連している可能性があるため、試験前の広告投与を避けた。また、試験後に投与することで、記憶への影響を分離することができた。
* *
SandsとWright(1979)の結果は、GoldとVan Buskirk(1976a、1976b)が無傷のラットで行った初期の研究や、Goldら(1977)が下葉切除ラットで行った後期の研究と同様であった。図13に示したように、投与量を増やすと、最大値は1.5倍になる。
図12. トレーニングの24時間後に測定された記憶力に及ぼすトレーニング後のACTH投与の効果
スコアが低いほど保持力が高いことを示す。Sands and Wright (1979, Figure 1, p.416)より。
図13. 1試行の抑制性(受動的)回避課題で訓練したラットのACTHによる保持潜時の中央値
スコアが高いほど保持力が向上している。Gold and Van Buskirk (1976b, Figure 1, p.390)より。
mumの促進は1IU/kgで起こる。Sands and Wright (1979)の実験は、Gold and van Buskirkの実験とは時間やテスト方法が異なるが、最適な投与量はよく似ている。
* *
なお、試験前の注射を用いた同様の知見(Beatty et al 1970年、Guth et al 1971年、Koranyi et al 1967年、Schneider et al 1974)は、Gold and Van Buskirk(1976a、1976b)およびSands and Wright(1979)の再結果と一致している。
しかし,試験前に暴露する方法は,ACTHがラットに動機を与えてよりよいパフォーマンスをさせるのではないかという批判を受ける可能性がある。また、Sands and Wright (1979)の追試では、ACTHを試験の4時間後に投与したが、記憶プロセスには何の影響もなく、時間依存性が強いことが示された。
エピネフリン
副腎皮質ホルモンの一種であるエピネフリンが、学習と記憶に二重に作用することは、GoldとVan Buskirk(1975, 1978)がSprague-Dawleyの成体雄ラットを用いて行った研究で立証されている。彼らの実験方法は、弱い足の衝撃でラットを訓練した後、エピネフリンを注射するというものであった。このように試験後にエピネフリンを注射することで、より過激なトレーニングスキームの作用を模倣し、事実上システムを騙すことで、保持力を高める可能性があると考えられた。
CCK-8
研究方法は、非常に喉の渇きを感じているラットに、4日間連続で新種のプレトレーニングを行うというものであった。それぞれのラットは、白と黒の2つのコンパートメントからなるトレーニング装置に入れられた。白と黒の2つの区画のうち、黒の区画の端には水かきがあった。
4回目の試行では10秒以内に水を飲むようになったが,5日目の試行では10秒後に水を舐めたラットに軽い足の電気ショックを与えた。ラットは電気ショックの後すぐに取り出され、5回投与されたエピネフリンのうちの1回が注射された。6日目には、すべてのラットグループが水を摂取するのを嫌がるようになった。対照群の潜伏時間は、約10秒から70秒近くまで増加した。
図14. 1試行の抑制性(受動的)回避課題における後の再試行のパフォーマンスに対する、試行後のエピネフリン注射の効果
アスタリスクはp < 0.05でコントロールと有意に異なることを示す。Gold and Van Buskirk (1978, Figure 1, p. 513)より。
全体的に逆U字型の用量反応が一貫して観察された(図14および15)。最大潜伏時間の観点から最適なエピネフリンの投与量があるだけでなく、この反応は時間にも依存しており、トレーニングの2時間後にエピネフリンを投与しても効果がなくなっていた。
このデータは、時間に依存した記憶プロセスが、トレーニング後のエピネフリン注入によって促進されたと解釈された。逆U字型の反応は明らかに指摘されたが、メカニズム的には説明されなかった。GoldとVan Buskirk(1978)による他の実験では、より強力な足裏ショック(0.7から 2.0mA,0.4秒に増加)を与えた場合、対照群の潜伏時間は40秒から300秒に増加した。
図15. トレーニング直後に生理食塩水またはエピネフリンを投与した動物の舐めるまでの平均遅延時間(および標準誤差)
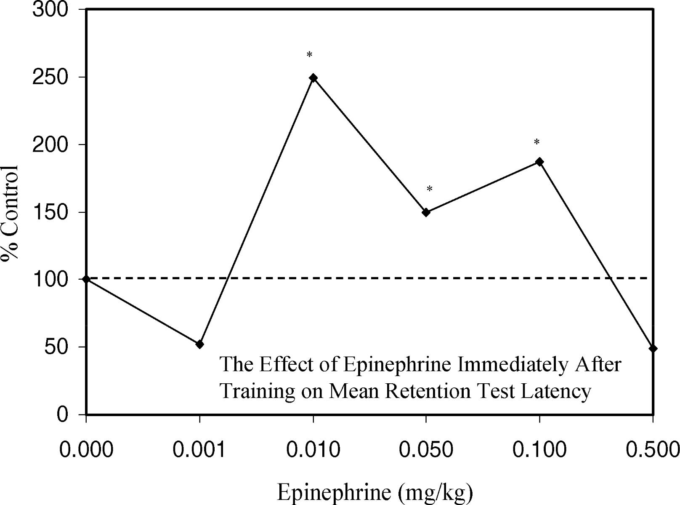
0.01~0.1mg/kgの用量範囲で、保持性能が有意に向上した。アスタリスクはp < 0.05で対照との有意差を示す。Gold and Van Buskirk (1975, Figure 1, p.148)より。
エピネフリンを用いたトレーニング後の同様の結果は、後にGoldら(Stone et al 1988)がDUB-ICR系統の雄マウスを用いて再報告している。この研究では、スコポラミンによって誘発された記憶喪失は、エピネフリンによって部分的に打ち消され、逆U字型の反応が見られた。
* *
進化論的には、動物が狩りの成功や餌の場所を明確に記憶することができれば、一般的に生存率が高まると考えられる。Floodら(1987b)は、この考えに基づいて、嫌悪的な訓練の後に動物に餌を与えると、記憶の保持が改善されると提案した。
この仮説を検証するために、生後6週齢の雄マウスの2つのグループには餌を与えず、3つ目のグループには同じ18時間の間、餌へのアクセスを無制限にした。このマウスは、T字型迷路で足の衝撃を避けることを学ぶために4回の訓練を受けた。
自由摂取群と餌を与えられていない群は,訓練の直後に餌を摂取した。アドリビタム群はほとんど食べなかったのに対し、餌を奪われた群は “貪欲に “食べた。3番目のグループは餌を与えられたが、訓練直後ではなく、3時間待つ必要があった。
この期間の後、3つのマウスグループは、1週間後にT字迷路での衝撃回避の記憶について再試験を受けるまで、自由に餌を食べることができた。再試験では、6回のうち5回連続して足裏にショックを受けないようにするには、何回の試行が必要かを評価した。
その結果、訓練直後に餌を入手した場合、テスト基準を達成するために必要な試行回数が有意に少ないことが明らかになった。訓練後すぐに餌を与えられた餌欠乏群は、アドリビタムマウスに比べて有意に少ない試行回数で済み、3時間待たされた餌欠乏マウスよりもさらに少ない試行回数で済んだ。
* *
摂食中にはさまざまな消化管(GI)ペプチドが放出され、中枢神経系に摂食終了の信号を送るので、Floodら(1987b)は、これらのペプチドの中で最も研究されているオクタペプチドであるGIペプチドchole-cystokininin(CCK-8)が記憶を増強するかどうかの影響を調べることにした。
先行研究では、CCK-8を末梢投与すると、いくつかの学習パラダイムで記憶保持が促進されることが実証されていた(Kat-suura and Itoh, 1986; Fekete et al, 1981, 1984)。
* *
Floodら(1987b)の研究では、記憶処理に影響を与えるという理由で、食物を奪われていないマウスに硫酸化CCK-8S(ip)を投与した。実験では、7つの治療群(0.01,0.05,0.1,0.5,1.0,5.0,10.0μg/kg)と対照群が同時に行われた。
4回のトレーニング試行の最後の30秒以内にCCK-8Sを投与し、1週間後に保持テストを行った。その結果、CCK-8Sは逆U字型の用量反応を示すことがわかった。すなわち、中間濃度では記憶力が著しく向上したが、低濃度と高濃度では対照値に近づいた。最適な反応を示したマウス(0.03〜1.0µg/kg)は、対照マウスの約1/3のトレーニングで記憶課題を達成した。
* *
CCK-8SのIP注射は、無傷の迷走神経を必要とするメカニズムでラットの摂食を阻害することが知られていたので、Floodら(1987b)は、迷走神経切開によっても記憶増強効果が阻止されるかどうかを検討した。その後の実験で、迷走神経を切断したマウスでは記憶の想起が著しく低下したことから、CCK-8が迷走神経を介して摂食による記憶増強効果を媒介している可能性が示唆された。
その後、L364,718を用いた実験が行われた。L364,718は強力なCCKアンタゴニストであり、主にCCK-A受容体(脳(CCK-B)受容体ではなく消化管受容体)に作用する。この実験では、FloodとMorley(1989)が、CCKの体内放出が、食事に伴う記憶保持の増強に影響を与えるかどうかを評価した。
拮抗薬は、訓練から7日後の記憶保持には影響しなかったが、訓練直後に食事を与えられたマウスの記憶保持の増強を著しく低下させた。これらの結果は、食事に伴う記憶保持の増強は、CCK-8の放出によるものであることを示している。
ニューロペプチドY
ニューロペプチドY(NPY)は,36アミノ酸のペプチドで,海馬や扁桃体などの記憶に敏感な部位に多くの結合部位を持つ。このようなNPY受容体の局在性から、Floodら(1987a, 1989)は、このペプチドがマウスの記憶に影響を与える能力を評価した。
Floodらは記憶力を評価するために、T字迷路のフットショック能動的回避とステップダウン受動的回避という2つの実験方法を用いた。ステップダウン受動的回避法では、7回の投与を行い、訓練後3分以内に脳の第三脳室にNPYを注入した。1週間後に行われた保持試験では、NPYはU字型の用量反応を示した。
同様の結果は、T-maze active avoidance protocolを用いて報告された。しかし、記憶を有意に増強するNPYの用量は、受動的回避(0.10-0.50ug/brain)と能動的回避(1.0-5μg/brain)で著しく異なっていた。この10倍の効力の違いは、NPYが受動的回避に関わる記憶保持に関連する神経経路に優先的に作用している可能性を示唆している。
* *
このような効力の違いにもかかわらず、能動的および受動的な記憶保持に関するさまざまな実験における記憶保持の増強の大きさは、すべて対照の2倍以内であり、ほとんどの最大反応は対照よりも30~60%大きいだけであった。
この実験方法をさらに改良し、脳の特定の部位にNPYを直接注入したところ、海馬または扁桃体に注入した場合、T字迷路フットショックによる能動的回避テストの反応が25-30%の範囲で増強されるというU字型の用量反応が再び明らかになった(Flood et al 1989年)。
保持力の加齢による変化
1981年、Takedaらは、老化が促進されたマウス系統(SAM P)と耐性のあるマウス系統(SAM R)の開発を報告した。P8系統では、R1やC57BLマウスに比べて学習・記憶障害が早期に現れたことから、Floodら(1993)は、加齢に伴う記憶障害に神経伝達物質が関与しているとすればそれは何かを調べた。
コリン系、ドーパミン系、アドレナリン系、セロトニン系、GABA系を調節する薬剤を、Floodらが以前に行ったT-maze foot-shock法を用いて評価した。当初、研究者らは、他のマウスの研究で記憶の再保持を促進することが示されていた単回投与量を試験に選び、T-mazeフットショック回避試験の直後に注射した。
この投与量の選択は、4カ月齢のR1マウスとP8マウスには非常によく効いたが、8カ月齢のP8マウスには一部しか効かなかった。この後者のケースでは、アレコリン(ムスカリンアゴニスト)タクライン(コリンエステラーゼ阻害剤)ミアンセリン(セロトニン拮抗剤)ではほとんど改善が見られなかったという。
アレコリンとタクラインがP8マウスの保持力を高められなかったのは、投与量が少なすぎたことが原因であると考えられたため、著者らはさらに幅広い高用量での実験を行った。セロトニン拮抗薬であるミアンセリンの場合は、低セロトニン作動性があると考えられ、低用量域で保持力が向上するのではないかという仮説が立てられた。
図16が示すように、これらの追試では、3つの例でU字型の反応が見られ、Floodらの直感を裏付ける結果となった。これらの用量反応の定量的特徴は、用量軸上でシフトしていることを除けば、正常マウスのU字型の用量反応と類似していた。
同様に、ホルミシス用量反応の量的特徴とも完全に一致していた。最適記憶保持反応の年齢差に関しては、4ヶ月齢から8ヶ月齢までは、アレコリンの投与量を2倍(1.5mg/kgから3.0mg/kg)にする必要があった。
12ヶ月齢になると、最適な投与量は4.5mg/kgに再び増加した。しかし、至適投与量にかかわらず、U字型の用量反応という概念が共通して浸透していた。同様のパターンは、Mianserinについても報告されている。その後の実験(Flood et al 1998)により、加齢による病変の基盤は海馬にある可能性が高いことが示された。
図16. 8ヶ月齢の老化促進マウスの退行に対するタクリン、アレコリン、およびミアンセリンの効果
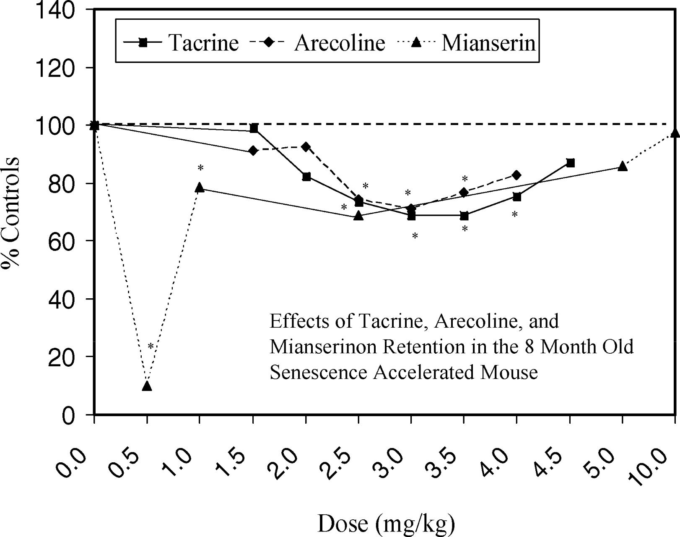
スコアが低いほど反応が良いことを示す。アスタリスクはp < 0.05でコントロールとの有意差を示す。Floodら(1993年、図2,p.162)より。
L-グルタミン酸、ビキュキュリン(GABAアンタゴニスト)ST-587(非アドレナリン系アゴニスト)SKF39393(ドーパミン系アゴニスト)を海馬に注射すると、P8マウスの一部または全グループでU字型の投与量再反応が見られた。
しかし、アリコラインだけは、海馬プスに注射した場合、保持力を高める力に年齢に応じた大きな用量反応の変化を示した。なお、R1マウスでは、同じ薬剤を投与しても用量依存的に記憶保持の増強が見られたが、加齢による変化は見られなかったことにも注目したい。
ニコチン受容体アンタゴニスト メカミラミン
ニコチン系受容体は、認知機能の様々な側面に大きく関与していることが示されている。しかし、報告されている改善効果が、受容体の刺激によるものなのか、脱感作によるものなのかは明らかではない。この混乱は、ニコチン受容体が容易に脱感作されるという事実に起因しており、学習の向上が低用量の刺激によるものなのか、高用量の抑制によるものなのかが明らかになっていない。
LevinとCaldwell(2006)は最近、この疑問に部分的に答えようと、低用量のニコチン性アンタゴニストを用いて、活性化せずに受容体を適度に阻害した場合の効果を評価する研究戦略を用いた。Sprague-Dawley系の雌の成体ラットを用いた研究では,幅広い低用量のニコチン拮抗薬を用いて,放射状腕迷路の反復学習法による学習効果を評価した。投与方法は、2桁(0.0156~1mg/kg)に及ぶ広範囲の低用量を用いたが、これらの用量は、記憶に悪影響を及ぼすことが知られている用量よりもはるかに低かった。
* *
迷路は、中央のゾーンと放射状に伸びる8本の長いアームで構成されていた。各試験時間は、ラットが中央ゾーンに置かれたときに開始された。10秒後に8本のアームの扉が開かれ、ラットが3本の餌付きアームに入るか、3分が経過するまでこのプロセスが続けられた。試験日には5回の連続した餌付け試験が行われた。ラットは5回の試験を連続して行う必要があった。
* *
試験日ごとに餌の付いた腕を変更し,隣接する2本の腕が餌にならないようにした。繰り返し獲得のための従属変数は,第2試行から第5試行までの試行ごとのエラーであった。ラットには週3回、18回の予備訓練を行った。データによると,メカミラミンの急性注射は,テストした範囲でU字型の用量反応に影響し,最も効果的な試行はセッションの中盤から後半にかけて見られた。
ミスの減少が最も顕著だったのは0.125mg/kgのときで,ミスが30%近く減少した(図17)。反応の速さ(図18)でも同じような改善が見られた(すなわち、腕の入力ごとの秒数で測定)。反応の向上は、反復性のエラーよりも、非反復性のエラーを回避するための精度に顕著に表れた。
非反復学習は、新しく餌を撒いたラジアルアームに移行できることと関連しており、反復エラーは、セッション間の移行の困難さに反映されていた。つまり、この行動は一種の学習可塑性を反映しているのである。U字型の用量反応を説明するメカニズムは解明されていないが、著者らは、低濃度の受容体遮断が認知機能を高めるのではないかと推測している。
図17. 成熟したSprague-Dawleyラットの放射状迷路における反復学習試行に対するメカミラミンの効果
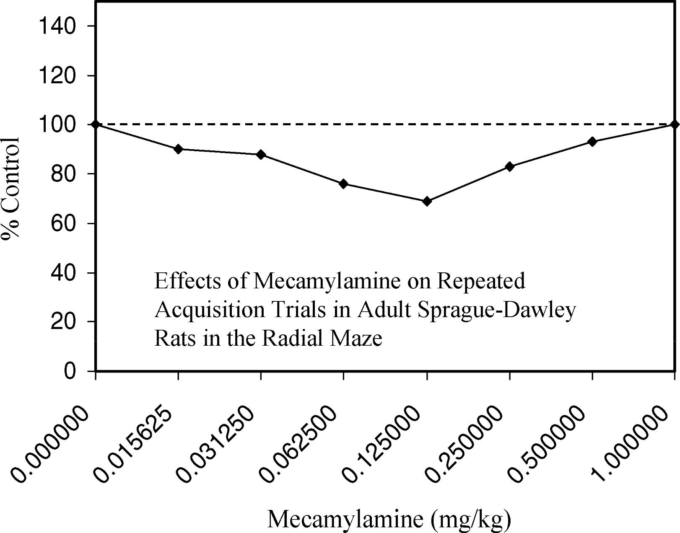
スコアが低いほど反応が改善したことを示す。Levin and Caldwell (2006, Figure 1, p.119)より。
図18. 成熟したSprague-Dawleyラットの放射状迷路における反応潜時に対するメカミラミンの効果
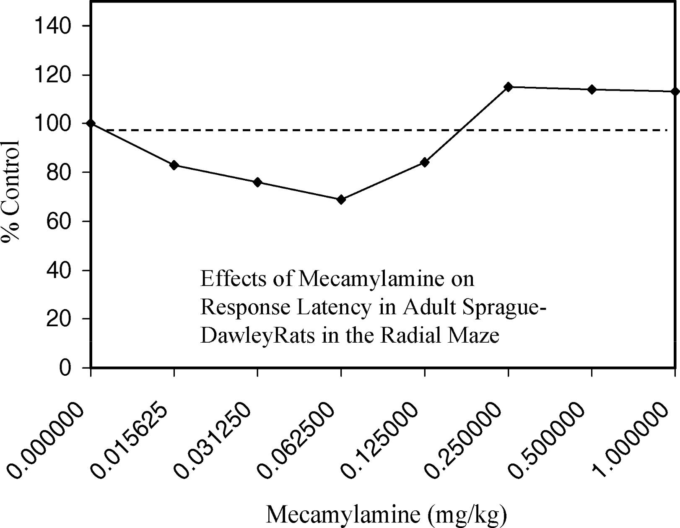
スコアが低いほど反応が改善したことを示す。Levin and Caldwell (2006, Figure 3, p.120)より。
血小板活性化因子アンタゴニスト
アルツハイマー病(AD)は、コリン作動性ニューロンの選択的な損失および神経炎症を含む複数の病態生理学的プロセスに起因する中枢神経系の神経変性疾患である。コリン作動性ニューロンの損失に対処するため、ACHEの活性を最適に阻害することで脳内のACHを増加させるというメカニズムの治療法が求められている。
ADに関連する炎症は、不溶性のアミロイドβと過剰にリン酸化されたタウタンパク質によって媒介されていると考えられており、これら、2つのタンパク質は、加速的な自己生成プロセスにおいて慢性的な脳の炎症を開始する可能性がある。ADの炎症プロセスは、強力な炎症メディエーターである血小板活性化因子(PAF)の関与によって進行すると考えられている。
Bate et al 2004a 2004b)は、PAFアンタゴニストであるギンコライドAまたはBが、AB型またはプリオンタンパク質から神経細胞を保護することを示し、ADとの関連性を指摘した。さらに、PAFの血漿レベルとアルツハイマー病患者の認知機能障害の程度との間には、有意な関連性があるとされている(Hershkowiz and Adunsky, 1996)。
* *
(Li et al 2007)は、抗ACHEと抗PAFの両方の特徴を持つ薬剤の記憶に対する能力を、成体の雄のKunningマウスを用いて評価した。その結果、実験薬はスコポラミンによる記憶・検索障害をU字型の用量反応で軽減することがわかった。試験は水迷路で行い、水底に沈んだプラットフォームに到達するまでの時間と、プラットフォームに到達するまでの泳ぎの距離を評価した。
* *
その結果、スコポラミンを投与した場合、各エンドポイントで90%近くの改善が見られたのである。これまでのACHE阻害剤の使用経験では、誘発される副作用が30~50%程度しか軽減されなかったため、このような改善の大きさは非常に心強い。しかし、最適な反転量の5倍の投与量では、有益な効果が本質的に失われることに注意する必要がある。この反応の二相性は、ホルミシス用量反応とよく似ている。
シナプスの可塑性
可塑性の概念は、生態学、行動学、組織学、遺伝学、そして複数の神経学的領域を含めて、非常に一般的に適用されている。神経領域では、この概念は主に脳とシナプスの可塑性に関係している。脳の可塑性の研究では、損傷を受けていない脳の領域が、損傷を受けた領域の機能を獲得する柔軟性に焦点が当てられることが多い。
シナプス可塑性の場合は、細胞や分子のメカニズムの理解が進み、長期増強(LTP)による記憶の形成と保存が行われるようになった(Martinez and Derrick, 1996)。LTPは、1回または連続した高周波刺激によって単シナプスの誘発反応が長期的に変化することを特徴とする。
LTPは,主に海馬の交連系とシェーファー側副系,および内嗅皮質-歯状回のパーフォラクトパスで研究されている。LTPは、発症が早く(0〜3分)持続時間が長い(1ヶ月)ことから、記憶保存の神経生理学的モデルとして提唱されている(Goddard, 1980; Lynch er al)。
* *
学習・記憶のシナプス可塑性モデルでは、LTPではシナプスの伝達が増加し、LTD(長期抑圧)のように減少することがある。今から 20年以上前、Bienenstockら(1982)は、シナプス強度の双方向の制御には、シナプス前後の活動の複合的な機能が必要であることを提唱した。
彼らは、活動が徐々に増加すると、最初はLTDになり、その後LTPに移行することを指摘した。このLTDとLTPの間の移行は閾値に基づいており、シナプス後の膜電位に依存している。Lisman (1989) は、シナプス可塑性の双方向の制御は、シナプス後のカルシウム (Ca2+) 濃度の上昇に依存していると報告している。
実際、現在、多くの研究が、LTDの大きさがシナプス後のCa2+濃度に依存し、U字型の再関係を記述することを示している(Cho et al 2001)。このカルシウム依存のU字型用量反応は、いわゆる双方向のシナプス可塑性変化をもたらす2つの形態のシナプス可塑性(LTPとLTD)を説明したもので、脳の複数の部分に適用できる一般的な概念である。
このCa2+濃度の変化は、α-amino-3-hydroxy-5-methylasoxazole-4-propionic acid receptor (AMPA-P)を介した視床下部経路の活性化によるもので、その結果、シナプス後のニューロンでCa2+が一過性に増加する(d’Alcantara et al 2003)。
* *
様々な研究で、コルチコステロン(図19)(Diamond et al 1992年、Pavlides et al 1994年、Lupien et al 2005年)エピネフリン(Gold et al 1984年)アンフェタミン(Gold et al 1984年)コカイン(図20)(Thompson et al 2005)などの薬剤による、様々な組織のLTPの影響を受けやすさが評価されている。
いずれの場合も、LTPを増強し、LTPと記憶保持の両方に同じ最適増強量を用いた行動実験で一貫して示されてきたように、逆U字型の用量反応曲線を示す結果となった。シナプス可塑性の指標であるLTP/LTD、正規化された興奮性シナプス後電位(EPSP)AMPA-P活性などのCa2+関連の用量反応の定量的な特徴は、記憶保持の反応と一致している。
さらに興味深いことに、これらの類似した用量反応は、力学的な活性化経路(ミネラルコルチコイドおよびグルコチコイド受容体、ドーパミン、アドレナリンなど)が異なっていても生じた。これらの用量反応の定量的な特徴は、ホルミシス用量反応を記述するニュメル的な用量反応とも一致する(Calabrese and Blain, 2005)。
これらのホルミシス応答は極めて一般的であり、生物学的モデル、組織、測定されたエンドポイント、化学物質の種類や物理的ストレス因子の種類に依存しない。これらのホルミシス用量反応は、特定の細胞タイプや生物におけるシナプス可塑性の場合と同様に、それぞれ独自の近縁のメカニズムを持っているが、用量反応の定量的な特徴は驚くほど類似している。
この発見は、可塑性の概念が非常に一般的であり、生物学的可塑性が機能するための共通の全体的な進化戦略があることを示唆している。実際、ホルミシス用量反応の定量的な特徴は、生物学的な可塑性が機能するために必要な、過去の経験を表しているようである。
図19. コルチコステロンとプライミングバースト増強の関係
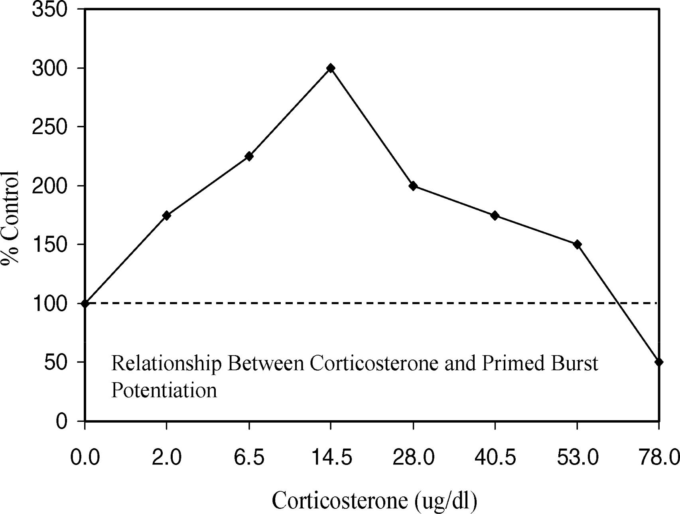
Diamondら(1992年、図2および3,p.424)より
図20. コカインはLTPの大きさに濃度依存的な二相性の効果を持つ。
海馬のCA1領域で記録されたfEPSP測定値を正規化してまとめたもの
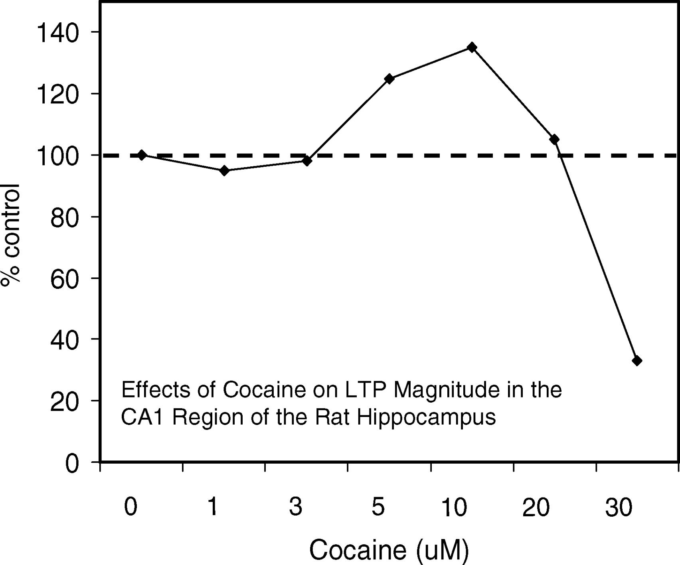
(Thompson et al 2005,図1D、p.187)より。
シナプス可塑性をはじめとする生物学的可塑性の定量的指標として、これまであまり認識されていなかった。
考察
1950年代後半、カリフォルニア大学バークレー校心理学部のMcGaugh、Petrinovichらによる初期の研究以来、認知機能向上剤の精神薬理学の分野は、生物医学研究者、製薬会社、そして何百万人もの様々なタイプの認知症患者にとっての課題であり、臨床上の希望でもある(Butler et al 1981,1984)。
これらの知見は、多くの合成薬(Butler et al 1981年、1984)や、ある種の神経ステロイド(DHEA、PREGなど)や神経ペプチドなどの内因性物質にも及んでいる。認知に影響を与える薬物や内因性アゴニストの用量反応関係は、この分野の50年近い研究の中で、しばしばU字型になっていると言われている。
この一般的な認知機能向上現象を説明するのに、ホルミシスなどの他の用語は使われていなかったようである。この分野の研究が開始される前の1950年代半ばには、化学物質による介入は認知障害を引き起こすだけだと考えられていたが、低濃度の多数の薬物が動物モデルやヒトの様々な認知症状を増強するという観察は、一般的に受け入れられた観察であり、その可能性に対する明らかな幅広い概念的批判はなかった。
U字型の用量反応が二律背反であることは一般的に受け入れられていたようだが、反応性の向上が記憶の定着に影響するのか、全体的なパフォーマンスに影響するのか、あるいは両方の組み合わせに影響するのかについては議論があった。また、動物実験で行われた特定の種類の認知的評価と、それが人間の状態に外挿できるかどうかについても、かなりの懸念が示されている。
同様に、至適投与量の反応性には個人差があり、臨床家にとってはユニークな問題であることも明らかになっている。
こうした課題にもかかわらず、Butlerら(1984)によると、逆U字型の用量反応の重要性は強調しすぎることはない。彼らの経験によると、薬効成分の毒性が低い場合、臨床現場では治療効果を得るために必要以上に投与量を増やしてしまう傾向があるという。しかし、ここで重要なのは、たとえ患者に毒性の兆候がなくても、治療域を超えてしまうとポジティブな認知効果が失われてしまうということである。

* *
この分野の研究では、いかにして患者を助け、その治療にかかる医療費を削減するかということが重要視されている。Butlerら(1981年、1984)などの経験を踏まえ、U字型の用量反応の発生と再現性を確実に立証した動物モデル研究から、反応を最適化する治療法を見つけるためのヒト臨床研究への移行を促進する必要性が指摘されている。このような基礎・応用研究では、認知機能を高める薬剤、動物モデルで得られた知見の再現、その結果のヒト臨床への応用、ヒトの反応性の確認、最適な反応性が得られる治療濃度域の決定などが行われてきた。
* *
今述べた枠組みは、研究目標と戦略、そしてこれらの目標を達成するために選択された投与量とその配分を含む研究デザインの特徴を確立するために、非常に重要である。認知研究の主な目的は、最適化ポイントに近づくほど確実かつ安全にパフォーマンスを向上させる薬剤を見つけることであるため、用量範囲発見実験で生物学的活性を広く定義し、最適な反応を示す用量を検証/複製するという用量反応研究戦略が存在する。
この研究戦略では、最適な反応を再現することに最優先で取り組んでいる。なぜなら、それは、より広範な用量反応連続体を理解するという観点から、臨床的に応用できる可能性があるからである。この戦略は、環境毒性学の分野では、U字型反応が起こることを機能的に認識したり期待したりすることはほとんどなく、危険有害性評価の目標は、ホルミシス領域の潜在的な反応を無視して、観測されない副作用レベル(NOAEL)の信頼できる推定値を導き出すことであったのとは明らかに対照的である。このように線量反応の評価方法が大きく異なるのは、明らかに認知研究者と環境規制科学者の線量反応の性質に関する目標や仮定が異なることを反映している。
認知研究の一般的な知見は、改善をもたらす薬剤は控えめなものであるということだ。すなわち、被験者が明らかな病理を持たず、年齢や性別に関係なく、あるいは認知に影響を与えることが知られている病理を持つかどうかにかかわらず、観察されたベースラインからの増加は、倍数の範囲ではなくパーセントの範囲になる傾向がある。
さらに、このことは、薬物がトレーニング期間の前に投与されたか、後に投与されたかにも関係する。より具体的には、最大の効果は30〜60%の範囲にあることが典型的に観察されている(図21)。
* *
このように、薬物による学習や記憶の向上に明らかな上限(=天井効果)があることは、重要な意味を持つ。この上限は、用量反応関係の最適化された部分を表している。単に薬物の投与量を増やすだけでは、パフォーマンスの向上は続かず、むしろ低下する。
また、高用量投与は、最適な状態から減少するだけでなく、有害な、あるいは望ましくない副作用を引き起こす可能性がある。反応の増加はベースラインの関数であり、絶対的な増加はベースラインの設定値に直接結びついている。
コリン作動性システムを扱う認知研究における刺激反応の幅は、動物モデルを用いた研究では、それが近親株であるか外来株であるかに関わらず、一般的に1オーダー以内である。このような用量反応の観点に対する最も顕著な挑戦は、タクラインを用いた研究に見られるかもしれない。
この研究では、薬物投与の時間をトレーニング後からトレーニング前に変更することで、用量反応が左にシフトしただけでなく、約10倍の反応範囲から 1000倍以上の反応範囲にシフトした(Smith et al 1996)。
図21. ACHE活性とアルツハイマー病患者の臨床的改善との関係
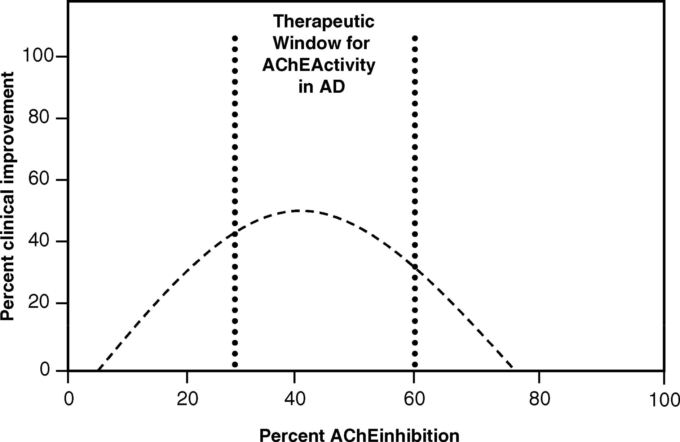
Beckerら(1991)による
認知機能の研究における刺激的な反応の大きさは控えめであるため、このような進歩は通常、罹患した患者に限られた利益しかもたらさない。このため、これまでに報告されているささやかな効果をはるかに超える効果を得る必要があると考えられる。
Floodら(1981)は、様々なACHE阻害剤とコリン作動薬を併用することで、相加効果以上の効果が得られることを期待して、多くの研究を行った。先に述べたように、Floodらが報告した基本的にすべてのケースで強力な相乗効果があった。
しかし、増強の大きさは対照の2倍以下に限られており、最大のホルミシス刺激の範囲内であった。相乗効果の真の利点は、1つの薬剤だけを使用し、その最適な投与量で適用した場合、効果を誘発するのに必要な投与量の約5%だけで、この最大の反応を達成できることであった。
Floodらの観察結果は、ホルミシス理論に非常に合致しているだけでなく、実用的にも非常に重要であり、事実上、ホルミシス応答が作用する可塑性限界によって課せられた制約を打破することがいかに困難であるかを明らかにしている。もし、ホルミシス制約を取り除くことができ、反応性を大幅に向上させることができるとしたら、生物医学的にどのような意味があるのか、という疑問を投げかける必要がある。
