Contents
Altered thyroid hormone profile in patients with Alzheimer’s disease
pubmed.ncbi.nlm.nih.gov/32889491/
ハイライト
- AD患者36名と健常対照者34名を対象とした横断的研究。
- 血清遊離T4は軽度AD認知症において中等度に上昇した。
- 血清T3/T4比の減少は、ADにおける末梢の脱ヨウ素反応の減少を示唆する。
- 脳脊髄液の甲状腺ホルモン濃度は、ADでは変化がなかった。
- 血清T3値は海馬および扁桃体の体積の増大と関連していた。
概要
背景
疫学的研究により、甲状腺ホルモン(TH)の高値はアルツハイマー病(AD)のリスク増加と関連しているが、進行したADでは、THは変化しないか、あるいは減少さえしている。AD初期の認知症では、甲状腺ホルモンがADの神経病理や脳の形態と関連しているかどうかはほとんど分かっていない。
研究方法
これは、1つのメモリークリニックで募集された36人の甲状腺機能低下症患者と34人の健康な対照者の横断的研究であった。血清および脳脊髄液(CSF)中のTHs濃度を測定した。さらに、CSF中のADバイオマーカー(アミロイドβ1-42、総タウ、リン酸化タウ)、MRIによる海馬と扁桃体の体積を測定した。
結果
AD患者では、対照群と比較して、血清遊離サイロキシン(FT4)値が上昇し、血清遊離トリヨードサイロニン(FT3)/FT4および総T3(TT3)/総T4(TT4)比が減少していた。さらに、血清TT4はAD患者でわずかに高かった(p = 0.05 vs. 対照群)。その他の血清中のTH濃度およびCSF中のTH濃度は両群で同程度であり、THとCSFのADバイオマーカーとの相関は認められなかった。しかし、血清FT3はAD患者の左扁桃体積と、血清TT3は対照群の左および右海馬体積と正の相関があった。
結論
甲状腺ホルモンは、血清FT4の増加を伴う軽度AD認知症において中程度の変化を示し、さらに、T3/T4比の減少は、T4からT3への末梢変換の低下を示唆している可能性がある。さらに、血清T3値はAD発症に関与する脳構造に関連していた。
キーワード
甲状腺ホルモン血清脳脊髄液Aβ1-42TauMRIボリューム測定TDP-43認知症
1. はじめに
甲状腺ホルモン(THs)は、ほとんどの組織の機能に影響を与える。脳では、THは生涯を通じて代謝、神経発生、髄鞘形成、細胞修復を制御する(Calzaら、2015;Remaudら、2014)。人生の初期に、THレベルが最適でない場合、脳の発達が損なわれる(Korevaarら、2016)。甲状腺刺激ホルモン(TSH)および生物活性トリヨードサイロニン(T3)の血清レベルは老化中に低下するが、T3へのプロホルモンとみなされることが多い遊離サイロキシン(T4)のレベルは維持される(Boelaert、2013年)。THレベルの変化は、神経変性や死亡率の上昇を含む死亡率および加齢に伴う表現型と関連しているため、これは重要であると考えられる(Cappolaら、2015;Gusseklooら、2004;Pasqualettiら、2015)。さらに、アルツハイマー病(AD)発症の実験的研究において、異常なTHシグナルは、アミロイド前駆体タンパク質(APP)遺伝子の転写を調節することによってβ-アミロイド(Aβ)産生を増強し、またタウのリン酸化を増加させる(Belakavadiら、2011;Belandiaら、1998;Chaalalら、2019;Luoら、2002)。
人口ベースの研究では、過剰なTHレベル、さらには基準範囲内の変化した血清TH[低正常TSHおよび高正常遊離T4(FT4)および総T4(TT4)]は、全原因認知症およびADのリスク上昇と関連していることがわかっている(Annerboら、2006、Chakerら、2016、Kalmijnら、2000、Moonら、2014、Riebenら、2016、Vadivelooら、2011、Yeapら、2012)。さらに、高正常血清TT4は、高齢男性の死後大脳皮質における新皮質神経斑(NP)および神経原線維変化(NFT)の量の増加と関連していた(de Jongら、2009年)。また、Rotterdam Scan Studyでは、高齢者の高血清FT4が内側側頭葉の萎縮と関連することが示された(de Jong et al.、2006)。注目すべきは、血清T3値と認知症リスクとの関係を調べた疫学研究は2件のみであり、これらの研究では、循環総T3(TT3)値と全原因認知症またはADのリスクとの関連は認められなかった(Cappolaら、2015、de Jongら、2006)。しかし、ライデン85プラス研究に含まれる超高齢者において、血清遊離T3(FT3)の低さは、認知症リスクは調査されなかったが、より速い認知機能低下と関連していた(Gusseklooら、2004)。
一方、ある横断的な集団ベースの研究では、甲状腺機能の低下(血清TSHの上昇)と全原因性痴呆との関連が観察された(Ganguliら、1996年)。さらに、8つの症例対照研究の再解析では、甲状腺機能低下症の既往がAD患者でより多く見られることが示された(Bretelerら、1991)。脳脊髄液(CSF)では、過去3件の研究で、AD患者のTH値は対照群と比較して変化しないか減少していることが明らかにされている。Accorroniらは、比較的軽度のAD認知症において、対照群と比較して同様のCSF TH値を報告している(Accorroniら、2017年)。別の研究では、顕性ADでは血清TSHが増加し、CSF TT4が減少した(Johanssonら、2013)。さらに、進行したADでは、CSF TT3レベルが顕著に低下した(Sampaolo et al.) 最後に、進行したAD(BraakステージV-VI)の剖検前頭前野では、軽度AD(BraakステージI-II)または健常対照脳と比較して、T3レベルの低下とT4レベルの変化が認められた(Davisら、2008年)。
要約すると、疫学的研究は、THレベルの高さと全死因性痴呆およびADのリスクの増加との関連を示唆している。一方、顕性ADにおける研究では、循環血中のTH濃度が変化しないか低いこと、さらに進行すると中枢神経系(CNS)においてTHの調節異常が見られることが示されている。今回、良好な管理下にあるヨーテボリMCI研究において、軽度認知症のAD患者と健常対照者の血清およびCSFのTHs濃度を調べた。血管負担がTHsとADの神経病理学的関連性を混乱させる可能性があるため、ADと血管性痴呆の混合型患者は除外された。また、THsの血清およびCSFレベルは、CSFのADバイオマーカー(Aβ1-42、総タウ、リン酸化タウ)、および磁気共鳴画像(MRI)を用いて推定した海馬および扁桃体積と関連しているかどうかを調査した。
2. 材料と方法
2.1. 研究参加者
単一のメモリークリニックで行われる縦断的研究であるヨーテボリMCI研究から募集したAD患者(n=36)および健常対照者(n=34)のTHのベースラインレベルを評価した(Wallin et al.、2016)。Gothenburg MCI研究において、すべての患者は、病歴、身体検査、放射線検査、神経学的検査、精神医学的検査を含む包括的なベースライン調査を実施された。包含基準は、年齢40歳以上79歳未満、Mini Mental State Examination(MMSE)スコア18点以上、自己または情報提供者が報告する認知機能低下の期間が6カ月以上であることとした。除外基準は、硬膜下出血、脳腫瘍、治療中の甲状腺機能低下症を除く甲状腺疾患、脳炎、不安定心疾患、大感情障害、双極性障害、統合失調症、物質依存、錯乱などの精神疾患などの認知障害を引き起こす急性疾患、全身疾患、その他の身体疾患であった。さらに、レボチロキシン治療、糖尿病、AD以外の認知症と診断された場合も除外基準とした。また、混合型認知症(ADと血管性認知症の合併)患者も除外された。認知機能低下のない、あるいはその既往のない健康な対照者は、高齢者団体を通じて、あるいは患者の配偶者の中から数例だけ募集した。それ以外は、対象・除外基準および研究手順はAD群と同様であった。
研究集団(AD、n=36および対照、n=34)において、研究期間中にレボチロキシン、アミオダロン、メチマゾール、プロピルチオウラシル、リチウム、5-フルオロウラシルなど甲状腺ホルモン値に影響を及ぼすことが知られている薬物治療を受けていた者はいなかった。
2.2. 倫理的配慮
この研究は、ヨーテボリ大学の倫理委員会によって承認された。すべての参加者から口頭および書面によるインフォームドコンセントを得た。本研究は、ヘルシンキ宣言に従って実施された。
2.3. 診断方法
認知障害の程度は、GDS(global deterioration scale)を用いて分類され、GDSのステージ1は認知障害なし、ステージ4は軽度認知症の可能性を示す(Reisberg et al.) この分類は、病歴(自己申告と医療記録のレビュー)と、記憶障害、見当識障害、抽象的思考障害、空間機能障害、言語の貧困、失語症、失行を含む段階的比較状態分析(STEP)の認知変数13〜20を含む認知症状の評価に基づいている(ウォリンら(Wallin et al, 1996)、I-Flex、Executive Interview(EXIT)の短縮版(Royallら、1992)、MMSE(Folsteinら、1975)、および臨床的認知症評価尺度(CDR)(Morris、1997)であった。CDRの評価は、参加者と情報提供者から提供された情報に基づいて行われた。STEP > 1, I-FLEX > 3, CDR > 1.0, MMSE ≤ 25の場合、患者は軽度認知症(GDS = 4)の基準を満たした。ただし、最終的なGDSスコアは、クリニックの専門医の合議による判断が必要であった。
GDSスコアが4の患者については、先に述べたような診断プロセスを適用した(Wallin et al.、2016)。認知症のサブタイプの診断については、臨床医は臨床症状およびMRIデータにアクセスできたが、CSFバイオマーカーおよび神経心理学的検査結果については盲検化された。ADの診断には、The National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer’s Disease and Related Disorders Association(NINCDS-ADRDA)の1984年の基準を用いた(McKhann et al.、1984)。さらに、認知症の混合型が含まれることを避けるため、ADの診断には、患者が主に頭頂側頭葉の症状を持ち、MRIで脳白質高濃度(WMH)を示さないか少量しか示さないことが必要であった。特に、ADに血管性痴呆を合併した患者を除外した。AD患者がMRIで脳WMH(Fazekas分類による中等度または高度)(Wahlundら、2001)を示し、前頭葉症候群が優勢ではない場合、またはAD患者が軽度のWMHを示し、著しい前頭葉症候群を合併した場合に診断された。
2.4. 臨床検査
体重は0.5kg単位で、身長は0.5cm単位で記録された。体格指数(BMI)は1メートル四方当たりキログラム(kg/m2)として計算された。服薬、喫煙習慣、ならびに糖尿病および高血圧の有無は、専門医により診察のたびに評価された。
2.5. 脳脊髄液および血液サンプル
CSFサンプルは、概日リズムの変動を避けるため、午前8時から10時の間にL3/L4またはL4/L5間座から腰椎穿刺により採取された。血液汚染を避けるため、CSFサンプルの最初の部分は廃棄された。CSFサンプルはポリプロピレンチューブに採取され、チューブを反転させることで穏やかに混合された。その後、CSFは室温で2000 x g、10分間遠心分離された。血液サンプルは午前8時から午前10時の間に絶食状態で採取した。血液と髄液のサンプルは生化学的分析が終わるまで-80℃で保存した。
2.6. MRIの手順と海馬と扁桃体の体積
磁気共鳴データの取得には、1.5 T MRI スキャナー(Siemens Symphony, Erlangen, Germany)が使用された。撮像プロトコルおよびシーケンスならびに容積測定手順は、以前に記載した(Eckerstrom et al.、2018)。FreeSurfer自動セグメンテーションソフトウェア(バージョン5.3.0;https://surfer.nmr.mgh.harvard.edu/)を使用して、頭蓋内、海馬、および扁桃体の体積を推定した。頭の大きさのばらつきを減らすために、各個体の局所脳体積は、残差正規化法(Voevodskaya et al.、2014)を用いて頭蓋内体積(ICV)に対して補正された。まず,対照群において関心領域生体積とICVの回帰分析を行い,回帰係数βを求めた後,回帰係数βを研究サンプル全体に適用し,式に従って修正局所脳体積を算出した。Volumeadjusted i = Volumeraw i – β(ICVraw i – ICVmean). 脳体積はcm3単位で表示される。
2.7. 生化学的手法
すべての生化学的分析は、分析者が臨床診断および他の臨床情報と盲検化された状態で行われた。TSH、フリーT4、総T4、フリーT3、および総T3の血清レベル、ならびにTSH、総T4、および総T3のCSFレベルは、電気化学発光免疫測定法(Roche Diagnostics, Mannheim, Germany)を用いて2017年に一度に測定された。すべての分析は、Sahlgrenska大学病院の中央研究所で行った。血清中の基準範囲は以下の通りであった。TSH: 0,30-4,2 mlU/l、TT4: 76,1-170 nmol/L、FT4: 12-22pmol/L, TT3: 1,3 – 3,1 nmol/L および FT3: 3,1-6,8 pmol/Lであった。
総(T)-tau、リン酸化(P)-tau181、およびAβアミノ酸1-42(Aβ1-42)のCSFレベルは、サンドイッチELISA(INNOTEST、富士レビオ、ゲント、ベルギー)を使用して決定した(Wallin et al.、2016)。APOE(遺伝子地図座19q13.2)遺伝子型判定は、以前に記載したようにミニシーケンスによって行った(Blennowら、2000;Wallinら、2016)。
2.8. 統計解析
すべての統計解析は、SPSS for Windows version 25 (SPSS, Chicago, IL, USA)を用いて実施した。TH変数の非正規分布のため、記述統計結果は中央値および四分位範囲として示される。グループ間の差は、カテゴリーデータに対してカイ二乗検定を使用して調べた。連続変数については、2群間の比較にはMann-Whitney U検定を適用し、複数群間の差(APOE ε4対立遺伝子分布に関連した血清およびCSF THレベル)の評価にはKruskal-Wallis検定を使用した。相関分析は、Spearman順位相関検定を用いて行った。すべての分析において、両側p<0.05は統計的に有意であるとみなした。
3. 結果
3.1. 臨床的特徴
非糖尿病AD患者36名と健常対照者34名のベースライン特性を表1に示す。年齢、性別、学歴(年)、BMI、高血圧の有病率に関して、研究グループに有意な差はなかった。予想通り、AD患者は健常対照者と比較して、MMSE得点が低く、APOE ε4対立遺伝子の頻度が高く、CSF Aβ1-42レベルが低く、CSF T-tauとP-tauのレベルが高かった(Table 1)。海馬と扁桃体の体積はすべてAD群で小さかった(表1)。
表1. AD患者および健常対照者のベースライン特性
| 広告 | コントロール | ||
|---|---|---|---|
| 変数 | (n = 36) | (n = 34) | p値 |
| 年齢(年) | 68(64–73) | 65(60–69) | .070 |
| 男性/女性、n(%) | 15/21(42/58) | 12/22(35/65) | .630 |
| 教育(年) | 12.0(9.0–15.0) | 12.0(11.0–14.0) | .395 |
| BMI(kg / m 2) | 23.9(22.5–25.8) | 25.4(22.9–27.8) | .054 |
| 高血圧、n(%) | 8(22.0) | 3(8.9) | .189 |
| MMSEスコア | 24.9(20.5–27.0) | 30.0(29.0–30.0) | <.001 |
| APOEε4対立遺伝子(0/1/2; n、%) | 9/16/6(25/44/216) | 18/9/1(53/27/3) | .016 |
| CSFADバイオマーカー | |||
| アミロイド-β1-42(ng / L) | 351(260–577) | 850(540-1045) | <.001 |
| 総タウ(ng / L) | 482(332–803) | 271(170–351) | <.001 |
| リン酸化タウ(ng / L) | 71(49–104) | 49(33–60) | <.001 |
| 調整された脳のボリューム(cm 3) | |||
| 左海馬 | 2.73(2.27–3.44) | 3.65(3.43–4.02) | <.001 |
| 右海馬 | 2.92(2.63–3.44) | 3.89(3.58–4.09) | <.001 |
| 左扁桃体 | 1.07(0.93–1.29) | 1.30(1.16–1.38) | .004 |
| 右扁桃体 | 1.15(1.06–1.28) | 1.34(1.28–1.48) | <.001 |
特に断りのない限り、数値は中央値(25~75パーセンタイル)で示した。P値は、カテゴリーデータにはカイ二乗検定を、連続変数にはMann-Whitney U検定を使用して算出した。脳容積は頭蓋内容積で調整した。AD患者5名と対照者6名ではAPOE遺伝子型判定は行われなかった。APOE ε4 = Apolipoprotein Eε4, BMI = Body mass index, MMSE = Mini Mental State Examination.
本研究では、AD患者および対照者のいずれも、甲状腺疾患の臨床的徴候を認めなかった。2人のAD患者は、血清TSHが軽度上昇し(それぞれ5.5および5.7mIU/L)、血清FT4値は基準範囲内であった。血清TSHが正常(2.2mIU/L)のAD患者1人は、血清FT4値がわずかに低値(11pmol/L)であった。対照群には、基準範囲外の血清TSH濃度を示した者はいなかった。しかし、2人の健康な対照者は、血清FT4レベルが基準範囲よりわずかに低かった(両方とも11pmol/L)。これらの患者と対照者を除外しても、この研究の結果には影響がなかった(データは示していない)。
AD患者のうち15人(42 %)はアセチルコリンエステラーゼ(AChE)阻害剤による治療を受けていた。しかし、血清およびCSF中のすべてのTH濃度は、AChE阻害剤投与患者と非投与患者で同程度であった(データ未提示)。
3.2. 血清およびCSF中の甲状腺ホルモン
AD患者は対照群に比べ、血清FT4値の増加(p=0.03)、血清TT4値の増加傾向(p=0.05)を示した(表2)。AD群と対照群では、TSH、FT3、TT3の血清レベルに関して差はなかった。しかし、AD患者は対照群に比べ、血清FT3/FT4比(p=0.04、図1A)だけでなく、血清TT3/TT4比(p=0.01、図1B)も低値であった。
表2. AD患者および対照群における血清および髄液中の甲状腺ホルモン濃度
| 広告 | コントロール | ||
|---|---|---|---|
| 変数 | (n = 36) | (n = 34) | p値 |
| 血清甲状腺濃度 | |||
| TSH(mlU / L) | 1.8(1.2–2.3) | 2.0(1.5–2.7) | .297 |
| フリーT4(pmol / L) | 15.0(14.0–16.3) | 14.0(12.8–15.0) | .032 |
| 合計T4(nmol / L) | 96.5(87.0–112.5) | 90.5(82.0–99.4) | .052 |
| フリーT3(pmol / L) | 4.4(4.3–5.0) | 4.9(4.2–5.1) | .351 |
| 合計T3(nmol / L) | 1.6(1.5–1.7) | 1.6(1.5–1.8) | .301 |
| CSF甲状腺濃度 | |||
| TSH(mlU / L) | 0.03(0.03−0.04) | 0.03(0.03〜0.04) | .203 |
| 合計T4(nmol / L) | 7.4(6.8–7.9) | 7.3(5.8–7.7) | .385 |
| 合計T3(nmol / L) | 1.0(0.9–1.0) | 1.0(0.9–1.0) | .124 |
| 合計T3/合計T4比率(%) | 12.9(12.2–14.2) | 12.9(12.3–15.6) | .492 |
| CSF/血清比 | |||
| TSH(%) | 1.8(1.4–2.3) | 1.8(1.5–2.2) | .915 |
| 合計T4(%) | 7.3(6.6–8.2) | 7.9(7.0–8.7) | .222 |
| 合計T3(%) | 59.1(54.5–66.0) | 58.8(52.6–63.0) | .286 |
特に明記されていない限り、値は中央値(25〜75パーセンタイル)として示される。P値は、マンホイットニーU検定を使用して計算された。T3 =トリヨードチロニン、T4 =チロキシン、TSH=甲状腺刺激ホルモン。
図1.
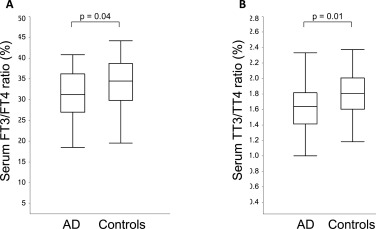
AD患者(n=36)は対照群(n=34)に比べ、血清T3/T4比が低かった。A) AD群と対照群における血清FT3/FT4比とB) 血清TT3/TT4比。箱ひげ図中の値は、中央値(横線)、25-75パーセンタイル(箱)、範囲(ひげ)で示される。群間差はMann-Whitney U検定で評価した
2つの研究グループは、TSH、TT4、TT3、およびTT3/TT4比のCSFレベルがほぼ同じであった(表2)。また、CSF/血清の TT4 と TT3 の比率も両群で統計的に同様であった(表 2)。
3.3. 性別とAPOE ε4遺伝子型の影響
男性および女性のAD患者は、血清およびCSF中のTHsのレベルがほぼ同じであった(データは示されていない)。さらに、APOE ε4対立遺伝子のキャリアは、非キャリアと同様に血清およびCSF中のTH濃度を有していた(データ示さず)。
3.4. 相関分析
まず、血清またはCSFのTHs濃度がCSFのADバイオマーカーと相関しているかどうかを分析した。しかし、AD患者においても対照群と同様に、血清およびCSFのTHsレベルは、CSFのAβ1-42、T-tau、P-tauのレベルと関連しなかった(データは示していない)。
次に、測定されたTHsがMRIで推定された海馬と扁桃体の体積と関連しているかどうかを評価した。血清FT3値は、AD患者の左扁桃体積と正の相関があった(rs = 0.42, p = 0.03;図2A)。さらに、対照群では、血清TT3値は、左(rs = 0.51, p < 0.01; 図2B)および右(rs = 0.48, p = 0.01; 図2C)海馬体積と正の相関を示した。THsのCSFレベルは、AD患者および健常対照者の脳体積と関連しなかった。
図2
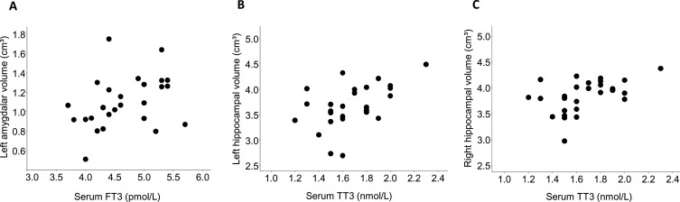
血清T3値は海馬および扁桃体の体積と正の相関があった。(A)AD患者では、血清遊離T3(FT3)濃度は左扁桃体積と正の相関があった(rs = 0.42, p = 0.03)。さらに、対照群では、血清総T3(TT3)値は、(B)左海馬体積(rs = 0.51 p < 0.01)および(C)右海馬体積(rs = 0.48, p = 0.01)と正の相関を示した。脳体積は頭蓋内容積で調整した。相関は、スピアマン順位相関検定を用いて求めた
4. 考察
単施設のメモリークリニックにおいて、血清および髄液中のTH濃度、髄液中のADバイオマーカーおよびMRIで推定した脳容積との関連について検討した。AD患者は、対照群と比較して、血清FT4が上昇し、血清FT3/FT4およびTT3/TT4の比率が低下し、血清TH濃度に中程度の変化がみられた。また、AD患者では血清TT4が高い傾向にあった(p=0.05)。一方、血清TSH、FT3、TT3およびCSFのTHs濃度は両研究グループとも同程度であった。血清およびCSFのTHs濃度は、CSFのADバイオマーカー(Aβ1-42、T-tau、P-tau)とは相関がなかった。一方、AD患者の血清FT3値は左扁桃体積と正の相関があり、健常対照群では血清TT3値が左右の海馬体積と正の相関があった。これらの結果は、全体として、AD初期におけるTHsの調節障害を示唆している。
本研究では、健常対照者と比較して、AD患者の血清FT4は高く、血清TT4は高い傾向にあった。両群とも、臨床症状がなく、検査値が正常範囲内であることから、すべての参加者に甲状腺疾患はなかった。さらに、参加者の誰も、TH値を妨害する薬物を投与されていなかった。これまで、いくつかの疫学研究により、低正常血清TSH値または高正常血清FT4およびTT4値によって示される高正常甲状腺機能と、全原因認知症およびADのリスク増加との関連性が示されている(Chakerら、2016;de Jongら、2009;Kalmijnら、2000;Riebenら、2016;Vadivelooら、2011;Yeapら、2012)。また、正常な老化と認知症の間の認知機能低下の過渡的状態である軽度認知障害(MCI)における2つの研究では、血清TSHの低正常値は、全原因性認知症またはADへの転換リスクの高さと関連していた(Annerboら、2006; Moonら、2014)。したがって、認知症状発症前の健常者においても、MCI患者においても、甲状腺機能の高さはADのリスク上昇と関連することが示唆されている。これらの結果とある程度一致するように、我々は軽度のAD認知症においても血清FT4の上昇を見いだした。
AD患者におけるFT3/FT4およびTT3/TT4比の低下は、末梢におけるT4の生物活性T3への変換が対照群よりも低いことを示唆している。しかしながら、血清FT3およびTT3値は変化していなかった。末梢の脱塩素化の低下は、重症患者の死亡率の増加(Flierら、2015年)、および高齢者集団の認知機能の低下と死亡リスクの増加(Gusseklooら、2004年)の両方と関連している。さらに、血清FT3/FT4比の低下は、老人病棟で血清FT3値が正常な高齢患者でも認知機能低下の独立した予測因子であった(Pasqualettiら、2018年)。認知症との関連で血清T3またはT3/T4比を調査した先行研究はほとんどない。2つの疫学研究では、血清TT3値と全原因認知症リスクとの関連は認められなかったが、TT3/TT4比は調査されていない(Cappolaら、2015年;de Jongら、2006年)。以前の縦断的解析では、血清FT3がMCIからADへの進行リスクと逆相関することを見出し、低T3がAD認知症のリスク上昇と関連することを示唆した(Quinlanら、2019年)。
血清のTH値とは対照的に、CSFのTH値にはグループ間の差は観察されなかった。軽度から中等度のAD認知症における過去の2つの横断研究では、CSF TH値は対照群と比較して変化しないか(Accorroniら、2017)、軽度の低下(CSF TT4の低下)(Johanssonら、2013)であった。一方、Sampaoloらは、進行したAD患者群(n=21、平均MMSEスコア=8)において、CSF TT3およびCSF TT3/TT4比が対照群と比較して減少していることを明らかにした(Sampaoloら、2005年)。このように、完全には一致しないが、これらの結果は、ADが重症化するにつれて、CSF中のTHが徐々に減少することを示唆している。この考えを支持するものとして、進行したAD(Braak病期V-VI)の死後前頭前野ではT3は低いがT4は変化しないが、神経病理的負荷が軽度のAD(Braak病期I-II)では変化しないことがわかった(Davisら、2008年)。したがって、今回の結果は、軽度AD認知症ではCSFのTHsレベルに大きな変化はないことを支持するものであり、一方、CSFのTHレベルは疾患の進行中に減少するようである。
相関分析では、TH値はCSFバイオマーカー(Aβ1-42、T-tau、P-tau)のレベルとは関連しなかった。これは、THがCSF ADバイオマーカーと無関係(Accorroniら、2017)または中程度の相関(Johanssonら、2013)であったため、以前の結果とある程度一致している。しかし、実験的研究は、T3がAPP遺伝子発現を抑制し、血清TH欠損ラットがAβ産生の増加、タウの高リン酸化、および海馬体積の減少を示したことから、THがAD発症に影響を与えることをある程度支持している(Belandiaら、1998;Chaalalら、2014、2019)。さらに、AD群では血清FT3が扁桃体積と正の相関を示し、対照群では血清TT3が左右の海馬体積と正の相関を示したことが確認された。成人の脳の形態とTH値の関係を調べた研究はほとんどなく、我々の知る限り、ADにおけるこの関係を調べた先行研究はない。Rotterdam Scan Studyでは、非発明高齢者において、血清FT4が高いほど海馬および扁桃体の萎縮が大きかったが、血清TT3は脳容積と関連しなかった(de Jong et al.) 同様に、高い血清FT4は、高齢者におけるより小さな総脳体積と関連した(Chakerら、2018)。全体として、この結果は、高いT4レベルが高齢者脳の体積の減少と関連することを示唆し、一方、十分なT3レベルがAD発症に関与する脳構造を維持するために必要である可能性がある。
ADは長年にわたって進行し、最初は神経病理学的負担が蓄積する臨床的に無症状の長い間隔があり、その後、臨床的に検出可能な認知機能低下を伴うMCI状態になり、最終的に機能障害を伴う顕性認知症になる(Aisen et al.、2017年)。これまでの研究結果から、TH値は様々な病期で異なることが示唆されている。疫学的データは、ADの無症状期には血清FT4およびTT4値が高正常であることを示唆しており、我々の結果は、軽度AD認知症において血清FT4の上昇が残っていることを示唆している。より進行したADでは、血清FT4値は非認知症高齢者と同様のレベルまで低下するようである。一方、ほとんど研究されていないが、T3値はADの無症状期には上昇していない。血清FT3はMCIからAD認知症への進行と逆相関さえしており(Quinlanら、2019)、CSF T3は進行期で低下していた(Sampaoloら、2005)。したがって、これまでの結果は本研究の結果と一致し、比較的早期のADでは血清中のT4の上昇はT3値の上昇を伴わないことが示唆された。これは、末梢でのT4からT3への変換が減少しているためであり、ひいては血清FT4上昇の影響を緩和するための防御機構である可能性があるとの仮説を立てることができる。
さらに推測すると、AD発症中の末梢でのT4からT3への変換の減少は、二次的な現象ではなく、TH代謝の主要な機能障害である可能性も否定できない。もしそうなら、疫学的研究における血清T4の増加は、おそらくデイオジナーゼ活性の低下によって引き起こされるT4からT3への脱ヨウ素反応の減少を補うための二次的事象である可能性がある。この考え方は、2型デイオジナーゼ(D2)をコードするDIO2遺伝子の共通多型(D2-Thr92Ala)のキャリアが、D2触媒活性の低下と神経変性障害に関連する転写変化を示すという知見によって支持されうる(McAninchら、2015年)。さらに、D2-Thr92Ala多型は、アフリカ系アメリカ人ではAD発症と関連したが、ヨーロッパ系アメリカ人では関連しなかった(McAninchら、2018年)。一方、DIO1(1型デイオジナーゼをコードする)およびDIO2遺伝子の多型は、Rotterdam Scan Studyにおいて海馬または扁桃体の体積と関連しなかった(de Jong et al.、2007)。
辺縁優位型加齢性TDP-43脳症(LATE)では、SLCO1A2/IAPPおよびABCC9リスク関連遺伝子型は、脳実質T3/T4比の低下を含むTH調節異常に関連している(Nelsonら、2016、2019b)。死後検査では、LATE神経病理が老化したAD脳にしばしば存在することが示されている(Josephsら、2015年)。LATEはエピソード記憶喪失と関連しており(Nagら、2017)、併存するLATE神経病理は扁桃体および海馬のAD関連萎縮を悪化させる可能性がある(Josephsら、2017;Makkinejadら、2019)。したがって、LATE神経病理を併発することは、THsのより深刻な調節障害を含むADの臨床的結果を悪化させる可能性がある。しかし、LATE神経病理は、80歳以上の個体に主に存在する(Nelsonら、2019a)。本研究では、AD患者の年齢の中央値は68歳で、最高年齢は78歳であった。剖検による確認ができなかったため、我々のAD患者におけるLATE併存の程度を判断することはできなかったが、本研究に含まれる患者よりも高齢のAD患者においては、LATE神経病理を併発することがより大きな意味を持つと推測される。
本研究はいくつかの長所と短所を有している。長所は、一つのメモリークリニックで、よく特徴づけられた、甲状腺機能正常、非糖尿病の研究集団であることだ。すべての血清とCSFサンプルは同じ機会に測定され、T3の測定も含まれている。さらに、THレベルの逸脱は、以前に心血管疾患のリスク上昇と関連しており(Jabbarら、2017)、THとAD進行の間の可能な関係を不明瞭にする可能性がある。したがって、この可能性を排除するために、ADと血管性認知症の混合型患者を除外した。しかし、LATE神経病理学などの併存疾患をコントロールするための剖検適合がないことが限界である(Nelson et al.、2019a)。もう一つの限界は、研究人口が比較的少ないため、統計的検出力が制限され、THsとAD関連病理との真の関連性を過小評価する結果となった可能性があることだ。また、研究参加者は全員甲状腺機能低下症であったが、参加者が以前に人生で甲状腺障害の病歴があったかどうかは記録されていない。最後に、本研究の横断的デザインは、結果の時間的特性についての結論を制限するものである。
5. 結論
この単一施設の研究において、軽度の AD 認知症患者は、健常対照者と比較して、血清 FT4 が上昇し、血清 TT4 がわずかに上昇し、血清 TH 値が中等度に変化していた。さらに、血清 FT3/FT4 比および TT3/TT4 比は AD で低下しており、おそらく末梢での T4 から T3 への変換が減少していることが示唆された。しかし、これがAD発症の主要な病理学的事象なのか、それとも血清T4上昇に対する二次的な保護反応なのかは、今後の研究によって解明される必要がある。さらに、ADで初めて、THがMRIで推定される脳の形態と関連しているかどうかを調べた。これらの解析により、ADでは血清FT3の高値が扁桃体積の大きさと関連しており、健常対照者では血清TT3が左右の海馬の体積と正の相関があることが示された。これらの関連は、AD患者のみならず健常高齢者においても、十分なT3レベルが脳の形態維持に有益であることを示唆している可能性がある。最後に、我々の研究でCSFのTH値が変化しなかったことは、いくつかの先行研究で見られたTHの病的なCNSレベルは、主にAD認知症の後期で起こることを示唆している。