Contents
A robustness-based approach to systems-oriented drug desig
北野宏明
公開: 2007年2月23日
概要
特定の疾患の根底にあると考えられる特定のタンパク質を特異的に標的とした多くの潜在的な薬剤は、期待されていたよりも効果が低かったり、重大な副作用を引き起こすことが判明している。このような薬剤の成功を阻む重要な要因は、生体システムが様々な摂動に対して本質的に頑健であることにある。複雑なネットワークシステムを研究し、工学的に確立された制御・通信理論を再構築することで、生体システム、特に細胞レベルでのロバスト性をより効果的に制御するシステム指向アプローチの理論的基盤を構築することができる。ここでは、ロバスト性の概念を説明するために既存の薬剤をベースにした例を用い、ロバスト性の重要性をより深く考えることが、複雑なシステムを制御することを目的とした新薬の設計にどのように影響を与えるかを議論する。
過去20年間のゲノム研究の進歩は、単一の疾患の原因分子を特異的に標的とする薬剤、すなわち「魔法の弾丸」が、がんや糖尿病、その他の複雑な疾患を治療できるのではないかという期待を煽った。しかし、そのような薬剤の中には成功したものもあるが、他の多くは効果がなかったり、重大な副作用を引き起こすことが判明している。このような残念な結果は、シングル・ターゲット・ドラッグ・パラダイム1-3の限界を、浮き彫りにしており、製薬業界の生産性の低迷の根本原因ではないかとの見方もある。
このような限界を踏まえて、効果的なコンビナトリアル医薬品、複数の標的を持つ医薬品、システム生物学3-6 の進歩により、システム指向の創薬アプローチへの関心が高まってきている。このようなアプローチには、マルチコンポーネントアプローチ7,合成致死量8,ハイスループットスクリーニングとデータ統合5,6,9,細胞ベースのシステムバイオロジーアッセイ3,4,メタボロームベースのアプローチ10-12などがある。このようなアプローチが出現し続ける中、今日の技術によって生成される大量の生物学的データに対応できる理論的・概念的な枠組みを確立することは、その期待を実現する上で重要な役割を果たす可能性がある。
成功した薬剤と失敗した薬剤の両方を分析した結果、薬剤の成功を決定する基本的な要因の一つは、疾患の発症と進行に関して生物学的システムの堅牢性と脆弱性がどのように利用されているかであることが明らかになった。生体システムは、一般的に突然変異、毒素、環境変化などの様々な摂動に対しては頑健であるが、システムが最適化されていない摂動に直面すると、非常に脆くなることがある。薬物は、標的とする患者(場合によっては病原体)のシステムの固有の堅牢性が、薬物によって引き起こされる変化を補うものである場合には、効果を発揮しないことがある。
対照的に、薬剤の副作用は、これらのシステムの予想外の脆弱性のポイントへの干渉の結果である可能性がある。
堅牢性、疾患、薬効と副作用の関係を理解することは、所望の治療目標を達成するために堅牢なシステムを標的とすることができる薬剤を設計するための第一歩である。このことを念頭に、生物学的システムの複雑性と工学的な制御・通信理論に基づいた概念的枠組みを用いて、生物学的ロバスト性の観点から医薬品の成功と失敗を考察し、システム指向の医薬品設計戦略の基礎を提案する。
生物学的堅牢性の基礎
頑健性とは、生物系に内在する性質であり、多様な摂動に直面しても機能を維持することを可能にするものであり、これは他の場所でも広く検討されている13-16。生物システムは堅牢でありながら進化可能でなければならず、そのためには堅牢性、脆弱性、資源需要、性能の間のトレードオフが必要となる17,18。これは、そのようなシステムを構成するアーキテクチャやメカニズムの種類に制約を課している。最近の研究では、ロバスト性は4つの基本的なメカニズム13:システム制御、冗長性と多様性によるフェイルセーフ、モジュール性、および物理レベルの摂動がシステムの機能レベルの活動から分離されるデカップリングによって可能になることが明らかになっている。
システム制御は、システムの恒常性を維持するために、ネガティブフィードバック、ポジティブフィードバック、フィードフォワード規制、その他の規制ループを導入し、システムが2つの安定状態の間を移動することを可能にする双安定動作19,20と同様に、システムの恒常性を維持する。例えば、負のフィードバックループが薬剤が標的とする分子のレベルの変化を補償する場合、薬剤の効果は中和される。
フェイルセーフ機構は、その分子や経路の1つが無効になってもシステムが機能し続けることを可能にする。このことは、このような経路にある分子を標的とした薬剤の有効性が限られていることを意味している。
モジュラリティは、特定のモジュールに適用される摂動がシステム全体に広がるのをブロックする。これは、局所的な損傷がシステム全体の摂動を引き起こすのを防ぐのに有用であるが、薬物の効果を局所的にすることもできる。
デカップリングは、機能レベルを物理レベルから分離する。例えば、デジタルシステムでは、オンとオフのビットストリームである機能レベルが、電気回路の実際の電圧変動から隔離されている。したがって、機能層は、物理層のわずかな変化に対してロバストである。デカップリングの生物学的な例としては、HSP90などのヒートショックプロテイン(HSP)によるタンパク質フォールディングの補正が挙げられる(参考文献21)。
これらのメカニズムに加えて、多くの場合、代謝ネットワーク22,シグナル伝達ネットワーク23および免疫系24を含む様々な機能サブシステムのための分子間相互作用ネットワークで観察することができる’蝶ネクタイ’ネットワーク16として認識される特定のネットワークアーキテクチャがある。
ボウタイ・アーキテクチャは、様々なフィードバック制御ループを持つ多様で冗長な入力および出力サブネットワークによって接続されたネットワークの高度に保存された、しばしば堅牢なコア部分で構成されている(図1a)。このネットワーク・アーキテクチャは、入力モジュールと出力モジュールの経路の冗長性のために、様々な刺激や関与する分子の阻害に対するロバストで柔軟な応答を提供する。しかし、ネットワークアーキテクチャはまた、おそらく冗長性がないことによって、またはレギュラトリーフィードバックが欠落していることによって、そのような摂動に対してロバストになるように構築されていない場合、コアネットワークを構成する分子の摂動に応答して脆弱になることができる。例えば、Toll様受容体シグナリングカスケードに見られるボウタイネットワークのコアは、MYD88(骨髄分化一次応答遺伝子88)25との非冗長なコアを持っているため、脆弱である。
最適(または亜最適)に進化してきた(または設計されてきた)複雑系は、「ロバストでありながら脆い」という特徴を持っている17,18。
頑健でありながら脆弱であるという特徴は、ある摂動に対して頑健であることが、他の摂動に対して脆弱であることと必然的に関連しているシステム固有の性質であると主張されてきた15。さらに、進化したシステムは、ロバスト性、脆弱性、性能、資源要求の間のトレードオフによって制約を受けることがある13。進化した複雑なネットワークは、ノードの除去に応答してロバスト性を示す傾向があるが、ノードの持続的な誤動作には脆弱である。このようなネットワークの例としては、ルータなどのノードの一部が除去された場合(そのような障害はローカルユーザにのみ影響を与えるため)には堅牢であるが、スパムやウイルスの持続的な送信などのノードの誤動作に対しては脆弱であることが多い26。ネットワークのノードが望ましくない方法で機能し続けるこのタイプの故障は、故障したノードが削除される「フェイルオフ」故障とは対照的に、しばしば「フェイルオン」故障と呼ばれる。フェイルオン故障(ビザンチン故障としても知られている)は、通信ネットワークの主要な問題であり、複雑なネットワークシステム全般において重要な問題であると考えられている27。生物学的ネットワークは、システムにとって最も深刻な脅威は、突然変異や侵入したコンポーネントによる不要な相互作用、遺伝子の過剰発現や増幅、それらの制御不能な制御ループの過剰活性化であるという、似たような特徴を共有することが期待されている。
図1 堅牢性の基本的なメカニズム
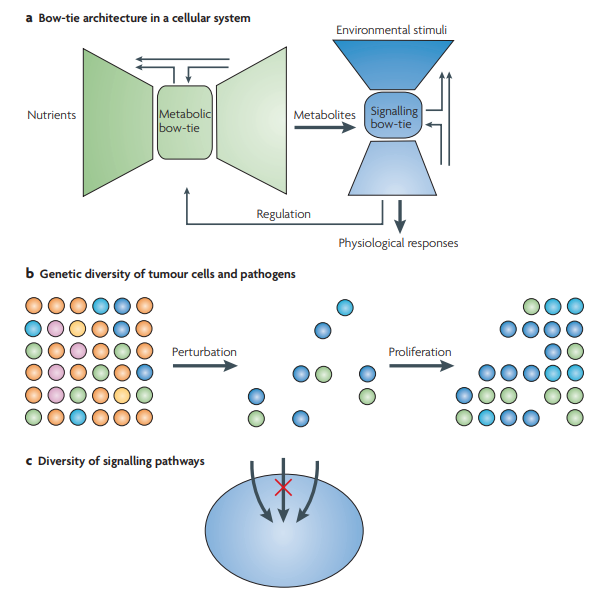
aネットワークの「蝶ネクタイ」構造は、代謝ネットワークとシグナル伝達ネットワークのために存在するかもしれない。同様の図は、CseteとDoyleによっても描かれている16。ボウタイネットワークは、多くの場合、ボウタイのコアに収束する多様で冗長な経路を持つ大規模な “ファンイン “翼と非対称構造を持っており、可能な応答の数が限られているとして、適度な多様性を持つ “ファンアウト “翼。代謝の蝶ネクタイとシグナリングの蝶ネクタイは、グローバルな細胞システムを形成するために連動している。治療的な摂動は、薬剤に反応する病原体や腫瘍細胞のサブセットを排除することができるかもしれない。しかし、薬剤に反応しない生存者も存在する。これらの薬剤耐性の生存者は増殖して、より耐性の高い病原体や腫瘍細胞のグループを形成する。多様性と冗長性は、多くの生物学的システムのロバスト性の主な源泉である。単一の経路の分子を標的とする抗がん剤の中には、その経路とクロストークする他の経路のために効果がないものもあり、腫瘍細胞の増殖を防ぐことができない。細胞ネットワークにおけるシグナル伝達経路の多様性は、抗がん剤の主要な障害の一つである。
頑健性と疾患
疾患は、正常な生理学的システムの頑健性が破壊され、頑健で進行性のある疾患状態が再び確立されることであると考えることができる。ロバスト性のトレードオフの観点から、疾患は以下のうちの1つ以上に分類される。宿主システムを様々な摂動から保護する堅牢性に破れがある単純な病気、治療的な介入を含む様々な摂動に直面して、堅牢性のメカニズムが病気の状態を誘発し、進行させるためにハイジャックされる寄生性の病気、そして、ある環境で堅牢性を提供するメカニズムが、システムが適応してきた条件とは明らかに異なる現在の環境下で好ましくない働きをする全身性の病気24,28-30である。
癌や感染症は、腫瘍細胞や病原体が宿主の頑健性メカニズムを乗っ取ることで宿主と寄生共生を形成するため、寄生性疾患と考えることができる。例えば、癌では、腫瘍は多剤耐性、微小環境のリモデリング、低酸素誘導性因子1(HIF1)のアップレギュレーション、腫瘍内の遺伝的不均一性などの様々なメカニズムを介して、様々な治療的介入に対する頑健性を確立している29,30。遺伝的多様性の向上による治療介入の反作用は一般的に観察され、薬剤は腫瘍細胞または病原体の一部の集団に対してのみ有効である。例えば、腫瘍細胞とHIVの両方が高いレベルの遺伝的多様性を持っていることが知られており、薬剤耐性病原体の変異体の出現と水平的遺伝子導入による薬剤耐性遺伝子の移入は、集団レベルで同様のメカニズムを提供している。これらのメカニズムを念頭に置いた創薬設計の戦略には、標的細胞の脆弱性のポイントを見つけ出し、標的細胞が悪用する可能性のあるロバスト性メカニズムを回避し、標的細胞を除去したり休眠状態を誘導したりすることを目的とした、特定の薬物介入に対する標的細胞のロバスト性を高める可能性を先取りすることが含まれる。
ボックス1 頑健性と薬剤耐性
しかしながら、アンフィレグリン69が過剰発現し、EGFRに特異的な変異(L858Rおよびエクソン19欠失)を有する進行NSCLC患者の特定のサブ集団に対してのみ臨床的有用性が示されている70,71。ゲフィチニブの副作用として間質性肺疾患の発生例が報告されており、ゲフィチニブはEGFRに選択的であると考えられているが、EGFR以外の下流シグナル伝達タンパク質やATP依存性キナーゼを阻害することもあり、毒性を引き起こす可能性がある72。ゲフィチニブ耐性腫瘍細胞を対象とした研究では、ゲフィチニブの抗増殖効果は、サイクリンD1を分解するグリコーゲン合成酵素キナーゼ3β(GSK3β)の活性化によるものであり、血小板由来成長因子受容体(PDGFR)シグナルの活性化は、マイトジェン活性化プロテインキナーゼ(MAPK)を活性化し、GSK3β活性を阻害することでゲフィチニブの効果を上書きすることが示されている73。さらに、ゲフィチニブ耐性腫瘍細胞は、EGFRのチロシンキナーゼドメインに特異的な変異があり、その変異は790位(T790M)でスレオニンをメチオニンに置換し、ゲフィチニブの結合部位へのアクセスを阻害する74。この症例は、ゲフィチニブの有効性を妨げるゲフィチニブの介入に対する腫瘍細胞の頑健性をもたらす、患者集団に既に蔓延している変異や経路の多様性を浮き彫りにしている。
ケーススタディ トラスツズマブ。トラスツズマブ(Herceptin; Genentech)は、ERBB2(HER2/neuとも呼ばれる)の細胞外ドメインに結合し、ERBB2シグナルをダウンレギュレートするヒト化モノクローナル抗体である75。この抗体の開発は、乳がん・卵巣がんの約 30%の症例で ERBB2 の発現と遺伝子増幅が高く、この遺伝子の過剰発現が予後不良と関連しているという事実に触発されたものである76。ERBB2過剰発現乳癌患者に対するトラスツズマブ単剤療法の有効性は報告されているが77,奏効率は35%程度と限られている78。さらに、インスリン様成長因子1受容体シグナル伝達の活性化79とホスファターゼおよびテンシンホモログの喪失80により、ERBファミリーのシグナルに関係なく腫瘍細胞の増殖が可能になることから、抵抗性が生じる可能性があると考えられている。これは、遺伝的多様性による特定の介入に対する腫瘍細胞の頑健性が、薬剤の有効性を損なう可能性があるもう一つの例である。
2型糖尿病や自己免疫疾患などの疾患は、全身制御の誤作動が疾患の症状を引き起こすため、全身疾患とみなすことができる。2型糖尿病の典型的な兆候は、インスリン抵抗性による血漿グルコース値の持続的な高さである。しかし、進化期の古代環境では、インスリン抵抗性は、(神経細胞や自然免疫関連細胞が依存する)血糖値を高く維持することで、病原性が高く敵対的な環境下での飢餓状態に近い食糧供給に対する堅牢性を提供するためのメカニズムだったのかもしれない。したがって、このシステムは、これらの歴史的な環境の脅威に対して堅牢性を提供するために進化的な時間スケール28で適応したかもしれないが、今では全く異なる生活様式の状況で望ましくないほど働いている。このタイプの疾患では、標的細胞を除去したり、休眠状態に誘導したりすることはできない。β細胞の機能障害のような問題があり、細胞型特異的な介入が必要であるが、そのような戦略は、全身レベルのネットワークの障害をそのままにしておくと、一時的な解決策を提供するだけになる傾向がある。ロバスト性のメカニズムは生物全体に分散しており、薬剤は全身的に病状を制御するように設計されなければならない。
頑健性と薬効
生物学的システムにおけるロバストネスの概念は、医薬品の有効性や副作用を解釈する上で貴重なものである。この概念は全身生理学レベルから細胞レベルまで有効であるが、スペースの都合上、本稿では細胞レベルにのみ焦点を当てることにする。薬物は、意図された介入に対する細胞システムの堅牢性のために効果がないことが多く、標的外の細胞の脆弱な点と相互作用して副作用を引き起こす可能性がある。これらの点を説明するために、いくつかのケースを以下に分析する。
単一の特定分子を標的とする薬剤は、標的分子が疾患症状の引き金となる細胞および病原体においてのみ観察され、疾患状態を維持する単一の原因因子である場合に最も効果的である。標的分子の阻害のみでは、他の細胞に害を与えることなく、症状を緩和することができるが、除去できない場合もある。したがって、標的分子は、疾患状態を維持するシステムの脆弱性のポイントとなる。抗感染症薬の中には、標的分子のほとんどが病原体にしか存在せず、宿主細胞には存在せず、標的分子を阻害することで病気の症状を大幅に軽減できるものがあるため、この種の薬剤の例として挙げられる。例えば、コレラ菌は多くの発展途上国で流行を引き起こす病原体である。コレラ菌は、Gタンパク質と相互作用する毒素を産生し、下痢を引き起こす。コレラ毒素は病原性島(PAI)にコードされており、水平方向の遺伝子導入によって獲得されると考えられている31。低分子阻害剤である4-N-(1,8-ナフタルイミド)-n-酪酸(virstatin)は、転写調節因子ToxT32を阻害することで、コレラ菌の病原性因子であるコレラ毒素と毒素制御ピルスの発現を抑制する。この薬剤が成功したのは、ToxTが病原体にしか存在せず、それが病原体の病原性因子を制御する単一の転写因子であるため、病原体系がToxTの阻害に対して頑健ではないことを暗示しているからである。もし、病原性因子が潜在的な薬剤の共通結合部位を持たない複数の転写因子によって制御されていれば、状況は違ったものになっていたかもしれない–転写因子の多様性によってフェイルセーフ機構に似たシステムである。しかし、薬剤耐性感染症では、薬剤耐性を獲得した細菌が1つ以上出現し、その後、薬剤耐性表現型に応答可能な遺伝子が水平移動する33。この現象は、遺伝子の多様性とPAIのモジュール構造に基づいた薬剤に対する細菌のロバスト性を表しており、遺伝子の水平移動を効率的に行うことができる。同時に、モジュール化された PAI 領域に依存する水平遺伝子導入を中断することで、薬剤耐性を緩和することも可能である。この例は、ロバスト性の概念が、薬剤に対する有効性や耐性の解釈にどのように役立つかを示している。
イマチニブ(Gleevec; Novartis)は、 疾患の原因となる遺伝子のタンパク質産物を標的とした薬剤の成功例と考えられている34。マウスを用いて、 慢性骨髄性白血病(CML)のほとんどの患者に見られる BCR-ABL 融合遺伝子を産生するクロモソーム 9 と 22 の長腕の間の転位という特徴的な遺伝的異常が、 疾患の原因として同定されている35-39。イマチニブは、 変異型 BCR-ABL キナーゼの特定のコンフォメーションに結合し、それを保持する。
ボックス2|脆弱性と薬の副作用
不活性状態での イマチニブが一部のCML患者に対して高い有効性を示しているのは、BCR-ABLの稀な発生率が、融合タンパク質が初期段階でCMLの単一原因であり、標的細胞にのみ存在することを示していることに起因していると考えられる。したがって、上述の抗感染症薬の例と同様に、イマチニブはCMLの脆弱性のポイントにぶつかる。しかし、イマチニブの有効性は、BCR-ABLの様々な変異の出現や、BCR-ABLの変異に依存しない薬剤耐性の出現によって損なわれる40。このことは、CML の病状が、腫瘍細胞の活性を維持する多様な変異と経路を通じて、薬剤に対する堅牢性を取り戻していることを示している。
これらの例から学ぶことができる教訓は、薬剤は脆弱性のポイントに到達した場合には有効であるが、多様性によって病原体や腫瘍細胞の介入に対する頑健性が現れた場合には有効性が低下する可能性があるということである(図1b,c)。生物学的システムが、外部および内部の幅広い摂動に対して頑健である複雑なシステムを形成するように進化してきたことは、それらが治療薬の介入に対しても頑健であり得ることを示唆している。そのようなケースの例をBOX 1で分析している。
薬物の副作用は、薬物が患者のシステムの脆弱性のポイントに到達したときに最も深刻になることがある(BOX 2)。明らかな副作用は薬剤開発の初期段階で特定して対処することができるが、副作用が特定の遺伝子多型やライフスタイルを持つ特定の集団でのみ発現し、患者がそのような介入を受けやすい状態になっている場合には困難が生じる。したがって、望ましくない効果をよりよく防ぐために、広範なデータを収集することが重要である。これには、潜在的な意図しない薬物標的の機能的役割を同定するための異なるヒト組織内の多数の細胞のサンプリング、および稀な亜集団における脆弱性の可能性のあるポイントを同定するための珍しい遺伝子型のスクリーニングが必要である。
多成分治療
多成分治療の各化合物は、異なる分子を同時に標的とし、相互作用することで細胞の状態を変化させることができる。これは、このような変化ができない場合や、個々の薬剤を使用しても効果が低い場合に有用である7。多成分治療はますます注目を集めており、サルメテロール/フルチカゾン(アドベア、グラクソ・スミスクライン)41,ニコチン酸/ロバスタチン(アドビコール、コス・ファーマシューティカルズ)42,43,AZT-3TC(コンビビル、グラクソ・スミスクライン)44など、いくつかの成功例が報告されている。また、アトルバスタチンとフェノフィブラートの組み合わせによるコレステロール値低下効果も報告されており6,組み合わせたハイスループットスクリーニング戦略が提案され、創薬パイプラインの段階で実施されている45。さらに、薬剤を作用させた細胞と作用させていない細胞の間の遺伝子転写物、タンパク質、代謝物の違いを捉えるシステム応答プロファイルの応用も提案されている6。
成功する多成分治療の組み合わせ効果を支える正確なメカニズムはまだ解明されていないが、3つの説明が提示されている(例はBOX3で強調されている)。
- 第一に、各成分の効果が経路の特定の部分で収束することで、より付加的な効果を引き起こす可能性がある。
- 第二に、標的とする経路の異なる成分が、ある薬剤の阻害効果を補う場合、薬剤の組み合わせの投与は、この中和効果を克服し、それによって、多様性を介してフェイルセーフ機構によって引き起こされる堅牢性を効果的に排除することができる。
- 第三に、各成分が異なる分子または特定の変異部位を標的とすることで、結果として非交差耐性が得られることが考えられ、BOX3に記載されているHIVに対するAZT-3TC併用療法で強調されている。
生物学的ネットワークに対する複数の弱い摂動の影響に関する最近の研究は、多成分医薬品の効果についての理論的な説明を提供してくれるかもしれない46,47。
適切に設計された多成分治療薬は、ロバスト性をコントロールして臨床効果を得るための第一歩であり、広く有用である。しかし、薬剤の組み合わせの選択性は、非標的細胞に対する標的細胞の相対的な応答に依存する。これは、癌化学療法において特に問題となる。標的とする分子が標的細胞ではなく、標的外の細胞で一意に発現していない限り、このようなアプローチでは十分なレベルの選択性が得られない可能性がある。多成分抗がん剤の創薬に合成致死性を利用することで選択性が向上する可能性があるが8,実用的なターゲットが見つかるかどうかはまだ示されていない。
多成分治療アプローチを極端に拡張したものとして、1つまたは2つの「主要な」遺伝子またはタンパク質だけを標的とするのではなく、広範囲の分子を標的とする大量の成分を使用することがある。伝統的な中国医学では、広範な因子を対象とした小規模な介入を重視している48,49が、伝統的な中国医学ではほとんどの成分は未確認である。興味深いのは、米国国立がん研究所が12,000種の植物から採取した根や果実の35,000サンプルをスクリーニングしたところ、3種類の新薬が見つかったということである48。伝統的な漢方薬は、複雑なネットワークシステムを体系的に制御するために多数のコンポーネントを使用する創薬戦略を作成するためのインスピレーションとなり得る。このような治療法は、ほとんどのターゲットが統計的分布のロングテールにあるため、「ロングテール」治療薬と考えることができる。この文脈でのロングテール分布は、スケールフリーである必要はなく、正確な力法則に従う必要もない。代謝ネットワーク50 に見られるように、分子間相互作用ネットワークのスケールリッチ性に関する最近の発見は、ロングテール分布の異なる部分にある分子の摂動がシステムに質的に異なる影響を与えうることを暗示しているかもしれない。
ロングテール分布の実用的な意味合いもある。例えば、がんのサブタイプ分類では、正確な予測には少数の主要遺伝子に注目するよりも、多数の遺伝子の発現プロファイルを考慮する必要があることが示されている51し、マイクロアレイデータを用いた理論的研究では、がん分類の精度を向上させるためには、上位の発現レベルよりも中間の発現レベルの遺伝子の発現の方が重要であると結論づけられている52。このように、複雑な分子ネットワークの系統的な制御が、ロングテール成分の摂動を用いて可能かどうかを調べることは、非常に思索的ではあるが、興味深いことかもしれない。
ボックス3|多成分治療
細胞ダイナミクスの多段階ターゲティング
制御リングのロバスト性に対するより洗練されたアプローチは、多段階治療である。一般的な概念は、標的細胞の動的状態を治療目的のために望ましいシステム状態に選択的に摂動できるように、特定の用量および時間間隔で投与される一連の薬剤を使用することである。このためには、細胞の動的状態のより高度な理解とそれを制御する方法が必要である。
効果的な多剤併用療法は、1つまたは複数の先制的介入と標的介入から構成され得る。
先制的介入は、細胞周期や制御フィードバックループなどの細胞状態の制御に関与する分子を標的とし、標的介入が最も効果的な特定の状態に細胞を誘導したり、標的介入を無効にする代償メカニズムを無効にしたりすることができるようにする。
標的介入は最終的に、腫瘍細胞のためのアポトーシスおよび休眠、および他の疾患のための様々な機能的治療のような細胞状態の所望の変化を誘導する。標的介入は、しばしば、介入の効果を相殺する代償的ロバスト性メカニズムを誘発することができ、そのような効果は、容易に先取りすることができるが、一度誘発されると容易に対抗することができないので、介入のタイミングは極めて重要である。
先制的な介入によって、最初に標的介入に対してロバスト性を提供するメカニズムを無効化することによって、標的介入に対する細胞のロバスト性が著しく低下し、それによって成功の可能性が高まる。このような場合には、投与する薬剤の正しい順序と個々の投与量、および各薬剤の投与間隔を検討することが重要である。多段階薬剤の一般的な考え方については、S1(図)に記載している。
多剤併用療法における薬剤の投与順序の重要性は、近年、特に腫瘍細胞の細胞周期との関連で報告されている53。例えば、大腸直腸癌細胞株(DLD1とSW480)を用いた研究では、パクリタキセル(Taxol、Bristol-Myers Squibb)とオキサリプラチン(Eloxatin、Sanofi-Aventis)の投与順序に及ぼす影響が調査されている;Taxol-オキサリプラチンの投与順序は、オキサリプラチン-Taxolの投与順序よりも成長抑制効果が高く、単剤治療よりも優れていた54。ヒト結腸癌細胞株HCT-116を用いた実験では、SN-38(イリノテカンの活性代謝物)にフラボピリドールを加えた配列では高い割合でアポトーシスが誘導されたが(約44%)逆の配列ではアポトーシスは中程度(約15%)にとどまり、SN-38を単剤で使用した場合はアポトーシスの1%しか誘導されなかった55,56。SN-38の使用はp21の発現とそれに伴うG2停止を誘導し、SN-38はトポイソメラーゼI阻害剤としての作用機序によりS期に最も効果的であるため、SN-38(したがってイリノテカン)に対して腫瘍細胞が抵抗性を持つようになる。フラボピリドールはG1とG2の停止を誘導し、CDK1,CDK2,CDK4,CDK6,およびBCL2,p21,phospho-survivinなどの一連の抗アポトーシス分子を阻害する56。したがって、SN-38とフラボピリドールの併用は相乗効果があり、SN-38によってG2で停止した細胞は、抗アポトーシス分子に対するフラボピリドールの阻害効果によってアポトーシスを受けるように誘導されたり、フラボピリドールによるp21の阻害によって停止状態から解放され、SN-38が最も効果的なG1-S期に進行したりする可能性がある。しかし、フラボピリドールに続いてSN-38を使用することで、フラボピリドールのp21阻害などの効果の一部がSN-38のアンタゴニスティック効果によって相殺され、p21をアップレギュレートさせる。
また、フラボピリドールの作用により細胞周期はG1,G2で停止し、SN-38が最も効果を発揮する時期にはS期に入る細胞数が少なくなる。現在、イリノテカンとフラボピリドールの併用療法が臨床試験中である57。
抗がん剤の逐次使用は、細胞周期や代謝に影響を及ぼす可能性があるため、概日リズムを反映したスケジューリングに拡張することも可能である58,59(がんクロノセラピー)(BOX 4)。がんクロノセラピーは、腫瘍細胞と正常細胞には異なる概日リズムがあり、それが薬剤の反応や副作用に影響を与えるという考えに基づいている。例えば、タキソール-オキサリプラチンのシーケンスが有効であり、ある時間帯にオキサリプラチンを使用することが最も効果的であり、副作用を最小限に抑えることができる場合、この時間帯は、腫瘍細胞と正常細胞の間の薬物反応の差を最大化する、複数の薬物を連続的に使用するための全体的な最適なスケジュールを決定するものとする。腫瘍細胞では概日リズムが調節されているが、正常細胞では調節されていない可能性があるという観察は、治療効果の選択性を高める可能性がある一つの手がかりとなる60 。この種の治療戦略の次の重要なステップは、疾患状態と正常状態における細胞の時間的ダイナミクス、および様々な薬剤とその組み合わせに対する細胞の差異的な時間的応答の科学的基盤をしっかりと確立することである。
ボックス4|がんクロノセラピー
システム指向の薬物設計
今、問題となっているのは、上述したシステムロバスト性の側面を考慮したシステム指向の薬剤をどのように設計するかということである。望ましい効果を得るためには、どのようにしてターゲット、タイミング、投与量を最適化すればよいのであろうか?そのためには、細胞レベルおよび組織レベルのダイナミクスを深く理解し、高度なハイスループットスクリーニングと計算解析ツールを組み合わせることが必要である。ここで説明するアプローチでは、複数の薬剤を高度な組み合わせで使用する必要がある。これは、複数の成分(多くの場合、大量に)を特定して検証し、適切な組み合わせ、投与量、使用時期を特定しなければならないため、創薬や治療法の設計プロセスにかなりのレベルの組み合わせの複雑さを加えることになる。しかし、それにもかかわらず、現在の食道内疾患を治療するための潜在的な戦略が増加していることは、絶好の機会であると言える。そのため、適切な戦略を体系的に同定するための効果的かつ効率的な方法を確立することが鍵となる。ここで議論されている複雑さの程度やダイナミクスの利用方法の違いに応じて、この課題に取り組むための様々な可能性のある選択肢を図2にまとめた。
理論的には、生物学的にも数学的にも、複雑なネットワークシステムを制御する方法を見つけることが主な課題である。単純なフィードバックシステムのダイナミクスは古典的・現代的な制御理論から十分に理解されているが、高度に分散した非線形ネットワークシステムの制御はまだ確立されていない。
また、生物系を記述する数学、特に制御の観点からの数学もまだ発展していない。ロングテール分布上の構成要素を用いて複雑なネットワークを制御するにはどうすればよいのか、といった疑問にもまだ答えが出ていない。先進的な通信理論は、インスピレーションの源となり得ます。例えば、携帯電話ではスペクトラム拡散通信62 が使用されており、ユーザ間で高度に選択的でノイズのない通信を実現している。干渉のないピアツーピア通信を実現するために用いられている戦略は、複雑な薬物システムの極限に位置するスペクトラム拡散型薬剤のように、特定のケースに対応した高度に洗練された薬物設計に応用できるかもしれない(補足情報S2(箱))。多くの興味をそそる理論や方法が存在するが、その多くは工学や物理学のためのものであり、単純に生物学の領域に翻訳することはできない。新しい理論の再構築や発明は、数学と生物学の両方の研究者にとって実りある挑戦となり得る。これらの研究は、伝統的な漢方医学の背後にある科学にも光を当てる可能性があり、このような一連の理論は、科学的根拠に基づいた西洋医学と東洋医学の統合につながる可能性がある。
技術的・実験的な観点からは、効果的なスクリーニング方法や解析ソフトの開発、細胞システムの理解を深めることが必要である。前述したように、多成分医薬品のシステム的スクリーニング研究が報告されており45,すでに多くの成功した配合剤が市場に出回っている。これらの開発は、ターゲット細胞とオフターゲット細胞の間で行われている65。今日の計算シミュレーションの精度は、定量的なデータ取得やモデリング技術の問題により、満足できるレベルではないが、状況は急速に改善されていくであろう。最も成功した計算アプローチの一つである計算流体力学が実用化されるまでには数十年の努力が必要であったことを忘れてはならない。さらに、分子間相互作用の高精度の包括的なマッピングを作成し、適切に維持する必要がある。
さらに、標的細胞に特有の特徴的な動態を最もよく特定し、副作用を回避するためには、異なる遺伝的背景を持つ異なる細胞タイプの相互作用や動態の違いを効率的に比較できるような差分システムバイオロジーを開発する必要がある。
図2
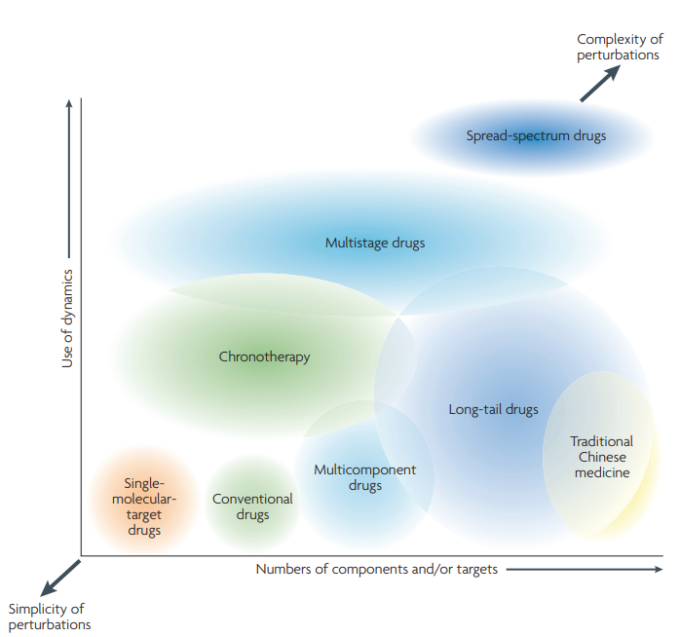
薬物設計のための選択肢の幅。さまざまなタイプの治療戦略は、構成薬剤の数、標的の数、ダイナミクスの利用によって分類することができる。現在の従来型の薬剤は少数の分子を標的とすることが多いのに対し、「ロングテール」の薬剤や漢方薬は多数の成分を用いる。単一分子を標的とする薬剤と、選択性を得るために広範囲にダイナミクスを利用するスプレッドスペクトラム薬剤(現時点ではまだ思索的な概念である)は、図の両極端のものであり、どちらの戦略も特殊な疾患に高い効果を発揮する可能性がある。どちらの戦略も特殊なケースでは高い効果を発揮する可能性があるが、広く適用できるほど汎用的ではないかもしれない。多段階治療薬、ロングテール治療薬、多成分治療薬(おそらく慢性治療との併用)は、幅広い応用が可能であり、将来的には主流の治療戦略になると予想される。
おわりに
この論文では、薬物や治療法のデザインは、細胞レベルから全身レベルまでの臓器レベルでの頑健性とそのトレードオフを深く理解した上で行われるべきであるという提案をしている。ゲノミクス、プロテオミクス、システム生物学の知識が爆発的に増えている今、当面の関心事は、細胞レベルでの薬剤介入に対するロバスト性と脆弱性の理解を得ることである。これは最終的には、システムレベルでのロバスト性分析につながる。ロバスト性の問題を明示的に考慮に入れていないことは明らかであるが、薬剤介入に対する細胞システムのロバスト性を打ち消す要因のセットを探っている。次のステップの課題は、単なる組み合わせ効果ではなく、ロバスト性と脆弱性の文脈でターゲットを体系的に特定することである。最近、私のグループは、遺伝子の投与量の定量的な摂動に対する細胞機能のロバスト性を包括的かつ定量的に測定するために、遺伝子綱引き(gTOW)と呼ばれる新しい実験手法を開発した63。このようなアプローチは、ゲノム全体のロバスト性に基づいたスクリーニングのためにスケールアップして改良することができ、薬物スクリーニングや標的同定のための新しいアプローチを提供することができる。
新薬とその標的を効率的に同定できる技術は、多成分治療、多段階治療、そして最も注目すべきはロングテール治療の選択肢を提供するために不可欠である。天然化合物と化学ゲノミクスの両方の細胞ベースのスクリーニングは、有効な薬剤3,4の広いベースを私たちに提供する可能性があり、マイクロ流体技術は、ハイスループットの細胞ベースのスクリーニング64のための機会を私たちに提供する可能性がある。
計算および数学的ツールのセットはまた、ロバストネスベースのアプローチをサポートするために開発する必要がある。ロバストネスに基づくアプローチは、特定の目標を持っている:コンビナトリアル摂動が有効性と選択性の両方を生成する特定のロバストネス特性を持つターゲットのセットを見つけることである。したがって、将来的には、この特定の目標に向けた様々な数学的・実験的ツールを適用することで、このプロセスをより洗練させていくことができる。そのためには、大規模モデルの高次元比較解析が可能な高度な分岐解析などのシステムダイナミクス解析パッケージが不可欠である。このようなソフトウェアは、過去に成功した多くの薬剤が、特定の分子や生物学的プロセスを調節する単一の介入が劇的な効果を引き起こすことができるように、ターゲットシステムの脆弱性のポイントに影響を与えてきた動的挙動の違いを識別するために、計算モデルを適用することを可能にする。しかし、がん、糖尿病、自己免疫疾患など、この単純な戦略では治療が困難であることが証明されている疾患は、細胞レベルから全身レベルまで、人体の頑健性に由来している。ロバスト性は生物論理システムの基本的な特性であることを考えると、将来のドラッグデザインのためのシステムベースのアプローチは、ロバスト性を中心的なフレームワークとして考慮する必要がある。複雑さは複雑さによって制御されなければならないため、より複雑で頑健な生体システムをより複雑な薬剤によって制御する新たな方法を確立する必要があるが、これらの課題に取り組み、ロバスト性に基づいたアプローチによる創薬設計を現実のものとすることは、医薬品業界と医療現場に根本的な変革をもたらす可能性がある。
