A Birds-Eye (Re)View of Acid-Suppression Drugs, COVID-19, and the Highly Variable Literature
www.ncbi.nlm.nih.gov/pmc/articles/PMC8385362/
オンラインで2021年8月11日公開
Cameron Mura, 1 Saskia Preissner, 2 Robert Preissner, 3 ,* and Philip E. Bourne 1 ,*.
概要
本稿では、COVID-19に関連して、酸抑制剤の潜在的な有用性に関する最近の急増した情報を検証し、特に、少なくとも人気のある制酸剤ファモチジンに関して、報告された知見に大きなばらつき(したがって、混乱)が生じていることに注目した。矛盾と不一致の度合いは、実験デザイン(レトロスペクティブ、オブザーバー、コホートベースなど)と統計解析ワークフロー(傾向スコアマッチング、サブコホートへの層別化など)の両方の観点から、ほぼ同様のアプローチをとった独立した臨床ベースの研究からの矛盾した結論を反映している。このような矛盾や潜在的な混乱は、治療的に最適な介入方法を選択しなければならない臨床医にも影響を与える。例えば、ファモチジンの潜在的な有益性は、特定のCOVID-19症例に使用することを示唆しているのであろうか?(例えば、ファモチジンの潜在的な利点は、特定のCOVID-19の症例に使用することを示唆するか?) Freedberg et al 2021)が今年の3月に端的に述べているように、「…いくつかのレトロスペクティブ・スタディでは、COVID-19におけるファモチジンと転帰との関係が示されており、いくつかの研究では示されていない」。ファモチジンに関する矛盾したデータと結論は、治療適応の可能性という差し迫った問題を超えて、創薬や再利用に役立つオントロジーやナレッジグラフ(KG)ベースのフレームワークに組み込む/統合する前に解決しなければならない。方法論的な問題としては、矛盾を解決することで、関連するデータソースを用いたメタアナリシスの有効性を高めることができる。また、おそらく最も広い意味で、矛盾を処理するシステムを開発することは、1)リアルワールドのエビデンスに基づく研究(レトロスペクティブ)2)プラセボ対照無作為化多施設臨床試験(プロスペクティブ)の両方の質を向上させることになる。言い換えれば、2つのタイプの研究を調和させるための体系的なアプローチは、それぞれのタイプの研究の質と有用性を本質的に向上させるものである。
キーワード
COVID-19,ヒスタミン(H2)受容体、ファモチジン、ナレッジグラフ、疾患オントロジー、アンタゴニスト作用
はじめに 体系的なアプローチの可能性?
COVID-19(Triggle et al 2021)に関する急速に蓄積された情報を体系的に構造化することを始めるために、矛盾を明確にして調整し、最終的には臨床的に行動可能な知識と理解へと情報を成熟させることを期待して、冒頭の文章が意味する3つの「軸」に沿ってこのトピックを見てみよう。すなわち、
- 1)疾病の背景(COD)軸、
- 2)(治療)効果の程度(DOB)軸、
- 3)作用機序(MOA)軸
を考える。これらの「軸」は、分類レベルや類型の観点から、名目上のものであることに注意してほしい(Stevens, 1946)。
MOA軸は、概念的に最もわかりやすいかもしれない。つまり、その化合物の最も重要な薬理学的経路における機構的、分子レベルの病因論的基盤(既知の範囲で)を単純に記述しているからである。具体的な例として、既知の胃酸分泌抑制剤は、以下のいずれかの作用を示す可能性がある。1)プロトンポンプ阻害剤(PPI)として、胃粘膜における酸分泌の最終段階を担うH+/K+-ATPaseポンプを介したプロトン排出を立体的に阻害する場合、または2)ヒスタミン2型受容体拮抗剤(H2RA)として、このサブタイプのGタンパク質共役型受容体に特異的に結合することで、同種のリガンド、すなわちヒスタミンによって引き起こされるはずだった下流のシグナル伝達およびエフェクターカスケードを遮断する場合(Eldanasory et al, ヒスタミンの場合は、下流のシグナル伝達やエフェクターのカスケードを遮断する(Eldanasory et al 2020,Ennis and Tiligada 2021)。広く使用されているPPIの例はオメプラゾール(例:プリロセック®)であり、人気のある市販のH2RAの例はファモチジン(例:ペプシド®)とラニチジン(例:ザンタック®)である。現在の例では、これらの2つの特定のクラスのGI薬のMOAは、相互に排他的である。すなわち、薬物は、1つの経路1(PPI-ブロッカー)または別の経路2(H2RA)で作用するが、両方ではない。このような基本的な分子レベルでの選択性は必ずしもそうではない。実際、ポリファーマコロジー(Xie er al)。 「オフターゲット」効果(有益または有害)についてのさらなる検討は、今回の説明の範囲を超えている。ここでは、最近の研究(Malone et al 2021)が、ファモチジンのオン/オフターゲット特性の可能性について、特に、1)MOAの仮説検証、2)投与量、単剤/多剤治療レジーム、薬物動態関連特性(例:ADME)などの違いにより、異なる研究間で生じうる矛盾、などについて、詳細かつ洞察的な分析を行っていることに言及するのみである。特に、この研究では、COVID-19治療薬としてのファモチジンの場合、オフターゲット(すなわち、非H2R)経路は主要な役割を果たしていない可能性が高いと結論づけている。
コロナウイルス感染症オントロジー(Liu et al 2021)のようなアプローチを採用して、1,2などの経路におけるの標的、考えられる副作用などを表現することで、MOA軸を構成する実体とその相互関係について、より定量的な記述を開発することができる。[CIDOはBioPortalに集められた多くの生物医学オントロジーの1つであることに注意してほしい(Whetzel er al 2011)]。最近のファモチジンの文献を総合すると、混乱の原因となる可能性があるのは、レトロスペクティブで観察的なコホートベースの研究の最近のメタアナリシス(Sethia et al 2020b;Kamal et al 2021;Sun et al 2021)が、少なくとも結論を出す際に、上記の2つのMOA(すなわち、PPI、H2RA)の間の明確な区分けを必ずしも強制していないことである。例えば、ある一次研究では、ファモチジンが有益であるのに対し、PPIは「保護効果がない」としている(Freedberg et al, 2021)ファモチジンもPPIも、追加のリスクや利益を示す証拠がないとした2つの研究(Cheung et al 2020,Shoaibi et al 2021)最後に、最近の別の研究(Zhou et al 2020)では、ファモチジンとPPIでは、罹患率や重症度との関連性のリスクが高いとしている(それぞれ個別に)。このような不整合は、すべての研究を総合的に見たときに、メタアナリシスがそのような研究の集合を利用するときに、内部矛盾をもたらす。つまり、矛盾したデータソースやデータ値を調和させるための明確な「結合」ルールがないのである。また、ある意味では、単一のグローバルな分析(メタアナリシスであれ、手動/人間の専門家による分析であれ)の傘の下で、異なるMOAを持つ薬剤を比較することは、リンゴとオレンジを比較することに似ている。これらは基本的に異なるタイプのものであり、それらを比較しようとする試みは、セマンティックネットワーク、構造化された推論、KGなどのオントロジー的な意味では不適切である[Kanza and Frey (2019)でレビュー]。ファーマコゲノミクスと創薬の観点からは、ファモチジンが薬理学的に介入する可能性のある細胞経路のオントロジーベースの知識表現グラフ(またはセマンティックモデル)を開発することが重要な目標となるだろう(図1)。このようなアプローチは、既存のソフトウェアシステムやツールキットを用いて、新たな標的候補、新薬のリード、新薬と標的の組み合わせの予測を、グラフ上の推論によって系統的かつ自動的に発見することを可能にするが、このようなフレームワークを構築するには、セマンティックネットワークの関係性を構築するために使用される主要データ間の不整合を解消する必要がある(図1A)。
図1 ファモチジンとCOVID-19に関するオントロジー的視点
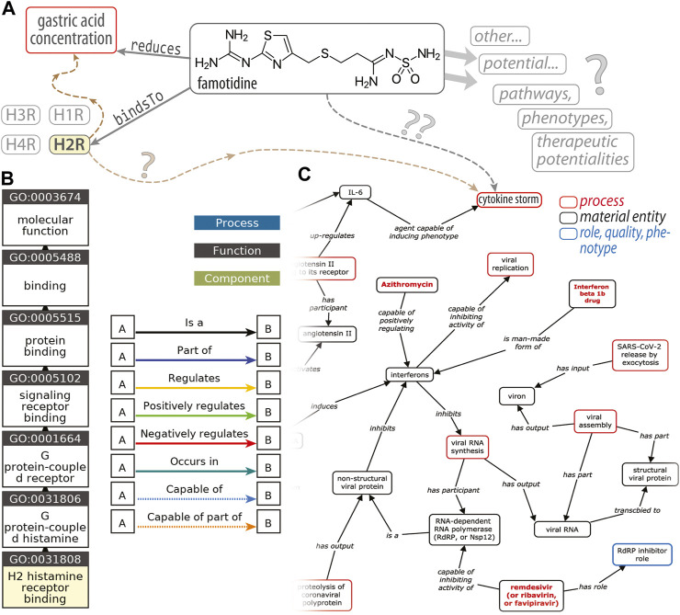
この図(A)は、オントロジーを支えるエンティティ間の関係を表現する、(主語、述語、目的語)トリプレットからなるRDFトリプル・アソシエーションの種類を示している。この例では,(famotidine, bindsTo, H2R)(ヒスタミン2型受容体)と(famotidine, reduces, gastric acid concentration)のトリプルがあり,H1R,H3R,H4Rはヒスタミン受容体の他のサブタイプを示す。茶色の破線の矢印(左)は、最終的に胃酸濃度を調整するH2Rをトリガーとするシグナル伝達カスケードを示すプレースホルダーである。疑問符(”?”)は、我々の知識が非常に弱いか曖昧な関連性を示している。B)のGOの「祖先チャート」は、「H2ヒスタミン受容体結合」という特定の分子機能に対応するGO:0031808という用語の概念階層を示している。この概念/クラス階層を、葉(下)から根(上;「分子機能」)に向かって横断することは、より広いカテゴリーの概念/クラスを順次横断することに相当する(例えば、H2RはGPCRの一種(すなわち、GPCRのサブセット)です)。パネル(C)は、Liu et al 2021)からの引用で、宿主-コロナウイルス間の薬物/相互作用のKGの抜粋で、右上にはファモチジンとサイトカインストームの間の推定される関連性が含まれている。
いくつかの研究では、ファモチジン/COVID-19に関する文献の不一致の少なくとも一部は、不一致や不均一性の原因となりうることを検討し始めている。例えば、Freedberg et al 2020b)は、症例をマッチさせたコホートのベースライン特性における残余交絡因子によるバイアスの可能性について述べているが、そのような原因の中には、研究デザインの違いに関連するものや、その他の方法論的なものもある。また、生理学的要因による偽の関連性(逆に言えば、隠された関連性)の可能性もある(例:Sethia et al, Sethia er al)。 Sethia et al 2020a)は、
- 1)病気の重症度の潜在的な大きな違いが治療成績に与える影響(サブコホートを得るための症例マッチングや層別化の方法でそのような違いを十分に考慮しない場合)
- 2)病気の重症度の分類における不均一性、
- 3)これらの違いが症例マッチングや層別化の段階で考慮されているかどうか。
- 4)ファモチジンの投与経路(経口、静脈内)投与量、症状発現のタイミング、治療期間など、ファモチジン治療のレジメンのばらつき(Malone (2021)も参照)
- 5)ファモチジンの効果が高い患者と低い患者の併用薬や併存疾患による交絡因子。集団全体のスケールでは、国の社会・医療制度の違い、民族の分布などに関連する潜在的な交絡因子によっても不一致が生じる可能性がある。
例えば、1)Singh et al 2020)は、様々なファモチジン製剤に含まれるカルシウムのレベルなどの細かい点が「疾患の転帰にメカニズム的に関連している」可能性があると指摘しており、2)一般的には、ファーマコゲノミック因子(Roden et al, 2019)は、治療薬としてのファモチジンの潜在的な有効性を支配し、これらは個々のケースバイケースで異なるだろう。
DOB(degree-of-benefit)軸は、比較的容易に概念化できる。ファモチジン(または、一般的な医薬品)の場合、この分類的記述は基本的に3つに分けられると考えることができる。”中立/無関連”、”pro-famotidine”、”anti-famotidine”。ある薬物化合物に対する記述子の有用性は、疾患の文脈に特有のものであり、すなわち、すべての疾患に普遍的に通用するものではないだろう。ある薬剤は、特定の病気や疾患ℐ1(例:AIDS)には否定的に示されるかもしれないが、同じ薬剤は別の疾患ℐ2(例:COVID-19)には示されるだろう。つまり、象徴的に言えば、2つの異なる疾患のコンテクストにおける所定の薬剤のDOBは、DAIDSDOB≠DCOVIDDOBというように、似て非なるものになる可能性があるということである。例えば、PPIの中には、酸の抑制(胃食道逆流症、潰瘍など)に有効であるという確立された記録があり、一見関係のない文脈(例えば、ライノウイルス感染の阻害剤としてのランソプラゾール(Sasaki er al 2005))でも価値があるかもしれないが、COVID-19の治療には必ずしも有益ではないかもしれない。このような特異的なパターンは、薬剤特異的、経路依存的、疾患関連的であり、薬剤の再利用の取り組みにおいて特に顕著である[この取り組みは、COVID-19についてはTarighi et al 2021)で、GI薬剤の特殊なケースについてはAguilaとCua(2020)で最近レビューされており、このような再利用の取り組みは、promiscuous(Gallo et al 2021)などの最新のウェブベースのリソースによって促進される]。
疾病のコンテキスト(COD)軸は、主観的であることに加えて、「有益」という用語が曖昧であるという事実を考慮している。つまり、単一の疾病または特定の適応症のセットであっても、様々なタイプの結果/基準によって評価することができる。COVID-19やその他の感染症の文脈では、候補となっている薬剤は、1) 伝達性、例えばFan et al 2021)は、H2RAであるラニチジンの使用がSARS-CoV-2感染に対する感受性を修飾するかどうかを検討している;2) 疾患の重症度指標、例えば 2)疾患の重症度の指標、例えば、機械的人工呼吸に到達する症例の可能性、WHO重症度指数[Yeramaneni et al 2021)はCOVID-19研究でこの順序尺度を使用した]など;および3)死亡率、頻度、または関連する指標。MOA軸とは異なり、COD軸に沿ったエンティティは、少なくとも現在のCOVID-19と酸抑制剤の例では、重複する可能性がある。例えば、ある薬剤が、SARS-CoV-2の感染性を減少させることと、感染した後の疾患の重症度を減少させることなど、2つの意味で有益であることができない先験的な理由はない(ただし、一般的に、異なる細胞/分子スケールの経路(MOA)が、生物体レベルの同様の結果を引き起こす可能性があることに注意してほしい)。
我々は、様々な独立した研究において、これらのMOA、CODおよびDOBの軸が(暗黙のうちに)取り扱われてきたことにいくつかの不調和があり、それがファモチジンとCOVID-19に関する矛盾した表示(反ファモチジン、中立、親ファモチジン)を出版物にもたらしているのではないかと考えている。文献間の知見を調和させることは、バイオインフォマティクスの観点からも、ある疾患に対する臨床的な標準治療/ベストプラクティスの観点からも、重要な目標である。
理解は進んだか?
最後に、H2RA、PPIなど(異なるMOA)の伝達における潜在的な利益(DOB)について、我々が知っていることの変遷をたどってみよう。(最後に、COVID-19の感染、重症度、死亡率(各種COD)に対するH2RA、PPIなど(異なるMOA)の潜在的な効果(DOB)について、過去1年間に蓄積された多くの文献報告を検討してみよう。これらの研究を概念的・テーマ的にグループ化することで、ファモチジンとCOVID-19に関する文献の進行(および我々の理解)において、以下の3つの「時代」を特定することができる。
– 時代1
独立したグループによる一次研究。時代1:独立したグループによる一次研究:これらの約10件の分析は、一般的にレトロスペクティブで、観察的(いくつかのコホートベース、いくつかのケースシリーズ)で、単一施設/センターであった。ほとんどの研究では、交絡因子を統計的に調整しようと試みているが(例:傾向スコアマッチング)その厳密さや慎重さにはばらつきがある(下記の時代3で引用されている研究を参照)。デザインには多くの共通点があるにもかかわらず、2つの矛盾した研究が出てきた。1)COVID-19でファモチジンを使用することを支持する結論を出した研究がいくつかある。すなわち、(Freedberg et al 2020a)Janowitz et al 2020)Mather et al 2020)Hogan et al 2020)である。一方、2)ほぼ同数の研究が支持しない結論を出した。すなわち、(Cheung et al 2020)Elmunzer et al 2020)Zhou et al 2020)Fan et al 2021)Yeramaneni et al 2021)である。ファモチジンについてあまり熱心ではない2つ目のカテゴリーの報告では、ファモチジンの使用を示唆するものもあれば(Cheung et al 2020,Yeramaneni et al 2021,Zhou et al 2020)ファモチジンやPPIとCOVID-19の治療値に関連性がないとするものもあった(Elmunzer et al 2020)Fan et al 2021))。
– 時代2
一次文献報告のメタアナリシス。これまでに3つのそのような分析が登場しているが、結果はまたもや様々である。Sethia et al 2020b)は慎重にファモチジンを支持しているが、Sun et al 2021)とKamal et al 2021)はより中立・否定的で、ほとんどの場合、統計的に正当化できるような関連性(正または負)はないと判断している。COVID-19にファモチジンが適応されるか否かについて、メタ分析のレベルでも一貫性がないのはなぜであろうか。その一因として、これらの異なるメタアナリシスでは、異なるデータベースの組み入れ基準が用いられていることが考えられる(これら3つの研究のそれぞれの「方法」の項を参照)。例えば、Sun et al 2021)はいくつかの中国のデータベースを利用し、medRxivやSSRNのプレプリントコレクションをサンプリングしていないのに対し、Sethia et al 2020b)はmedRixとSSRNを含み、いくつかの中国のデータベースを含まない。これがメタアナリシス間の不一致の原因となっている可能性がある。さらに、ファモチジンを示すことに関してより好ましい結論に達したメタアナリシス(すなわち、Sethiaら)は、それ自体が平均的にファモチジンを強く支持する一次文献の研究(上記の時代1で引用されたものを参照)に最も大きく依存していたことは、おそらく当然のことである。Sunら)には、一般的にあまり好ましくない結論に達した症例/コホート研究のサブセットが含まれている[Cheung et al 2020);Shoaibi et al 2021);Yeramaneni et al 2021)など]。3番目のメタアナリシスであるKamal et al 2021)は、COVID-19の結果と酸抑制剤(ファモチジンとPPIの両方)の使用との間に「一貫した関連性がない」としているため、ここでは「タイブレーカー」の役割を果たしていない。最後に、文献学的なメタアナリシスでは一般的に起こりうることであるが、データソースに「ポジティブアウトカム」の出版バイアス(Fanelli, 2012)が存在し、ネガティブな知見が主要な査読付き文献に掲載されなかった可能性がある。
– 時代3
不一致の原因は?Etminan et al 2020)は最近、メタ分析(!)に頼ることなく、(Elmunzer et al 2020)Freedberg et al 2020a)Mather et al 2020)のような主にレトロスペクティブな観察的単一施設研究からこれまでに導き出された結論の一貫性を制限する可能性のある要因について、徹底的かつ鋭く批判した。特に、残留交絡バイアスやスパースデータバイアス、不死時間バイアス(および多少関連する選択バイアス効果)逆因果バイアス[後者は、これらの疫学的バイアスの構造を解明することができる因果有向非環状グラフ(cDAG)モデルによって理解することができる]など、いくつかのタイプのバイアスの原因となりそうなものが特定された。ここでは、以下のことを簡単に記する。1)バイアスの原因の中には、(因果関係や限られたデータなどのために)他のものよりもコントロールしたり、統計的に特定して説明することが難しいものがある。 2)原則として、バイアスはそれ自体、一連の一次調査の間で必ずしも不整合をもたらすものではない。つまり、偏りと不整合は同等の現象ではなく、一連の研究の中の各研究が同じような偏りに悩まされていても、自己矛盾は生じないと考えられる。いずれにせよ、Etminanらは、ファモチジン↔COVID-19の関係を統計的に解明するための今後のアプローチにおいて、いくつかの改善点があることを強調している。
考察
COVID-19におけるファモチジンとその潜在的な役割を、よりメカニズム的な分子レベルのレンズで見ることで、いくつかの矛盾が解消されるのではないであろうか?患者を対象とした観察研究と並行して、ファモチジンの治療的役割のための潜在的なMOAについても、いくつかの論文で検討されている。特に、EnnisとTiligadaによる最近のレビュー(2021)では、ヒスタミン受容体拮抗薬(例:ファモチジン)とCOVIDの関連性について、説得力のある、権威ある記述がなされている。一方、ヒスタミン放出理論は、Eldanasory et al 2020)およびGhosh et al 2020)によって、少なくとも肺への影響(線維化など)とその結果としての急性呼吸困難に関して、COVID-19の病態生理の多くを支えると思われる破壊的な「サイトカインストーム」を含む、炎症促進経路におけるこの多目的シグナル分子の役割について説明されている。より一般的には、ファモチジンやその他のGI関連の薬剤は、(Tarighi et al 2021)によるCOVID時代の薬剤再利用に関する包括的なレビューに登場しており、Singh et al 2020)による最近の書簡では、ファモチジンによるCOVID治療の有効性の根底にあるものは(分子的に)何か、という疑問が検討されている。なぜなら、巨視的・組織的なレベルでの複数の異質な(そして一見矛盾した)現象や観察結果が、分子レベルで見たときに、つまり基礎となる細胞や生理学的な経路に訴求することによって調和することはよくあることだからである。実際、ファモチジンとCOVID-19のように、独立した矛盾した知見を調整し調和させるには、最終的に2つの道筋があると考えている。1)関心のある巨視的な現象(臨床レベルの観察)に最も重要であると考えられる経路を分子レベルで検討する、2)多くのミクロの現象(例えば、薬物とタンパク質の相互作用)の相互作用と構築を、マルチスケールで統合的にモデル化する。2)ミクロの現象(例えば、薬物とタンパク質の相互作用)が、多くの階層レベル(小器官、細胞内、細胞、組織、Sm_21A3)を経て、生物レベル、さらには集団(感染症の経過を変えるような治療結果)に至るまで、マルチスケールで統合的にモデリングすること。
オントロジー、そして未来への道?
ファモチジンとCOVID-19に関する文献の矛盾を解決する主な動機は、基礎的な創薬/リパーパスやCOVID-19と薬物の相互作用のモデル化の観点から、生体分子システムのオントロジーベースの知識グラフを作成する際のデータの一貫性と調和の重要性に由来する。図1は、オントロジー内の異なるエンティティ間の関係を表現するために使用されるResource Description Framework(RDF)の「トリプル」の種類を図式化したものである[Andronis et al 2011)Blake(2013)Hastings(2017)がオントロジーに関する入門書/プライマーを提供している]。図1の例では、他のヒスタミン受容体(H1R、H3R、H4R)も示しているが、これは、与えられた一対の関係が単独では存在しないことを強調するためである。すべての単純な関係は、一般的に多くのエンティティが関与する生理学的コンテキストの中に組み込まれている(リンクの信頼度はさまざまです)。RDFトリプルがエンティティ間の関係を表しているのに対し、オントロジーのもう一つの側面は、オントロジーの知識ドメインにまたがるクラス/概念(与えられたエンティティがそのインスタンスである)のコレクションのための、より高いレベルの構造化または組織(通常は階層的)である。図1Bに示す遺伝子オントロジー[GO; Ashburner er al)。 (2000)]の「祖先チャート」は、H2R結合に対応するGO:0031808という用語について、このような概念階層を示している。宿主-コロナウイルス薬物/相互作用マップの抜粋(図1C)は、前述のオントロジーの両方の側面、すなわち、1)概念/エンティティ間の構造的相互関係(ある広範なもの、ある特定のもの、ある他のサブセットなど)および2)そのようなKGが構築される対の関連(RDFトリプル)を反映したグラフベースの表現である。これらの「セマンティックネットワーク」アプローチは、創薬、ファーマコゲノミクスモデリング、「ビッグデータ」(スケールを超えたデータ統合)などにKGを使用できることを含め、多くの理由で説得力があり強力である(Andronis et al 2011)およびKanza and Frey(2019)でレビュー)。このような取り組みを成功させるには、データが制御された語彙で体系化されていること、構文が整っていることなどが必要である。このようなグラフを構築できるかどうかは、「✓FamoCOVIDDOB」と「✗FamoCOVIDDOB」のような内部的な不整合がないかどうかにかかっている。データソースの不整合や不正確さを解決することで、そのようなエラーがグラフを通じて「浸透」するのを緩和することができ、潜在的に誤った下流の結論を制限することができる(そのような結論は、多くの場合、機械学習アプローチを適用してグラフベースの構造に統計的推論を実行することで得られる)。
米国のNCT04504240,NCT04370262,NCT04545008をはじめ、国際的な取り組み(例:Samimagham et al 2020))など、進行中のいくつかの前向き臨床試験から得られた知見と合わせて、詳細な生体分子研究によって、これまで報告されてきたファモチジンとCOVID-19の間の矛盾した関係を明らかにできると期待している。その結果、創薬や薬理学的再利用のための、より強固で効果的かつ予測可能なオントロジーフレームワークの構築が可能になると考えられる。
