Contents
アルツハイマー3型 総合 CIRS・閉塞性睡眠時無呼吸症候群
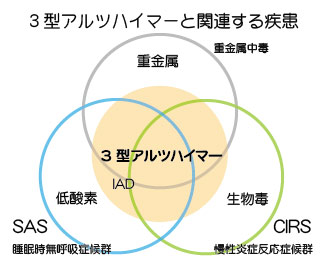
3型の症状、兆候、検査値
プロファイル
・65歳未満の発症 40代後半50代から症状が始まる。
・ApoE4遺伝子陰性 一般的にはApoE3/3
・家族のアルツハイマー病歴がない。または家族が本人よりも年上で発症している。
・慢性ライム病の有無
・マイトコキシンへの曝露、
・認知機能低下を伴うCIRSの診断歴
・マグロなどの大型魚を食べている。アマルガムを使っている。
前駆症状・臨床
・閉経、男性更年期があった。
・認知力低下の前に、うつ病を発症
・早期症状として頭痛
・初期の障害の特徴は記憶障害ではない。失語症など
・大きなストレス(失業、家族の死など)、睡眠が不十分
・低体温症
・幻覚、失語症、執行機能不全、健忘はあまりなく大脳皮質に問題が見られる。(100-7を繰り返す計算など)
検査値
・血清中性脂肪の低下
・血清亜鉛の低下 75mcg/dl以下、または銅と亜鉛の比率で銅が高い。>1.3
・低プレグネノロン、DHEA-S、および、またはAMコルチゾールを伴うHPA軸の機能不全
・血清C4a、TGF-β1、MMP9の高値、
・MSH(メラノサイト刺激ホルモン)の低値
・MARCoNSで鼻咽頭培養検査が陽性
・複数の生物毒素感受性または、病原体特異的感受性に関連するHLA-DR / DQ遺伝子に問題あり。
※上記項目に2つ以上該当するものがあれば、IAD(吸入性アルツハイマー病)の可能性を疑う。
代表的評価項目
・FDG-PETでは、脳萎縮、前頭側頭、頭頂部異常。(時には小脳萎縮)
・ApoE遺伝子型は、4/4、3/4ではなく、3/3が多い。(例外もある)
・銅と亜鉛の比率が高い
・血清亜鉛が低い。50~60mcg/dl(ただし血清亜鉛濃度の精度は正確ではない)
・プレグネノロン、DHEA-s、AMコルチゾールの副腎疲労があることもある。
感染症
・ウイルス(HSV、EBV、CMV、HSV6、ライム病、バベシア、バルトネラ、真菌、MARCoNS)
・口腔細菌 ポルフィロモナス・ジンジバリス
・口腔真菌 C. glabratus -raises
有害金属
・水銀 (歯科用アマルガム、大型魚)、アルミニウム、他の重金属
環境因子
・関節インプラント
・乳房インプラント
マイコトキシン
マイコトキシンの曝露がCIRSの最も多い病因
trichothenes(スタキボトリス)
オクラトキシンA(ペニシリウム)
アフラトキシン(アスペルギルス)
亜鉛欠乏症 3型関連
3型では血清亜鉛が非常に低い。50~60mcg/dl
血清亜鉛のレスポンスは鈍いため、血清検査値の亜鉛低値は重度の亜鉛欠乏症であることを示唆する。
亜鉛は鉄に次いで人体の中で豊富な微量ミネラル
300を超える酵素の触媒作用として、または補助因子として亜鉛が利用されている。
高齢者に共通した亜鉛欠乏症は、アルツハイマー病の危険因子であるインスリン抵抗性を誘発する。
また亜鉛欠乏によって炎症を増加させ、免疫力が落ちる。その結果、自己免疫応答が生じる。
老化の加速、毒素への感受性、感染への感受性が高まり、活性酸素種産生が増加、ホルモン機能が低下、副腎機能の低下、銅毒性の感受性増加、胃腸過敏性にも関連する。
したがって亜鉛欠乏症は、認知機能低下の潜在的な原因となる。
血清亜鉛が低いときには、亜鉛の欠乏症は非常に深刻となる可能性が高い。
亜鉛の補充によって、患者の認知低下を緩和させ、血清遊離銅を低下させることができる。
www.ncbi.nlm.nih.gov/pubmed/24224111
CIRS 慢性炎症反応症候群
CIRS = Chronic Inflammatory Response Syndrome 慢性炎症反応症候
関連記事
![]() CIRS(慢性炎症反応症候群)カビ毒治療プロトコル 14ステージ
CIRS(慢性炎症反応症候群)カビ毒治療プロトコル 14ステージ
