Contents
Zinc, Carnosine, and Neurodegenerative Diseases
www.ncbi.nlm.nih.gov/pmc/articles/PMC5852723/
要旨
亜鉛(Zn)は脳内に豊富に存在し、シナプス小胞に蓄積される。シナプス小胞に蓄積された亜鉛は、神経細胞の興奮とともに放出され、学習や記憶に重要な役割を果たしている。認知症の一種であるアルツハイマー病や血管性認知症、プリオン病など、様々な神経変性疾患にZnのホメオスタシスの破綻が関与していることが示唆されている。
カルノシン(β-アラニルヒスチジン)がこれらの神経変性疾患を予防することが示唆されている。カルノシンは、骨格筋や脳内に豊富に存在する内因性ジペプチドであり、抗酸化作用、金属キレート作用、抗架橋作用、抗糖化作用など多くの有益な作用を有している。
ポラプレジンと呼ばれるカルノシンとZnの複合体は、Zn補給療法や潰瘍の治療に広く使用されている。ここでは、Znとこれらの神経変性疾患との関連をレビューし、カルノシンの神経保護効果に焦点を当てている。また、様々な食品に含まれるカルノシンのレベルと、カルノシンの栄養補給による有益な効果についても考察する。
キーワード
亜鉛、銅、シナプス、アミロイド、アポトーシス、ERストレス、食品分析
1. はじめに
亜鉛(Zn)は鉄(Fe)に次いで豊富に存在する必須微量元素である。それは300以上の酵素や金属タンパク質のコファクターであり、細胞分裂、免疫系、タンパク質合成、およびDNA合成を含む多くの機能において重要な役割を果たしている[1,2]。増加する証拠は、Znがカルシウム(Ca)[3]と同様に、様々な生物学的システムでセカンドメッセンジャーとして機能することを示唆している。最近のヒトゲノムのバイオインフォマティクス研究では、Znは全タンパク質の約10%のZn結合モチーフまたは金属応答性エレメントと結合し、その発現レベルを制御していると報告されている[4]。
このようなヒトにおける重要な機能を考えると、Znの欠乏は様々な悪影響を引き起こす[5,6,7,8]。小児期のZn欠乏は、ヒトでは心身の発達の遅れ、学習障害、小人症、免疫系の機能不全を引き起こす。また、Znは嗅覚や味覚に不可欠な物質であるため、Zn欠乏症は成人の学習障害、味覚障害、嗅覚障害を引き起こす。さらに、Znの欠乏は、うつ病やストレスのレベルに関連している。
Znの推定平均必要量(EAR)は、日本の厚生労働省によって成人男性で12mg/日、成人女性で9mg/日と推奨されている。1日のZnの摂取量は10~15mgとされているが、Znの摂取量と吸収量には特徴があるため、軽度のZn欠乏症の患者が多いのが現状である。Znのバイオアベイラビリティは、植物に含まれるフィチン酸塩や繊維などの多くの食品成分の影響を受け、Znと難溶性複合体を形成して消化管吸収を阻害する[9]。安田・蔦井は、日本の高齢者や小児の約2割以上がZn欠乏症であることを報告している[10]。世界保健機関(WHO)は、世界の死亡者の1.4%(280万人)がZn欠乏症に起因していると報告している[11]。そのため、Zn欠乏症の予防・治療にはサプリメントの摂取が重要である。Zn補給療法は、圧迫性潰瘍、麻疹、味覚障害の治療に用いられている[12,13,14]。Znとカルノシン(β-アラニルヒスチジン)の複合体であるポラプレジンは、この目的のために広く使用されている[15]。ポラプレジンはまた、潰瘍に対する粘膜の保護やヘリコバクター・ピロリ菌関連胃炎の治療にも使用されている[16,17]。
カルノシンは内因性ジペプチドである[18]。カルノシンは小さく、水溶性である。カルノシンとその類縁体(ホモカルノシンとアンセリン)(図1)は、ヒトを含む鳥類、魚類、哺乳類など多くの生物に存在する。骨格筋に豊富に存在するが、胃、腎臓、心筋、脳にも存在する。このように、肉や魚などの日常的な食品にはかなりの量のカルノシンが含まれている。
図1 カルノシンとその類縁体の構造

(a)カルノシン (b)アンセリン (c)ホモカルノシン。
カルノシンは、抗糖化作用、抗ストレス作用、抗酸化作用、ヒドロキシルラジカル消去作用、pHバランスの維持、2価の亜鉛イオン(Zn2+)や2価の銅イオン(Cu2+)などの金属のキレート作用など、様々な有利な特性を持っている(図2)[19]。カルノシンは、クレアチンおよびアデノシン三リン酸(ATP)と同様の濃度で、骨格筋に最も豊富に存在する低分子化合物の一つである。カルノシンは骨格筋の運動による乳酸の物理化学的緩衝に寄与し、抗疲労作用を有する。カルノシンが脳内のZnの利用可能性の調節に寄与している可能性がある[9]。我々の研究をはじめとする多くの研究では、アルツハイマー病[20]、老人性痴呆症(VD)の血管型[21]、プリオン病[22]、自閉症スペクトラム障害[23]、湾岸戦争症候群[24]などの様々な神経変性疾患に対してカルノシンが神経保護作用を持つことが示されている。さらに、高齢者の認知機能障害の改善には、カルノシンやアンセリンの補充療法が有効であることが報告されている[25]。
図2 カルノシンの有益な効果
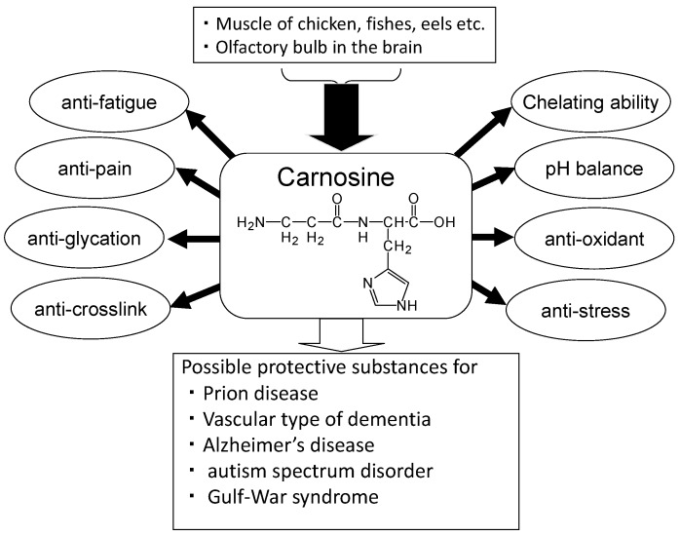
ここでは、カルノシンの神経保護機能に着目し、Znと神経変性疾患との関連性を概観し、これらの神経変性疾患の治療薬としての栄養素の観点からカルノシンの神経保護的役割を検討する。また、当社が開発した高速液体クロマトグラフィー(HPLC)を用いた簡便な定量分析法をもとに、食品中のカルノシン量についても検討している。
2. 脳内での亜鉛の役割
Znは精巣、筋肉、肝臓、脳組織に豊富に存在し、総含有量は約2gで、脳の海馬、扁桃体、大脳皮質、視床、嗅覚野に蓄積されている[26]。Znは海馬に70~90ppm(~20μM)存在すると推定されている[27]。脳内のZnは金属タンパク質や酵素に結合するが、約10%以上のZnは遊離亜鉛イオン(Zn2+)としてグルタミン酸を持つ興奮性ニューロンのシナプス前小胞に貯蔵される。神経細胞の興奮時には、キレート可能なZn2+がグルタミン酸小胞からシナプス前小胞に分泌される。分泌されたZnは、N-メチル-d-アスパラギン酸(NMDA)型グルタミン酸受容体、アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸(AMPA)型グルタミン酸受容体、γ-アミノ酪酸(GABA)受容体、グリシン受容体などの様々な神経伝達物質受容体と結合することで、脳の全体的な興奮性を調節することが報告されている[28]。上野らは、分泌されたZn2+が海馬の時空間情報を変調することを報告している[29]。このように、分泌されたZnはシナプス可塑性、情報処理、記憶形成に不可欠である。実際、Znは、シナプス情報貯蔵の一形態であるコケ繊維における長期増強(LTP)の誘導に不可欠であることが報告されている[30]。分泌されたZn2+が神経調節因子の役割を持っている可能性がある。Znは神経抑制を発生させることが示されているので、Znは距離依存的に隣接するシナプスへのシナプス裂け目に拡散することで、隣接するシナプスの活性を変調させることができる。同様の現象は「側方抑制」として報告されており、シナプス可塑性のメカニズムの根底にあるシグナルのコントラストを引き起こしていた[31]。
Zn2+と同様に、Cu2+もシナプス小胞に存在することが報告されている。神経細胞の興奮時には、Cu2+はシナプス小胞に分泌される [32]。分泌されたCu2+は、GABA受容体、AMPA型グルタミン酸受容体、NMDA型グルタミン酸受容体を含む様々な受容体と結合することで、神経細胞の興奮性を調節する。シナプス裂の大きさは、高さ20nm、幅120nmと推定され、脳の全細胞外容積の1%程度である[33]。その小ささを考慮すると、神経伝達物質や金属のレベルがシナプス内で高いというのはもっともらしいことである。実際、グルタミン酸の濃度は、シナプス裂け目での神経細胞の脱分極後にmMの範囲に達すると推定されている。脳脊髄液(脳脊髄液)中のZnのレベルは1μM未満であるが、シナプス裂でのZnのレベルは1-100μMであると報告されている[34];一方、シナプス裂でのCu2+のレベルは2-15μMであると報告されている[35]。Zn2+とCu2+は体内への進入や多くの結合タンパク質と競合しているため、過剰なZnはCuの異常恒常性にもつながる可能性がある。
カルノシンはアストロサイトやオリゴデンドロサイトで合成されることが報告されている。カルノシンは嗅球ニューロンやグリア細胞に存在し、グリア細胞からシナプス間隙に分泌される[36]。したがって、カルノシンがシナプス裂け目でZnとCuのホメオスタシスを調節している可能性が高い。シナプスにおけるZn2+とCu2+の仮説的な役割は、図3に表示されている。
図3
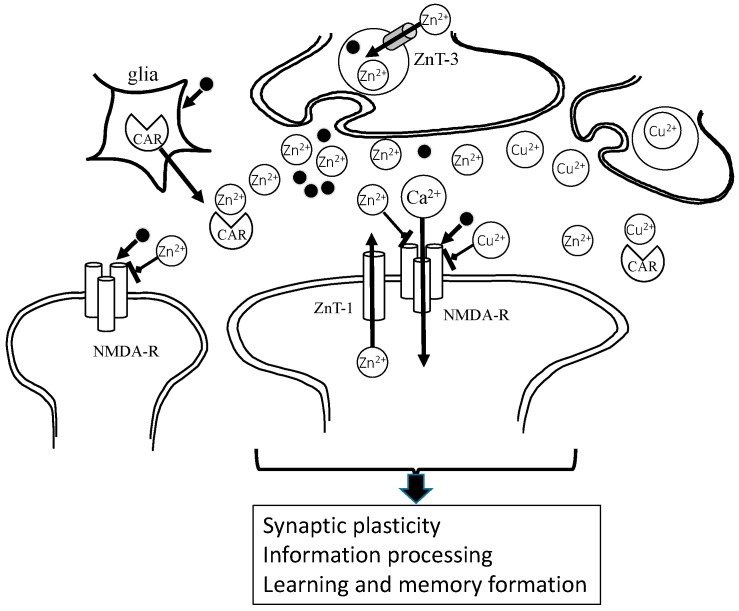
生理的条件下では、シナプス前小胞からZn2+とグルタミン酸が放出され、NMDA型グルタミン酸受容体(NMDA-Rs)を阻害し、他の受容体を調節する。Zn2+は隣接するシナプスに流出し、興奮性を調節する。シナプス可塑性の維持や記憶の形成にZnが不可欠であることが考えられる。また、Cu2+も分泌され、Zn2+と同様の作用をする。カルノシンは、Cu2+と同様にZn2+と結合し、シナプスにおけるこれらの濃度を調節する。Zn2+:2価の亜鉛イオン、Cu2+:2価の銅イオン、Ca2+:2価のカルシウムイオン、CAR:カルノシン、ZnT-1:亜鉛トランスポーター1,-グルタミン酸。
Znの恒常性は、カルノシンの他に、メタロチオネイン、Znトランスポーター(ZnT)およびZrt-、Irt様タンパク質(ZIP)Znトランスポーターの3つの因子によって調節されている[37,38]。メタロチオネインは、68個のアミノ酸からなるユビキタス金属結合タンパク質である。これらのタンパク質は20個のシステイン残基を持ち、Cu、Cd、Znなど7つの金属原子を結合している。メタロチオネインは3種類ある。MT-1,MT-2,MT-3の3種類のメタロチオネインのうち、MT-3は主に中枢神経系で観察されている。しかし、MT-1とMT-2は一般的に全身に存在している。
哺乳類には14種類のZnTが存在する。ZnTは、細胞からのZnの排出を促進することにより、細胞内のZnを減少させる。これらは、溶質担体(SLC30)遺伝子ファミリーでコードされている。ZnT-1は、Znの排出に重要な役割を果たし、過剰なZnからの保護に関与している。ZnT-1とZnT-3は脳内でキレート性Znと共局在している。ZnT-3はシナプス小胞にZnを輸送し、これらの小胞内のZn濃度を高く維持する。
ZIP Zn トランスポーターは、細胞外コンパートメントから細胞内にあるコンパートメントにZnを輸送し、細胞質のZnを増加させる。ZIP Zn トランスポーターは、14 の SLC39 遺伝子によってコードされている。ZIPトランスポーターはゴルジ体や小胞体(ER)の膜にも存在し、細胞内小器官のZnを制御している。Znトランスポーターの遺伝子変異の欠損は、エーラーズ・ダンロス症候群のような重篤な疾患を引き起こす[39]。
さらに、Znの過不足、すなわち脳内のZnの恒常性の異常は、アルツハイマー病、老人性痴呆症、プリオン病、筋萎縮性側索硬化症(ALS)などのいくつかの神経変性疾患の発症と関係があると考えられている[40,41,42,43]。
3. 亜鉛、カルノシンとアルツハイマー病
3.1. アミロイド仮説
日本では 2013年には75歳以上の高齢者が総人口の10%を占めている。そのため、約400万人が老人性認知症に罹患しており、その数は年々増加し続けている。
老人性認知症の多くは、アルツハイマー病、老人性痴呆症、レビー小体型認知症(DLB)に分けられる。老人性認知症の半数以上を占めるのがアルツハイマー病である。アルツハイマー病が初めて報告されたのは1906年であるが 2016年の米国でのアルツハイマー病患者数は500万人以上と推定されている。アルツハイマー病は、老人性プラークと呼ばれる沈着と神経原線維のもつれ(NFTs)によって特徴づけられる。海馬および大脳皮質領域のシナプスおよびニューロンの選択的な喪失も観察される[44]。NFTsの主成分はリン酸化タウタンパク質であり、老人斑の主成分はβアミロイドタンパク質(アミロイドβタンパク質)である。アルツハイマー病発症の主な要因については未だ議論の余地がある。タウ蛋白質の蓄積やコリン作動性神経細胞の変性が発症に関与しているのではないかと考えられている。しかし、アミロイドβタンパク質の蓄積とその結果としての神経変性がアルツハイマー病の中心的な役割を果たしていることを示唆するアミロイドカスケード仮説の考え方は、多くの研究者によって支持されている[45,46]。アミロイドβタンパク質は39-43アミノ酸残基からなる小さなペプチドである。アミロイドβタンパク質は、β-セクレターゼ(βサイトAPP切断酵素;BACE)によってN末端の大きな前駆体タンパク質(アミロイド前駆体タンパク質;APP)から分泌され、その後、γ-セクレターゼによるC末端の膜内切断が行われる。アミロイドβタンパク質(1-40)最初の40アミノ酸残基、またはアミロイドβタンパク質(1-42)のような切り詰められたアミロイドβタンパク質は、APPの異なるC末端切断によって産生される(図4)。分泌されたアミロイドβタンパク質は、一般にネプリリシンなどの特異的プロテアーゼによって分解される。47]で示された家族性アルツハイマー病の早期発症例の遺伝学的研究から、APPの変異とアミロイドβタンパク質の代謝がアルツハイマー病と関連していることが報告されている。また、プレセニリン遺伝子の変異が早期発症家族性アルツハイマー病症例の大部分を占めることも明らかになった。プレセニリンは、γ分泌酵素の一つであることが報告されている。プレセニリン遺伝子の変異は、切断されたアミロイドβタンパク質の産生やその神経毒性にも影響を与える。
図4 アミロイドβタンパク質の分泌とオリゴマー化
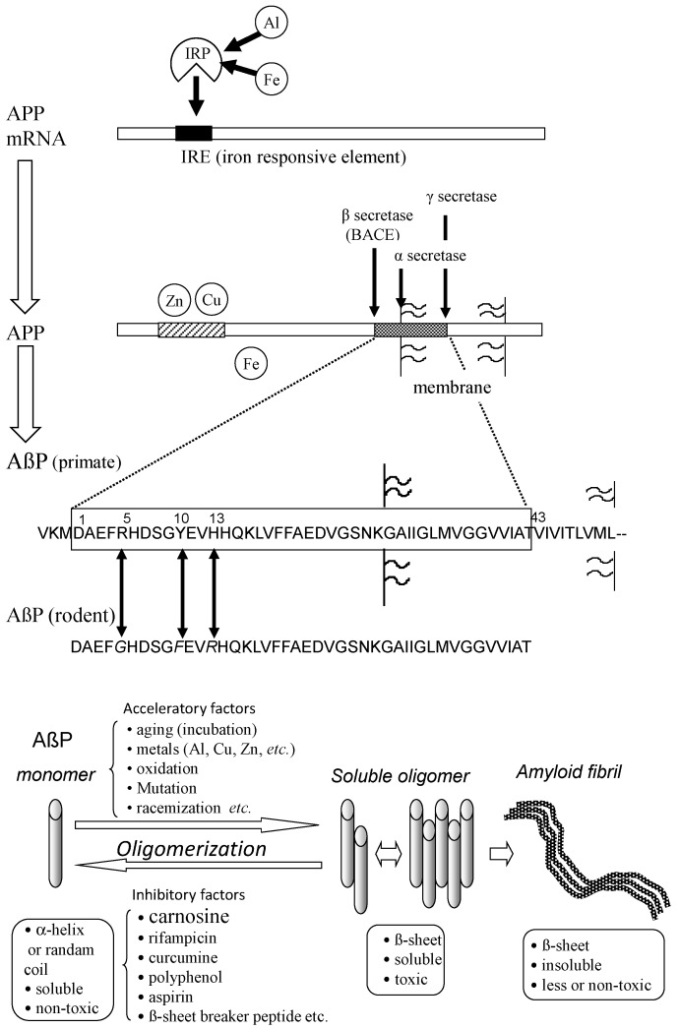
アミロイドβタンパク質はβ-セクレターゼ(BACE)とγ-セクレターゼによってAPPから分泌される。APPの発現はFeによって制御されており、Alの影響を受けている可能性がある。また、APPはCuやZnにも結合している。ヒトアミロイドβタンパク質の3つのアミノ酸(Arg5,Tyr10,His13)が齧歯類アミロイドβタンパク質に置換されている。老化条件下または促進因子の存在下では、ランダムまたはα-らせん構造を有する単量体アミロイドβタンパク質は自己会合し、数種類のオリゴマー(SDS可溶性オリゴマー、アミロイドβ由来の拡散性リガンド、グロビュロマー、プロトフィブリル)を形成した後、最終的に不溶性の凝集体(アミロイドフィブリル)を形成する。単量体およびフィブリル凝集体は比較的無毒であるが、オリゴマーの可溶性アミロイドβタンパク質は毒性がある。APP:アミロイド前駆体タンパク質;mRNA:メッセンジャーリボ核酸;アミロイドβタンパク質:βアミロイドタンパク質;Al:アルミニウム;Fe:鉄;IRP:鉄調節タンパク質。
1990年、Yanknerらは、アミロイドβタンパク質(1-40)が培養ラット海馬ニューロンの毒性を引き起こすことを発見した[48]。これらの知見には議論の余地があったが、アミロイドβタンパク質の神経毒性は、そのオリゴマー化とその後の構造変化によって影響を受けることが実証された[49]。アミロイドβタンパク質はオリゴマーに自己集合する傾向がある。アミロイドβタンパク質は調製したばかりの状態で水溶液に溶解すると単量体タンパク質として存在し、ランダムなコイル構造を示す。しかし、アミロイドβタンパク質は37℃で数日間培養(エージング)すると凝集体(オリゴマー)を形成する。オリゴマーのアミロイドβタンパク質はβプリーツ状のシート構造を持ち、最終的には不溶性の凝集体(アミロイド線維)を形成する。アミロイドβタンパク質 の神経毒性は老化の過程で増強されることが報告されている[50]。
3.2. 金属とアミロイド
アミロイドβタンパク質は若年者だけでなく、非認知症高齢者の脳脊髄液にも分泌されていると報告されている[51]。したがって、アミロイドβタンパク質の量だけでなく、そのオリゴマー化の促進因子や阻害因子もアルツハイマー病の発症には不可欠であると考えられる。アミロイドβタンパク質のオリゴマー化は、ペプチド濃度、pH、溶媒組成、温度などの影響を受ける。アミロイドβタンパク質の酸化、変異、ラセミ化はそれに影響を与える可能性がある[52]。Znおよびアルミニウム(Al)Cu、鉄(Fe)などの他の微量元素は重要な促進因子である。ヒトとげっ歯類のアミロイドβタンパク質のアミノ酸配列は類似しており、げっ歯類のアミロイドβタンパク質は霊長類のアミロイドβタンパク質とはわずか3つのアミノ酸(Arg5,Tyr10,His13)の違いだけである。しかし、げっ歯類の脳ではアミロイドβタンパク質の蓄積はほとんど見られない。実際、ネズミのアミロイドβタンパク質は、試験管内試験では霊長類のアミロイドβタンパク質に比べて凝集する傾向が少ない[53]。興味深いことに、これら3つのアミノ酸はすべて金属を結合する能力を持っている。Bushらは、Znが低濃度(300nM)でもアミロイドβタンパク質のオリゴマー化を誘導することを発見した[54]。また、Cuはアミロイドβタンパク質の凝集を著しく増強することも報告している[55]。Znはアミロイドβタンパク質の3つのヒスチジン残基(His6,His13,His14)やアミロイドβタンパク質のAsp1のカルボキシル基に結合している[56]。
しかし、金属によるアミロイドβタンパク質のオリゴマー化についてはまだ議論の余地がある。Al, Cu, Fe, Znとのアミロイドβタンパク質オリゴマーの形態はかなり異なっている[57]。Al、Cu、Fe、Znなどの金属はアミロイドβタンパク質のオリゴマー化と毒性を異なる方法で変化させる[58]。Cuのオリゴマー化したアミロイドβタンパク質は、Znのオリゴマー化したアミロイドβタンパク質に比べて毒性が強い[59]。Alは、Zn、Cu、Fe、カドミウム(Cd)などの他の金属と比較して、より顕著なオリゴマー化を引き起こすことがわかった[60]。さらに、Al会合型アミロイドβタンパク質は、Zn会合型アミロイドβタンパク質と比較して、曝露後数日で培養ニューロン表面に強固に結合し、線維状の沈着物を形成することがわかった。
一方、Znはアミロイドβタンパク質による神経毒性を減衰させることができ、プロテクターとしてアルツハイマー病に寄与している[40]。アミロイドβタンパク質曝露後には、サイトカインの誘導、ERストレスの誘導、活性酸素種の産生、細胞内カルシウム濃度の異常上昇([Ca2+]i)など、様々な副作用が報告されている[61]。これらの作用は相互に作用する可能性があるが、Ca2+が多くの細胞機能に関与していることを考えると、Ca2+の恒常性の崩壊がアミロイドβタンパク質神経毒性の主要な有害事象である可能性がある[62]。Arispeらは、アミロイドβタンパク質が人工脂質二重膜上に孔のようなチャネル構造を形成し、Ca2+や他のカチオンに透過性で、多レベルで、電圧に依存せず、かつ長時間持続することを最初に示した[63]。私たちは、アミロイドβタンパク質が神経細胞膜上に多孔質チャネルを形成していることを発見し[64]、培養神経細胞の細胞内Ca2+濃度の上昇をfura-2 Ca2+イメージングを用いて実証した[65]。これらの結果に基づいて、「アミロイドチャネル仮説」が示され、アミロイドβタンパク質が神経細胞膜に直接取り込まれ、アミロイドチャネルを介して細胞内Ca2+が増加することが、アミロイドβタンパク質の神経毒性の主要なイベントであることが示唆された[66]。アミロイドβタンパク質は、様々な抗菌薬や抗真菌ペプチドの毒性の根底にある類似のメカニズムを共有している可能性があり、これらのペプチドも同様にチャネル形成活性と細胞毒性を示している[67]。我々や他の研究者は、Zn2+への暴露によってチャネル活性が阻害され、Znキレート剤であるo-フェナントロリンによって回復することを発見した[64,68]。His残基はアミロイドチャネルの内面に露出しているため、ZnはこれらのHis残基に結合し、アミロイドβタンパク質誘発のCa異常恒常性からニューロンを保護することができる[69]。したがって、アルツハイマー病の発症におけるZnの役割はまだ議論の余地があり、Znはプロテクターとしてだけでなく、アルツハイマー病の発症の寄与者として作用する可能性がある。その意味で、Znは古代ローマの扉の神ヤヌスのように、2つの異なる顔で描かれているような役割を果たしているかもしれない[40]。
さらに、APPは、そのN末端に2つのCuおよび/またはZn結合ドメインを持つ金属結合タンパク質である。APPは、Cu2+をCu+に還元する能力を有している。CuおよびZnは、APPの発現および処理に影響を与え、アミロイドβタンパク質産生を増強する[70,71]。Cuは、APPの二量体化と小胞体から神経細胞への輸送を誘導する。また、APPは鉄のホメオスタシスを制御している。APPのmRNAは鉄応答性エレメント(IRE)を持っている。これは、APPの発現がフェリチン(鉄貯蔵タンパク質)と同様に鉄によって制御されていることを意味している[72]。一方、APPは鉄の排出を制御するフェルロポーチンに結合している[73]。したがって、APPはZn、Cu、Feを含む金属の恒常性を制御することが示唆されている。
3.3. アミロイドβタンパク質 の抗架橋剤としてのカルノシン
アミロイドβタンパク質 のオリゴマー化を阻害する分子は、予防的な アルツハイマー病 治療薬の候補となる可能性がある。リファンピシン、クルクミン、トランスサイレチンなどのいくつかの化合物がアミロイドβタンパク質のオリゴマー化を阻害することが報告されている[52]。βシートブレーカーペプチドと呼ばれる5つのアミノ酸からなる小さなペプチドは、アミロイドβタンパク質のオリゴマー化を著しく阻害する[74]。
カルノシンは、図2に示すように、抗架橋能を有しており、α-結晶などのタンパク質のオリゴマー化を阻害する[75]。このように、N-アセチルカルノシンは白内障の治療に使用されてきた[76]。増加する証拠は、カルノシンがアミロイドβタンパク質のオリゴマー化を阻害し、その神経毒性をブロックすることを示している[77,78]。Coronaらは、経口投与されたカルノシンがアミロイドβタンパク質の蓄積を抑制し、アルツハイマー病のマウスモデルにおいて学習障害を予防することを実証した[20]。さらに、ヒスチジンとカルノシンはアルツハイマー病患者の脳脊髄液で有意に減少している[79]。したがって、カルノシンはアルツハイマー病に対する神経保護の役割を果たす可能性がある。
4. 亜鉛、カルノシン、認知症の血管型
4.1. 亜鉛と虚血誘発性神経細胞死
老人性認知症の約3分の1が老人性痴呆症である。その危険因子は高血圧と糖尿病である。一過性の大脳虚血や脳卒中では、血流の途絶により酸素-グルコースの枯渇と膜の脱分極が起こる[80]。その後、シナプス裂け目へのグルタミン酸の過剰放出は、グルタミン酸受容体の過剰刺激とニューロンへの大量のCa2+の侵入を引き起こし、記憶形成に重要な海馬の錐体ニューロンの死を誘発する。
Znは虚血後の神経細胞死と老人性痴呆症の病態に重要な役割を果たしている[81,82]。過剰なZnは脳内での重要性にもかかわらず、神経毒性を示す可能性がある。シナプスクレフト中のZnの濃度は1~100μMと推定されている。しかし、かなりの量のZn(最大300μM)が虚血状態の間にグルタミン酸と共放出されてシナプス裂け目に入る[27]。Kohらは、虚血後に海馬のアポトーシスニューロンにZnが蓄積することを実証した[83]。膜不透過性のZnキレート剤(エチレンジアミン四酢酸カルシウム(Ca-EDTA))は、虚血後の海馬ニューロンを保護し、梗塞容積を減少させる[84]。Znはミトコンドリア障害や酸化ストレスを引き起こす可能性がある[85]。
4.2. Zn誘発神経毒性の分子機構。体外モデル系としてのGT1-7細胞
我々は、不死化された視床下部ニューロン(GT1-7細胞)におけるZnの神経毒性とカルノシンの保護機構の基礎となる分子機構を調査した。我々は、Znが用量依存的にGT1-7細胞の死を引き起こすことを発見した[86]。退化したGT1-7細胞は、DNA断片化を含むアポトーシス特性を示し、末端デオキシヌクレオチジル転移酵素を介したビオチン化ウリジン三リン酸(UTP)ニックエンド標識(TUNEL)陽性であった。GT1-7細胞は、初代培養ラット海馬ニューロン、B-50神経芽腫細胞、PC-12細胞などの他の神経細胞と比較して、Znに対してはるかに感受性が高く、Zn曝露後の生存率がはるかに低いことが明らかになった[87]。GT1-7細胞は、Mellonらによってマウス視床下部ニューロンから遺伝的に標的化された腫瘍形成によって開発された。GT1-7細胞は、神経突起の伸長やニューロン特異的なタンパク質や受容体の発現など、神経細胞としての特徴を持っている。一方、GT1-7細胞は低レベルのイオントロピー性グルタミン酸受容体を有し、グルタミン酸毒性を受けない。これらの特性は、GT1-7細胞株がZn誘導神経毒性の調査のための良いモデル系であることを示唆している。
GT1-7細胞を用いて、ピルビン酸、クエン酸塩、Ca2+チャネルのアンタゴニスト(ニフェジピン、コノトキシン)およびAl3+がGT1-7細胞のZn誘導死をブロックすることがわかった[86,87,89]。我々はまた、細胞内Ca2+レベル([Ca2+]i)がZnへの曝露後に増加することを発見した。Ca2+チャネルブロッカーであるAl3+の事前投与は、[Ca2+]iのZn誘発性上昇を抑制し、Zn誘発性神経毒性を減衰させた。このように、Ca2+の恒常性がZnの神経毒性経路に関与している可能性が高い。
4.3. Zn 誘導神経細胞死に対する保護物質
老人性痴呆症3 の病態における Zn の重要性を考えると、Zn の神経毒性を阻害する物質が 老人性痴呆症3 の予防・治療薬の候補となる可能性が高い。そこで私たちは、GT1-7細胞を用いて、このような物質をスクリーニングするアッセイ系を開発し、様々な農産物(果物、野菜、魚、海産物など)を調べた[90]。試験した化合物の中で、ニホンウナギの筋肉組織の水溶性抽出物が顕著な保護活性を示すことがわかった [91]。この活性は95℃で30分間煮沸しても低下しなかった。加熱した抽出物をHPLCで分離し、液体クロマトグラフィー質量分析法(LC-MS)を用いて活性画分の構造をカルノシンの構造と決定した。さらに、マンゴー果実(Mangifera indica)の抽出物およびニシン(Etrumeus teres)の抽出物にも保護活性が認められ、活性画分はそれぞれピルビン酸塩およびヒスチジンと決定した [92,93]。
4.4. カルノシンの保護作用
カルノシンの神経保護機構を調べ、まずカルノシンがZnをキレートすることからZnの転座に着目した。まず、Zn特異的蛍光色素ZnAF-2を用いて、Zn処理したGT1-7細胞の細胞内Zn2+濃度([Zn2+]i)を分析した。しかし、カルノシンとアンセリンのいずれもGT1-7細胞へのZnの流入を抑制しなかったのに対し、膜不透過性キレート剤であるCa-EDTAで処理すると[Zn2+]iが減少した[94]。このように、カルノシンはZnキレート剤として作用せず、Zn誘導神経毒性から神経細胞を保護しなかったことはもっともらしい。
第二に、我々は、Znによって誘導される遺伝子変化を分析し、我々のリアルタイムポリメラーゼ連鎖反応(RT-PCR)分析は、Znが、金属関連遺伝子(MT-1,MT-2,ZnT-1)ER-ストレス関連遺伝子(GADDD(成長-arrest-およびDNA-損傷誘導遺伝子)34,GADD45,p8,CHOP(C脳アミロイド血管症AT-エンハンサー結合タンパク質相同タンパク質)およびCa2+関連遺伝子(Arc)を含むいくつかの遺伝子のアップレギュレーションを引き起こしたことを明らかにした。カルノシンはZn2+をキレートすることができるが、カルノシンはZnの細胞内濃度やMT-1やZnT-1のZn誘発性アップレギュレーションに影響を与えないことを示した。一方、カルノシンはGADD34,GADD45,CHOPなどのERストレス関連遺伝子、活性制御細胞骨格関連タンパク質(Arc)などのCa2+恒常性関連遺伝子のアップレギュレーションを阻害することが明らかになった。また、カルノシンは、タプシガルギンやチュニカマイシンなどの小胞体ストレス因子や過酸化水素(H2O2)によって誘発される神経変性を抑制することを明らかにした。また、アンセリンはカルノシンと同様にZnによる神経毒性も減衰することを明らかにした。さらに、私たちは最近、亜致死濃度のCu2+がZn2+誘導神経毒性とERストレス関連遺伝子の発現を強く増強することを発見した[95]。Cu2+によるZn2+誘導神経毒性の増強は、ピルビン酸とチオレドキシン-アルブミン融合タンパク質によって減衰された [96,97]。合わせて、我々は、Znの神経毒性とカルノシンの作用の根底にある可能性のある分子機構を仮定している(図5)。Znへの暴露後、細胞内のZnレベルは少なくとも30分間上昇する。Ca-EDTAなどのキレート剤はこのプロセスをブロックする。Znは、細胞内Ca2+レベルの増加につながり、その後、ERストレスを誘発する。このプロセスは、Al3+や他のCa2+チャネルブロッカーによって阻害される。Znは、ミトコンドリアのエネルギー生産機械の阻害と酸化ストレスの生産を誘発する。エネルギー基質であるピルビン酸塩とクエン酸塩はこのプロセスを阻止する。この酸化ストレスは、チオレドキシン-アルブミン融合タンパク質によって抑制された。最後に、これらの3つのプロセスは、神経変性経路を誘発し、老人性痴呆症で観察される神経細胞死につながる。グリア細胞から放出されたカルノシンは、ペプチドトランスポーターによって神経細胞に入り込み、ZnによるERストレスを抑制する。カルノシンが虚血誘発性神経変性に対する保護作用を有することは、実験動物を用いた数多くの生体内試験研究により示唆されている[98,99,100]。我々は、カルノシンの活性に基づいた老人性認知症の予防・治療薬としての特許を公開している[101]。
図5 Znによって誘導される神経細胞の死を防ぐことにおけるカルノシンの保護効果の下にある可能性のある分子機構
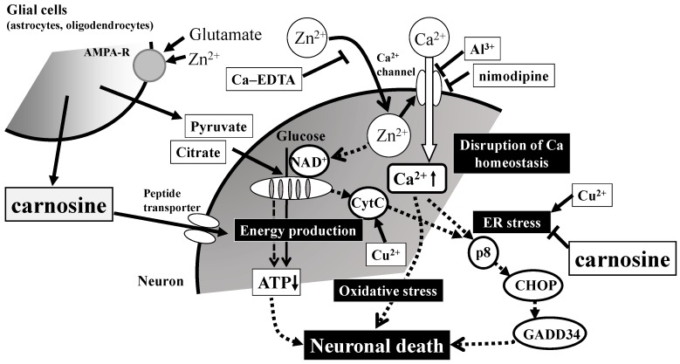
Zn の分泌された過剰量は、細胞内に移動し、Ca2+ の恒常性の崩壊、ミトコンドリアのエネルギー障害、酸化ストレスと同様に ER (小胞体) ストレスの誘導、およびアポトーシス神経細胞死を引き起こす可能性がある。カルノシンはシナプス裂け目に放出され、細胞体に輸送され、そこでZnによって活性化されたERストレス関連および/またはArc関連のアポトーシス経路を阻害することができる。詳細は本文に記載されている。Ca-EDTA:カルシウムエチレンジアミン四酢酸;NAD+:ニコチンアミドアデニンジヌクレオチド;CytC:シトクロムC;ATP:アデノシン三リン酸;CHOP:C脳アミロイド血管症AT-エンハンサー結合タンパク質相同タンパク質;GADD34:成長-arrest-およびDNA損傷誘導性遺伝子34。AMPA-R:AMPA型グルタミン酸受容体。AMPA型グルタミン酸受容体。
5. 亜鉛・カルノシン・プリオン病
5.1. 亜鉛・銅・プリオン病
また、Znやカルノシンもプリオン病に関与している。プリオン病には、ヒトではクロイツフェルト・ヤコブ病(CJD)ゲルストマン・ストラウスラー・シェンカー症候群(GSS)クル病などがある。また、牛の牛海綿状脳症(BSE)や羊のスクレイピーなども含まれる[102]。プリオン病は、神経細胞およびグリア細胞の海綿状変性とアミロイド原性プリオン蛋白質(PrP)の蓄積によって特徴づけられる。病原性組織の投与により特徴的な感染症が生じるため、プリオン病は伝達性海綿状脳症とも呼ばれている。伝達性感染症では、正常なプリオン蛋白質(PrPC)が異常なスクレイピー型アイソフォーム(PrPSc)に変換される。PrPCもPrPScも一次配列は同じであるが、PrPCはPrPScとは異なり、PrPScはPrPCに比べてβシート二次構造の含有量が多く、プロテアーゼ消化に対する耐性を持っている。PrPCは全身に遍在的に発現している(図6)。汚染された食品から投与された誤ったPrPScが、脳内の正常なPrPC分子を誤って凝集させているのではないかと推測されている。
図6 プリオンタンパクの構造
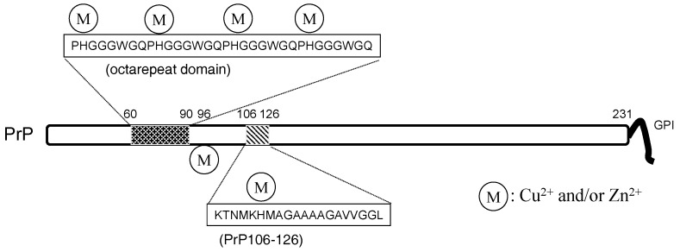
PrP:プリオンタンパク質
したがって、プリオン病はタンパク質ミスフォールディング病(コンフォメーション病)すなわちPrPCからPrPScへのコンフォメーション変化がプリオン病の発症に決定的に重要であると考えられている[103]。これらの特徴はアルツハイマー病と類似している。PrPCはメタロタンパク質であり、金属のホメオスタシスを制御していると報告されている[41]。PrPCは30-35kDaの糖タンパク質で、208個のアミノ酸残基を含む。N末端には、8残基の配列-PHGGGWGQ-の複数のタンデムコピーからなるオクタリピートドメインがあり、このオクタリピートドメインは4つの金属イオン(Cu2+、Zn2+、および他の2価のイオンを含む)と結合することができ、他の2つのヒスチジン残基、His96とHis111は2つの金属イオンと結合することができる[104]。PrPノックアウトマウスの脳内のCu濃度は、野生型マウスと比較して低下した[105]。PrPCはCu/Znスーパーオキシドジスムターゼ(Cu/Zn SOD)として酸化ストレスに対する防御的役割を持っている[106]。
また、Zn2+はPrPと結合しており、CuのPrPCへの結合に影響を与える可能性がある。さらに、プリオン遺伝子とZIPトランスポーターをコードする遺伝子は進化的に配列の類似性を持っている[107]。Wattらは、PrPCが「Znセンサー」として作用し、AMPA受容体と結合することでニューロンへのZnの取り込みを促進するという仮説を立てた[108]。
5.2. カルノシンとPrPScによる神経毒性
正常なPrPCは、Cuホメオスタシスの調節や抗酸化作用などの調節機能や神経保護機能を持っている。したがって、PrPScに変換することで保護機能が失われると、神経変性につながる。一方、PrPScには神経毒性がある。PrPScは感染性が強いため、完全長プリオン蛋白質を用いることは困難である[109]。PrPScの神経毒性の研究では、PrPのβシート形成、神経毒性、金属結合能などPrPScと類似した性質を持つPrPの合成断片ペプチド(PrP106-126)を用いてきた。
ラット海馬初代培養ニューロンとチオフラビンT(ThT)蛍光法を用いた結果、PrP106-126は「老化」過程(37℃で数日間培養)でβシート構造を形成し、老化したPrP106-126は有意な神経毒性を示すことが明らかになった。これらの特性は、アミロイドβタンパク質[22]と非常に類似している。Zn2+またはCu2+のいずれかは、PrP106-126の神経毒性を有意に減衰させる。さらに、Zn2+またはCu2+のいずれかは、チオフラビンT蛍光および原子間力顕微鏡観察によって観察される老化過程におけるPrP106-126のオリゴマー化を阻害する。
クリオキノールやデフェロキサミンなどのキレート剤はPrP106-126の神経毒性に影響を与えなかったが、カルノシンはPrP106-126の神経毒性を減衰させ、オリゴマー化を阻害することがわかった(図7)。したがって、カルノシンがPrP106-126の抗架橋剤として作用している可能性がある。また、カルノシンは、DLBやパーキンソン病[110]の主役であるα-シヌクレインのオリゴマー化を阻害し、水晶体のα-結晶化を阻害する[111]。この点、カルノシンのこれらの疾患に対する保護機能には、カルノシンの抗架橋活性が重要である。
図7 PrP106-126の神経毒性およびコンフォメーション変化に対するカルノシンの効果
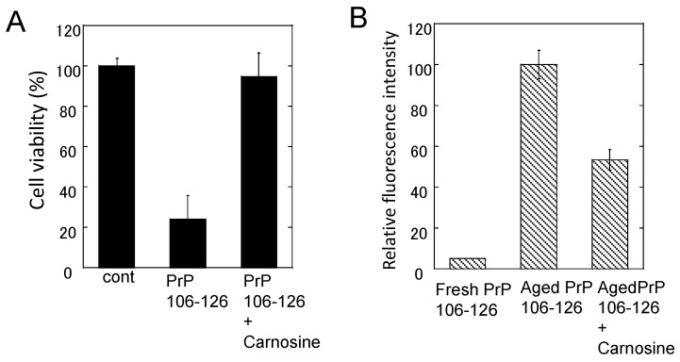
A)PrP106-126の神経毒性に対するカルノシンの効果。培養ラット海馬ニューロンの生存率を、50μMのPrP106-126を単独または1mMのカルノシンで熟成させたものに3日間曝露した後、乳酸脱水素酵素(LDH)法を用いて分析した。データは、平均±S.E.M.(n = 6)として示されている;(B)PrP106-126のチオフラビンT(ThT)蛍光に対するカルノシンの効果。25μMの新鮮なPrP106-126または1mMのカルノシンで熟成させたPrP106-126のThT蛍光(ex. 490 nm, em. 520 nm)を分析した。データは、平均±S.E.M.(n = 7)として示されている。
6. シナプスにおける金属とアミロイド原性タンパク質のクロストーク
6.1. シナプスにおけるAPPとPrPのコロケーション
シナプスは小さいながらも、神経ネットワークにおける情報処理や記憶形成に重要なノードである。シナプスの可塑性は記憶形成に不可欠であるため、多くの神経変性疾患ではシナプス変性が主に見られる。前節で述べたように、金属(Zn2+やCu2+)や神経伝達物質は、シナプス小胞からシナプス裂け目に共放出される。これらはシナプス後の密度で受容体に結合する。
APPとPrPCという2つのアミロイド原性タンパク質はシナプスに局在し、金属の恒常性の調節に重要な役割を果たしている。APPはシナプス前領域に存在し、アミロイドβタンパク質はニューロン刺激の存在下でシナプス裂け目に分泌される[112]。PrPCはシナプス後膜のグルタミン酸受容体に結合している[113]。シナプス裂け目(約20nm)を横切る短い距離を考えると、APPはかなりの量のZn2+とCu2+に囲まれたこの小さなコンパートメントでPrPCと相互作用することができる。実際、PrPCはアミロイドβタンパク質オリゴマーに結合し、その神経毒性を減衰させることが報告されている。
APPとPrPCが調節する金属の恒常性が乱れると、シナプスの変性を誘発し、神経変性を引き起こし、最終的にはこれらの疾患の発症につながると考えられる。また、ZnT-1はシナプス後膜に局在し、細胞外コンパートメントへのZnの流出を促進することでZnのホメオスタシスを制御している[114]。また、ZnT-1はNMDA型グルタミン酸受容体の活性を調節する。一方、PrPCは、シナプスのZn2+レベルを調節するAMPA型グルタミン酸受容体とともに、ZIPトランスポーターのアナログとして細胞へのZn2+流入を制御する。MT-3,脳特異的メタロチオネインもまた、シナプスにおけるZnの恒常性を調節する可能性がある[115]。さらに、MT-3は、アルツハイマー病患者の脳では減少している[116]。
6.2. カルノシン シナプスにおける Zn と Cu の調節因子
嗅球では、嗅覚細胞の細胞内での金属の恒常性を調節するために、カルノシンが重要な役割を果たしている。嗅球中のカルノシン濃度は0.5 mMと高い[18]。カルノシンとホモカルノシンはグリア細胞で合成され、アストロサイトやオリゴデンドロサイトではカルノシン様免疫反応が観察された[117]。カルノシンは、グルタミン酸によってオリゴデンドロサイトからシナプス間隙にZn依存的に分泌されることが報告されている[36,118]。したがって、カルノシンはシナプスでのZnの利用可能性に寄与し、Znの恒常性を制御し、したがって、様々な神経変性疾患に対する幅広い保護を提供することが示唆されている。図8は、シナプスにおけるカルノシン、APP、PrP、Zn、Cuの相互作用を仮想的に示した図である。
図8 シナプスにおけるカルノシン、金属、APP、PrPの間のクロストーク
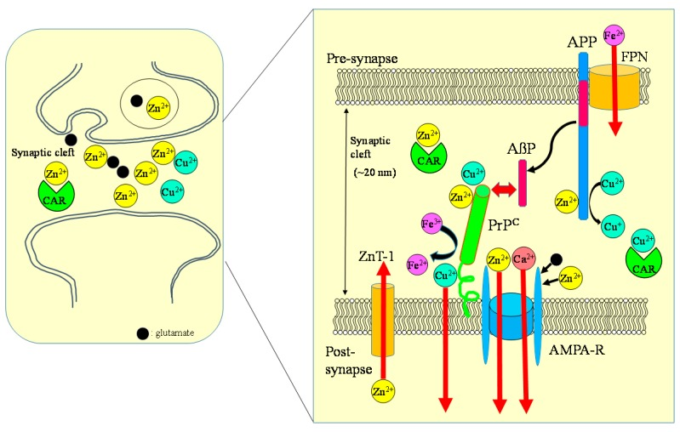
Zn、Cu、グルタミン酸はシナプス小胞に蓄積され、神経細胞の興奮時にシナプス裂け目に放出される。通常の生理的条件下では、APPはCuと結合し、Cu2+をCu+に還元することでCuレベルを調節する。正常なプリオンタンパク質のアイソフォームPrPCは、そのN末端ドメインでCuと結合し、シナプスのCuレベルを調節している。PrPCはAPPやNMDA型グルタミン酸受容体にCuを供給し、それによってアミロイドβタンパク質の産生や神経細胞の興奮性に影響を与えている可能性がある。APPとPrPCの両方がCu誘導毒性を減衰させることが報告されている。PrPCはまた、ZIPトランスポーターのアナログとして細胞内へのZn2+の流入を制御し、AMPA型グルタミン酸受容体はシナプスのZn2+レベルを調節している。ZnT-1は、NMDA型グルタミン酸受容体を発現するシナプス後膜に局在し、Znの恒常性を調節する。APPはフェルロポーチン(FPN)と結合し、Fe2+の排出を制御する。対照的に、PrPCはフェリレダクターゼとして作用し、シナプス内のFe2+/Fe3+比を調節する。Fe2+イオンは、神経伝達物質合成酵素を含む酵素また、FeレベルはAPPの発現を制御している。カルノシンがZn2+とCu2+に結合し、これらの金属の恒常性を調節していることはもっともらしい。
ZnT-1:亜鉛トランスポーター1,NMDA-R:NMDA型グルタミン酸受容体、MT-3:メタロチオネイン3,CAR:カルノシン。
7. 食品中のカルノシン
カルノシンの有益で神経保護的な役割を考えると、様々な神経変性疾患の予防のために、カルノシンの栄養補給が重要になる可能性がある。カルノシン/アンセリンの補給は、ADモデルマウス[119]や高齢者[120]の認知機能低下を改善する。カルノシンを経口投与すると、脳内のカルノシン濃度が上昇することがある[121]。さらに、カルノシン量は年齢に依存して減少する[122]。
したがって、食品中のカルノシンの定量分析は、サプリメント療法の開発に不可欠である。この目的のために、HPLCを用いて様々な食品中のカルノシンとアンセリンを分析する便利なシステムを確立した[123,124]。しかし、カルノシンとその類縁体は親水性が高く、ODS カラムでは保持されないため、通常のペプチド分析に用いられる従来のオクタデシルシリル(ODS)カラムを用いた逆相 HPLC ではカルノシンとアンセリンを分離することが困難であった。そこで、多孔性グラファイトカーボンを含むカーボンカラム(Hypercarb™カラム;Thermo Electron Corp. 標準的なカルノシンおよびアンセリンの典型的なクロマトグラムを図9Aに示す。これらの条件では、カルノシンは5.7分で、アンセリンは7.3分で出現した。カルノシンおよびアンセリンを検出するために、215nmでの吸光度を測定するために、従来のUV分光法を使用した。鶏胸肉及び豚肩肉の水抽出物を95℃で30分間加熱してタンパク質を還元除去した後の代表的なクロマトグラムを図9B,Cに示す。この単純な前処理後のカルノシンの回収率は98.8±6.6%、アンセリンの回収率は99.4±1.8%であった。
図9 本研究で調べた食品抽出物の代表的なクロマトグラム
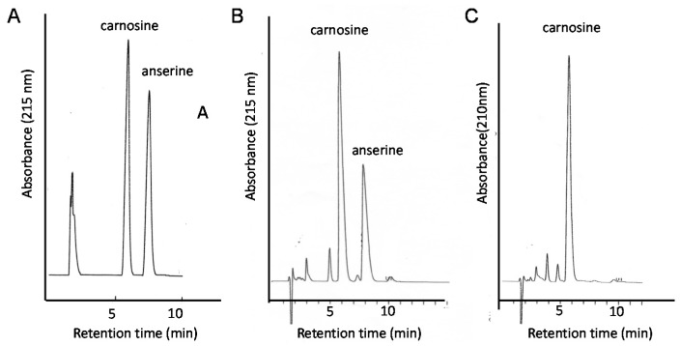
カルノシンとアンセリンの標準溶液(A)鶏胸肉の抽出物(B)または豚肉の抽出物(C)をカーボンカラムを備えたHPLCシステムに適用した。溶離液。0.05% TFAおよび7% CH3CN;流量。1.0 mL/minとした。215nmでの吸光度を観察した。
この方法を用いて、食品抽出物中のカルノシンおよびアンセリンのレベルを調べた(図10)。この結果から、筋肉中には比較的高濃度のカルノシンが存在することが示唆された。例えば、鶏の筋肉(胸部)1gには2.16±0.67mg/g(すなわち、約1mM)のカルノシンが含まれていた。カルノシンとアンセリンの濃度は種によって異なり、様々な地域で変化した。これらの結果は、先行研究[18]と一致している。
図10 各種食品中のカルノシンとアンセリンの量
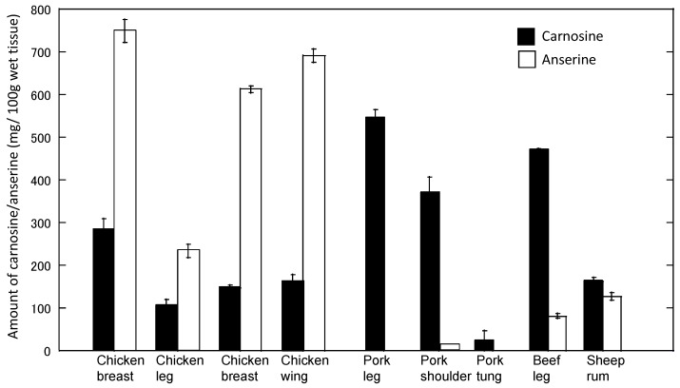
各種食品の水溶性抽出物のカルノシンとアンセリンの量をHPLCで分析した。データは平均値±S.E.M.(n = 3)で表した。
さらに、サラブレッド馬の筋肉中のカルノシン量を分析したところ、5つの筋肉組織(橈骨屈筋、上腕三頭筋分岐筋、咬筋、中臀筋、胸鎖乳突筋)の中で、大臀筋正中筋が最もカルノシンの濃度が高いことがわかった。大臀筋正中筋はIIa型筋に多く、主に高強度運動に使用されることを考えると、カルノシンは高強度運動に不可欠な役割を果たしている可能性がある。実際、国際スポーツ栄養学会[125]が結論づけたように、β-アラニンの補給は筋肉のカルノシン濃度を上昇させ、運動パフォーマンスを向上させると報告されている。
8. 結論と今後の展望
Zn は、アルツハイマー病、老人性痴呆症、プリオン病などの神経変性疾患の発症に重要な役割を果たしている。アルツハイマー病や老人性痴呆症では、Znは神経毒性の増強剤として、また保護剤として作用するが、Znキレート剤であるカルノシンは、抗ERストレス作用、抗酸化作用、抗クロスリンク作用など多くの有益な特性を有しているため、これらの疾患では神経保護剤として作用している可能性がある。さらに、水溶性、熱不活性、非毒性であることなどのカルノシンの特性は、それが健康のために有益な良い神経保護栄養素になる。このようなカルノシンの有益な特性を考慮すると、食品中のカルノシンが亜鉛の恒常性調節や神経変性疾患の予防に重要な役割を果たしていることから、カルノシンまたはその成分を含む栄養補助食品が健康に有用になる可能性がある。カルノシンの神経毒性予防の分子機構については、さらなる研究が必要とされている。
