Contents
pubmed.ncbi.nlm.nih.gov/36921857/
Tritium: Its relevance, sources and impacts on non-human biota
ハイライト
- トリチウム(3H)の排出量は、原子力プロセスの拡大により、さらに増加する可能性がある。
- 3Hは環境と生物学的システムに速やかに統合される。
- 非ヒト生物相における3Hの供給源、特性および影響について批判的に検討した。
- 生物相での研究は二枚貝、魚類、げっ歯類に傾いている。
- 3Hの影響をより包括的に評価するために必要な統合的アプローチ。
要旨
トリチウム(3H)は、原子力産業から大量に放出される水素の放射性同位体 である。トリチウムは環境中およびあらゆる生物系において極めて移動性が高く、ヒトおよびヒト以外の生物相(生物相)の健康に対する懸念が高まっている。本総説では、環境中のトリチウムの発生源と特徴を検討し、生物相における生物学的組織のさまざまなレベルにおけるトリチウムの生物学的影響に関する利用可能な情報を評価する。
トリチウムの放射線生物学分野での発表数は増加しているが、異なる分類群や種で利用可能なデータの間には大きな格差があり、観察結果は海産二枚貝、魚類、哺乳類(げっ歯類)に大きく偏っている。さらに、実験室と比較して野外での情報が乏しいこと、トリチウム水(HTO)以外の形態のトリチウムを用いた研究がないことが制約となっている。
このような制約の中で、分子レベルから行動レベルに至るまで、トリチウム水被ばくに対するさまざまな反応が初期のライフステージで報告されているが、潜在的な世代を超えた影響については不明である。
急速に発展している「オミックス」技術を応用すれば、このような知識のギャップを埋め、放射線に特異的な有害結果経路(AOPs)を開発することによって、分子レベルと生物レベルの反応の関係をさらに解明することができる。
より多様な基幹生物種を用い、複数のストレス因子に暴露することで、その他の新たな影響(バイスタンダー効果、生殖細胞系列効果、世代交代効果、エピジェネティック効果など)を解明することで、放射性核種の環境リスク評価を改善する機会がもたらされる。これらは、機械学習(ML)を含む人工知能(AI)や生態系ベースのアプローチと組み合わせることができる。
グラフィカル要旨
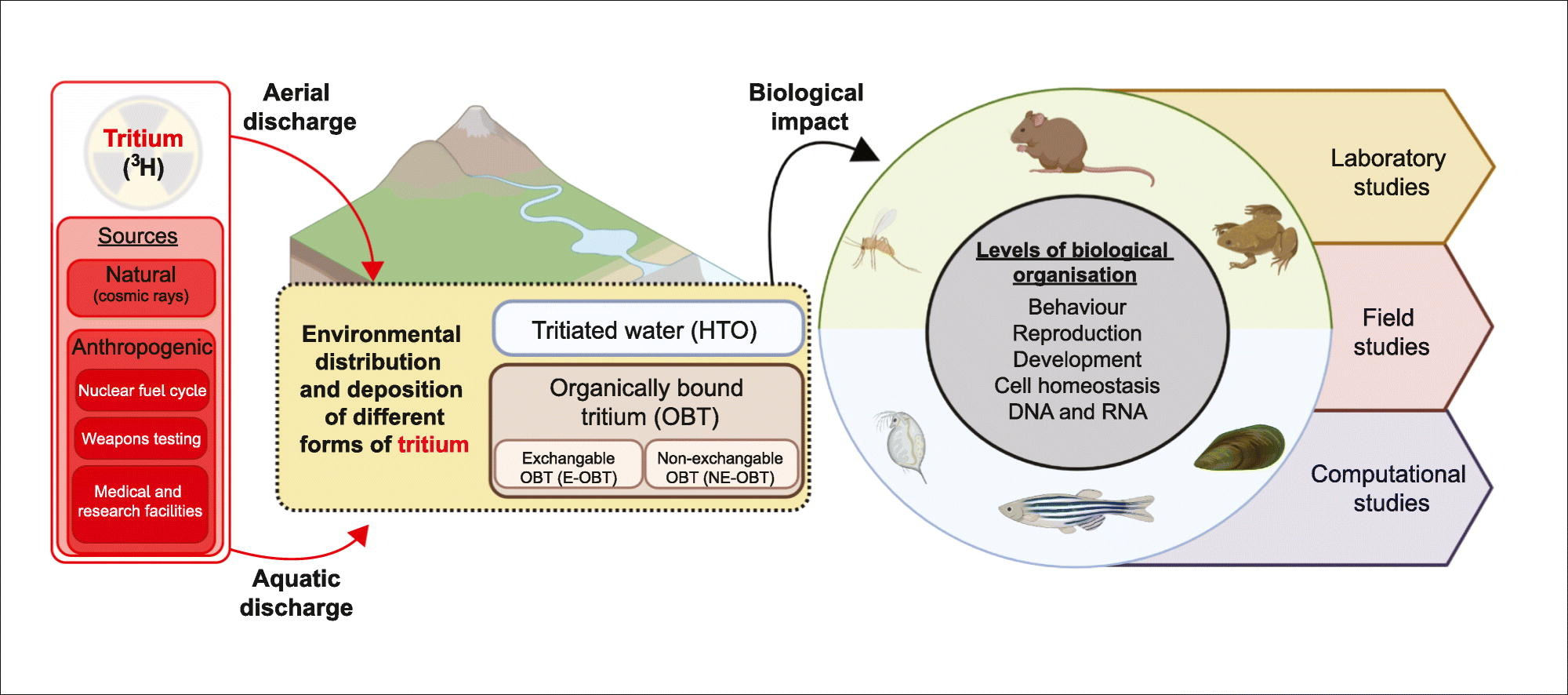
キーワード
原子力 トリチウム (3H) トリチウム水(HTO) 環境 放射線量 毒性 リスク評価
1.はじめに
水素の放射性同位体であるトリチウム(3H)(物理的半減期:12.3)は、大気中の宇宙線誘起核反応の作用から自然に発生するが(Oms et al., s19;Synzynys et al., s18)、人為起源の方が環境中に寄与する割合が大きい(Kim et al., m19;Nie et al., e21;Péron et al., n16)。人為起源発生源には、核分裂 炉と廃炉(解体や使用済み燃料の 再処理を含む )、過去の核兵器実験(1960年代初頭まで)、2011年の福島原発事故(ジャー, 2021 )などの原子力事故、トリチウム生産施設、医療・研究施設などが含まれる(Fiévet et al.)近い将来、新しい原子炉(例:欧州加圧原子炉)の導入や国際熱核融合実験炉の開発により、トリチウムの放出が増加すると予想されている(Larsen and Babineau, 2020;Rety et al.)
他の放射性核種に比べ、トリチウムは原子力部門から環境中に大量に放出される。例えば、1979年から1988年にかけて実施された放射性物質の液体排出の歴史的傾向の概観によると、英国のさまざまな原子力施設からの3Hの排出量は、1986年から1987年にかけて、ピーク値820 TBq ≃で10倍に増加した(McCubbin et al.)
中国のように原子力の重要性と利用が拡大している国では、原子力発電所(NPP)が1993年から2009年の間に平均137TBqy-1のトリチウム水を排出した(Dallas et al.)2005年から2008年の間、英仏海峡/アイリッシュ海に放出している2つのNFRP(すなわち、英国のセラフィールドとフランスのラ・アーグ)は、液体3Hを↪Sm_22000~10000TBqy-1排出した。トリチウム(3H)の高濃度は、イギリスのカーディフ湾や日本の福島第一原発での事故放出の結果、イギリスのセヴァーン河口の堆積物中や生物相の異なる栄養段階でも報告されている(McCubbin他 2001)(Bezhenar他、2021;Fiévet他、2013;Povinec他、2013)。
環境中に入ると、トリチウムは酸素と反応し、トリチウム水(HTO)として生物圏の数多くのサイクルに速やかに組み込まれる(図1)。その化学的特性により、生物系では極めて移動性が高く(Bay et al., 2020;Hanslík et al., 2017;Larsen and Babineau, 2020)、生物圏のすべての水素化分子と関連する水に含まれる可能性がある(Ducros et al., 2018;Eyrolle et al.)トリチウムは組織中に3つの形態で存在する:(i)組織自由水トリチウム(TFWT)、および(ii)交換可能な有機結合トリチウム(E-OBT)として組織中の酸素原子および窒素原子と結合している場合、および(iii)非交換可能な有機結合トリチウム(NE-OBT)として組織中の炭素原子と結合している場合(Baumgaertner et al., r09;Jaeschke et al., e11;Nie et al., e21)。
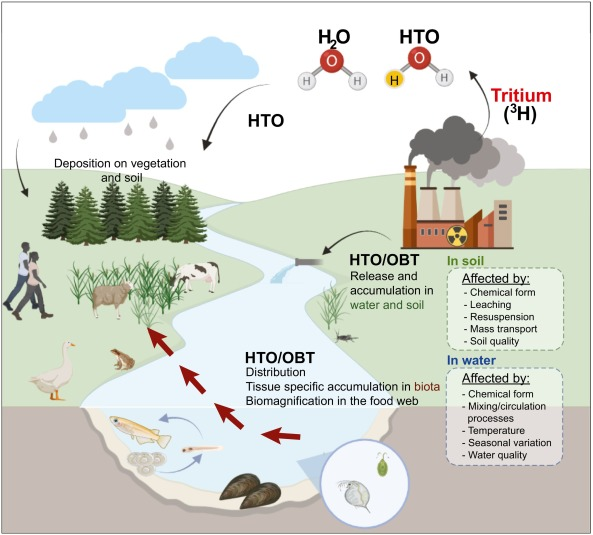
図1トリチウムの発生源、環境中の輸送と拡散。BioRender.comで 作成
一般に、E-OBTはTFWTと非常に速く平衡化し、それ自体が周囲の環境の水分子と平衡になることが認められている。NE-OBTの代謝は、ほとんどの場合、トリチウム化有機分子の性質と体内での機能に依存した速度で、トリチウム化水の生成につながる。そして、NE-OBTとしてのトリチウムは、トリチウム化された分子が異化されるまで結合したままであるため、生物学的半減期が長くなると予想される。したがって、NE-OBTはE-OBTよりも組織内で安定であり、トリチウムへの長期被ばくに関する有用な情報を提供できる(Antonova et al., 2022;Baumgaertner et al., 2009;Eyrolle et al., 2018;Jaeschke et al., 2011;Le Goff et al., 2014)。トリチウムの持続的かつ将来的な排出量の増加と、環境のさまざまな区画におけるトリチウムの特異な挙動を考えると、トリチウムはヒトとヒト以外の生物相(生物相)の両方の健康に対する懸念が高まっている。しかし、ヒトの研究と比較して、生物相におけるトリチウムの特性についてはほとんど知られていない(Beresford et al., 2008;Tornero and Hanke, 2016)。このような背景から、本レビューでは、生物相中のトリチウムの発生源、環境との関連性、生物学的影響に関する利用可能な文献を批判的に分析することを目的とする。また、将来のトリチウム研究のための知識ギャップを明らかにすることも目的とする。
文献調査は、Google scholar、ScienceDirect、PubMedで、「トリチウム放射線」、「トリチウム線源」、「核分裂エネルギー」、「トリチウム効果」、「トリチウム線量測定」、「環境中のトリチウム」、「生物相中のトリチウム」、「トリチウム水」、「有機結合トリチウム」、およびそれらの組み合わせを含むキーワードとキーフレーズで検索した。生物相に関する研究は、計算論的研究、フィールド研究、実験室ベースの研究によって分類された。報告された影響は、被ばく量(急性か慢性か)、分類群、生物学的組織レベルに従ってグループ分けされた。
本稿の目的は、植物集団におけるトリチウムを含む放射性核種の運命に関する文献をレビューすることではない。電離放射線の影響に関する徹底的なレビューはすでに入手可能である(Boyer et al., 2009;Caplin and Willey, 2018;Mousseau and Møller, 2020)。
2.環境中のトリチウム
大気中に存在するトリチウムの約99 %がトリチウム水の形態であることを考慮すると、蒸気交換、降水、河川流出を通じて海洋に急速に流入することが予想される(Liger et al.)水生環境中のトリチウム濃度は、緯度、季節、都市化や原子力施設に近いかどうかによって異なる(Ansari et al., 2018;Chae and Kim, 2018;Harms et al., 2016)。図2は、1996年から2016年までのトリチウムの世界平均濃度と北半球と南半球の分布を示している(Oms et al, 2019;UNSCEAR, 2016)。世界の原子炉の半分以上は北米と西ヨーロッパにあり、発展途上国の原子炉は10%未満である(Adamantiades and Kessides, 2009;Oms et al.
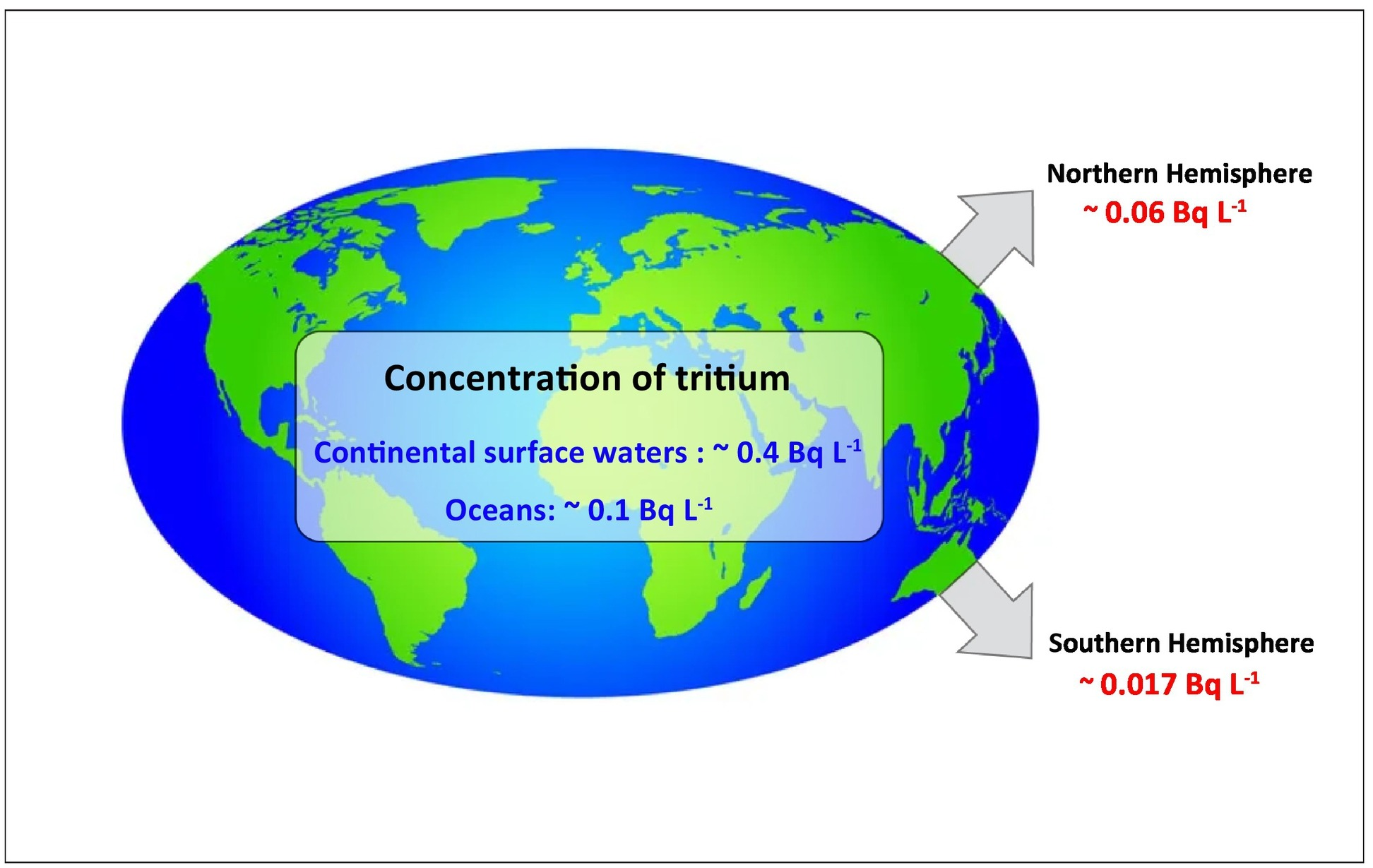
図2水中のトリチウムの世界分布(UNSCEAR, 2016;Oms et al.)
カナダでは、国内最大の原子炉のうち3基が五大湖畔に位置している。最大レベルのトリチウムはオンタリオ湖の北岸で報告され、その濃度(8.4 Bq L-1)は沖合水域(3.5 BqL-1)の2倍以上であった(Dove et al.)フランスでは、非核化沿岸河川で約3~4 Bq L-1のトリチウム濃度が報告されたが、原子力施設が密集しているローヌ川では、濃度は2.50~12.85 Bq L-1の間を変動し、平均は6.31 BqL-1であった(Jean-Baptiste et al.)核兵器材料製造施設からの汚染された廃液を受け入れた地域である米国のFourmile Branchでは、汚染された小川に隣接する池の水中のトリチウム濃度は1570~1920 Bq L-1で、平均濃度(1790 Bq L-1)は、小川の上空で測定された平均濃度(70 BqL-1)の約20倍であった(Yu et al., 2020)。
水生環境中のトリチウムの存在を制限しようとするさまざまな規制が存在する。表1は、飲料水に関する非常に多様な規制値を示しており、表2は、原子力施設が密集している地域のトリチウムレベルと、原子力施設の水系排出に関するサイト固有の規制値を示している。トリチウムの排出については、人の健康を守るための規制値がある一方で、生物相を保護するための規制値はまだ十分に定義されていない(Andersson et al.)
表1飲料水中のトリチウム規制値(BqL-1)は、さまざまな機関や国によって提案されている。カナダ原子力安全委員会 2008)より引用。
| 組織/国 | トリチウム濃度限度(BqL-1) |
|---|---|
| カナダ原子力安全委員会 | 7000 |
| 米国環境保護庁 | 740 |
| 世界保健機関 | 10,000 |
| オーストラリア | 76,100 |
| カナダ | 7000 |
| EU | 10,000a |
| フィンランド | 30,000 |
| ロシア | 7700 |
| スイス | 10,000 |
| 米国 | 740 |
- a EU委員会は放射能に関する要求事項を義務化せず、あくまで指標とした。トリチウムは、100 BqL-1という指標パラメータ値として引用された。100 Bq L-1というパラメータは、事実上スクリーニング値であり、環境中に排出される他の、潜在的により有害な人工放射性核種の存在の可能性を示すものである。トリチウム濃度と総指標線量はどちらも、超過した場合に潜在的な放射線学的問題を示すという同様の位置づけであり、限界値とみなされるべきではない。
表2原子力施設が密集している地域におけるトリチウムの平均濃度(BqL-1)、およびトリチウムの水系排出に対して設定されたサイト固有の制限値(Bq年-1)。ダーリントンダーリントン:重水減速冷却炉、ハートプール:原子力発電所、ラヘーグ:燃料再処理工場、オルキルオトおよびロヴィイサ:原子力発電所原子炉、セラフィールド:燃料再処理工場、ウォルソン:加圧重水原子炉。
| 所在地 | 原子力施設が密集する地域のトリチウム(BqL-1) | 参考文献 |
|---|---|---|
| フルマイル支店(米国) | 1790 | (Yu et al., u20) |
| オンタリオ湖(カナダ) | 4.76 | (Dove et al., e21)。 |
| ローヌ川 | 6.31 | (Jean-Baptiste et al.) |
| 所在地 | 原子力施設のサイト別基準値(Bq年-1) | 参考文献 |
| ダーリントン(カナダ) | 4.3 × 10^18 | (カナダ原子力安全委員会、2012) |
| ハートレプール(英国) | 1 × 10^13 | (RIFE、2019) |
| ロヴィーサ(リトアニア) | 1.50 × 10^14 | (Masionis et al., 2008) |
| ラ・ハーグ(フランス) | 1.85 × 10^16 | (シュナイダーとマリニャック 2008)。 |
| オルキルオト(リトアニア) | 1.83 × 10^13 | (Masionis et al., 2008) |
| セラフィールド(英国) | 1.8 × 10^16 | (RIFE、2019) |
| ウォルソン(韓国) | 3.48 × 10^14 | (Feng and Zhuo, 2022)。 |
水生生物相では、呼吸と浸透圧調節プロセスによる水収支の調節により、トリチウム水と水の平衡は1日以内に達成される(Calmon and Garnier-Laplace, 2001)。OBTについては、主にトリチウム化された食物の摂取によって取り込まれると考えられている。水生生物相におけるOBT濃度は、生態系における有機トリチウムのさまざまな物理化学的形態(溶存有機分子、砕屑有機粒子または新鮮有機粒子、微細技術粒子など)の存在に影響される。これらの形態は異なる起源(自生/全生)を持ち、異なる取り込み経路と移行速度を持つため、生物中のOBT濃度は周囲の環境によって変化すると予想される(Baburajan et al., n20;Eyrolle et al., e18;Nie et al., e21)。しかし、OBTの異なる物理化学的形態の挙動や生物相におけるその結果に関する知識は限られており、むしろ時代遅れである(Eyrolle et al., e18)。これまでの研究ではさらに、食物連鎖を介して人間の健康にも脅威を与える可能性のあるトリチウムの自然生物相への影響について、よりエビデンスに基づいた評価が必要であることが強調されている(Galeriu et al., 2008;McCubbin et al., 2001;Melintescu et al., 2011;Zhao et al.)
陸上動物では、トリチウム水は汚染された水から飲料や食物に取り込まれ、有機分子の異化によって生成される。動物はまた、トリチウム化された食物を摂取することで、OBTを組織や体液に取り込むことができる。組織・器官の乾物中への滞留時間と取り込みは、一般に構成分子と貯蔵分子の方が水よりも高い(Le Goff et al., 2014;Takeda, 1991)。これまでの研究では、土壌(Thompson et al., 2015)や水生表層堆積物(Eyrolle-Boyer et al., 2014;Eyrolle et al., 2019)など、有機物が保存されている一部の貯留層におけるOBTも報告されており、OBTストックの水循環や生物への移行が懸念されている(Galeriu et al., 2008;Ota et al., 2017)。
環境中の放射性核種の生物学的利用 能と動態に関する情報を得るためには、放射線汚染の歴史がある地域に生息する陸生野生生物の評価が重要である(Cleary et al., 2021;Kelsey-Wall et al.)しかし、この点で利用可能なデータは少なく(Beresford et al., 2016;Kelsey-Wall et al., 2005)、そのギャップを埋めるために実験室ベースの研究がしばしば採用されている(Galeriu et al., 2005a,Galeriu et al., 2005b;Melintescu and Galeriu, 2011)。過去数十年の間に、環境や動植物組織を介したトリチウムの移動を予測・計算することを目的とした、計算による評価や移行モデルが開発されてきた(Dallas et al., 2016b;Galeriu et al., 2005a,Galeriu et al., 2005b;Keum et al., 2006;Nie et al., 2021;Vives et al., 2022)(図3)。野生生物の放射線被ばくを評価するモデルは、系統的に異なる生物を研究する際の精度を向上させるために、生物相のOBT-トリチウム水データが有益であろう(Kim et al.)これにより、生物濃縮や取り込みに対する空間的・時間的影響や、潜在的な種特異的影響の比較も可能になるであろう(Beresford et al., 2016;Kim et al., 2013a)。

図31955年から2022年までに発表されたトリチウムの生物相への影響を評価した論文。英訳がない論文は除外した。
3.線量率のベンチマーク、規制値、非ヒト生物相の生物蓄積性
他の放射性核種と同様に、生物相はトリチウムに外部被ばくおよび/または内部被ばくする可能性がある(Goodhead他 2004;Melintescu and Galeriu. 2011)。そのため、環境リスク評価(ERA)や環境保護を改善するためには、観察された影響に関連付けられうる吸収放射線量を正確に決定することが重要である(Adam-Guillermin et al.)物理的、生物学的、臨床的線量評価が確立されているヒトの健康とは対照的に、生物相における放射線量の推定は非常に限定的であり、主に個人や集団のリスクが最小となる状況を除外することを目的とした取り組みが行われている(Andersson et al.)
表3は、ERAを改善するために様々な機関が提唱しているスクリーニング値である。原子放射線の影響に関する国連科学委員会(UNSCEAR, 2008)は、最も被ばく量の多い生物に対する慢性線量率が100μGyh-1未満であれば、ほとんどの陸上脊椎動物群に重大な影響を及ぼす可能性は低いと提案している。したがって、欧州連合のコンソーシアムプロジェクトであるERICAとPROTECTは、一般的な(全種)「影響なし」線量率を10μGy h-1と提案している(Andersson他 2008、Andersson他 2009;Beresford他 2004)。PROTECTプロジェクトはまた、無脊椎動物については200μGy h-1、脊椎動物については2μGyh-1という暫定的な線量率ベンチマークを提案した(Andersson et al.しかし、異なる生物群について利用可能なデータ数が少ないこと(Real and Garnier-Laplace. 2020)や、同じ門内であっても異なる形態のトリチウムの蓄積と生物変換に違いがあることが報告されていることから、この値の頑健性が疑問視されている(Beresford et al., d16;Jaeschke and Bradshaw. 2013;Kim et al., m13a)。JaeschkeとBradshaw(2013)は、同じ濃度のトリチウム水に暴露した後、2つの植物プランクトン種間で放射能濃度に格差があることを観察し、トリチウム化植物プランクトンを摂取した結果、二枚貝の組織に測定可能なトリチウムが取り込まれたことを示し、食物連鎖上への移行と濃縮を示唆した。Fiévetら(2013)は、海水のトリチウム水、生物相のトリチウム水、OBTの間のトリチウムのターンオーバーの動態を研究した。2つの藻類と軟体動物のトリチウム水は海水トリチウム水と迅速な交換を示したが、トリチウム水と生物全体のOBTの間の全体的なトリチウムのターンオーバーは、トリチウムの生物学的半減期が数ヶ月のオーダーの遅いプロセスであるように見えた。イガイを用いた研究では、Yankovichら(2011)も、OBT動態の速度の違いに対応する、遅いOBTコンパートメントと速いOBTコンパートメントの可能性を示唆している。特に、生殖過程と組織コンパートメントを考慮したモデルが、最良のOBT予測をもたらした。
表3多様な生物群を保護するために、様々な組織や指令が提唱している数値スクリーニング値(μGyh-1)。
| 空のセル | 水生生物 | 陸上生物 | 参考文献 | ||
|---|---|---|---|---|---|
| 空のセル | 淡水 | マリン | 無脊椎動物 | 脊椎動物 | 空のセル |
| エリカ | 10 | 10 | 10 | 10 | (Beresford et al.) |
| ファセット | 100 | 100 | 100 | 100 | (ラーション 2004) |
| IAEA | 400 | 40 | 40 | (IAEA、1992) | |
| 国際放射線防護委員会 | 4-40b、40-400c | 400-4000D、40-400E | 400-4000g | 4-40h | (ICRP, 2008) |
| エヌシーアールピー | 400 | 400 | (テンプルトン他、1991) | ||
| プロテクト | 2;200f | 2;200f | 200 | 2 | (Andersson et al.) |
| UNSCEAR | 400 | 100 | (unscear, 2008) | ||
NCRP=National Council on Radiation Protection、IAEA=International Atomic Energy Agency、FASSET=Framework for ASSessment of Environmental impacT、ICRP=International Commission on Radiological Protection、UNSCEAR=United Nations Scientific Committee on Effects of Atomic Radiation。ERICAプロジェクト=電離汚染物質による環境リスク:PROTECT project = 規制的文脈における電離放射線からの環境保護。
- a 範囲値は線量限度としてではなく、状況を評価することが正当化される線量率として見なされることを意図している。
- b 基準となるカエルの線量レベル。
- c 基準淡水魚(マス)の線量レベル。
- d 基準カニの線量レベル。
- e 基準となる海産魚(ヒラメ)の線量レベル。
- f 脊椎動物(2μGy h-1)と無脊椎動物(200μGy h-1)の線量レベル。
- g 基準となるハチとミミズの線量レベル。
- h 基準シカ、ラット、アヒルの線量レベル。
他の種類の汚染物質と同様に、重要な懸念は組織特異的蓄積であり、これは放射線量、ひいてはリスク評価に影響を及ぼす。例えばラットでは、トリチウム水の単回経口投与により、トリチウムが組織間に迅速かつ均一に分布することが示された(Lee et al., e19)。この研究では、3.7 × 10^-4Bq トリチウム水に被曝したラットの7日後と13日後、および3.7 × 10^5Bq トリチウム水に被曝したラットの17日後に、OBTおよび組織非含有トリチウム水濃度(Bq g-1、湿試料と乾燥試料の両方)は、異なる組織(心臓、肺、肝臓、生殖腺など)間で有意差を示さなかった(Lee et al.)ラットにトリチウム水(体重1gあたり3.7× 10^3Bq)を単回経口投与した後、1日目、3日目、5日目のOBT(湿試料、乾燥試料ともにBqg-1)について、組織特異的分析で同様の結果が得られた(Takeda et al., a85)。しかし、トリチウム化小麦(体重1g当たり0.074× 10^3Bq)に暴露したラットでは、組織間のOBT(Bqg-1、湿乾試料とも)の分布は均一ではなく、トリチウム化小麦摂取後の尿や糞便として排泄されるトリチウムはトリチウム水よりも少なかった(武田ら、1985)。これらの観察結果は、トリチウム水とトリチウム標識食品に慢性的に暴露したラットを用いた比較生物動態学的研究の結果(Takeda et al.さらに、OBTの組織間分布パターンは、各トリチウム化合物の化学的または生化学的特性だけでなく、各組織の代謝活性にも依存する(Kim et al., m13a;Le Goff et al., f14;Takeda、1991;Takeda et al., a85)。
水生生物相に関しては、トリチウム水とOBT(トリチウム化アミノ酸、グリシン;T-Gly)に暴露されたイガイの組織間でトリチウム濃度が異なることが、これまでの研究で報告されている(Dallas et al., 2016a;Jaeschke et al., 2011;ジャー et al., 2005)。具体的には、トリチウム水曝露後、足、消化腺、外套膜、内転筋はエラやビサスよりもOBT活性(Bq g-1乾燥試料)が高く、すべての組織において、脱塩1日後にレベルが低下した。逆に、OBT(T-Gly)処理群では、消化腺>エラ>足>ビサス>外套膜、内転筋の順でトリチウムの生物濃縮が最大となり、すべての組織で、21日間の休眠後も対照値を大幅に上回る活性濃度を保持していた(Jaeschke et al.)ジャー ら (2005) は消化腺の濃度 (Bqg-1dry sample)が高いことを報告しており、Dallas ら (2016a)は消化腺、足、鰓の濃度が他の組織よりも高いことを観察している。魚類では、OBTを添加した餌にさらすと、トリチウム水に比べてOBT生成率が有意に高くなることが報告されている(Kim et al., m13b)。この組織中のOBT濃度は餌中のOBT濃度よりも高く、魚類が食物網を通じてOBTを摂取した場合の生物濃縮を示している。さらに、OBT濃度は筋肉よりも内臓で高く、コンパートメント化が示唆された(Kim et al., 2013b)。
生物の代謝や実験的被ばくシナリオのばらつきを考慮すると、より確固とした評価を行うためには、線量評価や生態毒性学的研究に組織特異的蓄積を加味することが推奨される(Dallas et al.)すべての種におけるトリチウム移行を研究することは不可能だが、特に食物網を介した移行の可能性を推定する場合には、主要な種や生態学的に関連する分類群(Beresford et al.)
4.実験室および野外での暴露研究
図3、図4で明らかなように、生物相中のトリチウムに関する情報のほとんどは、管理された実験室での暴露から得られている。このような暴露では、管理された再現可能な条件下で、線量と影響の関係を理解するために繰り返し試験を行うことができる(Loria et al.)生物学的反応に関与するメカニズムや、トリチウム被曝の有害な影響を覆い隠したり強めたりする可能性のある環境内要因の潜在的な相乗効果、拮抗効果、相加効果を解明することが特に重要である(Dallas etal.)とはいえ、汚染物質の生物学的影響を決定する上で、特に長期的な集団レベルの影響を研究する場合、野外研究はより環境的に現実的である(Bréchignac, 2017;Loria et al.)さらに、長期間にわたる低放射線レベルへの曝露を伴う野外研究は、潜在的な適応、組織の恒常性に関与するプロセス、および生体内濃縮を調査する機会を提供する(Beaton et al., n19;McCubbin et al., n01)。
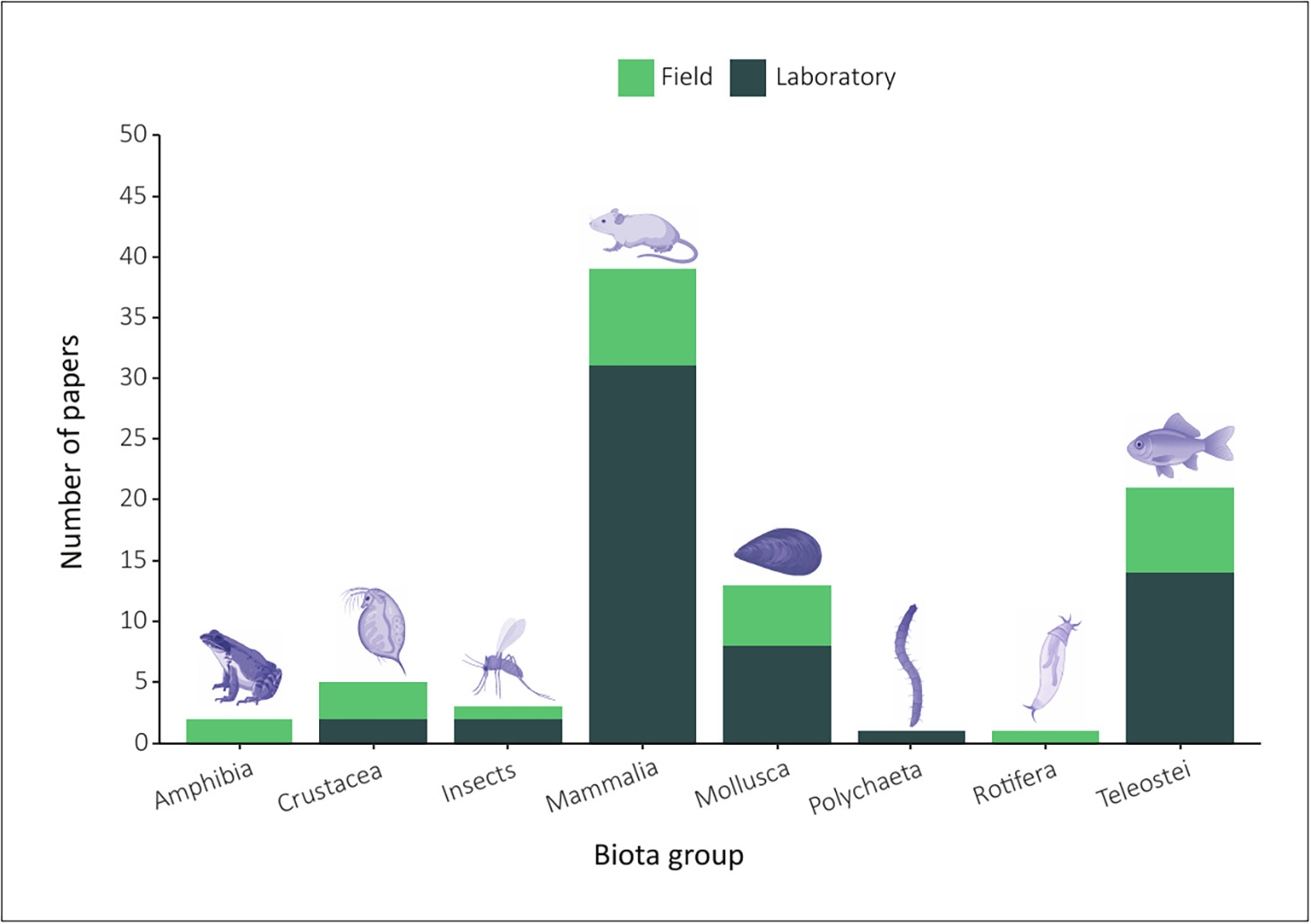
図4 1955年から2022年の間に発表された論文から、野外および実験室での研究で使用された分類群。2種以上を調査した論文は複数回カウントおよび/または分類した。
図3は、フィールド研究によるさまざまな生物のデータが入手可能であることを示しているが、これらのほとんどはトリチウムの蓄積について調査したものであり、生物相に対するトリチウムの影響について発表されたものはほとんどない(Audette-Stuart et al., t11;Beaton et al., n19;Gagnaire et al., e17)。カナダの稼働中の原子力発電所の近くで、Audette-Stuartら(2011)は、トリチウムがバックグラウンドレベルを超える地域(デューク沼、2800 Bq L-1)で採集されたカエルは、4 Gyの電離放射線を生体内で挑戦的に曝露した後、バックグラウンドレベル(214 BqL-1)の地域に生息するカエルと比較して、肝臓細胞のDNA損傷が低レベルであったと報告した。また、デューク沼で採集されたカエルの培養肝細胞に試験管内で放射線を照射したところ、放射線損傷に対する感受性の低下が観察された。著者らは、トリチウム濃度の高い地域に存在するストレスが、放射線に対する適応反応としてDNAの保護や細胞防御機構を誘導する可能性を示唆した。しかし、これらの結果は少ないサンプル数に基づいているため、さらなる研究が必要である。同じ地域の別の研究では、トリチウム被ばくが、ファットヘッドミノー魚類において、遺伝毒性、DNA修復活性、脂肪酸組成の変化、免疫・神経・抗酸化反応を誘発することが明らかになった(Gagnaire et al.)トリチウム水(12× 10^3,25× 10^3,180× 10^3Bq L-1)およびOBT(トリチウム化アミノ酸;27× 10^3Bq L-1)の勾配に魚類を慢性的に曝露した、その後の対照実験室研究では、野外現場で認められたものと同様の観察結果が報告された(Gagnaire et al., e18)。Beatonら(2019)は、実験室で暴露された魚のDNA損傷は野外で暴露された魚よりも高かったが、肝臓の酵素活性(SODやカタラーゼなど)は実験室条件下で暴露された魚の方が低かった。DNA損傷と内部移行したトリチウムとの間には、いずれの実験でも正の単調関係が認められたが、トリチウム内部濃度と酵素活性との間には相関関係は認められなかった。環境中の生物は、汚染物質の混合物や様々な変数(温度、pH、塩分など)にさらされており、酸化ストレスバイオマーカーは非特異的であることが知られている(Lourenço et al.)フィールドでの調査後に管理された実験室での実験を行う統合的アプローチは、トリチウムの挙動をよりよく理解し、現在および将来の放射線被曝の影響を評価・予測するために、トリチウム被曝に適したバイオマーカーを特定することができる(Dallas et al.)
4.1.慢性および急性暴露
他の放射性核種と同様に、トリチウムの生物学的影響を評価する際に考慮すべき重要な要素は、被曝の長さや期間である。実験室研究のレビューによると、トリチウムへの亜慢性および慢性暴露のデータは陸上生物相で優勢であるが(表4)、急性暴露は水生生物相で優勢である(表5)。急性暴露は、即時的なストレス反応を示したり、体内での汚染物質の代謝挙動を研究するモデルに応用したりするのに有用である(Giussani et al., 2020;Jaeschke and Bradshaw, 2013)。しかし、慢性暴露や低線量暴露は、バイオ モニタリングや環境リスク評価、さらには生物の適応反応に関する研究に、より適切である(Audette-Stuart et al., t11;Mothersill et al., l20;Real et al., l04)。
表4さまざまな陸生種を対象とした実験室研究で観察されたトリチウムの影響の概要 曝露レベルは、特に断りのない限り、トリチウム水の公称濃度を表す(OBTはアミノ酸に含まれる)。
| 濃度/投与量 | 期間/時間ポイント | 観測された効果 | 参考 |
|---|---|---|---|
| 昆虫-ユスリカ(世代交代型) | |||
| 9250 × 10^6BqL-1 | 20日 | トリチウム水で発育した成虫の幼虫における染色体異常。 | (ブレイロック、1971) |
| 18,500 × 10^6BqL-1 | 20日 | トリチウム水で発育した成虫の幼虫における染色体異常。 | (ブレイロック、1971) |
| 哺乳類-ムササビ | |||
| 18.5 × 10^3Bqg-1(IP注射) | 2,4、7,14日 | MN(14日目を除く)および尾部DNAの増加。2日目に白血球数と血小板数が減少。 | (李他、2021a) |
| 10 × 10^3BqL-1(トリチウム水またはOBT) | 1カ月と8カ月 | 赤血球(RBc)の減少と鉄欠乏は、OBT曝露群のすべてで1カ月後に見られた。8カ月後にはRBcが減少し、平均球状体積が増加した。 | (Bertho他、2019) |
| 1 × 10^6BqL-1(トリチウム水またはOBT) | 1カ月と8カ月 | 赤血球(RBc)の減少と鉄欠乏は、OBT曝露群のすべてで1カ月後に見られた。8カ月後にはRBcが減少し、平均球状体積が増加した。 | (Bertho他、2019) |
| 20 × 10^6BqL-1(トリチウム水またはOBT) | 1カ月と8カ月 | 赤血球(RBc)の減少と鉄欠乏は、OBT曝露群のすべてで1カ月後に見られた。8カ月後にはRBcが減少し、平均球状体積が増加した。 | (Bertho他、2019) |
| 0.01 × 10^6BqL-1(トリチウム水またはOBT) | 1カ月と8カ月 | 染色体異常なし。 | (Roch-Lefèvre他、2018)。 |
| 1 × 10^6BqL-1(トリチウム水またはOBT) | 1カ月と8カ月 | 1カ月後(トリチウム水とOBTに暴露)と8カ月後(OBTに暴露)に染色体異常が増加した。 | (Roch-Lefèvre他、2018)。 |
| 20 × 10^6BqL-1 | 1カ月と8カ月 | 1カ月後(トリチウム水とOBTに暴露)と8カ月後(OBTに暴露)に染色体異常が増加した。 | (Roch-Lefèvre他、2018)。 |
| 0.3 × 10^6BqL-1 | 15日 | 酸化ストレスの誘発はない。 | (Kelsey-Wall et al.) |
| 111 × 10^6BqL-1 | 90日、330日、500日、560日、700日 | 500,560日暴露を除く全群で染色体異常頻度が増加。 | (ブルックス他、1976)。 |
| 0.01 × 10^6BqL-1 | 1カ月と8カ月 | 脾臓重量および脾臓のDNA逆転には影響なし。 | (Bannister et al.) |
| 1 × 10^6BqL-1 | 1カ月と8カ月 | 脾臓重量および脾臓のDNA逆転には影響なし。 | (Bannister et al.) |
| 20 × 10^6BqL-1 | 1カ月と8カ月 | 脾臓重量および脾臓のDNA逆転には影響なし。 | (Bannister et al.) |
| 哺乳類-筋肉(胚) | |||
| 0.37 × 10^6BqL-1(OBT) | 96 h | 生存率の低下 | (Clerici et al., i84)。 |
| 3.7 × 10^6BqL-1(OBT) | 96 h | 生存率の低下 | (Clerici et al., i84)。 |
| 37 × 10^6BqL-1(OBT) | 96 h | 生存率の低下 | (Clerici et al., i84)。 |
| 哺乳類-ムササビ(トランスジェネレーショナル) | |||
| 100 × 10^3μGy | 56日 | 錐体細胞密度の減少。 | (孫他、1997) |
| 200 × 10^3μGy | 56日 | 錐体細胞密度の減少。 | (孫他、1997) |
| 400 × 10^3μGy | 56日 | 錐体細胞密度の減少。脳重量の減少、大脳皮質の厚さの減少。 | (孫他、1997) |
| 800 × 10^3μGy | 56日 | 錐体細胞密度の減少。脳重量の減少、大脳皮質の厚さの減少。 | (孫他、1997) |
| 0.111 × 10^9BqL-1bw IP注射 +0.074 × 10^9BqL-1TDW | 妊娠17日目から分娩まで | 1週齢、2週齢、3週齢のマウスにおける小脳の変化(プルキンエ細胞の変性と消失の観点から)。 | (Jain and Bhatia, 1996) |
| 0.011 × 10^9BqL-1bw IP注射 +0.074 × 10^9BqL-1TDW | 妊娠17日目から分娩まで | プルキンエ細胞の変性と消失という点で、小脳の損傷が激化している。 | (Jain and Bhatia, 1996) |
| 50× 10^3μGy(IP注射) | 21日 | 神経行動学的影響はない。 | (王と周、1995) |
| 100× 10^3μGy(IP注射) | 21日 | 技能の習得と記憶の保持が困難。 | (王と周、1995) |
| 300× 10^3μGy(IP注射) | 21日 | 技能の習得と記憶の保持が困難。 | (王と周、1995) |
| 111 × 10^6BqL-1 | F0は妊娠前からF1の誕生まで治療を受けた。 | 新生児(F1)の脳の特定部位のDNAとタンパク質含有量の減少。 | (ザメンホフとヴァン・マーセンズ、1981) |
| 111 × 10^6BqL-1 | 妊娠前に治療したF0と出産後に治療したF1。 | 青年期(F1)の脳の特定部位のDNAとタンパク質含量の減少。 | (ザメンホフとヴァン・マーセンズ、1981) |
| 111 × 10^6BqL-1 | 妊娠30日前から5世代まで。 | 成人の脳の特定部位のDNAとタンパク質含有量の減少。 | (ザメンホフとヴァン・マーセンズ、1981) |
| 111 × 10^6BqL-1 | F0は妊娠前からF1の誕生まで治療した。 | 新生児(F1)の60%に血腫と浮腫を認める。 | (ザメンホフとヴァン・マーセンズ、1979) |
| 111 × 10^6BqL-1 | 妊娠前に治療したF0と出産後に治療したF1。 | 血中アルカリホスファターゼの増加(F1)。 | (ザメンホフとヴァン・マーセンズ、1979) |
| 111 × 10^6BqL-1 | 妊娠30日前から5世代まで。 | 脳のDNA含量(F1,F3,F4)およびタンパク質含量(F1,F2,F4,F5)の減少。 | (ザメンホフとヴァン・マーセンズ、1979) |
| 111 × 10^6BqL-1 | 98日 | 生存胚の減少 | (CarstenとCommerford、1976)。 |
| 3.145 × 10^6BqL-1 | 受胎から生後14日まで | 全治療群で卵子の減少 | (ローリー・ドブソンとクーパー、1974)。 |
| 31.45 × 10^6BqL-1 | 受胎から生後14日まで | 全治療群で卵子の減少 | (ローリー・ドブソンとクーパー、1974)。 |
| 314.5 × 10^6BqL-1 | 受胎から生後14日まで | 全治療群で卵子の減少 | (ローリー・ドブソンとクーパー、1974)。 |
| 0.0185 × 10^6BqL-1bw | 4日 | 影響は観察されなかった。 | (ジョンソンとクロンカイト、1959) |
| 0.037 × 10^6BqL-1bw | 4日 | 影響は観察されなかった。 | (ジョンソンとクロンカイト、1959) |
| 0.185 × 10^6BqL-1bw | 4日 | 精母細胞の減少。 | (ジョンソンとクロンカイト、1959) |
| 0.37 × 10^6BqL-1bw | 4日 | 精母細胞の減少。 | (ジョンソンとクロンカイト、1959) |
| 0.74 × 10^6BqL-1bw | 4日 | 精母細胞の減少。 | (ジョンソンとクロンカイト、1959) |
| 哺乳類-ラットゥス・ノルヴェギクス(世代交代型) | |||
| 74 × 10^6BqL-1 | 14日と21日。 | 血液サンプルのMN頻度に差はなかった。 | (リーら、2019) |
| 740 × 10^6BqL-1 | 14日と21日。 | 血液サンプルのMN頻度に差はなかった。 | (リーら、2019) |
| 0.24 × 10^6Bqg-1bw | 妊娠13日目にIP注射1回 | 学習能力の遅延と記憶力の低下。海馬錐体細胞数の減少。 | (高ら、1999) |
| 0.48 × 10^6Bqg-1bw | 妊娠13日目にIP注射1回 | 学習能力の遅延と記憶力の低下。海馬錐体細胞数の減少。 | (高ら、1999) |
| 1.44 × 10^6Bqg-1bw | 妊娠13日目にIP注射1回 | 学習能力の遅れと記憶力の低下。身体および脳の重量の低下。培養神経細胞の変性および奇形。海馬錐体細胞のCa2+コンダクタンスの低下。 | (高ら、1999) |
| 370 × 10^6BqL-1bw | 妊娠から42日間 | 生後300日で、FSHの濃度が上昇し、NEとDAの濃度がともに低下した。精巣重量および精子数の減少。子孫(F2)の数は減少したが、体重は増加した。 | (ラスキーとバーシアン、1976)。 |
| 370 × 10^6BqL-1bw | 出生日から42日間 | 生後300日で、FSHの濃度が上昇し、NEとDAの濃度がともに低下した。精巣重量および精子数の減少。卵巣重量の減少。子(F2)の体重増加および脳重量の減少。 | (ラスキーとバーシアン、1976)。 |
| 370 × 10^6BqL-1bw | 生後42日から42日間 | 生後300日では、FSHの濃度が上昇し、NEとDAの濃度がともに低下した。下垂体重量の変化 | (ラスキーとバーシアン、1976)。 |
| 370 × 10^6BqL-1bw | 生後74日から42日間 | 300日後、NEとDAの濃度が低下。FSH濃度の上昇。子(F2)の体重増加。体重および相対脳重量の変化。 | (ラスキーとバーシアン、1976)。 |
| 37 × 10^6BqL-1bw | 22日(妊娠期間) | 寿命、全新生物発生率、発生率、乳腺線維腺腫の発症に影響は認められなかった。 | (Cahill et al., l75) |
| 370 × 10^6BqL-1bw | 22日(妊娠期間) | 寿命、全新生物発生率、発生率、乳腺線維腺腫の発症に影響は認められなかった。 | (Cahill et al., l75) |
| 1850 × 10^6BqL-1bw | 22日(妊娠期間) | 無菌のF1。乳腺腺腫の発生率が低い。 | (Cahill et al., l75) |
| 3700 × 10^6BqL-1bw | 22日(妊娠期間) | 無菌のF1。乳腺腺腫および全体的な新生物の発生率が低い。平均寿命の減少。 | (Cahill et al., l75) |
| 0.37 × 10^6BqL-1bw | 受胎から生後125日まで | 肝臓と腎臓の重量の減少(F2)。 | (ラスキーら、1973)。 |
| 3.7 × 10^6BqL-1bw | 受胎から生後125日まで | 脳重量の減少(F2)。 | (ラスキーら、1973)。 |
| 37 × 10^6BqL-1bw | 受胎から生後125日まで | 脳重量と体重の減少(F2)。 | (ラスキーら、1973)。 |
| 370 × 10^6BqL-1bw | 受胎から生後125日まで | 睾丸の重量が減少したが、成長や生殖能力に障害はなかった(F1)。脳と体の重量が減少し、子ガメのサイズが減少した(F2)。 | (ラスキーら、1973)。 |
| 37 × 10^6BqL-1bw | 21日 | 雌雄ともに体長、肝臓、心臓の重量が増加。 | (ケーヒルとユイル、1971) |
| 370 × 10^6BqL-1bw | 21日 | 精巣と脳の縮小。 | (ケーヒルとユイル、1971) |
| 740 × 10^6BqL-1bw | 21日 | 精巣、脳、脾臓、胸腺、腎臓、心臓の縮小。 | (ケーヒルとユイル、1971) |
| 1850 × 10^6BqL-1bw | 21日 | 不妊症。生殖腺、脳、脾臓、胸腺、腎臓、心臓の縮小。 | (ケーヒルとユイル、1971) |
| 2775 × 10^6BqL-1bw | 21日 | 不妊症。生殖腺、脳、脾臓、胸腺、腎臓、心臓の縮小。 | (ケーヒルとユイル、1971) |
| 3700 × 10^6BqL-1bw | 21日 | 不妊症。生殖腺、脳、脾臓、胸腺、腎臓、心臓の縮小。子数の減少。 | (ケーヒルとユイル、1971) |
Bw=体重、TDW=トリチウム飲料水、NE=ノルエピネフリン、DA=ドーパミン、IP=腹腔内、MN=小核、FSH=卵胞刺激ホルモン。
表5 異なる水生種を含む実験室研究で観察されたトリチウムの影響の概要
暴露レベルは、特に断りのない限り、トリチウム水の公称濃度を表す(OBTはアミノ酸に含まれる)。
| 濃度/投与量 | 期間/時間ポイント | 観測された効果 | 参考 |
|---|---|---|---|
| 多毛類-Ophryotrocha diadema(世代交代型) | |||
| 2240 × 10^6BqL-1 | 22日 | 卵の生存率の低下。 | (Knowles and Greenwood, 1997) |
| 甲殻類-カラスガイ | |||
| 1 × 10^6BqL-1 | 14日 | 血球におけるDNA損傷。 | (デヴォス他、2015) |
| 15 × 10^6BqL-1 | 14日 | 血球におけるDNA損傷。 | (デヴォス他、2015) |
| 甲殻類-ミジンコ(世代交代型) | |||
| 0.5 × 10^2BqL-1 | 5世代 | 成長速度の低下。性成熟の開始には変化なし。繁殖力と子孫の生存率の低下。胚発生時の異常の増加。核小体の数と直径の増加。 | (グドコフとキプニス、1996)。 |
| 0.5 × 10^6BqL-1 | 5世代 | 成長速度の低下。性成熟の開始には変化なし。繁殖力と子孫の生存率の低下。胚発生時の異常の増加。核小体の数と直径の増加。 | (グドコフとキプニス、1996)。 |
| 500 × 10^6BqL-1 | 17日(F1) | 成長率の低下。子供の死亡率100%。 | (グドコフとキプニス、1996)。 |
| 甲殻類-ポリクリペス・ポリメルス(幼生) | |||
| 0.00037 × 10^6BqL-1 | 32日 | 脱皮指数の変化。 | (アボットとミックス、1979) |
| 0.0037 × 10^6BqL-1 | 32日 | 脱皮指数の変化。 | (アボットとミックス、1979) |
| 0.037 × 10^6BqL-1 | 32日 | 脱皮指数の変化。 | (アボットとミックス、1979) |
| 0.37 × 10^6BqL-1 | 32日 | 脱皮指数の変化。 | (アボットとミックス、1979) |
| 3.7 × 10^6BqL-1 | 32日 | 脱皮指数の変化。 | (アボットとミックス、1979) |
| 37 × 10^6BqL-1 | 32日 | 脱皮指数の変化。 | (アボットとミックス、1979) |
| 軟体動物-イシガキダイ | |||
| 5 × 10^6BqL-1 | 14日 | 血球におけるDNA損傷。 | (ピアソンら、2018a)。 |
| 5 × 10^6BqL-1(トリチウム水) + 383 nM (Zn) | 14日 | 遺伝毒性はない。 | (ピアソンら、2018a)。 |
| 5 × 10^6BqL-1(トリチウム水) + 1913 nM (Zn) | 14日 | 遺伝毒性はない。 | (ピアソンら、2018a)。 |
| 5 × 10^6BqL-1(トリチウム水) + 3825 nM (Zn) | 14日 | 遺伝毒性はない。 | (ピアソンら、2018a)。 |
| 15 °C で、15 × 10^6BqL-1 | 12, 72, 168 h | 血球細胞におけるDNA損傷は168時間のみであった。hsp-70、hsp-90、mt20、p53の遺伝子発現は72時間で上昇した。 | (ダラス他、2016a) |
| 25 °C で、15 × 10^6BqL-1 | 12, 72, 168 h | 血球細胞におけるDNA損傷。72時間後にはhsp-70、hsp-90、mt20、p53の遺伝子発現が低下した。 | (ダラス他、2016a) |
| 軟体動物門イシガレイ | |||
| 0.122 × 10^3μGyh-1 | 7日 | 血球における小核の誘発。 | (Jaeschke et al., 2011) |
| 0.079 × 10^3μGyh-1 | 14日 | 血球における小核の誘発。 | (Jaeschke et al., 2011) |
| 0.0049 × 10^3μGyh-1(OBT) | 7日 | 血球における小核の誘発。 | (Jaeschke et al., 2011) |
| 0.012 × 10^3μGyh-1 | 96 h | 血球におけるDNA損傷。 | (ジャー et al.) |
| 0.121 × 10^3μGyh-1 | 96 h | 血球におけるDNA損傷。 | (ジャー et al.) |
| 0.485 × 10^3μGyh-1 | 96 h | 血球におけるDNA損傷。 | (ジャー et al.) |
| 軟体動物-イガイ(胚幼生) | |||
| 0.37 × 10^6BqL-1 | 24 h | ランダム増幅多型DNAの差異パターン。増殖率指数の低下。正常幼虫および生存率の低下。 | (Hagger et al.) |
| 3.7 × 10^6BqL-1 | 24 h | ランダム増幅多型DNAの差異パターン。姉妹染色分体交換および染色体異常の誘発。増殖率指数の低下。正常幼虫および生存率の低下。 | (Hagger et al.) |
| 37 × 10^6BqL-1 | 24 h | ランダム増幅多型DNAの差異パターン。姉妹染色分体交換および染色体異常の誘発。増殖率指数の低下。正常幼虫および生存率の低下。 | (Hagger et al.) |
| 370 × 10^6BqL-1 | 24 h | ランダム増幅多型DNAの差異パターン。姉妹染色分体交換および染色体異常の誘発。増殖率指数の低下。正常幼虫および生存率の低下。 | (Hagger et al.) |
| ヨコシマクロダイ(幼魚) | |||
| 0.05 × 10^3BqL-1 | 672 h | 異常幼虫。コントロールより体長が大きい。 | (ボンダレヴァ、2017) |
| 0.5 × 10^3BqL-1 | 672 h | 異常幼虫。コントロールより体長が大きい。 | (ボンダレヴァ、2017) |
| 5 × 10^3BqL-1 | 672 h | 異常幼虫。コントロールより体長が大きい。 | (ボンダレヴァ、2017) |
| 50 × 10^3BqL-1 | 672 h | 異常幼虫。コントロールより体長が大きい。 | (ボンダレヴァ、2017) |
| ヨコヅナダニオ・レリオ(胚幼生) | |||
| 3.7 × 10^6BqL-1 | 60および120 hpf | 孵化率の低下。遊泳活動の低下。 | (李他、2021b) |
| 37 × 10^6BqL-1 | 60および120 hpf | 孵化率、遊泳活性、ホルモン(T3、T4)濃度の低下。遺伝子発現の変化。 | (李他、2021b) |
| 370 × 10^6BqL-1 | 61および120 hpf | 心拍数の増加。水泳活動の低下。 | (李他、2021b) |
| 0.4 × 10^3μGyh-1 | 24, 72, 96 h | 96 hpf幼生では遊泳速度が低い。 | (アルカンジョら、2020)。 |
| 4 × 10^3μGyh-1 | 24, 72, 96 h | 水泳行動には影響なし。 | (アルカンジョら、2020)。 |
| 10 × 10^6BqL-1 | 24 hpf~10 dpf | 24hpfで卵径が大きく、3dpfと7dpfで卵黄袋径が大きい。4dpfで幼生長が短く、DNA損傷が少ない。4dpfでアクチンとミオシンフィラメントの変化を伴う筋原繊維の劣化。 | (Gagnaire et al.) |
| 108BqL-1 | 24 hpf~10 dpf | 4dpfでコントロールより高いDNA損傷。活性酸素刺激レベルは4-、7-、10dpf幼生でより高かった。4dpfでアクチンとミオシンフィラメントの変化を伴う筋原繊維の分解。 | (Gagnaire et al.) |
| 109BqL-1 | 24 hpf~10 dpf | 4dpfでコントロールより高いDNA損傷と活性酸素刺激指数。4dpfにおける尾筋の筋原線維の分解。 | (Gagnaire et al.) |
| 0.4 × 10^3μGyh-1 | 24, 96 h | 筋収縮と眼球混濁に関連する遺伝子は24時間後に発現が上昇した。活性酸素消去に関与する遺伝子は24時間後に発現に差が見られた。DNA修復に関与する遺伝子は96時間後に発現が増加した。 | (アルカンジョら、2018)。 |
| 4 × 10^3μGyh-1 | 24, 96 h | 筋収縮と眼の混濁に関連する遺伝子の発現が低下した。DNA修復に関わる遺伝子は24時間後と96時間後に増加した。96時間後にサルコメアの構造が破壊された。 | (アルカンジョら、2018)。 |
| フグ幼生(胚幼生) | |||
| 37 × 10^5BqL-1 | 180 h | 孵化率には影響なし。 | (須山・市川、1974)。 |
| 37 × 10^7BqL-1 | 180 h | 孵化率には影響なし。 | (須山・市川、1974)。 |
| 37 × 10^9BqL-1 | 180 h | 孵化率には影響なし。 | (須山・市川、1974)。 |
| 37 × 10^10BqL-1 | 130 h | 不活発な幼虫。体が小さく、腹部が膨らんでいる。目の直径が小さい。 | (須山・市川、1974)。 |
| 棘皮動物門オニカマス属 | |||
| 0.030 × 10^6BqL-1(OBT) | 126,146日 | 影響なし。 | (フェスタリーニ他、2019) |
| 0.007 × 10^6BqL-1 | 126,146日 | 影響なし。 | (フェスタリーニ他、2019) |
| 0.03 (OBT) + 0.007 (トリチウム水) x106BqL-1 | 126,146日 | 126日後の脂肪酸組成をコントロールと比較した。 | (フェスタリーニ他、2019) |
| 棘皮動物-Oryzias latipes(胚) | |||
| 3700 × 10^6BqL-1 | 10日 | 生殖細胞数の減少。 | (兵頭・田口、江藤、1986)。 |
| 7400 × 10^6BqL-1 | 10日 | 生殖細胞数の減少。 | (兵頭・田口、江藤、1986)。 |
| 14,800 × 10^6BqL-1 | 10日 | 生殖細胞数の減少。 | (兵頭・田口、江藤、1986)。 |
| 18,500 × 10^6BqL-1 | 10日 | 生殖細胞数の減少。 | (兵頭・田口、江藤、1986)。 |
| 27,750 × 10^6BqL-1 | 10日 | 生殖細胞数の減少。 | (兵頭・田口、江藤、1986)。 |
| 37,000 × 10^6BqL-1 | 10日 | 生殖細胞数の減少。 | (兵頭・田口、江藤、1986)。 |
| 370 × 10^6BqL-1 | 240日 | 生殖細胞数の減少。 | (兵頭・田口・江上、1977) |
| ヨコエビ(胚) | |||
| 370 BqL-1 | 180 h | 孵化率には影響なし。 | (須山・市川、1974)。 |
| 37 × 10^3BqL-1 | 180 h | 孵化率には影響なし。 | (須山・市川、1974)。 |
| 37 × 10^5BqL-1 | 180 h | 孵化率には影響なし。 | (須山・市川、1974)。 |
| 37 × 10^7BqL-1 | 180 h | 孵化率には影響なし。 | (須山・市川、1974)。 |
| 棘皮動物(胚) | |||
| 0.012 × 10^6BqL-1 | 60日および120日 | 120日後の生殖腺におけるDNA損傷の増加。 | (Gagnaire et al, 2018)。 |
| 0.025 × 10^6BqL-1 | 60日および120日 | 120日後の生殖腺におけるDNA損傷の増加。 | (Gagnaire et al, 2018)。 |
| 0.18 × 10^6BqL-1 | 60日および120日 | 60日および120日後に生殖腺でDNA損傷が増加。血液中の小核頻度増加。120日目に貪食活性が増加。 | (Gagnaire et al, 2018)。 |
| 27 × 10^3BqL-1(OBT) | 60日および120日 | 120日後の生殖腺におけるDNA損傷の増加。 | (Gagnaire et al, 2018)。 |
| 25 × 10^3BqL-1(OBT、トリチウム水) | 60日および120日 | 生殖腺におけるDNA損傷の増加と血液中の小核頻度の増加。 | (Gagnaire et al, 2018)。 |
| 鯨偶蹄目Salmo gairdneri | |||
| 0.4 × 10^-3μGy | 20日 | 免疫能の不可逆的な抑制。 | (Strand et al.) |
| 4 × 10^-3μGy | 20日 | 免疫能の不可逆的な抑制。 | (Strand et al.) |
| 40 × 10^-3μGy | 20日 | 免疫能の不可逆的な抑制。 | (Strand et al.) |
| 400 × 10^-3μGy | 20日 | 免疫能の不可逆的な抑制。 | (Strand et al.) |
| 棘皮動物:サルモ・ガイルドネリ(幼魚) | |||
| 0.4 × 10^-3μGy | 20日 | 免疫反応には影響なし。 | (Strand et al.) |
| 4 × 10^-3μGy | 20日 | 免疫反応には影響なし。 | (Strand et al.) |
| 40 × 10^-3μGy | 20日 | 免疫反応の低下。 | (Strand et al.) |
| 400 × 10^-3μGy | 20日 | 免疫反応の低下。 | (Strand et al.) |
dpf=受精後日数、hpf=受精後時間。
マウスでは、トリチウム水とOBTの両方が、1カ月の慢性被ばく後、1および20× 10^6BqL-1の濃度で末梢血リンパ球の染色体異常レベルの上昇を誘発することが判明した。しかし、被ばくを8カ月に延長した場合には、トリチウム水に過剰な損傷は観察されず、被ばく期間が長くなれば、何らかの代償的修復機構が誘発される可能性が示唆された(Roch-Lefèvre et al.)対照的に、Bannisterら(2016)は、マウスの脾臓で20× 10^6BqL-1までのトリチウム水への慢性被ばく(1カ月および8カ月)後の細胞毒性または遺伝毒性の証拠を発見しなかった。このことは、トリチウム蓄積が組織および時間特異的であることの重要性を浮き彫りにしている(Dallas et al., s16a;ジャー et al., a05;Pearson et al., n18a)。
水生生物相の研究では、急性トリチウム暴露後の影響として、遺伝子発現レベルの変化、発生、遺伝毒性、細胞毒性作用などが報告されている。逆に、亜慢性および慢性暴露は、生理学的、行動学的反応および遺伝毒性影響におけるトリチウムの影響を評価するために実施されている(表5)。急性暴露と慢性暴露では、対象とする代謝経路や生理過程、あるいはライフステージが異なるため、異なる組織レベルでの反応は、異なる暴露時間スケールでよりよく理解される可能性がある。
4.2.異なる動物群に関する研究
さまざまな動物群に対するトリチウムの潜在的影響を評価することを目的とした研究の概要を表4にまとめた。マウスやラットなどのげっ歯類は、解剖学的、生理学的、遺伝学的にヒトと類似しているため、長い間、実験室の研究モデルとして用いられてきた。また、妊娠期間が短く、ライフサイクルが短く、体が小さく、維持が容易であることから、好ましいモデルとされてきた。したがって、図4と表4は、トリチウムを含む実験室研究では哺乳類、主にマウスとラットが優勢であることを示している。これらの研究は、高濃度を用い、ヒトの健康に対する潜在的な毒性に対処する目的で実施されているが、貴重なデータを提供し、哺乳類やその他の生物相におけるトリチウムの影響を理解するのに役立つメカニズム情報を生み出している。急性(Li et al., 2021b)および慢性(世代交代を含む)暴露シナリオ(Bannister et al., 2016;Gao et al., 1999;Roch-Lefèvre et al., 2018)の後、実験室環境下で分子レベルから行動レベルまでの影響が報告されている(表4)。観察された影響には、子孫の生存率の低下(Cahill et al., l75;Clerici et al., i84)、生殖器官の重量減少(CahillとYuile、1971;Laskey et al., y73)、不妊F1(Cahill et al., l75)などがある。分子レベル(LaskeyとBursian, 1976)や行動レベル(Gaoら, 1999;WangとZhou, 1995)での神経系の変化も報告されている。ラットとマウスの全ゲノム配列が入手可能になったことで、遺伝学的手法を導入してトランスジェニックマウスを開発し、毒性学的研究に利用する可能性も出てきた(Ankley et al., 2010;Kratchman et al., 2018)し、トリチウム研究に関しては、DNA逆転頻度をモニターして遺伝毒性を評価することもできる(Bannister et al.)
原子力施設の大半は河川や湖沼とつながっており、直接的または間接的に海洋環境とつながっている(Adam-Guillermin et al.)淡水のモデル種としてよく知られているにもかかわらず、トリチウムの影響を評価する生物学的モデルとしてミジンコを採用した研究は、私たちの知る限り、1 件しかない(Gudkov and Kipnis, 1996)。そこで、ミジンコを5 世代にわたって トリチウム水に長期暴露したところ、繁殖能力の変化、胚形成期の異常の増加、生存率の低下、細胞あたりの核小体数の増加という細胞学的な差異が報告された(表 4)。この種は生態学的に水生無脊椎動物を代表する種ではないかもしれないが(Dallas et al., 2012)、多世代にわたる曝露シナリオと個体群動態における潜在的な摂動を理解することができる(Atienzar and ジャー, 2004)。
水生哺乳類におけるトリチウム研究は乏しく、脊椎動物では魚類が主なデータ源となっている(Adam-Guillermin他、2012;Beresford他、2016)(図2、表5)。ある種の魚類の生理学とライフサイクルはよく知られているため、分子生物学的研究(例えば、Arcanjoet al. 2020;Festarini et al., 2016)、実験室(Arcanjo et al., 2018;Festarini et al., 2016,Festarini et al., 2019;Gagnaire et al., 2020)または野外環境(Gagnaire et al., 2017)で実施されてきた。これらのモデルは、既知でライフサイクルが短いなど、げっ歯類と共通する利点もあるが、私たちの知る限り、魚類におけるトリチウム被曝の世代を超えた影響を評価した研究はない。
トリチウムの影響に関するほとんどのデータは、最も一般的な魚類モデルの2つであるゼブラフィッシュとメダカの初期のライフステージで入手可能である(表5)。ゼブラフィッシュでは、0.4× 10^3μGyh-1を超える急性および慢性被ばく後の観察として、遊泳活動、甲状腺ホルモン、孵化率の低下、DNA損傷、解毒プロセスや筋収縮に関与する遺伝子の発現変化などが見られる。これらのバイオマーカーが環境的に現実的な放射線量に対して感受性があるかどうか、また慢性的な被ばく後に何らかの影響を克服できるかどうかを判断するには、より低いトリチウム濃度とより長い被ばく期間を用いた研究が必要である。
汚染物質の周囲(水)濃度と組織濃度との関係は、自由行動する動物では確立や検証が困難な場合がある。そのため、無脊椎動物(イガイなど)には重要な利点がある(National Research Council, 1991)。そのため、トリチウムを含むさまざまな放射性核種に対する毒性反応のモニタリングや研究に利用されてきた(Dallas et al., 2016a;ジャー et al., 2005,ジャー et al., 2006;Pearson et al.)表5と図4にまとめたように、軟体動物はトリチウムの生物濃縮と生物学的影響を研究するために使用される主な水生無脊椎動物であり、トリチウム水またはOBT(T-Gly)として単独で、あるいは金属のような他のストレス要因や汚染物質と組み合わせて使用される。JaeschkeとBradshaw(2013)は、トリチウム化植物プランクトンを介したイガイ組織への有機トリチウムの蓄積の証拠を示し、トリチウムの移動経路とその潜在的な生物蓄積性を示唆した。足、エラ、消化腺、外套膜の各組織におけるトリチウム活性は、摂餌回数とともに直線的な増加を示し、消化腺は他の組織に比べてトリチウムの取り込みが最も高かった。また、トリチウム水とT-Gly への曝露後、血球における小核の誘発も観察された。(Jaeschke et al., 2011)。トリチウム水の活性は1日以内に消失したが、T-Glyは比較的ゆっくりと消失した。ムラサキイガイの遺伝毒性も温度と時間に依存するようで、トリチウム水に25℃で暴露した場合、DNA鎖切断の誘発は3日後に観察されたが、15℃では7日後に観察された(Dallas et al., s16b)。亜鉛とトリチウム水の共曝露試験において、Pearsonら(2018a)は、使用したすべてのZn濃度で、トリチウム水の遺伝毒性(DNA鎖切断)に対するZnの明確な拮抗作用を観察したが、これはおそらくDNA修復酵素におけるZnの重要性に起因すると考えられる。これらの観察結果は、環境中の生物被ばくに関する現在および将来のリスク評価戦略を改善するために、トリチウムと物理的および化学的要因の潜在的相互作用を評価することの重要性を強調している。
魚類や水生無脊椎動物のライフステージ間における汚染物質に対する感受性の差異が報告されており、初期のライフステージは有毒物質の影響を受けやすいと考えられている(Mohammed, 2013;Santos et al.)とはいえ、無脊椎動物に対するトリチウムの影響に関する利用可能なデータのほとんどは、成体に関するものである(Dallas et al., s16a;Devos et al., s15;Jaeschke et al., e11;Jaeschke and Bradshaw. 2013;Pearson et al., n18a)。海産二枚貝Mytilus edulisの胚幼生とフジツボPollicipes polymerusにおける潜在的影響は、無脊椎動物の初期ライフステージで研究された唯一のものである(Hagger et al., r05;AbbottとMix、1979)。二枚貝では、急性被曝後に細胞遺伝学的損傷、細胞毒性、発生異常、死亡が観察され、放射線量の関数として増加した(Hagger et al.)フジツボでは、脱皮指数が、トリチウム水 濃度に関連して指数関数的に減少することが観察された。この影響は、259 BqL-1という低濃度で明らかになった(Abbott and Mix, 1979)。
5.生物学的効果
様々な生物またはモデル種に関与するストレス因子の性質に応じて、様々な生物学的試験やアッセイが用いられてきた(Aliko et al.)潜在的には、あらゆるプロセスにおける変化がバイオマーカーとして使用される可能性があり、組織や体液サンプル、あるいは生物全体のレベルで測定することで、1つ以上の汚染物質による曝露影響の証拠を得ることができる(Hagger et al.)生物学的組織の各レベルにおける反応は、被ばくと悪影響の関係を理解・解釈するのに役立つ情報を提供する(Hagger et al.)特に、放射線生物学的影響は、FASSET プロジェクトの枠組み(Copplestone et al., 2008)で提案されているように、生物に対する罹患率、死亡率、生殖影響、突然変異影響を含む「包括的エンドポイント」(Garnier-Laplace et al.)生存と繁殖は個体と集団の両方に関連するエンドポイントであり、これらのパラメー タの変動は集団のフィットネスと遺伝的多様性に影響を与える可能性があるからだ(King-Heiden et al., 2012;Marty et al., 2011)。しかし、多くの場合、汚染物質は数多くのメカニズムを介して作用する可能性があるため(Connon et al.)さらに、生物レベルで影響が現れてからでは、改善策が手遅れになることも多い。
過去数年の間に、トリチウムが生物相に与える潜在的な影響を判断する際に、分子的、生化学的、生理学的バイオマーカーの利用が増加している(図5)。有害な影響を明確に測定できる単一のバイオマーカーは存在しないことを考慮し、多くの研究が統合的なマルチバイオマーカーアプローチの適用を実施または推奨している(Adams, 2005;Brenner et al., 2014;Galloway et al., 2004a;ジャー, 2008;Larsson et al., 2018;Linde-Arias et al.)ERAの枠組みでは、短期的な反応と長期的な生態学的関連エンドポイントの両方が、環境ストレッサーと生態影響との関係を確立するための証拠の重み付け(weight-of-evidence)アプローチを提供する(Galloway et al., y04b;Hagger et al., r06)。
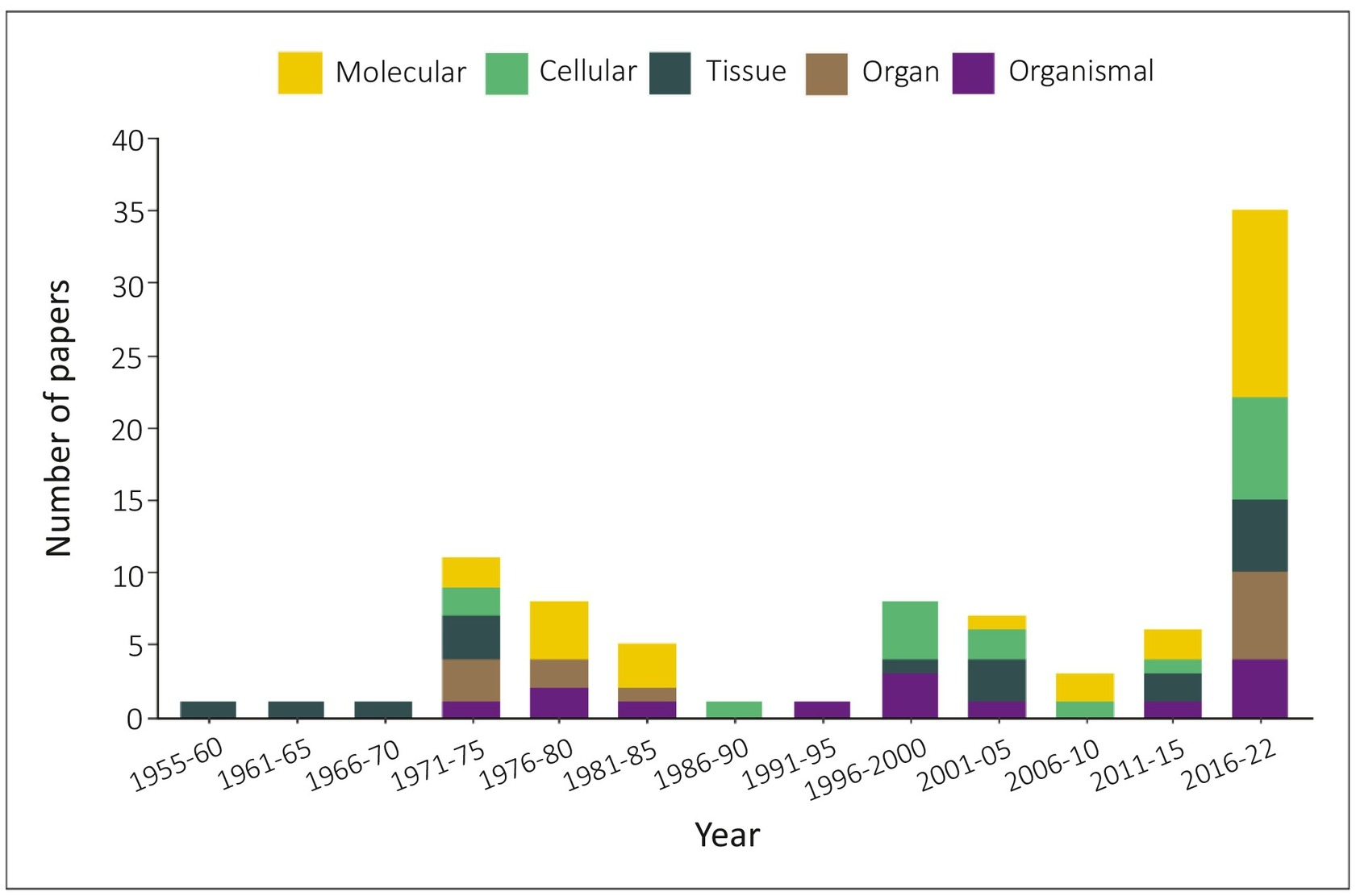
図5 1955年から2022年の間に発表された論文の中で、トリチウムの影響を調べるために生物学的組織の異なるレベルで使用されたエンドポイント。
2つ以上のレベルの組織でエンドポイントを検討した論文は、複数回カウントおよび/または分類した。
5.1.行動反応
行動分析は、生化学的および/または生理学的な障害を反映できる感度の高い指標と考えられている。行動は個体群の成長率に直接的または間接的な影響を与える可能性があり、それによって生物および超生物レベルでの生態学的関連反応を表す(Bertram et al., 2015;Candolin and Wong, 2019;Scott and Sloman, 2004)。例えば、(Wang and Zhou (1995))は、子宮内で48.18および144.54× 10^3Bqg-1を受けたマウス(妊娠成体がトリチウム水の腹腔内注射を1回受けた後)の子孫は、技能の学習と記憶保持の両方に困難があることを発見した。同様の結果がラットの子孫にも見られ、これは処理群で観察された海馬ニューロンの誘導変性と奇形に関連していた(Gao et al., o99)。より最近の研究では、トリチウム水暴露が魚類の行動に影響を与えることが報告されている(Festarini et al., i16;Li et al., i21b)。Liら(2021b)は、トリチウム水(3.7× 10^6BqL-1,3.7× 10^7Bq L-1,3.7× 10^8Bq L-1)に曝露された受精後120時間(hpf)のゼブラフィッシュ幼生が、対照群と比較して、活動性、遊泳速度、および総遊泳距離の低下を示したことを観察した。1.10× 10^8および1.35× 10^9Bq L-1のトリチウム水に曝露された96 hpfのゼブラフィッシュ幼生でも遊泳行動の変化が報告されており、発生異常が原因であるとされている(Arcanjo et al.)
5.2.生殖と発達
生殖は最も放射線感受性の高い生物学的機能の1つであることが知られており、死亡率を引き起こす線量の10%未満の線量で障害が生じる可能性がある(Adam-Guillermin et al.)細胞分裂が活発な細胞は感受性が高く、放射線感受性が最も高いのは、生殖(精原細胞など)または成長(発育中の胚など)のために急速な細胞分裂を行う細胞系であると考えられる(UNSCEAR, 1996)。
げっ歯類では、急性、慢性、胎内、世代交代など、さまざまな被ばくシナリオでトリチウムの生殖・発達への影響が実験的に評価されている(概要は表4を参照 )。生殖機能障害、用量依存的な卵子数の減少、発育異常に伴うさまざまな神経細胞への影響が、世代を超えた研究で観察された主な影響である(表4)。ラットでは、トリチウム水(妊娠成体では 1850 および3700× 10^6BqL-1体液)に子宮内連続被ばくした後、不妊の子孫が報告されており(Cahill and Yuile, 1971)、一方、低線量のトリチウム水(370× 10^6BqL-1体液)に被ばくした後のF1では、精巣と卵巣の重量の減少が観察された(Cahill and Yuile, 1971;Laskey et al.)多世代にわたる研究において、トリチウム水への出生前の恒常的な被曝は、トリチウム水胎内被曝後の相対脳重量の減少(妊娠中の成体では3.7,37および370× 10^6Bq L-1体水)、および37および370× 10^6BqL-1体重のトリチウム水濃度に被曝した雌のF2における体重減少など、F2ラットの新生児に有意な影響を示した(Laskey et al., y73)。妊娠中に異なる線量のトリチウム(92× 10^3μGyと273× 10^3μGy)を受けたラットでは、脳の異常と条件反射の確立の変化も報告された(Gao et al., o99)。マウスでは、雄にトリチウムチミジン(0.185 × 10^9Bqg-1体重)を注射すると、4日後に精母細胞の減少が認められた(Johnson and Cronkite, 1959)。111× 10^6Bq・L-1のトリチウム水を含む飲料水で飼育したマウスの胚では生存率の低下が観察され(Carsten and Commerford, 1976)、子宮内でトリチウム水(妊娠中の成体で3.1× 10^6Bq・L-1体水)に曝露したF1では卵子の有意な減少が認められた(Lowry Dobson and Cooper, 1974)。
上記の研究のほとんどは、生殖と潜在的な神経病理学に焦点を当てている。これらは亜致死影響であるとはいえ、生物および個体群レベルで重要な影響を及ぼすことは明らかであり、特に成体哺乳類では発育中の神経細胞や雌性細胞の一部がいずれも代替不可能であることを考慮すればなおさらである(Bharti et al., i21;Stifani. 2014)。また、適用される用量は脊椎動物に対して提案されているスクリーニング値を超えており、データはマウスとラットについてのみ入手可能であることを理解することが重要である。生態学的リスク評価を改善するためには、他の哺乳類種におけるトリチウム被ばくによって誘発される影響に関する追加的な情報を、さまざまな濃度にわたって入手することが有用であろう。
水生生物相では、生物レベルで測定されたエンドポイントとして、死亡率、胚の孵化成功率、発育パラメータなどがあり、主に魚類に焦点が当てられている(表5)。須山と市川(1974)は、ヒラメ(Paralichthys olivaceus)とフグ(Fugu niphobles)の2種の海産魚の発生におけるトリチウム被曝の影響を研究した。どちらもトリチウム水(最大370× 10^6Bq L-1)暴露後の孵化率に有意な低下は見られず、孵化時の目の小ささや腹部の膨張など、フグ胚の孵化率や成長に対するトリチウム水の影響は、非常に高い濃度(370× 10^8~370× 10^9BqL-1)でのみ明らかであった。同様の影響は、より低濃度のトリチウム水(100 × 10^6Bq L-1)に曝露したゼブラフィッシュ幼生でも観察されている(Gagnaire et al.)ここでは、卵は受精後3時間後に曝露されたが、フグの卵は受精後19時間後に曝露された。Bondareva((2017))は、カラシウマ(Carassius gibelio)の幼生(6 hpf)をトリチウム水(50,500,5000,50,000 BqL-1)に慢性的に曝露した後、異常発生率の増加を観察したが、これは曝露レベルの増加とは相関しなかった。これらの研究は、ゼブラフィッシュで以前に報告されたように(Arcanjo et al.)しかし、淡水と海水における種の感受性やトリチウムの挙動(化学的活性など)の違いは否定できない。
水生生物相の繁殖におけるトリチウムの影響を評価した研究はほとんどなく、最も一般的に研究されている繁殖エンドポイントは、繁殖能力(すなわち、生物が生存可能な配偶子を生産する能力)である(表5)。メダカの稚魚では、生殖細胞の生存率がトリチウム線量とともに指数関数的に減少し、メスの生殖細胞はオスの生殖細胞よりも放射線感受性が高いことが観察された。これらの結果は、トリチウム水(1850-37,000 × 10^6BqL-1)中で10日間飼育した卵(受精後2時間)で得られた(Hyodo-Taguchi and Etoh, 1986)。同様に、メダカの雄成魚では、370 × 10^6BqL-1濃度のトリチウム水を添加すると、10日間暴露後に生殖細胞数が減少することが報告されており(兵頭・田口、江上、1977)、明らかに成魚の生殖細胞の感受性が高いことを示している。種の長期的な存続は繁殖の成功に依存するため、このプロセスの変化は最も重大な亜致死影響のひとつである。しかし、天然種の正常な繁殖パターンは、温度、年齢、餌の入手可能性、季節性など、さまざまな要因に大きく影響されることも知られている(ジャー, 2008;Rizzo and Bazzoli, 2019)。このため、実験室での繁殖測定は論理的に困難であり(ジャー, 2008)、実験室での結果と生態系への影響を外挿することはより困難である(Hook et al.)
トリチウム被ばくによる生殖への影響に関するデータは少ないが、発育パラメータを評価する初期段階の研究から、繁殖力の低下と同様に生態学的に関連する貴重な情報が得られる(Connon et al.)個体は捕食を回避し、繁殖し、餌をめぐって他の生物と競争し、他の環境ストレッサーに対処しなければならないからだ。さらに、フジツボ(Abbott and Mix, 1979)やさまざまな魚種(Arcanjo et al., 2018;Gagnaire et al., 2020;Suyama and Ichikawa, 1974)で報告されているように、トリチウム曝露によって発生が著しく遅延した場合、生物は捕食されやすい(Paradis et al., 1999)、あるいは病原体に感染しやすい(Sweet and Bateman, 2015)、より脆弱な段階でより多くの時間を過ごす可能性がある。
5.3.細胞毒性
内部放射性崩壊のエネルギーは、活性酸素種(ROS)を発生させる。これらの種は半減期の短い強力な酸化剤であるため、酸化ストレス応答はDNA損傷や細胞死を評価するエンドポイントとして用いられてきた(Isaksson, 2010;Lionetto et al.)
酸化ストレスは、多くの生物指標種において、野外および実験室ベースの研究(Amachree, 2014;Lourenço et al 2003)、トリチウムに関してはゼブラフィッシュ(Arcanjo他、2018;Gagnaire他、2020)、ファットヘッドミノー(Beaton他、2019;Gagnaire他、2017、Gagnaire他、2018)、マウス(Kelsey-Wall他 2006)で実施した。マウスを用いた研究では、マウスがトリチウム化飲料水(活性約30万BqL-1)に2週間暴露された後、抗酸化酵素(カタラーゼ[CAT]、グルタチオンペルオキシダーゼ[GPx]、スーパーオキシドジスムターゼ[SOD])の活性が誘導されなかったことが報告されている。野外調査において、Beatonら(2019)は、ファットヘッドミノウのGPx活性が肝臓のトリチウム線量と負の相関を示し、脳の線量と正の相関を示すことを観察したが、実験室ではこうした傾向は見られなかった。したがって著者らは、GPx活性はトリチウム濃度ではなく環境に反応する可能性を示唆した。独立した研究では、ファットヘッドミノーがトリチウム水に暴露された後、SOD、CAT、GPxの酵素活性は変化を示さなかったが、活性酸素指数は組織のトリチウム線量率と負の相関を示した(Gagnaire et al.)
細胞の健康状態を評価するもう一つの一般的なバイオマーカーは、リソソーム膜安定性(LMS)の測定である。ゼブラフィッシュにおいて、Gagnaireら(2020)は、LMSが組織中のトリチウム線量と正の相関があることを観察した。一方、トリチウムと金属によるマルチストレッサー暴露では、有害金属に対するトリチウムの保護効果に起因するファットヘッドミノーの脾臓におけるLMSの増加が見られた(Gagnaire et al., 2017)。
5.4.遺伝毒性
遺伝的損傷は、より低い線量率で誘発され、電離放射線被曝直後にさまざまな技術を用いて測定できるため、トリチウム被曝では関連するエンドポイントが採用されてきた。具体的には、軟体動物(Dallas et al., s16a;Devos et al., s15;Hagger et al., r05;ジャー et al., a05;Pearsonら、2018a、2018a)、昆虫(Blaylock, 1971)、哺乳類(Ichimasa et al., 2003;Lee et al., 2019)、魚類(Arcanjo et al., 2019;Festarini et al., 2016;Li et al., 2021bなど)が報告されている(表4、表5)。
遺伝毒性を評価するための最も一般的なアッセイの一つは、DNAの一本鎖/二本鎖切断(SSB/DSB)を検出するために用いられるコメットまたは単一細胞ゲル電気泳動アッセイ[SGCE]である(ジャー, 2008;Lee and Steinert, 2003)。小核(MN)試験もまた、環境放射性核種の遺伝毒性影響を検出するために用いられてきた(Beaton et al., n19;Gagnaire et al., e18;ジャー et al., a05;Poblete-Naredo and Albores. 2016;Samanta et al., a18;Vernon et al., n20)。MN試験は修復不可能な損傷を検出するのに対し、SCGEは切断やアルカリ不安定部位など修復可能な最近の損傷を検出する(Frenzilli et al.)コメットアッセイの方が感度が高いことが示唆されているが(Frenzilli et al., 2009)、SCGEとMNの両方で評価された遺伝毒性作用の間には一致性があることが報告されている(ジャー et al., 2005)。20 μGyh-1(15× 10^6BqL-1トリチウム水)(Dallas et al., 2016a)および4.9 μGyh-1(1.48 × 10^6BqL-1T-Gly)(Jaeschke et al.イガイの幼生において、Hagger ら(2005)は、トリチウム水(3.70 × 10^3~370× 10^3BqL-1; 30~150 μGy; 18.6 h)被ばく後の染色体異常、姉妹染色分体交換(SCE)の誘発、ランダム増幅多型 DNA(RAPD)プロファイルの変化を報告している。コメットアッセイを用いたDNA損傷も、7.5および113.9 μGyh-1(1× 10^6BqL-1および15× 10^ 6 BqL-1トリチウム水)の線量率で14日間暴露したカキで検出された(Devos et al., s15)。ファットヘッドミノーでは、0.65 μGyh-1(180× 10^3Bq L-1トリチウム水)の線量率を60日間照射すると、生殖腺のDNA損傷と血液中のMN頻度が増加した(Gagnaire et al.)同じ種において、γH2AX病巣の検出(DNAの二本鎖切断を反映)は、2種類の形態でトリチウムに曝露した後の内部被ばく線量率と正の相関があった:トリチウム水とOBTを添加した飼料である(Gagnaire et al.)逆に、Festariniら(2019)は、現在のカナダの飲料水ガイドラインである7000 BqL-1に近いトリチウム水活性濃度に慢性的に曝露した成魚のマスにおいて、細胞生存率、DNA切断、DNA修復活性に差はなかったと報告している。しかし、DNA修復活性を評価したところ、その後に試験管内で照射された急性高線量ガンマ株に対する反応の変化が認められた。4Gyのチャレンジ線量を照射した後、非照射の魚の組織と比較すると、肝臓と心臓の反応は、試験した他の組織と比較して亢進した。このことは、DNA修復活性とトリチウム放射線に対する組織の感受性に差があることを強調している。同様に、ゼブラフィッシュ胚幼生では、γH2AXの検出により、対照群とトリチウム水 1.22 × 10^2および1.22 × 10^3BqL-1(0.40 および4 mGyh-1)に被ばくした群との間に差は認められなかった(Arcanjo et al.)しかし、同じ被ばくシナリオのも\とで、著者らはDNA損傷に対する応答に関与するh2afx遺伝子(ヒストンH2Aをコード)のアップレギュレーションを観察した。これらの結果は、より高いレベルの生物学的組織において、電離放射線の影響とバランスをとるためにDNA修復経路が強化されたことを反映しているのではないかという仮説が立てられた。
化学物質の遺伝毒性の可能性は、細胞や組織の特性や汚染物質の蓄積場所に依存する(ジャー, 2008)。従って、異なる組織におけるトリチウムの分布と生物蓄積に関する情報は、組織感受性とDNA修復経路の理解を深める上で有用であろう。
5.5.「オミックス」研究
私たちの知る限り、生物相におけるトリチウムの影響を調べるために、プロテオミクスもメタボロミクスも適用されておらず、生物相のトランスクリプトームにおけるトリチウム被曝の影響を評価した研究はわずかである。これらはすべて魚類モデルで行われている(表5)。トリチウム水(1.22× 10^8および1.22× 10^9BqL-1)に曝露されたゼブラフィッシュ幼生(24および96 hpf)は、筋収縮、眼の混濁、概日および酸化ストレス応答、ならびに筋発達および骨格筋・心筋収縮に関与する経路に関与する遺伝子の発現に変化を示した(Arcanjo et al.)これらの影響は、96 hpf幼生の電子顕微鏡観察後、より高い生物学的スケールで確認され、筋肉の完全性がゼブラフィッシュの初期発生段階におけるトリチウム水曝露の良好なバイオマーカーとして考えられることが示された(Arcanjo et al.)眼球混濁に関与する遺伝子発現の変化は、24 hpfから96 hpfまでのステージを用いたより高い生物学的スケールでは確認されなかったが(Gagnaire et al., e20)、筋収縮に関与する遺伝子の誤った調節が運動における影響に関連していた(Arcanjo et al., o20)。Liら(2021b)は、低線量(3.7× 10^7BqL-1)のトリチウム水被ばく後のゼブラフィッシュ胚(120 hdp)において、心臓、循環器系、神経系の発達に関与する遺伝子の発現の変化と、放射性物質の代謝の変化を観察した。
たとえ分子レベルでの変化が必ずしも高いレベルでの影響に結びつかないとしても、トランスクリプトミクスは反応を特徴づけたり、生物学的プロセスをさらに探求したりするための「発見」ツールとなる(Hook et al.)さらに、これらの情報を組み合わせることで、同様の有害結果経路(AOPs)を共有する他の対象種の感受性を予測することもできる(McArdle et al.)
ERAへのオミックス・アプローチの適用と統合は、現実の世界では大きな課題を突きつけている。これは、電離放射線への曝露後の生物学的反応を評価するためにオミックスアプローチが広く採用されているヒトの健康分野とは対照的である(Brackmann et al.)自然環境では、種固有の要因(性別、年齢、繁殖期、ライフステージなど)に加え、物理化学的特性、水理形態学的特性、季節的特性における空間的・時間的変動といった要因が、環境ストレス因子に対する分子応答に影響を及ぼすことが知られている(Garcia-Reyero and Murphy, 2018;Martyniuk, 2018)。それにもかかわらず、オミックスと生態学的応答との間の導管としてAOPを使用することで、よりメカニズムに基づいたハザードとリスク評価への移行を促進できることが認識されている(Martyniuk, 2018;Tollefsen et al.)最近の研究では、一次生産者、回虫、ミミズ、甲殻類、魚類のさまざまなモデル種の研究から得られたデータを用いて、生殖に対する放射線影響のAOPネットワークを構築した(Tollefsen et al.)その後、これらの分類群に焦点を当てたAOPを使用して、共通の事象群をコンセンサスAOPに定義した。これは、多数の生物種を含む生物組織のさまざまなレベルにまたがる情報を共通の知識枠組みに集めるための取り組みである(Tollefsen et al.)この文脈において、放射線に特化したAOPの策定は、異なる生物からのデータと知識を統合し、異なる環境条件下でERAに有用な情報を得るための枠組みを形成することが示唆されている(Beresford et al.)しかし、これらのAOPをより多様なデータセットで構成するためには、さらなる研究が必要である。このような努力は、少数のモデル種への偏りを減らすことを目指すべきである。これにより、複雑な環境におけるエビデンスに基づく評価の重みが増すことになる(Halappanavar他、2020;Portugal他、2022;Tollefsen他、2022)。
他の研究では、標的遺伝子の発現におけるトリチウム被曝の影響を評価している。Devosら(2015)は、カキにおけるトリチウム水の慢性被曝の影響を研究し、熱ショックシャペロンタンパク質と解毒、酸化ストレス、細胞周期調節機構のメンバーの9遺伝子を分析した。しかし、14日後では、対象とした遺伝子に統計的な変化は見られなかった。クリアランス率はトリチウム被曝後も変化せず、DNA損傷は増加したが、これは持続可能なDNA修復能力の範囲内であったと思われる。イガイでは、Dallasら(2016a)が、解毒、酸化ストレス、タンパク質折り畳み、DNA二本鎖切断修復、細胞周期チェックポイントを担う6つの遺伝子の発現を分析した。彼らは、イガイを15℃でトリチウム水(15,000 BqL-1)に1時間暴露した後、hsp70、hsp90、mt20がエラで発現上昇することを発見した。興味深いことに、hsp70、hsp90、mt20、rad51およびp53は、イガイを25℃でトリチウム水に暴露すると発現が低下した。遺伝子発現の結果はDNA損傷とも相関しており、相関は時間によって変化したが、温度によって変化しなかった。例えば、p53(DNA修復に関連する遺伝子)は、72時間と168時間の暴露で、それぞれDNA損傷と負の相関と正の相関を示した。これらの影響がより高い生物学的レベルでの反応に結びつくかどうかについては、さらなる研究が必要である。
6.知識のギャップと将来の方向性
原子力の利用は、低炭素経済への移行に不可欠と考えられているため、今後増加すると予想される(Adam-Guillermin et al., 2012;Kadiyala et al., 2016;Nie et al.)特に、トリチウム(3H)の需要と生産は、核融合技術における潜在的な役割のために増加すると予想されている(Jean-Baptiste and Fourré, 2013;Pearson et al.)このような状況の中、多くの国々は、トリチウム化放射性廃棄物を管理する長期的な戦略を策定し、その環境影響を評価するツールを開発しなければならない事態に直面している(Bay et al., 2020;Di et al., 2012;Hanslík et al., 2017;Lainetti, 2016;Filho et al., 2013;Stamper et al., 2014)。
生物相に対する放射線防護は、過去 20年間で注目度が高まっており、様々な国際的ガイドラインが策定されている(Andersson et al., 2008,Andersson et al., 2009;IAEA, 2005;ICRP, 2017;UNSCEAR, 2016)。しかし、提案されている無影響線量率限界値(0.24 mGyd-1, 10 μGyh-1,表3)は、一部の生物種には不適切なようである(Dallas et al., 2016a;Hagger et al., 2005;ジャー et al.)このレビューでは、利用可能なデータは海洋二枚貝、魚類、哺乳類(すなわちげっ歯類)に大きく偏っており、主に野外研究ではなく実験室での研究を対象としており、トリチウム水としてのトリチウム被曝に焦点を当てていることが示された。OBT(Kim et al., m13a;Roch-Lefèvre et al., e18)またはトリチウム化粒子(Grisolia et al., a19;Liger et al., r18;Smith et al., h22)のような他の形態のトリチウムの取り込み経路と影響を調査する研究は欠けている。後者には、原子炉の廃止措置や解体から生じる鋼鉄やセメント粒子に関連するトリチウムが含まれる。
生態毒性学的影響を評価するために、今後の研究では、異なる生態学的ニッチからのより多様な主要種を検討し、比較研究を行うべきである。多様で生態学的に関連性のある種から得られた結果は、異なる種の相対的感受性の適切なベンチマークを確立するためのデータセットを改善するだけでなく、より一般的な環境アセスメントや将来の暴露シナリオの研究に使用されるモデルの開発を促進する(Galeriu and Melintescu, 2011;Melintescu et al.)また、環境中の放射性核種のリスク評価において、化学物質(金属、有機物など)や物理的パラメータ(温度、酸素、溶存有機炭素など)を含む人為的・自然的ストレス要因の組み合わせの側面についても研究する必要がある(Dallas etal.)
トリチウム被ばくに対するさまざまな反応(分子レベルから行動レベルまで)が、さまざまな分類群において、初期のライフステージで報告されており、エピジェネティックなメカニズムを通じて世代を超えて影響が伝達される可能性が提唱されている。これらのメカニズムについてはほとんど知られていないが(Merrifield and Kovalchuk, 2013;Thaulow et al., 2020)、「オミックス」技術は知識のギャップを埋め、分子レベルと生物レベルの反応の関係を解明するのに役立つ可能性がある(Dallas et al.)これらのツールは、作用様式や細胞内シグナル伝達経路の研究に利用され、特定のストレス因子に対する先験的な分子標的を必要としないため、探索的研究に適している(Cambiaghi et al.)「オミックス」分野は急速に発展しているにもかかわらず、トリチウム放射線生物学への応用はまだ比較的初期段階にあり、限られた数の研究しか実施していない(Arcanjo et al., 2018,Arcanjo et al., 2020;Gagnaire et al., 2017;Li et al., 2021b)。加えて、1990年以降のICRP勧告は、(i)誘発されたゲノムの不安定性(ii)、バイスタンダー効果、(iii)生殖細胞系列におけるミニサテライト突然変異誘発を、新規の現実の放射線生物学的現象として同定している(Goodhead et al., 2004)。これらは、潜在的な世代を超えた影響やエピジェネティックな影響に加えて、生物相に対するトリチウムの影響を評価しながら、詳しく説明する必要がある(Beresford et al.)
また、環境リスク管理に対する生態系ベースのアプローチを開発することへの関心も高まっている(Dallas et al., 2012;Bréchignac, 2017;Mothersill et al.)私たちの知る限り、生態系レベルでトリチウムの影響を評価した研究はない。さらに、レビューされたほとんどの研究は、非常に高濃度のトリチウムを用いて実施されており、作用メカニズムを発見し、より高い生物組織レベルでの潜在的影響を検出することが可能である。しかし、これらの研究は、現実的な被ばくシナリオで観察される被害を必ずしも反映していない(Brechignac et al.)生態学と放射線学の分野の科学者たちは、生態系科学を放射線生態学に再統合することの実現可能性と課題について検討してきた(Beresford et al., 2020;Mothersill et al., 2020;Rhodes et al., 2020)。バックグラウンドレベルを超える放射線が存在する地域での生態学的研究は限られており、非典型的で、しばしば結論が出なかったり、論争になったりする(Dallas etal., 2012;Fuller et al., 2015;Beresford et al.)環境放射能分野の課題は、確実な科学的アプローチの採用、明確な報告、専門知識の共有を通じて解決される必要がある(Beresford et al.)マイクロコズム、メソコズム、自然のフィールド条件で実施される研究は、調整された方法で計画されれば、数理モデルや計算モデルの構築に適切なデータを生み出すことができる(Mothersill et al.)最後に、これらのモデリングアプローチ以外にも、機械学習(ML)アプローチを含む人工知能の現在の発展は、放射性核種で汚染された複雑な環境における大規模なデータセットから洞察を得る新たな機会を提供する(Shuryak, 2017,Shuryak, 2022)。これらは、トリチウムやその他の環境関連放射性核種の生物学的影響を評価する上で、潜在的に有用なツールとなるであろう(Mothersill et al.)
CRediT著者貢献声明
MFF:データキュレーション、方法論、執筆-原案、検証、レビュー、編集。AT:可視化、形式分析、レビュー、編集。ELV:データキュレーション、原案作成。CG:レビューと編集、資金獲得、プロジェクト管理。LL-J: 査読と編集。VM:レビューと編集、資金獲得、検証、プロジェクト管理。ANJ: 概念化、視覚化、形式分析、検証、レビューと編集、監督、資金獲得、プロジェクト管理。
利益相反宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる競合する金銭的利益や個人的関係はないことを宣言する。
謝辞
本研究は、Euratom research and innovation programme 2014-2018(grant agreement No.754586)の助成を受けたTRANSATプロジェクト(htt
