Contents
Therapeutic Potential of Metformin in COVID-19: Reasoning for Its Protective Role
Samson Mathews Samuel,1,2,⁎ Elizabeth Varghese,1,2 and Dietrich Büsselberg1,⁎
概要
SARS-CoV-2(Severe Acute Respiratory Syndrome Coronavirus 2)感染症は,糖尿病患者では,非糖尿病患者に比べて重症度が高く,臨床転帰も悪い。糖尿病/高血糖が引き金となって起こる内皮機能障害と、活発な炎症反応および免疫反応は、糖尿病性新型コロナウイルス019(COVID-19)患者の集中治療室での入院日数が2倍から3倍に、死亡率が2倍以上になることと相関している。肥満、心血管疾患、高血圧などの併存疾患が糖尿病性COVID-19患者の予後を悪化させる一方で、COVID-19感染症は、新たな糖尿病の発症、重篤な代謝性合併症、内皮機能の異常を背景とした血栓イベントの増加にも関連している。血糖値を管理するためにいくつかの抗糖尿病薬が使用されているが、メトホルミンは血糖値を管理するだけでなく、SARS-CoV-2感染時の内皮機能障害を軽減し、ウイルスの侵入と感染を抑制し、炎症反応や免疫反応を変化させる可能性があるという多面的な作用について述べる。これらの作用から、メトホルミンは、糖尿病のCOVID-19患者において、SARS-CoV-2に起因する津波に対抗するために、リパーパスを検討すべき有力な候補薬である。
キーワード
血糖値コントロール、コロナウイルス、COVID-19,糖尿病、内皮機能障害、メトホルミン、SARS-CoV-2
糖尿病とCOVID-19。互恵関係が奏功
2020年1月7日 2019年12月30日に中国・武漢で表面化した「非定型肺炎」の原因ウイルスとして、新規のβ-コロナウイルスである重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)(用語解説参照)が同定された[1]。世界保健機関(WHO)が2020年3月11日にSARS-CoV-2を原因とするコロナウイルス感染症2019(COVID-19)の発生をパンデミックと宣言して以来、現在(2021年3月5日)までに1億1600万人以上のCOVID-19感染者が報告され、世界で250万人以上が命を落としている[1]。ワクチン-Tozinameran/BNT162b2/Comirnaty(Pfizer/BioNTech)mRNA-1273(Moderna)AZD1222/Covishield(University of Oxford/AstraZeneca)Ad26.COV2.S/JNJなどが開発されている現在でも、急速な感染拡大を抑制する効果的な方法とCOVID-19の治療法を見つけることが、このパンデミックとの戦いの最前線となっている。 COV2.S/JNJ-78436735(Janssen Vaccines and Prevention)-などが、いくつかの国で承認され、緊急時の使用が許可されている[2., 3., 4., 5.]。しかし、感染力の高いSARS-CoV-2の変異体が出現したことで、これらの変異体が体内の免疫反応を回避し、ワクチンの効果を脅かし、感染力の高いCOVID-19の症例が復活するのではないかという懸念が生じている[6]。
伝染力の強いSARS-CoV-2ウイルスは、年齢、性別、民族に関係なく、すべての人に影響を与えるが、その程度は様々です[7]。COVID-19のほとんどの症例は、無症状のままか、比較的軽度のインフルエンザ様の症状を呈しており、SARS-CoV-2の感染と著しい拡散のリスクを高めている[8]。それにもかかわらず、男性、高齢者、高血圧、心血管・脳血管疾患、糖尿病、がん、腎障害などの合併症・既往症を1つ以上持つ人では、感染しやすさ、病気の強さ・激しさ、入院率、死亡率が著しく高くなる[1,9]。持病・既往症がある場合、COVID-19の重症例は、急性呼吸窮迫症候群(ARDS)敗血症性ショック、多臓器不全症候群(MODS)臓器不全へと急速に進行する可能性がある[10]。
SARS-CoV-2が多臓器に感染しダメージを与える能力は、様々な臓器や組織における宿主のアンジオテンシン変換酵素2受容体(ACE2;ウイルスのスパイクタンパク質に結合する)と膜貫通型セリンプロテアーゼ2(TMPRSS2;ウイルスのスパイクタンパク質を切断してプライミングする)の発現・分布パターンに依存しており、ウイルスの活性化と宿主細胞への侵入を容易にしている[11,12]。糖尿病や肥満などの合併症があると、ACE2の発現が増加し、様々な組織や臓器内のウイルス量が増加する[13]。さらに、糖尿病や肥満の患者では、細胞表面からのACE2の脱落が増加するため、体内でのACE2の再分布が促進され、肺に蓄積される[13]。逆に、ACE2受容体は、レニン・アンジオテンシン・アルドステロン系(RAAS)の調節に重要な役割を果たしており、その結果、心血管や肺の機能を支え、保護している[14., 15., 16.]。ACE2は、RAASのACE2/Ang(1-7)/MAS軸を活性化してアンジオテンシンII(AngII)のレベルをダウンレギュレートすることで、重要なバランスを維持し、それによって血管拡張作用、血管保護作用、抗線維化作用、抗増殖作用、抗炎症作用を付与する[17]。したがって、SARS-CoV-2の結合によってACE2が枯渇すると、心肺イベントや多臓器障害の悪影響が出る可能性がある[12]。興味深いことに、血管系のACE2を発現する内皮細胞(EC)は、SARS-CoV-2感染の重要な標的となっている[18., 19., 20.]。糖尿病患者や肥満患者では、血管系におけるベースラインのACE2の発現が低下することで内皮機能障害(ED)が生じ、COVID-19患者の血栓イベントの発生率が高くなる一因となっている[13,19,20]。
以前、SARS-CoV-1や中東呼吸器症候群コロナウイルス(MERS-CoV)によるコロナウイルス感染症では、罹患者の重症度や死亡率を高める独立した危険因子として、糖尿病の既往が確認されていた[21]。同様に、COVID-19では、肥満、高血圧、心血管疾患、慢性腎臓病(CKD)などの1つ以上の併存疾患の有無にかかわらず、糖尿病患者は院内集中治療室(ICU)での治療や気管挿管・機械的換気を必要とし、糖尿病でない患者と比較して、予後不良や全死亡リスクの増加と相関している(図1)[1]。興味深いことに、COVID-19患者における新規発症の糖尿病とそれに関連する重篤な代謝性合併症(糖尿病性ケトアシドーシスおよび高浸透圧)の発生は、糖尿病とCOVID-19の間に双方向の関係があることを示している(図1)[22]。
図1 COVID-19患者における糖尿病/高血糖と考えられる転帰
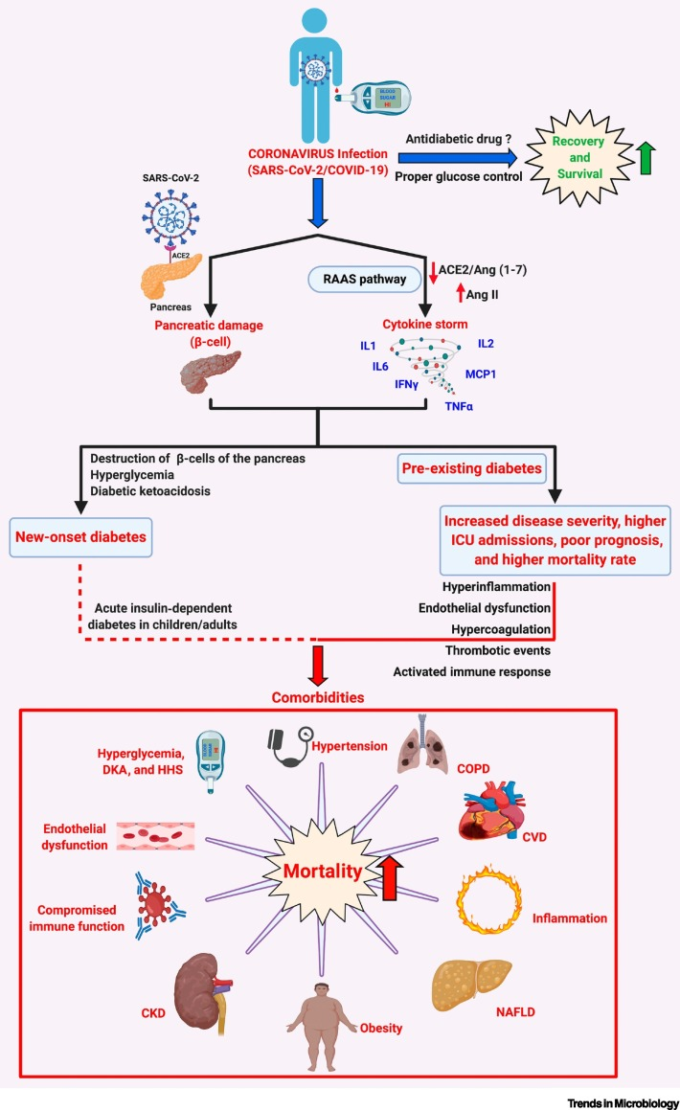
SARS-CoV-2感染によりRAASが活性化されると、AngII/AT1R軸を介して「サイトカインストーム」が生じ、腫瘍壊死因子-α(TNF-α)インターロイキン(ILs)1/2/6,インターフェロン-γ(IFNγ)単球化学吸引性タンパク質-1(MCP1)などの炎症性サイトカイン/ケモカインが合成・分泌される。SARS-CoV-2感染者で糖尿病の既往がある場合、糖尿病に伴う炎症促進状態や内皮機能障害、1つ以上の併存疾患-肥満、高血圧、心血管疾患、NAFLD、CKDなど-の発生率が高くなる。糖尿病のCOVID-19患者では、重症度の上昇、集中治療室(ICU)への入室率の上昇、予後の悪さ、死亡率の高さの原因となっている可能性がある。興味深いことに、SARS-CoV-2が膵臓のβ島に感染し、β細胞の損傷を引き起こすことで、COVID-19患者の糖尿病の新規発症、重度の高血糖、DKAを引き起こすことも報告されている。適切な血糖降下剤を用いて治療し、血糖値を適切に管理することで、COVID-19に罹患した糖尿病患者の回復と生存を助けることができる。糖尿病性COVID-19患者の病気の結果に影響を与える可能性のある、ある種のグルコース低下剤と抗ウイルス治療を組み合わせて使用することの利点、禁忌、制限など、様々な側面を注意深く分析する必要がある。略語の説明 ACE2,アンジオテンシン変換酵素2,AngII、アンジオテンシンII、AT1R、アンジオテンシンII I型受容体、CKD、慢性腎臓病、COPD、慢性閉塞性肺疾患、COVID-19,コロナウイルス感染症2019,心血管疾患、心血管疾患。DKA、糖尿病性ケトアシドーシス、HHS、高血糖高オスモル症候群、NAFLD、非アルコール性脂肪性肝疾患、RAAS、レニン-アンジオテンシン-アルドステロン系、SARS-CoV-2,重症急性呼吸器症候群新型コロナウイルス。BioRender.comで作成。
血糖値を適切に管理することで、病状の重症度、ARDSの発生率、ICUへの入室、人工呼吸器のサポートが減少し、糖尿病の既往のあるCOVID-19患者の回復が促進されたという報告がある(図1)[10]。血糖値を管理するためにいくつかの抗血糖薬があるが,高血糖をコントロールし,関連する有害事象を抑制するためには,COVID-19患者に安全に投与できる最適な抗糖尿病薬を慎重に見極める必要がある。この点、メトホルミン治療は、COVID-19患者の疾患の重症度と死亡率を低下させるため、糖尿病のCOVID-19患者の治療に有益であった[16,23]。本論文では,メトホルミンの多面的な有用性を強調するとともに,メトホルミンを糖尿病性COVID-19患者の治療に有効な薬剤として再利用する可能性を検討している。
糖尿病とCOVID-19 疾患の重症度と死亡率の増加
糖尿病患者は、免疫反応が低下しており、非糖尿病患者に比べて重篤な細菌やウイルスの感染症/疾患にかかりやすく、回復に多くの時間を要し、副作用が長引く傾向がある[24]。血糖値を適切に管理・維持すること(一貫した高血糖を避けること)は、慢性糖尿病患者の免疫・炎症反応を調整し、感染症と闘う身体の能力と密接に関係している[10]。高血糖/糖尿病のCOVID-19患者では、様々な細菌/ウイルス感染症の際に、炎症や免疫反応に関連した疾患の深刻な経過と高い死亡率が観察されたが、これは血糖値をコントロールすることで大幅に改善された。
COVID-19と既往の糖尿病
糖化ヘモグロビン(HbA1c)とSARS-CoV-2感染症/COVID-19関連の入院リスクをプロットすると,特徴的なJカーブを描き,糖尿病が感染症(特に呼吸器系の感染症)のリスクを高めることを示している[1]。糖尿病の既往はCOVID-19の発生リスクを増加させなかったが,糖尿病患者ではSARS-CoV-2感染症(COVID-19)の重症度が有意に増加し,それによって入院や救急治療を必要とするリスクが増加した[1]。高齢の重症糖尿病患者のCOVID-19患者は、誇張された炎症反応を示し、人工呼吸やICUでのサポートを必要とする可能性が高く、糖尿病のないCOVID-19患者に比べて死亡リスクが著しく高かった[25]。世界的な研究では、糖尿病を有するCOVID-19患者では、重度の肺炎症例、ICU入室リスクの増加、および死亡率の上昇が裏付けられた(表1 )。
表1 既往の糖尿病の有病率とCOVID-19の転帰([1]より引用
| 研究タイプ | 研究の起源 | 調査対象母集団 | 糖尿病の有病率(%) | 結果 | 参照 |
|---|---|---|---|---|---|
| 回顧展 | 中国 | 258 | 24 | ↑死亡率 | [ 26 ] |
| メタアナリシス | インド | 16 003(33の研究から) | 9.8 | ↑病気の重症度 ↑死亡率 |
[ 27 ] |
| 回顧展 | 中国 | 1590年 | NA | ↑ICU入室、または侵襲的換気、または死亡 | [ 28 ] |
| メタアナリシス | 中国 | 1527年(6件の研究から) | 9.7 | ↑ICU入室 | [ 29 ] |
| メタアナリシス | イタリア | 1687年(6件の研究から) | NA | ↑病気の重症度 | [ 30 ] |
| メタアナリシス | イタリア | 355(6つの研究から) | 35.5 | ↑死亡率 | [ 30 ] |
| 回顧展 | 米国 | 5279 | 22.6 | ↑入院 | [ 31 ] |
| メタアナリシス | イタリア | 1382(4つの研究から) | NA | ↑ICU入室 | [ 32 ] |
| メタアナリシス | イタリア | 471(4つの研究から) | NA | ↑死亡率 | [ 32 ] |
| 回顧展 | 中国 | 191 | 19 | ↑死亡率 | [ 9 ] |
| 回顧展 | 中国 | 7337 | 13 | ↑死亡率 | [ 10 ] |
| 回顧展 | 中国 | 193 | 25 | ↑死亡率 | [ 25 ] |
| 回顧展 | イタリア | 59 | 44 | ↑病気の重症度 ↓生存 |
[ 33 ] |
| メタアナリシス | 中国 | 1576(7つの研究から) | NA | ↑病気の重症度 | [ 34 ] |
| コホート | イギリス | 61 414 470 | 0.4(1型糖尿病) | ↑死亡率 | [ 35 ] |
| コホート | イギリス | 61 414 470 | 4.7(2型糖尿病) | ↑死亡率 | [ 35 ] |
| 回顧展 | フランス | 1317 | 88.5 | ↑機械的人工呼吸および/または死亡率のための気管挿管 | [ 36 ] |
COVID-19と新規発症の糖尿病
エンテロウイルス、ロタウイルス、ムンプスウイルスなどのウイルス感染症は、急性の1型糖尿病を引き起こす可能性がある[37]。SARS-CoV-1 に感染すると、過去に糖尿病の診断や既往歴のない人が急性高血糖を発症し、そのような人の死亡率が高くなる独立した指標となった [38]。これは、SARS-CoV-1ウイルスが膵島のACE2受容体に結合し、膵島に急性の損傷を与えることと関連していた[38]。
同様に、既存の糖尿病がないにもかかわらず、COVID-19の患者に新たな高血糖が発生したのは、SARS-CoV-2ウイルスの感染が原因である可能性がある[1,22]。膵臓のACE2受容体がSARS-CoV-2の結合と侵入を促進していることを示唆する証拠があり、続いて起こる細胞障害がCOVID-19患者の糖尿病の新規発症を説明するものと思われる[1,39]。SARS-CoV-2が膵臓のACE2受容体に結合すると、ACE2の活性が低下し、RAASのバランスが崩れる[40]。その後、AngIIが蓄積され、AngII/アンジオテンシンII I型受容体(AT1R)軸が過剰に活性化されることで、マクロファージが活性化され、NF-κBシグナルが誘発されることになる。これにより、いくつかの炎症性サイトカインが過剰に合成・分泌され(高サイトカイン血症/サイトカインストーム)膵臓の損傷を引き起こし、COVID-19患者の新規発症の糖尿病を一部説明している[17,40,41]。いくつかの炎症性サイトカイン/マーカー[インターロイキン(IL)-1β、IL-6,IL-10,および腫瘍壊死因子α(TNF-α)]のレベルの有意な上昇が、重症のCOVID-19患者およびICUに収容されたCOVID-19患者で報告され、IL-6のレベルの上昇は死亡率の上昇と相関していた[41,42]。ヒト膵臓α-細胞およびβ-細胞にSARS-CoV-2を侵入させるための疑似ウイルスを用いてウイルスのトロピズムを研究した試験管内試験モデルでは、膵臓細胞はSARS-CoV-2の侵入に対して高い寛容性を示し、COVID-19患者に典型的なケモカインの誘導を模倣していた[37]。
33人の小児(過去にSARS-CoV-2に曝露されたか,SARS-CoV-2の活動性感染があった)を対象とした研究では,そのうち30人(生後23カ月から 16.8歳)に新規発症の1型糖尿病が発生したことが報告されている[43].21人の子供(70%)が糖尿病性ケトアシドーシス(DKA)を発症し、21人の子供のうち11人が重度のDKAを報告した[43]。直接的な関連性はないものの、この研究では、SARS-CoV-2への曝露が子供の新規発症1型糖尿病の増加を引き起こしたと仮定している[43]。ある単発の研究では、DKAを呈した19歳の男性に高い血糖濃度(552mg/dl)とHbA1c(16.8%)の値が報告されており、SARS-CoV-2に対する抗体が陽性であったことから、入院の5-7週間前にCOVID-19に感染した可能性が示された[44]。興味深いことに、1型糖尿病の発症につながる自己免疫因子は除外されており、COVID-19と糖尿病発症の因果関係は、ACE2受容体を介したSARS-CoV-2のβ細胞への感染と、細胞に対するウイルスの直接的な細胞溶解作用によるものである可能性が示唆された[44]。驚くべきことに、新たに高血糖を発症した(糖尿病を発症していない)と診断されたCOVID-19患者の死亡率は、既存の糖尿病患者に比べて有意に高いことが報告されている[45,46]。
保健当局は、COVID-19患者に対して、血糖値を頻繁にモニタリングし、高血糖の可能性のある徴候・症状に注意を払うことを求める一般的な健康上の勧告を行う必要がある。治療法の推奨は、初期および継続的な血糖値の測定値と患者の病歴に基づいて行われなければならない。炎症マーカー、凝固因子、急性期反応物質、肝機能、腎機能を評価することで、高サイトカイン血症を特定し、血栓性イベントを予測することができる。したがって、治療計画に必要な調整を行えば、ハイリスクの糖尿病患者COVID-19の予後と生存率を改善することができる。
内皮機能障害 糖尿病とCOVID-19に共通する問題点
血管系は、SARS-CoV-2の感染に対して最も脆弱である[18]。ECはACE2受容体を発現しており、この受容体を介してSARS-CoV-2が細胞内に侵入する[19]。SARS-CoV-2の粒子と宿主の炎症細胞がECの内部で発見され、内皮細胞と炎症細胞の死が認められたことから、COVID-19患者の疾患の進行と転帰には、内皮とその機能の変化が関与している可能性が示唆された[19,20]。COVID-19 は、D-ダイマー、von Willebrand factor(VWF)フィブリノーゲン、可溶性 P-セレクチンの上昇、重症の COVID-19 ICU 患者における VWF 活性と第 VIII 因子活性の上昇が非 ICU 患者と比較して明らかになるように、ED、過混濁/凝固、血栓イベントの発生率の上昇、微小血管合併症と関連している [18,47,48]。静脈血栓塞栓症、微小血管肺血栓症、動脈イベント、播種性血管内損傷の発生率の増加は、重症COVID-19患者のICU入室数の増加、終末期イベントの発生、死亡率と関連していた[1,18,48,49]。
糖尿病のCOVID-19患者では、糖尿病に伴うEDがCOVID-19の重症度を悪化させるのか、それともCOVID-19の感染が糖尿病に伴うEDを際立たせるのか、正確に述べるにはまだ早すぐ。糖尿病では、内皮が高インスリン血症、高血糖、遊離脂肪酸の過剰にさらされ、その結果、活性酸素種(ROS)の増加や内皮の一酸化窒素(NO)レベルの低下などの様々な誘因に応じて、有害な分子イベントが次々と発生し、EDを引き起こす[50]。糖尿病に伴うEDとその結果としての血栓促進状態は、糖尿病のCOVID-19患者における血栓塞栓症イベントのリスクを高めると考えられる[1,25,51]。さらに、進行性糖化最終産物(AGEs)のレベルの増加と、それに続くAGEsの受容体(RAGEs)の活性化は、糖尿病における血管の過透磁率の増加、白血球の接着力の増加、および血管外遊出の増加に裏付けられた、血液凝固を促進するEDおよび慢性血管合併症に寄与している[52,53]。肺の1型肺胞上皮細胞はRAGEを構成的に発現しているが、 EC、平滑筋細胞、神経細胞、免疫細胞におけるRAGEの活性化は、 RAGEリガンドの局所発現に依存している[53,54]。SARS-CoV-2に感染した損傷・死にかけた細胞から放出される高移動度グループボックス1タンパク質(HMGB1)S100カルシウム結合タンパク質A12(S100A12)その他の危険関連分子パターン(DAMPs)外因性病原体関連分子パターン(PAMPs)などのリガンド(AGEs以外)は、RAGEの活性化を介して自然免疫系を活性化することができる[53]。RAGEの活性化は、炎症性サイトカインや細胞接着分子をコードするNF-κB依存性の炎症性遺伝子のRAGEによる転写を介して、炎症反応を悪化させるフィードフォワードループを形成する[53,55]。
すべてのCOVID-19患者、特に糖尿病患者に対しては、EDや血栓イベントのマーカーを常に臨床的に評価し、X線検査を行い、血栓予防/抗凝固療法を行うことが標準治療の一環として推奨されている[48,56]。正常な内皮装置と機能の回復と安定化をサポートし、炎症を標的とした治療的介入は、COVID-19患者の予後と生存を改善する可能性がある[57]。現在、COVID-19患者の疾患の重症度と死亡率を減少させるために、抗凝固療法と、RAS阻害剤、スタチン、抗酸化剤などの内皮機能を改善する潜在的な介入の有益な効果の可能性を調査する研究が進行中です[57]。
高血糖症とCOVID-19のアウトカム。血糖値コントロールの必要性
COVID-19患者が糖尿病の既往があるか、新たに糖尿病と診断されたか、あるいは糖尿病でないかにかかわらず、入手可能な証拠は、血糖値が(i)COVID-19に曝露された場合の感染のしやすさを決定する重要な因子であることを示している。COVID-19患者の(i)病気の重症度、(iii)治療戦略、(iv)回復、(v)転帰(病気の重症度/ARDS/ICU入院/心臓損傷/腎臓損傷/生存/死亡の観点から測定)を決定する重要な因子であることを示している[10,46,58,59]。高血糖と空腹時血糖値(FBG/FPG)の上昇(表2)は、COVID-19患者の重症度、ARDSの発生率、心臓および腎臓の障害を明らかに増加させ、ICUへの入室率および死亡率の上昇と相関していた。したがって、血糖値の測定は非常に重要であり、厳密な管理のもとで頻繁にモニターし、効率的な管理を行う必要がある。
表2 高血糖とCOVID-19の転帰([1]から引用している
| 研究タイプ | 研究の起源 | 調査対象母集団 | 糖尿病の有病率(%) | パラメータ | 結果 | 参照 |
|---|---|---|---|---|---|---|
| 回顧展 | 中国 | 810 | 100 | 入院中の血糖値の中央値(6.4ミリモル/ l;十分に管理されているvs10.6ミリモル/ l;不十分に管理されている) | ↑死亡率 ↑ARDS ↑心臓損傷 ↑腎障害 |
[ 10 ] |
| 回顧展 | イタリア | 59 | 42.4 | 入院時の血糖値(> 7.7mmol / l) | ↑病気の重症度 ↑死亡率 ↓生存 |
[ 33 ] |
| コホート | イギリス | 17 278 392 | 9.9 | HbA 1c(≥7.5%) | ↑死亡率 | [ 60 ] |
| 回顧展 | 中国 | 904 | 15 | 高血糖 | ↑死亡率 | [ 61 ] |
| 回顧展 | 中国 | 269 | 19.3 | 高血糖 | ↑死亡率 | [ 62 ] |
| 回顧展 | 中国 | 28 | 100 | ランダム高血糖 | ↑病気の重症度 ↑ICU入室 ↑ARDS ↑死亡率 |
[ 63 ] |
| 回顧展 | 米国 | 1122 | 40.2 | HbA 1c(≥6.5%)および制御不能な高血糖(24時間以内に2回以上の血糖測定値≥180mg/ dl) | ↑死亡率 ↑入院期間の中央値 |
[ 45 ] |
| コホート | 米国クウェート | 417 | 23.3 | 空腹時血糖値(FBGが1ミリモル/ lまたは5ミリモル/ l増加;FBG≥7ミリモル/ l) | ↑ICU入室 | [ 59 ] |
| 回顧展 | 中国 | 605 | 糖尿病の以前の診断はありません | FBG <6.1 mmol / l FBG –6.1〜6.9 mmol / l FBG> 7.0 mmol / l |
↑死亡率(FBG> 7.0mmol / lの患者) | [ 58 ] |
| 回顧展 | 中国 | 166 | 36.7(糖尿病) 12.7(FPG> 7.0 mmol / l) |
FPG> 7.0 mmol / l、ただしHbA 1c(<6.5%) | ↑ICU入室 ↑機械的人工呼吸 ↑死亡率 |
[ 64 ] |
メトホルミンの再利用:COVID-19治療戦略への影響の可能性
糖尿病患者の血糖値を管理するために、いくつかの抗血糖薬が日常的に使用されている。血糖値を効果的に下げ、COVID-19後の長期的な悪影響を抑え、最終的にSARS-CoV-2感染糖尿病患者の命を救うために、臨床医がどの薬/薬剤を(抗ウイルス剤など他の必要な薬剤と組み合わせて)推奨するかという疑問が残る。インスリンやシタグリプチンなどのグルコース低下剤は、糖尿病COVID-19患者の疾患重症度と死亡率を低下させた[33,65]。インスリンを使用した際に観察された有益な効果は、その抗炎症作用と免疫調節作用、および患者の血糖値コントロールの達成と相関している可能性がある[66]。逆に、インスリンのdisintegrin and metalloproteinase domain-containing protein-17 (ADAM17)に対する阻害作用は、ACE2の活性エクトドメインのタンパク質分解切断と脱落を促進し、ひいてはSARS-CoV-2感染に対するACE2の利用可能性と活性を高め、そのことがインスリン投与されたCOVID-19患者の臨床的プロファイルの悪化と予後の悪さの一因となっていると考えられる[61,67]。一方、最も多く処方されている経口血糖降下剤であるメトホルミンは、COVID-19の治療に複数のレベルで有益であると考えられる。メトホルミンは、十分に研究され、その効果が証明されていることから、血糖値の管理とCOVID-19の合併症を軽減するための答えとなる可能性がある。
メタアナリシス研究では、メトホルミン治療によってCOVID-19感染症関連死亡率が有意に低下したことが報告されている[68,69]。レトロスペクティブ研究からの報告では、高リスクの糖尿病性COVID-19患者の死亡率がメトホルミン治療によって有意に減少したことが示唆されている[23]。興味深いことに、COVID-19参加者6256名(うち2333名はCOVID-19診断前にメトホルミン治療を受けていた)を対象としたレトロスペクティブコホート研究では、メトホルミン治療が女性では疾患の重症度および死亡率の低下と関連するが、男性では関連しないという性差による効果が認められた[70]。1213人のCOVID-19患者(678人がメトホルミンを使用していた)を対象としたレトロスペクティブな研究では、2型糖尿病のCOVID-19参加者において、メトホルミン投与がアシドーシスの発生率の上昇(死亡率は上昇しない)と関連しており、これはメトホルミンの高用量、腎機能の低下、および重度のCOVID-19疾患と相関していたことが示された[71]。しかし、メトホルミンが2型糖尿病COVID-19患者の炎症を抑え、心保護をもたらす能力があることから、研究者らは、メトホルミン療法を継続しつつ、アシドーシスや腎機能の低下を継続的にモニタリングすることを推奨した[71]。Crouseらは、糖尿病COVID-19患者が非糖尿病COVID-19患者と比較して高い死亡率の原因となる顕著な独立した危険因子としての糖尿病の役割を再確認した[72]。彼らは、COVID-19と診断される前にメトホルミン治療を受けていた糖尿病性COVID-19患者の死亡率が3倍減少したことを報告したが、一方でインスリンの使用歴は死亡率に影響しなかった[72]。メトホルミンのこの有益な効果は、年齢、性別、人種、肥満、高血圧、あるいはCKDや心不全などの他のCOVID-19危険因子を補正しても観察された[72]。
メトホルミンは、血糖値を低下させ、インスリン感受性を高めるだけでなく、COVID-19に対する治療効果を示唆する分子作用が記録されている(詳細は図2を参照)。
図2 SARS-CoV-2感染症に対するメトホルミン治療の複数の利点
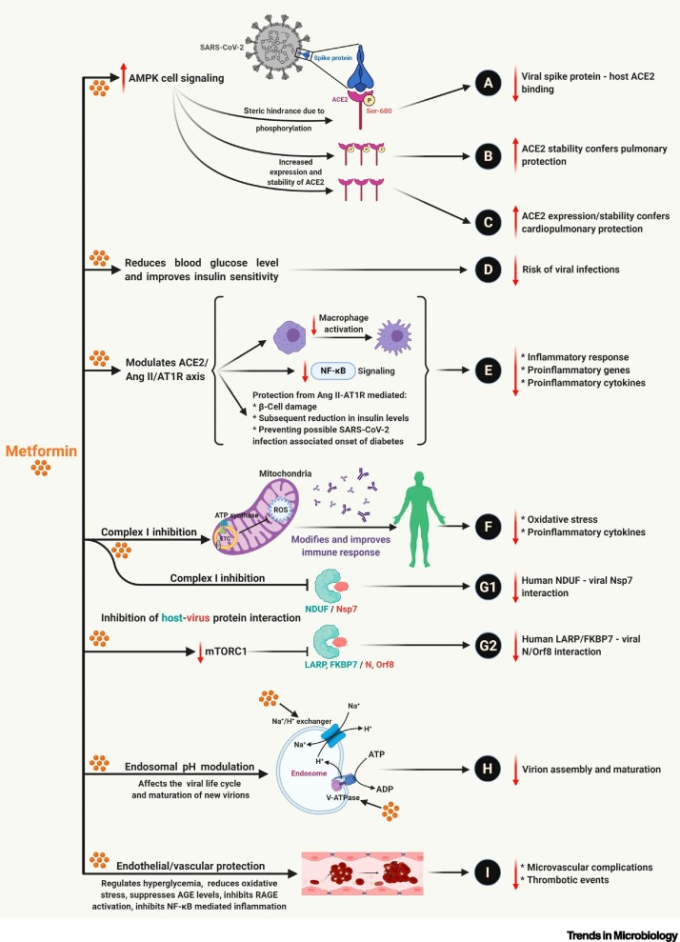
メトホルミン治療に伴うAMPKを介したシグナル伝達機構の活性化は、十分に研究され、記録されている[79]。
AMPK依存性の増加は、(A).ACE2受容体のリン酸化(Ser680)は、ACE2-ウイルススパイクタンパク質の結合を阻害し、ウイルスの細胞内への侵入を減少させるコンフォメーション変化を引き起こす[15,16]。
AMPKを介した(B)の増加。ACE2のリン酸化(ACE2のリン酸化は、ポリユビキチン化とそれに続く26-プロテアソームを介したACE2の分解を阻止する)。C)ACE2の発現は、その半減期/安定性を高め、RAAS調節を介して心肺保護を提供する[14., 15., 16.]。
メトホルミンが血糖値を下げ、インスリンの安定性を向上させる能力(D)は、SARS-CoV-2感染のリスクを低減させる[15]。メトホルミン治療に伴うACE2レベルと安定性の増加は、今度はACE2/AngII/AT1R軸を調節し、マクロファージの活性化とNF-κBシグナルを阻害することで、(E)炎症反応と炎症性サイトカインの放出を抑制する[16]。
メトホルミンは、ミトコンドリアの電子輸送鎖(ETC)の複合体Iを標的とし、活性酸素種(ROS)の生成を抑制し、(F)酸化ストレスを介した炎症性サイトカインの放出を抑制し、炎症性免疫反応を減弱させる[15,80]。
メトホルミンによるETCおよびmTORC1シグナル(AMPKまたはPI3K/Aktを介して)の抑制(G1およびG2)は,NDUF(ヒト)-Nsp7(ウイルス)およびLARP/FKBP7(ヒト)-N/ORF8(ウイルス)の相互作用など,宿主-ウイルス間のタンパク質相互作用の抑制に寄与している[81].宿主とウイルスのタンパク質相互作用が抑制されると,宿主依存のウイルス複製,ウイルスタンパク質の合成,ビリオンの成熟,放出が阻害される。
強塩基であるメトホルミンは,液胞ATPase(V-ATPase)とエンドソームのNa+/H+交換体(eNHEs)(H)を標的とし,細胞とエンドソームのpHを上昇させ,エンドサイトーシスサイクルとビリオンの組み立てと成熟を抑制する[15,82]。
メトホルミンの抗高血糖作用,抗酸化作用,免疫調節作用,抗炎症作用は,内皮機能障害を減弱させ,血管保護をもたらすことから,(I)SARS-CoV-2感染時の微小血管合併症や血栓イベントを減少させることができる。
略語の説明
ACE2,アンジオテンシン変換酵素2,AGE、進行性糖化最終生成物、AMPK、AMP活性化プロテインキナーゼ、AngII、アンジオテンシンII、AT1R、アンジオテンシンII I型受容体。mTORC1, mammalian target of rapamycin complex 1; RAAS, renin-angiotensin-aldosterone system; RAGE, receptor of AGE; SARS-CoV-2, severe acute respiratory syndrome coronavirus 2. BioRender.comで作成。
2型糖尿病患者にメトホルミンを使用すると、深部静脈血栓症のリスクが低下することが、非無作為化ペアマッチコホート研究で報告されている[73]。他の研究では、メトホルミンが血小板の活性化と細胞外のミトコンドリアDNAの放出を防ぐことで、出血時間を有意に延長させることなく、静脈および動脈血栓症を予防することが示唆されている[74]。メトホルミンは、AMP活性化プロテインキナーゼ(AMPK)Sirt1,内皮一酸化窒素合成酵素(eNOS)の活性化など、よく研究されているいくつかのメカニズムを通じて、内皮に複数の保護効果を与え、内皮依存性の血管反応を改善し、糖尿病のEDを減弱させる[75]。さらに、メトホルミンは、酸化ストレスの軽減、内皮炎症の抑制、白血球-内皮相互作用の抑制によって内皮を保護すると同時に、ECの老化やアポトーシスを抑制し、EDを防御する内皮グリコカリックスを維持することができる[75,76]。さらに、メトホルミンはRAGEの過剰発現を抑制し、高血糖によるNF-κBの活性化とそれに伴う血管壁細胞(ECや平滑筋細胞)やマクロファージにおけるいくつかの炎症性サイトカインや細胞接着分子の遺伝子発現を抑制し、血管保護作用を発揮する[77,78]。
肥満、高血圧、心血管疾患などの複数の合併症を持つ慢性糖尿病患者では、RAASの異常な活性化、酸化ストレスや炎症の増加、免疫系の活性化がSARS-COV-2感染時の臨床合併症を悪化させ、その結果、COVID-19患者の死亡率を高める要因となる。メトホルミンは、2型糖尿病患者や肥満患者を重症化から守り、COVID-19患者の生存率を高めるための予防薬として(重度の腎臓疾患がない場合)推奨できる。メトホルミンの保護効果は、複数の合併症を持つ慢性糖尿病患者における抗血糖効果やインスリン感受性を高める能力に留まらない。1つ以上の併存疾患がない/ある場合の糖尿病性COVID-19患者におけるメトホルミンの保護効果に寄与すると思われる、抗血糖作用、抗ウイルス作用、抗炎症作用、免疫調節作用、抗血栓作用を探る研究が必要である。
COVID-19治療におけるメトホルミンの有効性 – 臨床試験
COVID-19治療におけるメトホルミンの有効な治療法としての再利用と使用を支持するデータがある。ClincalTrials.gov(https://www.clinicaltrials.gov/)のデータ[2020年1月20日現在、一次検索キーワード(条件/疾患)。COVID-19,二次検索キーワード(その他の用語):糖尿病]では、COVID-19と糖尿病に関連する159件の臨床試験が示されている。しかし、これらの試験のうち、COVID-19iiのメトホルミン[二次検索キーワード(その他の用語):メトホルミン]に特化した試験は4件のみであった。
COVIDOUT – Outpatient Treatment of COVID-19 with Metformin」(NCT04510194,フェーズII/III、参加者750名、年齢30~85歳)は、入院していない成人のSARS-CoV-2感染者にメトホルミン(1500mg;1日)を投与することで、(i)低酸素症と救急部の利用を防ぐことができるか、(ii)COVID-19の疾患進行を防ぐことができるか、(iii)ウイルス量とC反応性タンパク質(CRP)を改善することができるかを調査することを意図しているiii。第II相試験「Pilot Study into the Use of Metformin and Low Dose Naltrexone (LDN) for Patients with Coronavirus Disease 2019 (COVID-19) – Assessment of Short and Long Term Effects」(NCT04604678;参加者80名、年齢30~70歳)では、メトホルミン(1500mg/日)とLDN(4. メトホルミン(1500mg/日)とLDN(4.5mg/日)の併用が、COVID-19患者の症状・重症度の軽減、回復時間、入院率、死亡率に及ぼす影響を、4週間にわたり一定の間隔で検討するものであるiv。
20名の参加者(18歳以上)による第II相試験(NCT04626089)では、「メタボリックシンドローム(MS)および2型糖尿病(DM2)患者に対するメトホルミングリシネートの有効性および安全性に関する適応症試験」を実施。SARS-CoV-2による重症急性呼吸器症候群で入院したメタボリックシンドローム(MS)および2型糖尿病(DM2)患者を対象とした無作為化二重盲検試験」で、メトホルミングリシン(620mg、1日2回)と標準治療の併用によるCOV患者の有効性と安全性を評価することを目的としている。1日2回)と標準治療を併用した場合の有効性と安全性を評価することを目的としている。同様の臨床試験(NCT04625985;フェーズII;18歳以上の推定20名が登録)では、入院中のCOVID-19患者(SARS-CoV-2感染による二次的なARDS)を対象に、メトホルミングリシネート(620mg;1日2回)と標準治療の有効性と安全性を検討しているvi。
臨床試験の中には、糖尿病ではないCOVID-19患者が含まれている場合もあり、その場合、メトホルミンが糖尿病ではないSARS-CoV-2感染患者を保護する効果があるかどうかを判断するのに役立つ。COVID-19におけるメトホルミンの使用を裏付ける分子メカニズムを解明し、COVID-19治療におけるメトホルミンとその治療可能性に関する未解決の疑問(「未解決の疑問」参照)に答えるためには、さらなる研究と臨床試験が必要である。
メトホルミン:COVID-19における副作用と禁忌の可能性
ほとんどの研究は、COVID-19患者におけるメトホルミンの有益な効果を概説しているが、いくつかの研究では、メトホルミンを使用しているCOVID-19患者においてアシドーシスのリスク(死亡率ではない)および疾患の重症度の増加を報告している[71,83]。このことは、重度の呼吸困難、腎障害、心不全のある患者ではメトホルミンが適切な選択ではないことを示唆しており[1]、薬剤選択において既往症や併存疾患に注意を払うことの重要性を強調している。さらに、メトホルミンの禁忌には投与前に対処する必要がある。
結語と今後の展望
SARS-CoV-2の新たな感染を防ぐために、世界は承認されたワクチンの安全性と有効性に期待を寄せているが、その一方で、ウイルスの拡散を抑えるための厳しい措置(ロックダウン/マスク/社会的距離を置く)が取られている。SARS-CoV-2/COVID-19に関する重要な情報は記録的な速さで収集されたが、ウイルス感染がどのように病気の進行に寄与し、個人によって重症度が異なるのかについては、まだ多くのことがわかっていない。しかし、高血糖と糖尿病関連の合併症がCOVID-19患者の重症度と死亡率を著しく高めることは明らかである。したがって、糖尿病のCOVID-19患者の予後と生存率を改善するためには、血糖値を適切にモニターし、管理する必要がある。抗糖尿病薬であるメトホルミンは、血糖降下作用に加えて、抗ウイルス作用、心臓保護作用、血管保護作用、免疫調節作用、抗炎症作用などが期待できるため、COVID-19の治療に再利用できる可能性がある。さらに、メトホルミンは安全性が高く、忍容性があり、副作用が少なく 2002年に特許が切れており(したがって経済的)メトホルミンの介入が有効なCOVID-19患者にすぐに利用できると考えられている[79]。
COVID-19との戦いで当面必要とされるのは、病気をうまく治療し、回復と予後を改善し、この病気の潜在的な「Long-hauler」であるCOVID-19の長期的な悪影響を弱めることができる効果的な薬剤/治療法である。COVID-19との戦いでは、効果的なワクチンと効率的な予防接種プログラムが最優先されているが、他の病状に日常的に使用されている薬剤が、この病気の治療に有効である可能性も見逃せません。妥当な安全性プロファイルを持つ現在販売されている1つまたは複数の薬剤を用いた宿主主導型の治療法は、このパンデミックに立ち向かうための優れたアプローチである。
未解決の質問
- メトホルミンを服用している糖尿病患者は、他の抗血糖薬を服用している糖尿病患者に比べて、SARS-CoV-2感染に対する抵抗力が強いか?
- 急性の新規高血糖を発症した「非糖尿病」COVID-19 患者にメトホルミン治療は有効か?
- COVID-19診断前にメトホルミンを服用していた糖尿病患者や肥満患者に認められたメトホルミンの有益な効果は、COVID-19診断後にメトホルミンを投与した場合、糖尿病の状態(非糖尿病、糖尿病の両方)やBMI(非肥満、肥満の両方)にかかわらず、再現できるか?
- メトホルミンは、糖尿病/高血糖のCOVID-19患者の内皮機能/機能不全、炎症、血栓イベントにどのような影響を与えるか?
- 非糖尿病のCOVID-19患者において、メトホルミン療法は炎症や血栓イベントを抑制するか?
- COVID-19の治療に用いられる他の薬剤とメトホルミンを併用した場合、禁忌はあるか?
- COVID-19患者におけるメトホルミン治療の長期的な影響はどのようなものであるか?
