Contents
THE TIME TO OFFER TREATMENTS FOR COVID-19
pubmed.ncbi.nlm.nih.gov/33721548/
2021年3月15日
概要
背景
2021年1月1日現在、全世界で確認されたCOVID-19の症例数は81,947,503件、死亡者数は1,808,041人となっている。現在、いくつかのワクチンが緊急に使用できるようになっているが、世界中の人々に予防接種を行うには何ヶ月もかかる。今、外来治療が急務となっている。可能な選択肢を検討した。
方法
COVID-19に対して今すぐ活用できる可能性のある治療法を特定するために、複数の情報源から最新の情報をレビューした。主題番号が100以上の進行中、完了、発表されたすべての試験結果を検索し、未発表の試験結果の発表を見つけるためにターゲット検索を使用した。
結果
2020年12月27日の時点で、現在募集段階にある750件の試験を確認した。そのうち、健康な人を対象とした予防を目的とした試験が122件、感染が確認された外来患者を対象とした治療を目的とした試験が100件、入院患者を対象とした治療を目的とした試験が390件であった。退院後の追跡段階に焦点を当てた試験は9件であった。試験の内訳は、ワクチンが60試験、ヒドロキシクロロキンが120試験、代替療法が33試験、コルヒチンが12試験、抗凝固剤が38試験、RNAポリメラーゼ阻害剤であるファビピラビル(FVP)が22試験、インターフェロンが19試験、グルココルチコイドが18試験、血漿製剤が58試験であった。153の試験では、年末までに登録を終了する予定であった。14種類の薬剤と7種類のワクチンについて、ヒトでの試験結果を報告した論文が83本見つかった。45件の無作為化または能動的対照研究があり、残りはレトロスペクティブな観察分析であった。ほとんどの論文は入院患者を対象としており、外来患者を対象とした論文は18件のみであった。米国では、レムデシビル、回復期血漿、合成抗スパイクタンパク抗体が緊急使用許可を得ている。また、COVID-19 呼吸窮迫症候群に対するグルココルチコイド治療の支持もある。いくつかの抗ウイルス剤の使用を支持するデータがあり、そのうちのいくつかは他の国で使用されている。
結論
ワクチンや抗体は抗原特異性が高い。集団予防接種に加えて、抗ウイルス剤の必要性がある。公衆衛生当局は、病気の継続的な広がりと死亡を防ぐために、限られたデータの中で難しい判断を下す必要があるだろう。
1. はじめに
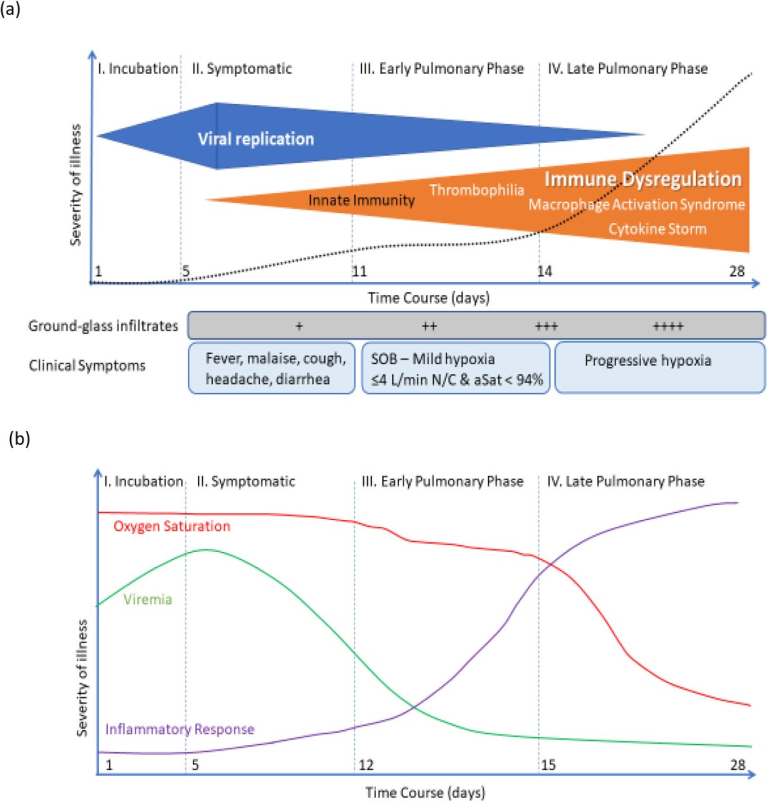
SARS-Cov-2は 2019年12月に中国の武漢で発生したことを発端に、異常なスピードで拡散した。2021年1月1日現在、220の国と地域に影響を与えたCOVID-19の確定症例は8194万7,503例で、全世界で180万8,041人が死亡している(1)。症候性COVID-19は、ウイルスの一次感染に関連した特徴的な一連のフェーズを示し、感染者の80%がインフルエンザ様疾患として発症する。その後、重症化する運命にある患者では、発症から7~10日以内に器官性肺炎が発症し、最大で5%の患者が補助人工呼吸を必要とする(図1参照)(2, 3)。この肺の段階では、サイトカインの上昇や凝固障害が見られることから、免疫反応が原因であると考えられている(4, 5)。
図1: COVID-19感染の各段階
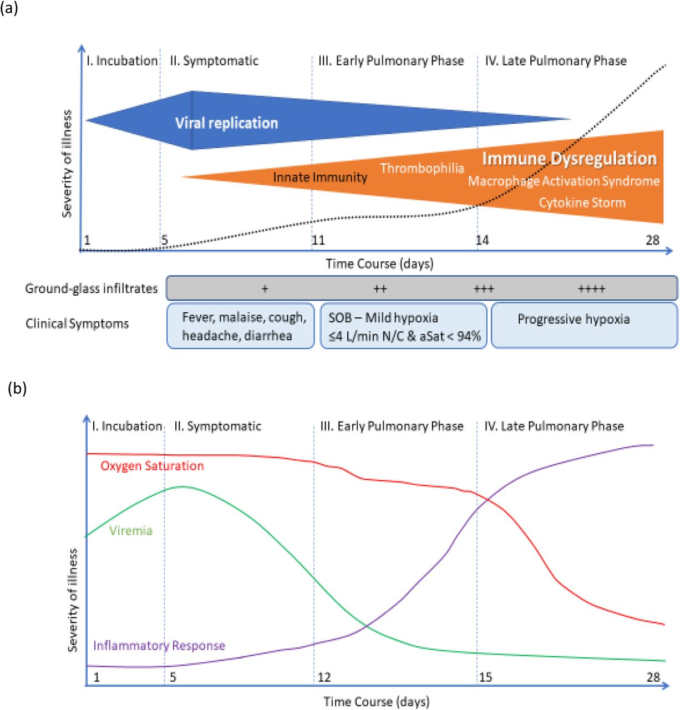
無症候性のウイルス血症は通常5日間続き、その後、上気道感染症の症状が現れる。その後1週間で免疫反応が起こる。肺浸潤が現れ始める。重度の感染症患者では、炎症反応が起こり、肺の症状が悪化し、低酸素状態になり、急性呼吸窮迫症候群になる可能性もある。
中国本土では、COVID-19の拡大を抑えるために、自宅隔離、企業活動の停止、渡航禁止、接触者の追跡管理などの積極的な取り組みが行われた。12月10日現在、中国では96,762人の確定患者と4,789人の死亡者が出ているが、4月以降、新規患者数は少なくなっている(1)。同様の対策により、台湾やニュージーランドでもパンデミックが抑えられた(1)。しかし、世界のその他の地域、特にヨーロッパでは26,490,355人の感染者と582,016人の死亡者が出ており、アメリカ(米国)では中国の5分の1の人口にもかかわらず、COVID-19の確定患者数は19,746,390人、死亡者数は335,789人となっており、パンデミックを抑えきれていない。(1). 西欧諸国では、中国と同様、パンデミックへの対応として、人と人との接触を減らすことが行われた。3月初旬から、社会的な集まりや会議は中止され、学校や会社は閉鎖され、レクリエーションエリアや公園、ビーチも閉鎖された。このように社会的な距離を置くことで、病気の広がりを抑えたが、中国で得られたような成果はなかった。経済的な圧力により、疫学的な封じ込めが緩和された結果、当初の4月のピークをはるかに上回る大きなパンデミックが継続した。
主要先進国では、COVID-19のワクチンを迅速に開発するために、これまでにない努力をしていた。2種類のmRNAワクチンは接種後2ヶ月で90%の有効性を示し、大量のワクチン接種が開始された。しかし、日々増え続ける新たな感染者や死亡者の数を考えると、予防接種だけに頼るのは賢明ではないと考えている。そこで、COVID-19の治療薬および予防薬の発売と、2021年のワクチン普及を目指して、現時点での選択肢を検討することにした。
2. 方法論
2.1 臨床試験
COVID-19 の潜在的な治療法を特定するために、複数の情報源から最新の情報を検討した。Reagan-Udall Expanded Access Navigator COVID-19 Treatment Hubを使用して、治療法の開発に取り組む企業の努力を追跡した。積極的に募集している治験と、登録を完了した治験を検索した。(A) covid-trials.orgを使用した。このレジストリは、International Clinical Trials Registry Platformおよびすべての主要な国内レジストリからデータを取得し、すべての試験をリアルタイムで照合する(6)。B)clinicaltrials.gov(米国国立医学図書館が管理する臨床試験情報のレジストリ)の情報を相互に検証した。さらに、(C)WHO ICTRP(世界保健機関の国際臨床試験登録プラットフォーム)(D)Cochrane COVID-19 Study Registerの試験を相互に検証した。複数の異なる治療法を用いた明らかに観察的な研究で、比較の手段がないものは除外した。さらに、試験の規模が小さいと一般的に規制当局の承認を得るための統計的検出力が不足するため、被験者数のカットオフ値を100に設定した。選択した各試験について、患者との接触方法(病院か外来か)対照処置の種類、試験が最初に登録された日、登録完了予定日を記録した。
2.2 公表された試験結果
検索は 2020年12月27日の週に実施した。pubmed.govで査読付き論文を、medRxivでプレプリントレポートを、WHO Global Literature on Coronavirus Diseaseですべての出版物を確認した。さらに、各治療法の候補について毎日Google™検索を行い、通常はプレスリリースとして発表され、ジャーナリストによってレビューされた予備的な報告を見つけた。すべての論文に加え、Clinicaltrials.govに完全な形で掲載されている試験結果も結果に含めた。被験者数が100人未満の試験は、試験が進行中の中間報告が多いため、除外しないであった。
2.3 共同執筆者間のバーチャル考察
原稿の普及を促し、共著者から広く「オープンソース」で意見を得られるようにするため、プレプリントサーバーのmedRxivを利用して、COVID-19の治療的介入の開発に関する系統的な分析を掲載した(7)。このプレプリント論文の連続したバージョンは 2020年5月下旬から現在まで、年代記として定期的に投稿されている(8)。このプロセスを経て、36人の共著者が参加する今回の多国籍コンセンサスが実現した。
3. 結果
3.1 現在の臨床試験のレビュー
2020年12月27日時点で、現在募集段階にあり、被験者数が100人以上の試験が750件確認された(補足表1)。このうち、122件は健常者の予防を目的としたもので、100件は感染が確認された外来患者の治療に分類され、390件は入院患者の治療を目的としたものであった。退院後の追跡に焦点を当てた試験は9件であった。残りの試験は対象者が不明確であった。試験の内訳は、ワクチンが60件、hydroxychloroquine( ヒドロキシクロロキン)が120件、代替療法が33件、コルヒチンが12件、抗凝固剤が38件、RNAポリメラーゼ阻害剤favipiravir(FVP)が22件、インターフェロンが19件、グルココルチコイドが18件、血漿製剤が58件であった。153の試験では、年末までに登録を終了する予定であった。
3.2 終了した試験
2020年12月27日時点で、被験者数100人以上で完了を報告している試験は97件あった(補足表2 入院患者を対象とした試験が52件、外来患者を対象とした試験が9件、予防試験が12件で、残りは混在していた。
補足表2:2020年12月27日時点で完了している試験
原文参照
各規制機関の登録IDと登録国、登録完了日を記載している。各試験の被験者の設定。HOSP:入院中、PREV:健康なボランティアまたは被ばくしたボランティア、OUTPAT:入院していない感染症患者、UNCLEAR:複数のカテゴリーを含む。SOC:Standard of Care(標準治療);FPV: ファビピラビル; LPV/R: ロパノビル/リトナビル; ヒドロキシクロロキン: ヒドロキシクロロキン; AZM: アジスロマイシン; TCM: 中国のハーブティー; NSAID: 非ステロイド性抗炎症薬;Conv Plasma: 回復期血漿:Convalescent Plasma
3.3 COVID-19試験の公表結果
2020年12月27日時点で、14種類の薬剤と7種類のワクチンに関するヒト試験の結果を報告した83の論文が見つかった(表1参照)。45件の無作為化試験またはアクティブコントロール試験が行われた。残りはレトロスペクティブな観察分析であった。また、外来患者を対象とした論文は15件のみで、そのうち7件はワクチンに関するものであったが、残りはすべて入院患者を対象としたものであった。
表 1. 2020年12月27日時点で発表された研究
原文参照
各薬剤は、発表された国とともに記載されている。被験者数が100人以上の研究を掲載した。対照処置の種類を示す。RCT:無作為化比較試験 PLAC:プラセボ、soc:各地域によって変動する標準治療。AC:アクティブコントロール:コントロールの選択肢を括弧内に記載している。OBS:retrospective observation study。LPV/R:ロパノビル/リトナビル、 ヒドロキシクロロキン:ヒドロキシクロロキン、AZM:アジスロマイシン、IFN:インターフェロン、tocilizumab。TCZ。SEV:重症、CRIT:重症、MOD:中等症。W.H.O: 世界保健機関
3.3.1
抗ウイルス剤のグループでは、発表された無作為化比較試験のうち最大のものは、静脈内投与のRNAポリメラーゼ阻害剤であるレムデシビルであった(9-13)。米国国立アレルギー・感染症研究所(NIAID)は、中等症から重症の患者1062人を対象に、レムデシビルの二重盲検無作為化プラセボ対照試験を実施した(10)。レムデシビルを投与された患者の回復期間の中央値は10日(95%信頼区間[CI]、9~11)であったのに対し、プラセボを投与された患者では15日(95%CI、13~18)であった(回復率比、1.29;95%CI、1.12~1.49;P<0.001)。P<0.001). 無作為化後29日までの死亡率のKaplan-Meier推定値は,レムデシビル投与群で11.4%,プラセボ投与群で15.2%であった(ハザード比,0.73;95%CI,0.52~1.03).この試験に基づいて、米国食品医薬品局(FDA)は、COVID-19入院患者に対するレムデシビルの使用を承認した。また、COVID-19の臨床状態が中等度の入院患者を対象としたレムデシビルの別の試験では、5日間の経過では標準治療と比較して11日目までに臨床状態の改善が認められたが、10日間の経過では認められなかった(12)。米国で行われたレムデシビルの試験では、ウイルスのクリアランスに関するデータは提供されていない。4月上旬、WHOは、入院中の患者のみを対象とした4つの別々の治療法を評価するために、適切に「Solidarity」と名付けられたメガトライアルを開催した。(a)RNAポリメラーゼ阻害剤であるレムデシビル、(b)HIV治療薬であるロパノビル/リタノビル(LPV/R)(c)LPV/Rとインターフェロンβ-1aの併用、(d)抗マラリア薬であるヒドロキシクロロキン( ヒドロキシクロロキン)とクロロキン(13)である。Solidarity Trialの結果は 2020年10月15日に世界保健機関(WHO)から報告された。その結果、5451名の入院患者を対象とした試験において、28日目の死亡率、機械的換気の必要性、入院期間に対するレムデシビルの効果は認められなかった(13)。
3.3.2
中国では、経口投与のRNAポリメラーゼ阻害剤であるファビピラビル(FVP)について、2つの肯定的な無作為化アクティブコントロール臨床試験が行われた(14,15)。FVPを投与した116名の患者とumifenovirを投与した120名の患者を比較した試験では、7日間の臨床的回復率はumifenovir群で55.9%、FVP群で71%でした(15)。ロシアでは、FVPの予備試験でウイルス排出期間の短縮が確認され 2020年6月12日に複数の病院で始まる臨床治療に承認された(17)。フォローアップの第3相試験では、10日目の臨床的改善が標準治療の15%に対して27%、SARS-COV-2のクリアランスが79%に対して98%であったと報告している(18)。インドでは、軽度から中等度のCOVID-19患者150人を対象とした研究で、臨床的治癒までの期間の中央値が、コントロールの5日(95%CI:4日、6日)に対してFVPでは3日(95%CI:3日、4日)となり、P=0.030となり、7月にCOVID-19の治療にFVPが承認された(19)。また、9月下旬には、日本で実施された無作為化比較試験の報告(未発表)で、FVPを投与された患者では、より迅速なウイルスの除去が可能であると発表された。
3.3.3
ヒドロキシクロロキンについては多くの研究が行われている(20-47)。マルセイユのグループは、SARS-Cov-2 のスクリーニングで陽性と判定された 3737 人の患者を対象に、QT 延長のリスクがある患者を除外した後、直ちに ヒドロキシクロロキン とアジスロマイシン(AZM)で治療した経験を報告している(20)。その結果、10日後までに89.4%の患者でウイルスの排出がなくなった。彼らの集団における全死亡率は0.9%で、60歳未満の患者にはなく、心臓突然死もなかった。彼らは無作為化対照集団を持たなかったが、この研究をきっかけに、COVID-19患者の治療に ヒドロキシクロロキンが世界中で広く使用されるようになった。
その後の入院患者を対象とした無作為化比較試験では、 ヒドロキシクロロキンの臨床的および死亡率的な利点は示されなかった。英国の入院患者1542人を対象とした無作為化RECOVERY試験では、主要評価項目である28日死亡率に有意な差はなかった( ヒドロキシクロロキン 26.8%対通常ケア25%、ハザード比1.09[95%信頼区間0.96-1.23]、p=0.18)(34)。Solidarity Trialでは、死亡率( ヒドロキシクロロキン RR=1.19(0.89-1.59,p=0.23,104/947 vs 84/906)機械的換気の必要性、入院期間に対して ヒドロキシクロロキンの有益性はなかった(13)。しかし、NYU Langone Healthで行われた2020年3月2日から4月5日までに入院した全患者を対象としたレトロスペクティブな比較研究では、標準的な ヒドロキシクロロキン+AZMレジメンに亜鉛100mgを1日1回追加する動きがあった(35)。亜鉛を投与した患者の死亡率(13.1%)は、亜鉛を投与しなかった患者の死亡率(22.8%)に比べて有意に低かった。
外来患者を対象とした ヒドロキシクロロキンの研究は限られている。インターネットを利用した1つの予防研究では、SARS-Cov-2に著しく暴露された健康な人に ヒドロキシクロロキンを5日間投与したところ、COVID-19に適合する新たな疾病の発生率は、 ヒドロキシクロロキンを投与された参加者(414人中49人[11.8%])とプラセボを投与された参加者(407人中58人[14.3%])との間に有意な差はなかった;絶対差-2.4%ポイント(95%信頼区間、-7.0~2.2;p=0.35)(36)。また、同じグループが、COVID-19にインピュートされた軽度の症状の患者423人を治療した(37)。14日目の時点で、 ヒドロキシクロロキンを投与された被験者の24%(201人中49人)は、プラセボを投与された被験者の30%(194人中59人)と比較して、症状が継続していた(p=0.21)。
PCRで確認された軽度のCOVID-19患者293人を対象としたスペインでの研究では、 ヒドロキシクロロキンを6日間投与しても、未投与の患者と比較して、ウイルス量や入院のリスクに差はなかった(38)。同じグループは、COVID-19指標症例672人の健康な接触者1,116人に ヒドロキシクロロキンを投与し、1,198人には通常の治療を無作為に割り当てた(39)。PCR で確認された症候性 COVID-19 疾患という主要アウトカムには有意な差はなく(通常のケア 6.2% 対 ヒドロキシクロロキン 5.7%;リスク比 0.89 [95%信頼区間 0.54-1.46]),SARS-CoV-2 感染の予防に関するエビデンスもなかった(通常のケア 17.8% 対 ヒドロキシクロロキン 18.7%).
ポルトガルで行われた大規模な集団研究では,慢性的に ヒドロキシクロロキン治療を受けているすべての患者を調査し,COVID-19に登録された患者の必須データベースと照合した(40).SARS-CoV-2感染に対するPCR検査の陽性率は、 ヒドロキシクロロキン投与を受けている患者では5.96%であったのに対し、そうでない患者では7.45%であり、調整済みオッズ比は0.51(0.37-0.70)であった。しかし、2つの独立した無作為化対照研究では、 ヒドロキシクロロキンによる病院勤務者の2ヶ月間の予防的治療の有益性を示す証拠は得られなかった(41,42)。
3.3.4.
ロパノビル/リトナビル(LPV/r)の発表結果は期待外れであった(13, 43-45)。99 人の患者に LPV/r を投与し、100 人に標準治療を行った無作為化試験では、臨床的改善までの時間、死亡率、ウイルスクリアランスに差はなかった(44)。入院患者1,596名を対象としたRECOVERY試験では、主要評価項目である28日死亡率に有意な差はなかった(LPV/r群22.1%、通常治療群21.3%、相対リスク1.04[95%信頼区間0.91-1.18]、(p=0.58))(45)。Solidarity Studyでは、28日目の死亡率、LPV/rのRR=1.00(0.79-1.25,p=0.97,148/1399対146/1372)人工呼吸の必要性、入院期間にLPV/rの効果はなかった(13)。
香港では、LPV/r+リバビリン+インターフェロンβ-1の3剤併用療法に割り付けられた86人の患者を対象とした研究で、より良好な結果が得られた(46)。LPV/r を単独で投与された 41 名の対照群と比較して、併用群では、試験治療開始から SARS-Cov-2 鼻咽頭ぬぐい液が陰性になるまでの期間の中央値(7 日[IQR 5-11])が、対照群(12 日[8-15]、ハザード比 4.37[95% CI 1.86-10.24]、p=0-0010)よりも有意に短かった。症状が完全に緩和されるまでの期間は,併用群が4日[IQR 3-8]であったのに対し,対照群は8日[7-9]であった;HR 3.92[95% CI 1.66-9.23]。この研究は、LPV/r療法を支持するものではなく、むしろインターフェロンβ-1を主要な治療法として重視していると解釈された。
3.3.5
インターフェロンの研究は励みになっている。キューバでは、LPV/rとクロロキンのバックグラウンド療法にインターフェロンα-2bとインターフェロンγを併用することで、78.6%の患者が4日間でウイルスクリアランスを達成したのに対し、インターフェロンα-2b単独投与の患者は40.6%でした(49)。入院患者を対象としたSolidarity Studyでは、28日目の死亡率(IFN RR=1.16(0.96-1.39,p=0.11,243/2050対216/2050)機械的換気の必要性、入院期間に対するインターフェロン注射の効果は認められなかった(13)。しかし、インターフェロンβ-1のネブライザーを使用した別の試験では、臨床状態の改善が認められたと報告されている(52)。
3.3.6
COVID-19 の肺性フェーズを緩和するために、IL-6 阻害剤のトシリズマブや IL-1 阻害剤のアナキンラを用いた免疫調節療法については、入院中の重症患者や重篤な患者の死亡率や挿管の必要性の低下を示唆する多くの観察研究がある(28, 53-66)。しかし、いくつかの無作為化比較試験では、tocilizumabの有効性は認められなかった(67-69)。COVACTA試験では、臨床状態、死亡率(トシリズマブ19.7%対プラセボ=19.4%)人工呼吸器を使用しない日数においてもトシリズマブの有益性は認められず(68)Cor-Immuno-Toci試験では28日目の死亡率の低下は認められなかった(69)。これらの無作為化比較試験におけるtocilizumabの結果は、対照群におけるグルココルチコイドの使用頻度の高さが影響している。
3.3.7
COVID-19 以前は、グルココルチコイド治療は重度の呼吸困難患者の死亡率を改善する治療法として認められてた(70)。デキサメタゾンは現在、いくつかのCOVID-19感染症院試験で有効性が実証されている(71-72)。RECOVERY試験では、2104人の患者がデキサメタゾンを10日間投与されるように無作為に割り付けられ、同時に通常のケアに割り付けられた4321人の患者と比較された(72)。全体では、デキサメタゾン投与に無作為に割り付けられた454名(21.6%)の患者と、通常の治療を受けた1065名(24.6%)の患者が28日以内に死亡した(年齢調整後の死亡率比[RR]0.83,95%信頼区間[CI]0.74~0.92,p<0.001)。デキサメタゾンは,侵襲的人工呼吸を受けている患者のサブグループにおいて,死亡を3分の1に減少させた(29.0% vs. 40.7%, RR 0.65 [95% CI 0.51~0.82]; p<0.001). 001)侵襲的人工呼吸を行わずに酸素吸入を行っている患者では5分の1に減少したが(21.5%対25.0%、RR 0.80 [95%CI 0.70~0.92]、p=0.002)無作為化時に呼吸補助を行っていなかった患者の死亡率は減少しなかった(17.0%対13 .2%、RR 1.22 [95% CI 0.93~1.61]、p=0.14)。) 他のグルココルチコイドのほとんどの試験で、COVID-19 の急性呼吸不全患者に同様の効果が認められている(73-80)
3.3.8
回復期血漿に関する有望なデータがある(81-86)。多国間で行われた一連の研究における 4173 名の患者の転帰を含むメタアナリシスでは、回復期血漿治療によって死亡率が 57%減少したと結論づけられている(85)。この減少率は、診断後3日以内に高力価抗体血漿を投与された患者で最大であった。Mayo Clinicがコーディネートした拡張アクセスプログラムで2万人以上の患者に安全性が確認されたことから、米国FDAは最近、回復期血漿の使用を緊急承認した(86)。SARS-COV-2のスパイクタンパクに対するモノクローナル抗体が合成された。外来患者にLY-CoV555中和抗体とRegeneron社の2つの抗体の組み合わせを感染初期に投与することで、入院の頻度を減らすことに成功しており、FDAは外来患者への使用を緊急承認した(88)。
3.3.9
通常、抗ウイルス剤として考えられていない薬剤に関する報告が多数ある。これらは、ファモチジン、ニタゾキサニド、フルボキサミン、コルヒチン、イベルメクチンなどです(89-96)。抗炎症剤であるコルヒチンは、105名の患者を対象としたGRECCOプラセボ対照無作為化臨床試験において、その有用性が示唆された(90)。主要臨床エンドポイントである人工呼吸への移行または死亡は、対照群では14%(50人中7人)コルヒチン群では1.8%(55人中1人)でした(オッズ比,0.11,95%CI,0.01-0.96,p=0.02)。現在、COVID-19の予防と治療の両方でイベルメクチンの有効性を示唆する無作為化比較試験を含む多くの試験が行われている(表1)。
3.3.10
多くのワクチンが、初期段階の試験で中和抗体や細胞性免疫反応の誘導に成功したと報告されている(98-104)。Moderna社とPfizer Biontech社のmRNAスパイク・プロテイン・ワクチンは、接種後2ヶ月間の観察期間において、症状のある感染を防ぐ効果が90%以上であるというデータを発表し、予防接種の緊急認可が与えられた。多くの国で大規模な予防接種が開始された。
4. おわりに
SARS-Cov-2は、現代のジェット機による移動が原因で、パンデミックに対する医療の備えを圧倒した。現在の予測では、2021年も新たな感染者と死亡者が続くとされている(105,106)。2020年12月31日には、世界中で470,046件の新規症例が報告された(1)。この174例のうち、814例は米国で発生した。これまでの臨床試験では、主に入院中の患者を対象として、死亡を防ぐことを試みていた。レムデシビル、回復期血漿、グルココルチコイド、抗凝固療法、COVID-19による呼吸不全の管理を改善することで、現在の入院中の死亡率を下げることができると期待されている(77)。しかし、病気の特定の段階を認識して治療を試みるという現在のやり方を変えることが不可欠である(107)。特に、入院を回避するためには、初期のウイルス感染の予防と治療に重点を置く必要がある。感染者の80%を占め、SARS-Cov-2の主な感染経路である軽症から中等症の外来患者に対する現在の予防と治療が不十分であるというジレンマを抱えている。重症の入院患者で得られた教訓は、必ずしも初期のウイルス感染期には当てはまらない。レムデシビルやファビピラビルなどの抗ウイルス剤、インターフェロン、回復期血漿、モノクローナル抗体などは、入院を必要とする肺症状が出る前のウイルス血症の初期段階で最も効果を発揮すると考えられる。
ワクチンは、公衆衛生当局がSARS-Cov-2を阻止するための唯一の希望となっている。ワクチンの開発は急速に進んでいるが、全世界の人々に投与するワクチンを開発するには、開発のスピードが速くても課題は減らない。ワクチン候補によって中和抗体やメモリーT細胞が産生されることはあっても、真の保護効果を実証するには、ワクチンを接種した集団を長期的に追跡調査する必要がある。現在のワクチンは、2ヶ月間の短い観察期間を経て、緊急用にリリースされる。ワクチンがどれだけ急速に第3相試験に進んだとしても、追跡調査の期間を短くすることはできないし、SARS-Cov-2の場合はいくつかの要因により長期化する可能性がある。第一に、誘導された抗体がウイルスの骨髄系細胞への侵入と内在化を促進することで起こる、感染の免疫増強のリスクがある(108)。この重大な合併症は 2017年に新しく開発されたデング熱ワクチンを襲った(109)。第二に、SARS-Cov-2の不吉な自己免疫性の病原性は、ワクチンに対する最初の免疫反応によってウイルスが完全かつ即時に駆除されない場合、長期的な遅発性の害のリスクを高める。さらに、コロナウイルスの再感染に関する研究によると、感染によって得られる免疫は1年未満であることが示唆されている(110)。新しいワクチンが導入された後、プラセボ治療を受けた患者が感染した場合に利用できる治療法がなければ、より効果的な新しいワクチンの臨床試験のためのボランティアを見つける努力が妨げられる。ワクチンは、目的とする病原体に特異的に作用する。ウイルスが突然変異して、新しいワクチンでは完全に防御できない可能性もある。すでに2つの変異型が出現し、大規模なパンデミックを引き起こしている。現在のワクチンがどの程度の防御力を発揮するかは、現在研究中である。最後に、COVID-19ワクチンが一般の人々にどの程度受け入れられるかは疑問である。2019年の季節性インフルエンザワクチン接種率は、わずか48%でした(111)。子どもは通常、COVID-19の症状が限られている。しかし、彼らは進行中の感染力のリザーバーとして機能する可能性がある(112)。現在、小児に対するワクチンの臨床試験結果はない。
また、SARS-Cov-2のように、全く新しいウイルスが出現する可能性もある。SARS-Cov-1,H1N1インフルエンザ、MERS、ジカ熱、エボラ熱などに比べて、COVID-19は過去20年間に人類を襲った6つ目の深刻なウイルスのパンデミックとなっているが、だからといって、これらの繰り返し起こるウイルスの脅威の重大さが減じるわけではない。SARS-Cov-2のように、抗原特異的なワクチンの開発には長い時間がかかり、その間に多くの犠牲者が出てしまう。このようにウイルスによる被害が相次いでいることから、抗ウイルス剤を広く使用する必要がある。COVID-19に対する現在の推奨は、疑わしい症状のある患者に対する特別な治療を行わず、自宅で隔離することである。必要とされているのは、COVID-19が陽性となったすべての外来患者を、病院での治療を必要とする悪化を待つのではなく、初期症状の時点で治療するために使用できる治療的介入である。Hydroxychloroquineは成功していない。ギリアド社は吸入式のレムデシビル製剤の開発を試みているが、その取り組みはまだ始まったばかりである。錠剤のFavipiravirは、感染の初期段階で使用することができ、現在、ロシア、ハンガリー、インドで発売されているが、米国とEUでは発売されていない。この薬には胚発生のリスクがあることが知られているため、ニキビ治療薬のトレチノインや多発性骨髄腫治療薬のサリドマイドと同様に、妊娠の可能性がある女性に対して使用を制限する必要がある。SARS-Cov-2の細胞侵入を阻止することができるセリンプロテアーゼ阻害剤であるcamostatの試験は、今年の第4四半期までに終了する予定である。同様に、コルヒチンを用いた予防試験も2020年の第4四半期までに終了する予定である。招集血漿は主に入院患者に使用される。同じ原理のモノクローナル抗ウイルス中和抗体は、ようやく外来患者への緊急使用許可が下りました。しかし、これらのモノクローナル抗体の生産規模は、治療を受けるべき外来患者全員に提供するにはあまりにも限られている。インターフェロン製剤はいくつかの研究で有望視されている。イベルメクチンについては、予防と治療の両方に効果があることを示唆するいくつかのランダム化比較試験が行われている。
しかし、現時点では、大規模な第3相無作為化プラセボ対照試験で安全性と有効性が証明された外来治療はない。試験が完了して分析されるまでは、薬剤の緊急使用を避けるべきだという強い主張があるが、提案されている薬剤は新しいものではない。しかし、提案されている薬剤は新しいものではなく、イベルメクチン、コルヒチン、インターフェロンなど、他の疾患で販売されている薬剤で、安全性プロファイルもよく知られている。今、世界の人々に外来での治療的介入を提供する必要性は明らかである。
緊急の臨床的必要性と、有効性を証明するための厳密な対照試験の必要性との間の対立を解決するための前例がある。私たちは、過去20年間、パンデミックとの戦いで最大の成功を収めたのは、AIDSの原因となるHIVウイルスとの戦いであったことを忘れてはならない。AIDSは1981年にMSM(男性と性交渉を持つ男性)のコミュニティで初めて認識された。この病気は死の宣告と考えられてた。
治療法がないために恐怖が広がり、感染者数は数百万人にも上ると予測された。最初のエイズ治療薬はアジドチミジン(AZT)で、1964年に癌の治療薬として期待されて合成された。その20年後、アメリカ国立がん研究所の責任者であるサミュエル・ブローダー博士が、この薬が試験管内でHIVウイルスに対して活性を持つことを示した(113)。バロース・ウェルカム社は、わずか300人の患者を対象とした試験を急遽開始した。バロース・ウェルカム社は、わずか300人の患者を対象とした急ピッチの治験を開始したが、AZTを投与した方がより多くの患者が生存できるとして、16週間で治験を中止した。FDAは、エイズ活動家からの大きな圧力を受け、たった1回の試験で、1987年3月19日に承認されたのである。FDAが薬の発売を承認するまでに20ヶ月もかかっていたのである。この試験のデザインと結果については、現在でも議論の余地がある。
LGBTコミュニティは、エイズのパンデミックに対抗するため、他の薬の早期リリースを求めて戦い続けた。1988年10月11日、FDA(米国食品医薬品局)で大規模な抗議活動が行われた。当時、アンソニー・ファウチ博士は、研究が進んでいても薬を広く入手できるようにするパラレルトラックのアイデアを公に発表した。”標準的な臨床試験のデザイン、つまり厳格な適格性基準、臨床試験の調査や医薬品の承認に伴う厳格な規制面は、有効な治療法のないこのような新規で大部分が致命的な疾患には適していないことは明らかであり、このアプローチをより柔軟で倫理的に健全なものにするにはどうしたらよいか、何度も熱心に議論した。その一つが、私や他の人たちがエイズ活動家と緊密に協力して開発した「臨床試験のパラレルトラック」と呼ばれるものであった。パラレルトラックとは、米国食品医薬品局が最終的に支持した概念で、ある薬の臨床試験において、高度に管理された標準的な入院基準とデータ収集を行うというものである。しかし、それと並行して、臨床試験の厳しい参加基準を満たさなくても、この致命的な病気に効果があると証明されていない治療法を切実に必要としている人々にも、その薬を提供することができる」(114)。
ファウチ博士が提唱した平行線が採用された。現在、HIV感染症の治療と予防のためにFDAが承認している薬は41種類またはその組み合わせである。ワクチンはまだない。現在、米国には110万人のHIV患者がいると推定されているが、そのほとんどが抗ウイルス剤のおかげでほぼ通常の生活を送っている。CDCは安全なセックスを推奨することでHIVの感染拡大を抑えることに大きく貢献しているが、HIVは社会的に距離を置くことが当たり前ではない。むしろ、HIV感染者に対しては、感染を予防するための高活性抗レトロウイルスレジメンを用いた「予防としての治療」と、毎日の抗ウイルス剤の併用による曝露前予防が、現在CDCによって支持され、リスクのある人々の広い範囲で採用されている(115)。
このパンデミックの危機において、私たちは公衆衛生当局に、現在の研究の流れを外来診療に変え、機関、商業、国際的な境界線を越えて、ヨーロッパ、中国、ロシア、日本、インド、その他の国のすべての薬剤、および競合企業から提出されたすべての無作為化比較試験データを、公式に発表されたもの、オンラインで公開されているもの、未発表のものを問わず、照合、結合し、最終的な確認結果を得ることを訴える。Solidarity Trialは、外来患者を対象とした無作為化比較試験を追求する世界的な取り組みを統一するために、何ができるのか、何をすべきなのかを示すモデルとなっている。同時に、良好な予備的結果が得られ、安全性に問題がない薬剤は、パラレルトラックで提供されるべきである。ロシアとインドでは、パラレルトラックが完全に実施され、FVPは両国で治療薬として提供されているが、さらに確認のための対照試験が進められている。中国とキューバでは、インターフェロン製剤が治療法として承認されている。医療従事者や高齢者などのリスクのある人々を対象とした、非常に大規模なパラレルトラック試験でのワクチン接種を許可することは合理的である。現時点では、他の選択肢がないため、改良されたワクチンを開発するために対照研究を行う必要があるにもかかわらず、ワクチン接種は普遍的に行われなければならない。しかし、SARS-Cov2を阻止するために、最終的な大量のワクチン接種への期待だけに頼るのは賢明ではない。 抗ウイルス薬はHIVや肝炎の抑制に成功しており、抗ウイルス薬はインフルエンザの制御のために毎年のワクチン接種と同様に重要だ。公衆衛生当局は、現在の限られたデータにもかかわらず、今、厳しい決断を下し、これ以上遅らせることなく、広い範囲で外来治療を行うことが必要である。
データ提供
登録されているすべての臨床試験の包括的なリストを補足表1に、終了したすべての臨床試験を補足表2に掲載している。
脚注
1 USCのケックメディカルスクールより
2 ローズ・サルター医学研究財団より
3 共同研究者