コンテンツ
The extended autonomic system, dyshomeostasis, and COVID-19
https://link.springer.com/article/10.1007%2Fs10286-020-00714-0
要旨
パンデミックウイルス性疾患COVID-19は、高齢者や様々な慢性疾患を持つ人に特に生命を脅かすものである。本論文では、このリスクの高まりには「拡張自律神経系」(EAS)の活性化が関与している可能性を探る。従来、自律神経系は交感神経系、副交感神経系、腸管神経系で構成されていると考えられてきた。しかし、過去100年の間に、神経内分泌系や神経免疫系が前面に出てきて、「自律神経」の意味が拡大していた。
追加のファセットは、アドレナリンがキーエフェクターである交感神経アドレナリン系、視床下部-下垂体-副腎皮質軸、アルギニンバソプレシン(抗利尿ホルモンと同義)、アンジオテンシンIIとアルドステロンが主なエフェクターで、レニン-アンジオテンシン-アルドステロン系、およびコリン作動性抗炎症性および交感神経性炎症性の経路が含まれている。
これらのシステムを制御しているのは、階層的な脳内ネットワークである「中枢自律神経ネットワーク」であり、その中には、Chrousos/Goldの「ストレスシステム」の構成要素が組み込まれている。
ホメオスタシス(allostasis)は、外傷性出血、窒息、敗血症など、人類の進化の中でホメオスタシスを脅かしてきたストレス要因を生き延びるために重要な役割を果たすが、EASの活性化が強かったり、長期に及ぶと害を及ぼす可能性がある。
緊急時の適切な対応には必要であるが、慢性的にホメオスタシスの効率が低下している状態(dyshomeostasis)でのEASの活性化は、不安定化した致死的な悪循環を誘発する閾値を低下させる可能性がある。
これらの概念から導き出された検証可能な仮説は、EAS活性化のバイオマーカーが臨床および病態生理学的データと相関し、COVID-19の転帰を予測すること、および個々の患者で特定された特定の異常を標的とした治療が有益である可能性があるということである。
序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)による急性疾患であるコロナウイルス病2019(COVID-19)は、効果的な治療法やワクチンがないまま、今のところパンデミックとなっている。世界中の生物医学研究者は、緊急にCOVID-19に焦点を移している。
COVID-19がもたらす大きな課題の一つは、高齢者や糖尿病、冠動脈疾患、肥満などの慢性疾患を抱えている人では、他の集団よりも致死的になる可能性が高いということである。この現象を説明するための概念的枠組みは提供されていない。
通常、肺炎と肺機能障害が臨床像を支配しているが、COVID-19が心臓、腸、腎臓、脳を含む他の身体器官やシステムに重要な関与をしていることは明らかである。本論文の目的は、COVID-19による死亡率の加齢関連性と、この疾患の多臓器、したがって多領域にわたる側面を説明できる視点を伝えることである。この論文では、これらの側面はいずれも自律神経失調症を反映しているのではないかと考えている。
プレゼンテーションでは、統合的な生理学的概念であるホメオスタシス、アロスタシス、ディスホメオスタシス、ストレスから始まり、「拡張」自律神経系(EAS)の概念を紹介する。EAS活性化のバイオマーカーがCOVID-19の転帰を予測する可能性があり、個々の患者における特定のEAS異常を標的とした治療は、万能なアプローチよりも効果的であるかもしれないということが、主な持ち帰りメッセージである。
ホメオスタシス
「恒常性」(ホメオスタシス)という用語は、身体の 「内なる世界 」の安定性を指す。システム生物学では、ホメオスタシスは創発的な現象であるが、統合生理学ではホメオスタシスはゴール、つまり目標である[71]。
このように、統合生理学の創始者であるクロード・ベルナールは、「内部環境の恒常性は、自由で独立した生命の条件である…すべての生命のメカニズムは、それらがどんなに多様であろうとも、常に一つの目的、すなわち内部環境の中で生命の条件の完全性を維持することを持っている」[12]と書いている。
そして、ホメオスタシスという言葉を造語したウォルター・B・キャノンは、「私の信念の第一条は、現在の知識の中でほぼ普遍的に確認されている、私たちの体の中で起こることが有用な目的に向けられているという観察に基づいている」[26]と書いている。
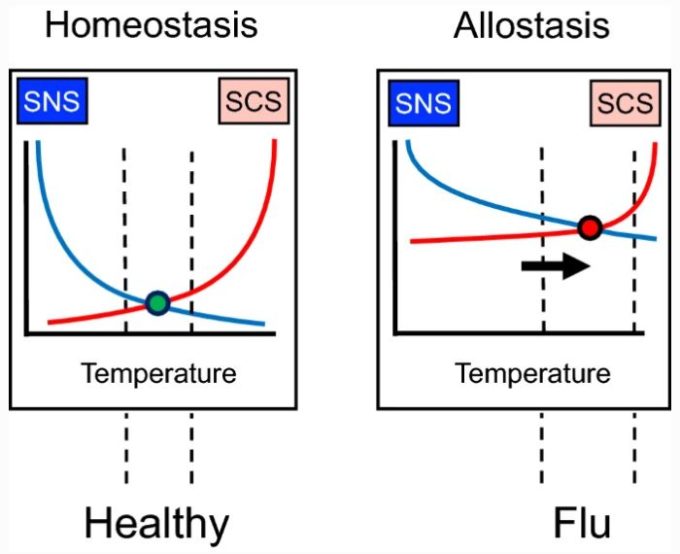
ホメオスタシスの典型的な例は、コア温度の調節である(図1、左)。寒さにさらされると、交感神経ノルアドレナリン系(SNS)の流出が増加し、その結果、皮膚血管収縮、震え、パイロエレクションが生じ、これらはすべて体温を維持する傾向がある。また、熱曝露に反応して交感神経コリン作動系(SCS)の流出量が増加し、発汗を誘発し、蒸発熱損失により体温を維持する傾向がある。
図1に示すように、交感神経コリン作動系(SCS)のアウトフローは、交感神経コリン作動系(SCS)のアウトフローの増加に比例して増加する。
図1
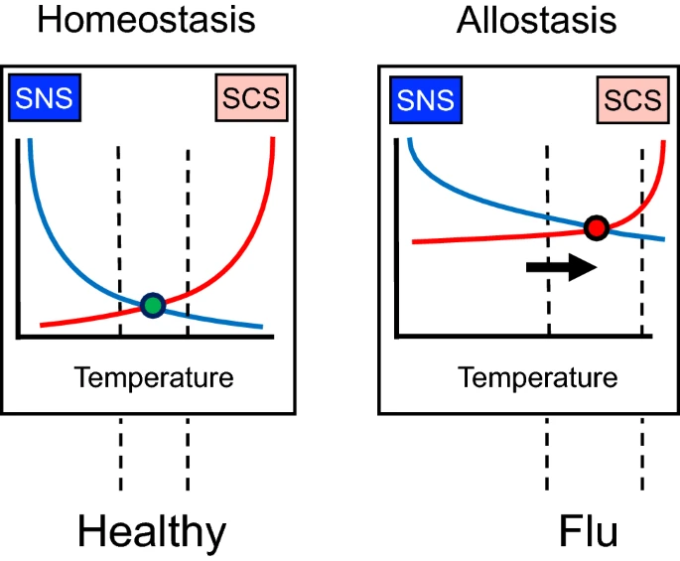
恒常性からアロスタシスへ。アロスタシスでは、反対に作用するエフェクター(黄色と白)の入出力曲線のシフトがあり、モニターされた変数(この場合は体温)を異なるレベルで調節する結果となる。許容範囲は縦の破線である。インフルエンザのような病気に伴う低悪性度の発熱は、アロスタティック状態の例である。
アロスタシス
アロスタシスとは、ギリシャ語で「他の」「静止している」を意味する言葉で、入出力曲線のシフトを意味する(図1右)。ウイルス性疾患に罹患したときの微熱がアロスタシスの一例である。体温は調整されているが、恒温設定を変えている。
恒常性の調整よりも恒常性の調整の方がエネルギーを消費するが、通常、恒常性の状態は一時的で有益である(発熱がウイルス性疾患の撃退に役立つかどうかは何十年も議論されている[130])。個人が回復すると、入出力曲線は急性疾患の前の状態に戻り、明らかな害はない。
しかし、恒常性状態では、エフェクターと標的臓器の両方の消耗も増大する-恒常性負荷[74]。加齢および慢性疾患に伴うホメオスタティック効率の低下(dysshomeostasis)は、アロスタティック負荷の蓄積を長引かせたり、強めたりして、最終的には致死的になりうるさまざまな悪循環(正のフィードバックループ)のしきい値を低下させる。
高齢者における恒常性不全
老化とともに回復力が低下することは、人類の進化の遺産の一部である。ウォルター・B・キャノンは『身体の知恵』の中で、この現象に全章を割いている。キャノンは、加齢に伴い、体温、ブドウ糖、血液のpH、酸素を含んだ血液をベースラインの状態に維持する能力は維持されるが、これらの重要な機能のそれぞれについて、暑さや寒さへの曝露、ブドウ糖の摂取、運動などのストレスを受けると、適切なレベルを維持する能力が低下するという、すでに多くの文献を要約している。
このような約1世紀前の考え方は今でも通用する。例えば、冷たい生理食塩水の静脈内注入による冷却中、55~72歳の高齢者は、18~23歳の若年者よりもコア温度の低下が大きく、血漿ノルエピネフーリン(ノルエピネフリン)レベル、全身血管抵抗、および発熱の増加が小さい [58]。
高炭水化物食を摂取した後、若年成人では食後の血漿アドレナリン(エピネフーリン、エピネフリン)レベルは、グルコースおよびインスリンレベルとは逆の関係にある二相性の日周パターンをたどる。加齢はこの反応の調節障害と関連しており [139] 、インスリン感受性は加齢とともに低下する [171]。
圧反射感受性、その結果として血圧を範囲内に維持する能力もまた、高血圧と関連した方法で、年齢の関数として低下する [16]。骨格筋交感神経のパルス同期バーストの速度は加齢とともに増加するが [170] 、筋交感神経のトラフィック [117] および心血管流出の動脈圧反射制御は高齢者では低下する [16]。
血漿 ノルエピネフリン レベル、ストレスに対する ノルエピネフリン 応答、骨格筋交感神経流出、および心臓 ノルエピネフリン の流出はすべて、おそらく ノルエピネフリン のニューロン再取り込みの減少と交感神経トラヒックの増加の組み合わせから、加齢とともに増加する [44, 54, 134]。しかし、反射的に増加した交感神経の流出量に対しては、血管収縮反応は鈍化する [44]。運動に対する心筋 ノルエピネフリン の波及反応は高齢者と若年男性で類似しているが、これは放出された ノルエピネフリン のニューロン再取り込みにおける加齢に関連した減少によるものであり、心筋交感神経流出の増加はおそらく鈍化していることを意味している [54]。
トリグリセリドを遊離脂肪酸に分解するカテコールアミンの能力は加齢とともに低下する。これは、運動不耐症への感受性を高め、寒冷曝露時に体温を維持する能力を低下させ、飢餓状態を乗り切る能力を低下させ、内臓脂肪率と無気力を増加させる可能性がある。
また、加齢に伴い、免疫応答性の効率も一般的に低下する。遺伝学、エピジェネティクス、および人生経験に応じて、「免疫年齢」を推定することができ、全死因死亡率と相関している[3]。脂肪マクロファージの偏りのない全トランスクリプトーム解析により、加齢がモノアミン酸化酵素A(MAO-A)をコードする遺伝子をNLRP3炎症因子に依存した方法でアップレギュレーションし、MAO-Aの阻害はノルエピネフリン誘発性脂肪分解を回復させることが明らかになっている[22]。
拡張自律神経系(EAS)
自律神経内分泌系
20世紀初頭にLangleyによって概念化された自律神経系は、3つの構成要素-交感神経系、副交感神経系、および腸管神経系-を有する [102]。Walter B. Cannonは、ここでは交感神経アドレナリン系(SAS)と呼ばれる神経内分泌系の構成要素を追加したが、その中でエピネフリンはホルモンの化学的メッセンジャーである[27、28]。
Cannonは、交感神経系と副腎は非常時には共に作用して恒常性を維持すると教えた[23、24]。この見解は今でも広く支持されているが、現在では、ニューロン成分(ここでは交感神経ノルアドレナリン系(SNS)と呼ばれる)とホルモン成分であるSASが構成的に活動しており [101]、日常生活のありふれた側面にさえ参加していることを示す豊富な証拠がある。
神経内分泌系は 「自律神経 」の意味を拡大する。現代の神経内分泌学では、特に視床下部ニューロンによって循環に分泌されるペプチドを指す。この意味でも神経内分泌系と自律神経系は相互に作用する。
例えば、サイロトロピンの分泌を増加させる甲状腺摘出術は、SNS神経伝達物質ノルエピネフリンの血漿レベルも増加させる[61]。脳内のコルチコトロピン放出ホルモン(CRH)の放出は、同時にSNSおよびSASの流出を増加させる [18、91]。
β-アドレナリン受容体作動薬イソプロテレノールのヒトへの注入は、コルチコトロピン(ACTH)とエピネフリンの両方の血漿レベルを減少させる [52];プレドニゾンによる亜急性グルココルチコイド治療は、直接記録された骨格筋交感神経アウトフローを減少させる [68]。下垂体機能低下症と副腎皮質機能不全の両方が血漿エピネフリンを減少させ、血漿ノルエピネフリンレベルを増加させる [152、172]。
アルギニンバソプレシン(AVP)は、出血に対するSNSの反応を阻害する[85]。培養副腎皮質細胞によるコルチコステロイド合成は、副腎髄質クロマフィン細胞との共培養により10倍に増加する[82]。一般的に、さまざまなストレス因子の間では、血漿エピネフリン応答はノルエピネフリン応答よりもACTH応答とより密接に結びついている[73]。
自律神経免疫学
自律神経の概念のもう一つの拡張は、免疫系に関係している。神経免疫学の分野では、神経系と免疫機能の相互作用に焦点を当てている。副腎皮質ステロイドによって発揮される抗炎症は、後述するSelyeのストレス理論[159]の基礎となった。自律神経-免疫相互作用のより現代的な例は、迷走神経によるサイトカインと「インフルナソーム」の調節である [97, 191]。インフラマソームの概念は、NOD-、LRR-、およびピリンドメイン含有タンパク質3、またはNLPR3に基づいている [173]。NLPR3は、RNAウイルスを含む多種多様な微生物を検出できる細胞内センサーとして概念化されている。NLPR3のインフラマソーム形成は、炎症性サイトカインであるIL-1βおよびIL-18の放出、およびパイロプトーシスによる細胞死につながる。パイロプトーシスは、組織内の細胞内ウイルス複製ニッチを除去する可能性のあるプログラムされた細胞死の一形態である。
サイトカインIL-6はHPA軸を活性化するだけでなく、アルドステロン、コルチゾール、アンドロゲン性ステロイドの産生を直接刺激する[137]。意識のある拘束されていないラットでは、TNF-αの投与により、グルカゴン、コルチコステロン、ACTH、ノルエピネフリン、および3,4-ジヒドロキシフェニルグリコール(DHPG、ノルエピネフリンの主な神経代謝物)の血漿レベルが上昇する[43]。
SNSの活性化による心筋βアドレナリン受容体の過剰活性化が炎症促進作用を発揮することが提案されている[94]。ヒトの末梢カテコラミン系には、実際には3つのタイプがある-ノルエピネフリンが局所的に作用する神経伝達物質であるSNS、エピネフリンがホルモンであるSAS、およびドーパミンが循環からDOPAを取り込んでアミノ酸を脱炭酸してカテコラミンを形成する実質細胞で産生され、そこから放出され、局所的に作用するDOPA-ドーパミン(ドーパミン)自分泌パラクリン系[75]である。後者のメカニズムは、定義上、拡散性神経内分泌系でポリペプチドホルモンを放出する「APUD」細胞(APUDはアミン前駆体の取り込みと脱炭酸を意味する)の活性である[124]。
ヒトの初代単球において、フェニルフーリンによるα-1アドレナリン受容体刺激は、NLPR3インフラマソームを抑制することが報告されている[87];しかしながら、IL-6およびNLRP3の発現増加によって証明されるように、同じ薬剤は生体内試験(in vivo)で心機能障害および炎症を誘発することが報告されている[195]。様々なストレスの多い状況において、エピネフリンレベルの上昇は炎症性サイトカインIL-6 [41, 84, 90, 96, 100, 135, 141]の上昇と関連している;しかしながら、この関係の根拠は全身的には研究されていない。
脳外での内因性ドーパミンの発生源は比較的よくわかっていない。腎臓では、ドーパミンは近位尿細管細胞による循環DOPA [190]の取り込みおよび脱炭酸により形成され、自然排尿を促進する自己分泌性副腎物質[75]として作用する[8]。崩壊性うっ血性心不全患者では、レボドパ投与により尿中ナトリウム排泄量が増加する[77]。DOPAまたはドーパミンの静脈内投与がNLRP3炎症ソームに影響を与えるかどうかは不明である。
炎症性サイトカインは、おそらく迷走神経求心性を介して、視床下部でCRHとAVPの発現を増加させる [34]。重症患者では、非生存者では、外因性に投与されたCRHに反応してACTHレベルが高く、コルチゾールの放出が長くなり、IL-6およびIL-8のレベルが高くなることが報告されている[46]。
コリン作動性抗炎症経路[182]では、迷走神経の背側運動核からの求心性神経伝達は、脾臓で終末を迎え、脾臓免疫細胞に作用してTNF-αの生成を減少させる腹腔上腸間膜後神経細胞上のα7ニコチン受容体サブユニットへのアセチルコリンの送達を増加させる[97, 150]。
ストレスと「ストレス・システム」
Hans Selyeはストレスを、身体に課せられたあらゆる要求に対する身体の非特異的な反応と定義した [161]。Selyeの概念化に沿って、1990年代にNIHのGeorge ChrousosとPhilip Goldは「ストレス症候群」を誘発する中心的なストレスシステムの存在を提案した[36, 168]。当初提案されていたストレス系の主要な要素は、視床下部の傍室核(PVN)であり、CRHはここから、また、大部分の脳のノルエピネフリンはここから、ポンズの小脳室核(LC)に由来していた(図2、左パネル)。CRHはHPA軸で下垂体からのACTHの放出を促進する。
図2
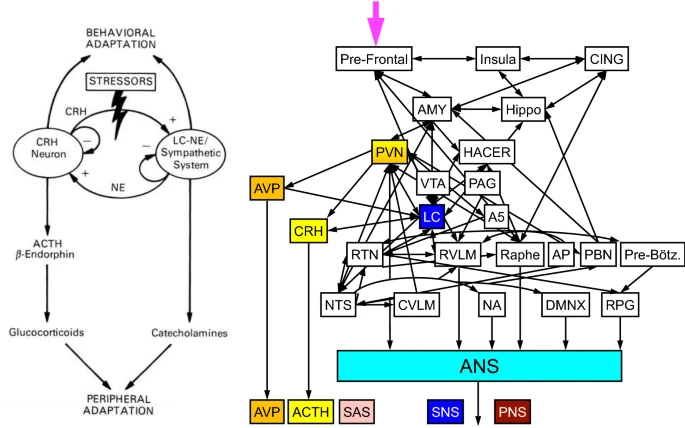
図2
中心的ストレスシステム。左の概念図(米国医師会の許可を得て転載)は、「」中枢性ストレスシステム 「」のChrousosとGoldモデルを示している。右側の概念図は、中枢性ストレスシステムと中枢性自律神経ネットワークの関係を示している。CING帯状皮質、AMY扁桃体、海馬、PVN視床下部傍室核、HACER感情反応を制御する視床下部領域、AVPアルギニンバソプレシン(アンチと同じ)、CRHコルチコトロピン放出ホルモン。VTA腹側索野,PAG末梢灰白斑,LC小嚢座,A5 A5ノルアドレナリン細胞群,RTN後脚核,RVLM吻側髄質,AP後葉領域,PBN傍頭核,Pre-Botz. プレ・ボッツィンガー複合体、NTS孤道核、CVLM尾部ベントロ側髄質、NA曖昧核、DMNX迷走神経背側運動核、RPG呼吸パターン発生器。ACTH 副腎皮質刺激ホルモン(コルチコトロピン)、ANS 自律神経系、SNS 交感神経ノルアドレナリン系(ノルエピネフーリン)、SAS 交感神経アドレナリン系(アドレナリン)、末梢神経系 副交感神経系(アセチルコリン)
元々のChrousos/Goldストレスシステムには修正が必要とされている。一つには、アルギニンバソプレシン(AVP、抗利尿ホルモン、ADHと同義)はPVNに由来するもう一つの神経内分泌因子である。別の点では、LCはSNSまたはSASの流出を直接駆動しない;他のいくつかの脳幹部位が駆動する [40, 48, 49, 79, 125]。より複雑なスキーマでは、ストレスシステムを「中央自律神経ネットワーク」 [10]内に組み込んでいる(図2、右パネル)。中枢自律神経ネットワークは、ノルエピネフリンが神経伝達物質であるSNS、エピネフリンがホルモンであるSAS、そしてアセチルコリンが神経伝達物質である副交感神経系(末梢神経系)を含む自律神経系の構成要素への流出源である[70]。
Selyeはまた、「一般適応症候群」[160]を概念化した。これにより、彼は3つの段階について言及していた。段階は警報期、抵抗期、疲労期であり、3つの病理学的結果は副腎肥大、胃出血、および 「胸腺リンパ系装置の巻き込み 」であった。警報期は急性期であり、現在の語彙ではHPA、SNS、SASの活性化が含まれる。Selyeが理論化した抵抗期は、時間の可変期間のために続くことができ、適応的であり、アロスタティック状態に対応している可能性がある。アロスタティック負荷の蓄積は、切迫した器質的死の前触れである疲弊期をもたらす悪循環の誘発のしきい値を減少させる。
EAS活性化の効果
交感神経アドレナリン系(SAS
エピネフリンは非常に強力なホルモンであり、多くの身体作用を発揮する。これらのほとんどはよく知られているので、ここではCOVID-19に関連する可能性のある部分のみを記載する。隔壁床および腎臓におけるエピネフリン誘発性血管収縮は、消化管および腎臓の灌流を低下させる。エピネフリンは発汗を増加させる [132] が、皮膚血管収縮とアドレナリン性発汗の組み合わせは、ショック状態にある人を特徴づける「冷や汗」を説明しているかもしれない。エピネフリンは心拍数と収縮力を増加させ[121]、心拍出量を増加させ、自発的な電気的脱分極と心電図的QTc間隔を増加させる[169]。
エピネフリンはまた、抗インスリン作用、肝グリコーゲンの分解、肝グルコース新生の刺激[163]、およびグルカゴンの膵分泌の刺激を含む複数の機序により、血清グルコース値[42]を増加させる[83]。
エピネフリンは、脂質の遊離脂肪酸への肝内分解を増加させ、熱を発生させ、褐色脂肪組織のアンカップリングプロテイン-1を介して熱発生を誘発する [179]。
エピネフリンは、α-2アドレナリン受容体[103、104]の占有を介して血小板[122]を活性化する。
エピネフリンはレニン-アンジオテンシン-アルドステロン系(RAS)を刺激する[76]。アンジオテンシンIIは強力な血管収縮薬であり、エピネフリンと併用することで、スプランクおよび腎血管抵抗性を増強することが期待される。アルドステロンは、体内の主要なミネラルコルチコイドであり、ナトリウムの再吸収と腎カリウムの損失を促進する。
エピネフリンは、膜貫通陽イオン流入を媒介するNa/K ATPasesの増強を介して血清カリウムおよびマグネシウムレベルを減少させる [42, 129] [9]。血清カリウムの低下は、刺激された血漿レニン活性の解離と血漿アルドステロンに対する明確な効果が少ないことを説明するのに役立つかもしれない[99]。
最後に、エピネフリンは恐怖の否定的な感情経験を強める [167]が、おそらくアドレナリン受容体の占有によって発揮される生理学的変化から脳への求心性情報を介してであろう。
交感神経ノルアドレナリン系(SNS)
SNSは同調的に活動しており[101]、起立[101]、食事の摂取、軽度の運動[158]、バルサルバ運動、および変化した環境温度への調整などの日常生活の活動中に、血管床間の心拍出量分布のパターン化された変化に重要な役割を果たしている。心血管系に加えて、虹彩、汗腺、消化管、膵臓、および腎臓へのSNS流出は、重要な「ハウスキーピング」の役割を果たしている。
ノルエピネフリンは神経伝達物質であり、ホルモンではないことを心に留めておくことが重要である。このような地域的な不均一性と異なる役割のため、血漿ノルエピネフリンレベルを測定しても情報が得られないことがある。例えば、安静時のヒトでは、低酸素は血漿 ノルエピネフリン を増加させることなく骨格筋交感神経流出を増加させる [151]。
腎交感神経流出の増加は、近位尿細管細胞によるナトリウム再吸収を促進する [66]。ノルエピネフリンとエピネフリンの両方とも、カリウムの細胞内取り込みを増加させるため、血清カリウム濃度を低下させる傾向がある[37]。
アルギニンバソプレシン/抗利尿ホルモン(AVP/ADH)
ADHとして作用するAVPは、水の腎滞留を促進する。急性疾患では、これは血清オスモラリティの低下および低ナトリウム血症として現れることがある [59]。加圧剤として作用するAVPは血管収縮と血圧に寄与する;しかしながら、その効果は全身の血管抵抗の他の決定因子によって隠蔽される可能性がある。さらに、脳内ではAVPは動脈圧反射を血圧を下げるようにシフトさせ、所定の血圧低下に対する交感神経活性化の最大量を減少させる [85]。
視床下部-下垂体-副腎皮質(HPA)軸
上述のように、HPA軸は中枢性ストレスシステムの主要なエフェクターと考えられていた。HPA軸の制御は、Selyeの理論やChrousos/Goldモデルで描かれたものよりも複雑である。例えば、重症患者では、循環コルチゾールのクリアランスが低下している[14, 138]。これはCRHの負のフィードバック制御を増強し、ACTH反応の減衰を説明する可能性がある。グルココルチコイドホルモンとグルココルチコイド受容体機能のリアルタイムダイナミクスに関わる研究では、HPA軸の脈動性と連続的な動的平衡が示されている[111]。
多発性硬化症の再燃に対してメチルプレドニゾロンの静脈内投与を受けた患者では、腹痛、吐き気、嘔吐、睡眠障害、および混乱、過敏性、落ち着きのなさなどの神経行動の変化を含む多様な急性症状の副作用がある [92]。一般的な臨床検査所見は、高血糖、低カリウム血症、血圧上昇、および抗炎症である。集中治療環境では管理の一環として高用量ステロイドが頻繁に使用されているため、これらすべての側面がCOVID-19の神経行動および臨床検査値の異常と関連している可能性がある。
副交感神経系(末梢神経系)
他の自律神経エフェクターとは異なり、末梢神経系は苦痛を感じない状況では活性化し、エネルギーを使い切るのではなく蓄積する傾向がある [70]。中枢ストレス系が活性化されると、末梢神経系の流出は一般的に減少する(図3の赤の負の符号)。末梢神経系抑制の症状には、頻脈、消化管運動の低下、唾液および涙の産生の低下、および膀胱緊張の低下が含まれる。迷走神経刺激はサイトカインTNF-αの産生を阻害する[106, 200]。
図3
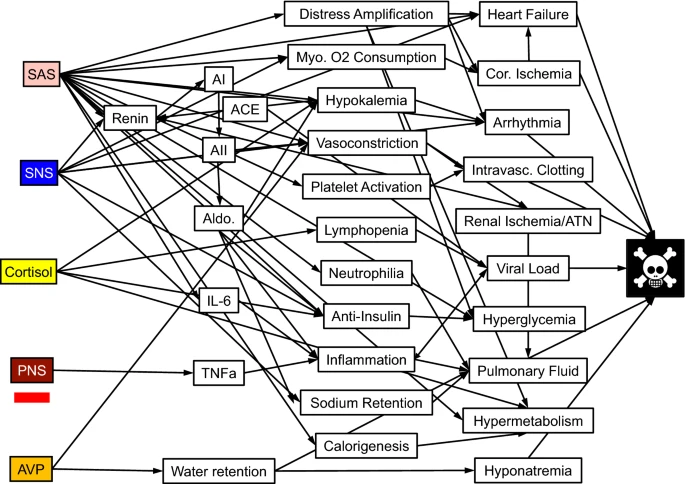
図3
EAS系の活性化から恒常性障害から死へ。EASの5つのエフェクター成分が左にある。中央に介入変数がある。危篤または死亡に寄与する因子が右にある。末梢神経系の下の赤いバーは末梢神経系の阻害を示す。AI アンジオテンシンI、ACE アンジオテンシン変換酵素、AII アンジオテンシンII、Aldo アルドステロン、ATN 急性尿細管壊死、IL-6 インターロイキン6、Myo.心筋、Cor.冠動脈、TNFa 腫瘍壊死因子アルファ
レニン-アンジオテンシン-アルドステロン系(RAS)
レニン-アンジオテンシン-アルドステロン系(RAS)は、細胞外液量、血圧、電解質、免疫機能の恒常性維持に重要な役割を果たしている。タンパク質分解酵素レニンの放出の主な決定因子は、SNSとSASの活性化(β-aアドレナリン受容体を介して作用)、腎灌流の低下、および腎臓の遠位尿細管へのナトリウム送達の低下である。レニンは循環蛋白質アンジオテンシノーゲンを切断してアンジオテンシンIを形成する。アンジオテンシンIはアンジオテンシン変換酵素(ACE)によってアンジオテンシンII(AII)に変換され、特に肺の血管内皮に多く存在する。AIIは多くの効果を発揮する。AIIは強力な血管収縮作用を持ち、アルドステロン(体内の主要な塩分保持ステロイド)の副腎皮質分泌を増強する。副腎髄質細胞では、AIIは細胞質イオン化カルシウムの増加を介してカテコールアミンの分泌を刺激する [203]。脳では、おそらく別個の局所RASを介して、AIIはAVP放出と飲酒行動を誘発し、交感神経の流出を増加させる。ACEのホモログであるACE2は、AIIをアンジオテンシン1-7(Ang 1-7)に変換し、これはAIIの効果に対抗する。したがって、ACE2を阻害することでAIIを増強することが期待される。今回の議論に関連して、SARS-CoV-2ウイルスはACE2との結合を介して細胞内に侵入する。
EASとリスクのバイオマーカー、COVID-19への応用について
COVID-19パンデミックの教訓の一つであり、不安と心配の種であるが、感染者の中で誰が急性呼吸窮迫症候群や多臓器不全に急速に移行するかを予測することは不可能であるように思われる。このセクションでは、このような移行のリスクが高いことを示す可能性があり、EAS機能の変化に関連する臨床バイオマーカーと実験室バイオマーカーについて説明する。
ここでは、突然の予期せぬ健康被害-地震、急性冠症候群およびストレス関連心筋症(たこつぼ心筋症)、および以前のウイルス性伝染病(SARS、中東呼吸器症候群)-について言及している。公表されている情報の範囲内で、各因子をCOVID-19に適用している。
年齢
2005年のハリケーン・カトリーナ[1, 19]や2011年の日本の地震/津波[39, 131]のような自然災害の前と後の医療記録の分析では、高齢者の罹患率と死亡率が不均衡に増加していることが示されている[118]。しかし、これは普遍的な知見ではない[183]。
COVID-19による高齢者の重篤な疾患または致死リスクの高さは明らかである。米国疾病対策センターによると、入院、集中治療室入院、および症例死亡率は年齢に関連している[143]。75~84歳の症例死亡率は55~64歳の約10倍、20~22歳の約40倍である。
高血糖症
高血糖症は、糖尿病の既往歴のない患者でも重症患者によくみられる特徴である [65]。急性重症頭部外傷患者では、血清エピネフリン値およびノルエピネフリン値の高さが高血糖、グラスゴー昏睡スコアの悪化、および生存率の低下と関連している [199]。1995年の神戸地震の後、ヘモグロビンA1c値および一般健康質問票の高得点は、自宅に大きな被害を受けたか、死亡または負傷した親族がいる糖尿病患者で特に顕著であり、急性ストレス曝露の長期的な影響を示唆している [88]。2011年の東日本大震災後、糖尿病診療所でフォローアップされた糖尿病患者において、身体症状、睡眠障害や不安は独立して血糖コントロールの悪化と関連していた [60]。
急性冠症候群では、入院時の高血糖は糖尿病の既往にかかわらず一般的であり、死亡率の増加[98]と、心室頻拍・細動、心房細動、高度の心房室ブロック、肺水腫[51]を含む様々な病的状態[51]、および緊急冠動脈バイパスグラフト術後の予後不良[177]の両方と関連している。急性心筋梗塞で入院した非糖尿病患者では、コルチゾール、エピネフリン、ノルエピネフリンの濃度が循環グルコース濃度の主な相関関係である [133]。高グルコース濃度は、糖尿病の発生にかかわらず、ST上昇型心筋梗塞(STEMI)で入院する患者の予後不良因子である[162]。急性死亡率と亜急性期イベント率の両方とも、入院時の血糖値が高い患者では増加する[47, 147]。自然循環の回復を伴う心停止の病院前段階では、高血糖が一般的に起こり、死亡率の増加と関連している[185]。
COVID-19を有する患者では、入院時の高血糖は一般的であり、予後不良と関連している[13、156、164、193]。入院中に「新規」糖尿病と診断された患者は、どちらかといえば、すでに診断が確定している患者よりも予後が悪い [107]。
低カリウム血症
エピネフリンの投与は、β-2アドレナリン受容体におけるアゴニスト効果を介して血清カリウム濃度を低下させる[169] [17, 42, 93]。2008年の四川大地震の後、低カリウム血症はその後の1ヵ月間に心室性頻脈性不整脈と関連していた[202]。
COVID-19入院患者では低カリウム血症が一般的に起こり、死亡率の増加とも関連している[31]。血清カリウムの低下は、内因性および外因性のエピネフリン投与と同様にアルドステロンを介した腎臓でのナトリウム/カリウム交換の亢進を反映している可能性がある。
低ナトリウム血症
低ナトリウム血症は重篤な疾患でしばしば発生する[59]。2008年の日本の四川大地震および2003年のイランのバム地震の後、低ナトリウム血症の頻度が高く、低ナトリウム血症は独立した死亡リスク因子であった [155, 201]。うっ血性心不全患者では、低ナトリウム血症と関連した方法でADHレベルが上昇する[146, 174]。
COVID-19を有する患者では、低ナトリウム血症は早期または単発的な所見でありうる [5, 21, 81]。低ナトリウム血症はADHの不適切な分泌 [2, 35] に起因している。低ナトリウム血症がCOVID-19の転帰の独立した予測因子であるかどうかは不明である。
心電図異常
周波数領域での頻脈、心電図変化、心拍変動異常は、大災害時や重篤な疾患時によく発生する。1999年の台湾地震の際には、15名の患者が24時間ホルターモニタリングを受けており、心拍変動データを時間領域と周波数領域で解析した。心拍数と低周波/高周波(LF/HF)パワーの比は地震後に増加し、末梢神経系の離脱に起因していた[112]。1995年の阪神大震災後には、深い陰性心電図T波の頻度が増加し、心筋123I-metaiodobenzylguanidine由来の放射能のウォッシュアウトが加速されたが、これは心筋交感神経のアウトフローの増加を示していると解釈された[196]。2008年の四川大地震は、血行動態的に不安定な心室性頻脈性不整脈の頻度の増加と関連していた [202]。一方、2011年のクライストチャーチ地震では、植込み型除細動器診断の解析に基づいて、心室性不整脈の増加とは関連していなかった[30]が、同年の東日本大震災後には、植込み型心臓装置を装着した患者の頻脈性不整脈の発生率が増加していた[128]。2012年の東アザルバイジャン地震の後、除細動器を植え込んだ患者では不安に関連した不整脈イベントの可能性が増加したと報告されている[145]。
ストレス関連の急性心不全では、左室心尖バルーンに関係なくQTc間隔の延長が起こる[188](たこつぼ心筋症については以下の項を参照)。
エピネフリンは心電図的QTc間隔を延長させる[42、169]。急性期脳卒中では、最も一般的な新規心電図異常はQTc延長である[20、69]。
COVID-19の入院患者では、いくつかの研究でQTc間隔の延長が指摘されている;しかしながら、クロロキンまたはヒドロキシクロロキンによる治療による異所性の可能性があるため、この異常を解釈することは困難である [95]。心拍変動のパワースペクトル分析については、時間領域または周波数領域のいずれの研究も報告していない。SNSまたはSASの活性化が心臓不整脈を誘発するメカニズムは数多く存在する [50]。これらはいずれもCOVID-19関連の研究では特に検討されていない。
免疫機能
中枢ストレス系の活性化は、HPA軸の刺激からリンパ減少を生じると予想される。好中球減少は、グルココルチコイド[181]またはカテコールアミンの影響を反映している可能性がある。健康なボランティアにアドレナリンを注入すると、急性に白血球症、好中球症、およびリンパ球症を誘発し、ナチュラルキラー細胞の活性と数を増加させる [181]。循環カテコラミンの効果は、占有されているアドレナリン受容体の種類に依存する。両方のタイプのアドレナリン受容体を刺激するアドレナリンは、β-アドレナリン受容体介在性の効果をより多くもたらす[11]。
COVID-19の患者は 「」サイトカインストーム 「」の影響を受けやすいことが広く知られており、一般的に受け入れられている。この変動性の根拠は不明である。COVID-19を有する無症候性の患者では、症候性の患者よりも活発な免疫応答が少ないようである[115]。症状発症から 19日以内に、すべての患者が抗ウイルス免疫グロブリン-G(IgG)陽性であることが報告されている[114]。これらの所見は、症状のある患者はより活発な免疫反応を持っていることを示唆している。
COVID-19患者では、ナチュラルキラー細胞およびT細胞集団の減少に関連したリンパ減少が報告されている[55, 113]。総T細胞数、CD4(+)およびCD8(+) T細胞数は劇的に減少し、血清IL-6、IL-10、およびTNF-α濃度の上昇と関連しており、生存率は不良である[45]。一方、好中球外トラップ(病原体と結合する好中球DNAを主に含む細胞外繊維のネットワーク)の増加と好中球の細胞外トラップが存在する傾向があり、COVID-19死亡率の増加と関連している[180]。
心不全
恒常性不全と心不全
本質的な心臓のポンプ効率が低下すると、SNSが活性化される [89, 119, 178]。最初は、SNSの流出の増加は心臓に限定されているようである [153]。最大限のSNS刺激にもかかわらず心臓のポンプ機能が一定レベル以下に低下すると、血液が肺静脈に逆流し、肺水腫が生じる。患者は息切れし、苦悩反応として、SASの大規模な活性化と循環エピネフリンレベルの高値と太古の昔から関連している古典的な「切迫した破滅感」を経験する。左室の心筋収縮力を増強するのではなく、エピネフリンは心筋細胞に毒性を持つことがある。心筋収縮力はさらに低下し、「ストレス性心疾患」が発症し、肺水腫を悪化させる可能性がある。
低LFパワーは心不全患者の突然死の独立した予測因子である[63]。LFパワーは、圧反射を介してその流出を調節する能力よりも、心臓の交感神経の流出のマーカーではないようである [72, 144, 166]。したがって、重症心不全におけるLFパワーの欠如は、圧反射障害を表している可能性がある。重症COVID-19患者のLFパワーが低いかどうかは不明である。
ストレス関連心筋症
非虚血性心筋梗塞 [189] を伴う特定のタイプの急性心不全は、たこつぼ心筋症 [94] と呼ばれているが、これは、この症候群における左心室尖端バルーンが、たこつぼ(タコを捕るための日本の土器の一種)のようなX線写真的外観を与えるためである。たこつぼ心筋症は特に閉経後の女性に多く、理由は不明である。褐色細胞腫などの高循環カテコールアミン濃度が関与する障害では、先端アキネジアを伴う心不全が起こることがある[62]。
2004年の新潟地震の後、たこつぼ心筋症を発症した2人の患者が報告された [175]。2人ともストレスに伴う胸痛、心電図上の巨大T波、心エコー図上の心尖性低酸素症を有していたが、心臓カテーテル検査では冠動脈疾患の証拠は認められなかった。両患者とも123I-メタイオドベンジルグアニジン(123I-MIBG)由来の放射能の消失が加速しており、これは心筋交感神経からの交感神経介在性エキソサイトーシスの増加と一致していた。1995年の阪神大震災後には、深部陰性T波患者の発生率が増加しており、123I-MIBG由来の放射能の喪失が加速されたことも関連している[196]。2011年の東日本大震災後、被災地では急性心不全の発生率が増加した [127]。心房細動の頻度も増加した[126]。地震後に入院した患者は、高齢、収縮期高血圧、感染症、B型ナトリウム利尿ペプチドおよびC反応性蛋白(心不全および炎症のそれぞれのバイオマーカー)の増加、および糸球体濾過率の低下を特徴としていた[197]。
COVID-19患者では心不全が大きな懸念事項である。心血管疾患の既往がある患者は、SARS-CoV-2に感染している可能性が高く、重篤な症状を発症する可能性が高い。いくつかの可能性のあるメカニズムが考えられる。心筋炎は、SARS-CoV-2への局所感染および局所免疫応答から直接生じる可能性がある[165]。ACE2受容体の障害は、AIIのAngへの変換を阻害することで障害を引き起こす可能性がある(1-7) [7]。内因性または外因性カテコールアミンの毒性効果は、たこつぼ心不全パターンを誘発することがある[67, 120, 123, 136, 148]。内皮機能不全または微小血管機能不全、または冠動脈プラークの不安定性があるかもしれない [80]。
心不全では心臓のノルエピネフリン貯蔵量が枯渇する [32]。これは、チロシン水酸化酵素を介したカテコールアミン生合成と比較して、神経細胞の再取り込みを逃れたノルエピネフリンの放出が大きいことに起因すると考えられる[53]。心不全に陥ったヒトの心臓におけるノルエピネフリン貯蔵量の枯渇は、間接的に作用する交感神経刺激アミンが強心性支持を提供する能力を減衰させる [142]。
血管内凝固
COVID-19パンデミックでは、深部静脈血栓性静脈炎、肺塞栓症、心筋梗塞、または脳卒中などの血管内凝固の頻度が予想外に高くなっている。凝固と炎症のバランスが崩れることで、高凝固状態になることが提案されている。自然免疫系によって開始された血栓症は、SARS-CoV-2の伝播を制限する可能性があるが、この系の異常な活性化は、線溶および血栓症の調節障害を伴う内皮傷害を引き起こす可能性がある [38]。好中球、好中球細胞外トラップ、血小板活性化、および炎症性サイトカインの役割は、活発な調査および進行中の臨床試験の主題である。
アドレナリンは強力な止血薬であり、血管収縮だけでなく血小板凝集の促進 [104, 122]、少なくとも部分的にはα-2アドレナリン受容体でのアゴニズムを介して [4, 103] であることに留意すべきである。これがCOVID-19における血管内凝固に寄与するかどうかは不明である。
中枢神経系
COVID-19は、脳卒中、脳症、脳炎、無神経症、食欲不振、頭痛、吐き気、およびdeleriumを含むさまざまな中枢神経系の異常と関連している[184]。先行伝染病(SARS、中東呼吸器症候群)の文献のメタアナリシスでは、混乱、抑うつ気分、不安、記憶障害、および不眠症の高頻度が指摘されている[149]。SARS-CoV-2ウイルスが脳幹に侵入し、髄質心肺センターの機能を変化させる可能性が提案されている [110]。
パーキンソン病患者では、COVID-19は運動症状と非運動症状を悪化させ、排尿異常と疲労が顕著である[110]。この研究では、自律神経障害に起因すると考えられる症状や徴候は影響を受けなかった。軸索損傷のバイオマーカーである血清ニューロフィラメント軽鎖レベルは、COVID-19患者で増加することが報告されている [116]。血清ニューロフィラメント軽鎖レベルが上昇した患者は挿管を必要とする可能性が高いと報告されているが、このレベルは神経症状とは無関係のようである。
COVID-19患者における中枢自律神経ネットワークの脳領域または経路についての報告はないが、孤道髄核または迷走神経背側運動核の関与が吐き気、嘔吐、食欲不振などの症状を引き起こしやすいのではないかと推測するのが妥当であろう [33]。
自律神経失調性姿勢頻拍症候群(POTS)は、ウイルス性疾患の結果である可能性があり [56、157]、自己免疫性の要素を有する可能性がある [78、108、154]。体位性頻脈症候群の患者におけるCOVID-19によるリスク増加の可能性については、かなりの懸念があるが、公表されたデータはない。逆に、COVID-19患者では、体位性頻脈症候群の発症率が増加すると予想される。
また、心的外傷後ストレス障害[57, 194]の頻度が高いことも予想されるが、これはEASの活性化[140]に関連している可能性がある。
COVID-19におけるEAS活性化は諸刃の剣である
EAS活性化の直接的および間接的な効果は、窒息、出血、飢餓、塩分欠乏、水分欠乏、極端な温度への曝露、および「闘うか飛ぶか」の遭遇など、哺乳類の進化を通して恒常性を脅かしてきた生命を脅かす緊急事態における生存を高めるという観点から理解することができる[24, 25]。
この活性化には犠牲が伴う。特に,拡張 自律神経系の活性化は,心筋の酸素消費量とグルコースレベルを増加させ,エネルギーを消費し,不整脈の閾値を低下させ,低カリウム血症と低ナトリウム血症を誘発し,腎虚血性障害と血管内血栓症を促進し,ストレス性心疾患の一形態を引き起こす可能性がある [189].さらに、インフラマソーム系の不均衡は、サイトカインの 「」嵐 「」に寄与しうる。
いくつかの点で、重篤な患者では、生理学的な負のフィードバックループが、病態生理学的な正のフィードバックループへと移行する可能性がある。症状が発現してから驚くほど短期間で、カテコラミン誘発性心室性不整脈が原因で数分以内に、難治性肺水腫が原因で数時間以内に、あるいは腎臓などの身体器官の灌流が決定的に低下して数日以内に、患者は死亡することがある。
COVID-19死亡率を予測するバイオマーカー
高血糖、低カリウム血症、低ナトリウム血症、心電図的QTc間隔の延長、不整脈、血行動態の不安定性、たこつぼ心不全、および神経行動学的症状は、COVID-19の罹患率と死亡率にEASが寄与していることを示唆している;しかしながら、これらの指標はすべて間接的であり、複雑に決定される。
血漿中カテコールアミン、ACTH、AVP、およびAIIレベルの増加などのEAS活性化の定量的指標は、EASの関与がCOVID-19の加齢および慢性調節障害に伴う高い死亡率を説明しているかどうかを検証するための貴重なバイオマーカーを提供することができる。これまでのところ、COVID-19患者におけるこれらの化合物のいずれのレベルも記載された報告はない。最近の研究では、好中球/リンパ球比の上昇とコルチゾールレベルの上昇の両方がCOVID-19患者の生存率低下と関連していることが報告されている[176]。
治療への影響
EAS活性化の証拠があるCOVID-19患者においては、ベンゾジアゼピン系アルプラゾラム[15、86]、CRH-1受容体拮抗薬アンタラミン[6]、α-2副腎皮質受容体作動薬デクスメデトミジン[109、187]、β-1副腎皮質受容体遮断薬、IL-6阻害薬(トシリズマブ)、さらにはDOPAまたはドーパミンなどの既存の薬剤で治療することで、正のフィードバックループを防ぎ、生存率を改善できるかもしれない。これらのうちのいくつかは現在臨床試験中である。
アドレナリンが血小板凝集を促進することを考えると、デクスメデトミジンによる治療は、血管内凝固を有するCOVID-19患者ではリスクが高いかもしれない。
ドーパミンは、タイプ1 ドーパミン受容体-1(DRD1)およびサイクリックAMPシグナル伝達を介して、NLRP3インフラマソームを阻害する[198]。これは、DRD1アゴニストによるサイトカイン「ストーム」の調節の可能性を導入している。フェノルドパムはカテコール含有DRD1部分アゴニストであり、血液脳関門を越えない。また、冠動脈、腎動脈、腸間膜、末梢動脈に血管拡張作用を示し、降圧剤として臨床的に静脈内投与されている。スルホニルウレア系経口血糖降下薬グリブリドはNLPR3阻害薬である[186];しかしながら、有効量は心血管系の副作用をもたらすのに十分な高用量である。
敗血症または急性呼吸窮迫症候群の患者では、高用量のコルチコステロイド投与は生存率を改善しない;しかしながら、低用量のコルチコステロイドは炎症を緩和し、生存率を改善する[29]。最近のニュース報告では、デキサメタゾンがCOVID-19の死亡率を実質的に改善したことが指摘されているが、査読付き論文には言及されていない[105]。
非侵襲的な経皮的迷走神経刺激のランダム化盲検化健康対照パイロット試験では、炎症性サイトカイン放出のダウンレギュレーションが報告されている[106]。COVID-19における非侵襲的迷走神経刺激の臨床試験が現在進行中である(NCT04382391、NCT04379037)。
結論
EAS、アロスタシス、恒常性不全などの概念は、COVID-19の死亡率の加齢に関連したものであり、この疾患における多臓器関与を説明することができる。これらの概念は、COVID-19のリスクのバイオマーカーと可能な治療法についての検証可能な仮説につながる。アイデアは安くて簡単、データは高くて難しい、COVID-19と自律神経系の科学はまだ黎明期にある。