Contents
Role of the antigen presentation process in the immunization mechanism of the genetic vaccines against COVID-19 and the need for biodistribution evaluations
pubmed.ncbi.nlm.nih.gov/35298029/
編集者宛ての手紙
初出:2022年3月17日 doi.org/10.1111/sji.13160
編集部へ
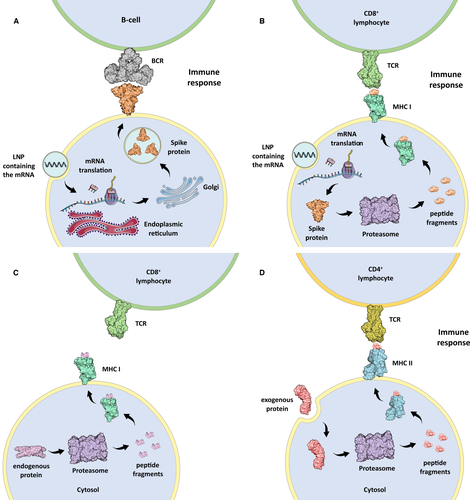
「従来の」ワクチンのメカニズムは、あらかじめ不活性化(熱処理など)または弱毒化(最適でない増殖条件での複数回継代など)されたウイルスを接種することで成り立っている1。このように急性感染を引き起こす能力を失ったウイルスは、免疫システムが外来病原体として認識し、特異抗体や記憶Tリンパ球の産生を促進する1。欧州連合で使用許可を取得したCOVID-19に対する遺伝子ワクチン、すなわちアデノウイルスワクチン(AstraZeneca社およびJanssen社製)およびmRNAワクチン(Pfizer/BioNTech社およびモデルナ社製)は、ヒト細胞がウイルス抗原を生成できるよう遺伝情報をコード化したものである。より正確には、前述のワクチンは、ヒト細胞のタンパク質合成機構に、SARS-CoV-2のウイルスカプシドのスパイクタンパク質を翻訳するよう誘導する。 2 リボソームによる翻訳後、スパイクタンパク質はゴルジ装置で処理され、2つの形態で免疫系に提示される。i)タンパク質全体として細胞膜上に表示され、B細胞やT-ヘルパー細胞に認識される(図1A)ii)主要組織適合複合体I(MHC I)にロードされた断片として、CD8+Tリンパ球に内因性抗原を提示される(図1B)。免疫系は外来抗原を認識し、炎症反応を開始し、その後B細胞による特異的抗体の産生に至る。2 ヒトの細胞では、抗原提示プロセスはMHC IおよびIIによって行われ、このメカニズムは細胞媒介性免疫に不可欠である3。MHC Iは、すべての有核細胞の膜上に存在するタンパク質複合体で、細胞内タンパク質のプロテアソーム分解に伴って生成される内因性抗原の断片をCD8+リンパ球に提示す(図1C)3。この機構により、免疫システムは、細胞がウイルスや変異タンパク質を合成していることを検出するために、体内のすべての有核細胞のタンパク質合成活性を常にスクリーニングしている。MHC IIは、マクロファージ、単球、B細胞、樹状細胞などの専門的な抗原提示細胞(APC)の膜上にあり、体内で摂取された外来抗原の断片をCD4+リンパ球に提示す(図1D)3。いくつかのケースでは、MHC II分子は炎症シグナルの結果として内皮細胞にも見出されることがある3。CD8+またはCD4+リンパ球が、ウイルス遺伝子(例:感染による)変異遺伝子(例:癌による)または外来遺伝子(例:移植による)を発現している細胞を検出すると、MHCに結合し、異常細胞の破壊につながる免疫反応を活性化する3。「従来の」ワクチンは、一般にヒトの細胞がウイルスタンパク質を産生するように誘導しないため、ヒトの細胞はタンパク質合成活性に由来するウイルス抗原を露出することがない。一方、COVID-19に対する遺伝子ワクチンは、ヒトの細胞にスパイクタンパク質を産生させるため、遺伝物質を取り込んでタンパク質合成を開始したすべての細胞に及ぶ自己免疫反応に本質的に依存している。
図1 模式図
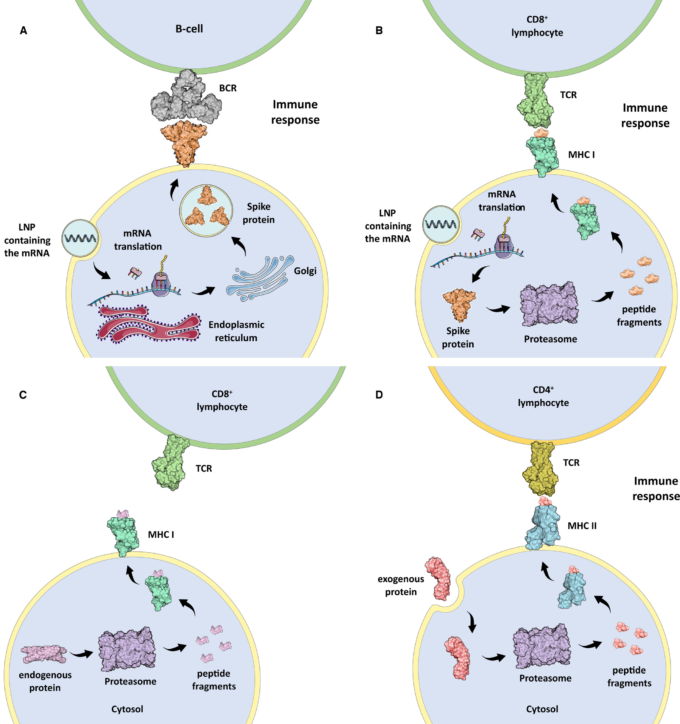
(A) mRNAを含む脂質ナノ粒子(LNP)を摂取し、SARS-CoV-2スパイクタンパク質を翻訳し、B細胞のB細胞受容体(BCR)に提示するヒト細胞。(B)mRNAを含むLNPを取り込み、スパイクタンパク質を翻訳し、MHC I抗原提示プロセスを介してCD8+リンパ球のT細胞受容体(TCR)に提示するヒト細胞。(C)MHC Iは、内因性タンパク質のプロテアソーム分解に由来するペプチドをCD8+リンパ球のT細胞受容体(TCR)に提示している。(D) CD4+リンパ球のT細胞レセプター(TCR)に外来性タンパク質のプロテアソーム分解から派生したペプチドを提示するMHC II
生体内分布研究は、注射された化合物がどの組織や臓器に移動し、蓄積されるかを明らかにするための基本的な研究である。筆者の知る限り、これまで緊急用として承認されたCOVID-19ワクチンのいずれについても、ヒトに対してそのような評価は行われていない。Pfizer/BioNTechのBNT162b2ワクチンに関しては、三角筋に注射され、主に腋窩リンパ節に排出される。理論的には、mRNAが封入された脂質ナノ粒子(LNP)は、排出される腋窩リンパ節を標的として、非常に限定された生体内分布を示すはずである4。しかし、ファイザーが日本の規制当局のために行った薬物動態試験では、LNPが脾臓、肝臓、下垂体、甲状腺、卵巣などの組織で蓄積し、標的外分布を示すことが示されている5。同様に、欧州医薬品庁(EMA)の評価報告書では、ファイザー/バイオテック社およびモデルナ社が使用したLNPが、ネズミの肝臓などの臓器に標的外分布を示すことが示されている6, 7。
もう一つの有害な毒性源は、スパイクタンパク質そのものであることが証明されている。ある研究では、mRNA-1273 モデルナワクチンの接種者から採取した血漿サンプルを経時的に測定した。8 この研究では、接種から数日後の血漿中に、切断されたS1サブユニットと同様に、かなりの量のスパイクタンパク質が検出されることが分かっている。8 スパイクタンパク質が血流に放出されるということは、APCによってウイルスタンパク質が体内に取り込まれるため、MHC IIを介した抗原提示プロセスにも関与していることになる(図1D)。
現在までに,1000件を超える査読付き研究が,COVID-19ワクチン接種者に多数の有害事象があることを証明している9.こうした研究は,血栓症,血小板減少,心筋炎,心膜炎,不整脈,神経系障害,その他の変化を含むワクチン接種後の重度の有害反応について報告している.なお、前述の副作用のいくつかは、情報公開法(FOIA)手続きの一環として公開された、ファイザー社が2020年12月14日から2021年2月28日までに記録した死亡および有害事象のデータを提供する、機密の承認後累積分析ですでに報告されていた10。
結論として、LNPを摂取してウイルスタンパク質を翻訳する(mRNAワクチンの場合)あるいはアデノウイルスに感染してウイルスタンパク質を発現・翻訳する(アデノウイルスベースのワクチンの場合)すべてのヒト細胞は、必然的に免疫系に脅威として認識され、死滅する(図1)ことを強調しておく必要がある。このメカニズムに例外はない。その結果生じる損傷の深刻さと健康への影響は、関与する細胞の量、組織の種類、そしてその後の自己免疫反応の強さによって異なる。例えば、LNPに含まれるmRNAが心筋細胞に取り込まれ、その細胞がスパイクタンパク質を産生した場合、炎症は心筋の壊死につながり、その程度は取り込まれた細胞の数に比例する可能性が高い。したがって、COVID-19に対するワクチンの正確な生体内分布を決定し、脅威となりうる組織を特定するためには、ヒトにおける薬物動態学的評価を行うことが基本である。
利益相反
著者は、本論文で報告された研究に影響を及ぼすと思われる既知の競合する金銭的利益や個人的関係がないことを宣言するものである。