Contents
Role of Copper in the Onset of Alzheimer’s Disease Compared to Other Metals
www.ncbi.nlm.nih.gov/pmc/articles/PMC5810277/
要旨
アルツハイマー病は、患者の脳組織にアミロイド斑が形成されることを特徴とする神経変性疾患である。プラークは主にβアミロイドペプチドとZn2+、Cu2+などの微量元素で構成されている。一部の研究では、アルツハイマー病は一種の金属異常症と考えられることが示されている。
プラークに関与する金属イオンの中でも、プラーク形成における主要なカチオン性元素の一つであると思われる銅イオンに注目した研究が数多く行われている。アルツハイマー病における銅の関与については議論の余地があり、いくつかの研究では、アルツハイマー病における銅欠乏を示し、その結果、銅濃度を高める必要がある一方で、他のデータでは、銅の過負荷を指摘し、その結果、銅濃度を下げる必要があることを示している。
本論文では、アルツハイマー病における銅イオンの役割と、いくつかの矛盾した報告をレビューし、議論する。
キーワード
アルツハイマー病、銅、亜鉛、神経変性疾患、アミロイド斑、コレステロール、カルシウム
序論
アルツハイマー病は、1907 年にアロイス・アルツハイマーによって記述された進行性の神経変性疾患である。彼は、認知症の兆候を示す患者の脳にアミロイド斑や神経原線維のもつれ(NFT)が見られることを発見した(Sarell, 2010)。今日、アルツハイマー病は65歳以上の人の10%、80歳以上の人の50%に影響を与える最も有病率の高い神経変性疾患である(Zhang et al 2011)。2016年には世界で約4700万人のアルツハイマー病患者がいると推定され、この数は2050年には1億3000万人以上に増加すると予測されている。世界アルツハイマー報告書は、2015年に認知症の社会的・経済的コストを世界で年間8,180億米ドルと評価しており、この金額は2018年には1兆円にまで増加すると予測されている(Unzeta er al)。
アルツハイマー病は最終的に致死的なものであり、脳内の神経組織の損傷が進行することを特徴としている。徴候は、記憶喪失、被害妄想、推論力の損失と混乱を含む(Sarell、2010)。残念ながら、アルツハイマー病は認知症状が現れてからでないと認識されず、効果的な治療には遅すぎるかもしれない(Leskovjan et al 2011)。さらに、承認されている薬は患者の幸福感に及ぼす影響が小さく、これは多くの要因がアルツハイマー病の原因となっているためかもしれない(Conte-Daban et al 2016;Pickart et al 2017)。実際、経験的なデータに裏付けられたアルツハイマー病の原因を示すいくつかの理論があり、Armstrong(2013)によって検討されている。
大脳皮質や海馬などのアルツハイマー病に影響を受ける脳領域では、細胞外老人性プラークや細胞内NFTが蓄積する(Zhang et al 2011)。老人斑またはアミロイド斑は、その名の通り、β-アミロイドと呼ばれる小さなペプチドを主成分としている(Masters et al 1985)。後者は、アミロイド生成経路において、最初に残基671でのβ-セクレターゼによる連続的な切断を経て、次に残基711または713(APP770アイソフォームによる残基番号付け)でのγ-セクレターゼによる切断を経て、β-アミロイド前駆体タンパク質(APP)から生成される。あるいは、APP分子は、残基687でβアミロイドドメイン内のα-セクレターゼによって切断され、非アミロイド原性経路でのβアミロイド産生を阻止することができる(Zhang er al)。 APPには、APP695,APP751,APP770の3つの主要なアイソフォームがあり、APP695は他のアイソフォームに比べて脳内で高発現している(Nalivaeva and Turner, 2013)。さらに、タウタンパク質を主成分とするNFTsは、アルツハイマー病脳に蓄積するもう一つの重要な因子である(Buée er al)。 主に神経細胞で発現するタウタンパク質は、試験管内試験で微小管の集合を誘導する能力を持っている(Weingarten et al 1975;Cleveland et al 1977)。実際、細胞骨格系の主要構成要素の一つである微小管は、神経細胞の形態の維持および軸索および樹状突起の形成に関与している(GendronおよびPetrucelli、2009)。アルツハイマー病における最初の、そして最も重篤な損傷を受けた脳領域の一つは、神経発生と長期記憶の保存に関連する海馬である。また、他の脳領域よりも金属障害を受けやすいと考えられている。また、プラーク病理によりアルツハイマー病で損傷を受けるもう一つの脳領域は、議論、感情、言語などの機能に関連する大脳皮質である(Leskovjan et al 2011)。
老人性プラークへのβアミロイド凝集は、アルツハイマー病の主な特徴の一つである(Wan er al)。 アデノシン受容体とβアミロイドのかなりの共局在化が老人斑で報告されている(Angulo er al)。 アデノシンは、神経調節性および神経保護性を有するプリンリボヌクレオシドであり(Rahman, 2009睡眠、認知、記憶および神経変性などの様々な重要な脳機能に影響を及ぼす(De Mendonça and Ribeiro, 1996; Porkka-Heiskanen, 1999; Ribeiro et al 2002; Rahman, 2009)。アデノシンは、アルツハイマー病を含む多数の神経障害に関与している(Cortés et al 2015; )。様々な健康障害におけるアルツハイマー病Aの関与のため、実現可能な治療薬としてのアルツハイマー病A阻害剤の開発が多くの研究で検討されてきた(Cristalli et al 2001; Saboury et al 2003,2004,2005; Ataie et al 2004,2007; Terasaka et al 2004a,b; Da Settimo et al 2005; Ajloo et al 2007; Ujjinamatada et al 2008; La Motta et al 2009; Bazl et al 2012)。最近では、周産期低酸素-虚血性脳損傷治療において、アルツハイマー病A阻害剤が提案されている(Pimentel et al 2013)。
銅、亜鉛、鉄などの多価金属カチオンは、アルツハイマー病患者の脳の老人斑に高濃度で存在している(Smith et al 1997年;Lovell et al 1998年;Sayre et al 2000年;Suh et al 2000年;Dong et al 2003年;Miller et al 2006)。さらに、ADモデルマウスを用いたいくつかの研究では、5×家族性アルツハイマー病やCVNなどの神経変性を有するマウスモデルでは老人斑に銅が蓄積しているにもかかわらず(Bourassa et al 2013軽度の神経変性を有するPSAPPマウスモデルでは銅の蓄積が認められないことが明らかにされた(Bourassa et al 2013;James et al 2017)。亜鉛イオンおよび銅イオンの不均一性がアルツハイマー病発症の主な要因であることを指摘するかなりのデータがある(Deibel et al 1996;Lovell et al 1998;Cherny et al 1999,2001;González et al 1999;Huang et al 1999,2004;Sayre et al 1998;Cherny et al 1999,2001;González et al 1999,2004;Huang et al 1999,2004;Sayre et al 1999,1999,2004;Sayre et al 1999,2004 1999,2004;Sayre et al 2000;Bayer et al 2003;Phinney et al 2003;Ritchie et al 2003;Pajonk et al 2005;Kessler et al 2006;Ma et al 2006;Maynard et al 2006,2002;Miller et al 2006)
異なる著者は、アルツハイマー病における銅の関与の毒性の様々なモデルを提唱している。最も権威のあるものは、Cu2+と結合した後のβアミロイドの機能の獲得を提案している(Bush et al 2003;Bush and Tanzi、2008)(Multhaup et al 1996)。代替的でより最近の仮説(Lee er al 2005; Cavaleri, 2015; Kepp, 2016)は、脳内の有害金属の過剰に対するβアミロイドの保護的役割を提案し、βアミロイドの機能喪失を疾患の病原性プロセスとして指定している(Hua er al 2011; )。APPは神経細胞からの金属の輸出において正常な機能を持っていると考えられており、可溶性で機能的なβアミロイドモノマーが失われると、細胞内に銅が蓄積される可能性があると考えられている(Kepp, 2016)。
科学的証拠は、βアミロイドへの金属イオンの結合がアミロイド凝集を加速し、それが最終的にアルツハイマー病のニューロンにダメージを与える可能性があることを示している(Pithadia and Lim, 2012)。アルツハイマー病 における銅の関与については議論の余地があるが、いくつかの研究では アルツハイマー病 における銅の欠乏が示されており、その結果、銅のレベルを高める必要がある(Borchardt et al 1999; Kessler et al 2005, 2008a,b; Exley, 2006; Jiao and Yang, 2007; Vural et al 2010; Kaden et al 2011; Exley et al 2012)。2012)他のデータでは銅の過負荷を指摘しており、したがって銅のレベルを下げる必要があるとされている(Cherny et al 2001年;Sparks et al 2006年;Hua et al 2011年;Luo et al 2011年;Ceccom et al 2012年;Eskiciら、Axelsen et al 2012年;Brewer et al 2014年;Squitti et al 2014b;Yu et al 2015)。銅のラビリプールの増加およびタンパク質に結合した銅の減少を伴う異常な銅のホメオスタシスは、主にアップデイトされた解釈である(Kepp, 2016; Squitti et al 2016)。本論文では、アルツハイマー病における金属イオン、特に銅の役割をレビューし、議論する。
アルツハイマー病における銅イオン毒性
アルツハイマー病の重要なイベントは、アルツハイマー病患者の脳内でのフィブリルとプラークの形成である。プラークは主に脳内で産生され、脳脊髄液(脳脊髄液)や血清中にナノモル濃度で存在する天然のペプチドであるβアミロイドペプチドで構成されている(Masters et al 1985;Vigo-Pelfrey et al 1993)。一方、アミロイド斑では、銅を含む微量金属の高濃度が観察されている(Miller et al 2006)。興味深いことに、いくつかのデータは、TASTPMマウスモデル(Torres et al 2016)において、脳内の銅の分布は、プラーク病理学的には対応していないが、神経細胞の損失は認められないことを示す(Howlett et al 2004)。銅は、その恒常性の崩壊がメンケス病やウィルソン病のような神経変性疾患につながるので、神経系の発達に必要な微量金属である(Waggoner et al 1999)。Cu2+イオンは、高い親和性でβアミロイドペプチドに結合し(Atwood et al 2000;Sarell et al 2009;Barrittら、Viles et al 2015;Mital et al 2015;Drew et al 2017)アミロイドペプチド中のβシート構造およびαヘリックス構造の割合を増加させ、これはβアミロイド凝集の原因となり得る(Dai et al 2006)。銅イオンの様々な濃度の銅イオンはフィブリル形成を促進するが、銅イオンがβアミロイドに結合すると細胞に対する毒性が顕著に増加する(Dai et al 2006; Sarell et al 2010)。さらに、Cu2+の変量濃度は細胞に対してより毒性が高い(Sarell et al 2010)。
フィブリル形成は、高度にpH依存性であり、Cu2+イオンは、生理的pHでそれを引き起こす。しかしながら、非晶質凝集体の形成は酸性条件下で支配的である(Jun er al 2009; Sarell, 2010; Lv er al 2013)。プロトンが多い環境では、βアミロイド(アミロイドβ40)は2つの銅結合部位を持ち、その2番目に結合したCu2+イオンがβアミロイドのアミロイド線維への構造転移を阻害して非晶質凝集体の形成を引き起こす(Jun er al)。
活性酸素種(ROS)の産生は、神経細胞に対するβアミロイドの毒性の重要な因子であり、金属イオンの酸化還元特性に依存している。β-アミロイド線維と複合体の銅イオンは、生物学的還元剤の存在下で、過酸化水素を生成する(Parthasarathy er al)。 ペプチドに対する銅の比率が増加すると、過酸化水素レベルおよびヒドロキシルラジカルの産生が増加し、凝集体の形態がフィブリルから非晶質へと変化する(Mayes et al 2014)。これまでの研究では、活性酸素は神経変性を引き起こす致命的な分子として提示されてきたが、蓄積されたエビデンスから、いくつかの活性酸素は認知や記憶形成の基礎となるプロセスにおいて必須の分子として作用することが示されている(Klann, 1998; Yermolaieva et al 2000; Knapp and Klann, 2002a,b; Kamsler and Segal, 2003, 2004; Hu et al 2006; Kishida and Klann, 2007)。一方、銅-アミロイド複合体は遊離銅イオンよりも少ない活性酸素の生成を示唆する結果もある(Nakamura et al 2007)。試験管内試験のデータによると、βアミロイドのオリゴマー型とフィブリル型は、Cu2+濃度が高くなるとH2O2の発生を抑制する。さらに、フィブリラー形態は、より少ないH2O2(Fang et al 2010)の生成を抑制する。
アルツハイマー病脳における銅の毒性は、銅イオンの酸化形態、すなわちCu2+に起因する(Brewer, 2015; Greenough et al 2016)。対照的に、他のデータは、銅イオンは、それらの還元形態、すなわち、Cu1+でのみ輸送されることを示している(Macreadie、2008)。いくつかの研究は、Cu2+が肝臓を迂回することを示唆している(Brewer, 2015)。そうでなければ、いくつかのデータは、β-アミロイドからのCu1+の除去が、オリゴマーの形成を妨げ、ROSの産生を防ぐことを示している(Atrián-Blasco et al 2015)。βアミロイドペプチドの可溶性銅結合ドメインのCu1+に対する親和性の研究は、Cu1+がCu2+よりも強くβアミロイドに結合することを示し、Cu1+が生体内で関連する酸化状態であることを示唆している(Feaga et al 2011)。Cu1+とCu2+はともにインスリン分解酵素によるβアミロイド分解を阻害するが、Cu1+は不可逆的な阻害剤として作用する(Grasso et al 2011)。Cu2+からCu1+への還元による銅イオンは、フリーラジカルからタンパク質を保護する(Deloncle and Guillard, 2014)。
メタ解析(Schrag et al 2011)およびその後の研究(James et al 2012;Szabo et al 2016)では、アルツハイマー病患者の脳では総銅の濃度が低下する一方で、アルツハイマー病脳の最も影響を受けた領域ではラビレ銅の濃度が上昇することが示された(James et al 2012)。さらに、アルツハイマー病の皮質組織(James et al 2012)および外傷性脳損傷マウスの皮質は、Cu2+に対する結合能の上昇を示している(Peng et al 2015)。別の研究では、大脳実質プラークを示すが神経細胞の喪失は見られない(Elder et al 2010;Sasaguri et al 2017)アルツハイマー病のAPPsw/0マウスモデルでは、金属が毛細血管に蓄積するコントロールマウスとは異なり、銅イオンが脳実質に蓄積することが示されている。これらのイオンはβアミロイドに結合し、βシートのコンフォメーション、凝集、および毒性を刺激する可能性がある(Singh et al 2013)。
「アミロイドカスケード仮説」では、プラーク形成はアルツハイマー病病態の主要イベントであるが、神経変性に先行することもあり、アルツハイマー病患者の免疫によるプラーククリアランスでは疾患の進行は防げない(Chui et al 1999年;Oddo et al 2003年;Holmes et al 2008年;Bayerら、Wirths et al 2010年;Bittner et al 2012年;Wright et al 2013年;Xie et al 2013年;Jung et al 2015)。さらに、いくつかの研究は、老人性プラークが認知的に正常な人にも存在することを示しており(Jack et al 2010;Sperling et al 2011;Swerdlow et al 2011;Esparza et al 2013)同等のプラークが存在するにもかかわらず、脳アミロイドオリゴマーの濃度は、アルツハイマー病患者の方が正常な場合よりも高い。毒性オリゴマー仮説」は、アミロイドプラークではなく、小さくて拡散性のあるオリゴマーが毒性の原因であることを示唆することによって、これらの事象を説明している(Naylor et al 2008年;Sarell、2010)。細胞培養から得られたオリゴマーは、異常に高い化学的安定性を有し、様々な分解剤によるモノマーへの分解に抵抗し、オリゴマー間に共有結合的な架橋が存在することを裏付けている(Podlisny et al 1995; Walsh et al 2002; Lesné et al 2006; Naylor et al 2008)。試験管内試験実験に基づいて、βアミロイドへのCu2+結合は、アルツハイマー病で見られるβアミロイドのジトロシン結合二量体の形成を導き得る(Atwood et al 2004年;Haeffner et al 2005年;Bush and Tanzi et al 2008年;Streltsov et al 2008年;Al-Hilaly et al 2013)。Cu2+の存在下では、二量体のコンフォメーションは平行から反平行へと変化し、占有された銅結合部位によって安定化される(Hane er al)。 しかし、同じ著者らは、ナノモル濃度でのCu2+がアミロイド二量体のペプチド親和性に影響を与えないことを後に示した(Hane et al 2016)。他の著者は、Cu2+イオンの結合がアミロイドダイマーの構造変化を誘導し、その中のN末端相互作用をもたらすことを実証している(Lv et al 2013)。架橋を生成することができない変異体ダイマーは、神経毒性がないことを除いて、変異体ダイマーの特性が野生型ダイマーの特性と同じであるため、Cu2+架橋ダイマーの毒性を支持する証拠を提供する(Barnham, 2004; 図11)。さらに、他の研究では、架橋ダイマーの毒性は、強化された膜結合によるものであることが示唆されている(Ciccotosto et al 2004)。
図1 アルツハイマー病におけるβアミロイド神経毒性における銅の役割
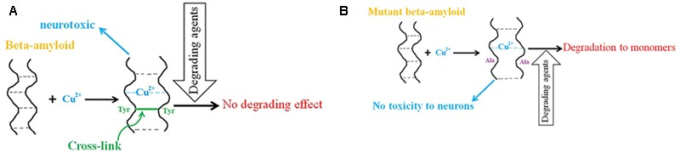
(A) βアミロイドペプチドへの銅の結合は、ジトロシン結合したβアミロイド二量体の形成をもたらし、この二量体はモノマーへの分解に抵抗し、神経毒性を有する。B)銅イオンの存在下での変異型βアミロイド(Tyr→Ala)は、神経細胞に対する毒性効果はなく、分解剤によってモノマーに分解される。
βアミロイドからCu2+を除去することは、試験管内試験でのアミロイド凝集を防ぎ(Wu et al 2008;Behbehani et al 2012)βアミロイドの分解を促進し、H2O2の形成を防ぐ。したがって、それはまた、細胞の死亡率を減少させる(Wu er al)。 銅消去のこれらの肯定的な効果のために、いくつかの研究では、銅キレート剤を適切な薬剤として標的にしている(Moret et al 2006年;Geng et al 2012年;Nguyen et al 2014年;Savelieff et al 2014年;Hauser-Davis et al 2015年;Hung et al 2015年;Yang et al 2016)。しかしながら、銅キレート療法に関する最も最近発表されたレビューでは、一部の著者がこの解釈に反論しているにもかかわらず、ヒト臨床試験での結果は落胆させるものであると述べている(Squitti et al 2017a)。さらに、実質プラークを示すが、神経細胞の喪失は認められないアルツハイマー病のTg2576マウスモデルにおける研究(Elder et al 2010;Sasaguri et al 2017)は、キレート剤の使用はアルツハイマー病の予防に役立つが、アルツハイマー病治療においては非効率的であることを示しており、全身的な銅除去は疾患の初期段階でのみ有用であることを示唆している(Quinn et al 2010)。興味深いことに、初期の段階で脳の銅の取り込みを変化させることで、アミロイド病理学にかなりの効果があることを示す証拠がいくつかある(Lang et al 2013)。
2012 年までは、以前に発表された曖昧な結果の数は、アルツハイマー病 患者の銅レベルについての議論を煽った。全体的に、6つのメタアナリシスは、異なる生物学的マトリックス(血清、血漿、脳脊髄液)のアルツハイマー病の銅濃度を評価するために過去6年間で実施されている。1984年から 2017年の間に発表された研究(Bucossi et al 2011年;Ventriglia et al 2012年;Schrag et al 2013年;Squitti et al 2014a;Wang et al 2015年;Li et al 2017)から収集されたデータを組み合わせたこれらのメタアナリシスは、明確な結果を提供する:総銅(Bucossi et al 2011年;Ventriglia et al 2012年;Schrag et al 2013年;Squitti et al 2014a;Wang et al 2015年;Li et al 2017)。2011; Ventriglia et al 2012; Schrag et al 2013; Squitti et al 2014a; Wang et al 2015; Li et al 2017)および「遊離」銅(Squitti et al 2014a)は、健康なコントロールと比較して、アルツハイマー病患者の血清-血漿中に高い。より具体的には、大規模なスタンドの最も最近のメタ分析(分析された被験者の総プール:2128 アルツハイマー病対2889健康なコントロール)には、35の研究の合計が含まれている。18 の増加を報告し、14 の違いがない、1 つは健康な対照群と比較して アルツハイマー病 の血清-血漿中の銅の値の減少 (李 et al 2017)。このコンセンサス結果の発表後に3つの追加研究が登場し(Guan et al 2017年;Pu et al 2017年;Talwar et al 2017年アルツハイマー病患者対対照群でのCu2+濃度の増加を報告している。
最近の研究は、初期の論争をさらに解き明かすことに貢献し、アルツハイマー病における血清銅の濃度の増加は、血中の「遊離」銅プールの血漿画分の濃度の増加によって説明できることを実証し、それはアルツハイマー病患者の50〜60%にしか検出されない(Squitti et al 2016; Szabo et al 2016; Tecchio et al 2016; Talwar et al 2017)。より古い研究では、血清銅濃度が特殊なタイプのアルツハイマー病で上昇することも示されている(González et al 1999)。いくつかの研究では、この観察の説明として、このアルツハイマー病サブタイプの遺伝的根拠が提案されている(González et al 1999;Liu et al 2013;Squitti et al 2013,2017b;Mercer et al 2017)。
アルツハイマー病における脳の銅欠乏
銅イオンレベルの有意な減少は、年齢をマッチさせた対照群と比較して、アルツハイマー病患者の海馬と扁桃腺領域で観察される(Deibel et al 1996)。さらに、純銅の減少は、TgCRND8 ADマウスモデルの脳で見られ(Phinney et al 2003このモデルは、実質アミロイド沈着を示すが、神経細胞の損失は認められない(Sasaguri et al 2017)。前述したように、メタアナリシスでは、アルツハイマー病患者の脳で銅が有意に減少していることが示されている(Schrag et al 2011)。死亡した認知症患者のヒト脳の分析では、欠陥領域は銅含有量が非常に低いと結論づけている(Pickart et al 2017)。高齢化したヒトの脳の銅含有量は、アミロイド斑の重症度と有意な負の相関がある(Exley et al 2012)。対照群と比較してアルツハイマー病患者の銅イオンの有意な減少を示す結果に基づいて(Giacoppo et al 2014アルツハイマー病は銅欠乏の結果であるという仮説が立てられてきた(Klevay、2008)。血清血漿中のメタアナリシスと脳内のメタアナリシスの銅定量結果を説明できる代替的でより包括的な解釈は、脳内の銅の減少は、ウィルソン病に似た異常な銅の恒常性の徴候であるということである(Fujiwara et al 2006)。興味深いことに、アルツハイマー病患者の銅欠乏は食生活とは無関係であることを示すデータもある(Giacoppo et al 2014)。
銅の存在下および非存在下では、APP分子はそれぞれ非アミロイド原性経路およびアミロイド原性経路で切断される。後者の経路はアミロイド産生をもたらす。いくつかのデータは、銅イオンがγ-セクレターゼ複合体と相互作用することにより(Gerber et al 2017)またはAPPの二量体化に影響を与えることにより、アミロイド産生を阻害することを示している(Kong et al 2008)。そうでなければ、銅イオンは、APPのエキソサイトーシスを増加させ、かつエンドサイトーシスを減少させることの両方によって、細胞表面でのAPPの曝露を増強する(Acevedo et al 2011)。アルツハイマー病患者で観察されるように、銅欠乏はAPPのアミロイド生成処理を誘導することにより、βアミロイドの産生と蓄積を促進する(Bayer et al 2003)。しかし、その分子機構はまだ明らかになっていない(Wild et al 2017)。
哺乳類系の銅イオン取り込みに必要なタンパク質をコードする遺伝子の変異は、早期発症の家族性アルツハイマー病につながる(Southon et al 2013)。一方、大脳皮質斑はあるが神経細胞の欠損はないAPP/PS1トランスジェニックADマウス(Crouch et al 2009)やAPP23トランスジェニックマウス(Bayer et al 2003)において、食事性銅の添加による細胞内銅濃度の増強は、アルツハイマー病の病態の低下を引き起こす(Elder et al 2010年;Sasaguri et al 2017)。いくつかの神経変性疾患における脳銅の低値の報告に基づき、フリーラジカルに対する銅の保護機能の障害が、これらの疾患の主な原因として提案されている(Deloncle and Guillard, 2014)。
アルツハイマー病における銅と亜鉛イオン
いくつかのデータは、アルツハイマー病の大脳皮質におけるZn2+含有量の上昇を示しているが、Zn2+の有意な上昇は、アルツハイマー病の海馬と扁桃腺領域(Deibel et al 1996年および対照群と比較してアルツハイマー病の神経鞘で見られる(Lovell et al 1998年(Religa et al 2006)。したがって、メタアナリシスでは、アルツハイマー病大脳皮質の亜鉛含有量に有意な変化はないことが明らかになった(Schrag et al 2011)。それにもかかわらず、最近、アルツハイマー病患者と健常対照者の血漿および血清亜鉛濃度について3つのメタアナリシス(Ventriglia et al 2015年;Wang et al 2015年;Li et al 2017)が実施された。ある研究(Ventriglia et al 2015)(プールされたサンプルサイズには、アルツハイマー病患者777人対健常対照1728人が含まれていた)は、合計16の研究を分析し、アルツハイマー病患者は健常対照と比較して血清亜鉛濃度の低下を示すと結論づけている。(Ventriglia et al 2015)の研究(プールされたサンプルサイズは、287 アルツハイマー病 vs. 166健常対照者を含む)は、血漿亜鉛に関する5つの研究を合計で分析した:2つは減少を示し、3つは対照者と比較してアルツハイマー病患者の血漿亜鉛に有意差がないことを示している。他の研究(Wang et al 2015)(被験者プールには862人のアルツハイマー病患者対1705人の対照群が含まれていた)では、合計17の研究を分析した。10件は減少を示し、7件は対照群と比較してアルツハイマー病患者の血清亜鉛に有意差がなかった。(Li et al 2017)による最新のメタアナリシスでは、アルツハイマー病患者1027人と健常対照者1949人の合計22研究を分析した:3研究は増加を示し、18研究は減少を示し、1研究はアルツハイマー病患者と健常対照者の間で血清亜鉛に差がなかった。興味深いことに、古い研究では、血清 Zn2+ の上昇が アルツハイマー病 の特別なタイプで発生することがわかった (González et al 1999 年)。血清中のフィブリノゲンの不在が血清と血漿の組成の主な違いであり、フィブリノゲン-β-アミロイド相互作用がアルツハイマー病の進行に関与していることから(Cortes-Canteli et al 2012年;Derakhshankhah et al 2016)アルツハイマー病患者における血清Zn2+の低下はフィブリノゲンとの相互作用によるものである可能性が高いと考えられる。亜鉛レベルの上昇は、組織アミロイドレベルの上昇を伴う(Religa et al 2006)。アルツハイマー病の脳組織には、特に銅イオンと亜鉛イオンに富む金属イオンのホットスポットが含まれている。2006年には、βアミロイド斑と蓄積した金属イオンのホットスポットが共局在することが初めて報告された(Miller et al 2006)。
亜鉛イオンがβアミロイド凝集を誘導するのに対し、Cu2+イオンは亜鉛とヒスチジン残基を競合させることでβアミロイド凝集を阻害することが示唆されている。最も強い阻害効果は、銅とβアミロイドのモル比が約4のときに起こる。この値を超えると、銅イオン自体が凝集を誘発する(Suzuki er al)。 興味深いことに、これまでの研究では、βアミロイドはpH7.0で3〜4個のCu2+イオンと結合することが示されている(Atwood et al 1998)。合成アミロイドβ(1-40)およびアミロイドβ(1-42)ペプチドの研究は、生理学的pHでは、βアミロイドは同じ比率の銅イオンと亜鉛イオンを結合するが、酸性条件下では銅イオンが亜鉛イオンに置き換わることを示している(図22;Atwood et al 2000;Roberts et al 2012)。Cu2+およびZn2+イオンはβアミロイドの線溶化を阻害し、代わりに試験管内試験では非線溶性凝集体の形成を促進する。さらに、亜鉛イオンは銅イオンよりも3倍強い阻害効果を有する(Tõugu et al 2009)。Cu2+イオンおよびZn2イオンの両方とも、試験管内試験でアミロイドβ(1-42)とインキュベートした場合、可溶性フィブリルの形成を阻害する(Bolognin et al 2011)。また、いくつかの著者は、小さな可溶性オリゴマーがβアミロイド神経毒性において主な役割を果たすことを報告している(Tabner et al 2011)。Cu2+イオンはβアミロイド(アミロイドβ40)と安定で可溶性の1:1錯体を形成し、一方、Zn2+イオンはその部分的な凝集を引き起こす(Tõugu er al)。 Cu2+誘発凝集体は、アスコルビン酸の存在下でのみニューロンに毒性を示すが、モノマーおよび亜鉛誘発凝集体は毒性を示さない(Tõugu et al 2009)。
図2 アルツハイマー病における銅イオンと亜鉛イオン
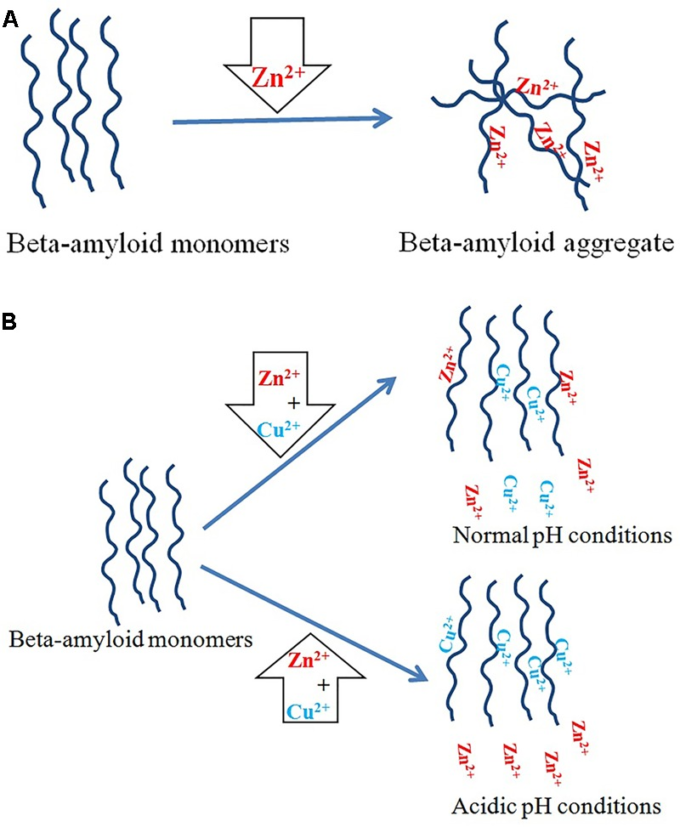
A)亜鉛イオンはβアミロイド凝集を促進する。B)銅イオンは亜鉛イオンによって誘導される凝集を抑制する効果がある。生理的条件下では、βアミロイドは銅イオンと亜鉛イオンの同じ比率で結合するが、酸性pHでは銅イオンが全体的に亜鉛イオンに取って代わる。
アルツハイマー病における亜鉛補給の役割は、ZenithとZincageの研究がいくつかの効果を示唆したにもかかわらず、食事中のZn2+は認知機能の低下に影響を与えないことを報告する2012年のシステマティックレビュー(Loef et al 2012)によると議論の余地が残っている(Simpson et al 2005年; Marcellini et al 2006年; Maylor et al 2006)。しかしながら、アルツハイマー病患者に類似した背景神経病理を有する3xTg-ADマウスモデル(Sasaguri et al 2017)は、記憶障害の遅延を示した(Corona et al 2010)。さらに、Tg2576,TgCRND8およびCRND8/E4モデルは、記憶障害の増強を示した(Linkous et al 2009; Railey et al 2011; Flinn et al 2014)。さらに、Tg2576マウスおよびSprague Dawleyラットは、それぞれ、脳の銅およびアミロイドの負担が低下し(Harris et al 2014)より高い認知能力を示した(Sandusky-Beltran et al 2017)。
複合体による細胞内のCu2+およびZn2+イオンの選択的放出は、βアミロイドのレベルを低下させることができる(Donnelly et al 2008)。銅イオンおよび亜鉛イオンの生理学的濃度の存在下でのB-アミロイドペプチドは分解されるが、これらの陽イオンのより高い濃度では凝集する(Strozyk et al 2009)。この知見と一致して、銅-亜鉛キレート剤の使用は、APP2576トランスジェニックマウスにおける脳アミロイドの沈着のかなりの減少を迅速に引き起こす(Cherny et al 2001)。他の著者は、β-アミロイド凝集体へのキレート剤の添加が、試験管内試験でその急速なフィブリル化を誘導することを示唆している。さらに、非フィブリル化凝集体の長時間のインキュベーションは、それらをフィブリル化形態に変換する(Tõugu et al 2009)。これらの知見は、βアミロイドのフィブリル形態が最も安定な状態であることを確認した(Tõugu et al 2009; Breydo et al 2016)。Zn2+およびCu2+イオンは、βシートのα-らせん構造へのリフォールディングを誘導し、アミロイドペプチドのオリゴマー化および膜貫通を誘導する(Curtain et al 2001)。銅イオンと亜鉛イオンはともにβアミロイドの構造変化を誘導するが、亜鉛の方がより大きな効果がある(Yao et al 2012)。
アルツハイマー病の鉄イオン
鉄は酸化還元活性金属であり、その脳内濃度は脳の特定の領域によって異なる。一般的に、運動機能を担う脳領域は、非運動関連領域に比べて鉄濃度が高いことがわかっている(Kozlowski et al 2012)。また、鉄はアミロイドプラークの周辺部でも高濃度である(Greenough et al 2013)。それにもかかわらず、アルツハイマー病脳のプラーク外の鉄のレベルについては論争がある(Schrag et al 2011)。銅や亜鉛とは対照的に、βアミロイドへの鉄の配位に関する構造研究はほとんど報告されていない(Hureau, 2012)。銅と亜鉛はプラークから抽出されたβアミロイドと共沈するが、鉄はβアミロイド鉱床内では共沈しない(Grundke-Iqbal et al 1990; Quintana et al 2006; Kozlowski et al 2012)試験管内試験研究ではβアミロイドが低い親和性で鉄と結合することが示されている(Viles、2012; Greenough et al 2013)。1950年代に行われたルイ・グッドマンの症例研究の後、アルツハイマー病病態の領域と鉄蓄積との関係が提唱された(Everett et al 2014)。いくつかのデータは、βアミロイドが試験管内試験で溶液中のFe3+-Fe2+を減少させることを示している(Khan et al 2006;Everett et al 2014)。一部の著者は、Fe3+のβアミロイドへの直接の配位は自然のpHでは不可能であり、Fe2+は空気に敏感であり、測定中にFe3+に酸化すると主張しているが(Hureau, 2012)他の著者は、Fe2+およびFe3+の潜在的なプロ会合機能を報告し(MastersおよびSelkoe, 2012)いくつかのデータは、トランスフェリンと比較してβアミロイドのFe2+に対するより高い親和性を示す(Jiang er al)。 血清、脳脊髄液および脳におけるアルツハイマー病における鉄濃度を評価するために、過去4年間に3つのメタアナリシスが実施されている(Tao et al 2014年;Wang et al 2015年;Li et al 2017 Tao et al 2014)のメタ分析(分析対象者の総プール:1813 アルツハイマー病対2401健常対照者)には、合計43の研究が含まれている;21は血清鉄を検討し、7は脳脊髄液鉄を検討し、19はアルツハイマー病の様々な脳領域での鉄を調査している。彼らの結果は、血清鉄は対照群と比較してアルツハイマー病で有意に減少することを示している。いくつかの特定の脳領域が鉄濃度の増加を示している間、脳脊髄液の鉄は違いを示していない。(Wang et al 2015)のメタアナリシス(分析対象者の総プール:1084 アルツハイマー病対1319健常対照群)には、血清鉄に差がないことを示した18の研究が含まれているが、高い異質性を生み出した研究を除外した後、彼らの結果は、血清鉄濃度がアルツハイマー病被験者で有意に低いと結論づけている。Li et al 2017)のメタ分析(分析対象者の総プール:1379 アルツハイマー病 vs. 1664 健常対照群)には、アルツハイマー病と対照群の間で血清鉄に全体的に有意な差がないことを示す25の研究が含まれているが、高い異質性を産生する2つの研究を除外した後、アルツハイマー病症例では血清鉄値が有意に低いと結論づけている。
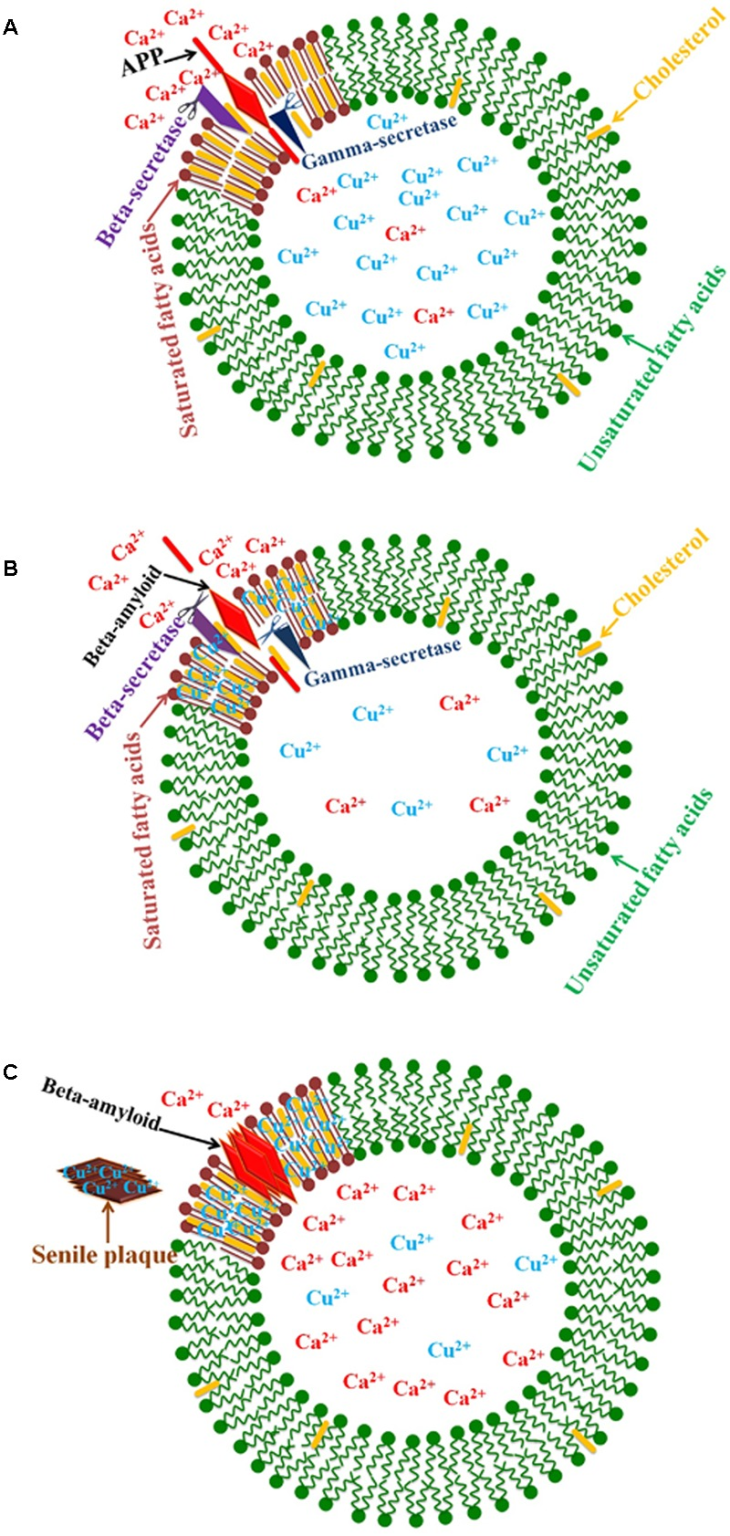
アルツハイマー病における銅と脂質ラフト
アミロイド生成経路が、コレステロールに富む特異的な膜ドメインである脂質ラフトで行われるというかなりの証拠がある。APPをβアミロイドペプチドに切断する酵素は、脂質ラフトに存在する(Riddell et al 2001; Hung et al 2009)。細胞内銅欠乏は、コレステロールに富んだ脂質ラフトに銅イオンの蓄積をもたらす。実際、脂質ラフト中の銅レベルは細胞性銅とは逆に関連しており、これはアルツハイマー病における銅欠乏の条件下で銅アミロイド複合体の形成を強化する結果となる(Cater et al 2008; Hung et al 2009)。
明らかに、食事はアルツハイマー病の進行において重要な因子である。いくつかの研究は、アルツハイマー病における脂肪の重要な役割を示している(グラント、1997年;スパークスとシュラーズ、2003年;モリス et al 2006年;ブリュワー、2012)。神経変性におけるCu2+およびコレステロール過負荷の有効な役割が報告されている(Arnal et al 2013b; Wong et al 2014)。銅およびコレステロールで処理したラットでは、視覚空間記憶の有意な変化が検出される(Arnal et al 2013b)一方で、食事性コレステロール+銅補給飲料水(硫酸銅の形で)の投与は、ウサギの脳におけるβアミロイドの蓄積を誘導する(Larry、2004)。βアミロイドへのCu2+イオンの結合は、コレステロールの酸化を引き起こし、H2O2の生成(Hung et al 2009)および他の脂質過酸化生成物がアルツハイマー病患者の脳(Murray et al 2007)およびTg2576トランスジェニックマウスモデル(Puglielli et al 2005)に蓄積する。実際、以前の不成功な治療の試みおよび脂質ラフトにおけるβ-アミロイド蓄積に関する最近の知見は、アルツハイマー病における神経毒性が、小可溶性アミロイドオリゴマーと細胞膜との関連の結果であるという新たな仮説を導き出した(Drolle et al 2014; Kotler et al 2014; Arbor et al 2016)。Bアミロイド膜結合は、ホスファチジルセリンとの相互作用によって媒介される(Ciccotosto et al 2011)。
アルツハイマー病患者の脳に蓄積するβアミロイドの毒性の強いアイソフォームは、脂質過酸化を誘導する能力が大きい。また、細胞膜に結合してカルシウムの流入を変化させる。このアイソフォームは、活性酸素の増加にはつながらず、代わりに細胞膜の完全性の低下とジトロシン-β-アミロイドオリ
ゴマーの増加を引き起こす(Gunn et al 2016)。他の研究では、架橋ダイマーの毒性は、強化された膜結合によるものであることが示唆されている(Ciccotosto et al 2004)。
シミュレーション実験では、細胞膜コレステロールの増加は、膜にいくつかの変化をもたらすことを示している。これらの膜の変化は、アミロイドの細胞膜への結合を誘導し、β-アミロイドをらせん状または非構造体へとリフォールディングさせる。β-アミロイドは、膜表面で安定化されるか、カルシウムイオンの助けを借りて二重層に挿入される(Yu and Zheng, 2012)。実際、β-アミロイドペプチドは、コレステロール結合ドメインを介して膜のオリゴマー細孔を構成する(Lashuel et al 2002;Di Scala et al 2014)。チャネル形成は、コレステロール依存性であり、脂質二重層膜中の少なくとも30%のコレステロールの存在下で起こる。これらの孔は、神経細胞におけるカルシウムの恒常性を混乱させるイオンチャネルであり、アルツハイマー病の「カルシウム仮説」の復活をもたらした(Di Scala et al 2014,2016;図33)。銅の非存在下では、コレステロール値の上昇があってもβアミロイドは血液中にクリアされるが、銅の存在下ではβアミロイドは脳内に蓄積する(Sparks, 2007)。それ以外では、βアミロイドが存在しない状態での銅イオンは細胞に毒性がない(Sarell et al 2010)。
図3 アルツハイマー病における銅と脂質ラフトの関係を示す模式図
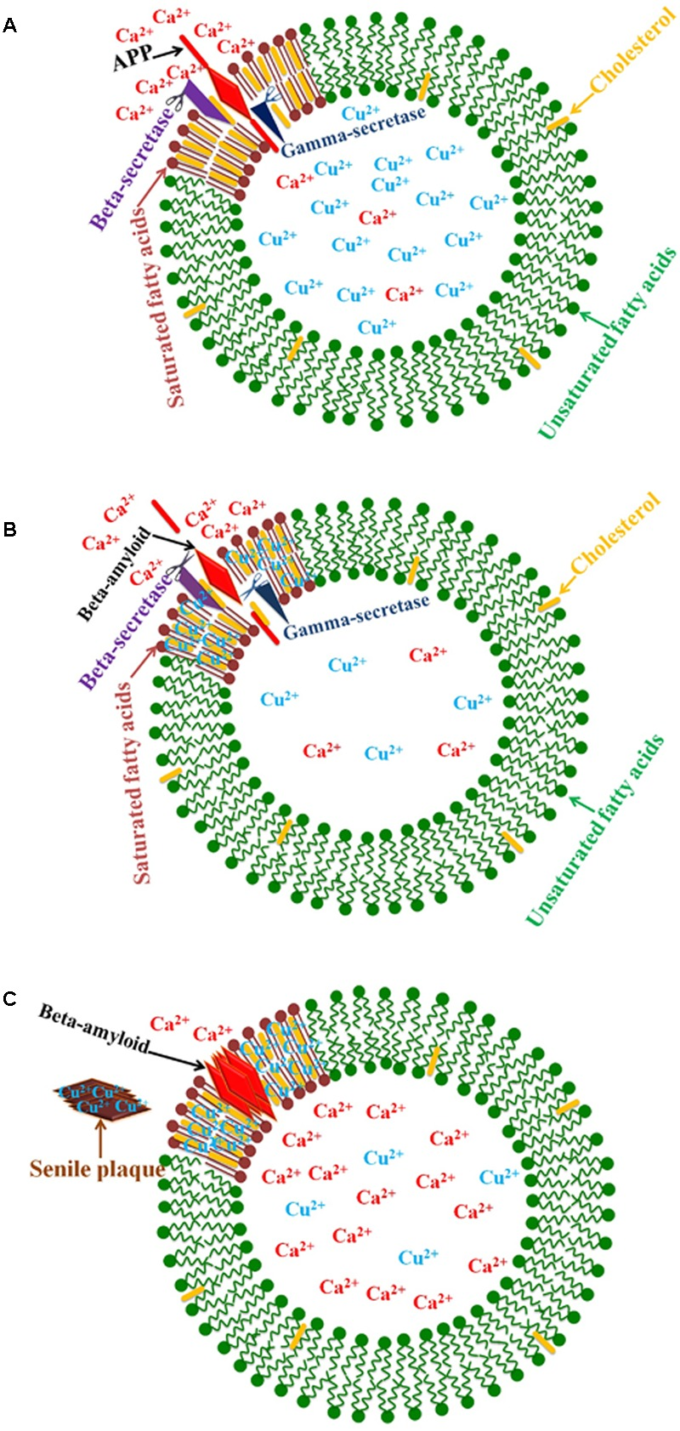
A)APPをβアミロイドペプチドに切断する酵素は脂質ラフトに存在する。B)細胞内の銅欠乏により、コレステロールの多い脂質ラフトに銅イオンが蓄積し、銅濃度の上昇により酵素の活性が高まるため、βアミロイドの産生が増加する。C)βアミロイドペプチドは、コレステロール結合ドメインを介して膜のオリゴマー細孔を構成している。これらの細孔は、神経細胞のカルシウムの恒常性を乱すカルシウムチャネルである。
おわりに
アルツハイマー病は、アルツハイマー病患者の脳内に老人性プラークが存在することを特徴とする進行性の変性疾患である。それは、遺伝的要因と環境要因の数が関与している可能性が高い多因子性疾患である。これまでの研究では、これらのプラークはアルツハイマー病の有害要素として同定されている。しかし、他の研究では、健康な人の20~40%が脳内に老人性プラークを保有していることが実証されている(Jack et al 2010)。さらに、プラーク形成に先立って細胞死が起こることもある。多くの研究は、銅-アミロイド複合体による活性酸素の発生に焦点を当て、活性酸素がアルツハイマー病の有害元素であることを提案してきた。さらに他の著者は、活性酸素が記憶形成の基礎となることを示している。さらに、より高い銅イオン濃度でのフィブリルおよびオリゴマーは、活性酸素の産生を抑制する。代替として、毒性オリゴマー仮説は、可溶性オリゴマーが細胞膜と相互作用し、それらの中でカルシウムチャネルの形成を誘導することを示す、強いようである。まとめて、それは銅の制御機構の混乱は、異なる組織や臓器での金属のコンパートメントに影響を与える、アルツハイマー病 で発生すると思われる。一部の著者は、脳(ジェームズ et al 2012)と周辺部(Squitti et al 2014a)の銅のラボイルプールのレベルの増加は、脳内の銅の欠乏と脳内の銅のラボイルプールの増加と血中の “遊離銅 “の増加をもたらすことを観察している。これがウィルソン病の病態(Fujiwara er al)。 考えられる解釈としては、脳細胞での銅欠乏はアミロイド産生のために有害であり、その後、銅欠乏は脂質ラフト上の銅濃度の上昇につながるということである。銅欠乏状態では、銅とアミロイドの両方のレベルが高く、アミロイドペプチドの銅に対する親和性が高いため、アミロイドと銅の複合体が脂質ラフト上で増加する。銅イオンの結合と細胞膜への近接は、アミロイドペプチドのリフォールディングを誘導し、最終的にはそれらのオリゴマー化と細胞膜との相互作用を引き起こす。脳細胞における銅欠乏の根源は、アルツハイマー病の重要な因子であると思われる。脂質ラフトの銅富化を伴うので、脂質ラフトドメインの上昇が脳内の銅欠乏につながる可能性があり、脂質ラフトを標的とすることが有効な治療法となる可能性がある。実際、いくつかのデータは、(オメガ3脂肪酸による)脂質ラフトの破壊が、疾患の発生を遅らせることを示している(クーパー、2003年;ダネンバーガー et al 2013年;アーバー et al 2016)。