Raynaud’s Phenomenon: A Brief Review of the Underlying Mechanisms
オンラインで2016年11月16日に公開
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC5110514/
概要
レイノー現象(RP)は,寒さによる血管収縮の増強を特徴とする.この拡張された血管収縮は、交感神経系を介した冷却に対する反射反応と、α2Cアドレナリン受容体(α2C-AR)の局所的な活性化によって起こるものである。活性酸素種とRho/ROCK経路が関与する寒冷時のミトコンドリアを介したメカニズムでは、血管平滑筋細胞の細胞骨格の再編成により、α2C-ARが細胞膜に移動し、この受容体がリガンドと容易に相互作用するようになる。このようなα2C-ARの空間的・機能的救済には、さまざまなパラメータが関与している。特に重要なのは、女性ホルモンである17β-エストラジオール(エストロゲン)である。このことは、閉経前の女性では、同年齢の男性に比べてRPの有病率が高いことと一致している。これらの様々な因子の役割を明らかにするだけでなく、RPの発症や有病率に対する汚染や遺伝的背景の寄与についても論じている。また、この病気の治療法として採用されているさまざまな治療法についても取り上げ、分析している。RPの適切な動物モデルがないことから、この病気をよりよく理解し、最終的には治療するためにさらなる努力が必要である。いくつかの治療法が利用されているが、RPの発作の重症度や頻度を減らすためには、予防が効果的であることに留意する必要がある。
キーワード:レイノー現象、末梢血管疾患、α2アドレナリン受容体、エストロゲン、体温調節、Rhoキナーゼ
はじめに
寒さによって引き起こされる皮膚細動脈の血管収縮は、過度の熱損失から身体を守るために血液を表層循環から内臓へと導く正常な生理的プロセスである(Charkoudian, 2010)。この収縮は、ノルエピネフリンの反射的な交感神経の放出(Charkoudian, 2010)と、血管系の感作の増加(Vanhoutte, 1980; Wigley and Flavahan, 2016)によって媒介される。この寒さによる収縮が誇張されると、レイノー現象(RP)と呼ばれる病的な状態になる(Herrick, 2012)。この疾患は、臨床的に一次性と二次性に分類される(Block and Sequeira, 2001)。一次性RPは特発性であり、この病気の最も一般的な形態である(Roustit et al.) 一方、二次性RPは、自己免疫疾患や癌などの無数の基礎的な健康状態や、喫煙や特定の薬などのライフスタイルに起因する可能性がある(Prete et al.) 実際、強皮症を患う患者の95%がRPと診断されている(Black, 1995)。
レイノー現象は、一般人口の最大10%が罹患すると言われている(Garnerら、2015年)。罹患者は、主に指のレベルでの膨らみや潰瘍に加えて、古典的な3色の変化(蒼白、チアノーゼ、紅斑)を伴う寒冷誘発性血管攣縮発作(Heidrich, 2010)に悩まされる(Maverakisら, 2014)。その他、鼻、足指、乳首などの遠位の身体器官が影響を受けることが報告されている(Block and Sequeira, 2001; Anderson et al., 2004)。RPの診断にはさまざまな症状があるが、いくつかのパラメータの変化も参考になる。例えば、RP患者の血清学的検査では、エンドセリン-1(Zamoraら、1990年)、腫瘍壊死因子-α(TNF-α)(Rychlik-Golemaら、2006年)、フィブリノゲン(Spenglerら、2004年)、血小板因子(PF-4)、およびvWF(von Willebrand’s factor)のレベルが上昇している(Rychlik-Golemaら、2006年)。マグネシウムイオンとS-ニトロソチオールのレベルは、RP患者では罹患していない人に比べて減少するようである(Leppertら、1990年、Kunduら、2014年)。さらに、患者の血清には抗セントロメア抗体と抗セントリオレ抗体が検出される(Gentricら、1990;Yamadaら、2014)。
RPの発症に関与する基本的なメカニズムを解明するために、多くの仮説が提案されてきた。最近では、この疾患のモザイク説が強く支持されているようである(Greensteinら、1996年)。この理論は、局所的、神経的、およびホルモン的なメディエーターが関与する、この疾患の複数の病因を統合するものである(Wigley, 2002)。これらのメディエーターのいずれかの機能低下が、ノルアドレナリンに反応して皮膚動脈を過度に収縮させる原因となっている可能性がある(Easter and Marshall, 2005)。ノルアドレナリンは、血管平滑筋細胞(VSMC)の表面に存在するアドレナリン受容体に結合することにより、その効果を発揮する(Guimaraes and Moura, 2001)。一般的に、VSMCはα1、α2、β2の3種類のアドレナリン受容体(AR)を持っている。血管床によっては、β1およびβ3アドレナリン受容体も存在するが、通常はβ2アドレナリン受容体よりも発現量が少ない(Ahles and Engelhardt, 2014)。β2アドレナリン受容体は血管拡張のみに関与し(McCance and Huether, 2013)、α1およびα2-ARは血管収縮に関与する(図1A1A)。α1-ARは血管樹全体に広い発現パターンを持っているのに対し、α2-ARはより細い血管や細動脈に主に存在する(Polonia et al.) ある時、これらの受容体がミンチにした大動脈のタンパク質抽出液中に存在することが驚きをもって発見された(Chotani et al., 2004)。しかし、組織化学的な分析により、これらの受容体は大動脈の血管内に発現していることがわかった(Chotani et al., 2004)。
図1 (A) 動脈の血管平滑筋細胞(VSMC)における優勢なアドレナリン受容体 β2ARは小微小血管の血管拡張を媒介する
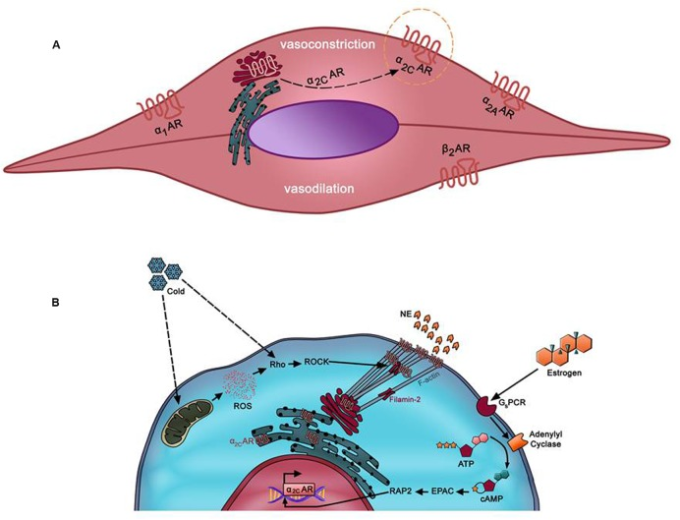
これらの血管の血管収縮は、α1-AR、α2A-AR、α2C-ARを介して起こる。これらの細胞のα1-AR、α2A-AR、β2-ARが細胞表面に局在しているのに対し、α2C-AR(オレンジの点線の円)は細胞内(主にトランスゴルジ)にユニークに捕捉されている。α2C-ARは、寒冷時に起こる血管収縮を仲介し、これが悪化するとレイノー現象(RP)を引き起こす可能性がある。(B) 寒冷によりα2C-ARが動員されるメカニズム。皮膚動脈SMCでは、温度の低下をミトコンドリアが感知し、活性酸素種(ROS)を放出する。活性酸素は、Rho/ROCK経路を活性化する。続いて、F-アクチンとフィラミン-2が関与する細胞骨格の再編成が行われ、α2C-ARが小胞体/ゴルジ体から細胞表面に動員される。
初期の研究では、局所冷却による皮膚動脈の収縮にα2-ARが重要な役割を果たしていることが明らかになった。ここで重要なのは、局所的な冷却が血管拡張を引き起こすこと(Johnson and Kellogg, 2010)と、α1-ARを介した血管収縮を抑制すること(Freedman et al, 1992)である。逆説的に言えば、この冷却は、α2-ARを介した収縮作用を選択的に増幅する可能性があるため、血管収縮も引き起こす(Jeyaraj et al., 2001; Eid et al., 2008)。α2-ARは交感神経系の皮膚血管の収縮に重要な役割を果たしているため、α2-ARを選択的に増強することで、寒冷により誘発される収縮作用が血管拡張作用に打ち勝つことができる。そのため、非選択的なα2-ARアンタゴニストが末梢の寒冷による血管収縮の治療に用いられたこともあったが、治療効果はなかった(Freedmanら、1993年)。
分子、遺伝子、薬理学的研究から、α2-ARは実際にはα2A、α2B、α2Cの3つのサブタイプからなることがわかっている(MacDonaldら、1997年)。これらのサブタイプは、3つの異なる染色体上に対応する遺伝子を持ち、すべて阻害性のヘテロ三量体Gタンパク質と結合している(MacDonald et al., 1997)。α2A-ARは寒冷時の血管収縮には関与していないようであった(Chotani et al., 2000)。いくつかの報告では、RPの血管痙攣の治療法としてα2B-ARアンタゴニストを使用する可能性が指摘されていた(MacDonald et al., 1997)。驚いたことに、レイノー病の治療にα2B-ARアンタゴニストの役割を支持する強力な実験的・臨床的データを見つけることができなかった。
α2-ARのサブタイプのうち、α2C-ARは2つの主な理由から胎児性の受容体であると考えられてた。1つ目は、α2C-ARは細胞内のコンパートメントに隔離されているため(von Zastrow and Kobilka, 1994)、その機能は免疫組織化学のアッセイでは容易に検出できなかったことである(MacDonald et al., 1997)。2つ目は、α2C-ARノックアウトマウスもトランスジェニックマウスも大きな変化は見られず、どちらも生存率、繁殖力が高く、ほぼ正常な状態を保っていたことである(Sallinen et al., 1997)。その一方で、α2C-ARの見かけ上の残存性を否定する別の証拠も現れた。第一に、α2C-ARは他のアドレナリン受容体に存在する高度に保存されたドメインを持っている(Nyronen et al.、2001)。第二に、一見正常に見える表現型は、他のα2-ARによる補償によるものである可能性があり、第三に、α2C-ARは異なる組織の細胞で異なる発現をしている(MacDonald et al., 1997)。
α2C-ARの生物学的な特徴として、ある種の生理的・病態的な刺激を受けると、α2C-ARが小胞体やゴルジ装置から細胞膜へと移動するという興味深いものがある。この空間的な移動により、受容体にリガンドが結合できるようになり、リガンドの結合によって受容体が活性化される(Chotaniら、2000年、2004年、Jeyarajら、2001年)。適度な生理的冷却(28℃)を行うと、α2C-ARはER/ゴルジ体から細胞表面に動員される(Baileyら、2004)。細胞表面に局在化したα2C-ARは、アゴニストと容易に相互作用し、活性化され、ノルエピネフリンに反応して皮膚の血管収縮を引き起こす(Jeyaraj et al.) 実際、寒さによって引き起こされる皮膚動脈の収縮の全体が、α2C-ARの活性上昇によるものであることが明らかになっている(Baileyら、2004年、Eidら、2008年)。そのため、RPで観察される血管収縮の増大には、α2C-ARが重要な役割を果たしていると考えられる(Baileyら、2004年)。
α2C-ARのトランスロケーションが起こるメカニズムには、活性酸素種(ROS)、Rho/Rhoキナーゼ、アクチン細胞骨格など、さまざまなプレーヤーが関与している(図1B1B)。Baileyらは、細胞が低温にさらされると、早ければ数分後にRho/Rhoキナーゼ経路が活性化されることを報告している(Bailey et al.) 活性化されたRhoは、α2C-ARの膜への動員を促し、その結果、寒さによる血管収縮を誘発する(Bailey et al.、2004年)。この意味で、α2C-ARではなく、Rhoが「温度センサー」であると考えられる(Bailey et al.) しかし、Flavahanのグループは、ミトコンドリアがVSMCの「温度感受性」の高いオルガネラであることを、さらにエレガントな方法で示した(Bailey et al.2005)。実際、低温ストレスを受けると、ミトコンドリアが活性酸素を放出してプロセスを開始し、それが酸化還元シグナルの引き金となってRho/Rhoキナーゼ経路が活性化され、α2C-ARの空間的な再分布と機能的な活性化を引き起こす(Bailey et al.2005)。この冷却によるRhoの活性化は、カルシウム感受性を高めたり、細胞骨格構造を変化させたりすることで作用すると考えられる(Hall, 1998; Jeyaraj et al.)
RPとアクチン細胞骨格
細胞骨格は、細胞分裂、移動、細胞間のコミュニケーション、タンパク質輸送など、細胞の基本的なプロセスにおいて重要な役割を果たしている(Fletcher and Mullins, 2010)。RPの主役であるα2C-ARがER/ゴルジ体からVSMCの細胞膜に移動することは、その活性化に不可欠である。このトランスロケーションには、F-アクチンやアクチン/ミオシンフィラメントなどの多くの細胞骨格成分が関与している。VSMCの収縮、そして最終的には血管収縮が起こるのは、アクトミオシンフィラメントの調節によるものである。
Rhoキナーゼシグナルの下流のエフェクターであるF-アクチンの増加により、アクチンの上部構造が再編成されることで、寒さによるRhoを介した構造変化が起こる(Jeyaraj et al.、2012)。興味深いことに、免疫細胞化学的分析によると、非血管系の細胞では、細胞内のα2C-ARとF-アクチンが共存していることがある(Hurtら、2000)。その後、α2C-ARはアクチンフィラメントに接近して結合し、トラフィッキングプロセスの準備を整える(Jeyaraj et al.) この密接な結合は、α2C-ARとアクチンフィラメントの架橋剤であるフィラミン-2との直接的な相互作用を介して行われるようである(Motawea et al.) 実際、さらにin silicoでタンパク質-タンパク質ドッキングを検討したところ、α2C-ARとF-アクチンの相互作用は、α2C-ARとアクチン結合タンパク質であるフィラミンとの直接結合を介して起こることが確認された(Pawlowski et al.) 興味深いことに、この相互作用は温血動物でのみ進化している(Pawlowskiら、2014年)。したがって、同様のタンパク質-タンパク質相互作用を解明することは、誇張された血管収縮に対するより効率的な治療法の確立に役立つ。その一つのシナリオとして、α2C-ARと細胞骨格成分であるF-アクチンとの相互作用を阻害するアプローチが考えられる。
RPとエストロゲン
疫学調査によると、RPの有病率に関して興味深い結果が得られている。この疾患は、年齢を合わせた男性よりも女性の方が有意に高い発生率を示している(Mericqら、1993年、Garnerら、2015年)。実際、RPに罹患しているアメリカ人患者の70%は女性である(Maricqら、1993年)。RPに罹患した患者のうち、閉経前の女性と年齢を合わせた男性との比率は9:1に近い(Belch and Ho, 2001)。このことは、この病気の有病率に男女差があることを示しており、この病気の発症や病態に性ホルモンが関与している可能性を示唆している(Mericq et al., 1993)。一般的に心血管疾患は男性と閉経後の女性に多いと報告されているが(Reslan and Khalil, 2012)、女性であることはRPの危険因子の一つである(Garnerら, 2015)。この結論は、男性に比べて女性の有病率がはるかに高いことを主張するメタアナリシス研究に一部基づいている(Garnerら、2015年)。特に、閉経前の女性と閉経後の女性では発症率が高く、月経周期と低温変調デジタル血流との間に興味深い関連性が見られた(Greensteinら、1996年)。さらに解析を進めると、閉経後にエストロゲン補充療法(ERT)を受けている女性は、ERTを受けていない閉経後の女性に比べて、この病気にかかりやすいことがわかった(Mayes, 1999)。これらの知見を総合すると、閉経前の女性で発症率が高いのはエストロゲンの影響であると考えられる(図図図22)。興味深いことに、対向エストロゲン療法(エストロゲンとプロゲステロンの併用)を受けている閉経後の女性では、RPの発生率は閉経前の女性に比べて有意に高くなかった(Fraenkelら、1998年)。このことは、プロゲステロンがエストロゲンの効果を否定していることを示唆しているのかもしれないが、これはまだ確立されていない。
図2 エストロゲンとRPとの正の関連性を示す証拠
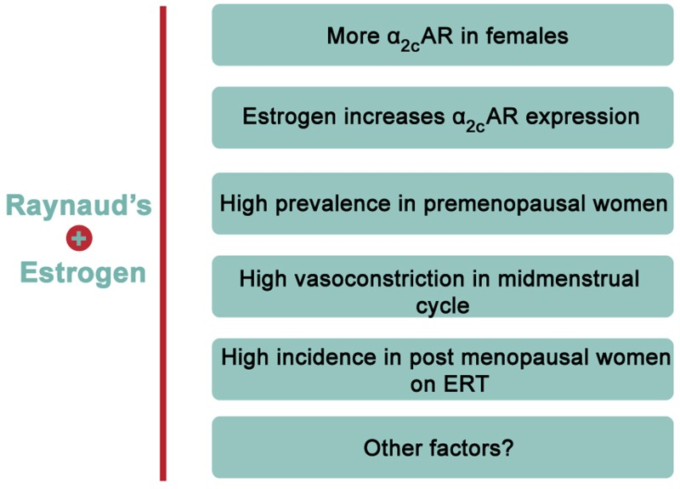
蓄積された証拠は、エストロゲンとRPの間に圧倒的な関連性があることを示している。例えば、ヒトの動脈平滑筋細胞では、エストロゲンはα2C-ARを増加させるが、α2A-ARは増加させない。さらに、女性は男性に比べてα2C-ARの発現が高いことがわかっている。疫学的には、RPは閉経前または閉経後でエストロゲン補充療法(ERT)を受けている女性に非常に高い発症率を示すことが報告されている。
閉経前の女性では、ノルアドレナリンを介した血管収縮は、エストロゲン濃度が比較的高い月経周期中期に、月経周期初期に比べて高くなることが知られている(Chanら、2001)。さらに、ヒトとラットの生殖年齢の女性は、男性よりも高い血管反応性を示す(Li et al.、2014)。興味深いことに、男性の血管反応性は、17β-エストラジオールを外部から補充すると増強される(Li et al.、2014)。このことは、エストロゲンが血管反応性に直接作用していることを示唆しているが、このような増強のメカニズムはまだ不明である。
体温の調節におけるエストロゲンの基本的な役割が定義されている(Charkoudian and Stachenfeld, 2016)。エストロゲンには血管拡張作用があるが、多くの場合、体温を低下させる可能性がある(Charkoudian and Stachenfeld, 2016)。RPは血管性の体温調節制御障害と考えられるため(Flavahan, 2015)、特に閉経前の女性の寒さに対する反応が誇張されていることや、若い女性にRPの有病率が高いことを考えると、この疾患におけるエストロゲンの意味合いは明らかになる。このことは、エストロゲンに対する血管運動活性に男女差があり、この差がRPなどの血管痙攣性疾患の病因に重要な役割を果たしている可能性があるというEnglishらの研究結果からも裏付けられている(Englishら、2001年)。
エストロゲンがVSMCにおけるα2C-ARの発現を増加させ、α2C-ARがラット尾動脈における寒冷による血管収縮を媒介することが明らかにされている(Eid et al.) 特筆すべき点は、α2-ARのうち、α2C-ARサブタイプのみがラット尾動脈で異なる発現をしており、雌での発現が顕著であることである(McNeill et al., 1999)。また、ヒトのVSMCでは、エストロゲンがα2A-ARの発現を修飾しないことも報告していた(Eid et al.) Flavahanのグループは、寒さによる血管収縮の全体をα2C-ARが仲介することも明らかにしていた。我々は、エストロゲンがα2C-ARの発現、表面局在、および機能を実際に増加させるという仮説を立て、後にそれを確認した(Eid et al.) このエストロゲンによるα2C-ARの活性化に続いて、マウス尾動脈の寒冷による血管収縮反応が増強された(Eidら、2007年)。これらの証拠から、エストロゲンとRPの間には正の関係があることが明らかになった。
RPと遺伝的背景
前述のように、RPには特発性のものと、強皮症のような他の疾患に続発するものがある。遺伝的素因がこの病気の発症に関与しているのではないかと推測されている(Tan and Arnett, 2000)(図33)。しかし、シークエンスの結果、この病気の病因に関与していると疑われている候補遺伝子には変異が見られなかった(Susol et al.) これらの候補遺伝子は、筋アセチルコリン受容体のβサブユニットとセロトニン1Bおよび1E受容体である(Susolら、2000年)。それにもかかわらず、この疾患の有病率には遺伝的要因があると主張し続ける人もいた(Pistorius et al., 2006)。この主張は、家族研究や双子解析によって裏付けられている(Pistorius et al., 2006)。最近では、生後1カ月の男性の赤ちゃんがRPと診断された例が報告されている(Sharathkumar and Castillo-Caro, 2011)。この症例を受けて、この病気には遺伝的な要因があるのではないかと推測されている。しかし、遺伝とRPの間に強い因果関係があると断言するには、まだ多くの証拠が不足している。
図3 RPの遺伝的基盤
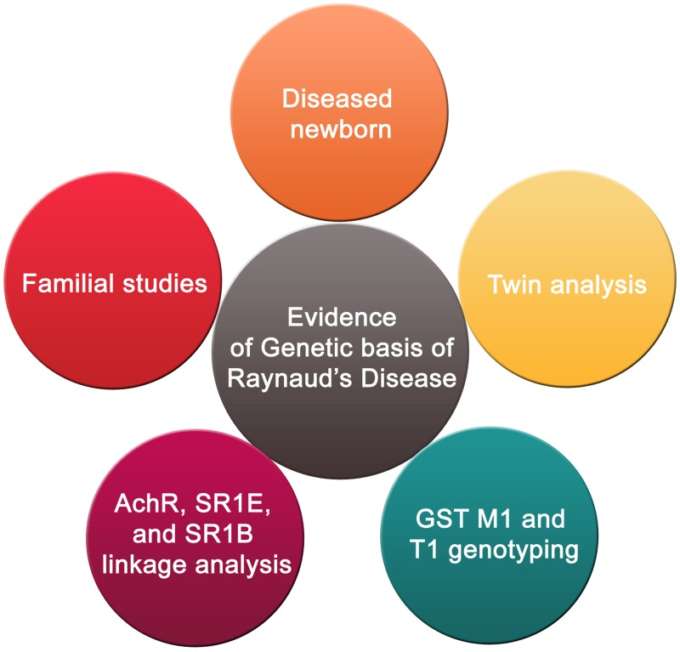
RPの遺伝的基盤は、家族調査や双生児解析に加え、生後1カ月の男性がRPと診断された例が報告されている。さらに、グルタチオンS-トランスフェラーゼのM1およびT1サブタイプをコードする両遺伝子のポジティブな遺伝子型の組み合わせが、RPの感受性に関与している可能性もある。連鎖解析の結果、RPに関連する可能性のある3つの候補遺伝子(筋肉アセチルコリン受容体のβサブユニット、セロトニン受容体の1Eおよび1B)に対応する5つの領域が特定された。
興味深いことに、塩化ビニルモノマー(VCM)に暴露されたRP患者の研究では、特定の遺伝的背景と環境条件との相互作用が、VCM暴露者のRPの発症を増加させる役割を果たしている可能性が示唆されている(Fontanaら、2006年)。2006年、Fontanaら(2006)は、グルタチオンS-トランスフェラーゼM1およびT1遺伝子の多型とVCMに曝されたRP患者との間に関連性があるかどうかを調査した(Fontanaら、2006)。その結果、両遺伝子のポジティブな遺伝子型の組み合わせが、RPの感受性を高める可能性があることがわかった(Fontana et al., 2006)。別の研究では、298個のマイクロサテライトマーカーを用いて、各家族に少なくとも3人のRP患者を持つ6つの拡大家族の2段階の全ゲノムスクリーニングが行われた(Susol et al., 2000)。連鎖解析の結果、5つの染色体上に連鎖の可能性がある領域が特定された。これらの領域は、RPに関連する可能性のある3つの候補遺伝子(筋肉アセチルコリン受容体のβサブユニット、1Eおよび1Bセロトニン受容体)にマッピングされた(Susol et al.、2000)。これは、RP感受性の遺伝的基盤の証拠となる。また、5つの可能性のある関連性が強調されたことは、RPが単原性ではなく、オリゴ原性の疾患である可能性を示している。しかし、報告された所見の中には偽陽性のものもあるので、この示唆を確かめるにはさらなる研究が必要である(Susol et al.、2000)。したがって、多くのRP患者を対象にして、これらの候補遺伝子の変異やSNPをスクリーニングすることは興味深いことである。
RPの毒物学的基礎
RPで観察される血管反応の高まりの多くは、交感神経系または局所的な原因によるものである。寒さや不安などのストレスは、ノルアドレナリンを介して血管収縮を引き起こすことから、交感神経系の原因に該当する。一方、機械的なストレスや化学的なストレスは、病気の症状が現れる体の器官に直接影響を与えるため、「局所的」なカテゴリーに属する。このような「局所的」なストレスの影響を受けやすい部位として、「指」が挙げられる。機械的ストレスの一例として、手や腕のレベルの振動に長時間さらされることがある。振動誘発性白指としても知られているこの手腕振動症候群は、まさに職業上の危険に起因する二次的なRPの一形態である(White et al., 2004)。機械の振動による手や腕への継続的な刺激は、熱的または感情的なストレスを受けたときに、これらの器官が血管攣縮性の攻撃を受けやすくする。この症状が進行すると、このような振動は室温でも指先の血管攣縮を増加させる(White et al.、2004年)。したがって、振動する道具を扱うことが必要な仕事をしている労働者に血管症状が多く見られるのは驚くことではない(White et al.2004)。
RPにおける化学的ストレス要因の顕著な例として、VCMが挙げられる。このモノマーは、プラスチック、特にポリ塩化ビニル(PVC)の製造に使用される無色のガスである。興味深いことに、PVCにさらされている労働者の約3分の1がRPに悩まされている(Maricqら、1978年)。これらの患者の手の血管造影では、血管緊張の変化や指動脈の狭窄などの血管病変が見られた(Falappa et al., 1982)。血管造影や毛細血管造影検査では,VCMへの曝露が内皮に対して毒性があることが示されているので,これは驚くべきことではない(Maricqら,1976;Falappaら,1982)。さらに、VCMへの曝露は、RPの症状と関連して再発した手の遠位指骨の先端骨溶解に大きく寄与することが示された(Wilsonら、1967年)。実際、前述したように、PVCに暴露されたフランス人労働者にはRPの有病率が高いことが報告されている(Fontana et al.、2006)。これらを総合すると、ポリ塩化ビニルの持続的な毒性作用がRPの発症や病因に関与しているという考えが支持される。
この他にも、RPの発症に関連する化学物質や医薬品がある。例えば、ヒ素、ニコチン、ゲムシタビンなどが挙げられる。実際、ヒ素とRPの間には正の相関関係があるようである。チリで行われた研究では、RPを含む末梢血管疾患の兆候や症状の有病率の増加が、ヒ素に汚染された飲料水と関連していることが示されている(Nordberg et al.、2014年)。文脈的には、ヒ素にさらされた製錬所の労働者は、RPを思わせる指の血管痙攣反応の高まりを示している(Lagerkvist et al.、1986;Hall、2002;William and Markowitz、2007)。これらの知見を総合すると、ヒ素がRPの病因に関与していることを示す証拠となる。
喫煙は、古くからRPと正の関連があるとされてきた(Garnerら、2015年)。さらに、タバコの主成分の1つであるニコチンは、血流を著しく減少させ、血管抵抗を増加させることが知られている(Cardelli and Kleinsmith, 1989)。したがって、ニコチンがRPの症状を悪化させることは驚くべきことではなく(Cherniackら、2000年、Jackson、2006年)、乳頭のRPの治療の1つの要素としてニコチンを避けることが提案されているほどである(Andersonら、2004年)。
また、化学療法に用いられるヌクレオシド系薬剤であるゲムシタビン(Carmichael, 1998)のように、RPを想起させる症状を引き起こす薬剤もある(Yamada et al.) 実際、経口投与すると、RPの典型的な症状である痛み、腫れ、指の白化などが起こるようである(Carmichael, 1998)。実際に、膀胱がんのためにゲムシタビンを投与した後にRPと指の壊死を起こした例が報告されている(D’Alessandro et al.) さらに、強皮症の患者がゲムシタビンとカルボプラチンの併用療法を受けた後、デジタル虚血を発症した(Clowse and Wigley, 2003)。興味深いことに、ゲムシタビン化学療法とデジタル虚血イベントとの関連は、これまで疑われていたよりも一般的で、特にタバコ関連のがん患者に多いようである(Kuhar et al., 2010)。このゲムシタビンによる血管障害のメカニズムはまだ明らかになっていないが、内皮の損傷や血栓性微小血管症(Venat-Bouvetら、2003年、Holsteinら、2010年)が一因ではないかと提案されている。このゲムシタビンに関連した血管毒性は、強皮症患者ではむしろ顕著であることに注意する必要がある。同様に、RP症状の増悪はフルオロピリミジン、すなわちカペシタビン療法に関連することが判明した(Cowardら、2005年)。このように、強皮症患者やRP患者に化学療法剤、特にゲムシタビンを投与する際には注意が必要である。
また、ゲムシタビン以外の化学療法剤もRPとの関連が指摘されている。例えば、ドキソルビシン、シクロホスファミドによる強皮症の症例は、ほとんどがびまん性硬化症とRPを呈する(Saif et al.、2016)。さらに、ビンクリスチンによる用量依存性のRPも報告されている(Gottschlingら、2004年)。興味深いことに、シスプラチンとビンブラスチンを併用すると、RPの有病率が高くなることが指摘されている(Vogelzangら、1981年)。これらの薬剤の神経毒性が、RPの有病率増加の背景にあるかどうかは、まだよくわかっていない。交感神経流出の過活動が根本的な原因である可能性が示唆されている(Chant, 1987; Olsen et al., 1987)。しかし、このことは、末端動脈の血管系への直接的な影響も考えられるという可能性を排除することはできない。特に、寒冷により誘発される血管収縮の全体は、内皮や交感神経系からの寄与とは無関係に、血管のα2C-ARによって媒介される(Kristensen, 1979; Eid et al., 2007, 2008; Wigley and Flavahan, 2016)。
シスプラチン、ビンブラスチン、ブレオマイシンの化学療法を併用した長期研究から得られた疫学的データによると、これらの治療を受けた患者の35~45%がRPを発症していた(Hansen and Olsen, 1989)。特にブレオマイシンは、これらの患者のRP発症の鍵を握っていると思われる。実際、最近行われた大規模な横断研究では、化学療法後の追跡調査でRPが持続するかどうかの唯一の有意な予測因子がブレオマイシンの投与量であることが示された(Glendenning et al.)
RPの治療
RPの理解と治療を深めるために多大な努力がなされてきた(Leeら、2014年、Poredos and Poredos、2016年)。しかし、この疾患に対する決定的または特異的な治療法は、まだ米国食品医薬品局(FDA;Landry, 2013)によって承認されていない。この病気との戦いにおける制限要因の1つは、その病態生理の不完全な理解であり(Landry, 2013)、これはRPの適切な動物モデルの欠如によってさらに悪化している。さらに、治療法の有効性は、疾患の重症度と種類、および血管障害の程度によって異なる。しかし、RPの症状を緩和すると考えられるいくつかの薬や治療法が臨床現場で採用されている。これらの選択肢は、伝統的な薬理学的治療法、民族薬理学的治療法、非伝統的治療法、そして最近では外科的介入にまとめて分類することができる(表表11)。
表1 レイノー病の様々な治療法
| 処理 | 効果 | リファレンス | |
|---|---|---|---|
| 伝統的な治療 | カルシウムチャネル遮断薬。 | 効果的; 治療の第一線 | ハラワ、2001 ; トンプソンと教皇、2005年 |
| PTK阻害剤 | 効率的 | Furspan et al。、2004、2005 | |
| PDE5阻害剤 | 非効率的な | Lee et al。、2014 | |
| ベータ遮断薬 | 物議を醸す | マーシャル他、1976年 コルトリンガー他、1991年 | |
| スタチン | 新興/強力 | Abou-Raya et al。、2008 | |
| プロスタサイクリン | 効率的 | Rademaker et al。、1987 | |
| ACE阻害剤 | 可変効果 | ヘネスとウィグレー、2007年 | |
| エンドセリン受容体拮抗薬 | 可変効果 | ポレドスとポレドス、2016年 | |
| セロトニン受容体拮抗薬 | 効果的 | Coleiro et al。、2001 | |
| 非伝統的な治療 | ボツリヌス毒素A型 | 効率的 | Neumeister et al。、2014 |
| チャイニーズハーブ | 効果がない | Wu et al。、2008 | |
| イチョウのビロバ | 効果がない | Muir et al。、2002 | |
| 鍼 | 効率的 | Appiah et al。、1997 | |
| レーザー治療 | 効率的 | Hirschl et al。、2004 | |
| 手術 | 胸腔鏡下胸部切除術 | 効果的 | Coveliers et al。、2011 |
| ハンドストリッピング | 効果的 | Balogh et al。、2002 | |
| 神経刺激 | 効果的 | カーダ、1982年 | |
| 脂肪移植 | 有望な結果 | Bank et al。、2014 |
伝統的な治療法と非伝統的な治療法、そしていくつかの外科的介入についてまとめた。
伝統的な薬理学的薬剤は、血管収縮を抑える、血管拡張作用を誘発する、あるいはまだはっきりしないメカニズムでRPの症状を緩和する。血管拡張作用のある薬剤としては、カルシウム拮抗薬、環状グアノシン一リン酸(cGMP)特異的ホスホジエステラーゼ5型(PDE5)阻害薬、プロスタサイクリン、プロスタグランジンアナログ、α1遮断薬などがある。カルシウム拮抗薬は、最も一般的で好ましい第一選択の治療法である(Halawa, 2001; Thompson and Pope, 2005)。しかし、296人の患者を対象とした7つの無作為化試験を分析した最新の包括的なコクランレビューでは、経口カルシウム拮抗薬は一次性RPの治療には比較的効果がないと結論づけられている。この重要なレビューの著者は、発作の頻度と重症度を軽減する上で、これらのブロッカーの役割を支持する証拠はないと結論づけている(Enisら、2016年)。これは、RPの発作の重症度を軽減するためのこれらのブロッカーの有効性を小さいながらも示唆した以前のメタ分析とはやや矛盾している(Thompson and Pope, 2005)。しかし、この論文の著者は、メタ分析に含まれる試験のほとんどが順序効果を決定しないクロスオーバー試験であったため、何らかのバイアスがかかっている可能性があると強調している(Thompson and Pope, 2005)。 cGMP特異的PDE5阻害剤も使用されている(Caglayan et al.) 実際、40人の患者を対象としたオープンラベルのパイロット試験では、PDE V阻害剤であるバルデナフィルの投与を受けたRP患者において、デジタルフローが有意に改善したことが明らかになっている(Caglayan et al.) これと一致して、PDE5阻害剤が血管攣縮性発作を減少させ、デジタル血流を改善することも判明した(Leeら、2014年)。実際、PDE5阻害剤のこの有効性は、29人の患者を2群に分けた二重盲検無作為化クロスオーバー試験で報告されている。一方のグループにはPDE V阻害薬であるウデナフィルを、もう一方のグループにはカルシウム拮抗薬であるアムロジピンを、それぞれ4週間にわたって投与した。両治療法は、血管攣縮性発作の重症度の減少に関して、RP治療において同等の効果を示した(Lee et al.2014)。さらに、PDE V阻害剤を投与された患者は、アムロジピンを投与された患者と比較して、デジタル血流が改善された(Leeら、2014年)。
プロスタノイドは、RP患者の血管攣縮性発作の重症度と頻度を減少させることが報告されている。その有効性は、システマティックレビュー、メタアナリシス、および複数の無作為化臨床試験で一貫して報告されている(Cliffordら、1980年、Mohrlandら、1985年、Wigleyら、1994年、Popeら、2000年、Scorzaら、2001年、Milioら、2006年、Kawaldら、2008年)。例えば、プロスタサイクリン類似物質であるイロプロストは、13人のRP患者の治療に使用された。イロプロストは、潰瘍性病変を減少させるだけでなく、これらの患者の血流を改善させた(Rademakerら、1987年)。さらに、二重盲検プラセボ対照試験では、ブフロメジルは発作の頻度を減少させるが、Raynaud重症度スコアには影響を与えないことが明らかになった(Le Quentrec and Lefebvre, 1991)。一方、コクラン・レビューでは、ベラプロスト、ケタンセリン、ダゾキシベン、モキシシライトについて、発作の頻度や持続時間、重症度の改善効果を裏付ける証拠はないと結論づけている(Stewart and Morling, 2012)。しかし、このレビューの著者は、このレビューに含まれる研究のほとんどが、デザインや実施が不十分であるという事実によって、結論の精度に影響があると指摘している。
RPの治療には、アンジオテンシン受容体拮抗薬、ACE(アンジオテンシン変換酵素)阻害薬、PTK(プロテインチロシンキナーゼ)阻害薬、ETRA(エンドセリン受容体拮抗薬)なども、血管収縮を抑える作用があるために使用される。ある臨床試験では、ロサルタン(50mg)が痙攣エピソードの重症度と頻度を大幅に減少させることが報告されている(Dziadzioら、1999年)。RPの管理にACE阻害剤を使用することの治療上の利点は様々なようである(Henness and Wigley, 2007)。いくつかの研究では、従来の治療法よりも程度は低いものの、わずかな効果があると報告されている(Wood and Ernst, 2006)。実際、RPの治療において、アンジオテンシン受容体拮抗薬をACE阻害薬と置き換えることは推奨されていない(Linnemann and Erbe, 2016)。ここで注意したいのは、エナラプリルやカプトプリルは、一次性RPでは発作の回数を減らすことが報告されているが、二次性RPではこれらの発作を減らすのに有効ではないようである(Tosiら、1987年、Janiniら、1988年)。さらに、210名の患者を対象とした多施設共同無作為化二重盲検プラセボ対照試験では、キナプリルを最長3年間投与しても、発作の重症度や頻度を軽減する有益な効果は認められなかった(Gridon et al.2007)。PTKのリン酸化の増加は、α2C-ARを介した血管収縮と関連している。したがって、PTK阻害剤は、冷却に対する収縮反応を逆転させるために使用されるかもしれない。これらの研究は、PTKのリン酸化が、ctrlの動脈に比べてRP患者の動脈で高いことを示している(Furspan et al., 2004, 2005)。しかし、この興味深いタイプの治療法については、今後の研究が必要である。
強皮症の血管障害に関与していると考えられている初期の事象の一つに内皮の損傷がある。このような損傷は、強力な血管収縮物質であるエンドセリン-1の放出を増加させるため、エンドセリンのシグナル伝達と機能を遮断することは、全身性強皮症(SSc)とそれに関連する二次性RPの治療に有益な役割を果たすと考えられてた。ETRAが採用されたとき、すべての患者が肯定的な反応を示したわけではないが、それにもかかわらず、これらの拮抗薬は少なくとも血管攣縮性発作の重症度と頻度を軽減することができた(Poredos and Poredos, 2016)。いくつかの研究では、SSc関連RPの治療におけるETRAの効果を調べている。2006年には、RPにおけるETRAの潜在的利益を調査した最初の前向き研究が発表された(Selenko-Gebauerら、2006年)。この研究では、ボセンタンを16週間投与したところ、RPの発作の重症度が有意に減少したことが確認された。また、別の観察研究では、ボセンタンを中央値で8週間投与したところ、RPの重症度が低下したと報告されている(Funauchi et al.、2009年)。βブロッカーが治療効果を持つかどうかは、依然として議論の余地がある。102名の患者を対象としたある研究では、β遮断薬であるプロプラノロール、オクスプレノロール、アテノロールが微小循環を阻害し、副作用としてRPを引き起こすと報告されている(Marshall et al.、1976年)。これと一致するように、13件の研究のメタアナリシスでは、βブロッカーの使用がRPの高い発生率と関連していることが示唆されている(Mohokum et al., 2012)。一方で、βブロッカーは、特に血液の粘度を下げる働きがあるため、有益であるとする報告もある(Koltringerら、1991年)。この研究では、被験者40人のうち半数がメトプロロールを投与され、対照群に比べて血液粘度の低下が認められた。興味深いことに、β遮断薬(メトプロロール)とカルシウム拮抗薬(フェロジピン)の併用療法は、RPの症状を軽減するのに非常に有効であることが示された(Csiki et al.、2011年)。
その他にも、RPの管理に使用できる可能性があると思われる薬剤がある。例えば、スタチン系薬剤(Abou-Rayaら、2008年)やセロトニン受容体拮抗薬(Coleiroら、2001年)などである。これらの薬剤の作用機序は完全には解明されていないが、RPの血管損傷を遅らせ、重症度を軽減し、RPに伴う痛みを軽減すると考えられている。
最近の報告では、RPの治療に従来とは異なる方法を用いることで、その効果が期待できるとされている。A型ボツリヌス毒素(BTX-A)を局所的に注射することで、潰瘍のある指を改善し、関連する痛みを軽減することができる(Neumeisterら、2014年)。この改善は、より良い灌流と血管の改善によるものと考えられるが、正確なメカニズムはまだ分かっていない。注目すべきは、BTX-Aの使用が安全で効率的である可能性を示す研究である(Neumeisterら、2014年)。最近のレトロスペクティブな研究では、BTX-Aの局所注入により、動脈流速、表面温度、潰瘍、およびその他の臨床症状が大きく改善することが示された(ビジュアルアナログスケールで測定;Zhangら、2015年)。その他にも、RPの管理におけるBTX-Aの同様の有益な効果が報告されている(Smithら、2012年、Zhao and Lian、2015年)。しかし、これらの興味深い有望な結果にもかかわらず、最近のシステミックレビューでは、RPの管理におけるBTX-Aの有効性を支持する証拠はまだ不十分であると結論づけている。このように、この興味深いアプローチの潜在的な有効性をよりよく判断するためには、さらなる研究、特にランダム化比較試験が必要である。
なお、前述の薬理学的製剤は、患者によっては頭痛やめまいなどの副作用を引き起こすことがある。このような副作用を避けるために、多くの患者が代替療法に頼っている。漢方薬による治療もその一つである。特にRPの管理においては、Ginkgo biloba植物抽出物(Muirら、2002年)や、Duhuo-Tisheng TangとDanggui-Sini Tangという2つの漢方薬の組み合わせ(Wuら、2008年)が注目されている。しかし、この治療を受けているRP患者のデジタル血管反応は、上記の漢方薬の組み合わせを摂取している患者では変化しなかったという矛盾した報告がある(Appiah他、1997年、Hirschl他、2004年、Wu他、2008年)。鍼灸治療もRPの管理に用いられている。実際、無作為化比較前向き研究では、中国の伝統的な鍼治療は、一次性RPの症状、特に発作の頻度を軽減するのに有効であると結論づけられている(Appiah et al., 1997)。また、耳介電気鍼がRPの発作の重症度と頻度の軽減に役立つという報告もある(Schlager et al., 2011)。しかし、メタアナリシスやシステマティックレビューでは、RPの管理における鍼治療の使用を決定的には支持していない(Malenfant et al., 2009; Huisstede et al., 2011)。
また、レーザー治療も注目されている。48人の患者を対象とした無作為化プラセボ対照二重盲検クロスオーバー試験では、低レベルレーザー治療がRPの発作の頻度と重症度を減少させることが示された(Hirschl et al.) この研究結果は、同年に発表された別の二重盲検試験の結果と一致している(al-Awami et al., 2004)。また、高出力レーザー治療は、強皮症とRPを患っている患者の発作の頻度と重症度を減少させることが報告されている(St Surin-Lord and Obagi, 2011)。
治療法の選択肢として、外科的治療が検討されることもあることに留意する必要がある(Landry, 2013)。これらの治療法には、胸部交感神経切除術、ハンドストリッピング、神経刺激などがある(Kaada, 1982; Balogh et al.2002; Coveliers et al.) 侵襲的ではあるが、これらは痛みの軽減と潰瘍の治癒に成功していると考えられる(Landry, 2013)。最後に、患者の手に脂肪を移植する方法は、RP患者に対する新しい、かなり型破りな手術療法である(Bankら、2014年)。この新しい治療法は、火傷や放射線皮膚炎を起こした手に脂肪を移植したところ、臨床的な改善が見られたことに由来する(Rigottiら、2007年)。その後、RP患者のグループで「テスト」されたところ、痛みの緩和、潰瘍の減少、冷え性の減少など、有望な結果が得られた(Bankら、2014年)。脂肪移植がこれらの効果をもたらしたメカニズムはほとんど明らかになっていないが、新血管形成と幹細胞が関与する経路が関係している可能性が高いという仮説が立てられている(Bank et al.)
治療法の多様性とその効果の変化により、この疾患の根底にある分子メカニズムをよりよく理解するとともに、より標的化された効率的な薬剤を開発するための緊急かつ協調的な取り組みが求められている。このような薬剤には、α2-ARのブロッカー、PTKやRhoキナーゼの阻害剤などが考えられる(Lambova and Muller-Ladner, 2009)。実際、α2-ARを阻害することでRPの発作を改善するという概念が最初に証明されたのは、Freedmanらの研究(1995年)であった。この論文では、α2-ARアンタゴニストであるヨヒンビンが、α1-ARアンタゴニストであるプラゾシンではなく、RPの血管攣縮性発作を有意に減少させることが示された。より具体的には、二次性RP患者の寒冷誘発血管痙攣からの回復における、α2C-ARサブタイプに優先的に結合する選択的α-ARアンタゴニストであるOPC-28326の有効性を、二重盲検、プラセボ対照、無作為化クロスオーバー試験で検討した。この研究では、OPC-28326が強皮症の二次性RP患者の急性寒冷チャレンジ後のデジタル血流を改善できることが示された(Wise et al., 2004)。また、別の第II相無作為化二重盲検クロスオーバー単回投与プラセボ対照試験では、強力なα2C-ARアンタゴニストであるORM-12741の有効性が検証された。興味深いことに、この研究の結果は予想外のもので、ORM-12741は、寒冷チャレンジ後の再加温の遅れによって明らかになる、寒さによる指動脈の収縮の持続時間を短縮するのではなく、延長した(Herrickら、2014年)。この予想外の結果の理由はまだ不明であり、α2C-ARの興味深い生物学、特にRPの病態生理に関連する生物学をよりよく理解するためには、さらなる研究が必要である。
まとめと今後の展望
研究と生物医学の飛躍的な進歩にもかかわらず、RPの決定的かつ治癒的な治療法はいまだに現実的でとらえどころのない課題となっている。この病気の多くの側面や要因が解明されているが、RPの発症や進行の基礎となる分子メカニズムについては、さらなる研究が必要である。これは少なからず、この病気が多因子性の病因(ホルモン、神経、内皮)であることに起因している。もう一つの課題は、この病気の適切な動物モデルが存在しないことである。また、α2C-ARが嗅球や大脳皮質などの多くの脳領域で発現していることも、RPに特異的な薬剤の探索をさらに複雑にしている。また、α2C-ARは、心臓のシナプス前の制御にも関与しているため、特に困難である。そのため、α2C-ARを標的にしてRPを治療することは、心臓や脳にも影響を及ぼすため、最適とはいえない。しかし、α2C-ARsの阻害剤を含む局所クリームを患部に塗布することで、副作用が少なく、効果が期待できるのではないかと推測される。しかし、この提案を裏付けるためには、厳密な基礎研究と臨床試験が必要である。今のところ、寒さによるRPの血管攣縮性発作を抑えるには、予防が有効であることが多い。
著者の貢献度
すべての著者が執筆に貢献した。AHEは構想、設計、原稿の修正を行った。
利害の衝突に関する声明
本研究は,利益相反の可能性がある商業的・金銭的関係がない状態で実施されたことを表明する。
