Contents
New Insights in Anorexia Nervosa
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC4925664/
公開オンライン2016 Jun 29
Philip Gorwood,1,2,3,* Corinne Blanchet-Collet,4 Nicolas Chartrel,5,6,7 Jeanne Duclos,8,9,10 Pierre Dechelotte,11,12 Mouna Hanachi,13,14 Serguei Fetissov, 11 Nathalie Godart,8,9 Jean-Claude Melchior,13,14 Nicolas Ramoz,2,3 Carole Rovere-Jovene,15 Virginie Tolle,2,3 Odile Viltart,16 and Jacques Epelbaum2,3, GIR-AFDAS-TCA Group
概要
神経性食欲不振症(AN)は、古典的には、体重が異常に少なく、太ることへの強い恐怖、体重や体型に関する歪んだ認知、および痩せたいという欲求を伴う状態と定義されている。本論文では、生理、遺伝、エピジェネティクス、脳イメージングなどの最新の研究成果を紹介し、ANを報酬経路の異常、あるいは精神的な恒常性を維持するための試みと考えることができる。特に、グレリノ抵抗性、視床下部外側のオレキシジェニックペプチド、腸内細菌叢、神経ペプチドシグナル伝達の免疫異常の重要性が強調されている。摂食障害の基礎となる二次的な生理学的プロセスと、病前の脆弱性因子である「ポンデロ栄養基盤」についても議論する。
キーワード:摂食障害、報酬系適応、マイクロバイオータ、自己抗体、感受性因子、精神的ホメオスタシス
はじめに
神経性食欲不振症(AN)は、体重が異常に少なく、太ることへの強い恐怖と、体重や体型に関する歪んだ認知、および痩せたいという欲求を伴う摂食障害である(米国精神医学会 2013)。この疾患は、女性の12カ月間の有病率が0.4%で、すべての精神疾患の中で最も死亡率が高く(Harris and Barraclough, 1998)例外的に再発率が高いことが特徴である(Zipfel er al)。
神経性食欲不振症に関する研究は、歴史的に、下垂体(Gull, 1888)最低12kgの自発的減量に関連する精神医学的側面(Bliss and Branch, 1960)またはエストラジオール、プロゲステロン、LHRHなどのホルモン(Boyar et al 1974)に焦点を当ててきたが、ANの病因はいまだ不明であり、一方、その発症、進行、転帰は、生物学的、社会文化的、心理学的要因に明らかに影響されると考えられている。生物学的レベルでは、例えば、AgRP、NPY、グレリンの増加は、痩せることの報酬面を促進すると考えられており、一方、BDNF、オキシトシン、TRH、VP、レプチン、PYYの減少は、ANで観察される満腹感フィードバックの異常に関係していると考えられている(Tortorella et al 2014)。
しかし、脳イメージング技術(特に機能的MRI)GWASやエピジェネティックなアプローチ、動物モデル、神経ペプチド(26RFaなど)の発見、腸内細菌叢の役割に関する知識の増加などの進歩により、小児期(あるいはそれ以前)の心理的な危険因子に関する知識の向上や、ANの高い精神科併存率から得られる新たな知見も考慮した、より包括的なANのモデルを提案することが可能になってきている。本総説では、これらの異なるアプローチに基づいて、身体(神経免疫内分泌アプローチ)脳(イメージング)心(心理学的および臨床的アプローチ)のレベルでのホメオスタシスの乱れの概念に基づいた、ANの暫定的な全体像を提案するために、7つの短い寄稿を掲載している。
モデル1:神経性食欲不振症は報酬経路の異常:生理学、遺伝学、エピジェネティクス、脳画像からの証拠
神経性食欲不振症(AN)は、食物報酬経路の異常によって引き起こされる飢餓依存症であるという仮説が、30年前から生理学的に裏付けられている。また、分子遺伝学や脳イメージングなどの新しい手法により、この病態生理学的仮説を裏付ける証拠が増えてきた。
数多くのオピオイド神経ペプチドが同定され、食欲や生殖などの重要な機能の調節に関与していることが明らかになった。これらの神経ペプチドには報酬特性が付与されており、外因性オピエートと同様に高い中毒性があるようである(Le Merrer er al)。 そのため、摂食障害における中毒理論は、食欲不振(飢餓や暴飲暴食)と激しい身体活動の両方が、AN患者の80%においてエンドルフィン活動を刺激するという事実によって裏付けられている(Kaye er al)1989)。1982年、Kayeらは、脳脊髄液からのオピオイド活性が、対照群に比べて低体重のAN患者で有意に高いことを報告した。一方、体重が回復したAN患者や回復した症例では、コントロールに比べてこの活性が低下する(Kaye et al 1982)。さらに、コデインとモルヒネの血漿レベルは、コントロール群と比較してAN患者で有意に上昇したと報告されている(Marrazzi et al 1997)。これらの内因性オピオイドは、最初のダイエット中に放出される可能性があり、オピオイドのフィードバック制御により、一部のリスクのある被験者では、関連する飢餓プロセスが強化される。実際、末梢のエンドルフィンは、栄養や水分を節約し、エネルギーを消費する活動を減少させることで、飢餓状態での生存を促進する可能性がある(Margules, 1979)。
単純な金銭報酬タスクを分析した脳機能イメージング研究によると、健康な女性はポジティブなフィードバックとネガティブなフィードバックで線条体の活動が異なるが、回復したAN患者はそうではなかった(Wagner er al)。 この研究は、ANの報酬プロセスが変化しているという仮説を支持するものであった。別の脳機能イメージング研究では、回復したAN患者では、報酬性および嫌悪性の食物刺激に対するサリエンスの帰属が増加していることが示された(Cowdrey er al)。 また、脳構造イメージングでは、AN患者はもちろん、回復した患者でも報酬回路に関与する脳領域の変化が明らかになっている(Frank er al)。 最近の研究では、AN患者は対照群とは異なり、遅延型報酬(小さくてすぐの報酬ではなく、大きくて遅い報酬)を好むことが示されており、そのような報酬に対して腹側線条体の活動が増加する唯一の患者であった(Decker er al 2015)。最後に、低体重、普通体重、過体重の典型的な全身の特徴を持つ女性の体を描いた視覚刺激の評価に基づいた2つの機能的脳画像研究では、(自己言及的な方法で)「感じる」課題と、対照課題としての「体重」課題で脳活動を評価した(Fladung et al 2010,2013)。その結果、「重さ」の課題では、AN患者と対照者の間に差がなかったと報告されている。一方、「感触」課題では、成人および青年のAN患者が健常者と比較して反対のスコアが観察された。最も興味深いのは、腹側線条体の機能的な活動が、AN患者では低体重の特徴で(対照群と比較して)有意に高く、成人の正常な体の特徴では劇的に低下していたことである(Fladung et al 2010)。同様の傾向は、青年期の分析でも観察された(Fladung et al 2013)。これらの研究は、ANにおける報酬回路の変化の存在を改めて支持するものであり、おそらく飢餓による強化効果が原因で、低体重時の快感が増大し、正常体重時の肯定的な感覚が減少していると考えられる。報酬過程の異常を説明するもう一つの候補は、AN患者の80%に観察される過剰な運動である(Davis et al 1997)。これまでに行われたANに関する最大規模のGWASでは、2つのSNPがANとわずかに関連しており(p = 5 × 10-6)そのうちの1つ(rS17030795)は、カルシニューリン遺伝子であるPPP3CAに位置しており、ヒトの持久運動能力や耐性の違いに関与している可能性がある(He er al 2010b)。さらに、ネズミの研究では、レプチンがドーパミントーンを介してランニングの動機付け効果に影響を与えてたが(Fernandes et al 2015年)レプチンは直接的な遺伝的制御よりも、DNAメチル化に依存している(すなわち、エピジェネティックな制御下にある)(Tremolizzo et al 2014)。
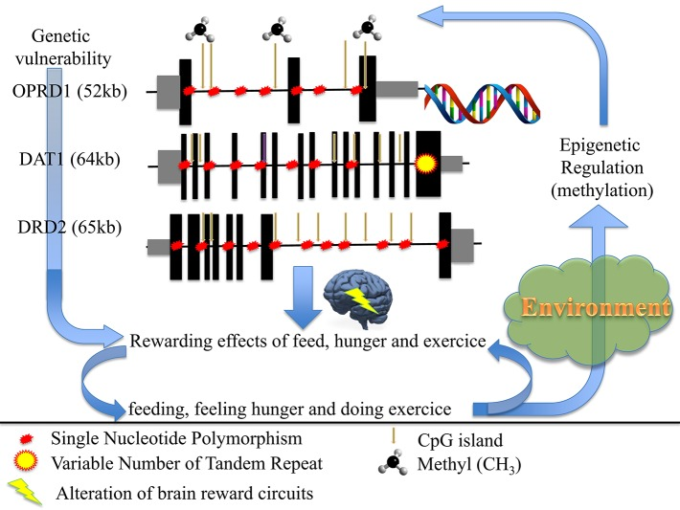
興味深いことに、37家族のANを対象とした最初のゲノムワイド連鎖研究では、1Dセロトニン受容体をコードするHTR1D遺伝子とオピオイドデルタ受容体をコードするOPRD1遺伝子を含む1p33-36番染色体に有意なピークが確認された。さらに、AN患者191人と対照群98人を対象とした候補遺伝子研究では、HTR1DおよびOPRD1遺伝子の個々の変異およびハプロタイプがANと関連していた(Bergen et al 2003)。神経性食欲不振症におけるOPRD1遺伝子の役割は、226人のAN患者と678人の対照群を比較した独立した研究でも再現されている(Brown er al 2007)。最後に、1033人のAN患者と3733人の対照者を対象に行われたゲノムワイド関連解析では、OPRD1遺伝子の共通変異が実際にANと関連していることが確認された(Wang et al 2011)が、より多くのサンプルを対象に行われた最近のGWASでは確認されなかった(Boraska et al 2014)。
側坐核(NA)におけるオピオイドのレベルは、ドーパミンの放出を決定的に制御している。回復したAN患者10名と対照者12名を対象に行われたポジトロン・エミッション・トモグラフィーでは、NAを含む前腹側線条体において、ドーパミンD2/D3受容体の結合が増加していることが報告されている(Frank et al 2005)。この違いは、NAにおけるD2/D3受容体の密度や親和性の増加、あるいはANにおけるドーパミン濃度の低下のいずれかによるものと考えられる。したがって、AN患者が食事量を減らすのは、ドーパミンの機能異常、すなわち報酬脳回路の異常によって、期待される快楽的な信号ではなく、不安的な信号が伝達されているためである可能性がある。DRD2遺伝子の遺伝的変異には、転写レベルを変化させることが明らかになっている-141C Ins/Delを含むものがあり、ANとの関連が認められた(Bergen er al)。 さらに、DAT1およびDRD2遺伝子のプロモーターがメチル化されている割合が、AN患者では対照群に比べて有意に高く、このようなメチル化は、DAT1遺伝子の発現増加およびDRD2遺伝子の発現減少と関連していた(Frieling et al 2010)。このように、ドーパミン報酬回路の遺伝的およびエピジェネティックな異常は、ANの病態生理における役割を強化する可能性がある。さらに、空腹ホルモンであるグレリンの受容体は、視床下部の神経細胞でDRD2とヘテロ二量体を形成することができ、拒食行動を促進する可能性がある(Kern er al)。
結論として(図1)神経性食欲不振症は、(1)腹側線条体に存在する報酬回路、(2)視床下部に存在する食物調節機構に関与するドーパミン遺伝子が、入力(摂食・空腹)と出力(過度の運動)のバランスを、遺伝的および/またはエピジェネティックなレベルで調節することにより、これらのプロセスを変化させ、飢餓依存症をもたらすことを提案する。
図1 遺伝的およびエピジェネティックな要因が、拒食行動のリスクや維持にどのように影響するか
(体重が少ない状態でさらに痩せようとする)
モデル2:神経性食欲不振症はグレリン特異的な抵抗性?
神経性食欲不振症の患者は、エネルギー代謝や摂食行動の調節に関与するホルモンの分泌に変化が見られる(Germain et al 2007,Hasan and Hasan 2011)。特に、主に胃から分泌される食欲増進ホルモンであるグレリンの血漿レベルが上昇する(Cummings et al 2001)(Germain et al 2009,2010)。このようなグレリンの増加は、これらの患者が食事を制限していることを考えると逆説的に思えるが、栄養不足によるフィードバックメカニズムによって適応されているのかもしれない。いくつかのグループは、グレリン抵抗性という概念を提唱している。これは、グレリンの増加がAN患者の食欲を誘発することができず、食事制限行動によって維持される代謝の悪循環を反映したものである。このような観点から、グレリンシステムは摂食障害の貴重な治療標的として考えられるべきである。
グレリンは、摂食行動に関与するさまざまなペプチドをコードする独自のプロホルモンに由来する
栄養、快楽、感情のシグナルに敏感な末梢因子の中でも、プレプログレリンは、構造的にも機能的にも異質な複数のペプチドをコードするユニークなプロホルモンである(Hassouna er al)。 グレリンは、胃から合成され(Kojima et al 1999; Tomasetto et al 2000)、当初は成長ホルモン(GH)分泌促進受容体(GHS-R1a)の内因性リガンドとして同定された。グレリンは、GH分泌促進剤としての主要な作用(Tolle et al 2001)に加えて、ドーパミン系報酬系の調節など、末梢および中枢の両方で多面的な作用を発揮する(図(2),2)(レビューはMéquinion et al 2013を参照)。グレリンの他の天然型としては、血漿中に最も多く存在し、グレリン全体の80~90%を占める脱脂グレリン(DAG)(Kojima and Kangawa, 2005)や、げっ歯類における食欲減退作用が最初に報告された生理活性ペプチドであるオベスタチン(Zhang et al, 2005)がある。
図2 嗅覚刺激ホルモンであるグレリンの主な生理作用
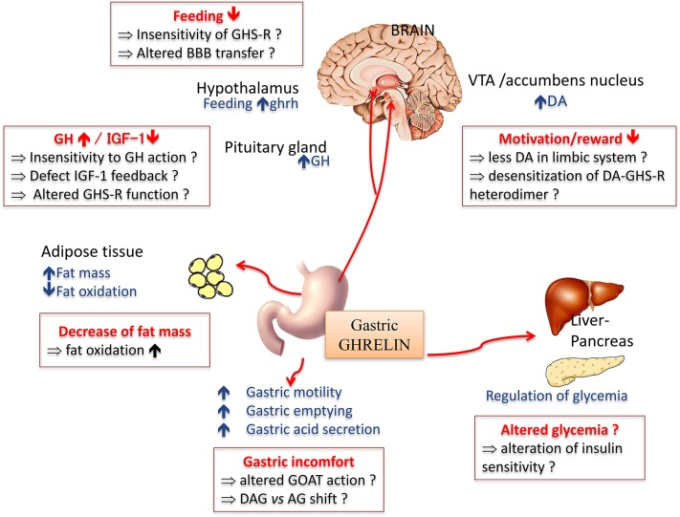
神経性食欲不振症では、古典的に記述されている症状のいくつかは、グレリンの作用に対する抵抗性または不感症によるものかもしれない(赤い四角で囲んだ部分)。AG(アシルグレリン)BBB(血液脳関門)DA(ドーパミン)OAG(デアシルグレリン)GH(成長ホルモン)GHS-R(グレリン受容体)GOAT(グレリンO-アシルトランスフェラーゼ)IGF-1(インスリン成長因子1)VTA(腹側被蓋野)。
グレリノ抵抗性の臨床的証拠
純粋な制限型のAN(AN-R)では、血漿中のアシルグレリン(AG)濃度が上昇する(Germain et al 2009,2010)。AN患者におけるグレリンの薬理作用に関する研究は、まだ決定的ではない。実際、グレリンを5時間かけて静脈内投与したところ、食物摂取量に明確な変化は見られなかったが、眠気が増加した(Miljic et al 2006)。AN患者9名のうち6名がグレリン1mg/kgのボーラス静注により空腹感を示したが(Broglio et al 2004年)健常者(7名中5名が反応)と同様であった。また、別の研究では、グレリン(3 mg/kg)を1日2回投与することにより、5人のAN患者において、消化器症状が減少し、空腹感が増加し、1日のエネルギー摂取量が12~36%増加することが示された(Hotta er al)。 これらのパイロット試験では、適切な対照群の欠如、治療を受けた患者数の少なさ、患者の真の摂食意欲を適切に評価することの難しさ、グレリンおよび/またはアゴニストの投与経路と頻度などの理由により、グレリンの真の効果を評価することは困難である(Ueno er al)。
グレリーノ抵抗性があるとすれば、それはどこで、どのようにして起こるのか?
AN-R患者がグレリンレベルの上昇に反応できないのは、視床下部の中枢標的に輸送される能力の低下(Shaffer er al 2013年)GHS-Rの感度または機能の低下、グレリン作用の直接的または間接的な標的である視床下部のNPY/AgRPおよびPOMCニューロンの調節障害(Denis et al, 2014);報酬/運動行動に関与する構造である腹側被蓋領域(VTA)(Abizaid et al 2006)と視床下部でそれぞれ食欲を調節するドーパミン作動性ニューロンに対するグレリンシグナルの変化(Jiang et al 2006;Kern et al 2012;Sharpe et al 2016)。
グレリーノ抵抗性:他のグレリン由来のペプチドによる拮抗作用?
AN-Rにおけるグレリーノ抵抗性の仮説には、動物モデルやAN患者において、(1)内因性グレリンが食欲を刺激するのに重要であること、(2)他のグレリン由来のペプチドがAG作用の調節因子である可能性があることを示すさらなる証拠が必要である。
グレリンを完全に欠いたマウスやAGを選択的に欠いたマウスでは、食物摂取量は減少しない(Sun et al 2003,2004,Zigman et al 2005,Pfluger et al 2008,Zhao et al 2010)。これでは、AGが恒常的な摂食に重要な役割を果たしているとは言えないようである。
しかし、自由選択食品パラダイムにおける報酬食品の摂取抑制、手掛かりによる摂食促進の欠如、オペラント反応モデルにおける摂食動機の抑制は、むしろ快楽的摂食における内因性ペプチドの役割を支持していると考えられる(Uchida er al)。
DAGは、中枢または末梢への注射で示されたように、AGの作用を打ち消して食欲を調節する重要な因子である可能性がある(Asakawa er al 2005; Inhoff er al 2008)。興味深いことに、DAGを過剰に発現させたトランスジェニックマウスは、非トランスジェニックマウスと比較して、体重が有意に減少し、摂食量と体脂肪量が減少し、直線的な成長が緩やかになる(Asakawa er al)。 さらに、DAGは、GHS-R経路とは独立して、グルコースのホメオスタシスや脂肪代謝の調節など、いくつかの生物学的作用を発揮する(Delhanty er al)。 オベスタチンは、当初、オーファン受容体であるGPR39に作用することにより、グレリンの作用に対抗して食欲を減退させ、体重を増加させることが報告されたが(Zhang et al 2005年)GPR39を介したこのペプチドの食欲減退作用については、急速に議論が高まっている(Lauwers et al 2006,Chartrel et al 2007,Holst et al 2007,Zizzari et al 2007,Hassouna et al 2010,2012)。AN-R患者では、オベスタチンおよびグレリン/オベスタチン比が減少していることが確認されたが、体質的にやせている女性ではこの比は変化していなかった(Germain et al 2009,2010)。このような変化は、これらの患者に見られる高グレリン血症にもかかわらず摂食制限を行うことに関与している可能性がある。
摂食抵抗性を説明するその他の可能なメカニズム
グレリンは、特に中脳-皮質-辺縁系を含む非恒常性システムにも影響を与える可能性がある。Skibicka et al 2013)は、VTAにグレリンを注射した後に観察された食物意欲/報酬行動の有意な増加が、VTAドーパミンニューロンの主な標的である側坐核に注射したD1様またはD2受容体拮抗薬による前処理によって消失することを示した。この脳構造は、前頭前野の抑制性回路からのメッセージの統合にも関与している。実際、前頭前野は、fMRI研究で観察されたように、AN患者が食べ物のイメージを提示すると強く活性化され(Zhu et al 2012年)セロトニン/ドーパミンのシグナル伝達の変化もこれらの患者で説明されている(Bailer et al 2007,2013)。AN患者では、グレリンが報酬系に与える影響が変化することで、食物に関連した情動プロセスに関する情報の統合が変化する可能性がある。データが少なく、一貫した臨床情報が得られないため、動物モデルを用いて、脳システムのさまざまなレベルにおけるグレリンの作用メカニズムをより詳細に解析することが不可欠であると考えられる。
クリニックからベンチへ:動物モデルから何がわかるのか?
ANの完全な動物モデルは、この疾患の神経精神医学的な側面のために存在しない(Méquinion er al 2015b)。そのような理想的なANのモデルとしては、青年期の発症、女性の優位性、高い活動性、慢性的なストレス、食物摂取量の減少、体重の減少などが挙げられる。さらに、ANは慢性疾患であり、これまでに記載されたマウスモデルのほとんどは、短期間(数日)でプロトコルを維持している。
しかし、自発的な運動に伴う摂食制限や慢性的なストレスのように、マウスモデルで再現できる部分もある。van Leeuwenら(1997)がマウスで初めて開発した、食物へのアクセスを制限した分離モデル(分離に基づく拒食症、SBA)は、慢性的なストレスを誘発し、過活動を伴わないエネルギー消費量の増加をもたらす。最近のデータでは、このプロトコルを長期的に維持すると、レプチンシグナルの調節障害に伴う骨密度の低下(骨粗鬆症)など、ANのような変化が誘発されることが明らかになった(Zgheib et al 2014)。食物制限に伴う活動性亢進モデル(活動性食欲不振、ABA)は、ラットで最初に開発され(Hall et al 1953年、RouttenbergとKuznesof、1967年)その後マウスに適応された(Gelegen et al 2007)が、この疾患の重要な特徴を模倣しているため、ANの優れた動物モデルと考えられている(RouttenbergとKuznesof、1967年、de Rijke et al 2005)。また、ABAモデルでは、AN-R患者にも見られる行動である食物の予期行動にグレリン/GHS-R経路が関与していることが強調されている(Blum et al 2009,Scheurink et al 2010,Verhagen et al 2011)。食物を量的に制限(10週間で50%)した修正長期ABAモデルでは、AN患者で古典的に観察される症状(体重減少、内分泌系の変化、排卵周期の減少…)に加えて、視床下部レベルでのグレリンメッセージの統合の変化が観察された(Méquinion et al 2015a)。
結論 神経性食欲不振症はグレリーノ抵抗性なのか、それとも栄養失調に対する適応的な代謝反応なのか?
ヒトの病理では、グレリン抵抗性(または感受性の低下)は、患者の空腹感と満腹感のバランスや、食べ物の報酬面に対するモチベーションに限定されるのかという疑問が残る。実際、このような高グレリン血症は、疾患に対する適応的な神経内分泌代謝反応としても機能する可能性がある。というのも、マウスの激しいカロリー制限中に血糖値のホメオスタシスを維持するためにはグレリンが必要であると考えられるからである(Zhao er al)。 したがって、ANの制限型では、生存を維持するためにグレリンの合成量の増加が必要であると考えられる。
しかし、食欲不振のサブタイプによってグレリンの調節が異なることがわかっている。血漿中のグレリン濃度は、暴飲暴食をする食欲不振患者では変化しないことから、両サブタイプでは飢餓に対する適応過程が異なること、あるいは空腹感の認識や食事の動機が異なることが示唆される。これらの基本的な観察結果からヒトの病態を推定するには、慎重に解釈する必要があり、実験モデルのさらなる調査と検証が必要である。動物モデルは、本疾患のいくつかの側面において弱点があるにもかかわらず、活動や慢性的なストレスを伴うか否かにかかわらず、慢性的で急激な食物制限による長期的な末梢および/または中枢の変化を評価することができる。不安や多動性の行動は、この病気の発症と進行に重要な役割を果たしている。動物モデルとしてマウスを用いることの大きな利点の一つは、食欲不振の遺伝的あるいは環境的要素の一部を評価するために、よく記述された多くの近親交配系統が利用可能であることである。これらの動物モデルは、グレリンシグナルの統合障害に関わるメカニズムを正確に解明するのに有用である。
モデル3:神経性食欲不振症(AN)は、視床下部外側領域のオレキシジェニック神経ペプチドによる報酬系の慢性的な刺激である
視床下部は、行動や感情の反応に極めて重要な役割を果たしており、摂食行動を調節する主要な中枢が含まれている。すべての患者は、エネルギー需要とコストに応じて摂食行動を適応させることができないことから、視床下部で食欲を制御するオレキシジェニックおよび/またはアノレキシジェニック神経ペプチドの機能障害の可能性がある。さらに、最近の研究では、ANは飢餓や自浄作用に対する報酬が異常に高い病態ではないかと考えられている。例えば、食欲不振から回復した患者は、報酬を司る脳回路において、快食刺激と不快食刺激の両方に対する神経反応が増大している(Cowdrey et al 2011)。ドーパミンは報酬系の神経伝達物質であり、ANではドーパミン-線条体系の機能障害が生じていることを示唆する証拠がいくつかある。このことが、食欲不振患者の食物摂取に伴う快感の欠如や全般的な無気力を説明する可能性がある(Kaye er al)。 この考えを裏付けるように、アンフェタミンによるドーパミン放出は、食欲不振から回復した人の不安感を増大させる(Bailer er al)。 興味深いことに、オレキシン、メラニン集中ホルモン(MCH)26RFaを発現するオレキシンニューロンを含む視床下部外側野(LHA)は、脳の報酬回路に投射を送っており(Aston-Jones et al 2010年)オレキシンニューロンの機能障害がANのドーパミン報酬系を変化させる可能性が示唆されている。
ここでは、ANのLHAのニューロンが産生する3つのオレキシン性神経ペプチド、すなわちオレキシン、MCH、26RFaに関する現在の知見を簡単に紹介する(図(3)3)。
図3 神経性食欲不振症の報酬回路に対するオレキシジェニック神経ペプチドの仮説的な慢性的刺激の模式図
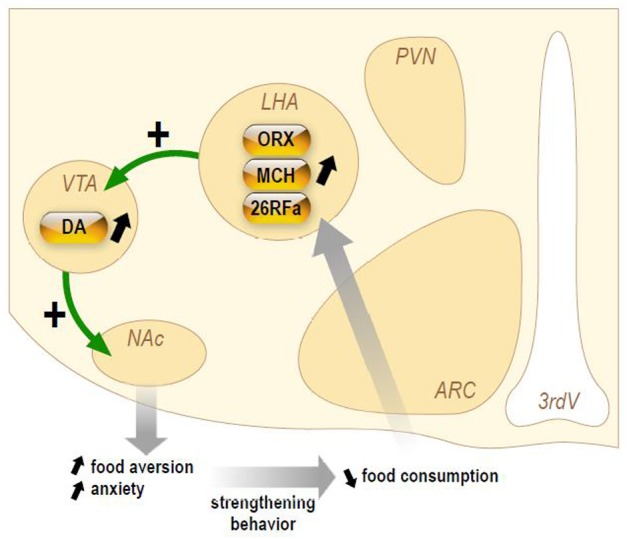
食物摂取量が減少すると、視床下部外側領域(LHA)のニューロン活動が刺激され、オレキシン(ORX)メラニン集中性ホルモン(MCH)26RFainが腹側被蓋領域(VTA)に放出されると考えられる。その結果、側坐核(NAc)におけるドーパミン(DA)の放出量が増加する。拒食症患者では、報酬系が刺激されることにより、食物嫌悪とそれに伴う不安感が高まり、食物摂取量の減少が助長されることになる。
オレキシン
オレキシンは、LHAにのみ存在する80,000個以下のニューロンによって産生される(Sakurai et al 1998)。オレキシンA(OxA)とオレキシンB(OxB)は46%の同一性を持つ2つの神経ペプチドで、同じ前駆体上にタンデムに存在している(Sakurai et al 1998)。オレキシンは、OxR1およびOxR2と呼ばれる2つのGタンパク質共役型受容体の内因性リガンドである(Sakurai et al 1998)。OxAまたはOxBを中枢投与すると、食物の消費が促進される(Sakurai et al 1998)。Prepro-orexin mRNAは空腹時に増加し、逆にob/obおよびdb/db肥満マウスでは減少する(Sakurai et al 1998; Yamamoto et al 1999)一方、orexin欠損マウスは強い摂食低下を示す(Hara et al 2001)。さらに、OxR1アンタゴニストであるSB-334867を全身に投与すると、行動上の満腹感を選択的に高めることで摂食量が減少する(Ishii er al)。
2つの異なる研究では、AN患者の血漿中OxAレベルの変化を、2ヶ月、3ヶ月、または6ヶ月のリアリズム期間中に評価している(Bronsky et al 2011; Janas-Kozik et al 2011)。最初の研究(Bronsky et al 2011)では、未治療のAN患者における空腹時血漿OxA濃度の有意な上昇が報告されているが、2番目の研究では、再摂食前のAN患者における循環OxAの減少が報告されており、得られたデータは矛盾している(Janas-Kozik et al 2011)。
しかし、この2つの研究では、再摂食中に循環OxAが徐々に減少することが観察されており、むしろANではオレキシン系がアップレギュレーションされていることが示唆されている。
蓄積されたデータは、オレキシンが報酬に基づく摂食に関与していることを示している。実際、LHAにおけるオレキシンニューロンの活性化は、薬物や食物の報酬に関連する手がかりに対する嗜好性と強く関連している(Harris et al 2005)。これと一致するように、ドーパミンニューロンを含むVTAにオレキシンを注入すると、側坐核(NAc)でのドーパミン放出が増加し、楽しみと強化を与えて繰り返し活動する動機となり、報酬のある高脂肪食の摂取を刺激する(Zheng et al 2007)。逆に、VTAのOXR1アンタゴニズムは、ラットの高脂肪食摂取を抑制する(Cason er al)。 さらに、オレキシンを中枢に投与すると、甘いものの自己投与が増加するが、この効果はOXR1アンタゴニストによって阻害されることから、オレキシンは少なくともいくつかの種類の食物の強化特性を促進することが示唆されている(Cason et al 2010)。
MCH
MCHは、LHAに主に発現している環状ペプチドである。MCHの遺伝子発現は、空腹時や低レプチン血症のob/obマウスで変化する(Qu et al 1996)。ヒトには2つのGタンパク質共役型(GPCR)MCH受容体(MCH-R1およびMCH-R2)が存在するが、げっ歯類ではMCH-R1のみが機能しているようである(Forray, 2003)。MCH遺伝子を過剰に発現させたマウス(Shimada et al 1998)やMCH-R1遺伝子を欠損させたマウス(Marsh et al 2002)が作製され、食欲やエネルギーバランスの制御に顕著な変化を示した。現在のところ、MCHシステムがANで研究されたことはない。
しかし、興味深いことに、MCHのオレキシジェニック効果は、報酬系のNAcでの作用に大きく依存していることがわかっている。実際、NAcにMCHおよびMCHアンタゴニストを注射すると、それぞれ拒食症および拒食症になる(Georgescu et al 2005)。NAcにMCHを注入すると、有棘細胞の発火が減少し、甘いものの価値が高まる(Lopez et al 2011)。このことは、MCHシグナル伝達経路が摂食・報酬制御において複雑かつ重要な役割を果たしていることを示唆しており、AN発症のメカニズムに関する重要な情報を提供する可能性がある。
26RFa
26RFaは、ヒトを含む様々な脊椎動物に存在する26残基のRFアミドペプチドである(Chartrel er al)。 26RFaは、ヒトのオーファンGタンパク質共役型受容体であるGPR103のコグネートリガンドとして同定されている(Takayasu er al)。 神経解剖学的観察により、26RFaおよびGPR103を発現する神経細胞は、主に摂食行動の制御に関与する視床下部の核に局在することが明らかになった(Chartrel er al)。 26RFaを含むニューロンは、LHAと視床下部腹内側核にのみ存在している(Chartrel er al 2003)。26RFaを中枢投与すると、げっ歯類では摂食量が増加し、肥満の原因となる(Chartrel et al 2003,Moriya et al 2006,Takayasu et al 2006)。また、26RFaのmRNAは、肥満のob/obマウスおよびdb/dbマウスの視床下部で発現が増加しており(Takayasu et al 2006)、エネルギーバランスが崩れた状態で26RFa遺伝子の発現が調節されていることを示している。
AN患者を対象に、血漿中の26RFaのサーカディアンプロファイルを調べた。その結果、制限型AN患者では、健常者と比較して一日中26RFaレベルが有意に上昇することが示された(Galusca et al 2012)。
脳内のGPR103 mRNAの詳細なマッピングにより、26RFa受容体がVTA、扁桃体、NAcに発現していることが明らかになり(Bruzzone et al 2007)、オレキシンやMCHと同じように、26RFaが報酬に基づく食物摂取に関与している可能性が示唆された。
結論
ANでは、グレリン、オレキシン、26RFaなどの再帰性神経ペプチドが発現しており、この再帰性プロファイルは、食物摂取を促進し、栄養不足を解消するための生体の適応メカニズムを反映していると考えられる。
しかし、この適応メカニズムは、食物摂取量を増加させる効果がないため、AN患者はオレキシジェニックなシグナルに対して全体的に耐性があると考えられている。ここで、我々は別の仮説を提示する。我々は、オレキシン、MCH、26RFaを発現するLHAオレキシジェニックニューロンの活動が慢性的に増加することで、AN患者の報酬系におけるドーパミン誘発性の不安が強化され、その結果、食物摂取に対する嫌悪感が強まるのではないかと推測している。
モデル4:腸内細菌叢は神経性食欲不振症の中心的要因である
最も頻度が高く、最も深刻な摂食障害である神経性食欲不振症(AN)は、しばしば重度のタンパク質-エネルギー栄養失調(PEM)を伴う。マラスムスは、半長期絶食の適応型であり、ANに伴う栄養不良の主な形態である。
しかし、クワシオルコル型は、末梢性浮腫、低アルブミン血症、脂肪肝、皮膚や毛髪の病変、無気力、感染症のリスクが高い相対的な免疫低下などの特徴がある。また、多くの有害な二次的合併症や高い罹患率/死亡率を伴う。患者の中には、Marasmic-Kwashiokor栄養失調が混在している者もいる。
ここ数十年、新しい手法の開発により、さまざまな疾患における腸内細菌叢の役割が明らかになってきた。その中でも最も精度の高いものはメタゲノミクスであり、これはハイスループットシーケンシングによって原核生物細胞のすべての遺伝子内容を研究することを目的としている。
このような新しいツールを用いて、栄養吸収とエネルギー調節(エネルギーの収穫、貯蔵、消費)における腸内細菌叢の役割が定義された。現在では、腸内細菌叢が栄養代謝や免疫機能を通じて、栄養失調のリスクや病因に寄与していることが確立されている(Krajmalnik-Brown er al)。 栄養失調の子供7人と健康な子供7人の16s rRNA PCR糞便サンプルを比較した臨床試験では、前者の腸内には健康な被験者よりも有意に少ないオペレーショナル分類単位が存在することが示された(310対546)(Monira et al 2011)。9組の栄養状態の良い双子と13組のクワシオルコルの不一致の双子を対象に、メタゲノムによる腸内細菌叢の比較を行ったところ、腸内細菌叢のプロファイルに有意な差が見られた。栄養不良の双子(クワシオルコル)の腸内細菌叢は、健常児やマラズミック・チルドレンに比べて、分化が少なく未熟であることが明らかになった(Smith er al)。 クワシオルコルで栄養失調に陥った子どもの便サンプルをgnotobiotisマウスに移植したところ、これらの動物は体重減少と重度の栄養失調に陥った(Smith er al)。 最近行われたマラウイの栄養失調児2767人を対象とした無作為化比較臨床試験では、(腸内細菌叢を変調させる)抗生物質を1週間経口投与することで、栄養失調児の栄養状態が改善され、死亡率が低下した(Trehan er al)。
腸内細菌叢の変調は、AN患者においても記述されている。Armougom et al 2009)は、Bacteriodetes、Firmicutes、Lactobacillus、およびMethanobrevibacter smithiiの細菌部門を測定した。彼らは、20人の肥満被験者、9人のAN患者、20人の正常体重の健常対照者の糞便を比較した。AN患者は中程度の栄養不足で、平均BMIは16であった。AN患者は全員、M. smithiiが増加していた(Armougom er al 2009)。M. smithiiは、健康な成人の大腸内に存在する嫌気性菌の最大10%を占め、多糖類の消化に中心的な役割を果たしている。メタンに含まれる水素を再利用することで、栄養素をカロリーに変換する能力を高め、エネルギー効率を向上させることができる(Samuel er al)。 AN患者に多い慢性的な便秘も減量前に存在し、腸内でM smithiiを増加させる原因になっている可能性がある(Kim er al)。 また、16S RNAマイクロバイオータの電気泳動プロファイルを用いて、9人の健常者と比較して、8人のANの栄養不良患者(平均BMIは12)でマイクロバイオータの逸脱が認められた(Hanachi er al)。
これらのデータは、重度の栄養失調とは限らないAN患者の腸内細菌叢に変化があることを示している。これらの変化には、エネルギー効率に直接関与するメタノゲンアーキアの増加が含まれる。実際、M. smithiiの増加は、食物による栄養素のカロリーへの変換を最適化することにつながる。このようなM. smithiiの増加は、栄養不足に先立ち、神経性食欲不振症の発生に中心的な役割を果たしている可能性がある。この経路を探るためには、AN患者の腸内細菌叢を、体重減少開始前、栄養療法中、および体重減少回復後に評価する必要がある。
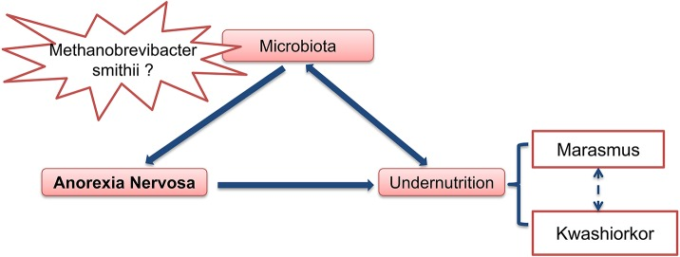
要約すると(図(図4),4)神経性食欲不振症における腸内細菌叢の役割に関して、少なくとも2つの仮説が提案できる。(1)これらの患者では、腸内細菌叢に何らかの既存の変化があり、それが食事制限を誘発したり参加したりしており、慢性的な便秘がこの腸内細菌叢の変化を誘発したり促進したりする可能性がある。(2)腸内細菌叢は、個々の患者のPEMのタイプ、すなわちマラスムス型とクワシオルコル型を決定する。このような場合、AN中に腸内細菌叢を(例えば抗生物質で)操作すると、栄養療法中の栄養失調の問題が改善する可能性がある。
図4 神経性食欲不振症の重要な要因としての腸内細菌叢
モデル5:神経ペプチドシグナル伝達の免疫異常としての神経性食欲不振症
ここでは、ストレス要因が、特定の免疫グロブリン(Igs)による神経ペプチドシグナル伝達の変化によって、食行動の調節障害を引き起こすことを説明する実験的および臨床的研究から得られた最近の証拠をレビューする(図.5)。また、この調節障害には、腸内細菌と腸管バリアーの機能不全が重要な役割を果たしていることも述べている。神経性食欲不振症(AN)は精神疾患に分類されるが、中核となる行動・精神症状に加えて多臓器の機能障害が関与していることが臨床的に観察されており、統合的な病態生理学的アプローチの必要性が強調されている。拒食症は一般的に、栄養失調とその多臓器障害を引き起こす原動力となり、さらに拒食症と精神疾患の併存が続くという悪循環に陥っていると考えられている。
しかし、この古典的なアプローチでは、これまで健康であった青年や成人に食欲不振や関連する症状がどのようにして起こるのかを明らかにすることはできない。ANを発症するリスクは、身体的ストレス(思春期、トラウマ、虐待、感染症など)および/または精神的ストレス(知的・身体的疲労、繰り返しのダイエットなど)というさまざまな種類のストレス要因によって顕著に増加することが広く認められている(Hilbert er al 2014)。また、ストレス事象やストレス関連疾患の家族歴もANの危険因子であり、ANを発症する患者のストレスに対する不適応な反応には、これまであまり特定されていない遺伝的またはエピジェネティックな因子が寄与している可能性が示唆されている(Trace er al 2013)。最後に、過去10~20年の間に、食行動の生理に関する知識が急速に増加し、モノアミンに加えて、神経ペプチドやペプチドホルモンが、食事の摂取量や満腹感、さらには快感や、睡眠、不安、消化管運動、感度、内分泌機能、骨代謝など、ANの間に変化する可能性のある他の行動や機能を制御する主要なシグナル分子であることが明らかになった(Berthoud, 2011)。
しかし、ペプチド濃度の測定や古典的なホルモン-受容体相互作用のみに基づいたアプローチでは、矛盾した、あるいは逆説的な知見が得られた(Prince et al 2009)。例えば、食欲不振の患者では、オレキシジェニックなグレリン(Otto et al 2001)が増加し、オレキシジェニックなレプチン(Hebebrand et al 1995)が減少しているにもかかわらず、食物摂取量が低いままであることなどである。
図5 神経性食欲不振症における神経ペプチドシグナル伝達の機能不全における微生物タンパク質と特異的免疫グロブリンの関与
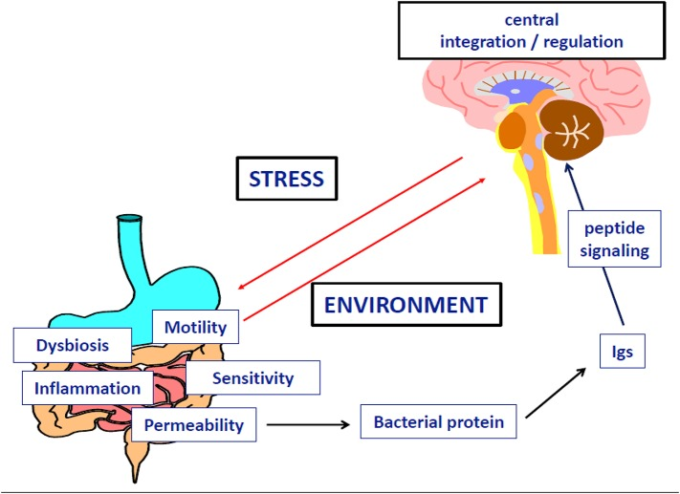
我々は、摂食障害や肥満の神経生物学的メカニズムには、食物摂取や感情を制御するペプチドホルモンと反応するIgsが関与している可能性を示す一連の臨床的・実験的研究を行ってきた(Fetissov er al)。 最初の発見は、視床下部ニューロンのα-メラノサイト刺激ホルモン(α-MSH)に結合するIgsが、ANまたは神経性過食症(BN)患者の血清中に同定されたことであった(Fetissov er al 2002)。さらに、これらのIgは、ANおよびBN患者の血漿レベルとEating Disorder Inventory-2(EDI-2)スコアとの相関関係から、その臨床的意義が示唆された(Fetissov et al 2005)。これらのIgsの潜在的な起源を明らかにするために、分子模倣の概念に基づいて、環境中、特に腸内細菌叢中に存在するいくつかの微生物が神経ペプチドと配列相同性を示すのではないかという仮説を立てて、in silico検索を行った。この仮説は、食欲や満腹感、感情に関わる主要なペプチド(α-MSH、グレリン、レプチン、オレキシンなど)と同一の連続した5つのアミノ酸を持つタンパク質をいくつかの一般的な微生物が発現していることで確認された(Fetissov et al 2008)。さらに、ペプチドホルモンに反応するIgGおよびIgAクラスのIgsが健常者にも存在することから、抗原の供給源が管腔内にあること、および神経ペプチドシグナルの調節におけるこれらのIgsの生理的役割がさらに裏付けられた。これを裏付けるように、無菌マウスにおいて、すべてのIgsクラスに対する腸内細菌叢の刺激効果が示されている(Hansson et al 2011)。
ANの病態生理に関しては、いくつかの研究で抗α-MSH Igsに注目した。なぜなら、この13アミノ酸ペプチドは、エネルギーバランスの主要な調節因子であり、メラノコルチン受容体4型(MC4-R)の活性化を介して満腹感とエネルギー消費を増加させ、ストレスに対する視床下部の反応と密接に関係しているからである(Cone, 2006)。この点を考慮して、げっ歯類を用いた研究が行われ、慢性的なストレス要因が、食物摂取や不安様行動に関連する抗α-MSH Igsのレベルや結合特性に影響を与えることが示された(Sinno er al 2009)。さらに、一過性の食欲不振と腸管伝染性の増大を引き起こす重度の腸炎モデルのラットでは、腸炎が治まった後も体重増加不足が続き、抗α-MSH Igsの増加と関連していた(Coquerel et al 2012)。また、我々は、活動性食欲不振(ABA)と呼ばれるANの動物モデルを採用した。ABAは、食物に触れる時間を徐々に減らし、ランニングホイールを組み合わせることで、AN患者の多動性を模倣したものである。その結果、ABAマウスでは、腸内細菌から宿主への抗原の通過に有利な大腸伝染性が亢進していることがわかった(Jésus er al)。
ペプチド反応性Igの発生に腸内細菌のタンパク質が関与しているかどうかを調べるために、プロテオミクスと免疫学を組み合わせた手法を用いて、大腸菌のα-MSH抗原模倣タンパク質を同定した。いくつかの大腸菌のタンパク質がα-MSHと5つのアミノ酸配列の相同性を示すことから、常在菌である大腸菌K12を用いた(Fetissov er al)。 我々は、α-MSHのコンフォメーション抗原模倣体として、ヒートショックシャペロンタンパク質であるClpBを同定した(Tennoune er al 2014)。ClpBをマウスに免疫すると、α-MSHと交差反応する抗ClpB Igの産生が誘導され、それに伴って摂食量、体重、不安感、MC4-Rシグナルが変化することを示した。さらに、野生型大腸菌を胃内投与したマウスでは、摂食量と体重増加が減少し、α-MSHと交差反応する抗ClpB-抗体が産生された。一方、ClpB欠損大腸菌を投与したマウスでは、摂食量やIgs値に変化はなかった。最後に、摂食障害の患者では、α-MSHと交差反応する抗ClpB IgGの血漿レベルが上昇しており、AN患者のEDI-2スコアと抗ClpB IgGおよびIgMレベルの間には、抗α-MSH反応性Igsに関するこれまでの知見と同様に、いくつかの有意な相関関係が認められた(Tennoune er al 2014)。これらのデータから、ヒトや動物のα-MSH反応性Igsは、主に大腸菌を含むいくつかの腸内細菌が産生する細菌性ClpBタンパク質に反応して生成されることが明らかになった。また、細菌のClpBタンパク質の発現は、タンパク質の凝集を防ぐ様々なストレス要因によって刺激されることから(Winkler er al 2012)ClpBは食事制限中の宿主の飢餓によっても活性化される可能性が示唆された。
これらの研究を総合すると、食物制限を含むさまざまなストレス要因が、腸管伝染性の亢進を介して、細菌タンパク質の腸管外への移行を促し、その結果、神経ペプチド反応性Igsの産生が増加する可能性があることを示している。より具体的には、細菌タンパク質ClpBは、α-MSHと交差反応するIgsの産生を誘発することにより、直接的および間接的に食欲減退性のα-MSH模倣タンパク質として作用し、この内因性ペプチドホルモンの満腹感や不安感に対する作用を変化させると考えられる。これには、α-MSHによるMC4-Rの活性化に対するIgsの調節機能が関与している可能性があるが(Lucas er al 2014)正確なメカニズムについては今後の調査が必要である。他のグループは、腸内細菌叢、特に大腸菌がストレス軸に影響を与えている可能性を示唆している(Dinan and Cryan, 2012)。また、大腸菌の含有量は、AN患者を含めた肥満度指数と逆相関していた(Million er al)。 腸内細菌叢の脳機能への関与に関する研究については、別の場所で議論されている(Cryan and Dinan, 2012)。我々のデータは、腸-脳軸のコミュニケーションにおけるペプチドホルモンを模倣した細菌のタンパク質の役割を支持し、そのようなタンパク質を検出するための効率的なツールとしてプロテオミクスアプローチの有用性を検証するものである。
ANの病態生理においてα-MSH模倣タンパク質とα-MSH反応性Igsが重要な役割を果たしていることに加えて、摂食や感情の制御に関わる他のペプチド系も、腸-脳軸のコミュニケーションに関わる同様のメカニズムで変化する可能性がある。その結果、AN患者ではグレリンと反応するIgsの量や性質が変化しており(Terashi et al 2011年)以前から提唱されている≪グレリン抵抗性≫の原因となっている可能性がある(Otto et al 2001)。反対に、肥満患者におけるグレリン反応性Igsの親和性の動態は、その分解が減少することによって、オレキシジェニック効果の増大を説明している(Takagi er al)24)。AN患者のグレリン反応性Igsがグレリン受容体の活性化を変化させるかどうかについては、まだ検討されていない。Orexin反応性Igsはナルコレプシーでも検出されており(Deloumeau er al 2010)AN患者の睡眠障害に関与している可能性が指摘されている。また、食物摂取や不安を制御するいくつかの神経ペプチドは、消化管の運動や感受性の調節にも関与しており(グレリン、CCKなど)これがANの消化器症状の高さを説明している可能性がある(Déchelotte et al 2007)。
結論として、我々は、ANの自然史に適合する以下の段階の統合的な病態生理学的シナリオを提案する。(1)ストレスに対する脆弱性の増大(遺伝的、エピジェネティック、または環境要因)(2)ストレス軸を活性化する大きなストレス事象、腸管伝染性の増大、および微生物叢の病原性の増大、(3)細菌のタンパク質(ClpBなど)が免疫反応に挑戦し、分子模倣により、神経ペプチド(α-MSHなど)と交差反応するIgsの産生を増加させる。(4) その結果、中枢および末梢のメラノコルチンシグナルが変化することにより、食物摂取量の変化、不安、胃腸の不快感などが引き起こされる。このような観点から、ANの治療には、行動療法や薬理学的なストレス軽減、腸管バリア機能の回復、微生物叢の不均衡の是正、細菌のタンパク質や関連するIgsの特異的な標的化など、マルチモーダルなアプローチが必要であると考えられる。
モデル6:神経性食欲不振症は、幼少期の前駆期にポンデロ栄養食の地下に根付く
生理的な思春期のプロセスは、部分的には遺伝的に決定されるが、身体的、精神的、感情的、ホルモン的、代謝的、摂食行動の強い変化と関連している。思春期の神経性食欲不振症は、この生理的プロセスの一種のミスマッチであり、≪ポンデロ-栄養-摂食≫の基盤に関わる基礎的かつ病前期の脆弱性因子によって許容されているという仮説が考えられる(図(6).6)。思春期前に存在する脆弱因子は、味覚の発達、食べ物の選択、食行動に関係しているかもしれない。思春期過程の刺激がこれらの脆弱性因子を阻害すると、≪ポンデロ-栄養-摂食≫システムのホメオスタシスが破綻し、後に神経性食欲不振症を引き起こす可能性がある。脆弱なシステムは、思春期の困難な時期の症状選択を説明する一種のトリガーゾーンであり、当初の逸脱した食行動が、栄養失調と自己暗示を促す代謝の変化によって自ら進化し、重度の心身症となっていく様子を説明している。
図6 思春期のプロセスとポンデロ栄養食の地下室:ミスマッチなチーム。
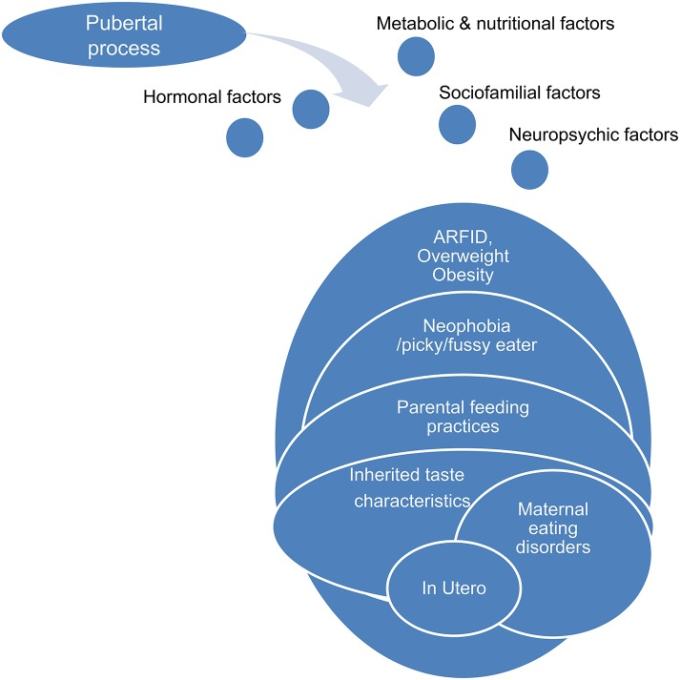
食嗜好の発達
食べ物の好みや食行動の発達は、おそらく胎児期から始まる複雑で逆説的なプロセスであり、遺伝的な味覚特性と、家族の食行動、仲間の影響、社会文化的背景などの環境要因との相互作用が関与している(Birch, 1999)。
継承された特性
2歳児の味覚表情を調査した結果、≪低味覚群≫、≪正常味覚群≫、≪高味覚群≫が認められた。超味覚障害群は、食べ物の選択や母親の授乳の相互作用に困難をきたす(Chiva, 1982)。フェニルチオカルバミド(PTC)や6-n-プロピルチオウラシル(PROP)の苦味に対する個人の遺伝的感受性が、食べ物の好みや食生活を決定する。欧米人の30%は「非味覚派」、50%は「味覚派」、20%は「超味覚派」と呼ばれている。このような味覚の個人差が、食品の嗜好(苦味や抗酸化物質を多く含む食品、甘味や脂肪を含む食品、アルコール飲料)や食行動に影響を与え、それが体重や慢性疾患のリスクにつながっている可能性がある。PTCまたはPROPに対する遺伝的感受性とBMIおよび体脂肪率との間には逆相関があるかもしれない。
しかし、TAS2R38遺伝子を介したこの表現型が、食品規制にどの程度関与しているかはまだ議論の余地がある。他の遺伝的な苦味・非苦味因子は、味蕾の栄養因子である唾液中のイオン性亜鉛濃度に影響を与えるgustine遺伝子のように、食わず嫌いや逸脱した食行動を含む食嗜好に役割を果たしている可能性がある。また、神経性食欲不振症の患者が嗅覚や味覚の障害を訴えることが多いにもかかわらず、摂食障害の臨床集団に関する研究はない(Goldzak-Kunik et al 2012)。
親の摂食習慣と社会文化の影響
子どもの食行動は、社会文化的環境、親の食習慣、特に母親の食習慣や食べ物の好みに早々に影響される。幼少期の食事時のネガティブな影響、食事中の葛藤、食べ物との格闘、不快な食事などは、その後の神経性食欲不振症の症状の高いリスクと関連している。母親の食事は、幼少期の食物消費を最も強く予測する要因の一つである。実際、子どもの困難さのばらつきの15〜20%は、母親の摂食習慣と関連している可能性がある。フランスで行われた研究では、偶発的、強制的、寛容的などの極端な摂食方法が、子どもの食の困難さ(食わず嫌い、好き嫌い、食欲不振、食事の楽しさの低下など)を高めることが示された。逆に、柔軟な態度で繰り返し食べ物に触れることで、食べることへのモチベーションが高まった(Rigal et al 2012)。親が子どもの食事方法を過度に制限したりコントロールしたりすると、子どもの食事の自主性が制限され、子どもの食の選択に悪影響を与え、逆に砂糖や塩分、脂肪分の多い「悪い食べ物」の摂取を促進する可能性がある。また、子供のニーズを認めないような押し付けがましさやその他の有害な親の行動も、摂食障害の高いリスクと関連している(Gahagan, 2012)。
親の摂食障害
摂食障害の母親の子供は、小児期や青年期に精神病理を発症するリスクが高いことが、いくつかの研究で示されている。母親の摂食障害は、非常に早い段階で乳児の摂食の質に影響を与え、未熟児、低出生体重(これらは摂食障害の危険因子である)過体重、過食の頻度が高い胎内で始まる(Micali et al 2011)。体重や体型に不安のある女性は、新生児への授乳量が少なく、この授乳期間中に自分の食事制限があるため、将来の子どもの食事選択に影響を与える可能性がある。その後、食事の際の葛藤や不快な発言、押し付けがましい食事の仕方、コントロールされた食事の仕方は、子どもの否定的な食行動、食事を拒否する反抗的な態度、乳幼児期の拒食症などを助長する可能性がある(Micali et al 2009)。摂食障害の女性の子どもと「非暴露」の子どもを比較した縦断的研究では、第1群では「健康志向/ベジタリアン」の食事パターンへの密着度が高く、神経性過食症の女性の子どもでは脂肪分が少なく、炭水化物が多く、暴食サブタイプの拒食症の既往がある女性の子どもでは高エネルギー密度の食品が多くなるなど、摂食行動の修正が見られた。このような食べ物の選択の変更は、後の小児期や青年期に体重の心配や過体重、摂食障害を発症するさらなるリスクと関連している可能性がある(Easter er al)。
病前の過体重または肥満
幼少期の過体重または肥満と、思春期のさらなる神経性食欲不振症との関連性に関する研究はない。しかし、他のタイプの摂食障害の発生率が不明であるにもかかわらず、小児期の過体重または肥満は多食と強く関連している。神経性食欲不振症とむちゃ食い障害は、病前の性格・行動の問題や家族の過食については異なっているが、神経性過食症の危険因子は主に神経性食欲不振症とむちゃ食いと共通している。病前のBMIは、神経性食欲不振症エピソードの経過中にある神経性過食症やむちゃ食い障害と正の相関がある(Nishumira et al 2008)。思春期男性の神経性食欲不振症患者では、病前期の過体重または肥満がより頻繁に見られる(30〜40%)。その他、最近の研究では、病前期の過体重または肥満の既往がある青年は、制限型摂食障害を発症する可能性があり、重度の体重減少、重度の医学的合併症を伴い、予後も悪いことが示唆されている。
食物恐怖症/偏食/ARFID
どのような問題が予測されるかについて、研究では確固とした結論が得られていないが、幼児期に摂食障害があったり、思春期に摂食障害があったりすると、若年成人期に摂食障害になる危険性が高い(Kotler et al 2001)。新生児期や乳児期初期の消化器系トラブル(重度の胃食道逆流)や、吐き気や嘔吐を伴う消化器系疾患による二次的な食わず嫌いは、食欲や食事パターンに悪影響を及ぼすことが報告されている。食物嫌悪症は、幼少期に頻繁に見られる問題である偏食・騒動の中で、未知の食物に拒絶反応を示す生存メカニズムである(8〜50%)。慣れ親しんだ食品を拒絶し、不十分な種類の食品を摂取し、野菜や果物の摂取量が少ない状態と定義されている。後に摂食障害を発症する危険因子には、偏食と消化器系の問題が含まれており、1〜10歳の10年間で有意な安定性を示している(Marchi and Cohen, 1990)。食物恐怖症と偏食が別のものだとしても、おそらく重複しており、どちらもある種の摂食障害と関連している可能性がある。ARFID(小児・青年期の回避・制限性食物摂取障害)は、DSM-5の分類では、幼児期からの選択的(偏食)な食事を持つ者を含む新しいカテゴリーである。ARFIDグループに共通する摂食行動や症状には、食物の回避、食欲不振、腹痛、嘔吐恐怖などがある。ARFID患者は、AN患者よりも若く、12歳以前に発症することが多く、男性であることが多い(Norris er al)。 最近の研究では、ARFID患者は有意に低体重であり、罹患期間が長く、併存する医学的疾患、不安障害や気分障害を持つ可能性が高いとされている。ARFIDの経過は不明であるが、これらの子どもや青年がAN、BN、EDNOSなどの他のタイプの摂食障害を発症する可能性がある(フィッシャー et al 2014)。
結論
神経性食欲不振症は、幼少期の摂食・食行動のベースを決定する脆弱性因子に根ざしている。食物の嗜好、遺伝的味覚因子、環境因子、早期の不十分な食物摂取を含むこれらの脆弱性因子は、思春期のプロセスに関連した修正によって影響を受ける可能性があるため、”ミスマッチチーム “と呼ばれている。思春期に神経性食欲不振症を発症する可能性のある幼児・児童には、特定の食事パターンの特徴や逸脱したポンデリングの履歴が認められることがあるが、これは脆弱性や高リスクを示すものである。
モデル7:神経性無食欲症(AN)は精神的な恒常性を保とうとする試みである
ANは、精神的なホメオスタシスを回復させようとする試みが、摂食制限という方法で身体領域を利用した結果であると考えることができる(図.7)。特定の被験者は、素因(Garner et al 1993)のために、ANに対する脆弱性の軌跡を描く可能性がある。この脆弱性は、個人的要因(精神的または身体的要因)や対人関係要因の結果として、「幸福感」または「ユーデモニア」の喪失につながる要因が生じた際に表面化する可能性がある(図参照)。不安定なホメオスタシスは、第一段階では、食事制限によって回復するが、このプロセスはANを長引かせる原因となる。脆弱性の軌跡と誘因因子は、被験者ごとに性質や強度が異なる可能性があり、発症年齢、臨床症状、障害の強度、経過時間、治療反応、または慢性疾患、過食症や他の精神疾患への進展など、様々な臨床表現を説明することができる。
図7 精神のホメオスタシスを保つための試みとしての神経性無食欲症のモデル
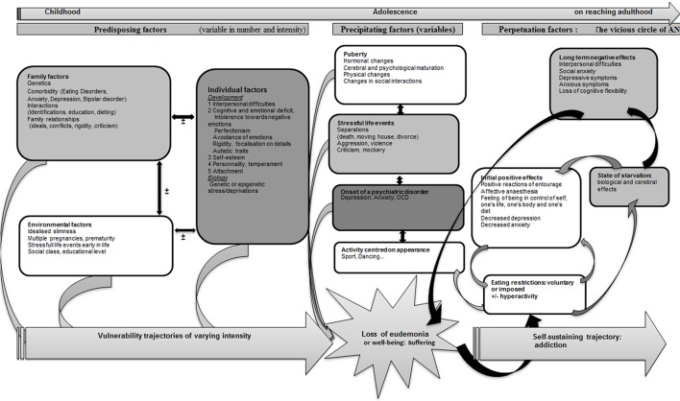
ANの脆弱性の軌跡に寄与する素因は、患者に一度にすべて存在するわけではなく、多数の異なる脆弱性要因が組み合わさって軌跡を形成する。これらの素因には、
(1)遺伝的な障害への感受性を含む家族要因(Pinheiro et al 2010,Trace et al 2013年)摂食障害の精神科的家族歴(Strober et al 2000年)不安障害、鬱病、双極性障害(Bouldら、。2015)完璧主義や硬直性などの特徴(Treasure et al 2010)人生の早い段階での家族の相互作用の乱れ(剥奪、暴力-Jaite et al 2012)または食習慣に関連した家族の相互作用(Hill and Franklin、1998;Haycraft et al 2014;Loth et al 2014;Micali et al 2014)などが挙げられる。また、
(2)個人的な要因としては、女性の性別(Connan et al 2003年)エピジェネティックな調節を介した子宮内ストレス(Connan et al 2003,Treasure et al 2010)を含む早期のストレスへの曝露(Toyokawa et al 2012年)影響、認知、対人関係で明らかになる個人的な成長の乱れ(Connan et al 2003)などが関与している可能性がある。
さまざまな研究で用いられている概念に応じて、これらの現象は、パーソナリティ障害の形や次元(完璧主義、強迫性、神経症、否定的感情性、危害回避、低自己指示性、低協調性、低新規性追求。および回避性パーソナリティ障害に関連する特徴)(Cassin and Von Ranson, 2005)愛着障害(Tasca and Balfour, 2014)感情調整障害(Haynos and Fruzzetti, 2011)認知障害(弱い中枢制御、硬直性)(Treasure and Schmidt, 2013)不安障害(Raney er al)。 , 2008; Touchette et al 2011)生物学的または遺伝的な特殊性(例えば、Bailer and Kaye, 2011; Tremolizzo et al 2014を参照)。
(3)未熟児(Favaro et al 2006年)多胎妊娠(Raevuori et al 2014)などのストレスの多いライフイベントや、社会におけるスリムの理想(Garner、1993年)社会階級(Godart et al 2013年)教育レベル(Goodman et al 2014)などの社会的要因など、環境的要因も重要な役割を果たしている。
これらの様々な要素から導き出される軌跡は、まだ特徴づけられていない。大まかには5つのタイプに分けられ、それぞれ(1)こだわりや完璧主義、(2)アスペルガー症候群に近い大きな対人関係の困難、(3)不安、(4)気分障害、再発性単極性うつ病、双極性障害、(5)幼少期の剥奪や暴力が織り込まれた人格障害に支配されている。
誘因となる要素は、主にストレスの多いライフイベント(Connan et al 2006,SchmidtとTreasure 2006)やネガティブな感情状態(FoxとPower 2009)であり、時には、初期の精神医学的併存疾患(うつ病、不安、OCD、Godart et al 2002,2007)の設定であったり、思春期に関連してホルモン要因(Klump 2013)や心理的、身体的、関係的要因を含むことが多い。
摂食制限の開始は、様々な文脈で現れる。(1)ネガティブな感情状態(自尊心の低下)に結びついた心理的な不満が身体に伝わり(Fox and Power, 2009)身体への不満に結びついた食物摂取を制限する意志を誘発する、(2)痩身ダイエット(体重増加の結果として。(2) 痩身ダイエット(体重増加、家族からのプレッシャー、ピアグループからの影響)(3) 消化管に関わる連続した出来事、(4) 感情状態(ストレス-Greeno and Wing, 1996-不安または抑うつを介して)または身体的病理は、本来の意味での拒食症(食欲不振)を引き起こす可能性がある。
しかし、過去の脆弱性の経過やきっかけとなった出来事が何であれ、これらの被験者は食物摂取を制限することでポジティブな効果を発見し(うつ病で短期的に報告されているように、Fond et al 2013)一時的にユーデミアに戻ることができる。このウェルビーイングは、飢餓によって引き起こされる生物学的な変化、不安や抑うつ症状の減少(Kaye er al 2003)自分の人生や身体、食事をコントロールできているという感覚、側近からの時には肯定的なフィードバック、そして場合によっては情動麻酔の結果である(Garner, 1993; Fox and Power, 2009)。
しかし、いずれの場合も、バランスを崩す原因が残っているため、得られたバランスはもろく、長続きしない。さらに、食べ物の不足(しばしば多動性と相まって)は、生物学的およびホルモン学的な影響を及ぼすため、(不安や抑うつの症状につながる Swenne and Rosling, 2010; Gauthier et al, 2009)患者の状態に関連した親の批判(Treasure and Schmidt, 2013; Duclos et al 2014)などがあり、対象者は同じ効果を取り戻すために、食物摂取制限という同じ手段で対処しようとし、さらには食物の剥奪を強めようとするため、対象者はANの悪循環に陥ってしまう。このモデルでは、ANは、自分自身と空腹感をコントロールすることを目的とした嗜癖行動であると考えることができる(Jeammet, 1991; Venisse, 1991; Goodman, 2008; Duclos et al 2014)。
臨床家が観察する臨床プロファイルは複合的であり、脆弱性の軌跡(例えば、先に述べた5つのうちの1つ)や障害の発症年齢に関連する要素に依存する(例えば、思春期前の被験者は成長と思春期の遅れを示する)青年は成人よりも自分のやせを否定することが少ないである(Couturier and Lock, 2006)。また、前駆要因(例えば、障害の前に抑うつ状態があった場合、自殺念慮や精神運動遅滞が見られることがある)や、食物の剥奪の強度と期間にも依存する。我々は、ANの進化の過程の重さは、脆弱性因子の重さ、飢餓状態の重さ、およびANの予後にも関連しているという仮説を立てた。つまり、AN発症前の困難が重ければ重いほど、障害が重くなり慢性化する可能性が高く、ANを悪化させる精神的障害も大きくなる。
我々は、これまでに開発されたモデル(Garner, 1993; Connan et al 2003; Fairburn and Harrison, 2003; Schmidt and Treasure, 2006; Fox and Power, 2009; Herpertz-Dahlmann et al 2011; Tasca et al 2013; Treasure and Schmidt, 2013; Treasure et al 2014)と、精神的ホメオスタシスの概念から出発して、グローバルで統合的な神経性食欲不振症(AN)の臨床モデルを提案している(Agnati et al, 精神的ホメオスタシスとは、(1)生物学的なホメオスタシスの概念を精神領域に置き換えることができる、(2)心理学的な観点から、いかなる個人も「人間の精神の幸福」または「エウデモニア」と呼ばれる平衡状態を有している、(3)精神的ホメオスタシスは、人が自分自身(感情的、身体的)および他者(対人関係)に対して安心感を得ることでエウデモニアを維持することができる、と仮定する概念である(Agnati et al, 2011)。この精神的な恒常性を崩すような出来事があると、「精神的アロスタシス」という状態になり、対象者にとっては苦痛であり、対象者は以前の均衡を取り戻すための適応プロセスによって、この状態と闘うことになる。人の精神的ホメオスタシスの均衡は、家族、個人、環境要因と結びついた発達の軌跡に応じて、可変的に脆弱化するダイナミックなバランスプロセスなのである。
おわりに
多くの複雑な障害と同様に、科学的根拠に基づいて、ANの様々な発見的モデルを導くことができる。効率的なモデルは、有効なリスク因子を用いて、神経性食欲不振症の潜在的に関与する作用機序をさらに明確にするべきである。ANに寄与する素因(モデル7参照)としては、(1)摂食障害の精神科的家族歴の存在、(2)個人的な不安障害、抑うつ障害、双極性障害の存在、(3)完璧主義や硬直性などの異なる性格的特徴。(4)人生の早い段階での家族との交流の乱れ(剥奪や暴力)(5)食習慣に関連した家族との交流だけでなく、(6)女性の性別、(7)子宮内ストレス、多胎妊娠、未熟児などの早期のストレスへの曝露、(8)個人的な成長の乱れなどである。また、(9)社会における細身の理想像、(10)社会階層、(11)教育水準など、社会的要因も関係している。
拒食症の特徴の一つは、低体重の患者に食糧不足やパージ行動があるにもかかわらず、過剰な運動をすることである。このことは、食物の報酬特性における内因性オピオイドとドーパミン経路の役割(モデル1参照)や、オピオイドやドーパミンの受容体や輸送体をコードする遺伝子の特異的な多型がANに多いことから間接的に支持され、食物や運動の報酬価値の異常が中核的な特徴として提唱されている。報酬プロセスの異常には、より具体的には、遅延報酬を好むことや(対照群と同様に)即時報酬を好む能力の低下が含まれる可能性がある。このような遅延型報酬への嗜好は、飢餓状態のときに(体重を減らすために)食べ物を避けたり、(疲労困憊しているときに)休まなかったりすることに意味がある。アンフェタミンによって誘発されたドーパミン放出は、実際にANから回復した人の不安を増大させた。これにより、食物に関連したドーパミン放出が、AN患者では不安を、健常者では快楽を生じさせる理由が説明できる可能性がある(モデル2参照)。これまでに行われた最大規模のGWASから得られたカルシニューリン遺伝子の(わずかな)役割を示す最近の証拠は、この遺伝子が持久的な運動能力と耐性におけるヒトのバリエーションの一部を独立して説明していることから、この見解を支持するものである(He er al 2010a)。報酬プロセスの異常がANの中心であるという考えは、グレリン(通常、食物を欲する行動を誘発するオレキシジェニックホルモン)の血漿レベルがANで増加しているという事実によって裏付けられている。グレリンは、例えばヘテロ二量体を介して、ドーパミン系の報酬系を調節するなど、多面的な作用を発揮するので、ANにおけるグレリンの役割は可能であり、実際、いくつかの遺伝子研究によって裏付けられている。
しかし、LHAから脳の報酬回路に投射するニューロンには、グレリン以外にも、発現しているオレキシン、MCH、26RFaなどの因子が含まれている(モデル3参照)。例えば、LHAのオレキシンニューロンは、薬物や食物の報酬に関連した手がかりに対する嗜好性と強く関連しており、VTAにオレキシンを注入すると、側坐核(NAc)のドーパミン放出が増加する。ANにおいてMCHシステムの役割が調査されたことはないが、MCHのオレキシジェニック効果がNAcでの作用に大きく依存していることは興味深いことである。26RFaの濃度も、制限型AN患者では健常者に比べて1日中有意に上昇するという異常が見られ、脳内のGPR103 mRNA(26RFaの受容体)をマッピングすると、26RFaの受容体はVTAやNAcにも発現していることがわかった。したがって、グレリン、オレキシン、26RFaなどのオレキシジェニックな神経ペプチドは、ANで明らかに発現が増加している。これらのオレキシジェニックなプロファイルは、食物摂取を促進するための適応的なメカニズムを反映している可能性があり、栄養不足を解消しようとしても不十分であり、AN患者の報酬系におけるドーパミン誘発性の不安を強化し、その結果、食物に対する嫌悪感を引き起こしている可能性がある。
腸内細菌叢は、栄養代謝や免疫機能を通じて、栄養不良のリスクや病因に関与しているが、AN患者では、微生物叢の偏りや、エネルギー効率に直接関与するM.smithii(モデル4参照)の増加などの特異性も示されている。したがって、腸内細菌叢の既存の変化が、例えば、ANによく見られる慢性的な便秘を介して、食事制限を誘発したり、食事制限に関与したりする可能性があると考えられる。さらに正確には、食物制限により腸管伝染性が亢進することで、細菌のタンパク質が腸内から移動し、その結果、神経ペプチド反応性のIgsの産生が増加し、細菌の熱ショックシャペロンタンパク質(ClpB)が食欲不振を引き起こすα-MSH模倣タンパク質として作用する可能性を指摘する著者もいる。AN患者ではグレリンと反応するIgsの量や性質も変化していることから(モデル5参照)抗原には他の神経ペプチドが関与している可能性がある。
親から子への遺伝子多型の継承とは別に、危険因子が親子間の相互作用によって世代間で受け継がれることもある。実際、体重や体型に不安のある女性は、新生児の母乳の出が悪くなる(モデル6参照)。その後、摂食行動に対する対立的、侵入的、過剰なコントロールは、子どもの否定的な摂食行動を促進する(参考文献)。また、摂食障害の女性は、「健康志向・ベジタリアン」の食事パターンをとる頻度が高いことが、縦断的な研究で示されている。さらに、思春期に食わず嫌いや好き嫌い、ARFID(児童・思春期における回避性・制限性食物摂取障害)などの摂食障害があると、若年成人期に摂食障害になるリスクが高いと言われている。
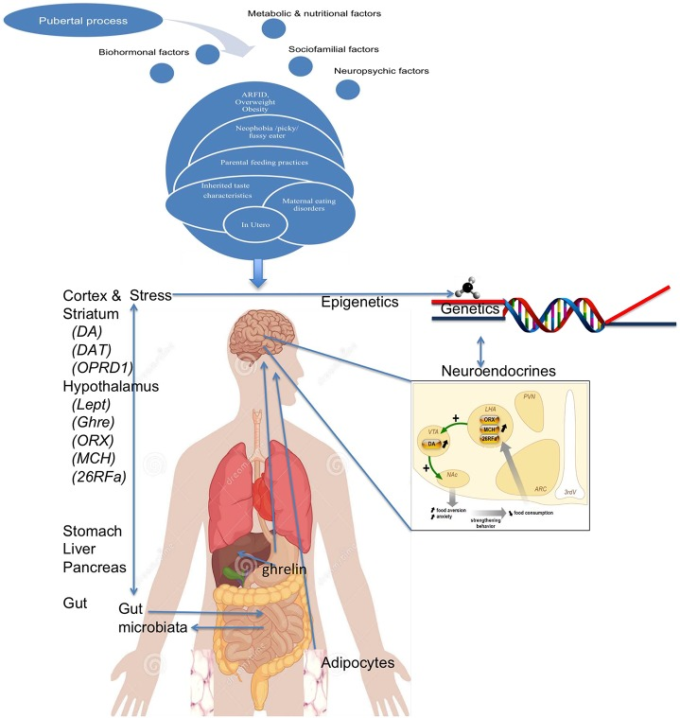
これらを総合すると(図8)遺伝的にリスクのある被験者や、親から病的な摂食態度を受けた被験者は、通常は気づかない非特異的な早期の摂食障害、例えば、食べ物の嫌悪感や好き嫌い、ARFIDに関する特徴を持つ可能性があると考えられる。他の危険因子との関連では、このような閾値以下の困難は、一部の患者では悪化し(例えば、個人的または家族的な精神的病的状態、完璧主義または硬直性の特徴または硬直性のため)促進的な環境(食べ物の豊かさと薄さに対する高い価値)の中で誘因因子(思春期前後のストレスなど)に出会うと、神経性拒食症を発症する可能性さえある。このような経路では、食べ物の報酬価値が徐々に変化し、満腹感というポジティブな価値が失われたり、減量や過度の運動に伴うポジティブな感情が増加したりするが、これは潜在的に遅延報酬を好むようになるためである。興味深いことに、このような病気の進行は、危険因子の蓄積(人生のさまざまな時期に起こる)だけでなく、遺伝子×遺伝子の相互作用(2ヒット仮説)エピジェネティックな変化(遺伝子と環境の相互作用全体)さらには腸管伝染性の亢進によって神経ペプチド反応性免疫グロブリンの産生が増加することによっても説明できる。いくつかの側面がまだ推測の域を出ないとしても、これらは2つの重要な結論をもたらす。第一に、ここで紹介した多くの側面は、神経性食欲不振症においてはまだ非常に予備的なものであり、より多くの患者とより強力な技術を用いて研究すれば、当初考えられていたよりもはるかに重要になる可能性がある(マイクロバイオータ、エピジェネティックな制御、免疫など)。第二に、ANの統合モデルを提案することは、この障害のメカニズムを描くには、それらの異なる側面を一緒に研究する必要があり、単一のアプローチでは、この複雑な障害のすべての側面をカバーする可能性が低くなるという考えを補強するものである。
図8 神経性食欲不振症のグローバルモデル
著者の貢献
JEはPGと一緒に序論と結論を書き、論文のさまざまな部分と図を検討した。PGはJEと一緒に導入部と結論部を書き、論文と図の異なる部分を検討した。CB, NC, JD, PD, MH, SF, NG, JM, NR, CR, VT, OVは、論文の執筆と図のデザインに参加した。
利害の衝突に関する声明
著者らは,本研究が,潜在的な利益相反として解釈される可能性のある商業的または金銭的関係がない状態で実施されたことを表明する.VP査読者は,著者OVとの共通の所属と過去の共著を取り扱い編集者に申告したが,編集者はそのプロセスが公正で客観的な査読の基準を満たしていることを確認した。
