Contents
Phenylindanes in Brewed Coffee Inhibit Amyloid-Beta and Tau Aggregation
www.ncbi.nlm.nih.gov/pmc/articles/PMC6194148/
www.compoundchem.com/2014/01/30/why-is-coffee-bitter-the-chemistry-of-coffee/
要旨
コーヒーの摂取はアルツハイマー病(AD)やパーキンソン病(PD)の発症リスクの低下と相関があるが、コーヒーがヒトの神経保護効果をもたらすメカニズムは十分には解明されていない。我々は、淹れたコーヒーに含まれる化合物が、アミロイドベータ(Aβ)やタウ(AD)αシヌクレイン(PD)の凝集を抑制することで、神経保護効果を発揮するのではないかと考えた。
3種類のインスタントコーヒー抽出物(ライトロースト、ダークロースト、カフェインレスダークロースト)と6種類のコーヒー成分
- カフェイン
- クロロゲン酸
- キナ酸
- カフェイン酸
- ケルセチン
- フェニルインダン
について、それぞれチオフラビンT(ThT)蛍光アッセイおよびチオフラビンS(ThS)蛍光アッセイを用いて、Aβおよびタウタンパク質の線維化を阻害する能力を調べた。
Aβおよびα-シヌクレインオリゴマー化の阻害は、ELISAアッセイを用いて評価した。すべてのインスタントコーヒー抽出物は、100μg/mL以上の濃度でAβおよびタウのフィブリル化を阻害し、α-シヌクレインのオリゴマー化を促進した。
ダークローストコーヒー抽出物は、ライトローストコーヒー抽出物(IC50 = 40.3 μg/mL)よりもAβオリゴマー化のより強力な阻害剤(IC50 ca. 10 μg/mL)であり、純粋なカフェイン(1)は、Aβ、タウまたはαシヌクレインの凝集に影響を及ぼさない。
コーヒー成分2,4,5は100μMの濃度でAβのフィブリル化を阻害するが、5のみがAβのオリゴマー化を阻害する(IC50 = 10.3μM)。1〜5はタウのフィブリル化には効果がない。一方、コーヒー成分6(フェニルインダン)は、Aβとタウの両方のフィブリル化を強力に阻害し、Aβのオリゴマー化も阻害する(IC50 = 42.1 μM)。
コーヒー成分4および5は100μM以上の濃度でα-シヌクレインの凝集を促進するが、他のコーヒー成分はα-シヌクレインのオリゴマー化に影響を与えない。
コーヒー摂取による神経保護効果は、様々な要因の組み合わせによるものと考えられるが、我々のデータは、フェニルインダン6(コーヒー豆の焙煎中に生成され、ダークローストコーヒーではより多くの量が検出される)によるAβおよびタウの凝集の阻害が、コーヒーが神経保護を提供する可能性がある最も適切なメカニズムであることを示唆している。
フェニルインダン6がAβとタウの両方の凝集阻害剤であることを明らかにしたことは注目すべきことであり、6の凝集阻害活性の報告はこれが初めてである。
キーワード
アルツハイマー病、パーキンソン病、タンパク質のミスフォールディング、凝集抑制、コーヒー、カフェイン、フェニルインダン、神経保護作用
序論
コーヒーは世界で最も広く消費されている飲料の一つであり、年間約5000億杯が消費されている(ButtとSultan 2011年)。コーヒー飲料は、さまざまな異なる味、焙煎レベル、およびまたカフェインの有無に応じて利用可能である。最近では、コーヒーの消費と糖尿病、様々 な癌やアルツハイマー病 (AD) とパーキンソン病 (PD) (バットとサルタン 2011) などの神経変性疾患の開発のリスクの減少と相関関係のある疫学研究とメタアナリシスの数が増えているため、医療界での関心を集めている。カフェインやカフェイン入りコーヒーが覚醒度、注意力、記憶力の短期的な改善を引き出すことは一般的に受け入れられているが(Butt and Sultan, 2011)加齢に伴う認知機能の低下から保護する能力はあまり明らかにされていない。(Santos et al 2010)による 2010 年のシステマティックレビューとメタアナリシスでは、コーヒー摂取と認知症予防の間に正の相関関係があることが示唆されているが、研究デザインや方法論の不一致により、実験結果の解釈が複雑になっている(Costa et al 2010)。(Mirza et al 2014)の最近の研究では、コーヒー摂取と認知症の発症との間には相関関係はなく、神経保護効果は逆因果関係にあると主張している。
コーヒーの主な精神作用成分はカフェイン(1)であり、血液脳関門(BBB)を容易に通過するキサンチンアルカロイドである。コーヒーに含まれるカフェインの含有量は、コーヒー豆の種類(アラビカ種とロブスタ種)焙煎方法(ライトローストとダークロースト)抽出方法(ドリップとボイル)によって大きく変化することが知られている。例えば、標準的なドリップコーヒーの場合、150 mL あたり平均 70~80 mg のカフェインが含まれている(Barone and Roberts, 1996)のに対し、エスプレッソコーヒーの場合は 150 mL あたり約 950 mg のカフェインが含まれている(Ludwig er al)。 しかし、典型的な8オンスのドリップコーヒーカップと1オンスのエスプレッソショットの間のサービングサイズの違いを考慮すると、全体的なカフェイン摂取量は似ている。カフェインはまた、カフェインの吸収率がほぼ100%で、摂取後45分後に発生する(Blanchard and Sawers, 1983)。これらの好ましい薬物様特性は、AD(Arendash et al 2006,2009)およびPD(Chen et al 2001; Xu et al 2010)に関連する認知機能低下を治療するためのカフェインの使用への研究努力を促してきた。しかし、最近では、カフェインの慢性投与が認知症患者の行動的および心理的症状(不安関連行動)を悪化させる可能性があり、カフェイン摂取の潜在的な認知的利益のいずれかを妨げる可能性があることが示唆されている(Baeta-Corral et al 2018)。
カフェインに加えて、コーヒーはまた、クロロゲン酸として集合的に知られている様々なポリフェノール酸、および様々なフラビノイド、タンニンおよびメラノイド類を含んでいる。実際には、粗カフェイン-カフェインに加えて他の様々な植物化学物質を含むコーヒーの脱カフェイン化プロセスの副産物-を投与されたADのトランスジェニックマウスモデルは、純粋なカフェインで処理されたマウスと比較して、記憶障害とAβペプチドとAβプラークの低い海馬レベルを示した(Chu et al 2012)。カフェインはコーヒーに含まれる他の成分との相乗効果により、全体的な神経保護効果をもたらす可能性が示唆されている(Cao er al)。 我々の研究室では、アミロイド原性タンパク質の凝集を阻害することができる天然に存在する低分子の同定に関心を持っている;脳内でのタンパク質凝集体(特にプレフィブリルオリゴマー)の形成は神経毒性があることが知られており(Ono, 2017, 2018)凝集プロセスの阻害は神経変性疾患の治療のための魅力的な戦略である。このように、創薬プロジェクトに拍車をかけるために、AD(Aβ/tau)およびPD(α-シヌクレイン)に関連するアミロイド原性タンパク質の凝集を防止することが可能な薬剤様分子の同定が必要とされている。しかしながら、タンパク質凝集のいくつかの低分子阻害剤が、より小さなオリゴマー種を安定化することによってその効果を示すことは注目に値する(Dedmon et al 2005;谷口 et al 2005;増田 et al 2006;Zhu et al 2013;Matos et al 2017年)神経毒性を有する可能性がある(Caruso et al 2017)。
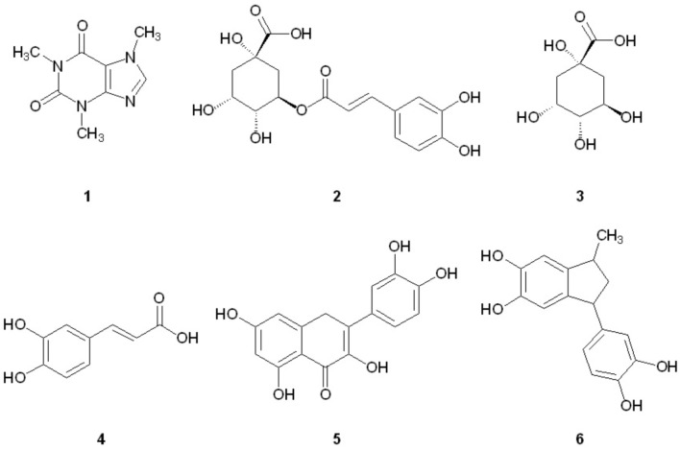
我々は最近、カナダ産メープルシロップの成分がアミロイド原性Aβおよびタウの凝集を減少させることができることを報告しており(Hawco et al 2016)我々は、淹れたコーヒーに含まれるカフェインまたは他の成分が同様のメカニズムを介して神経保護効果を引き出すかどうかに興味を持っていた。ここでは、コーヒーの消費に関連した神経保護の実行可能なメカニズムがタンパク質凝集の阻害であるかどうかを判断するために、認知症に関連したミスフォールドされたタンパク質の凝集に対するコーヒーの効果を調査したことを報告する。我々は、淹れたコーヒーに含まれる多くのポリフェノール化合物(図11)が、Aβ、タウ、α-シヌクレインの凝集プロファイルを変化させることを示している。調査したコーヒー成分のうち、熱分解生成物フェニルインダン(6)は、Aβとタウの両方の凝集を強力に阻害することがわかった。関連する一連のインダネジオン類似体もまた、Aβ線維化を阻害することが知られている(Catto et al 2010)が、タウ凝集は本報告では調査されていない。我々の知る限りでは、Aβ、タウ、α-シヌクレインに対するフェニルインダン(6)の凝集抑制活性についての初めての報告である。
図1 コーヒー成分の凝集抑制活性の構造
材料と方法
コーヒー抽出物とコーヒー成分
スターバックスブランドのアラビカ種100%インスタントコーヒー(スターバックスVia InstantTM)を、ライトロースト、ダークロースト、カフェインレスダークローストの3種類で入手した。コーヒー抽出物のストック溶液は、試験管内試験スクリーニング用に10.0 mg/mLの濃度でマイクロポアろ過し、脱イオンした水(MilliQ® Advantage A10,Millipore Sigma)に調製した。カフェイン(1)は、BDH biochemical(Mississauga, ON, Canada)から購入した。クロロゲン酸(2)、キナ酸(3)、カフェイン酸(4)およびケルセチン(5)は、コンビブロック(カリフォルニア州サンディエゴ、米国)から購入した。フェニルインダン(6)を、修正された文献手順(Stadler et al 1996)に従って、以下に概説するように調製した。化合物1-4および6のストック溶液を、試験管内試験スクリーニングのために25.0 mMの濃度でMilliQ®水に調製した。化合物5のストック溶液は、試験管内試験スクリーニングのために、DMSO(水への溶解度が低いため)中で25.0 mMの濃度で調製した。
フェニルインダン(6)の化学合成
フラッシュクロマトグラフィーは、Teledyne Isco (Lincoln, NE, United States)からのIsco CombiFlashシステムを使用してRediSepカラム上で実施した。薄層クロマトグラフィー(TLC)は、メルク社製シリカゲル60 F254アルミバックプレートを用いて実施し、生成物は254 nmでのUV照射により可視化した。溶媒は、Sigma-Aldrich(Oakville、ON、カナダ)またはFisher Scientific(Markham、ON、カナダ)から購入した。脱イオン水は社内供給から入手した。プロトン核磁気共鳴(1H NMR)スペクトルおよび炭素核磁気共鳴(13C NMR)スペクトルは、500 MHz Agilent DD2 スペクトロメーター(Santa Clara, CA, United States)で記録した。プロトンの化学シフトは、テトラメチルシランからのダウンフィールドの百万分の一(ppm)単位で報告され、NMR溶媒(CD3OD:δ3.31)中の残留プロチウムを参照している。炭素の化学シフトは、テトラメチルシランからのダウンフィールドでppmで報告され、溶媒の炭素共鳴を参照している(CD3OD:δ49.0)。データは、化学シフト(δ、ppm);多重度(s、一重項;d、二重項;ddd、二重項の二重項;q、四重項;m、多重項);積分;結合定数(J、Hz)プロトンの割り当てとして表される。プロトン共鳴は、2次元COSY、HSQC、およびHMBC実験に基づいて割り当てた。質量スペクトルは、Xevo TQ-XSタンデム三重四重極質量分析計(Watersブランド、Taunton、MA、米国)を用いて、電子スプレーイオン化(ESI+)を用いて記録した。高速液体クロマトグラフィー(HPLC)は、Waters Acquity UPLC(2.1×50 mm、粒径1.7 μm)を用いて、グラジエント溶出[アセトニトリル/水中0.100%(v/v)ギ酸/0.100%(v/v)ギ酸]を用いて,0.600 mL/minの流速で行った。UV検出は波長254nmで行った。
フェニルインダン(6)を修正した文献の手順(Stadler et al 1996)に従って調製した:カフェイン酸(4) (5.00 g, 27.8 mmol)を2.00 N硫酸(100 mL)の溶液に懸濁し、還流まで加熱した。溶液を還流下で4時間撹拌した後、室温まで冷却した。水相をジエチルエーテルで3回洗浄し、有機化合物を抽出した。有機抽出物を合わせ、無水硫酸マグネシウム上で乾燥し、濾過し、減圧下で濃縮して紫色の固体を得た。粗物質をシリカゲル上のフラッシュカラムクロマトグラフィー(勾配溶出、ヘキサン中10〜50%ジエチルエーテル)により精製した。集めた画分のアリコートを少量の1.00M水酸化ナトリウム水溶液で処理することにより、生成物画分を同定した;フェニルインダンに富む画分では濃い紫色が観察された。製品画分を回収し、減圧下で溶媒を除去して、約25%の未確認の副生成物を含む665 mgの茶色/オレンジ色の非晶質固体を得ました。この物質は、C18シリカゲル(1:9アセトニトリル:水)上での逆相フラッシュカラムクロマトグラフィーを用いてさらに精製された。生成物画分を合わせ、メチル-tert-ブチルエーテル(MTBE)で3回洗浄した。有機抽出物を合わせ、無水硫酸マグネシウム上で乾燥し、濾過し、減圧下で濃縮して、オレンジ色の非晶質固体を与えた。この物質をシリカゲル上のフラッシュカラムクロマトグラフィー(6:4 MTBE:ヘキサン)で再度精製し、オレンジ色の非晶質固体(204 mg、2.69%)として純粋な6を収得し、立体異性体(1.00:1.87 cis:trans)の混合物として単離した。NMRデータは、以前の文献報告(Stadler et al 1996)と一致している。TLC RF = 0.65 (ジエチルエーテル)。 シス-異性体。1H NMR(500 MHz、CD3OD):δ(ppm)6.69(d、1H、J = 8.0 Hz、H-5′)6.63(d、1H、J = 0.9 Hz、H-7)6.60(d、1H、J = 2.1 Hz、H-2′)6.53(ddd、1H、J = 8.1,2.1,0.4 Hz、H-6′)6. 27 (d、1H、J = 1.0 Hz、H-4)、3.94 (dd、1H、J = 10.6,7.1 Hz、H-1)、3.01 (m、1H、H-3)、2.58 (dd、1H、J = 12.0,6.9 Hz、H-2)、1.43 (ddd、1H、J = 12.0,10.4 Hz、H-2)、1.28 (dd、1H、J = 6.7 Hz、CH3)。13C NMR(125 MHz、CD3OD):δ(ppm)146.2,145.2,144.9,144.6,141.1,139.7,138.7,120.7,116.1,116.1,112.4,110.5,51.0,48.4,39.0,20.1.トランス異性体。1H NMR(500MHz、CD3OD):δ(ppm)6.65(d、1H、J = 8.0 Hz、H-5′)6.64(s、1H、H-7)6.49(d、1H、J = 2.1 Hz、H-2′)6.44(dd、1H、J = 8.1,2.2 Hz、H-6′)6.38(d、1H、J = 0. 8 Hz、H-4)4.13(dd、1H、J = 8.0,5.7 Hz、H-1)3.19(m、1H、H-3)2.14(dd、1H、J = 12.5,7.6,5.9 Hz、H-2)2.05(dd、1H、J = 12.5,8.1,5.5 Hz、H-2)1.17(d、1H、J = 6.7 Hz、CH3)。13C NMR(125 MHz、CD3OD):δ(ppm)146.1,145.4,145.1,144.3,141.5,139.6,138.7,120.1,116.1,115.7,112.7,111.0,50.0,46.7,38.9,21.3。HRMS(ESI、m/z)は、[C16H16O4](M)+ 272.1043のために計算された; 272.1047を発見した。C16H15O4] (M-H)+ 271.0965のために計算された; 発見:271。0970.
β-アミロイドThT凝集アッセイ
このアッセイは、LeVine(1993)から適応した。Aβ1-40(>95%)は、AnaSpec(Freemont、CA、米国)から購入し、-80℃で保存した。他のすべての試薬は、Sigma-Aldrich(Oakville、ON、カナダ)から購入した、利用可能な最高純度のものであり、さらなる精製なしで使用した。アッセイに使用したすべての水は、マイクロポアフィルターでろ過し、脱イオン(MilliQ®)した。Aβ1-40(1.00 mg)をヘキサフルオロ-2-プロパノール(HFIP)に溶解し、事前に形成された凝集体を分解するために30分間超音波をかけた。HFIPは、ボルテックスと10分間のソニケーションを使用して1.00 mLのトリス塩基(20.0 mM、pH10.0)でAβ1-40を溶解する前に、アルゴンガスのストリームを使用して除去した。この溶液を4.70 mLのトリス塩基でさらに希釈し、次いで濃塩酸を用いてpH7.40に調整し,0.200 μmのシリンジフィルターを用いてろ過した。前処理したAβ1-40を等量(5.70 mL)のTris(20.0 mM、pH7.40,300 mM NaCl)中の8.00 μM ThTで希釈し、この溶液の200 μLのアリコート[20.0 μM Aβ1-40および4.00 μM ThT in Tris(20.0 mM、pH7.40,150 mM NaCl)]を黒色ポリスチレン96ウェルプレートのウエルに添加した。4.00μLの様々な濃度の試験化合物溶液を各ウェルに添加した。各サンプルを3回に分けて実施し、MilliQ®水のみをビヒクルコントロールとして使用した。プレートを封印し、最初に15秒間高強度で振盪された後、15分ごとに記録された蛍光測定値(λex = 450nm、λem = 480nm)で37.0℃でマイクロプレートリーダー(Tecan Genios)でインキュベートし、各読書の前に10秒のために解決するために許可された。
β-アミロイドオリゴマー化アッセイ
このアッセイは、LeVine(2006)から適応された。ビオチン化Aβ1-42をAnaSpec(Freemont, CA, United States)から購入した。ELISAプレート(Costar 9018)を、リン酸ナトリウム緩衝液(10.0mM、pH7.50)中の1.00μg/mL NeutrAvidinを含むストック溶液の50.0μLでコーティングした。プレートを密封し、OFB-T緩衝液[20.0 mMリン酸ナトリウム、150 mM NaCl、pH 7.50,0.100% (v/v) Tween 20]の200 μL/wellで2時間室温でブロッキングする前に、一晩4℃で保存した。次いで、20.0μLのAβ1-42原液(0.100mg/mL)をHFIPで処理し、アルゴンの流れ下で乾燥させた。チューブに100μLのトリフルオロ酢酸(TFA)を添加し、アルゴンの流れの下で乾燥する前にボルテックスミキサーを用いてサンプルを溶解した。HFIPを添加し、ストリームまたはアルゴンの流れの下で乾燥させ、残留TFAを除去した。ビオチン化されたAβ1-42をDMSOの870μLに溶解し、溶液の2.00μLを96ウェルポリプロピレンプレート(Costar 3365)の各ウェルに添加し、OFB-T緩衝液(様々な濃度)で希釈した試験化合物の100μLに続いた。プレートを振盪せずに室温で1時間インキュベートした後、MilliQ®水で0.300%(v/v)のTween 20を50.0μL添加して停止した。ビオチン化されたAβ1-42/化合物溶液の50.0μLをNeutrAvidinTMコーティングプレートの各ウェルに添加し(ブロッキング溶液を除去した後)プレートを密閉し、150rpmで振とうしながら2時間インキュベートした。プレートを TBST 溶液[20.0 mM Tris-HCl, 34.0 mM 塩化ナトリウム, pH 7.50, 0.100% (v/v) Tween 20]で 3 回洗浄し、50.0 μL の OFB-T バッファー中の Streptavidin-HRP (1:20,000)を加え、プレートを密閉し、150 rpm で振とうしながら 1 時間インキュベートした。プレートを再びTBSTで3回洗浄し、続いて各ウェルにテトラメチルベンジジン/H2O2基質溶液100μLを添加した。反応は、プレートリーダーで450nmで吸光度を読む前に2.00%(v/v)水性硫酸の100μLの添加によって10〜30分後に停止した。
タウタンパク質の調製
ヒトtau40(tau)cDNAを、Taq DNAポリメラーゼ(ThermoFisher Scientific)を用いて、tauフォワードプライマー(5′-GCTGAGCCGCクロロゲン酸GTTCG-3′)およびtauリバースプライマー(5′-TCACAAACCCTGCTTGGCCAGG-3′)を用いて、ポリメラーゼ連鎖反応(PCR)により増幅した。Waltham, MA, United States)を用い、TAクローニングによりChampion pET SUMOベクター(ThermoFisher Scientific, Waltham, MA, United States)にクローニングした。TOP10大腸菌株に形質転換した後、T7逆プライマー(5′-TAGTTATTGCTCAGCGGTGG-3′)とタウ内部フォワードプライマー(5′-CGCATGGTCAGTAAAAGCAAA-3′)を用いたコロニーPCRにより、正しい配向を有するコロニーを選択した。プラスミドDNAを調製し、配列決定を行い、正しい配列のものを選択した。 次に、pET SUMO タウベクターをBL21(DE3)大腸菌株に形質転換し、遺伝子発現を行った。pET SUMO tauベクターを導入したBL21(DE3)大腸菌を培地71757(Overnight ExpressTM Instant LB Medium – Novagen with kanamycin)で増殖させた。発現は、遠心分離によって細胞を収穫する前に7時間維持された。収穫した大腸菌を、氷中で1.00% (v/v) Triton X-100/50.0 mM Tris-HCl/pH 7.40/500 mM NaCl/EDTAフリープロテアーゼ阻害剤カクテル(ロシュ、ドイツ)の存在下で超音波溶出により溶解させた。20,000×gでの遠心分離により不溶性の破片を除去した後、可溶性ライセートを回収した。6×Hisタグを有するSUMO-tauをTalon IMAC樹脂(Clonetech, Mountain View, CA, United States)を介した溶出により精製し、溶出液を50.0 mM Tris-HCl/pH 7.40/150 mM NaCl/1.00 mM dithiothreitol/0.200% (v/v) NP40に対してダイアル化した。6×His-SUMOタグをSUMOプロテアーゼで切断し、タグフリーのタウタンパク質をTalon IMACカラムを介した溶出により回収した。タグフリーのタウタンパク質は、C18カラム(150×21.2mm、粒径5.00μm)を用いた分取逆相HPLCにより、4.00 mL/minの流速でグラジエント溶出[1-30%アセトニトリル/0.100%(v/v)ギ酸 in MilliQ®水/0.100%(v/v)ギ酸]を用いてさらに精製した。UV検出は波長220nMで行った。
タウThS凝集アッセイ
このアッセイは、Friedhoffら(1998)から適応された。5.00μM ThS in Tris(50.0mM、pH7.40,10.0μg/mLヘパリン、1.00mMジチオスレイトール、50.0μMアジ化ナトリウム)中のタウの4.00μM溶液を各実験のために新鮮に調製し、200μLのアリコートを黒色ポリスチレン96ウェルプレートのウェルに添加した。様々な濃度の化合物溶液の4.00μLを各ウェルに添加した。各サンプルは、3回に分けて実行され、MilliQ®水だけでは、ビヒクルコントロールとして機能した。プレートを封印し、15分ごとに記録された蛍光測定値(λex = 450 nm、λem = 480 nm)で37℃でマイクロプレートリーダー(Tecan Genios)でインキュベートした。
α-シヌクレインオリゴマー化アッセイ
このアッセイは、El-Agnaf et al 2004)から適応した。キャプチャー抗体(α-シヌクレイン211)および検出抗体(α-シヌクレイン211,HRP)は、Santa Cruz(Freemont, CA, United States)から購入し、4℃で保存した。α-シヌクレインは、rPeptide(Watkinsville, GA, United States)から購入し、-80℃で保存した。DMSO中のα-シヌクレインの0.100mg/mLストック溶液を調製し、1.80μgのα-シヌクレインを5.00mLのリン酸緩衝生理食塩水(PBS)で希釈し、ボルテックスを用いてよく混合し、50.0μLのアリコートを低結合プレート(Costar)の各ウェルに添加した。PBSで様々な濃度の化合物溶液を調製し、α-シヌクレインを含むプレートの各ウェルに50.0μLのアリコートを添加した。このプレートをエッペンドルフプレートシェーカーを用いて20℃で450rpmで45秒間振盪した後、振盪せずに室温で16時間インキュベートした。反応を停止し、MilliQ®水に0.300% (v/v) Tween 20を50.0μL添加し、穏やかに混合した。10.0 mMリン酸ナトリウム/PH 7.50中のキャプチャー抗体50.0 μLを高結合ELISAプレート(Costar)の各ウェルに添加し、4℃で一晩静置した。ブロッキング後のプレートをTBSTで3回洗浄した後、各ウェルに試験化合物/α-シヌクレイン溶液50〜100μLを添加し、プレートを密封して室温で2時間インキュベートした。プレートを密封し、室温で1時間インキュベートした後、TBSTで3回洗浄した。テトラメチルベンジジン/H2O2基質溶液100μLを各ウェルに添加した。プレートリーダーで450nmの吸光度を読み取る前に,0.118M硫酸100μLの水溶液を添加して25〜30分後に反応を停止させた。
統計解析
データ分析は、GraphPad Prismソフトウェア(バージョン7.04; GraphPad Software, San Diego, CA, United States)を用いて行った。差は、P < 0.05で統計的に有意であると考えられた。フィブリル化データは、平均値±標準偏差で表された;阻害率は、分析物を含まないビヒクルコントロールサンプル(阻害率0%とした)と比較して計算された。阻害率の群間差は、各濃度レベルにおける焙煎レベル(ライトローストとダークロースト)とカフェイン含有量(カフェイン入りダークとカフェイン抜きダーク)の要因を調べるために、双方向ANOVAを用いて評価した。コーヒー成分 2~6 の阻害効果は、一方向 ANOVA とポストホック Dunnett 検定を用いて分析した。
IC50値は、最小二乗回帰(R2 > 0.9)を用いて用量反応曲線に当てはめて外挿した。IC50値の群間差は、各因子(焙煎レベルまたはカフェイン含有量)について、対をなしていない両側 t 検定を用いて分析した。多重比較の実行にはボンフェローニ補正を適用した(P = 0.05/2検定)。
結果
コーヒーの抽出物とカフェイン
私たちはまず、インスタントコーヒー抽出物の凝集抑制活性を評価することから始めた。私たちは、ライトロースト、ダークロースト、およびカフェインレスダークローストの 3 つの異なるタイプのコーヒーを調査することを選択した。カフェイン含有量の効果は、カフェインレスとカフェインレスのダークローストコーヒー抽出物の活性を比較することによって評価される。さらに、焙煎レベルの違いがコーヒーの組成に影響を与えることが知られているため(Farah et al 2005; Jaiswal et al 2012)ライトローストとダークローストのコーヒー抽出物を比較した。コーヒー抽出物のフィブリラー凝集体の形成を阻害する能力を、Aβに対するThT蛍光アッセイ(図22)とタウに対するThS蛍光アッセイ(図33)を用いて調査した。
図2 Aβペプチドのフィブリル化
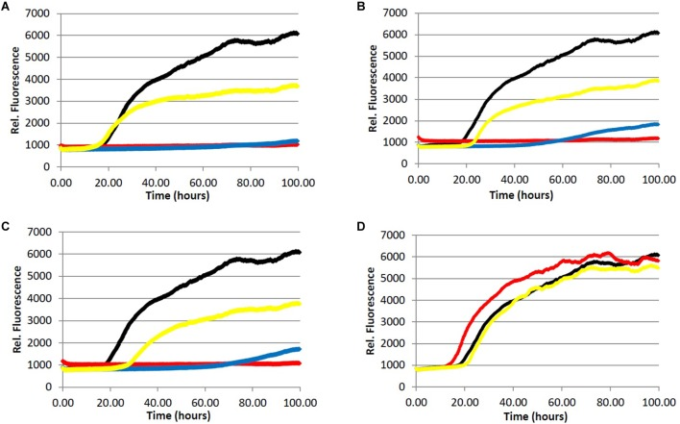
Tris緩衝液(20.0 mM, pH 7.4, 150 mM NaCl)中の20.0 μM Aβ1-40を、4.0 μM ThTおよび可変濃度の分析物の存在下、37.0℃でインキュベートした。(赤)=200μg/mL、(青)=40.0μg/mL、(黄)=5.0μg/mL、(黒)=0.0μg/mL(ビヒクルコントロール)。A)ライトローストインスタントコーヒー抽出物。B)ダークローストインスタントコーヒー抽出物。C)カフェインレスダークローストコーヒー抽出物。D)カフェイン1.
図3 タウタンパク質のフィブリル化
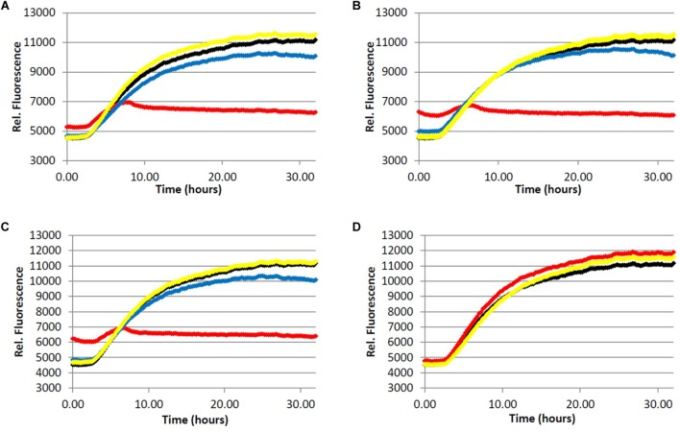
Tris緩衝液(50.0mM、pH7.4,10.0μg/mLヘパリン、1.0mMジチオスレイトール、50.0mMアジ化ナトリウム)中の4.0μMタウを、5.0μM ThSおよび可変濃度の分析物の存在下、37.0℃でインキュベートした。(赤)=200μg/mL、(青)=40.0μg/mL、(黄)=5.0μg/mL、(黒)=0.0μg/mL(ビヒクルコントロール)。A)ライトローストインスタントコーヒー抽出物。B)ダークローストインスタントコーヒー抽出物。C)カフェインレスダークローストコーヒー抽出物。D)カフェイン1.
3つのコーヒー抽出物はすべて、200μg/mLの濃度でAβおよびタウタンパク質の両方のフィブリル化を阻害し、Aβフィブリルについては5μg/mLの濃度で中等度の阻害レベルが維持された(表11)。タウのフィブリル化については、40μg/mLのコーヒー抽出物(表22)において、わずかではあるが測定可能なレベルの阻害が観察された。Aβフィブリル化については、ローストレベル(ライトロースト対ダークロースト)およびカフェイン含有量(ダークロースト対カフェインレスダークロースト)の主な影響は観察されなかった。タウフィブリル化については、ローストレベルの効果が観察された(P = 0.0059)が、200μg/mLの濃度でのみ(P < 0.0001);カフェイン含有量の効果は認められなかった。カフェイン含有量が凝集抑制に影響を及ぼさないことに驚いたので、純粋なカフェイン(1)の事後分析を行った(一方向ANOVA)。ビヒクルコントロールと比較して、フィブリル増殖に対する効果は観察されず、カフェイン入りコーヒー抽出物とカフェイン抜きコーヒー抽出物の結果と一致した。
表1 コーヒー抽出物による ThT 蛍光アッセイにおける Aβフィブリル形成阻害作用
| 濃度(μg/ mL) | ライトローストコーヒー抽出物(%阻害) | ダークローストコーヒー抽出物(%阻害) | カフェイン抜きのダークローストコーヒー抽出物(%阻害) | カフェイン(1)b(%阻害) |
|---|---|---|---|---|
| 200 | 98.5±1.0 | 100.1±1.8 | 100.5±1.5 | -5.4±3.5 |
| 40.0 | 96.6±1.0 | 88.4±1.6 | 94.9±1.4 | – |
| 5.0 | 46.6±2.2 | 46.5±2.2 | 47.4±2.5 | 5.7±3.0 |
表2 コーヒー抽出物による ThS 蛍光アッセイにおけるタウフィブリル形成阻害作用
| 濃度(μg/ mL) | ライトローストコーヒー抽出物(%阻害) | ダークローストコーヒー抽出物(%阻害) | カフェイン抜きのダークローストコーヒー抽出物(%阻害) | カフェイン(1)c(%阻害) |
|---|---|---|---|---|
| 200 | 86.2±1.0 | 102.6±2.4 | 95.8±2.1 | -4.2±3.4 |
| 40.0 | 17.0±2.4 | 17.7±2.4 | 17.6±2.3 | – |
| 5.0 b | -4.5±3.2 | -5.5±3.3 | -0.9±2.9 | -4.0±3.2 |
a%阻害率は、ビヒクルコントロールサンプル(阻害率0%とした)と比較して計算され、3つの別々の実験の平均±標準偏差として報告されている。
aビヒクルコントロール試料に対する相対的に計算された阻害率(阻害率0%とした)であり、3回の別々の実験の平均値±標準偏差として報告されている。
また、コーヒー抽出物は、Aβおよびα-シヌクレインのオリゴマー化を阻害する能力についても調査した。コーヒー抽出物とカフェインのIC50値を表33に示す。すべてのコーヒー抽出物は、100μg/mL以上の濃度でAβに対して強力な凝集阻害活性を示し、α-シヌクレインに対してはプロ凝集作用を示した。さらに、ダークローストコーヒー抽出物は、ライトローストコーヒー抽出物よりもAβのオリゴマー化に対してより強力な凝集阻害活性を示し(P<0.001)カフェインレスダークローストコーヒー抽出物は、カフェインレスダークローストコーヒー抽出物とほぼ同一の効力を示した(P>0.9)。純粋なカフェイン(1)は、Aβまたはα-シヌクレインのオリゴマー化を阻害することができず、測定可能なIC50値は得られなかった。
表3 コーヒー抽出物とカフェインのオリゴマーアッセイにおけるIC50値
| エキス | AβIC 50濃度(μg/ mL)を | α-シヌクレインIC50(μg/ mL) |
|---|---|---|
| ライトローストコーヒーエキス | 40.3±4.6 | プロアグリゲート |
| ダークローストコーヒーエキス | 9.5±1.7 | プロアグリゲート |
| カフェイン抜きのダークローストコーヒー抽出物 | 9.4±1.5 | プロアグリゲート |
| カフェイン(1) | ND | ND |
コーヒー成分
観察された凝集抑制活性の原因となっているコーヒー抽出物中の有効成分を特定するために、コーヒーの個々の成分の代表例として図11に示す化合物を測定した(成分の選択方法の根拠については後述の考察の項を参照)。全ての化合物は100μMでAβフィブリルの形成を阻害することができたが、対照試料と比較してAβフィブリルの成長を促進することが見出されたキナ酸(3)を除いては(図4A4Aおよび5A5A)Aβフィブリルの形成を阻害することができた。タウのフィブリル化(図4B4Bおよび5B5B)は、100μMでは化合物2〜4の影響を受けなかったが、5および6では測定可能な阻害効果が観察された(それぞれ23.7および95.2%の阻害)。Aβおよびタウの両方に対する6の強力な活性を考慮して、フェニルインダン(6)を20μMの低濃度で線溶化アッセイで再スクリーニングした;Aβ線溶化は完全に阻害されたままであり(図5A5A)タウの阻害の中程度のレベルが維持された(図5B5B)。2-6によるAβおよびタウフィブリル化の%阻害についての計算値を表4に示す。
図4 (A) Aβペプチドのフィブリル化
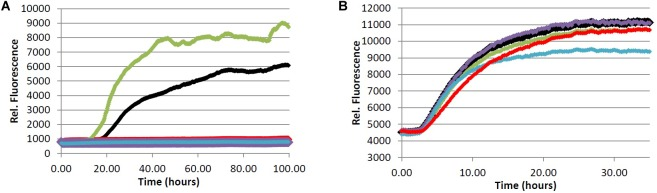
Tris緩衝液(20.0 mM, pH 7.4, 150 mM NaCl)中の20.0 μM Aβ1-40を、4.0 μM ThTおよび100 μMの分析物の存在下、37.0℃でインキュベートした。(B) タウタンパク質のフィブリル化。Tris緩衝液(50.0mM、pH7.4,10.0μg/mLヘパリン、1.0mMジチオスレイトール、50.0mMアジ化ナトリウム)中の4.0μMタウを、5.0μM ThSおよび100μMの分析物の存在下で37.0℃でインキュベートした。(赤)=クロロゲン酸(2)、(緑)=キナ酸(3)、(紫)=カフェイン酸(4)、(青)=ケルセチン(5)、(黒)=化合物なし(ビヒクルコントロール)。
図5 フェニルインダン6によるフィブリル形成の阻害
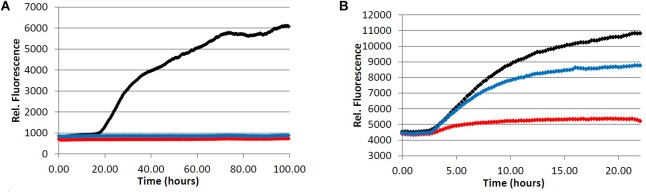
(A) Aβペプチドのフィブリル化。Tris緩衝液(20.0 mM, pH 7.4, 150 mM NaCl)中の20.0 μM Aβ1-40を、4.0 μM ThTおよび可変濃度の分析物の存在下、37.0℃でインキュベートした。(B) タウタンパク質のフィブリル化。Tris緩衝液(50.0mM、pH7.4,10.0μg/mLヘパリン、1.0mMジチオスレイトール、50.0mMアジ化ナトリウム)中の4.0μMタウを、5.0μM ThSおよび分析物の可変濃度の存在下で37.0℃でインキュベートした。(赤)=100μM、(青)=20.0μM、(黒)=0.0μM(ビヒクルコントロール)。
表4ThTおよびThS蛍光アッセイにおける2-6によるAβおよびタウのフィブリル形成阻害
| コーヒー成分 | Aβフィブリル阻害(%) | タウフィブリル阻害(%) |
|---|---|---|
| クロロゲン酸(2) | 97.7±0.7 | 3.4±2.9 B |
| Quinic acid (3) | -48.8±2.8 | 6.7±3.0 B |
| コーヒー酸(4) | 99.4±0.9 | -2.6±3.4 B |
| ケルセチン(5) | 97.9±0.4 | 23.7±2.4 |
| フェニルインダン(6) | 99.0±0.4 | 95.2±1.7 |
| フェニルインダン(6)c | 99.2±0.4 | 34.4±2.4 |
aサンプル2〜6は100μMの濃度でスクリーニングした。Aβの凝集は、ThT蛍光アッセイを用いて測定した;データは、3つの別々の実験の平均±標準偏差として報告されている。タウの凝集は、ThS蛍光アッセイを用いて測定した;データは、3つの別々の実験の平均±標準偏差として報告されている。阻害率は、ビヒクルコントロール(0%の阻害として取られる)に相対的に計算された。 bビヒクルコントロールに相対的に有意な効果なし。
コーヒー成分2〜6をオリゴマー化アッセイでも試験し、Aβおよびα-シヌクレインのIC50値を表55に示す。成分2,3およびカフェイン酸(4)はアッセイ条件下でAβのオリゴマー化を阻害することができなかったが、ケルセチン(5)およびフェニルインダン(6)は、それぞれ10.3μMおよび42.1μMのIC50値を有するAβオリゴマー化のかなり強力な阻害剤として同定された。α-シヌクレインのオリゴマー化は、2,3およびフェニルインダン(6)によって影響を受けなかったが、100μM以上の濃度でカフェイン酸(4)およびケルセチン(5)の存在下では、α-シヌクレインのプロ会合効果が観察された。
表5 オリゴマーアッセイにおけるコーヒー成分2〜6のIC50値
| コーヒー成分 | AβIC 50(μM) | α-シヌクレインIC50(μM) |
|---|---|---|
| クロロゲン酸(2) | ND | ND |
| キナ酸(3) | ND | ND |
| コーヒー酸(4) | ND | プロアグリゲート |
| ケルセチン(5) | 10.3±1.1 | プロアグリゲート |
| フェニルインダン(6) | 42.1±1.4 | ND |
議論
カフェイン
カフェインの知覚された利点(1)は、カフェインの観察された神経保護効果が選択的A2A受容体アンタゴニスト(Canas et al 2009)またはA2Aノックアウトマウス(Chen et al 2001; Canas et al 2009)を用いて再現されているので、主にA2A受容体アンタゴニストとしての作用に起因している。実験室実験では、カフェイン治療は、β-セクレターゼ(BACE1)およびプレセニリン1(PS1)/γ-セクレターゼの両方の発現の抑制を介して、ADモデルのマウスにおいて、作業記憶を改善し、脳のAβ負荷を減少させることができることも示されている(Arendash et al 2006,2009)。2006, 2009)1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)誘導毒性モデルにおける運動機能の改善やドーパミン枯渇の抑制などが報告されている(Chen et al 2001; Xu et al 2010)。しかし、コーヒーの神経保護効果がカフェイン成分によるものかどうかについては、まだ曖昧な点がある:ショウジョウバエのADとPDのモデルでは、カフェイン入りコーヒーとカフェイン抜きコーヒーの摂取は同じ神経保護効果をもたらしたが、純粋なカフェインはこの系では治療効果が得られなかった(Trinh er al)。 著者らは、(脱)カフェインコーヒーの利点は、Nrf2依存性の抗酸化経路への作用にあるとしており、疾患に関連する神経炎症から保護するとしている。カフェイン(1)は、ADやPDに関連するBBBの変性から保護することも知られており(Chen et al 2010)、コーヒーの神経保護効果にも寄与している可能性がある。
カフェインの脳内アミロイド原性タンパク質の凝集を防止する能力に関して、以前の報告では、カフェイン(1)は、モノマーまたは小さな凝集体と疎水性接触を形成することにより、Aβの凝集を阻害する可能性が示唆されている(Sharma and Paul, 2016; Sharma er al)。 この系では、Aβフィブリル化に対するカフェインの控えめではあるが観察可能な効果は、カフェイン:Aβ比3:1で発生し、カフェインのモル過剰10倍以上で達成された有意なレベルの阻害を有する。我々の結果は、カフェイン(1)の任意の神経保護特性は、カフェインは、我々のフィブリル化アッセイ(図2D2Dおよび3D3D)でAβ(50倍モル過剰カフェイン)またはタウの凝集プロファイルを変更することができなかったように、アミロイド原性タンパク質またはADに関連付けられているタンパク質の凝集体との関連付けに起因していないことを示唆している。実験結果の違いは、アッセイ条件の違いによるものと思われ、先行研究では(今回の調査で使用したAβ1-40ではなく)切り捨てられたAβ16-22を使用して実施し、アッセイは純水中で実施しており、当グループが実施した計算シミュレーションを忠実に再現しようとしている。この驚くべき実験結果の違いは、凝集プロセスの複雑さを浮き彫りにし、実験結果を生体内試験環境に翻訳できるようにするために、生理学的条件を密接に模倣したアッセイ条件を設計することの重要性を物語っている。溶液のpH、緩衝液組成、Aβまたはタウの濃度などの変化は、実験結果にばらつきを生じることが知られており(LeVine、1993; Tiiman et al 2015)生物学的環境を最も代表するアッセイ条件は、生体システムで再現される可能性が高くなる。しかしながら、試験管内試験での結果が生体内で再現されるという保証はなく、試験管内試験データの解釈の際には注意が必要である。カフェイン(1)のより高い濃度のカフェイン(1)は、コーヒー抽出物が同濃度のカフェインよりも強力な凝集阻害活性を示したことを考慮して、調査しなかった(図22および図33,表11〜33)。
カフェイン(1)もまた、α-シヌクレインのオリゴマー化を阻害することができず、プロ凝集作用は観察されなかった(表33)。この結果は、カフェイン(1)の存在下でのα-シヌクレインのフィブリル化に関する以前の報告(Kardani and Roy, 2015)と一致している:カフェイン(1)の存在下で増殖したフィブリルは、カフェイン(1)の非存在下で増殖したフィブリルと比較して異なる形態を示したが、著者らは、これはカフェイン(1)とα-シヌクレインタンパク質との相互作用によるものではないと主張している。カフェイン(1)とAβ/tau/α-シヌクレインとの間の観察可能な相互作用の欠如は、コーヒー抽出物の観察された活性がカフェイン成分によるものではないことを示唆しているであろう。カフェイン(1)は、より高い濃度で凝集阻害活性を有する可能性があるが、コーヒーに含まれる他の成分は、タンパク質凝集のより強力な阻害剤である可能性がある。カフェイン入りコーヒー抽出物とカフェイン抜きコーヒー抽出物の間で観察された同等の活性は、この仮説を支持するものである。
クロロゲン酸
クロロゲン酸(CGA)はコーヒー豆に含まれる主要なポリフェノール酸であり、生豆(未焙煎)コーヒー豆の乾燥重量の最大 15%を占めている。クロロゲン酸 には 9 種類の異性体が確認されており、主要な異性体は 5-O-カフェオキノリン酸(2)で、クロロゲン酸 全量の約 60%を占めている(Farah and Donangelo, 2006)。典型的な一杯のコーヒーには、豆の種類や焙煎方法によって異なるが、70~300mgのクロロゲン酸が含まれている(Farah and Donangelo, 2006; Ludwig er al)。 クロロゲン酸は、腸管吸収を介して血流に入ることが知られており(Olthof et al 2001)抗がん作用、抗血栓作用、抗炎症作用、血糖降下作用のために、様々な健康上の利点と相関している(Johnston et al 2003; Feng et al 2005; dos Santos et al 2006; Lee and Zhu et al 2006; Park et al 2009)。クロロゲン酸の潜在的な健康上の利点とそのバイオアベイラビリティを考えると、クロロゲン酸の調査が必要であると感じた。クロロゲン酸 の主要成分である 5-O-カフェオキノリン酸(2)をコーヒーに含まれる クロロゲン酸 の代表例として試験した。
かなりの文献の体は、試験管内試験での様々な神経細胞株へのクロロゲン酸の投与が、酸化ストレスの条件下または神経毒の存在下で細胞の生存率を改善することができることを示している(Anggreani and Lee, 2017; Nabavi et al 2017)。神経保護効果は、活性酸素種による損傷から細胞を保護するクロロゲン酸の高い抗酸化能力に起因していた。また、クロロゲン酸処理がリポ多糖類(LPS)刺激時のミクログリアのプロ炎症反応を減衰させることも実証されている(Shen et al 2012)。我々のデータは、クロロゲン酸(2)が100μMでのThTアッセイにおいてAβフィブリル化の強力な阻害剤であることを示している(図4A4A)これは、クロロゲン酸(2)によるAβフィブリル化の阻害のための約40μMのIC50値の以前に報告された値と一致している(Masuda et al 2006)。しかしながら、クロロゲン酸(2)はAβのオリゴマー化を阻害することができなかった(表55)ことから、クロロゲン酸(2)のモノマー/オリゴマー性Aβタンパク質との相互作用は、より大きなAβ凝集体との相互作用とは異なることが示唆される。このような効果は以前にも報告されており、小さな有機分子は、より小さなオリゴマー凝集体を安定化することによって、より大きなAβ凝集体の形成を阻害していた(Masuda er al)。 2とAβとの相互作用に関する我々のデータは、この種の挙動と一致している。
タウのフィブリル化は、100μMでの2の存在下では影響を受けなかった(図4B4B)が、これは再び文献データ(Masuda et al 2006)と一致しており、クロロゲン酸(2)とα-シヌクレインとの間の観察可能な相互作用は、我々のオリゴマー化アッセイでは検出されなかった(表55)。しかしながら、クロロゲン酸(2)は、α-シヌクレイン凝集の合理的に強力な阻害剤であることが報告されており、フィブリル化阻害のためのIC50は約80μMである(Masuda et al 2006)。α-シヌクレインのオリゴマー化に対するクロロゲン酸(2)の観察可能な阻害効果がないことから、2はα-シヌクレインの大小の凝集体と異なる相互作用を示し、クロロゲン酸(2)はAβで観察されるのと同様に、より小さなオリゴマー種の安定化を介してα-シヌクレインの線維化を阻害する可能性があることを示唆している(Masuda er al)。 Aβ、タウおよびαシヌクレインの可溶性アミロイドオリゴマーが共通の構造的特徴を共有していることを考えると(Kayed er al)。
クロロゲン酸 は非常に生物学的に利用可能であるが、2 (クロロゲン酸)のような化合物は BBB を越える可能性が低いことが実証されている(Lardeau and Poquet, 2013)。このように、コーヒーに含まれる クロロゲン酸 は脳内のアミロイド原性タンパク質の凝集を阻害する可能性は低いと考えられる。神経保護の二次的なメカニズムを排除することはできない。クロロゲン酸を投与された虚血ラットモデルでは、感覚運動機能の改善と対照群と比較して脳圧迫のレベルが低下したことが示された(Ahn et al 2011)。虚血性イベントはADの進行と相関しており(Kalaria, 2000)コーヒーに含まれるクロロゲン酸の消費は、低BBBの浸透性にもかかわらず、神経保護効果を有する可能性がある。それにもかかわらず、クロロゲン酸(2)は比較的高濃度でしかAβの凝集を抑制することができないこと、タウやα-シヌクレインとの相互作用が観察されないことを考えると、コーヒー抽出物の観察された凝集抑制活性には、クロロゲン酸(2)や淹れたコーヒーに含まれる他のクロロゲン酸が関与している可能性は低いと考えられる。
キナ酸とカフェイン酸
コーヒー豆の焙煎中に、クロロゲン酸 はエステルの開裂過程を経てキナ酸(3)と様々なフェノール性シナメートに変換される。典型的なライトローストのコーヒー豆では、初期の クロロゲン酸 含有量の約 25%が失われるのに対し、ミディアムローストのコーヒー豆では 45%、ダークローストのコーヒー豆では 90%の クロロゲン酸 含有量が失われる(Trugo and Macrae, 1984; Ludwig er al)。 焙煎中に失われた クロロゲン酸 の大部分は、メイラード反応を経てメラノイアンに取り込まれる。難消化性ではあるが、メラノイド類は、有益なタイプの腸内細菌の成長を促進し、食物繊維として作用することにより、プレバイオティクスの機能を果たす可能性がある(Reichardt et al 2009)が、血流に吸収されないという理由で、我々の調査からは省略された。カフェイン酸(4)は、5-O-カフェオキノリン酸(2)(コーヒー豆に含まれる主要な クロロゲン酸 成分 (Farah and Donangelo, 2006))のエステル開裂により形成されるため、コーヒーに含まれるフェノール性シナメートの代表例として、生物学的に利用しやすい (Olthof et al 2001) カフェイン酸(4)を選んだ。キナ酸(3)もまた、タンパク質凝集試験で試験したが、遊離のキナ酸(3)の一部は焙煎中に1,5-ラクトンに変換されることは注目に値する(Farah and Donangelo, 2006)。しかし、3はAβ、タウまたはαシヌクレインの凝集阻害剤としての観察可能な活性を示さなかった。
カフェイン酸(4)は抗酸化作用を有することが知られており(Guillot et al 1996; Gulcin, 2006)、関連するエステル誘導体であるロスマリン酸は、試験管内試験でAβ、タウおよびα-シヌクレインの線維化を阻害することが示されている(Masuda et al 2006)。これらの以前の実験と一致して、我々のアッセイは、カフェイン酸(4)がAβフィブリル化の効果的な阻害剤であることを示している(図4A4A)が、Aβオリゴマー化に対する阻害効果は観察されなかった(表55)。カフェイン酸(4)はまた、ADの他の特徴的なタンパク質集合体であるタウ(図4B)のフィブリル化を阻害することができなかった。Aβおよびタウに対する2およびカフェイン酸(4)の類似の挙動は、凝集アッセイにおいてキナ酸(3)が観察可能な阻害効果を有さなかったことを考えると、観察された2の活性はヒドロキシ桂皮酸部位(すなわち、カフェイン酸(4))によるものであることを示唆しているであろう。注目すべきことに、カフェイン酸(4)は、100μMを超える濃度でα-シヌクレインの凝集を誘導することが観察された(表5)が、これは、レビー小体形成を促進し、従って脳内の有毒オリゴマー種の濃度を減少させることによって神経保護効果を有し得る(Pinotsi et al 2016;小野 2017)。しかし、α-シヌクレインの凝集を誘導するのに必要なカフェイン酸(4)の高濃度は、生体内に蓄積される可能性は低い。
カフェイン酸(4)およびその誘導体が血流に入る能力があるにもかかわらず、このタイプの化合物はBBBを貫通する可能性が低いことが実証されている(Lardeau and Poquet, 2013)。したがって、コーヒーの神経保護効果がこれらの成分に由来するとは考えにくい。しかし、ポリフェノールが腸内マイクロバイオームに作用するという二次的なメカニズムも否定できない(Olthof er al)。 ホルモンの分泌と分子吸収の変化は、最終的には脳内の神経毒性化合物の蓄積を減少させることにつながる可能性があるが、そのような効果を特定するためにはさらなる調査が必要である。それにもかかわらず、3およびカフェイン酸(4)はAβのオリゴマー化を阻害しなかったこと、タウについては凝集阻害活性が観察されなかったことを考えると、これらのコーヒー成分がコーヒー抽出物の観察された活性に関与しているとは考えにくい。
ケルセチン
コーヒー豆に含まれる主な成分はカフェインとクロロゲン酸であるが、低濃度ではあるが様々なフラボノイドも確認されている。コーヒーのフラボノイドとして知られているケルセチン(5)は、酸化ストレスや炎症を緩和する抗酸化作用があると報告されている(Guillot er al)。 また、ケルセチン(5)がグルタチオン(GSH)発現を増加させ、抗酸化/抗炎症性神経保護の追加のメカニズムを提供することも実証されている(Lee et al 2016)。実際、最近、カフェイン(1)ではなくケルセチン(5)がコーヒーの神経保護効果を担う成分であることが示唆されているが(Lee et al 2016)著者らは抗酸化/抗炎症経路に基づくメカニズムを示唆している(タンパク質凝集の阻害は本報告では調査されていない)。5ケルセチン(5)とその代謝物は、バイオアベイラビリティが低いにもかかわらずラットの脳内に蓄積することが薬物動態データで示されている(石坂 et al 2011)[経口投与後の吸収率は約 20%である(Chen et al 2005)]。
以前の報告(Masuda er al 2006; Matos er al 2017)と一致して、我々は、ケルセチン(5)がAβ凝集の強力な阻害剤であることを観察した(図4A、表5)しかしながら、100μMの5の負荷は、タウフィブリル化に対する中程度の阻害効果しか示さなかった(図4B)これは、以前のデータ(ケルセチン(5)によるタウフィブリル化に対するIC50>200μMの報告)(Masuda er al 2006)と再び一致していた。しかしながら、文献データとは対照的に、はα-シヌクレインのフィブリル化を阻害するのではなく、α-シヌクレインの凝集を促進することができることが観察された(表55)(Masuda et al 2006)。この不一致は、アッセイ条件(オリゴマーアッセイとフィブリルアッセイ)の違いに起因していると考えられ、このことは、ケルセチン(5)がモノマー/オリゴマーのα-シヌクレインおよびその成熟した凝集体と異なる相互作用をすることを示唆している。実際、そのような効果は以前に記載されている(Zhu et al 2013);ケルセチン(5)は、フィブリル化の前に形成されるより小さいオリゴマー種の安定化を介してα-シヌクレインフィブリルの形成を阻害する。ケルセチン(5)によるα-シヌクレインモノマー/オリゴマーの共有結合的修飾は、親水性表面積の増加をもたらし、水性媒体中でα-シヌクレイン-クエルセチン付加体を安定化し、さらなる凝集を防止する。また、5は、同様のメカニズムを介してAβの小さなオリゴマー凝集体の形成を促進する可能性が示唆されており、これは神経毒性を有する可能性がある(Matos et al 2017)。しかしながら、我々のAβオリゴマー化アッセイでは、ケルセチン(5)のプロ凝集効果は観察されず(表5)実際には、ケルセチン(5)はAβオリゴマー化の効果的な阻害剤であることが示された(IC50 = 10.3μM)。
我々のデータは、文献報告と合わせて、焙煎コーヒー中のケルセチン(5)が、その既知の抗酸化/抗炎症特性に加えて、脳内の病原性Aβの凝集を阻害することにより、生体内試験での神経保護を提供する可能性を示唆している(Sabogal-Guuaqueta et al 2015; Lee et al 2016)。しかしながら、ケルセチン(5)がタウフィブリル化を阻害することができないことは、ADに関連するタンパク質のミスフォールディング障害を治療するための治療薬としての効力を制限している。さらに、共有結合修飾を介してα-シヌクレインのオリゴマー凝集体を促進し、安定化させる5の性質は、PD病理を治療するためにケルセチン(5)を使用することの潜在的な欠点である。また、ケルセチン(5)は、より大きなフィブリル凝集体を犠牲にして、より小さなα-シヌクレインのオリゴマー凝集体を形成し得ることも示されている(Zhu et al 2013)。これは、フィブリル形成が神経保護的であることが疑われているため、別の欠点である。
フェニルインダン
フェニルインダンは、コーヒー豆の焙煎中にカフェイン酸などのシナメートの水酸化物から生成される(Guillot et al 1996; Stadler et al 1996)。フェニルインダン類は、エスプレッソなどのダーク焙煎コーヒー(焙煎時間が長い)に多く含まれており、ダーク焙煎ブレンドの苦味の主な原因となっている(Frank er al)。 コーヒーに含まれるフェニルインダンは、5-O-カフェオキノリン酸(2)、カフェイン酸(4)、ケルセチン(5)よりも驚くほど強力な抗酸化活性を示すことが報告されているが、アミロイド原性タンパク質と相互作用する能力はまだ報告されていない。ライトローストとダークローストのコーヒー抽出物の間に見られる活性の違い(表22と33)を考慮すると、このコーヒー成分の調査が必要であると考えた。
フェニルインダン混合物 6(1.00:1.87 シス:トランス 6)は、Aβフィブリル化アッセイ(図 5A)と Aβオリゴマー化アッセイ(表 5)の両方において、強力な凝集阻害活性を示すことが観察された。さらに、フェニルインダン(6)は他のどの化合物よりも強力なタウ凝集阻害活性を示した(図5B)。コーヒー抽出物のAβオリゴマー化試験(表33)では、カフェイン抜きとカフェイン抜きの両方のダークローストコーヒー抽出物がライトローストコーヒー抽出物に比べてより強力なレベルの凝集阻害を示しており(表33)ダークローストコーヒー豆ではフェニルインダン(6)の量が多いことから、コーヒー抽出物のAβとタウの両方について観察された凝集阻害活性の主な原因はフェニルインデン(6)の成分であることが示唆される。コーヒー豆を焙煎する前にカフェイン抜きを行うことから、両タイプのダークローストコーヒーで同程度の量のフェニルインダン(6)が生成されていると仮定するのが妥当である(焙煎時間も同様であると仮定する)。
ライトローストからダークローストへの焙煎時間の増加は、ダークローストコーヒーブレンド中のケルセチン配糖体の加水分解を介してケルセチン(5)濃度の増加にもつながり(配糖体の加水分解はケルセチンアグリコン5の濃度を増加させる可能性がある)ダークローストコーヒー抽出物の凝集抑制活性の増加と相関している可能性があると論じられる。しかし、熱分解(焙煎)条件下では、ケルセチン配糖体の濃度は低下するが、ケルセチン(5)とその誘導体(酸化生成物)の濃度は有意に変化しないことが示されている(Rohn er al)。 本質的に親電子性である5およびその誘導体が、食品混合物中に存在する求核性成分と反応して、タンニンなどの高分子複合体を生成するという理論的根拠が提案されている(Rohn et al 2007; Oracz et al 2015)。より可能性が高いのは、コーヒー豆の焙煎を増加させると、ケルセチン(5)の量が減少することであろう。したがって、我々は、ダーク焙煎コーヒー抽出物中のより高い濃度のフェニルインダン(6)が、Aβオリゴマー化アッセイにおけるダーク焙煎コーヒー抽出物対軽質焙煎コーヒー抽出物の凝集抑制活性の増加に関与していることを提案する(表33)。
フェニルインダン(6)をα-シヌクレイン凝集アッセイで試験した場合、見かけのIC50値を計算することができず、また、プロ凝集挙動を観察することもできなかった(表5)。フェニルインダン(6)とα-シヌクレインとの間に観察可能な相互作用がないことは、フェニルインダン(6)がコーヒー抽出物のプロ凝集活性に関与していないことを示唆しているだろう。より可能性が高いのは、この挙動がカフェイン酸(4)およびケルセチン(5)に由来することである。コーヒーの神経保護効果がα-シヌクレインとの相互作用によるものであるとは考えにくいが、神経炎症・抗酸化経路や遺伝子・タンパク質の発現を変化させて脳内の病原性α-シヌクレイン量を減少させるなどの他のメカニズムによって、コーヒーがパーキンソン病の神経保護効果を引き出す可能性は十分に考えられる。同様のメカニズムは、いずれの場合もまだそのような効果は報告されていないが、ADの病態にも有効である可能性がある。さらなる研究は、このようにコーヒー中のフェニルインダンは、ADとPDの細胞または動物モデルにおける神経保護の追加のメカニズムを促進するかどうかを決定するために保証されている。
フェニルインダン(6)のバイオアベイラビリティーに関する情報はまだ報告されていない。フェニルインダン(6)は水溶性であるが、水相からエーテル(99.8%)に完全に抽出できることが知られている(Guillot er al)。 これらの結果から、フェニルインダンの足場は、神経変性疾患、特に病原性Aβとタウ(AD)の凝集を伴う疾患を治療するための薬物様分子の開発のための有望なリードであることが示唆されている。コーヒー中のフェニルインダンのバイオアベイラビリティと薬物動態、およびそれらのBBB浸透性についてのさらなる調査が必要である。
結論
要約すると、我々は3種類のインスタントコーヒー抽出物(ライトロースト、ダークロースト、カフェインレスダークロースト)とコーヒーに含まれる様々な成分(1~6)のAβ、タウ、α-シヌクレインに対する凝集阻害活性を定量化した。我々は、Aβとタウの二重凝集阻害剤としてフェニルインダン(6)を同定し、コーヒー抽出物のAβとタウに対する観察された凝集阻害活性の原因は、コーヒーのフェニルインダン成分であることを提案した。コーヒー抽出物のα-シヌクレインに対する凝集抑制活性は確認されなかったが、カフェイン酸(4)とケルセチン(5)は100μM以上の濃度でα-シヌクレインのプロ凝集体であることが確認されている。
コーヒー消費の知覚された神経保護効果は、1-6の様々な生物学的活性に関連する因子の組み合わせに起因する可能性が高いが、フェニルインダン(6)が病原性Aβおよびタウと直接相互作用してそれらの凝集を阻害する能力は注目に値する。コーヒー中のフェニルインダン(6)によるAβおよびタウの凝集抑制は、コーヒー飲料を摂取する個人のAD病態における神経保護のもっともらしいメカニズムと考えられる。我々の知る限りでは、これはフェニルインダン(6)の凝集阻害活性の最初の報告であり、フェニルインダン(6)の足場は、タンパク質の凝集プロセスをターゲットとした将来の創薬プロジェクトのために考慮されるべきである。ADおよびPDの細胞モデルおよび動物モデルにおけるAβ、タウおよびαシヌクレイン負荷を減少させるフェニルインダン(6)の能力は、我々のグループで現在調査中であり、今後報告される予定である。