Persistent SARS-2 infections contribute to long COVID-19
pubmed.ncbi.nlm.nih.gov/33621843/
2021年2月16日
要旨
COVID-19は、4000万人以上が感染している深刻な病気である。重大な死亡率のほかに、SARS-CoV-2感染は、Long-COVIDと呼ばれる相当かつ持続的な罹患率を引き起こす。本論文では、この罹患率の一部は持続的な全身感染によるものである可能性を論じている。
持続的な感染は、ウイルスRNAの継続的な脱落によって示される。ウイルスのスーパー抗原は抗ウイルス免疫応答を過剰に刺激し、それによって負のフィードバックループを誘発し、逆説的にウイルスの持続を可能にする。スーパー抗原は、残留感染に対して強い免疫応答を誘導するだろう。
この仮説は、ウイルス感染を完全にクリアすることが、Long-COVIDに対する適切な介入となることを示唆している。
序論
SARS-CoV-2に起因するCOVID-19は、1年足らずで世界的な健康上の大きな脅威となっており[1]、4000万人の症例が報告され、110万人以上の死亡例が報告されている[2]。現在、毎日約30万人と増加傾向にある新規症例が確認されているが、1日の死亡者数は約6000人で安定している。推定感染致死率(IFR)は、全人口で0.68%(0.53~0.82%)60歳以下では0.2%以下である[3]。
SARS-CoV-2感染後の死亡率は低いが、入院患者の87%が発症から 2か月後に症状が長引いていた[4]。Long-COVID[5]の症状の長期化は、重症者だけでなく、軽症者にも見られる[6], [7]。発病後の回復の遅れはCOVID-19に特有のものではなく、他のいくつかのウイルス感染症の後に見られる[8]。COVID-19の合併症は、免疫系、神経系、循環器系、呼吸器系、皮膚系、肝系、腎系、膵臓系(糖尿病)などの複数の生理機能に影響を与える可能性がある[9], [10], [11], [12]。
3つの異なるメカニズムがCOVID-19の長期化に役割を果たすとの仮説が立てられている。
- (i)ウイルス後疲労症候群[13]、[14]、[15]、
- (ii)自己免疫[16]、[17]、
- (iii)持続的なウイルス感染(本稿)
COVID-19の症状は、一般的なウイルス後疲労症候群で報告されているものよりも多様で激しい。自己免疫は交差反応性抗原を必要とし、いくつかの候補が同定されている [18], [19]。さらなる研究により、これらの抗原が同定される。交差反応性抗原だけでは自己免疫の発症には十分ではなく、免疫系は危険なシグナルを発信しなければならない。細胞の損傷や直接的な活性化は樹状細胞の成熟を誘発する可能性がある [20]。持続的なウイルス感染は、細胞損傷と樹状細胞の直接活性化の両方を誘発し、自己免疫を引き起こす可能性がある。ただし、免疫学的な観点から見ると、持続感染と自己免疫は、SARS-CoV-2によって引き起こされる可能性のある2つの明らかに異なるメカニズムである[21]。
簡単に言えば、持続感染がLong-COVIDの症状を説明する可能性がある。本稿では、SARS-CoV-2がどのようにして持続感染を引き起こすのかを検討する。
仮説の概要
SARS-CoV-2についてはスーパー抗原が記載されており [22], [23]、スーパー抗原はポリクローナルT細胞の活性化によってサイトカインストームを引き起こすことが知られている [24]。SARS-CoV-2は非常に強い免疫応答を誘導する[25]が、これはスーパー抗原によるものである可能性がある。コルチコステロイド治療による免疫系のダウンレギュレーションは、重症COVID-19の死亡率を減少させる[26]が、免疫抑制の必要性を示している。ほとんどの患者では、スーパー抗原応答のダウンレギュレーションは自然に起こるため、スーパー抗原誘発免疫応答は、免疫応答を生成する上ではほとんど効率的である[27]。負の免疫学的フィードバックループは、特に免疫応答が比較的弱い場合には、ウイルスが体内で繁殖することを可能にする可能性がある。図1は、スーパー抗原感染の場合の免疫活性化と免疫抑制の微妙なバランスを示している。
図1 抗原とスーパー抗原による抗ウイルス免疫応答。抗原特異的免疫応答のオーケストレーションの代表としてTリンパ球を用いた簡略化された表現
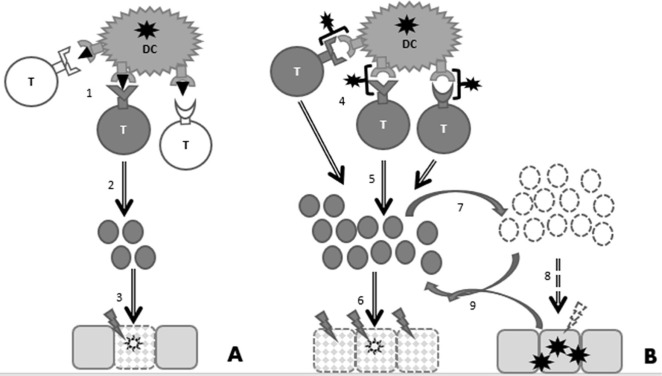
A. 通常のウイルス抗原は樹状細胞(DC)からTリンパ球に提示される。(1) MHC文脈でペプチドにマッチする抗原特異的T細胞受容体(TCR)を持つT細胞のみが活性化され、(2)クローン性の拡張を持つ。(3)拡大した抗原特異的T細胞集団は、ウイルスの効果的なクリアランスをもたらす。B. スーパー抗原は、DCによってTリンパ球に提示される。(4) Tリンパ球の大規模なサブグループは、例えば、それらの共通のVβ受容体を介して活性化される。の外側に結合するため、この結合はTCRの特異性に依存しない。(5)活性化されたT細胞の大群は、クローン性の拡張を有し、(6)免疫過剰反応、すなわち敗血症の可能性がある。敗血症の自己破壊性のため、(7)免疫反応は負のフィードバックループ、例えばCD4+CD25+Tregリンパ球およびインターロイキン-10(IL-10)によってダウンレギュレートされる。(8) その結果、ウイルスの持続性を可能にする部分的に有効な免疫応答が得られる。(9) 持続的なウイルス感染は免疫系を再活性化させ、その結果、効果はないが組織にダメージを与えるウイルス-免疫反応ループが生じる。
SARS-CoV-2が持続感染を確立するためには、スーパー抗原によって誘導される免疫抑制が重要であると考えられる。多くのRNAウイルスは持続感染を引き起こす可能性がある [28]。通常の臨床では、呼吸器(上気道)からの検体でのみSARS-CoV-2の検査が行われている。SARS-CoV-2は、他の多くのウイルスと同様に、抗体介在感染によって、分散感染を引き起こす可能性があることに注意すべきである[29]。ウイルス超抗原は、それが産生される体内のどこにいても強い免疫応答を引き起こすであろう。
仮説の評価
持続感染の証拠は、いくつかのグループの患者の糞便中のウイルス脱落の長期化によって示されている [31]、[32]、[33]、[34]。そのメカニズムに関わらず、SARS-CoV-2の持続感染は様々な臓器に分散している [35], [36]。これらの論文では、鼻咽頭および/または咽頭腔内のサンプリングに基づく通常のRT-PCR診断では、持続的なウイルス感染が見落とされる可能性があることがしばしば示されている。持続感染は、マウスコロナウイルス、マウス肝炎ウイルス(MHV)[37]、[38]、[39]についても記述されている。SARS-CoV-2と同様に、MHVもスーパー抗原活性を持っている[40]。
SARS-CoV-2ウイルスは、COVID-19患者では免疫応答と長期共存しており、重症化しているにもかかわらず、免疫があまり効果的でないことを示している[41]。スーパー抗原による強い免疫応答は、他の呼吸器ウイルスで示されているように、不完全な免疫につながる可能性がある[42]。
持続的な感染は不完全免疫の強い徴候である。これは、季節性コロナウイルスに対する保護免疫が短期間で持続することと一致している[43]。いくつかの論文では、SARS-CoV-2による早期の再感染が報告されているが、場合によってはさらに重症化することもある [44], [45]。この直観的ではない免疫学的知見は、スーパー抗原の特徴とうまく合致している。
仮説の結果
持続的なウイルス感染は、宿主における持続的なスーパー抗原曝露を意味する。慢性的なスーパー抗原暴露は全身の炎症を誘発し、糖尿病の発症に関与している可能性がある [46]。実際、COVID-19後に糖尿病を発症するリスクが記載されている[12]。また、心血管疾患の発症もCOVID-19に起因する罹患症である可能性がある[10], [11]。不完全な免疫や短命の免疫もまた、SARS-CoV-2による再感染において重要な役割を果たしており、より重症化する可能性がある[44]。糖尿病や心血管疾患の併存は再感染の予後を悪化させ [47] ,また,スーパー抗原の再曝露による免疫学的増悪の継続は再感染後の予後をより重症化させる可能性がある.
残留炎症や自己免疫反応はいずれも望ましくない免疫反応である。免疫が不完全であれば、炎症が継続し、その結果として自己免疫反応が起こると考えられる感染の持続につながる可能性がある。症状が強すぎる免疫反応に起因するものなのか、それとも持続的な感染症に起因するものなのかを知ることは、臨床的な判断を下す上で非常に重要である。前者の場合は、コルチコステロイドなどによる免疫反応の抑制を目的とした介入が必要である。後者では、I型インターフェロン、インターロイキン-2(IL-2)IL-7,または抗ウイルス剤を用いて抗ウイルス免疫を高めることが提案されている[48], [49]。
本論文の議論は、持続的なウイルス感染との戦いが、少なくともいくつかのケースでは適切な介入であろうということだ。介入の選択は、患者のウイルスおよび/または免疫状態が決定するべきである。持続性ウイルス感染の状態は、現在、鼻咽頭および口咽頭腔に存在しない全身性SARS-CoV-2感染からサンプリングするための汎用的な方法がないため、検出が困難な場合がある。免疫学に基づく臨床的意思決定は、免疫学者にとって新しいものではなく[50]、個別化医療の基礎を形成した[51]。同様の免疫学に基づいた臨床的意思決定システムは、Long-COVID患者の適切な治療法を選択するために極めて重要であるかもしれない。
