Contents
Persistent Brainstem Dysfunction in Long-COVID: A Hypothesis
pubmed.ncbi.nlm.nih.gov/33538586/
掲載日:2021年2月4日
要旨
Long-COVIDは、初期の重症度や年齢に関係なく、COVID-19の生存者に影響を及ぼす可能性のあるウイルス性後遺症である。long-COVIDの症状には、疲労、呼吸困難、胃腸および心臓の問題、認知障害、筋肉痛などがある。Long-COVIDの原因として考えられるのは、長期的な組織損傷、ウイルスの持続、慢性炎症などであるが、本レビューでは、持続的な脳幹機能障害も関与している可能性があることを、おそらく初めて提案している。この仮説は2つの部分に分けることができる。
第一は、COVID-19における脳幹のトロピズムと損傷である。脳幹は他の脳領域に比べてACE2受容体の発現が比較的高いため、SARS-CoV-2はそこにトロピズムを示す可能性がある。また、SARS-CoV-2の共受容体であるニューロピリン-1が脳幹で発現している可能性も示唆されている。実際、剖検研究では脳幹でSARS-CoV-2のRNAとタンパク質が検出されている。また、脳幹は病的な免疫や血管の活性化による損傷を受けやすく、これはCOVID-19症例の剖検でも観察されている。
第二部では、Long-COVIDの症状と重なる脳幹の機能について述べる。脳幹には、呼吸器、心血管系、消化器、神経系のプロセスを制御する多数の異なる核と部分があり、これらはLong-COVIDと関連している可能性がある。
ニューロンは容易には再生しないため、脳幹機能障害は長期的に持続する可能性があり、したがって、Long-COVIDとなる。実際、脳幹機能障害は、慢性疼痛や片頭痛、筋痛性脳脊髄炎や慢性疲労症候群などの他の類似の障害に関与している。
キーワード
Long-COVIDコロナウイルス脳幹トロピズム神経系脳解剖
1. 序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、間違いなく人類が直面している最も感染力の高いウイルスの1つである。2020年の終わりに近づいて、SARS-CoV-2による新型コロナウイルス感染症(COVID-19)のパンデミックは、全世界で200万人近くの死者を出し、7000万人の症例を超えている(www.worldometers.info/coronavirus/)。COVID-19の約81%は無症状で軽症で、回復までに2週間程度かかる。一方、重篤な肺炎と重篤な多臓器不全は、それぞれ14%と5%に発生し、3~6週間持続する(1,2) 。 しかし、COVID-19の生存者のかなりの割合は、退院後にSARS-CoV-2が陰性であったにもかかわらず、完全に回復せず、long-COVID(または長期不調組COVID-19)として知られるウイルス感染後症候群を発症する(3,4) 。
公式な医学的定義や診断基準はまだ確認されていないが、現在のところ、Long-COVIDの記述は、症状の発現または退院後少なくとも4週間続く疲労、呼吸困難、頭痛、認知機能障害、咳、関節痛および胸痛、気分の変化、嗅覚および味覚障害、および筋肉痛の継続的な症状である(5-8)。 COVID-19の生存者を追跡調査した研究では、30-80%が1-6ヵ月間続くLong-COVIDの症状を呈することが報告されている(9-18)。そのような研究では、Long-COVIDは誰にでも起こりうることがわかっており、若年成人、学生、小児、および呼吸器のサポートも病院でのケアも必要としない軽度のCOVID-19の人にも起こりうることがわかっている(9-18)。
これは興味をそそる疑問を提起している。なぜCOVID-19は、たとえ軽度であっても、約30-80%の時間でlong-COVIDに変化するのか?これまでのところ、一般的な説明としては、急性COVID-19から未解決のままの残留組織損傷、ウイルスの持続、慢性炎症が挙げられる(3,5,6,19,20)が、他の場所では詳細に議論されていないが、Long-COVIDのもう一つの潜在的な原因は、SARS-CoV-2の脳幹トロピズムとその結果として持続する低悪性度の脳幹機能障害である可能性がある。
2. 脳幹に対するSARS-CoV-2のトロピズム
SARS-CoV-2 は神経細胞培養物、脳オルガノイド、マウス脳に感染・複製する能力を持つ神経向性ウイルスであることが広く知られている(21-23) 。 このことは、COVID-19 や他の病原性ヒトコロナウイルス感染例において、神経精神医学的または神経学的症状(例えば、認知・気分障害、頭痛、嗅覚・味覚の変化、疲労感、筋肉痛など)の発生率が高いことと一致している(24-26)。これは、COVID-19や他の病原性ヒトコロナウイルスの症例において、神経精神症状や神経症状(例えば、認知障害や気分障害、頭痛、嗅覚や味覚の変化、疲労感、筋肉痛など)が高いことと一致している(24-26) 。 (27) さらに、COVID-19患者の剖検では、30〜40%の症例でSARS-CoV-2 RNAが脳内で検出されている(28-30)が、他の剖検研究では、COVID-19患者の脳内に組織学的変化やSARS-CoV-2物質は検出されていない(31-33) このことは、SARS-CoV-2神経栄養症や脳浸潤は起こりうるが、すべての症例で起こるわけではないことを示唆している。
さらに興味深いことに、特定の脳領域を調べた剖検研究では、炎症反応、神経変性、ウイルス浸潤など、COVID-19の脳幹への関与の証拠が見つかっている(表1)。例えば、COVID-19の6人の犠牲者の脳解剖では、すべての症例で脳幹とその神経接続部に顕著な神経変性が確認されている。重要なことに、本研究では、低酸素の影響を受けやすい他の脳領域は有意な損傷を受けていなかったため、低酸素が脳幹の損傷の原因ではないと断定された。このことから、病的な免疫反応かSARS-CoV-2の脳幹への浸潤が疑われた(34)。 別の剖検研究では、COVID-19の犠牲者16人から32の脳切片を分離し、嗅神経と脳幹の髄質の3つの切片にSARS-CoV-2 RNA(5コピー/mm3以上)が濃縮されていることが明らかになった(35)。 (35) さらに説得力のあることに、死亡したCOVID-19患者の別の剖検研究では、脳幹サンプルの50%と40%でそれぞれSARS-CoV-2 RNAとタンパク質(ヌクレオカプシドまたはスパイク)が検出された。 (36) 同様に、別の剖検研究では、嗅粘膜-神経接合部および脳幹の髄質でSARS-CoV-2 RNAおよびスパイク蛋白質がそれぞれ67%および19%のサンプルで検出された(37)。 まとめると、これらの剖検研究は、嗅覚系から脳幹へのSARS-CoV-2トロピズムの証拠を提供している。
表1 脳幹または延髄を中心とした特定の脳領域を調査した剖検研究
| 調査 | 死亡したCOVID-19患者からの脳サンプル | 注目すべき剖検所見 |
|---|---|---|
| (38) | 1人の患者からの全脳(男性; 73歳;ニューヨーク、米国)。 | 延髄を含むいくつかの脳領域に存在する収縮したニューロン、梗塞、および炎症。 |
| 嗅球および小脳では陽性のSARS-CoV-2RNAであるが、延髄ではない。 | ||
| (67) | 5人の患者(42〜84歳、男性2人と女性3人、米国ワシントン州)の全脳。 | 1人の患者の脳幹に存在する出血。 |
| (68) | 1人の患者(男性; 54歳;ミラノ、イタリア)からの嗅神経、直回、および脳幹の髄質。 | 嗅神経、直回、延髄には多数のウイルス様粒子と組織損傷が見られた。 |
| (39) | 7人の患者からの全脳(6人の男性と1人の女性; 54-96歳;バーゼル、スイス)。 | 2人の代表的な患者の嗅球、橋、脳幹、および延髄における顕著な炎症(ミクログリアおよび星状細胞の活性化)。 |
| それぞれ4人と2人の患者の嗅球と視神経における陽性SARS-CoV-2RNA。すべての場合において、脳幹および小脳における負のSARS-CoV-2RNA。 | ||
| (40) | 10人の患者からの全脳(7人の男性と3人の女性; 51-74歳;ボローニャ、イタリア)。 | 1人の患者の嗅神経と脳における陽性SARS-CoV-2RNA。 |
| すべての患者の大脳基底核および脳幹における顕著な微小血栓。 | ||
| (69) | 2人の患者(男性2人、70〜79歳、スイス、チューリッヒ)の全脳。 | 嗅上皮と神経の顕著な炎症(白血球浸潤)と微小血栓症、および両方の患者の大脳基底核。 |
| (36) | 43人の患者からの全脳(27人の男性と16人の女性; 51-94歳;ハンブルク、ドイツ)。 | ほとんどの場合、小脳と延髄で最も顕著であった顕著な炎症(白血球浸潤とミクログリアおよび星状細胞の活性化)。 |
| 前頭葉(23人の患者のうち9人)および脳幹(8人の患者のうち4人)で陽性のSARS-CoV-2RNA。 | ||
| 40人の患者のうち16人で、延髄およびその神経接続(舌咽神経または迷走神経)のSARS-CoV-2ヌクレオカプシドまたはスパイクタンパク質が陽性でした。 | ||
| (37) | 33人の患者(22人の男性と11人の女性; 67-79歳;ベルリン、ドイツ)からの嗅粘膜と特定の脳領域。 | 嗅粘膜(30人中20人の患者)小脳(24人中3人の患者)および延髄(31人中6人)のサンプルで陽性のSARS-CoV-2RNA。 |
| 嗅粘膜-神経接合部における陽性SARS-CoV-2スパイクS1タンパク質。 | ||
| 脳の顕著な炎症(白血球浸潤とミクログリア活性化; 25人の患者のうち13人)と微小血栓(33人の患者のうち6人)。 | ||
| (42) | 21人の患者のサンプルからの9人の患者からの全脳(16人の男性と5人の女性; 41-78歳;アムステルダム、オランダ)。 | 顕著な炎症(白血球浸潤およびミクログリアおよび星状細胞の活性化)は、すべての場合において嗅球および髄質で最も明白でした。 |
| (35) | 2人の患者(男性2人、50〜71歳、マサチューセッツ州、米国)のさまざまな脳領域からの20の脳切片。 | あいまいなウイルス感染(<5つのコピー/ mmの3 4つのセクションは髄質に属しているの9つのセクションのSARS-CoVの-2 RNAの)。 |
| 残りの11セクションでの負のウイルス感染。 | ||
| 16人の患者(男性12人と女性4人、48〜90歳、マサチューセッツ州、米国)からの32の脳切片(前頭葉と嗅神経から 16,脳幹髄質から 16)。 | 正のウイルス感染(> 5つのコピー/ mmの3(髄質から前頭葉および嗅神経及び3から3)6節におけるSARS-CoVの-2 RNAの)。 | |
| それぞれ20セクションと6セクションでのあいまいなウイルス感染と陰性のウイルス感染。 | ||
| (34) | 6人の患者(男性4人と女性2人、58〜82歳、ドイツ、ミュンヘン)の全脳。 | すべてのサンプルにおける血管周囲および間質性脳炎および脳幹の孤立性、背側裂孔核、および神経接続(すなわち、迷走神経、嗅神経および三叉神経、ならびに内側縦束の背側運動核)の神経変性。 |
| 新皮質、海馬、小脳などの低酸素症になりやすい領域は、広範囲に損傷を受けていなかった。 |
しかし、他の実施例では、死亡したCOVID-19患者の脳解剖でSARS-CoV-2 RNAが存在しないにもかかわらず、脳幹神経病理が観察された(38-40)。このことは、COVID-19はSARS-CoV-2の侵入以外にも、病理学的な免疫活性化や血管活性化などの方法で脳幹の損傷を誘発する可能性を示唆している。例えば、白血球浸潤、常駐するミクログリアおよびアストロサイトの活性化、および微小血栓症がCOVID-19犠牲者の脳解剖で、特に脳幹で観察されている(37,39,41,42)。実際、脳幹は、炎症、外傷、代謝変化、血管損傷などの様々な原因による急性および慢性の損傷に対して非常に脆弱であることが知られている(43) 。 これらを総合すると、SARS-CoV-2は、ウイルスの侵入、炎症、血管の活性化を介して脳幹に損傷を与える可能性がある(44) (表1,図1)。
図1 SARS-CoV-2による脳幹機能障害のメカニズム
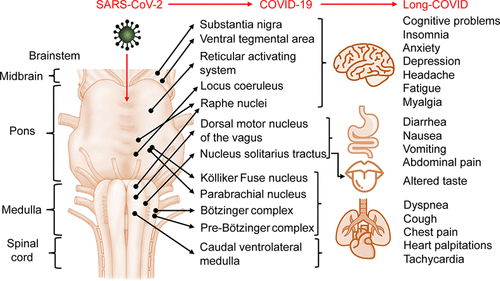
例えば、SARS-CoV-2は、アンジオテンシン変換酵素2(ACE2)およびニューロピリン-1(NRP-1)受容体の表面発現を介して脳幹に直接侵入する可能性がある。SARS-CoV-2またはCOVID-19はまた、ミクログリアおよびアストロサイトの活性化および血液脳関門を介した白血球の浸潤を介して神経炎症を開始する可能性がある。これらは、脳幹および血管細胞を損傷する炎症性メディエーターの産生につながるであろう。血管損傷から生じる微小血栓症は、神経炎症および脳幹機能障害をさらに増強する可能性がある。
アンジオテンシン変換酵素2(ACE2)は、SARS-CoV-2が細胞に感染するために使用する受容体である(45,46)。実際、ACE2のmRNAとタンパク質は、マウス脳幹のニューロンとアストロサイトで発見されている(47-49)。 ヒトの21の異なる脳領域から採取した組織を解析した研究では、大脳皮質、扁桃体、脳幹でACE2が高発現していることが明らかになっている。最近では、ニューロピリン-1がSARS-CoV-2の細胞への感染を促進する共受容体であることが確認されており、特にACE2の発現が比較的低い嗅覚上皮での発現が確認されている(51,52)。 (51,52) また、ニューロピリン-1は動物の脳幹でも発現している(53,54) ことから、成熟脳幹でもニューロピリン-1が発現し、SARS-CoV-2感染を促進している可能性がある。
先行する病原性重症急性呼吸器症候群(SARS)および中東呼吸器症候群(MERS)コロナウイルスもまた、マウス実験で脳幹を標的にして損傷を与える傾向を示している(55-58)。 (55-58) 興味をそそることに、SARSやMERSの生存者の一部は、何年も続く長期にわたるポストウイルス性疾患にも直面している(24,59-61) 。 したがって、SARS-CoV-2が同様のトロピズム特徴とポストウイルス性Long-COVIDを誘発する能力を進化させたことは驚くべきことではない。SARS-CoV-2が脳幹に侵入すると考えられる経路は、末梢神経、嗅覚神経、または頭蓋神経を介したシナプス伝達と、全身循環からの血液-脳バリア(BBB)の侵入を含む(62-66)。
3. 脳幹機能がLong-COVID症状と重なる
また、COVID-19の呼吸不全の原因として、脳幹に対するSARS-CoV-2のトロピズムの可能性も指摘されている(70-75)。これは、脳の心肺機能の中心が脳幹にあるからである(70-75)が、髄質、ポンズ、中脳で構成される脳幹は、呼吸調節以外にも、心血管系、消化器系、神経系のプロセスを維持するなど、他の役割を担っている(図2)。神経細胞の損傷は末梢および中枢ともに永続的なものであり、再生は極めて稀で遅いため(76-78)、脳幹の損傷も同様に長期に及ぶ可能性がある。興味深いことに、脳幹の機能とLong-COVIDの症状は大きく重なっている(図2)。
図2 long-COVIDにおける脳幹機能障害仮説の概要
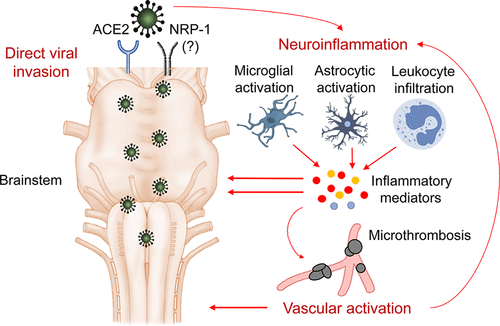
脳幹の髄質、ポンズ、および中脳の核および部分は縮尺で描かれておらず、正確な神経解剖学的構造を反映していない場合があることに注意してほしい。使用される略語は以下の通り。ACE2,アンジオテンシン変換酵素2;COVID-19,新型コロナウイルス感染症;NRP-1,ニューロピリン-1;SARS-CoV-2,重症急性呼吸器症候群コロナウイルス2。
一つには、COVID-19生存者の最大30〜50%が2〜3ヶ月間の持続的な呼吸困難および咳を経験する(13,15,79-81) 胸痛、動悸、および頻脈もまた、生存者の約20〜40%に発生するLong-COVIDの一般的な症状である。 (13,82) 特筆すべきことに、脳の呼吸ニューロン回路と心血管系ニューロン回路は脳幹で密接に絡み合っている(83) 。 髄質の腹側呼吸列(VRC)には、呼気時と吸気時のリズミカルな呼吸をそれぞれ制御するベッツィンガー複合体と前ベッツィンガー複合体が存在する(84,85)。 (84,85) また、脳幹にはポンティヌス呼吸器群(PRG)があり、ここには傍頭蓋核とケリカー・フューズ核が存在し、呼気と吸気の間の移行を制御している(86)。 (86) さらに、脳幹には、心臓のリズムを調節するニューロンを含む尾部ベントロ側髄質(CVLM)がある(87,88) 。 したがって、VRC、PRG、CVLMのレベルでの持続的な脳幹機能障害が、Long-COVIDの心肺機能障害に関連する症状を説明している可能性がある。
COVID-19生存者の約25~30%はまた、退院後2~3ヵ月間、吐き気、嘔吐、下痢、腹痛などの消化器症状を経験することがある(82,89)。 (82,89) 面白いことに、脳幹の道索状核(NTS)および迷走神経背側運動核(DMV)は、それぞれ消化管との間で求心性および消極性のニューロンの投射を行い、運動および分泌を調節している(90,91)。 したがって、これらの脳幹領域の機能障害は、下痢、嘔吐、および腹痛につながる可能性がある。消化管から求心性ニューロンを受け取る一方で、NTSは高次脳領域(扁桃体、島皮質、前帯状皮質など)との神経接続を有しており、吐き気感覚を伝える可能性がある(92,93)。
Long-COVIDは、疲労、筋肉痛、不眠、頭痛、抑うつ、不安、嗅覚および味覚の変化、認知障害など、COVID-19生存者の20-70%に起こりうる無数の神経学的症状を伴う(10-13,15)。 (10-13,15) 脳幹には、味蕾からの神経情報を味覚野に中継するNTS内の味覚ニューロンがある(94)が、この領域の機能不全は、Long-COVIDにおける味覚知覚の変化を説明できるかもしれないが、関連する嗅覚の誤作動は、COVID-19の剖検でよく観察される嗅球の損傷に起因するかもしれない(表1)。さらに、脳幹の網状体活性化系(RAS)は、睡眠覚醒周期と注意力を制御している(43) 。 脳幹には、セロトニン作動性ニューロンとノルアドレナリン作動性ニューロンの脳の主要な供給源であるラッパ核と脊髄座も存在する(95,96) (95,96) 。 (97,98) これらの脳幹からの神経伝達物質は、うつ病、不安、睡眠・認知障害、頭痛、疲労、筋肉痛、疼痛知覚などの幅広い神経疾患に関与している(99-102) 。 したがって、SARS-CoV-2が脳幹に侵入すると、脳内の神経伝達物質システムが破壊され、多様な神経症状を引き起こす可能性がある。
4. Long-COVIDにおける持続的な低悪性度脳幹機能障害
これらを総合すると、脳幹機能障害がlong-COVIDの病態に関与しているのではないかという仮説が立てられる。しかし、この仮説に対する大きな注意点として、脳幹機能障害の大きさが曖昧であることが挙げられる。脳幹への障害、特に呼吸ペースメーカー前のBötzinger complexでの障害は致死的であり、神経原性呼吸不全や死亡につながることが証明されている(43,71,103)。 さらに、外傷性脳衝撃による一次脳幹損傷は高い死亡率を示している(104)。 (104) また、乳幼児突然死症候群(SIDS)は、脳幹の髄質セロトニン作動系の障害に起因することが提案されている(105,106) その他、脳幹障害に関連した重篤で生命を脅かす臨床転帰として、自律神経障害、意識障害(例:昏睡、せん妄)などがある。(43,107) したがって、Long-COVIDのような慢性的または持続的な状態に脳幹機能障害が関与しているとは考えにくいかもしれない。
しかし、脳幹機能障害は慢性疾患の病態生理にも関与している。例えば、脳イメージング研究では、慢性的な筋骨格系疼痛や神経障害性疼痛を持つ参加者の脳幹における拡散性や機能的連結性の変化が確認されている(108-110)。 ヒトの慢性片頭痛や頭痛における脳幹機能障害の関与についても広く実証されている(111-114)。 注目すべきことに、Long-COVIDは、疲労、筋肉痛、認知障害、睡眠障害を特徴とする筋痛性脳脊髄炎や慢性疲労症候群(ME/CFS)と類似しており、密接に関連している。 (115,116) 面白いことに、脳画像研究では、ME/CFSの症状の重症度は、特にRASにおける脳幹機能障害と関連し、相関していることがわかっている(117-121) このように、脳幹機能障害は、致死的または持続的な疾患を引き起こす可能性があり、後者の疾患にはLong-COVIDが含まれる可能性がある(図3)。
図3 致死的または持続性のある脳幹機能障害に関連する障害の概要
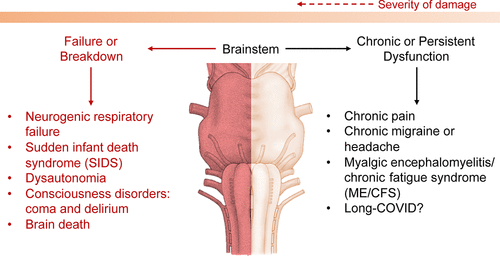
赤やオレンジの濃淡が濃いほど重症度が高いことに注意してほしい。
5. おわりに
このレビューでは、脳幹はLong-COVIDの見落とされた側面である可能性があることが強調された。急性COVID-19では、脳幹の損傷は剖検研究で広く報告されている。いくつかの剖検報告では、脳幹にSARS-CoV-2遺伝子とタンパク質が検出されており、これはウイルスのトロピズムと浸潤を示唆している。実際、脳幹にはACE2受容体やニューロピリン-1が比較的多く発現しており、これはSARS-CoV-2が細胞感染のために利用している可能性がある。COVID-19の軽症例でも神経学的症状が現れることから、疾患の初期段階では脳幹が影響を受ける可能性がある。神経細胞はほとんど再生しないため、COVID-19による脳幹の損傷は長期に及ぶ可能性がある。これに続いて、脳幹の呼吸器、循環器、消化器、神経機能が無期限に損なわれる可能性がある。興味深いことに、これらのシステムもLong-COVIDでは誤作動が疑われている。実際、脳幹機能障害は、慢性疼痛や片頭痛、ME/CFSなどの他の慢性疾患にも関与している。したがって、Long-COVIDは持続的な脳幹機能障害に起因しているのではないかという仮説が立てられる。
これに関連して、これまでの研究では、持続的な脳の構造的変化(例:帯状回、乏しい脳の構造的変化)を発見したのは1件のみである。3ヵ月前に退院したLong-COVID生存者において、持続的な脳の構造的変化(帯状回、嗅覚野、海馬など)を発見した研究はこれまでに1件しかないが、残念ながら、この研究では技術的限界のために脳幹の検査は行われていない(11)。
結論として、Long-COVIDを対象とした今後の研究では、脳幹機能障害仮説をさらに詳しく調べることに関心があり、脳画像検査、神経生理学的評価、反射(例:咳、瞳孔光、反射)などを行うことになるだろう。咳、瞳孔光反射、角膜反射など)や聴覚反応検査を行い、脳幹の異常を検出することなどが挙げられる(43,64,121)。
