Contents
- 概要
- 1. はじめに
- 2. 幹細胞を用いたHSV1とADとの関連研究
- 3. GV971のAD治療への使用と、関連化合物であるフコイダンの使用例
- 4. ヘルペスウイルスの再活性化に対するCOVID-19の効果およびCOVID-19の重症度のAPOE依存性
- 5. 認知症発症前のHSVおよびVZV感染に対する抗ウイルス剤治療の効果
- 6. VZVのAD/認知症への関与
- 7. HHV6のADへの関与の可能性
- 8. ワクチン接種によるADのリスクとHSV1再活性化の防御
- 9. 抗HSV血清抗体とADのリスク
- 10. APOEと感染症および感染負荷と認知機能との関係
- 11. HSV1誘発の酸化ストレス、オートファジー、アポトーシスとADとの関係
- 12. 結論
Overwhelming Evidence for a Major Role for Herpes Simplex Virus Type 1 (HSV1) in Alzheimer’s Disease (AD); Underwhelming Evidence against
www.ncbi.nlm.nih.gov/pmc/articles/PMC8234998/
オンラインで2021年6月21日に公開
Ruth F. Itzhaki
Simone Agostini, Academic Editor, Roberta Mancuso, Academic Editor
概要
この総説では,AD/認知症におけるHSV1の役割という一般的なテーマの中で,ここ2,3年の間に発表された特定のテーマに関する研究を紹介している。その中には以下のような研究が含まれている。神経幹細胞を用いたHSV1とADとの関係、認知症発症前のHSV1感染またはVZV感染に対する抗ウイルス剤による治療の明らかな予防効果、AD/認知症におけるVZVの推定される関与、ADにおけるヒトヘルペスウイルス6(HHV6)の可能な役割。様々な種類のワクチンを接種した後に認知症のリスクが減少したように見えること、いくつかのワクチン研究でHSV1再活性化の頻度減少との関連が示されていること、APOE-ε4キャリアの脳内HSV1とADとの関連を支持する抗HSV血清抗体、APOEと認知機能との関連、APOEと感染症とAD/認知症との関連などである。結論としては、APOE-ε4保有者の脳内にHSV1が存在する場合、HSV1がADに関与しており、おそらく因果関係があることを示す圧倒的な証拠が存在すること、また、ワクチン接種や、発症前のAPOE-ε4保有者のHSV1感染に対する長期の抗ウイルス治療によって、この疾患を予防できる可能性があることについて、さらなる調査を行うべきである。
キーワード
アルツハイマー病、単純ヘルペスウイルス1型(HSV1)アポリポ蛋白質E(APOE)脳、抗ウイルス剤
1. はじめに
2017,私は、アルツハイマー病(AD)への単純ヘルペスウイルス1型(HSV1)の関与を直接的または間接的に支持する論文の数が着実に増加していることを強調した[1]。それ以来,論文数はさらに増加し,非常に多くなっているため,妥当な消化可能な長さの総説では,最近発表された論文のすべて,あるいはその多くについて議論することは不可能である。HSV1の役割を示す非常に豊富な証拠を管理するために、私はADの特定の特徴または特定の関連因子に関連する研究のみを記述した。したがって、いくつかの興味深く重要な研究を省略したことをお詫びしなければならない。
ADにおけるHSV1の役割という概念を繰り返し述べると、多くの証拠から、HSV1はおそらく中年期に脳に侵入し、そこに潜伏している可能性があることがわかっている。ストレス、炎症、その他の事象によってウイルスが再活性化され、生産性の高い感染を引き起こし、その結果、アポリポ蛋白E遺伝子の4型対立遺伝子(APOE-ε4)を持つ人では損傷が大きくなることが示唆されている。再活性化が繰り返されると、ダメージが蓄積され、最終的にはADにつながる。結論として、脳内HSV1とAPOE-ε4対立遺伝子の保有との組み合わせにより、AD発症のリスクが高くなることがわかった。一方、HSV1単独、すなわちAPOE-ε4非保有者の脳内HSV1では、AD発症の危険性ははるかに低いか全くない。末梢神経系においてAPOE-ε4が口唇ヘルペスの主要な危険因子であるという我々の発見は、この結論を間接的に強く支持するものである[2]。
第一に、「対照群」が感染していても無症状の場合があること、すなわち、感染していても必ずしも罹患しているとは限らないことが認識されていない場合が多く、対照群と罹患群の微生物感染の頻度・有病率がほぼ同じ値であっても、その微生物が疾患に関与していることを否定するものではない。微生物や病原体に対する個人の反応は、宿主の遺伝子やその他の要因によって決定される可能性がある。例えば、少なくとも80%の人がHSV1に感染しているが、そのうち口唇ヘルペスに悩まされるのは5分の1程度であり、残りの5分の4は無症状であるため、対照者として挙げられる。第二に、アルツハイマー病患者は対照群よりもHSV1に感染しやすいと言われることがあるが、脳内のHSV1の有病率はアルツハイマー病患者よりも対照群の方がはるかに低いわけではないという事実により、これは無効である[2]。第三に、APOE-ε4保有者はHSV1に感染しやすいという考えは明らかに間違っている。ほとんどの集団の80%以上がウイルスに感染しているが、APOE-ε4保有者は25-30%程度である。
2. 幹細胞を用いたHSV1とADとの関連研究
分化した幹細胞を用いた非常に有用な研究がいくつか行われている。Aiutoら[3]は,HSV1-ヒト-中枢神経系相互作用のモデルとして,皮膚線維芽細胞由来のニューロン様ヒト誘導多能性幹細胞(hipsc)をHSV1に感染させた2Dおよび3D培養を行った。その結果、HSV1の感染を許容する細胞であること、動物モデルのHSV1と同様の静止状態を確立できること、3次元培養ではウイルスが構造体の周辺部から中心部に移動すること、静止状態からの再活性化が可能であることがわかった。3次元培養では、2次元培養に比べて再活性化の効率が低く、HSV1に感染した実験動物において、中枢神経系での再活性化の頻度が中枢神経系に比べて低いことと類似していた。再活性化により、神経細胞のプロセスが変性し、細胞と細胞の融合が起こり、神経細胞の合体が形成された。
その後の研究で、同じグループ[4]は、HSV-1に感染した2次元および3次元の神経細胞培養物において、βアミロイド42(Aβ42)の蓄積のパターンが異なることを発見した。2次元神経細胞培養液では、ほとんどの場合、HSV1感染細胞(HSV1の主要な転写因子であるimmediate early ICP4(感染細胞ポリペプチド4,HSV1複製のマーカー)を染色することで検出される)または抗ウイルス剤に曝された感染細胞でAβ42が見られたのに対し、3次元脳オルガノイドでは、主にHSV1感染細胞を取り囲む非感染細胞でAβ42が見られた。著者らは、脳オルガノイドは2次元培養よりも発達中の脳の特徴をよく再現しているため、ADの病態におけるHSV1の関与を調べるためのモデルとしてより適しているとしている。
Cairnsら[5]は最近、ADに関連するHSV1感染の影響を調べるために、APOE-ε3/4遺伝子型のヒト神経幹細胞(hiNSCs)を用いて、斬新でエキサイティングな3Dバイオエンジニアリング脳モデルを構築した(D. CairnsおよびD. Kaplan、私信)。これらの幹細胞は、自発的に複数の神経細胞やグリア細胞に分化し、その分化はわずか4日ほどで急速に進行する。HSV1に感染すると、このモデルはヒトの疾患に類似しており、多細胞のアミロイドプラーク様の形成、グリオシス、神経炎症、電気生理学的な活動の低下などが見られ(図1)アルツハイマー病患者の機能低下に匹敵することがわかった。著者らは、これらのAD様の変化は、ADを制御したり誘発したりする可能性のある外因性のメディエーターが存在しない状態で起こったことを強調している。さらに、抗ウイルス剤であるバラシクロビル(VCV)を添加すると、変化の大きさが減少した。これは、Vero細胞を用いた従来の研究よりも、感染した脳に対する抗ウイルス剤の効果に直接関連していると考えられる。彼らのADモデルは、ADにおける(APOE-ε4を持つ)脳内のHSV1の因果関係を強く支持しており、また、筆者の研究室による抗ウイルス剤に関する先行研究([6]など)も支持している。
図1
3次元脳類似モデルへのHSV1感染の影響、AD脳に類似した変化を示す。
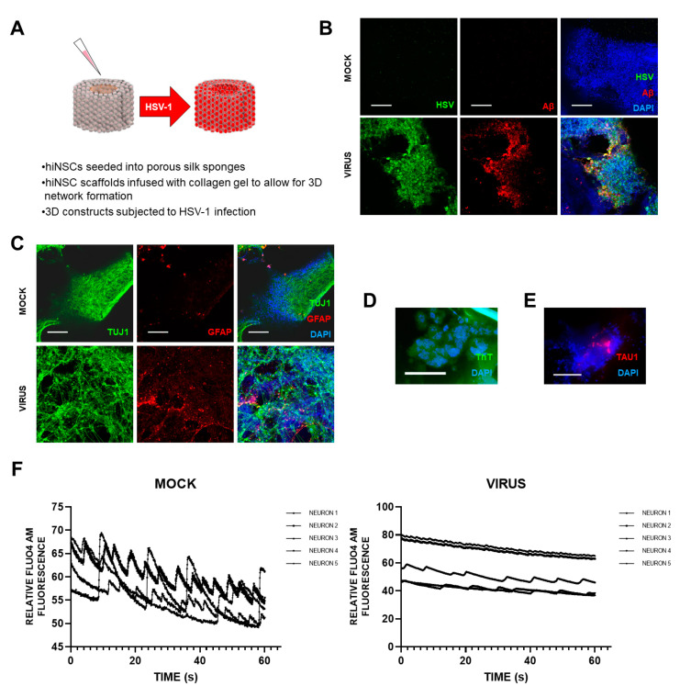
スキャフォールドにAPOE-ε3/4遺伝子型のヒト誘導神経幹細胞(hiNSCs)を播種し、4週間成熟させた。その後、HSV1に1週間感染させ、その後、サンプルを採取して複数のアッセイを行った。(A) ヘルペスによるADの3D脳類似組織モデルの模式図。(B) 単純ヘルペスウイルス1(HSV)とウイルス感染サンプルにおけるβアミロイド(Aβ)の発現を示す3Dドーナツの蛍光免疫染色像。(C) 3Dドーナツの蛍光免疫染色像。ウイルス感染したサンプルでは、汎神経細胞マーカーであるβIIIチューブリン(TUJ1)とグリア線維酸性タンパク質(GFAP)が発現している。(D)チオフラビンT(ThT)組織学的染色により、感染細胞にAβ線維が存在することが示された。(E)蛍光タウ免疫染色により、HSV-1感染サンプルに存在するプラーク様形成(PLF)内での発現を示す。(F) Fluo4AMカルシウムイメージングにより、モックまたはウイルス感染したhiNSCスカフォールド内のニューロン発火の代表的な痕跡を示す。スケールバーはすべて100μm。
家族性AD(FAD)患者由来のipsc、またはAPPもしくはAPP/プレセニリン変異を有する遺伝子改変ヒト幹細胞株の3D培養物、すなわち、主にAβ産生に関連するFADの神経細胞モデルを用いたChoiら[7]は、散発性アルツハイマー病患者由来の神経細胞ではAβレベルにばらつきがある結果となり、わずかな症例でレベルの上昇を示したと述べていることは注目に値する。
3. GV971のAD治療への使用と、関連化合物であるフコイダンの使用例
Cairnsらの研究[5]は、アルツハイマー病患者に対する抗ウイルス治療の使用を強く支持しており、VCVをアルツハイマー病患者の治療に使用する臨床試験がコロンビア大学で進行中である。また、Cummingsら[8]が発表したアルツハイマー病患者を対象とした別の臨床試験では、有望な結果が得られている。GV971は褐藻類由来の化合物で、様々な大きさの多糖類-線状のオリゴマン酸ナトリウム-分子から構成されている。最近では、XiaoらがGV971の第3相試験の良好な結果を報告している[9]。Xiaoらは、GV971が認知機能の改善に有意な効果を示し、36週間の試験のすべての観察期間において持続的な改善が認められ、安全性と忍容性も良好であったと述べている。しかし、別の、あるいはおそらく追加のメカニズムとして、本剤がHSV1に対する抗ウイルス剤として作用することが考えられる[10]。海洋由来の多糖類には,抗ウイルス作用[11]や抗菌作用など,さまざまな生理活性があることが知られている。
海水由来の多糖類の抗ウイルス活性は、通常、特定の糖構造、分子量、およびそれらの硫酸化度に関連している。(筆者は、グリーンバレー社に問い合わせたところ、GV971は硫酸化されていないとのことだったので、将来ADの治療薬として使用する可能性を考慮して、硫酸化されたバージョンを評価するように勧めた)。) 同じく褐藻類由来の多糖類であるフコイダン(フカンとも呼ばれる)は、硫酸化フカンであり、様々な病気に対する保護作用があるとされ、古くから食品として利用されてきたものである。HSV1に対して抗ウイルス活性と殺ウイルス活性を有しており[12]、その作用機序は、ウイルスが宿主細胞に最初に付着するのを阻害することによると考えられている。この阻害作用は、おそらく、フコイダンがウイルスエンベロープ糖タンパク質の正電荷ドメインと相互作用することにより媒介され、ウイルスが宿主細胞表面のヘパラン硫酸プロテオグリカンに付着することを誘導するものと考えられる。
硫酸化フコイダンは,HSV1を感染させた培養細胞で産生されるAβや,特にAD様タウ(P-tau)のレベルを低下させるのに非常に有効であることが分かっており,HSV1によるAβやP-tauの産生に対するUndaria pinnatifida由来のフコイダンの活性は特に有効であった[13]。さらに、フコイダンを、ウイルスのDNA複製を特異的に阻害する最も一般的な抗HSV抗ウイルス剤であるアシクロビル(ACV)と一緒に感染細胞に添加すると、その効果は相乗的であり、どちらか一方の薬剤だけを使用した場合よりも、P-tauとAβのレベルを大幅に低下させることができた。おそらく、フコイダンが細胞内に侵入するウイルスの数を減らし、侵入したウイルスの場合はACVがそのDNAの複製を阻害したものと思われる。
フコイダンの使用法については、試験管内試験の研究では、SARS-CoV-2にも効果があることが示唆されている。Kwon er al)。 Kwonら[14]は、フコイダンと他の高度に硫酸化された多糖類、ヘパリン、ヘパラン硫酸、その他のグリコサミノグリカン(GAG)の抗ウイルス活性を調べた。SARS-CoV-2ウイルスの受容体であるACE2を発現するVero細胞を用いて、表面プラズモン共鳴により、上記化合物とSARSスパイクタンパク質であるCoV-2 S-proteinとの結合を測定したところ、ヘパリンがSARS-CoV-2のスパイクタンパク質(S-protein)と極めて高い結合親和性を持つことがわかった。海藻Saccharina japonicaから抽出したフコイダン、化学酵素的に合成したヘパリンの誘導体、およびヘパリンそのものに有意な抗ウイルス活性が認められた。著者らは、SARS-CoV-2は鼻や消化管など、ACE2が十分に存在する幅広い組織に感染することから、フコイダンを含むこれらの物質の投与方法としては、鼻腔内スプレー、定量吸入器、経口投与などが考えられるとしている。また、フコイダンの経口摂取については、「一般に安全と認められている」としている。
では、COVID-19とHSV1,APOEの関連性について述べる。では、COVID-19,HSV1,およびAPOEの関連性について述べる。
4. ヘルペスウイルスの再活性化に対するCOVID-19の効果およびCOVID-19の重症度のAPOE依存性
一見バラバラに見えるこれらの話題は、以下の記事で述べられているように、実際にはつながっている。ごく最近行われた3つの研究では、重度のCOVID-19がヘルペスウイルスの再活性化を引き起こすことが示された。これは、末梢の感染症が炎症を引き起こすことにより、脳内のHSVを再活性化させることを示す多くの先行研究と一致している。Le Balc’hら[15]は 2020年3月3日から 2020年4月15日の間にCOVID-19関連の重症急性呼吸窮迫症候群(ARDS)でレンヌ大学病院に入院した患者のすべてのウイルス学的結果をレビューした。SARS-CoV-2感染はPCRで確認した。7日以上機械的に人工呼吸され、HSVとサイトメガロウイルス(CMV)のPCRが陰性だった患者を解析対象とした。HSVとCMVの複製は、各患者について週2回、気管吸引液を用いて定量的リアルタイムPCRで測定した。ヘルペスウイルス科の再活性化は,気管吸引液でHSVまたはCMVのPCRが2回連続して陽性となった場合に定義した。平均年齢59歳のCOVID-19重症患者計38名のうち、18名(47%)が少なくとも1つのウイルス性肺再活性化を呈した。このうち、9名はHSV単独の再活性化、2名はCMV単独の再活性化、7名は同時再活性化であった。(このうち9名はHSV単独、2名はCMV単独、7名は共同再活性化であった(一部の患者はヘルペスウイルス陰性であったため、その吸引液では再活性化は認められなかった)。)
Xuら[16]は、73歳の重症患者を対象に、血液、喀痰、気管支肺胞洗浄液(BALF)の検査を含む、病原体の次世代配列(NGS)の連続的な追跡検査を行った。血液中の病原体NGSの報告では、VZVとHSV1の両方の再活性化が発症していた。
Simonnetら[17]は 2020年3月16日から8月6日の間にSARS-Cov-2感染症で入院したすべての患者を対象に、EBV DNA、CMV DNA、HHV-6を調査した。全患者から入院時に鼻咽頭と喉のスワブサンプルを採取し、SARS-CoV-2感染を特定するためにリアルタイムRT PCRアッセイを用いて検査した。再活性化のリスクが高いと考えられる患者に対しては、ICUを退室するか死亡するまで、血液中のEBV DNA、CMV DNA、時にはHHV-6 DNAを定期的に定量した。コホート内の5人の患者(15%)は、ウイルスDNA血症が検出されなかった。20人の患者(59%)が1種類のウイルス(EBVが19例、HHV-6が1例)に陽性で、7/34人(20%)が2種類のウイルス(EBVとCMVが3例、EBVとHHV-6が4例)に陽性で、2/34人(6%)が3種類のウイルスに陽性であった。このように、EBV、CMV、HHV-6のウイルス血症は、それぞれ28人(82%)5人(15%)7人(22%)の患者で検出された。EBVの再活性化はICU入室後早期に起こり、ICU滞在期間の延長と関連していた。
Henekaら[18]は、COVID-19の長期的影響の可能性についてコメントしており、多くの患者におけるSARS-CoV-2への感染による神経学的な障害について述べている。退院時のCOVID-19患者の3分の1は、認知障害と運動障害を示しており、著者らは、COVID-19が高齢者で最も重篤であるという事実の関連性を強調している。COVID-19に罹患した重症患者は、高濃度の炎症性サイトカインと急性呼吸器障害を経験し、人工呼吸を必要とすることが多い。これらすべての要因は、直接的な結果として、あるいは免疫の調節障害から、あるいは既存の認知障害の増強を介して、認知機能の低下を引き起こす可能性がある。彼らは、COVID-19の生存者は、その後の神経疾患、特にADの発症リスクが高いと結論づけている。というのも、SARS-CoV-2が脳内に存在することを示す確固たる証拠がまだないからである。したがって、SARS-CoV-2がADに関与していることを否定する論拠は、HSV1がADに関与していると考えられていることを否定する論拠よりもはるかに強いものになると思われる(対照的に、多くの高齢者の脳内にSARS-CoV-2が存在していることは確固たる証拠がある)。もし、SARS-CoV-2の影響が炎症を介した間接的なものであると仮定すれば、APOE-ε4保有者の脳内HSV1の再活性化因子として作用し、ADを引き起こす可能性がある。
また、APOE-ε4が認知症やせん妄のリスクであり、高齢者では既往の認知症やせん妄がCOVID-19の重症化のリスク因子であるという事実に基づいて、APOE-COVID-19の関連性も指摘されている。Kuoら[19]は、APOE-ε4とCOVID-19の重症度との直接的な関係の可能性を検討した。彼らは、APOE-ε4ホモ接合体は実際に重症のCOVID-19感染のリスクが高く、COVID-19の重症度にも関連するAPOE-ε4関連疾患を持つ参加者を除外しても、その関連性は同様であることを発見した。筆者は、APOE-SARS-CoV2の関連性を調べることを計画していた。というのも、筆者の研究室では、口唇ヘルペスを含む多くの感染症において、APOE遺伝子型が病原体に対する感受性や病原体による損傷の重症度を決定することを明らかにしていたからである[2]。これらの疾患は,病原体が細胞に侵入するための細胞表面の受容体が,(APOE遺伝子によってコードされる)タンパク質であるアポエの受容体でもあり,タンパク質の異なるアイソフォーム(タイプ2,3,4)が,細胞への侵入をめぐって病原体と異なる程度に競合する可能性があるという理由で選択された[20]。
Kuoらの結果を説明するには、アポEのヘパラン硫酸プロテオグリカン(HSPG)-受容体結合ドメインが幅広い抗ウイルス活性を持ち、HSV1,HSV2,HIVのウイルス侵入を直接阻止することが挙げられる[21,22]。SARS-CoV2も、最初はアポEと同じ非特異的受容体であるHSPGに結合する(その後、主要な受容体であるアンジオテンシン変換酵素2(ACE2)に結合するが)ので、APOE遺伝子型効果は、アポEがHSPGの結合と競合することに起因すると考えられる。実際、関連するコロナウイルスであるSARS-CoVは、HSPGの結合と競合してラクトフェリンで抑制されることが以前に示されている。apoE-SARS-CoV-2の競合の可能性の程度は、apoEアイソフォームによって異なるかもしれない(これらのアイソフォームを作り出す変異は、apoEのHSPG-受容体結合ドメインを挟んでいる)。あるいは、SARS-CoV2による全身へのダメージが脳内で炎症を引き起こし、そこに潜伏していたHSV1が再活性化する可能性もある。実際、Helmsら[23]が発見したように、神経精神症状はSARS-CoV2が中枢神経系に侵入する必要はない。さらに、COVID-19の神経病理に関するThakurら[24]の最近の研究では、「我々の発見は、COVID19の脳における検出可能なウイルスのレベルは非常に低く、病理組織学的変化とは相関していないことを示している」と述べている。
5. 認知症発症前のHSVおよびVZV感染に対する抗ウイルス剤治療の効果
ヘルペスウイルスの再活性化の結果について、非常に驚くべき、しかし検証されれば重要な可能性のある結果がいくつか報告されている。これらを整理するために、以前に紹介した3つの関連研究の結果[25]を繰り返す価値がある。Chenら[26]は、帯状疱疹(HZ-帯状疱疹)患者と対照群を比較し、HZに関連するリスクがわずかに増加することを発見した(HR(ハザード比)1.11,95%CI、1.04-1.17)。さらに、HSV1だけでなくVZVも標的とする抗ウイルス剤(AVT)を投与したHZ患者と未治療のHZ患者を比較したところ、その後の6.2年間に認知症を発症するリスクが大幅に減少することが分かった(HR = 0.55,95% CI, 0.40-0.7)。Tzengら[27]は 2000年に新たにHSV(HSV1またはHSV2)感染と診断された50歳以上の被験者を対象に、口唇ヘルペスおよび/または性器潰瘍の症状が非常に重度で再発している可能性が高いと判断した。この人たちを、指標年にHSV感染がなかった25,086人の対照群と比較した。HSV感染者の認知症リスクは非常に高かった(HR 2.564,95%CI、2.351-2.795,p < 0.001)。感染者の多くはHSV1によるものであったが、HSV2によるリスクもわずかながら認められた。ADと血管性認知症のリスクプロファイルは類似していた。抗ヘルペス薬による治療は、10年後(2010年まで)の認知症発症を劇的に減少させ(HR, 0.092, 95% CI, 0.079-0.108, p < 0.001)治療期間が長いほど(30日以上と30日未満)予防効果が高かった。
最近では、Baeら[28]による韓国の国民健康保険サービスのデータを用いた研究で、50歳以上の229,594人が分析された。HZ患者は、認知症のリスクが高かった(調整後HR、1.12,95%CI、1.05-1.19)。HZ患者34,505人のうち、28,873人(84%)が抗ウイルス剤(アシクロビル、ファムシクロビル、バラシクロビル)による治療を受けていた。治療を受けた群では、認知症のリスクが有意に低かった(HR 0.76,95%CI,0.65-0.90)。投与期間や投与量の詳細はデータバンクになかった。しかし、これらの結果はChenらやTsaiらの結果とほぼ同様であった。
Schnierら[29]は,4つの異なる国の集団におけるHSV感染に関する全国観察コホート研究に参加した65歳以上の250万人の電子カルテをリンクして調査した。HSV感染の診断基準は記録に記載されていなかったため,血清学的検査に基づいていたのか,口唇ヘルペスや性器潰瘍(通常はHSV2によって引き起こされる)の出現に基づいていたのかは不明である。著者らは、抗ウイルス剤による治療を受けておらず、おそらく症状が軽度であった感染者と、HSV感染の検査を受けていない被験者を比較したが、ほとんどの被験者はHSV1に感染していたと思われる(人口の約80%がそうである)。当然のことながら、前者のグループは、AD/認知症のリスクがわずかに増加しただけであった(HR 1.18)。Tzengらが示したHR 2.56というはるかに大きなリスクは、後者の著者が重度のHSV1症状があると推定される対象者を比較したためであり、したがってAPOE-eε4キャリアである可能性が高いと考えられる。抗ウイルス剤治療の効果については、Schnierらが軽度のHSV1感染者を対象に、抗ウイルス剤治療(1〜2週間の単回処方)を受けた者と受けていない者を比較している。その結果、デンマークとウェールズのコホートでは、ヘルペスの抗ウイルス薬(主にACVとVCV)を1回以上処方された人は、認知症リスクが最大で11%しか低下しなかったが、これは交絡因子によるものではないかと著者らは考えている。一方、ドイツとスコットランドの他の2つのコホートでは、リスクの変化は見られなかった。ヘルペスウイルスの種類による認知症の影響はなかった。これらのデータは、AVT治療を受けた患者の認知症リスクが非常に低く、治療期間の長さを反映していると思われるTzengらのデータとは、また別の意味で対照的である。
スウェーデンのLopatko Lindmanら[30]によるごく最近の研究では 2005年から 2017年の間にVZVまたはHSV1感染と診断された50歳以上の265,172人が調査され、そのうちの何人かは主にVCVやACVなどの抗ウイルス剤で治療された。ウイルスの診断と抗ウイルス剤治療のデータは、National Patient Register(NPR)とSwedish Prescribed Drug Registerの2つの全国的なデータベースから収集した。著者らは、スウェーデンにおけるHSVおよびVZVの診断は、通常、典型的な発疹の有無とその部位についての身体検査に基づいていると述べている。おそらく、HSV1の場合は被験者が重症の口唇ヘルペスであり、VZVの場合は被験者が帯状疱疹であることを意味していると思われる。ヘルペスの診断を受けておらず、抗ウイルス剤治療を受けていない対照者は、性別と出生年で1:1の割合で無作為にマッチさせた。VZV感染者の方がHSV感染者よりも多かった(抗ウイルス剤治療を受けていない場合はそれぞれ4323人と5722人、抗ウイルス剤治療を受けている場合はそれぞれ24,045人と6510人で、被験者が両方のウイルスに感染していることを明らかにしたケースもあった)。著者らは、抗ウイルス剤治療を受けていない被験者と、少なくとも一度は抗ウイルス剤を処方された被験者を比較した。また、データベースに適切な情報がなかったため、投与量や投与期間に関連した影響を調べることはできなかった。しかし、スウェーデンの臨床ガイドラインによると、帯状疱疹の再活性化に対する標準的な投与量は、VCV1000mgを1日3回、7日間、またはACV800mgを1日5回、7日間となっている。その結果、抗ウイルス剤の投与を受けていないVZVおよびHSV感染者は、認知症のリスクが高まり(調整後HR 1.50,95%CI、1.29~1.74)抗ウイルス剤の投与により認知症のリスクが低下することがわかった(調整後HR 0.89,95%CI,0.86~0.92)。
上記のデータベースではAPOE遺伝子型が提供されていないため、上記の研究では考慮されていない大きな特徴は、APOE-ε4の影響である。この対立遺伝子は、脳内のHSV1感染と相まって、ADのリスクとなることを示す良い証拠がある。したがって、APOE-ε4保有者であるHSV1感染者は、HSV1感染者全体よりもAD/痴呆のリスクが高いことになる。一方、APOE-ε4保有者の割合はかなり低く、高齢になるにつれて減少するので、HSV1感染者全体ではリスクはほとんどない。APOE-ε4は口唇ヘルペスの主要なリスクであるため(症例の約65%を占める[2])口唇ヘルペス患者はおそらくADのリスクが高いと考えられる。
Lopatko Lindmanらの研究におけるVZVの関与は、VZVがHSV1と同様に認知症のリスクをもたらすという過去の4つの知見[26,28,29,31]を支持するものである(さらに、本著者らによるVZVの疫学的・血清学的研究[32,33]によっても支持されている)。
VZVに関する疫学研究は、帯状疱疹が容易に診断される病気であることから、比較的簡単であることは言及する価値がある。一方、HSV1の場合、口唇ヘルペスは軽度であれば、診断はおろか医師に報告されないことが多い。このような詳細はデータバンクに記録されることはないので、(VZVのグッドメーカーである帯状疱疹とは異なり)口唇ヘルペスは疫学研究におけるHSV1感染のマーカーとしては適していない。重要なことは、口唇ヘルペスに関する研究には、それが周辺部に潜伏しているHSV1だけでなく、脳内に潜伏しているHSV1の再活性化を示しているのかどうかがわからないという欠点があることである。また、周辺部におけるHSV1抗原の存在を示す血清抗体が、脳内におけるHSV1の活動を示しているのかどうかについても、同様の不確実性がある。
VZVの作用が直接的であるかどうか、すなわち、VZVが脳内に存在し、その後、脳内で再活性化されることに起因するのか、あるいは、代わりに、脳内に存在するHSV1の再活性化を引き起こす炎症過程を介して作用する間接的なものであるかどうかについては、不明である。このような間接的な炎症による中枢神経系におけるHSV1の再活性化は、おそらく末梢神経系におけるVZV以外の感染因子によっても引き起こされる可能性があり[34]、前述したようにSARS-CoV-2もその一つである。実際、筆者の研究室では、ADと老齢対照の脳にVZVのDNAを探索したが[35]、検出されなかった。一方、Hemlingら[36]は、HSV1のDNAは検出されなかったが、VZVの場合は検出された(驚くべきことに、両ウイルスのDNAの検出感度はLinらのそれよりもはるかに低かった)。VZVの認知症への関与は、他のアプローチでも示唆されている。例えば、Grahnらの研究[37]では、VZVの急性感染後、主に中枢神経系の症状を呈していた患者が3年後に著しい認知機能の低下を示した。
抗ウイルス剤による治療がその後の認知症にほとんど影響しないというSchnierらの結果は、台湾の2つの研究や、Baeら、Lopatkin Lindmanらの研究とは異なり、いずれもヘルペス感染の抗ウイルス剤による前処置がその後の認知症のリスクを低減することを示している。これはおそらく、Schnierらの研究に比べて、抗ウイルス剤の投与期間が非常に長く、頻繁に使用されていることに関係していると思われる。
抗ウイルス剤の事前投与によって認知症が予防されるという実際の順序は不明である。筆者やRichard Latheが指摘したように[38]、この予防効果は非常に不可解である。なぜならば、各治療後に抗ウイルス剤はわずか数日間しか体内に残らず、その多くが排泄されてしまうからである。我々は、約24年前の私のグループの研究[2]に基づいて、1つの可能な説明を提案した。それは、ほとんどの成人の末梢神経系に存在するウイルスが、中年期後半に免疫システムの衰えとともに末梢神経系から中枢神経系に移動するのではないかというものである。この提案が正しいと仮定すると、我々は、抗ウイルス剤の投与によってHSV1の脳への移行が阻止されるか、あるいは移行が遅れるのではないかと推測した。もしそうであれば、台湾での調査を5~10年延長すれば、治療を受けたコホートで2010年以降に認知症患者が増加するかどうかを判断できたかもしれない[38]。そのような認知症患者と、認知症にならなかった患者の死後の脳にHSV1 DNAを調べることは、状況を解明するのに役立ったかもしれない。
また、Lopatko Lindmanらが示唆しているように、高齢者においてウイルスがすでに脳に到達している場合、抗ウイルス剤が再活性化の頻度を減少させる可能性もある。しかし、この2つの提案に対する反論は、治療期間が長くなったり、投与回数が多くなったりしても、その後のウイルスの中枢神経系への移行や、中枢神経系での通常の再活性化の再開により、最終的には効果がなくなってしまうと考えられることである。このように、抗ヘルペス剤の投与がその後の認知症のリスクを減少させる効果があるかどうかの謎はまだ解決されていない。
VZVが脳に生息しているかどうか、またHSV1が脳に生息する唯一の向神経性性ウイルス(または細菌)であるかどうかを明らかにすることは非常に興味深いことである。また、APOEの遺伝子型や、使用した抗ウイルス剤の種類、期間などの詳細を明らかにする必要がある。
6. VZVのAD/認知症への関与
前節で述べた研究を除いて、VZVが認知症の将来的な原因として示唆されたことは今のところない。VZVの関与を否定する可能性があるのは、VZVが通常1回だけ再活性化し、2回目の再活性化はほとんどないという事実である。認知症は何年もかけて進行するので、再活性化が繰り返されることは、認知症発症の必須条件であると思われる。しかし、前述のように、認知症の原因が、脳内にVZVが存在する場合と、末梢のVZV感染による炎症(潜伏しているHSV1の再活性化因子として知られている)を介して、脳内でHSV1が再活性化される場合があるかどうかは不明である。帯状疱疹患者の場合、Chenら[26]とBaeら[28]は、帯状疱疹は明らかにAD/認知症のリスクと関連していたが、そのリスクは小さく、抗ウイルス剤で治療を受けた患者では有意に低かったとしている。
APOEの対立遺伝子が帯状疱疹のリスクをもたらすかどうかについては不明である。Pirtillaら[39]は、HZ患者41人のAPOE遺伝子型を調査し、患者と対照者の間に対立遺伝子の頻度の差は認めなかった。対照的に、私のグループは、関与する病原体が特定のapoEアイソフォームと細胞表面受容体を共有しているため、細胞への侵入をめぐって競合する可能性がある疾患に関するいくつかの研究のうちの1つとして、APOE-ε4のホモ接合体を持つ女性は帯状疱疹のリスクが通常より高いことを明らかにした[40]。しかし、どちらの研究も参加者数が少なかったため、再調査が必要である。
7. HHV6のADへの関与の可能性
ADに関与している可能性のある別のヘルペスウイルスはHHV6である。アルツハイマー病患者ではHHV6の頻度が高い(70%)が、年齢をマッチさせた対照群では低く(40%)HSV1との重複が多く、アルツハイマー病患者の脳の54%に両ウイルスが保有されていた。対照的に、Itzhaki研究室では、アルツハイマー病患者だけでなく、高い割合の高齢対照者の脳からもHSV1が検出された(言い換えれば、これらの対照者は感染していても無症状であったため、多くの微生物疾患で見られるように対照者として分類された)[41]。その際の顕著な違いは、アルツハイマー病患者のほとんどがAPOE-ε4対立遺伝子を持っていたが、高齢対照者ではほとんどいなかったことであり、脳内HSV1とAPOE-ε4を合わせてADの主要な危険因子として提案された。しかし、APOE-ε4を持つアルツハイマー病患者では、HHV6は直接関連していなかった。我々は、HHV6は日和見感染であるかもしれないが、代わりに、ADにおけるHSV1およびAPOE-ε4による障害を増強する可能性があることを示唆した[35]。
Readheadら[42]は、4つの独立したコホートを用いて、アルツハイマー病患者と対照者の脳サンプルのトランスクリプトームを分析し、高齢者とADの脳で、HSV1だけでなく、ヘルペスウイルス6Aと7を検出した(残念ながら、Readheadらのデータには、HSV1を検出しなかったという誤った報道がなされることがある)が、4つのコホートのうち3つでは、HHV6とHHV7のレベルが対照者よりもADのサンプルで高かった。これらのウイルスに感染すると、タンパク質およびmRNAレベルの解析から、いくつかの転写調節因子(アミロイド前駆体タンパク質の処理やADリスク関連遺伝子の調節因子を含む)に変化が生じることが示唆された。Readheadら[42]のデータは、HHV6とHHV7が単なる日和見感染であることを否定するものであり、Linら[35]のデータは、これらのウイルスのレベルと様々な特徴的なADのレベルとの間に関連があることを明らかにした。
しかし、これらの結果は、2つの反論を招いた。Allnutら[43]は、Readheadらが調査した2つの情報源からのバイオインフォマティクスデータを、BROAD研究所が開発したPathSeqツールを用いて再解析した。PathSeqツールは、118種類のヒトウイルスを含む25,000種類以上の微生物をスクリーニングするツールで、アルツハイマー病患者と対照者の脳から採取したDNAを、飛沫デジタルPCR(dd PCR)によってHHV-6AとHHV-6Bについても分析した。その結果、いずれのウイルスも検出される頻度は極めて低く、AD(またはADの下位分類)と非ADの脳の間で有意な差はないことがわかった。驚くべきことに、AllnutらはHSV1転写物が明らかに存在しないことを論じていない。実際、正常な高齢者の脳にもADの脳にもHSV1のDNAが存在することはよく知られている。多種多様な方法を用いた数百の研究から得られたデータは、脳内のHSV1の存在、ウイルスの活性、潜伏または再活性化の状態と一致しており、その多くはAPOE-ε4保有者の脳内のHSV1がADの高いリスクをもたらすという概念と一致している。さらに、APOE-ε4が末梢神経系の口唇ヘルペスのリスクとなるという知見は、通常HSV1が原因となるが、APOE-ε4保有者のHSV1は神経系で特に有害であるという概念と一致する。
Allnuttらは、ADと対照群における特定のウイルスの頻度/有病率、あるいは量/レベル/豊富さの値が類似していることから、HHV6はADにはおそらく関与していないと結論づけているが、これは冒頭で述べた「対照群も感染しうる」という一般的な指摘を強調する必要があることを示している。さらに、脳サンプル中のHHV6およびHHV7を求めるddPCR実験では、偽陽性のチェックについては言及されていたが、偽陰性のチェックについては言及されなかった(彼らの結果はほぼ完全に陰性であったが)。その他の有用な情報としては、研究のために入手したDNAの調製方法の詳細が挙げられるであろう。というのも、ある種の抽出手順では、DNA種が非常に低いレベルで存在していたとしても、それが失われる危険性が高いからである。
Chorlton[44]は、Readheadらの補足データをKrakenUniqという高速かつ高感度な方法で分析したところ、HHV7は検出されず、HHV6Aを最も多く検出したと報告されているサンプルの13%でHHV6Aを検出した。さらに、ReadheadらのSupplementary Table S2に基づき、彼らが修正したViromescanに基づいてウイルスの有病率を計算したところ、マウントサイナイ脳バンク(MSBB)の主要データセットでは、602個の脳サンプルのうち、HHV6AとHHV7がそれぞれ27%と30%で検出された。特筆すべきは、天然痘の原因ウイルスであるバリオラウイルスが、MSBBでは97.5%も検出されたことである。
したがって、これらの2つの研究は、HHV6がADに関与しているかどうかという疑問に対する答えはおろか、明らかにされておらず、実際、アルツハイマー病患者および年齢をマッチさせた対照群の脳におけるHHV6の有病率さえもまだ不確かである。
8. ワクチン接種によるADのリスクとHSV1再活性化の防御
いずれのウイルスがADに関与しているとしても、その作用を防ぐためには、それぞれのウイルスに対する特異的なワクチンが必要であると考えられる。しかし、ワクチン、特に結核予防を目的としたBCG(Bacillus Calmette Guérin)は、20世紀初頭から、多様な非特異的(オフターゲット)効果を引き起こすことが知られている(レビュー[45,46,47]参照)。これらの効果には,結核に対する効果とは無関係に乳幼児の死亡率を低下させるものが含まれている.例えば,西アフリカでは,BCGを接種した子供たちの総死亡率が50%低下したことが実証されているが,この効果は結核に対する保護だけでは説明できないほど大きなものであった[46].さらに最近では,これらの知見は,無作為化比較試験(RCT)や,低出生体重児の死亡率低下を調査した3つのRCTのメタアナリシスでも検証されている[46].BCGによって乳児の死亡率が低下したのは、関連性のない感染因子、特に呼吸器系感染に対する防御と、新生児敗血症に対する防御によると考えられている[48]。
Artsらは、BCGが実験的弱毒化黄熱ワクチン(YFV)によってボランティアに引き起こされるウイルス血症を減少させることを発見し、BCGが無関係な病原体に対するex vivoサイトカイン反応を増強することを示すいくつかの先行研究を確認した。著者らは、BCGワクチン接種によって単球のエピジェネティック・リプログラミングが誘導され、それに伴って自然免疫細胞の反応が大きく変化することを示唆している。このことは、BCGワクチンを接種したボランティアの末梢血単核細胞(PBMCs)では、プラセボを接種した人に比べて、炎症性サイトカイン(TNFa、IL-1b、IL-6)の産生量が多いことからもわかる。このような高いサイトカイン産生能は、局所的な抗菌反応とそれに続く病原体の排除を迅速に行うことで、全身的な反応を防ぎ、循環するサイトカインのレベルが高くなるのを防ぐ。著者らは、ウイルス量が少ないにもかかわらず、BCG接種は抗黄熱保護抗体の生成に影響を与えず、YFVの特異的効果にも影響を与えなかったことを強調している。このことは、BCGが抗原提示能力と適応反応を向上させる可能性を示唆しており、BCGがその後の3価インフルエンザワクチン接種に対する反応に有益な影響を与えることを示した別の研究と一致している[49]。後者の研究では、3価のインフルエンザワクチン接種も、さまざまな病原体によって誘発されるサイトカイン反応に非特異的な影響を与えることがわかった。
動物実験では、BCGの免疫が、炎症を解決する単球の脳へのリクルートを介して、APP/PS1マウス(家族性ADのモデル)の神経炎症と認知障害を緩和するという、一貫したデータが得られている[50]。著者らは,BCGの投与により,4Aβ1-15(GPGに結合したAβ1-15配列の4つのタンデムリピート)を接種した対照群で観察された認知機能の低下が回復したが,脳内のAβ負荷は減少しなかったことを示した。このことから、BCGはAPP/PS1マウスにおいて、全身の免疫抑制の緩和、インターフェロン-γ反応の誘導、神経炎症反応の緩和を通じて、有益な免疫調節作用を発揮することが示唆された。
ワクチンのオフターゲット効果に関する重要な研究として、Verreaultら[51]は、ジフテリア、破傷風、ポリオ、インフルエンザのワクチンがADの発症を予防することを明らかにした。この論文に対するコメントでは、感染が減少し、したがって炎症が減少することにより、おそらくリスクが減少することで、脳内でのHSV1の再活性化の頻度が減少し、それによってADのリスクが減少するのではないかと示唆されている[52]。Verreaultらのデータと同様に、その後の研究[53]では、BCGワクチンが膀胱がん患者のAD発症率を低下させたことが示された。著者らは、BCGが脳内の抗炎症性サイトカインを増加させ、その結果、神経炎症が減少することを示唆した。
PittetとCurtis[47]およびAdesanyaら[45]のレビューでは、HSV1-ADの概念に非常に関連して、口唇ヘルペスおよび性器ヘルペスの再発に対するBCGの効果に関するいくつかの研究が分析された。Hippmanら[54]は、Tine-test陰性(すなわち、M.tuberculosisへの感染が陰性)の対象者の口唇ヘルペスの再発を予防するための1回のBCG皮内注射の有効性を調査した。109人の患者にBCGワクチンを接種し(109人中106人でTine-testが陽性となった)その再発率をワクチン接種前と比較した(つまり、各人が自分自身の対照となった)。ワクチン接種後、少なくとも4~6ヶ月間、再発した被験者はいなかった。Hippmanらは、別のグループの被験者を10年間追跡調査し、BCGの効果が年々低下していることを示したが、3年後に21人(19%)がまだ再発しておらず、6年以上経っても10人(9%)が再発していなかった。これらのBCG後の再発の頻度と期間の減少は、統計的に有意であった(p<0.01)。PittetとCurtisは,HSVの再発に対するBCGの効果をさらに調査することを推奨した。特に,適切にコントロールされたRCTをさらに行い,BCGの菌株,最適な投与量,反復投与の必要性の影響について情報を得るべきである。
9. 抗HSV血清抗体とADのリスク
前述の「認知症発症前のHSVおよびVZV感染に対する抗ウイルス剤治療の効果」の項で述べたように、HSV1に対する抗体、特に免疫グロブリンG(IgG)と免疫グロブリンM(IgM)の存在、レベル、アビディティ(抗原に対する抗体の結合力の相対的な強さ)を調べた研究がいくつかある。これらのデータが末梢神経系のみにおけるHSV1の作用についての情報を提供しているかどうかは不明であるが、少なくとも部分的には中枢神経系にも当てはまると思われる。
Letenneurら[55]は、65歳のグループを14年間にわたって調査し、血清中の抗HSV1 IgMを末梢神経系における最近のHSV1再活性化のマーカーとして用いることで、HSV1再活性化を経験した人はIgM陰性の人に比べてAD発症のリスクが高いことを明らかにした。その後、HSV1-IgG抗体の高値は、年齢をマッチさせた対照群と比較して、患者でより頻繁に見られることが判明した[56]。さらに、軽度のアルツハイマー病患者(Mini-Mental State Examination(MMSE)18-23)において、HSV1特異的IgG抗体価とADで主に影響を受ける脳領域の皮質体積との間に正の相関関係が報告された[57]。[そのため、HSV1特異的体液性免疫がADの初期段階において保護的役割を果たしている可能性が示唆された[58]。この相関関係はHSV1でのみ生じ、CMVやHHV6抗体では生じなかった。また、後者はアルツハイマー病患者の磁気共鳴画像データ(皮質の体積を示す)や臨床パラメータとの相関関係はなかった[56,57,58]。最近では、Lovheimら[59]が、血清IgG抗体の存在とレベルで示されるHSVの保有とエピソード記憶機能の低下との間に関連性があることを発見した。
Lopatko Lindmanら[60]およびLinardら[61]による他の2つの研究では、HSV1とAPOE-ε4がもたらすADの複合リスクに関連して、これらの特徴が検討された。Lopatko Lindmanらは、大規模なネステッドケースコントロール研究を調査し、APOE-ε4ヘテロ接合体と抗HSV1 IgGの保有に関連して、APOE-ε3ホモ接合体と比較してAD発症リスクの増加を認めた(OR 4.55, p = 0.02)が、いずれかの因子のみの保有、抗HSV2 IgG、抗CMV IgGについては認めなかった。APOE-ε4ホモ接合体はリスクを大幅に増加させたが、APOE-ε2ホモ接合体には有意な関連はなかった。さらに、9つの追加リスク遺伝子に基づいて算出された遺伝的リスクスコアは、抗HSV1 IgGと相互作用し、ADのリスクを増加させた(OR 2.35, p = 0.01)。Linardらは、前向きコホートを調査し、HSV1再活性化の頻度が高いとされるAPOE-ε4キャリアーでは、IgM陽性またはIgGレベルが高い人はADのリスクが高いと報告した。APOE-ε4陰性者は有意な関連を示さなかった。
Pandeyら[62]は、新たな遺伝学的アプローチとして、IgG1抗体遺伝子の変異であるGM17のホモ接合体保有者は、APOE-ε4のリスクとは無関係に、非保有者に比べてADのリスクが4倍高いことを報告している。GM17は、HSV1のデコイ受容体に対する親和性を高めている。このデコイ受容体は、ウイルスと感染細胞の表面に存在するgE-gIという2つの糖タンパク質の複合体であり、宿主IgGのFc領域と結合する(ウイルスの細胞間伝播に関与する)。これにより、HSV1は抗体を介した宿主の反応(細胞の免疫防御)を回避することができる。HSV1特異的抗体がAD発症を予防する可能性を裏付ける他の証拠として、ADの発症率は加齢とともに増加すること、血液脳関門(BBB)の損傷は正常な脳でも検出されるが、軽度認知障害(MCI)被験者ではより顕著であることなどが挙げられる[63,64]。したがって、比較的高濃度のHSV1特異的抗体は、BBBが破壊された脳領域でのウイルスの再活性化を抑制する可能性がある。(Montagneら[64]はその後、APOE-ε4キャリアでは、認知機能が低下していないキャリアでも海馬や側頭葉内側で血液脳関門の破壊が起こっているが、認知機能が低下している被験者では破壊が大きく、CSFやPETで測定したAβやタウの病理とは無関係であることを示している。) 体液性応答の有効性は、抗体のアビディティによっても決定される。HSV1-IgGのアビディティ指標は、MCI被験者では健常者やアルツハイマー病患者よりも高いことが判明しており[65]、HSV1特異的抗体のアビディティは、ADを発症しなかったMCI被験者では、発症した被験者よりもベースラインで有意に高かった[66]。
10. APOEと感染症および感染負荷と認知機能との関係
APOE-ε4は、ADの最初に発見された主要な危険因子であり、認知機能の低下はADの主要な特徴である。このリスクとこの症状がどのように相互作用するのか、また、感染がどのように関与するのかは大きな問題である。実際、認知機能と感染因子に関する2つの興味深い研究と、APOEと認知機能に関する2つの研究が最近発表された。非常に興味深いのはZhaoら[67]の研究で、Northern Manhattan Study (NOMAS)という多民族コホートの調査について述べている。彼らの目的は、APOE-ε4がこの集団における感染負荷(IB)と認知的転帰との関連を変化させるかどうかを調べることであった。IBは、血管リスクに関連する一般的な病原体への曝露を定量的に加重した指標であるInfectious burden index(IBI)と、個々の感染症の血清検査によって評価された。彼らは以前、脳卒中のリスクに関連する一般的な病原体への曝露の複合的な血清学的指標であるIBIと、グローバルな認知機能評価における認知機能の低下との間に関連性があることを発見していた。その後、詳細な神経心理学的検査を行ったところ、IBIと実行機能領域との間に関連性があることがわかり、また、時間の経過とともに記憶力が低下することもわかったという。肺炎クラミジア、ピロリ菌、サイトメガロウイルス、HSV1およびHSV2に対するELISA法を用いて、IBの血清を調べた。肺炎クラミジアを除くすべての病原体にはIgG抗体が用いられ、IgA抗体が用いられた。認知機能は,ベースライン時にはMMSEで評価し,中央値で約6年後には,記憶,処理速度,言語,実行機能などの認知領域からなる神経心理学的検査の全項目で評価した。
APOE-ε4とIBIの相互作用を表す項を加えて、線形回帰とロジスティック回帰を調整し、IBIと認知機能との関連を推定した。その結果、神経心理学的検査の結果が得られた被験者では、処理速度に関して、IBIとAPOE-ε4(p=0.07)HSV1とAPOE-ε4(p=0.02)の間に相互作用が認められた。IBIは、非ε4キャリアでは処理速度の低下と関連していたが、APOEε4キャリアでは関連していなかった。HSV1陽性は、非ε4キャリアーでは処理速度の低下と関連していたが、APOEε4キャリアーでは関連していなかった。この研究の2つの興味深い点は、異なる民族間でのAPOE-ε4頻度の違いの関連性と、APOE-ε4の多面性(下記参照)の関連性についての議論であり、APOE-ε4はIBIと認知機能の関連性の修飾因子として働き、さらに民族によってある程度修飾されるというものであった。しかし、著者らは、HCV感染による肝臓の保護作用として挙げられているε4だけでなく、多くの感染症においてAPOEが感染の影響を調節していることを知らないようである[20]。さらに、アルツハイマー病患者においては、HSV1感染者の割合が非常に高いことを考えると、APOE-ε4保有者がHSV1に対する感受性を高めているのではないかという彼らの指摘が正しいとは考えられない。
関連したテーマの別の研究[59]では、大規模なコホートを対象とした横断的および縦断的な研究を用いて、ADの初期段階において、数年にわたるエピソード記憶の低下とHSVおよびAPOE-ε4との間に関連性があるかどうかを調べた。エピソード記憶障害は、ADの最初の前臨床症状の一つであり、加齢に伴うADリスクの上昇と強く関連しているが、その経過は個人によって大きく異なる。横断的解析では、HSVの存在(IgG血清陽性)とエピソード記憶機能(5つのエピソード記憶課題の複合指標を使用)の低下との年齢依存性が示され、特にAPOE-ε4キャリアで顕著であった(p = 0.008)。また、縦断的な解析により、高齢のHSVキャリアではエピソード記憶機能の低下のリスクが高まることが明らかになった(p < 0.001)。以上の結果から、HSV感染とエピソード記憶機能の低下との関連性が、特にAPOE 4キャリアにおいて支持された。
Gharbi-Merianiらの研究[69]では、APOE-ε4接合体と認知機能との関連性が中年期と老年期で変化するかどうかを調べることを目的とした。この対立遺伝子は、遅発性アルツハイマー病の最も強い遺伝的危険因子であり、欧米の集団におけるε4対立遺伝子ヘテロ接合体の有病率は約25〜30%、ε4ホモ接合体は約2%であり、この病気のリスクを持つ人は多く存在する。しかし、認知症との関連は別にして、APOEε4と成人の生涯にわたる認知機能の変化との関連は不明である。今回の調査では、Whitehall II Studyの被験者5561人を対象とした。Whitehall II Studyは、英国の公務員を対象とした現在進行中のコホート研究で、全員が白人である。著者らは、いくつかの先行研究で、APOE-ε4ホモ接合体では認知機能の低下が促進されるが、ヘテロ接合体ではそうではないことが示されたとコメントしている。さらに、APOEε4と認知機能との関係は年齢に依存すると考えられてきたが、その関係は不明確であり、ε4キャリアでは若年時に認知機能が向上すると報告している研究もあるが、すべてではない。著者らは、APOEε4と認知機能との年齢依存性は、遺伝子の健康への影響は人生のステージによって異なるとする拮抗型多面性仮説によって説明できるとしている。しかし、APOEに関するほとんどの研究が65歳以上の被験者を対象としており、追跡調査期間が10年未満であることから、説明や推論には限界があるという。
著者らは、今回の縦断的研究では2つの主要な知見が得られたと結論づけている。第一に、APOEのε4対立遺伝子は、ヘテロ接合体でもホモ接合体でも、認知症の発症にかかわらず、成人期の認知機能低下を促進することが確認された。e4キャリアの認知機能は、ホモ接合体では65歳から、ヘテロ接合体では75歳から、非ε4キャリアに比べて明らかに低下していた。第二に、APOEε4の一見逆説的な効果がヘテロ接合体に認められ、55歳までは非ε4キャリアよりもグローバル認知スコアの成績が良かった。より詳細な解析では、若年のε4ヘテロ接合体の方が実行機能に関わるテスト(推論、音韻流暢性)で優れた成績を示した。これらの結果は、拮抗的な多面的作用仮説を支持するものである。著者らは、約55歳以下のAPOE-ε4保有者は、特に推論力と精神運動速度において有利であり、平均寿命が50歳以下であった有史以前の時代にε4対立遺伝子を保存するのに役立ったのではないかと考えている。彼らもまた、Zhaoら[67]のように、APOEがいくつかの感染症に対する反応を調節することが示されていることや[20]、HCVによる肝臓障害の場合には、APOE-ε4が保護作用を持つことから、その保有が他の特定の病原体に対する進化上の優位性を持つ可能性があることを知らなかったのだろう。
HSV1とADに関するAPOE-ε4の保有の関連性を考慮していないと思われる報告がもう一つある。Murphyら [70]は、Rotterdam研究の4つのコホートのうち2つのコホートのデータを用いて、HSV1と認知機能低下、痴呆およびADのリスクとの関係を調べた。著者らは,2002年から 2005年の間に採取したHSV1に対する血清IgG抗体と,6.5年の間隔をおいて行われた2回の連続検診における認知機能の変化を測定した。1915人の非認知症の被験者(平均年齢71.3歳)を対象に、HSV1と認知症およびADのリスクとの関連を調べたところ、平均9.1年の追跡調査の間に244人が認知症を発症し、そのうち203人がADと診断された。対照群は血清陰性者であった。HSV1陽性は、全体的な認知能力の低下、および個別の認知領域における認知能力の低下と関連していた。しかし、HSV1陽性は、認知症のリスク(調整後HR 1.18,95%CI 0.83-1.68)や、ADのリスクとは関連しないことがわかった。このことから、HSV1は微妙な認知障害にのみ関連し、認知症に至るような大きな認知障害には関連しないことが示唆された。HSV1とADの関係は、APOE-ε4対立遺伝子の保有と脳内のHSV1の存在に依存していることを彼らは知らなかったことが、彼らの考察から明らかになった。本論文の冒頭で強調したように、HSV1だけではADのリスクはほとんどあるいは全くない。この事実は、このウイルスが60歳までに西欧諸国の人口の約80%に感染していることを考えれば明らかである。もし感染者全員が結果的にADを発症したとすれば、これらの人口の80%がこの病気に倒れることになるが、これは恐ろしいことである。さらに、台湾の(Tzeng et al 2018)の研究との比較は、後者は(ほぼ確実に)APOE-ε4のHSV1感染キャリアと、ウイルスに感染していない人とを比較しているので、妥当ではなかった
11. HSV1誘発の酸化ストレス、オートファジー、アポトーシスとADとの関係
ADに関与していると考えられている細胞プロセスの主な障害とその原因として、ADの病理に強く関与している酸化ストレス(OS)と、その原因となることが知られているHSV1が挙げられる。ADの脳は、脂質過酸化の基質である多価不飽和脂肪酸が多く、酸素の使用量が多く、抗酸化物質が少なく、様々なタンパク質誘導体や脂質酸化生成物などの酸化ストレスマーカーの増加が見られる。単純ヘルペス脳炎(稀だが非常に重篤な急性HSV1脳感染症)では、活性酸素やニトロ種の産生が増加し、酸化ストレスを助長する。また、HSV1に感染した神経細胞の培養では、活性酸素種(ROS)の産生が増加し、脂質過酸化を含む神経細胞の酸化損傷が生じる。最近、Prottoら[71]は、同じグループが設定したマウスモデル[72]において、熱ストレスによって複数のHSV1再活性化が達成された場合の酸化的損傷を調査した。Prottoらは生化学的および酸化還元プロテオミクス的アプローチを用いた。その結果、再活性化によって大脳皮質の脂質とタンパク質が酸化的に変化し、そのタンパク質のほとんどが、エネルギー代謝、タンパク質の折り畳み、分解プロセス、細胞構造など、ADの発症と進行に関連する細胞プロセスに関与していることがわかった。研究チームは、脳内で再活性化が繰り返されると、ミスフォールドしたタンパク質の蓄積、細胞骨格ネットワークの乱れ、酸化したタンパク質やDNAのクリアランス機構の乱れなどの酸化的なダメージを受け、細胞のタンパク質ではなくウイルスのタンパク質を合成するために細胞の翻訳機が使われるようになり、神経変性の原因となる可能性があると結論づけた。
HSV1が(損傷を受けたタンパク質の)クリアランスやオートファジーに及ぼす影響がADに関係している可能性が2008年に提案された[73]。これは、ウイルスが細胞内でAβとP-tauを生成するだけでなく、HSV1タンパク質ICP34.5を介してオートファジーを阻害し、それらの分解を妨げ、その結果、それらの蓄積と沈着を引き起こすと仮定された。その後,HSV1による酸化ストレスを介したリソソーム系のクリアランス機構の障害の詳細が多くの研究で報告されており,最近ではKristenらが報告している[74]。彼らは、ADの細胞モデルにおいて、HSV1とOSがリソソームの負荷を増加させ、リソソームのヒドロラーゼの活性を低下させ、カテプシンの成熟に影響を与え、エンドサイトーシスを介した上皮成長因子受容体の分解を阻害することを見出し、リソソームシステムの障害を示した。彼らは、機能的ゲノム解析からも同様の結論を導き出した。
Duarteら[75]は、HSV1感染とアポトーシスの関係について述べている。彼らは、アポトーシスは神経変性の結果であると考えられているが、アポトーシスに関連するシグナル伝達経路の変化は、ADのような神経変性疾患に広く関与しており、それらは感染中にHSV1が神経細胞のアポトーシスを調節することによって引き起こされる可能性があるとコメントしている。宿主細胞はウイルス感染時にウイルスを排除するためにアポトーシスを利用するが、HSV1はこれに対抗するために、神経細胞に感染した後、急性感染時および潜伏感染時の複数の段階でアポトーシス関連経路を調節し、アポトーシスの誘導または遮断を行うことができる。このようにして、ウイルスは神経細胞の生存と自分自身の持続を操作することができる。アポトーシスの阻害は、HSV1タンパク質のICP34.5を介して起こる。ICP34.5はeIF2αを脱リン酸化することで、宿主細胞とウイルスのタンパク質合成の停止を阻止し、アポトーシスを防ぐ一方で、オートファジーを促進する。しかし,Dollら[76]は,HSV1に感染したマウスの三叉神経節ニューロンでは,再活性化後,食細胞性マクロファージやミクログリアがHSVタンパク質を含むニューロンを破壊することで,感染性ウイルスが排除されることを示した。
ADにおけるミトコンドリア障害の関与については,Reddyらが議論している[77].彼らは、ミトコンドリアのエネルギー代謝が変異型APPやAβの発現によって損なわれ、その結果、ミトコンドリア遺伝子やアポトーシス関連遺伝子のアップレギュレーションが代償反応であり、ADの初期の変化であることを提案した。最近、PradeepkiranとReddy[78]は、損傷したミトコンドリアが選択的に細胞から除去されるプロセスであるマイトファジーが障害され、欠陥のあるオルガネラや損傷したミトコンドリアの蓄積が進行すると述べている。ADでは、AβとP-tauの増加が活性酸素の産生を誘発し、ミトコンドリアの過剰な断片化を引き起こし、マイトファジーの障害を促進する。HSV1とマイトファジーに関しては、ウイルスがマイトファジーに及ぼす影響を調べた研究は1件しかない。WaisnerとKalamvoki [79]は、HSV1が、HSV1タンパク質であるICP0を介して、オートファジーアダプタータンパク質であるsequestosomeとマイトファジーアダプターであるoptineurinをダウンレギュレートすることにより、病原体に対する防御機構であるオートファジーとマイトファジーの宿主のメカニズムを回避することを明らかにした。
12. 結論
APOE-ε4保持者の脳にHSV1が存在し、ADの強いリスクをもたらすという証拠は増え続けているが、筆者が知る限り、ごく最近になって反証となる実験結果は発表されていない。HSV1が長い年月をかけてこの疾患の発症を引き起こす正確なメカニズムの詳細はまだ明らかにされていない。このウイルスの驚くほど多様な作用を考慮すると、また、現在のところ、生きている間に脳内で再活性化してもそれを検出することができないという非常に残念な状況を考慮すると、これは困難なことである。潜伏期におけるHSV1の影響を解明すること、特に潜伏期の適切なモデルシステムを開発することは非常に重要であり、また、アポE-ε4が存在しない場合にHSV1だけでどのような影響があるかを解明することも重要である。しかしながら、すべての証拠から、さらなる臨床試験の必要性が高まっている。筆者の意見では、患者(少なくともHSV1血清陽性のAPOE-ε4保有者)には、VCVだけでなく、HSV1 DNA複製阻害剤とは全く異なる作用機序を持つフコイダンも投与すべきであると考えている。VCVに代わるものとして,ヘリカーゼ・プライマーゼ阻害剤の使用が考えられる。興味深いことに,このような新しい阻害剤であるIM-250の研究が行われており,動物では十分な脳への曝露が可能であり,(通常の1日2回ではなく)1日1回あるいは週1回という優れた投与法が可能であると報告されている[80]。同様に、あるいはそれ以上に刺激的なのは、BCGを中心としたワクチンの認知症発症に対する明らかな予防効果を調査する試験や、HSV1の症状のある患者を、認知症の兆候が検出される前の中年期に抗ウイルス剤で治療する試験である。認知症の予防は実に素晴らしい成果である。
