Nuclear Factor-Kappa B and Alzheimer Disease, Unifying Genetic and Environmental Risk Factors from Cell to Humans
www.ncbi.nlm.nih.gov/pmc/articles/PMC5732234/
要旨
炎症系の病理学的加齢がアルツハイマー病とどのように関係しているかは不明である。我々は、脳脊髄液(脳脊髄液)および血漿中の加齢に関連した炎症性変化がアルツハイマー病の異なるステージにわたって存在するかどうか、また、そのような変化がアルツハイマー病の病理学に関連するかどうかを検証した。
線形回帰は、まず、脳脊髄液と血漿の両方で測定された73種類の炎症性タンパク質のコレクションに基づいて、アミロイドβ陰性で認知機能障害のない個人(Aβ- CU、n = 312)の時系列年齢をモデル化するために使用された。次に、軽度認知障害(Aβ+ MCI;n = 150)またはアルツハイマー病性認知症(アミロイドβ+ アルツハイマー病;n = 139)を有するアミロイドβ+患者の蛋白質レベルにフィットモデルを適用し、蛋白質のみから予測される年齢(「炎症性年齢」)が真の年代から有意に異なるかどうかを検証した。
自覚的認知機能低下(Aβ- SCD;n=125)またはMCI(Aβ- MCI;n=104)を有するアミロイドβ-個体を独立した対照群として用いた。次に、炎症性年齢と時系列年齢との差(InflammAGEスコア)を、アミロイド、タウ、認知のコアアルツハイマー病バイオマーカーとの関連で評価した。
Aβ-CU患者では、脳脊髄液と血漿中の炎症性蛋白質の両方が年齢と有意に関連しており、脳脊髄液ベースの蛋白質は血漿ベースの蛋白質よりも慢性年齢を予測していた。一方、Aβ-SCD群と検証用Aβ-CU群では有意な炎症性老化は認められなかったが、アミロイドβ-MCI患者では脳脊髄液の炎症性マーカーでは炎症性老化が増加したが、血漿の炎症性マーカーでは増加しなかった。
脳脊髄液および血漿中炎症性変化はともにアミロイドβ+MCIおよびアミロイドβ+アルツハイマー病群で認められ、Aβ-CUおよびAβ-SCD群と比較して変化の程度が異なっていた。
最後に、脳脊髄液の炎症性変化はアミロイド、タウ、一般的な神経変性、認知と高い相関性を示したが、血漿中の変化はほとんどがアミロイドと認知と関連していた。炎症性経路は加齢とともに変化し、アルツハイマー病では特異的に変化し、病理学的特徴と密接に関連している。これらの結果は、アルツハイマー病の進行を追跡し、薬物標的化のための可能性のある経路を示唆するものである。
序論
近年、「脳年齢」という言葉が登場し、個人の脳の形態が年代的な年齢を非常に予測する現象を指すようになった。この枠組みを用いて、脳の病気が脳の老化の正常な軌道を悪化させ、神経変性疾患を持つ個人の脳の構造が、かなり高齢の健康な個人に似ていることが研究で明らかにされている1,2。アルツハイマー病 (AD)認知症の最も一般的な形態は、特に通常の老化の間に予想されるものを超えて重要な脳の萎縮によって特徴づけられ、生物学的ベースの脳年齢と年代的年齢の間の不一致は、両方の疾患の初期段階で個人の将来の転帰を予測することができるだけでなく、鑑別診断3-5の助けとなる。
この脳年齢のパラダイムはまた、生物学的老化の他のタイプを記述するために、データの他のタイプに適応することができる6。大規模なプロテオミクススクリーニングツールの可用性の増加に伴い、例えば、それは今、アルツハイマー病の文脈でプロテオミクス老化を調査することが賢明である。炎症性プロテオミクスは、被験者固有の炎症性リスクパターンを特定することにより、アルツハイマー病の我々の理解に貢献するために特に適している7。アルツハイマー病における炎症性の老化の関連性は、炎症性経路と増加した炎症反応とアルツハイマー病関連の病態生理学的変化8,9の間の確立された接続の年齢に関連する変化の観察によってサポートされている。
炎症は非常にアルツハイマー病の進行と結合されることが示されているが、アルツハイマー病における自然免疫の役割は、主に臨床的観点から未解明である10。慢性炎症は、アルツハイマー病の発症と進行に関与している、とアルツハイマー病における炎症性経路のための因果関係の役割は、遺伝的証拠によってサポートされている11,12。しかし、ほとんどの臨床研究は、炎症の単一の、広い測定値に依存しているため、特にどの炎症性経路が正常な老化で予想されるものを超えてアルツハイマー病の進行によって変更されているかは不明のままである。
今回の研究では、859人の大規模コホート研究において、脳脊髄液と血漿の両方で測定した73種類の炎症性タンパク質を用いて、アルツハイマー病の前臨床と臨床の両方の段階における脳脊髄液(脳脊髄液)と血漿の炎症性プロテオームの老化の加速を探った。我々の主な仮説は、炎症性タンパク質のレベルは、アルツハイマー病のバイオマーカーの証拠がない健康な人では年代的な年齢と有意に関連しており、アルツハイマー病の連続体の様々な段階で自分自身を発見した人は、生物学的に古い炎症性プロテオームを特徴とするだろうというものであった。さらに、認知機能の低下とともにアミロイドβ(アミロイドβ)とタウの脳脊髄液測定値を含むアルツハイマー病の主要な特徴は、個人レベルでの炎症性老化の実際の大きさに関連しているだろうという仮説を立てた。
研究方法
研究人口
研究集団は、スウェーデンのBioFINDER(Biomarkers For Identifying Neurodegenerative Disorders Early and Reliably)研究から来ている-詳細はbiofinder.seを参照のこと。今回の解析では、アミロイドβ-認知機能障害なし(Aβ-CU;n = 312)アミロイドβ-主観的認知機能低下(Aβ-SCD;n = 125)アミロイドβ-軽度認知障害(アミロイドβ-MCI;n = 104)アミロイドβ+軽度認知障害(アミロイドβ+MCI;n = 150)およびアミロイドβ+アルツハイマー病認知症(アミロイドβ+アルツハイマー病;n = 139)の個人が含まれている。BioFINDERのパーキンソン病サブスタディでコントロールとして独立してリクルートされたAβ-CU群(n = 29)は、元のモデルを検証するために用いられ、Aβ-SCD群とアミロイドβ-MCI群は、アミロイドβ+MCI群とアミロイドβ+アルツハイマー病群を比較するための追加群として用いられた。
CUの被験者は、もともとは集団ベースのEPICコホートおよびNomas 3試験13から登録されていた。除外基準は以下の通りであった:年齢は60歳以上、スクリーニング時のMini-Mental State Examination(MMSE)スコアが28以上、ベースライン訪問時のスコアが27以上、スウェーデン語が流暢であること。MCIの患者は連続して募集され、認知症疾患の専門医によって徹底的に評価された。含める基準は次のとおりであった:可能な認知障害のためにメモリクリニックに呼ばれ、認知症の基準を満たしていない、MMSEスコア24-30,少なくとも60歳、およびスウェーデン語で流暢である14。アルツハイマー病の人も連続して募集し、可能性のあるアルツハイマー病15のNIA-AA基準を満たしていた。二分化されたアミロイドβの状態は、脳脊髄液のアミロイドβ42/40比の事前に定義されたカットオフを使用して決定された(以下の詳細については、より詳細に記載されているアッセイ)16。
スウェーデンのルンドの地域倫理委員会は、研究を承認し、すべての被験者が書面によるインフォームドコンセントを行った。すべての手順は関連するガイドラインに従って実施された。
タンパク質およびバイオマーカーの定量
炎症性タンパク質濃度は、Olink Proteomics社(スウェーデン、ウプサラ)が開発した高感度で特異的なProseekマルチプレックスイムノアッセイを用いて定量した17。Inflammation I マルチプレックスパネル(詳細は www.olink.com/products/inflammation/ を参照)からの合計 92 個のタンパク質(炎症過程の分類が利用可能なため、73 個を使用した、以下を参照)を、脳脊髄液 とヒト血漿の両方で測定した。タンパク質の測定は、製造元のプロトコルに従い、Proximity Extension Assay(PEA)技術を用いて実施した。タンパク質量は、log2スケールで正規化されたタンパク質発現(NPX)値として生成され、アッセイ検出限界以下の測定値は分析に含まれなかった。欠損データについてはインputationを行わなかったため、利用可能なすべての測定値を持つ参加者のみが分析に含まれている。
パネル内のすべてのタンパク質は、生物学的プロセス/経路、疾患領域、組織発現、およびタンパク質クラスに従って、さらにプリオリ的に分類された。本研究で使用した11の機能的経路分類は以下の通りであった。(1)アポトーシス過程、(2)免疫応答に関与する細胞活性化、(3)細胞接着、(4)サイトカイン刺激に対する細胞応答、(5)走化性、(6)細胞外マトリックス組織化、(7)炎症応答、(8)MAPKカスケード、(9)免疫応答の調節、(10)低酸素に対する応答、(11)分泌である。特定のタンパク質をこれら、11の炎症過程のいずれかに分類するには、Uniprot、Human Protein Atlas、Gene Ontology (GO)、DisGeNETを含む広く利用されているパブリックアクセスのバイオインフォマティクスデータベースに掲載されているそのタンパク質の情報に基づいて行った。ほぼすべてのタンパク質が2つ以上の機能グループに属しており、平均して3.6種類のプロセスに属していた。各炎症経路に属するタンパク質の完全なリストを表S1に示する。
感度分析として、および先験的分類の潜在的な問題を避けるために、すべてのタンパク質を単一のモデルに含め、Aβ-CUグループの年齢を最も予測するタンパク質のセット(「データ駆動型クラスター」)をLASSO回帰を用いて選択した(以下でより詳細に説明する)。
アルツハイマー病関連のバイオマーカーに関しては、アミロイドβ42/アミロイドβ40(脳内アミロイド蓄積を表す)スレオニン181でリン酸化されたタウ(リン酸化タウ;脳内タウ蓄積を表す)総タウ(総タウ;脳内神経変性を表す)の脳脊髄液レベルをEuroimmunプラットフォーム18を用いて全参加者について測定した。解析に含まれた認知的指標は、Mini-Mental State Examination(MMSE)とClinical Dementia Rating Scale-Sum of Boxes(CDR-SB)であり、これらはいずれもアルツハイマー病臨床試験のエンドポイントとして使用されるとともに、診断や疾患進行の追跡に関連性が確立されている19。
統計的分析
まず、線形回帰を用いて、Aβ-CU個体の脳脊髄液または血漿中炎症性蛋白質と年代別年齢との関係を確立した。73種類の炎症性蛋白質すべてを、性、学歴、平均蛋白質レベルの調整とともにモデルに予測因子として含めた。反応変数は真の年齢であった。モデル全体と真の年齢との関係は、F検定を用いて統計的有意性を評価した。
次に、他のグループ-β- CU、Aβ- SCD、Aβ- MCI、Aβ+ MCIおよびアミロイドβ+ アルツハイマー病の各個人について、各個人の炎症性タンパク質値を前に適合したモデルに供給することにより、年齢を予測した。次に、適合された回帰モデルによって予測された年齢(すなわち炎症性年齢)と年代的年齢との間の差を計算し、InflammAGEスコアを決定した。例えば、65歳の個人のInflammAGEスコアが+5であれば、この個人の炎症性プロテオームは、70歳のアミロイド陰性で認知障害のない個人の代表的なものであることを意味する。ゼロと比較して有意に増加したInflammAGEスコア(正常な老化で予想されるものと比較して有意な炎症性老化を示す)を、次に、分散分析(ANOVA)を使用してグループ間で、およびペアワイズt検定を使用して各グループ間で評価した。
InflammAGEスコアと脳脊髄液中のアルツハイマー病関連バイオマーカー(アミロイドβ42,総タウ、およびリン酸化タウ)と認知(MMSE、CDR-SB)との間の関連は、InflammAGEスコアを予測因子として、各バイオマーカーを別々に従属変数として、年代別年齢、性別、教育、臨床診断、およびアミロイド状態を調整した線形回帰を用いて検定した。
この解析は、11の炎症過程のそれぞれのタンパク質について行われ、グループ全体から最適なタンパク質のセットを選択するために、スパースLASSO回帰を用いた感度解析が行われた(「データ駆動型クラスター」)。すべての統計モデリングは、R (v4.0.0) プログラミング言語20 で行った。すべての検定は両側検定で、有意水準をp < 0.05とし、必要に応じてBenjamini-Hochberg法を用いて多重比較の調整を行った。
倫理承認と参加の同意
BioFINDER 研究に参加する前に、すべての人から書面によるインフォームドコンセントを得た。ルンド大学の機関審査委員会から倫理的な承認を得ている。
結果
コホートの特徴
認知に関しては、アミロイドβ+ アルツハイマー病群はAβ+ MCI(P < 0.0001)と比較して有意に低いMMSEスコアを示し、その結果、Aβ- SCD群とAβ- CU群の両方と比較して有意に低いMMSEスコアを示した(両者ともP < 0.0001)。また、Aβ-SCD群は、Aβ-CU群と比較してMMSEスコアがわずかに低かった(P = 0.001)。年齢に関しては、Aβ+ MCI群とアミロイドβ+ アルツハイマー病群、またはアミロイドβ-群とAβ+ MCI群の間に年齢差はなかったが、アミロイドβ+ アルツハイマー病群は他のアミロイドβ-群に比べて有意に年齢が高かった(P<0.001)。さらに、メインのAβ-CUコホートは、検証用のAβ-CUコホートよりもわずかに高齢であったが、この差は有意ではなかった。性に関しては、アミロイドβ+MCI(53.3%)およびアミロイドβ+SCD(56.9%)群では、Aβ-CU(33.1%)およびアミロイドβ+アルツハイマー病(37.1%)群よりも男性が多く、すべての統計モデルに共変量として性を含める必要があった。人口統計学的情報をさらに表11にまとめた。
表1 コホートの人口統計
| 臨床診断 | Aβステータス | N | 年齢 | 男性(%) | CDRSB | MMSE |
|---|---|---|---|---|---|---|
| CU | – | 312 | 71.6±5.2 | 38.5 | 0.0±0.0 | 29.1±0.9 |
| CU-検証 | – | 29 | 68.7±5.3 | 45.8 | 0.0±0.0 | 28.5±1.3 |
| SCD | – | 125 | 69.5±5.3 | 44.4 | 0.5±0.7 | 28.7±1.3 |
| MCI | – | 104 | 69.3±5.6 | 67.8 | 1.3±0.9 | 27.3±2.0 |
| + | 150 | 72.3±4.9 | 53.3 | 1.5±0.9 | 26.8±1.7 | |
| 広告 | + | 139 | 75.5±5.8 | 37.1 | NA | 21.2±3.9 |
すべての連続値は平均値と標準偏差として報告されている。アミロイド状態は、脳脊髄液 アミロイドβ42/40比を用いて測定した。プロテオーム年齢回帰モデルの適合には、Aβ-CU群を用いた。
CU 認知障害なし、SCD 自覚的認知機能低下、MCI 軽度認知障害、アルツハイマー病 アルツハイマー病認知症。
炎症性タンパク質は健康な老化の間に大きく変化する
脳脊髄液の炎症性蛋白質は、「低酸素への反応」以外のすべての炎症性経路について、Aβ-CU個体の年齢を偶然の予想よりも正確に予測した(P < 0.0001)。脳脊髄液ベースのモデルで説明された分散(R2)は、炎症性経路全体で6~41%であり(図1;表S1)年齢と最も関連する経路は、「サイトカイン刺激に対する反応」(R2 = 0.34)「炎症性反応」(R2 = 0.31)「走化性」(R2 = 0.31)であった。データ駆動型のタンパク質クラスターは、年齢と最も近い関連を持っていた(R2 = 0.41;含まれるタンパク質については表S3を参照)。
図1 Aβ-CU個体における炎症性タンパク質からの年齢予測
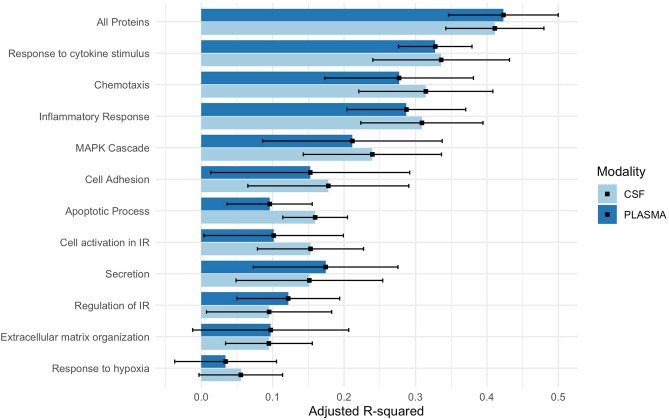
この図は、アミロイド陰性で認知機能に障害のない人の脳脊髄液と血漿中の炎症性蛋白質から年齢を予測するために用いた線形回帰モデルで説明された分散を示している。
血漿中では、Aβ-CU群では「低酸素への応答」と「細胞外マトリックス組織化」を除くすべての炎症性経路で正確に年齢を予測し、年齢予測モデルで説明される分散は3~42%であった(図1;表S1)。ここで、年代的に最も変動を説明した経路は、再び「サイトカイン刺激に対する応答」(R2 = 0.33)「炎症反応」(R2 = 0.29)「走化性」(R2 = 0.29)であった。ここでも、データ駆動型のタンパク質クラスターは、年齢と最も近い関連を有していた(R2 = 0.42;含まれるタンパク質については表S3を参照)。
InflammAGEモデルは独立したアミロイドβ-群で検証された。
回帰モデルのバリデーションは、独立して募集したAβ-CU群で行われ、このAβ-CUバリデーション群では有意な炎症性の老化がないことを示すことが目的であった。ここで、我々は、脳脊髄液または血漿中のいずれの炎症性経路においても、InflammAGEスコアがゼロよりも有意に大きくないことを示し、バリデーションAβ-CU群は、メインAβ-CU群に比べて有意に古い炎症性プロテオームを有していないことを示した(図2,3,3;表S4)。実際には、バリデーション群ではInflammAGEスコアが有意に低いプロセスが複数あり、バリデーション群は実際には予想以上に健康的な炎症性プロテオームが特徴的であることが示された。
図2 炎症性経路を横断した脳脊髄液ベースのプロテオミクス老化

この図は、脳脊髄液ベースの炎症性年齢スコア(すなわち、炎症性タンパク質のみから各個人の年齢を予測したもの)の分布を、グループおよび炎症過程にまたがって示したものである。点線のゼロは、個人のタンパク質レベルから予測される年齢がその個人の年代と同じであることを示しており、炎症性年齢が正常であることを示している。点線より上の値は、個人の炎症性プロテオームが年代的に高齢の個人をより代表することを示している。
図3 炎症経路を横断した血漿ベースのプロテオミクス老化

この図は、血漿ベースの炎症性年齢スコア(すなわち、炎症性タンパク質のみから各個人の年齢を予測したもの)の分布を、グループおよび炎症過程にまたがって示している。点線のゼロは、個人のタンパク質レベルから予測される年齢がその個人の年代と同じであることを示しており、炎症性年齢が正常であることを示している。点線より上の値は、個人の炎症性プロテオームが慢性的に年齢が高い個人の代表的なものであることを示している。
Aβ-SCD群とAβ-CU群のInflammAGEスコアを比較すると、「MAPKカスケード」とデータ駆動型クラスターのみで脳脊髄液ベースのInflammAGEスコアが有意に増加しているのに対し、Aβ-SCD群では血漿ベースのInflammAGEスコアがAβ-CU群に比べて増加している経路は見られなかった(図2,3,3;表S4)。
最後に、アミロイドβ-MCI群では、「免疫応答の調節」と「低酸素への応答」以外の脳脊髄液中の全ての炎症経路において、Aβ-CU群と比較してInflammAGEスコアが有意に増加していた。血漿中では、「MAPKカスケード」と「分泌」経路でのみ上昇が認められた(図2,3,3;表S4)。
炎症AGEスコアの上昇は、Aβ+ MCI群とアルツハイマー病群で認められた。
次に、Aβ+ MCI群とアミロイドβ+ アルツハイマー病群では、Aβ- CU群とAβ- MCI群の両方と比較して、どの経路が変化しているかを検証した。
その結果、Aβ+ MCI群では、Aβ-CU群に比べて「細胞接着」以外の全ての炎症性経路が変化しているのに対し、アミロイドβ-MCI群では「アポトーシス過程」のみが変化していることがわかった(図2,3,3,表S5)。アミロイドβ+アルツハイマー病群では、Aβ-CU群に比べて全ての炎症経路が変化したが、アミロイドβ-MCI群に比べて「アポトーシス過程」「細胞外マトリックス組織」「低酸素に対する反応」「データ駆動型クラスター」も変化した(図2,3,3;表S5)。
血漿ベースの炎症性タンパク質については、アミロイドβ+MCI群では、Aβ-CU群と比較しても、アミロイドβ-MCI群と比較しても、経路の変化は見られなかった(図2,3,3;表S5)。一方、アミロイドβ+ アルツハイマー病群では、すべての経路がAβ-CU群に比べて変化しており、「細胞接着」、「免疫応答の調節」、「低酸素への応答」の経路がアミロイドβ-MCI群に比べて変化していた(図2,3,3;表S5)。
InflammAGEスコアはアルツハイマー病の病理学的特徴と関連している
脳脊髄液ベースの炎症性タンパク質については、「細胞接着」以外のすべての経路におけるInflammAGEスコアは脳脊髄液のアミロイドβ42レベルと関連していた。すべての経路におけるInflammAGEスコアは、脳脊髄液のリン酸化タウおよび総タウレベルにも関連していた。低酸素への応答」、「免疫応答の調節」、「細胞接着」以外のすべての経路のInflammAGEスコアはCDRSBと関連していたが、MMSEと関連する経路はなかった(図4)。脳脊髄液中のデータ駆動型クラスターは、アミロイドβ42,リン酸化タウ、総タウ、CDRSBと関連していた。
図4 脳脊髄液ベースのプロテオミクス加齢とコアアルツハイマー病バイオマーカーとの関連性

この図は、脳脊髄液ベースのInflammAGEスコア(すなわち、個人の炎症性年齢とその年代の差)と、アルツハイマー病アミロイド蓄積、タウ蓄積、一般的な神経変性、認知機能低下の様々なコアバイオマーカーとの関連を示している。
血漿ベースの炎症性タンパク質については、「細胞接着」、「低酸素への応答」、「免疫応答の調節」、「分泌」、「免疫応答における細胞活性化」、「細胞外マトリックス組織化」のInflammAGEスコアが脳脊髄液のアミロイドβ42レベルと関連していたが、「細胞接着」のInflammAGEスコアのみが脳脊髄液のリン酸化タウと総タウレベルと関連していた。また、「細胞外マトリックス組織化」経路のInflammAGEスコアのみがCDRSBと関連していたのに対し、「細胞接着」、「細胞外マトリックス組織化」、「炎症反応」、「MAPKカスケード」経路のInflammAGEスコアはMMSEと関連していた(図5)。血漿中のデータ駆動型クラスターはMMSEとのみ関連していた。
図5 血漿ベースのプロテオミクス加齢とコアアルツハイマー病バイオマーカーとの関連性

この図は、血漿ベースのInflammAGEスコア(すなわち、個人の炎症年齢とその年代の差)と、アルツハイマー病アミロイド蓄積、タウ蓄積、一般的な神経変性、認知機能低下の様々なコアバイオマーカーとの関連性を示している。
考察
本研究では、アルツハイマー病における炎症経路の変化を調べるために、大規模な臨床コホートにおいて、脳脊髄液と血漿中の73種類の炎症性タンパク質を測定した。Aβ-CU個体では、脳脊髄液と血漿中の両方のタンパク質が年齢を予測するという我々の発見は、自然免疫系が健康な加齢期でも変化するという確立されたエビデンスに加えている21。これに基づいて、我々は、MCIとアルツハイマー病患者が有意に高齢化した健康な人に似た炎症性プロテオームを持っているような自然免疫系の生物学的老化が加速されることによって、アルツハイマー病の連続体が特徴であることを示した。この知見は、例えば、構造的な脳イメージング(すなわち脳年齢)を使用して実施されたアルツハイマー病の同様の生物学的老化の研究と一致している3。教育は、認知症との関連性が知られているため、それもベースラインの認知能力22に影響を与える社会経済的要因の代理として考慮される可能性があるため、特に説明した。
重要なことに、我々がアルツハイマー病連続体で観察した異常な炎症性老化は、特定の炎症経路で異なる発現を示しており、タンパク質が脳脊髄液で測定されるか血漿中で測定されるかによってさえも異なることがある。例えば、血漿ベースの炎症性老化がアミロイドβ-MCI患者と比較してアルツハイマー病患者で上昇したことを示す我々の結果は、血漿で測定されるような横断的な炎症性レベルは、脳脊髄液で測定されるものと比較して、ある時点でよりアルツハイマー病に特異的である可能性があることを示唆している。縦断的な変化を観察することは残念ながら本研究の範囲外であった。一方、脳脊髄液ベースの炎症性老化はコアアルツハイマー病バイオマーカーと強く相関し、主要なAβ-CU群では血漿よりも経年的年齢を予測したので、脳脊髄液炎症性タンパク質は通常の老化中に起こる脳ベースの炎症性変化とより密接に追跡している可能性が高い。この所見は、血漿中の測定値の分析変動が大きいことや、血漿中の炎症性タンパク質濃度が周辺部で見られるより豊富なタンパク質の影響を受けているという事実によって説明できるかもしれない23。しかし、血漿中の炎症性蛋白質は、血漿ベースのアッセイ法の最近の改善24,25と相まって、アルツハイマー病は周辺部で観察できる全身的な代謝状態を持っているという考えに基づいて、アルツハイマー病関連の変化を検出するための潜在的なソースであることが理論化されている。いずれにしても、我々は、この境界線がどこにあるかを識別するタスクはまだ残っているが、一般的に血漿と脳脊髄液の炎症性タンパク質は、異なるが、少なくとも部分的に重複するプロセスを測定するという仮説を立てている。しかし、本研究では、健康な人の年齢と最も密接に関連するタンパク質を強調するようにモデルを適合させることで、血漿と脳脊髄液の重複を最大化したいと考えていた。
さらに、Aβ-SCD群とアミロイドβ-MCI群では、多くのプロセスにおいて脳脊髄液炎症レベルの上昇が認められたが、血漿ではそのような傾向は認められなかった。一方、血漿ベースの炎症性蛋白質レベルの上昇はアルツハイマー病群のみで多く見られた。このことは、脳脊髄液の炎症性蛋白質がそれぞれの血漿蛋白質で見られるものよりも進んでいることを示しているのかもしれない。
我々の解析の大前提の一つは、健康な人が正常に年齢を重ねると、最終的にはアルツハイマー病患者と同じような炎症性プロファイルを持つようになるということである。しかし、今回の研究では、加齢に伴う炎症と疾患に伴う炎症を分離することは困難であるため、アルツハイマー病患者は単に疾患による炎症の変化が並行して進行しているだけである可能性がある。実際、加齢に関連した炎症変化とアルツハイマー病に関連した炎症変化の間には、原因と効果の両方に大きな違いがある27,28。しかし、我々の炎症性加齢モデルは、広い年齢範囲にわたる健康な個人からのデータのみに基づいて適合され、アミロイドの蓄積なしであったという事実は、我々がアルツハイマー病患者で観察された変化は、通常の年齢に関連する可能性が最も高いものであることを意味する。我々のモデルによって “高齢 “の炎症年齢を持っていると予測されるアルツハイマー病患者は、したがって、それが正常な加齢の間に自然に変化するそれらのタンパク質に関連しているように炎症性プロファイルの変化を持っていると予想されるべきである。
我々の知見は、特にコアとなるアルツハイマー病バイオマーカーの血漿アッセイが予後と臨床試験の両方のシナリオで強力なパフォーマンスを持っているように見えるように、アルツハイマー病の進行を識別または追跡するためのバイオマーカーとして炎症性タンパク質の使用のための強い意味を持っている29,30。創薬という点では、我々の結果は炎症経路のグループを指摘しており、その研究を進めれば、アルツハイマー病発症における炎症の役割を明らかにすることができる。研究の限界に関しては、我々は “古い “炎症性プロテオームを持っていることは、多くの要因によって説明することができることを認めている。以前の研究では、自然免疫系の有効性が低下し、年齢とともにますます活性化されていることを示唆しているので、これは1つの適切な解釈かもしれない21,31。方法論的には、この研究は、その横断的なデザインとOlinkパネルが唯一の絶対定量ではなく、タンパク質の相対定量を可能にするという事実によって制限されている。炎症性プロテオームが実際に単一の個人でどのように変化するかを理解することは、したがって、現在の分析では不可能である。また、異常な炎症性活性化が アルツハイマー病 病理のドライバーであるか、単に病気のプロセスの副作用であるかどうかを判断するために、このような横断的な臨床研究を使用することは困難である12。さらに、我々は個々の炎症性タンパク質に焦点を当てるのではなく、むしろより高いレベルの炎症プロセスに注目したため、我々の分析ではどのような炎症経路が具体的にターゲットにされているかについての解釈の余地を残している。
それでも、我々の研究に参加した多数の参加者は、患者の分類への客観的な生物学的アプローチを可能にする中核的なアルツハイマー病バイオマーカーデータと組み合わせて、我々の結果に大きな信頼性を追加する32。さらに、我々が採用した生物学的老化のパラダイムは、通常の老化の間に生物学的プロセスがどのように変化するかに関して信頼性の高い軌跡を確立することができる私たちのような大規模な対照群を持つ研究に特に適している6。我々の知見は、流体バイオマーカーの観点からアルツハイマー病における炎症性変化のより詳細な研究の基礎として使用することができる。アルツハイマー病における炎症性変化を調べる上での既存の作業の文脈では、我々の研究は、一般的に行われているように個々に変更された単一のタンパク質を識別するのではなく、より多くのパスウェイレベルの変化に焦点を当てている33。我々の結果におけるサイトカインやケモカインの強い影響力は、アルツハイマー病中にアップレギュレートされたこれらのタンパク質が潜在的な保護的役割を示唆している先行研究と強く一致している34,35。また、我々の分析は、アルツハイマー病36で変更されることが知られている酸化ストレスに関連する経路をターゲットにしたことが可能である。今後の研究では、アミロイド、タウ、神経変性の既存のコアとなるアルツハイマー病バイオマーカーに加えて、アルツハイマー病における炎症性変化のバイオマーカーがアルツハイマー病の進行を追跡するための付加的な価値を提供するかどうかを調査することも含まれるかもしれない。
結論
我々の研究は、炎症性老化がアルツハイマー病において容易に測定され、疾患過程における病態生理学的変化に直接関連していることを実証している。我々の結果は、アルツハイマー病治療のために炎症性プロセスを標的とし、炎症性マーカーを用いてアルツハイマー病の進行を追跡するために強い意味を持っている。これらの知見はまた、アルツハイマー病の文脈での炎症のよりニュアンスのある見方が必要であることを示唆している。
