In search of an anti-inflammatory drug for Alzheimer disease
Erika Gyengesi、Gerald Münch
慢性的な神経炎症がアルツハイマー病の発症に重要な役割を果たしていることを示唆する証拠がある。しかし、新しい臨床試験では、抗炎症作用のあるテトラサイクリン系抗生物質ミノサイクリンが、軽度のアルツハイマー病患者の病状進行を遅らせることができなかった。
慢性的なミクログリアの活性化は、慢性外傷性脳症、筋萎縮性側索硬化症、パーキンソン病(PD)アルツハイマー病など、多くの神経変性疾患で見られる。アルツハイマー病患者の脳では、ミクログリアの活性化がすべての病期で認められ、腫瘍壊死因子(TNF)IL-1β、IL-6,プロスタグランジン、活性酸素種、活性窒素種などの炎症性メディエーターの増加を伴っていることがわかっている1。さらに、ゲノムワイド関連解析(GWAS)では、骨髄系細胞に発現するトリガー受容体2(TREM2)をコードする遺伝子を含む炎症関連遺伝子の変異が、アルツハイマー病発症リスクと関連していることが確認されている2,3。TREM2は、ミクログリア細胞の表面に存在し、損傷関連分子パターン(DAMPs)や細菌のリポポリサッカライドに反応して、食作用を活性化し、ミクログリアの生存を促進する。TREM2とアルツハイマー病の関連性は、この疾患における神経炎症の役割を示す最も有力な論拠の一つと考えられている3。これらの遺伝学的、組織学的知見は、アルツハイマー病の進行が、少なくとも部分的にはー
ー アルツハイマー病の進行は、少なくとも部分的には、炎症性神経毒性の自己反復サイクルによって駆動されていることを示唆している。このサイクルでは、傷害を受けた神経細胞がDAMPs4を放出し、これがミクログリアを活性化する。活性化したミクログリアは、神経毒性のあるサイトカイン(TNFなど)やフリーラジカル(スーパーオキシドや一酸化窒素など)を分泌し、神経細胞を損傷して、再びこのサイクルを繰り返す。したがって、慢性的な神経炎症を抑える治療法があれば、アルツハイマー病の経過を変えることができるかもしれない。
JAMA Neurology誌に掲載された新しい臨床試験で、Howardら5は、テトラサイクリン系の抗生物質であるミノサイクリンの軽度のアルツハイマー病治療に対する有効性を検証した。Minocyclineは、アルツハイマー病治療薬として再利用するための優先順位の高い候補として、2つのシステムテマティクレビューに基づいて本試験に選ばれた。ミノサイクリンは、免疫抑制などの様々な副作用があるため、すでに関節リウマチのセカンドライン薬として使用されている。ミノサイクリンは、好中球の遊走および脱顆粒を抑制し、酸素ラジカルの生成を抑制することで、好中球による組織傷害を軽減することが動物実験で示されている6。また、家族性アルツハイマー病の動物モデルにおいても、ミノサイクリンはIL-1β、TNF、IL-4,IL-10のレベルを低下させるなど、抗炎症作用を示している(参考文献7)。これらの前臨床試験では、ミノサイクリンは1日あたり約50mg/kgの用量で試験されている。これは、平均的な人であれば400mgの投与量となり、感染症の治療に用いられる200mgよりもかなり高い量となる。
Howardら5の試験では、被験者はミノサイクリン200mg、ミノサイクリン400mg、プラセボのいずれかを1日1回投与された。認知機能は標準化ミニメンタルステート検査(sMMSE)で、食事、着替え、服薬などの基本的な日常生活動作はブリストル日常生活動作尺度(日常生活基本動作(B日常生活動作)S)で評価した。ミノサイクリン投与群とプラセボ投与群の間には、統計学的に有意な差は認められなかった。しかし、データを詳しく見ると、24カ月間のsMMSEスコアの変化の平均値は、プラセボ投与群で4.1ポイント、ミノサイクリン400mg投与群で3.3ポイントであり、ミノサイクリン400mg投与群では、プラセボ投与群に比べて抑止力が20%程度低下していることがわかった(図1)。しかし、400mgの投与量ではミノサイクリンの副作用が強く、このグループの参加者の28%しか試験を完了できなかった。
Howard氏らは、このような結果になった理由について熱心に検討した。この論文で示された最初の説明は、神経炎症は「神経変性の重要な要因というよりも、疾患の病理学的特徴に対する反応である可能性がある」というものである。しかし、GWASの結果によると、遅発性の散発性アルツハイマー病に関連する遺伝子の60%以上が炎症に関連しており、アルツハイマー病の病態形成に炎症が関与していることが強く示唆されている。さらに、5,600万人の電子カルテを対象とした大規模なレトロスペクティブケースコントロール研究では、TNF阻害剤が関節リウマチや乾癬患者のアルツハイマー病リスクを低減することが示されている8。例えば、エタネルセプト、アダリムマブ、インフリキシマブによる治療を受けている関節リウマチ患者さんは、未治療の関節リウマチ患者さんに比べて、アルツハイマー病と診断される可能性が低いことがわかった。
図1|ベースラインから 24ヶ月目までのsMMSEスコアの変化
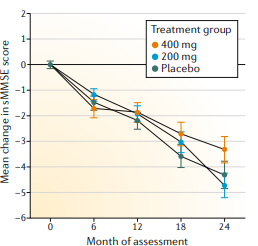
24ヶ月間、プラセボ、ミノサイクリン200mg、ミノサイクリン400mgのいずれかを毎日投与した患者群における標準化ミニメンタルステート検査(sMMSE)スコアの平均変化量。ref.5, CC BY 4.0 (creativecommons. org/licenses/by/4.0/)から引用した。
ミクログリアの活性化と神経変性の関連は複雑である
ミクログリアの活性化と神経変性の関連性は複雑であるため、ミノサイクリンは予期せぬ効果を発揮し、ミクログリアの支持機能を阻害する可能性がある。ミノサイクリンの最大の問題点は、抗炎症薬として設計されていないことであり、その正確なタールゲットと作用機序は完全には解明されていない。Howardら5による試験で投与されたミノサイクリンの用量が、関連する炎症性サイトカイン、ラジカル、神経毒のレベルを低下させることができるかどうかは、まだわかっていない。
否定的な結果の3つ目の説明として、研究者らは「ミノサイクリンはアルツハイマー病に対してある程度の効果があったが、治療効果が小さすぎて検出できなかった」という仮説を立てた。効果の大きさが小さいということは、神経炎症以外のプロセスが疾患の進行に寄与していることを反映している可能性がある。例えば、神経炎症がアルツハイマー病患者の認知機能低下の50%にしか関与しておらず、ミノサイクリンが神経炎症を50%減少させたとすれば、ミノサイクリン治療の観察された効果の大きさは25%程度にしかならないであろう。
今後の臨床試験では、サイトカイン抑制性抗炎症薬(CSAID)など、標的が明らかな抗炎症薬の使用が望まれる。CSAIDは、ミクログリアやアストログリアの炎症性シグナル伝達経路を標的とし、TNFなどの細胞傷害性サイトカインや一酸化窒素などのフリーラジカルの産生を低下させる9。将来的には、脳内で活性化したミクログリアやアストログリアのマーカーであるトランスロケータープロテインのPET画像を用いて、候補薬剤の抗炎症効果を測定することも可能である10。
