Contents
Magnesium in Infectious Diseases in Older People
2021年1月8日
pubmed.ncbi.nlm.nih.gov/33435521/
Ligia J. Dominguez 1,Nicola Veronese 1,*、Fernando Guerrero-Romero 2,Mario Barbagallo
1 パレルモ大学内科学・老年医学科老年医学ユニット ligia.dominguez@unipa.it (L.J.D.); mario.barbagallo@unipa.it (M.B.)
2 メキシコ社会保障研究所 IMSS, Biomedical Research Unit, Durango, ZC 34067, Mexico; guerrero.romero@gmail.com
概要
マグネシウム(Mg)摂取量の減少は、吸収率の低下、腎消耗、ポリファーマシー療法とともに、加齢に伴う欠乏の原因として頻繁に見られる。慢性的な Mg 欠乏は酸化ストレスや低悪性度の炎症の増加をもたらし,感染症への罹患率の上昇など,いくつかの加齢に関連した疾患と関連している可能性がある。
Mgは、厳密にはT細胞とB細胞の機能に関連付けられている免疫グロブリン合成および他のプロセスのための補因子である免疫応答の役割を果たしている可能性がある。また、Mgは、感染症の発症に重要なもう一つの因子であるビタミンDの生合成、輸送、活性化に必要である。
免疫細胞における細胞質遊離Mgの調節には、メラスタチン様一過性受容体電位7チャネル、溶質担体ファミリー、マグネシウムトランスポーター1(MAGT1)などのMg輸送系が関与している。
免疫における Mg 輸送の機能的重要性は、慢性的なエプスタインバーウイルス感染によって特徴づけられる MAGT1 の遺伝的欠損に起因する一次免疫不全 XMEN症候群(X-linked immunodeficiency with Mg defect, Epstein-Barr ,ウイルス感染、新生物)が記述されるまでは不明であった。この研究およびウイルスおよび細菌感染とMg欠損の関連性を報告する他の研究は、最近のコロナウイルス感染症2019(COVID-19)およびその合併症におけるMg欠損の役割の可能性を示唆している。
今回のレビューでは、免疫系に対するMgの重要性と、最近のCOVID-19のパンデミックを含む感染症に対するMgの重要性について考察する。
キーワード
マグネシウム;酸化ストレス;炎症;老化;感染症;ビタミンD;COVID-19
1. 序論
約1万1000年前、農業の導入に伴い、人類は辺境の原始的な狩猟採集組織から、動物の家畜化も含めた新しい形態の定住的な共同生活へと生活様式を根本的に変化させた。この新しい疫学的シナリオは、微生物、野生動物と家畜、そして人間の共存を可能にし、これが現在では最も重要なヒト感染症の起源であると認識されている[1]。これらの病気は、農業以前には世界のどこにも存在しなかった大規模で高密度な人間の集団の中でしか持続できない。この物語が始まったのは非常に昔のことであり、ワクチンや抗生物質の開発が進歩したにもかかわらず、感染症は世界の公衆衛生の大きな負担となり続けている[2]。さらに、新たな新興感染症が続々と報告され、現在のようにパンデミックにつながる可能性もあり、新たな感染症ノクセに対する私たちの準備不足が露呈している。実際、過密化と人口移動は、グローバル化の結果として、局所的な感染症問題を短期間のうちに深刻で恐れられるパンデミック攻撃へと変貌させる可能性がある。
歴史家は、感染症が歴史の流れを形成してきたことを認識するようになってきている。例えば、ヨーロッパ人の征服者が持ってきた微生物が原因でアメリカ先住民が死亡するケースが増えたことが象徴的な例として挙げられるように、新しい発見された領土を比較的簡単に征服することができた[1]。今日の人類は、コロナウイルス病2019(COVID-19)のパンデミックによって引き起こされた悲惨な死亡者数と経済的苦難で、感染症が歴史の中で作り出すことができる深遠な変化を再び目撃している。
感染症は、「正常な」加齢に伴う生理的変化や、様々な同時発生する慢性疾患とそれに伴う医学的、診断的、外科的介入を伴う高齢者集団に頻発する多病症など、多くの理由から、高齢者などの脆弱な集団でより頻繁に発生している。高齢者では感染症がより頻繁に発生しているだけでなく、人や経済的なコストに大きな影響を及ぼす合併症のカスケードを発生させ、より有害なものとなる可能性がある[3]。
マグネシウム(Mg)は、生理学的に重要なミネラルであり、生きている細胞に最も豊富に存在する二価の陽イオンである。ヒトの体内では、Mgはカリウムに次いで2番目に豊富な細胞内陽イオンであり、全身ではカルシウム、ナトリウム、カリウムに次いで4番目に多いミネラルである。Mg は、構造または触媒成分として酵素と基質の両方に作用する多くの生物学的プロセス(600 以上と推定される)に不可欠な補酵素であり[4]、酸化的リン酸化、エネルギー産生、タンパク質合成、解糖、核酸合成と安定性に必要とされる[5,6]。また、この基本的なイオンは、細胞膜を介した他のイオンの積極的な輸送にも重要な役割を果たしており、そのため、神経細胞の興奮性、筋収縮、正常な心拍数を調節している[7]。血清中では、Mg はタンパク質結合画分(アルブミンに 25%、グロブリンに 8%)キレート画分(12%)代謝的に活性なイオン化画分(55%)の 3 つの形態で存在している[5,6]。
これらすべての理由から、Mg は免疫系が関与するプロセスを含む正常な細胞や体の恒常性を維持するための重要な因子である。特に、Mgは、免疫細胞の発達、恒常性、および活性化[8]を調節するシグナル伝達経路で重要な役割を果たし、自然および後天的な免疫応答の両方と強い関係を持っている。高齢者に多いMg欠乏は、食細胞の活性化、カルシウムチャネルの開通、N-メチル-d-アスパラギン酸(NMDA)受容体の活性化、活性化B細胞の核因子κ-光鎖-エンハンサー(NF-κB)の活性化など、多様な機序で炎症を引き起こす一方で、酸化ストレスを増加させる可能性がある[10,11]。マグネシウム欠損を伴う X-linked immunodeficiency with magnesium defect (XMEN)という重度で慢性的なエプスタインバーウイルス感染症や新生物を引き起こす遺伝性疾患が発見されたことで、免疫におけるセカンドメッセンジャーとしての Mg の重要な役割が確認された[12-14]。
過去数十年の間に、Mg の臨床的関連性と生物学的意義が文書化されてきただけでなく、Mg が加齢に伴う分子的・生理的プロセス、特に免疫系や感染症に関す るものに与える影響も明らかにされてきた[11,15]。高齢者は、様々な理由による頻繁なマグネシウム欠乏[15]と一緒に、それらが感染症やその合併症[3]に特に敏感にすることができる免疫応答の変更を受ける。
このレビューでは、特に高齢者集団に焦点を当てて、免疫系と最近のCOVID-19のパンデミックを含む感染症のためのMgの重要性を議論する。
2. Mgと免疫応答
これまでの研究やその後の研究では、Mg が免疫グロブリン(Ig)合成、C3 コンバ ーターゼ、免疫細胞の付着、抗体依存性細胞溶解、IgM リンパ球の結合、マクロファージの リンパカインに対する反応、T ヘルパー-B 細胞の付着などの補因子として免疫応答に 役割を果たしていることが明らかにされている[8,16]。Mgは、生理学的なMg条件下でNF-κB活性を制御することでサブスタンスPや他の炎症性分子の発現や放出を減少させ、最適濃度以下ではNF-κB活性化とサイトカイン産生の増加をもたらす[17]。また、Mg はリンパ球の増殖や発育を制御することで、後天的な免疫にも影響を与えている[18]。これらの研究のほとんどは、Mg 欠乏食を与えた実験動物を用いて行われてきた。これらの動物では、多形核細胞の数と機能に変化が見られ、好中球の数も増加しており、これは貪食細胞の増加に関係していた[19]。また、Mg欠乏は肥満細胞の増殖と機能(ヒスタミンの貯蔵と分泌)を変化させ、肥満細胞依存性の肝線維化とステアトーシスに関与している可能性がある[20,21]。FasによるB細胞のアポトーシスはMg依存性のプロセスであるため、この陽イオンはヒトの細胞のアポトーシスに関与している。細胞内の遊離 Mg 濃度の上昇は、アポトーシスや細胞死を引き起こすシグナル伝達経路の引き金となる B 細胞表面での Fas 分子の結合発現に必要である[22]。他の研究では、Mg 欠乏実験動物が炎症の増加、免疫ストレス応答の悪化、特異的な免疫応答の低下を示していることが示されており、免疫炎症過程における Mg の重要性が確認されている[23-26]。
Mg 欠乏動物で観察される顕著な効果は、Mg 欠乏の初期段階であっても胸腺賦活が促進されていることである。Malpuech-Brugereらは、欠乏の2日目から開始し、炎症性細胞の存在を伴うコントロール通常Mg給餌群と比較して、Mg欠乏ラットから胸腺のアポトーシスの高いレベルを示した。その後、8日後に、彼らはリモデリングプロセス[27]を示す、皮質の上皮網状細胞の割合の増加を観察した。以上のことから、Mg 欠乏は T 細胞の機能低下と関連していることが示唆された。
免疫細胞における細胞質遊離 Mg の制御には、Mg/Na 交換体やメラスタチン様一過性受容体電位 7(TRPM7)チャネルなどの Mg トランスポーター、チャネル、交換体が関与している[28]。TRPM7は、ユビキタスに発現する非選択的Mgチャネル(Ca、Zn、Naも伝導する)である[28-32]。TRPM7はセリン/スレオニンキナーゼドメインを持っており、その活性はTRPM7のゲーティングを調節することができる[33]。TRPM7は免疫細胞におけるMgの恒常性維持のための基本的な役割を果たしている。このことは、TRPM7欠損B細胞株において細胞質遊離Mgの低下と細胞周期停止が見られたことからも明らかであるが、これは高Mg含有培地での培養やTRPM7条件ノックアウトマウスにおけるT細胞の発育障害によって部分的に回復した[33]。TRPM7 の特異的 T 細胞欠失マウスモデルでは、T リンパ球の発育が CD4CD8 段階で阻害され、胸腺の CD4 および CD4CD8 細胞が減少した [34]。さらに、TRPM7 欠損 T 細胞は Fas 受容体誘導性アポトーシスから保護されているようである[35]。免疫細胞における遊離 Mg のホメオスタシスの他の制御因子としては、細菌の Mg トランスポーターと相同性があり、ユビキタスに発現している溶質担体(SLC)ファミリーの SLC41A1 と SLC41A2 がある[29,31]。免疫細胞における Mg ホメオスタシスにおける SLC41A1/2 の役割は、TRPM7 を欠損した B 細胞株での異所性発現により確認されており、細胞内 Mg 濃度の低下と増殖不全を回復させることができた [36,37]。第三のタイプの Mg トランスポーターである MAGT1 は、免疫シグナル伝達に重要な役割を果たしている [38,39]。他のトランスポーターと比較して、MAGT1は免疫細胞や上皮細胞でより高いレベルで発現している[40,41]。免疫における Mg 輸送の機能的重要性は、MAGT1 の遺伝子欠損に起因する XMEN(X-linked immunodeficiency with Mg defect, Epstein-Barr virus infection, and neoplasia)という新たな原発性免疫不全症が報告されるまでは不明であったが [12-14]、MAG が細胞のシグナル伝達におけるセカンドメッセンジャーとして機能している可能性が示唆された。XMEN患者は慢性的なエプスタインバーウイルス感染、CD4+ T細胞数の低下、Tリンパ球の活性化不全を呈している。これらの影響は、MAGT1を介したMgの流入量の減少によるホスホリパーゼC(PLC)-g1の活性化の低下に起因すると仮説されている。実際、XMEN患者は、T細胞受容体刺激後のCa/Mg応答の低下を伴うPLCシグナル伝達障害を示し、ナチュラルキラーおよびCD8+ T細胞におけるナチュラルキラー活性化受容体NKG2Dの発現を廃止した[12-14]。MAGT1依存性のMgフラックスは、PLC-g1の最適な活性化、イノシトール三リン酸(IP3)の生成、プロテインキナーゼCuリン酸化、および貯蔵操作されたカルシウム導入を介したカルシウム動員に不可欠である[12]。また、MAGT1欠損は、T細胞およびB細胞における細胞質遊離Mgの減少およびMg取り込みの減少をもたらす[12,13]。さらに、XMEN患者では、経口Mg補給により細胞内遊離Mg濃度が回復することが示された[13]。XMEN病の発見[12-14]後、XMEN病の新しい亜種が記載されている[42]だけでなく、XMEN病患者の細胞におけるN-糖タンパク質の特定のサブセットのグリコシル化欠陥や細胞傷害性免疫細胞の殺傷機能の低下など、免疫不全を説明する新たなメカニズムも記載されている[43,44]。
喘息患者では、Mg の投与により気管支拡張が促進され、肺機能が改善されることが示されている[45-47]。気管支拡張作用に加えて、ある研究では、Mgの補給は急性喘息患者のCD4+ T細胞の免疫応答を調節し、2型CD4+ Tリンパ球サイトカインの分泌を減少させることが示されている[48]。
3. マグネシウム、炎症、酸化ストレス
3.1. 炎症
貧弱な Mg 食は、低悪性度の慢性炎症状態と関連しており、高齢者のいくつかの 慢性疾患と関連している状態である[49]。Mg 関連の低悪性度慢性炎症は、試験管内試験 研究において、インターロイキン(IL)-1β および腫瘍壊死因子(TNF)α受容体の過剰な産生・放出を開始し、食細胞を活性化させ、 カルシウムチャネルを開通させ、NMDA 受容体を活性化させ、NF-κB シグナルを活性化させ、一酸化窒素や炎症マーカーの合成を 刺激することによって説明できる可能性がある[9,50]。また、Mg欠損は血小板の凝集性や接着性を増加させ、内皮細胞の増殖や遊走を阻害し、微小血管機能を変化させる可能性がある[9]。さらに、急性炎症を起こした組織におけるMg濃度がIL-33/ST2軸の活性化を介して低下することを示すエビデンスもあり、炎症経路におけるMgの重要性がさらに示されている[51]。
動物モデルでは、Mg 欠乏はいくつかの結果を引き起こし、最終的には炎症性パラメータの増加、特に次のような結果をもたらすことが報告されている。
(i) プロ炎症性分子TNF-α、IL-1-β、IL-6,血管細胞接着分子、およびプラスミノーゲンアクチベーターインヒビター-1の著しい上昇 [24];(ii) 循環炎症性細胞数の増加 [16];および(iii) 急性期タンパク質(すなわち、補体、α2-マクロブロブリン、フィブリノーゲン)の肝産生および放出の増加 [9,19]。低マグネシウム曝露に関連する内皮機能障害もまた、炎症性メディエーターの放出と関連している[52]。逆に、硫酸マグネシウムの補給は、炎症性メディエーターと NF-κB のエンドトキシン誘発性アップレギュレーションの減衰を介して刺激されたマウスマクロファージの抗炎症効果を媒介することが示され、同様にホスホイノシチド 3-キナーゼの活性化と L 型イオンチャネルの阻害によって[53]。Mg のカルシウムチャネル遮断作用は、NF-κB、IL-6,CRP の下流抑制につながる[54]。
ヒトでは、血清 Mg 濃度の低さや食事による Mg 摂取量の不足が低悪性度の全身性炎症と関連していることが 報告されている[55-57]。他の研究では、Mg 摂取量と血清 Mg と炎症マーカーとの間には逆の関係があることが確認されている[58-60]。この研究では、血清 CRP 濃度で測定される全身性炎症と Mg 摂取量が逆相関していることが明らかになり、Mg 摂取量が低い人ほどメタボリックシンドロームの有病率が高いことが一 部的に正当化されている[58]。1999-2002年の国民健康・栄養調査(NHANES)データベースを用いても、同様の結果が得られている。興味深いことに、サプリメントを摂取していない NHANES 集団の 70%を対象に実施された King らの研究では、推奨一日摂取量(RDA)を下回る Mg 摂取量は CRP の上昇と有意に関連していた[55]。最近、大規模なフィンランド人集団を対象とした研究では、低食餌マグネシウム摂取量と血清hs-CRP濃度との間に逆の関係があることが改めて確認された[60]。Mg補給がCRPに及ぼす影響を評価した8件の無作為化比較試験(RCT)のメタ分析では、Mg補給後に血清CRP濃度が有意に低下することが示されたが、これはMg補給の投与量や追跡期間とは無関係であった[61]。[61]. それにもかかわらず、小規模な RCT におけるこれらの結果は、将来の大規模で長期的な調査によって確認されるべきである。
3.2. 酸化ストレス
Mg 欠乏は、酸化ストレスの増加と抗酸化防御障壁の低下と関連している。これまでの試験管内試験での研究では、Mg欠乏は、様々な組織における酸素由来フリーラジカルの産生の増加[9,10]、フリーラジカルが誘発する酸化的組織損傷の増加[10]、炎症性細胞によるスーパーオキシドアニオンの産生の増加[62]、抗酸化酵素の発現および活性の低下[63]、細胞および組織の抗酸化物質濃度の低下[63]、および過酸化酸素産生の増加[64]をもたらすことが示されていた。
動物モデルでは、Mg 欠乏は脂質過酸化とマロンジアルデヒドを増加させ、肝グルタチオン、スーパーオキサイドディスムターゼ、ビタミン E を減少させることが示されている[65]。この点、我々のグループは、Mg 摂取量が少ない人や血清 Mg 濃度が低い人の代謝状態が高いことを正当化する抗酸化能の変化と酸化ストレス、 炎症、脂質の酸化を活性化させる Mg 欠乏の作用との関連を示唆している[7]。Mg 自体は、スーパーオキサイドイオンの自然分解速度に影響を与えることに よって、酸素ラジカルを消去する抗酸化特性を持っているようである[64]。
血清Mg濃度が低いと、TRPM7やSLC41AなどのMgトランスポーターを刺激し、血清Mg濃度を上昇させるために細胞からのMg流出を誘発することが示されている[66]。その結果、細胞内のMg濃度は、MgとATPに依存して細胞のシグナル伝達機能の変化につながる減少する可能性がある。細胞内Mgの減少は、SLC41A3を介してMgを放出するためにミトコンドリアに貯蔵されたMgを誘発する可能性がある[67] [68]。ミトコンドリアのMg含有量のこの低下は、さらに、フリーラジカルのミトコンドリア過剰生産、また活性酸素種(ROS)と呼ばれるフリーラジカル、およびMg欠損動物モデルで観察されるATPの減少を説明するのに役立つかもしれない、MgとATPに関連したミトコンドリアのシグナル伝達と機能を変化させる可能性がある[69,70]。
最近では、Mg 欠乏症の糖尿病マウスではミトコンドリアの酸化ストレスが増加し、Mg 補給後に心臓拡張機能障害が逆転することが示された[69]。このことは、Mgがミトコンドリアの抗酸化物質として作用することを確認している。多くの実験研究によると、Mg 欠乏は、連成呼吸の変化[71-73]、ミトコンドリアの活性酸素産生の増加[9,10,69,70,74]、抗酸化防御システムの抑制(例えば、スーパーオキサイドディスムターゼ、グルタミン酸分解酵素、ミトコンドリアの活性化)など、多様な機序でミトコンドリアの機能を破壊している。スーパーオキシドジスムターゼ、グルタチオン、カタラーゼ、ビタミンE)[63-65,75-77]、ミトコンドリアカルシウムユニポーターを介したカルシウム過負荷の誘導[69,78,79]、プロサバイバルシグナル伝達の減衰[80-82]、ミトコンドリアATP感受性カリウムチャネル[83]、内膜アニオンチャネル[84]、ミトコンドリア伝染性遷移孔[85]の開通を促進することによって。] これらのすべての作用は、ミトコンドリア膜電位の脱分極につながる[78]。逆に、Mg の補充は、ミトコンドリアの活性酸素過剰産生の抑制[69,70]、ミトコンドリア伝染性遷移孔の開通とチトクロム C の放出の抑制[86-88]、ミトコンドリア膜電位の維持[89,90]、ミトコンドリアカルシウム蓄積量の減少[91-93]など、多様な機序でミトコンドリア機能を改善することを示す研究がある。抗アポトーシスB細胞リンパ腫2(Bcl-2)ファミリーのタンパク質発現の増加とプロアポトーシスタンパク質発現(Bcl-2関連Xタンパク質など)の同時減少[80,90]、低酸素誘導因子1-αおよびp38マイトジェン活性化プロテインキナーゼ/c-Jun N末端キナーゼ(p38/JNK)シグナル伝達の活性化を抑制することによるアポトーシスの減少[90]、およびオートファジーのダウンレギュレーション[93]などが挙げられる。
前述のように、加齢は、複数の慢性疾患に頻繁に関連するいくつかの組織および臓器を巻き込む慢性的な低悪性度炎症状態を特徴とする。
「炎症」と名付けられている[49]。Franceschi ら[94]は、炎症性刺激と酸化ストレスの主な原因は、自然免疫系の受容体によって認識された損傷や死 亡した細胞や小器官(細胞屑)に起因する内因性/自己、誤配置、または変化した分子であり、これらの分子は、オートファジーおよび/またはマイトファジーを介してプロテアソームによるそれらの処理が漸進的に減少するために、加齢に伴って増加すると提案している。
以上のような背景から、私たちは、Mg 欠乏が酸化還元状態の障害や低悪性度の炎症を 促進する役割を果たしていることから、Mg 欠乏が感染症の主要な素因を含むいくつかの 加齢性疾患や老化の加速に関連していると考えられることを提案した [11,15] 。
4. 感染症におけるMgとビタミンD
ビタミン/ホルモンDの研究は過去10年間で飛躍的に発展しており、ホルモンとしての役割は、人体の多くの器官やシステムに関連する様々な酵素学的、代謝学的、生理学的、病態生理学的プロセスにおいて確認されている[95]。このような関心の高まりは、中等度から重度のビタミンD欠乏症が世界中で広く蔓延しているという証拠によるものがほとんどである[96]。最適なビタミンDの状態は、骨や筋肉だけでなく、呼吸器感染症を中心とした感染症を含む複数の疾患と関連しているため、一般的な健康にも必要であることが広く合意されている[95-97]。ビタミンDが免疫調節ホルモンであり、自然免疫系および適応免疫系に重要な生物学的効果を持つという説得力のある証拠がある[97]。
4.1. MgとビタミンDの相互作用
多数の臓器におけるビタミンDの全体的な代謝および効果はよく知られている[96]。ビタミン D と 25-ヒドロキシビタミン D -25(OH)D またはカルシフェジオールの輸送タンパク質への結合や、肝および腎の水酸化によるビタミン D の活性ホルモン形態である 1,25-ジヒドロキシビタミン D (カルシトリオール) への変換など、ビタミン D の代謝におけるいくつかのステップは、補酵素として Mg に依存している [98-102];したがって、Mg が不足すると、これらの作用は鈍化する(図 1)。マグネシウムはまた、副甲状腺ホルモン(PTH)の合成と代謝にも重要な役割を果 たしており、Mg欠乏はPTHの分泌や合成を阻害する[103-106]。PTH値が高いにもかかわらず低カルシウム血症を呈するMg欠乏患者は、PTHに対する骨および腎臓の抵抗性を示唆している[107]。末梢性PTH抵抗性またはPTH分泌の低下に起因する二次的なMg欠乏に関連する低カルシウム血症は、ビタミンD欠乏の悪化に伴う腎1-α-水酸化のPTH刺激の喪失によってさらに複雑になる[98]。カルシトリオールの減少と PTH 反応の低下につながる Mg 欠乏 [98] は、「Mg 依存性ビタミン D 耐性くる病」[99,108] に関与している。Mg 欠乏症患者を対象とした 2 件の研究 [98,109] では、Mg の輸液のみではカルシトリオールと 25(OH)D が有意ではない増加を示したが [98]、経口ビタミン D に Mg を添加した場合には血清カルシトリオールと 25(OH)D の両方が有意に増加した [109] ことが示されており、Mg とビタミン D の相互作用が確認されている。ビタミンDは、Mgの代謝に重要な役割を果たしており、腸管でのMg吸収を促進し、腎でのMg排泄を防止している[110]。このように、Mg とビタミン D のそれぞれの欠乏が他方の欠乏を補っており、その結果、両方の欠乏がさらに悪化するという逆循環に陥っている可能性がある。MgとビタミンDの欠乏が複合的に作用すると、特に女性において脆弱性骨折のリスクが高くなるなど、臨床的に関連する転帰につながる可能性がある[111]。この有害な組み合わせによる同様の有害な影響が、感染症などの他の主要な臨床転帰においても観察される可能性がある。
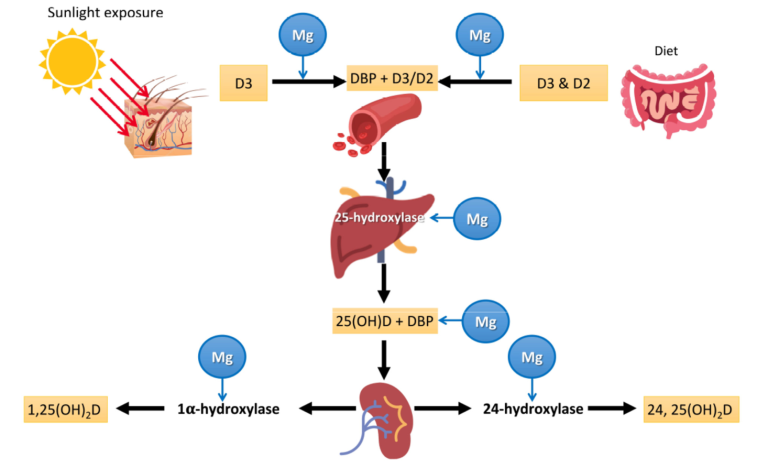
図1 MgとビタミンDの代謝
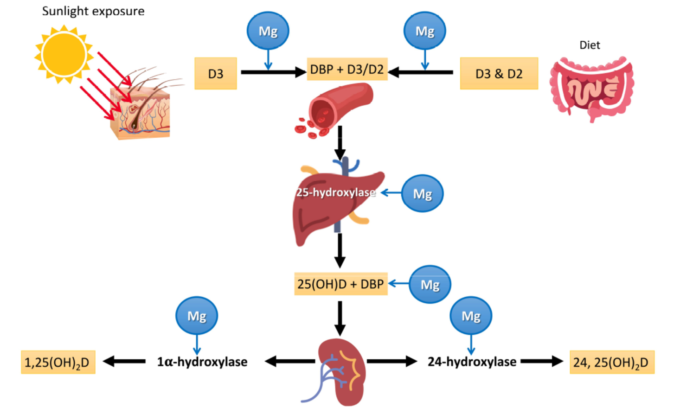
ビタミンD3は、皮膚の7-デヒドロコレステロールに達するUVB放射の作用によって皮膚で生成され、その後、熱反応が起こる。そのビタミンD3または経口ビタミンD(D2(エルゴコルシフェロール)またはD3(コレカルシフェロール))は、肝臓で25(OH)Dに変換され、必要に応じて腎臓などで活性ホルモン代謝物である1,25(OH)2D(カルシトリオール)に変換される。グラフに示すように、Mgは、ビタミンDの輸送タンパク質への結合、肝25-ヒドロキシル化によるビタミンDの変換、25(OH)Dの輸送、腎臓での1α-ヒドロキシル化による活性ホルモン型への変換に必要な補酵素である。したがって、これらのステップはすべてMg依存性である。DBP:ビタミンD結合タンパク質。
Dengらの研究[112]では、Mg摂取量とビタミンDの状態、および死亡率との間の潜在的な相互作用を調査した。彼らは、NHANES 2001年から 2006年およびNHANES IIIのデータを分析したところ、参加者の12%が重度の25(OH)D欠乏(12 ng/mL未満)30%がビタミンD不足(12~20 ng/mL)であったと報告している。総Mg摂取量が多い(食事療法またはサプリメントによる)ことは、ビタミンD欠乏またはビタミンD不足のリスクの減少と独立して関連していた。また、血清25(OH)Dと死亡率(特に心血管疾患および大腸がんによる)との間には逆相関があり、これはMgの高摂取によって修飾された(すなわち、逆相関は、Mg摂取量が中央値を超えている人の間で主に見られた)。このように、Mg 摂取量単独またはビタミン D 摂取量との相互作用がビタミン D の状態に寄与し、25(OH)D と死亡リスクとの関連が Mg 摂取量のレベルによって修飾される可能性がある。最近、Personal Prevention of Colorectal Cancer Trialの中で行われた入れ子になったRCTでは、180人の参加者を2×2の二重盲検RCTで評価し、液体クロマトグラフ質量分析法を用いて血漿中のビタミンD代謝物を測定することで、Mg補給がビタミンD代謝に影響を与えるかどうかを検証した。分析の結果、最適な Mg の状態が 25(OH)D の状態の改善と関連していることが示された[113]。
4.2. ビタミン D と感染症
ビタミンDは、その筋骨格系への作用に加えて、感染症においても重要な役割を果たしていると考えられている。ビタミンDが結核菌感染症に与える影響についての最初の証拠の一つは、ビタミンDが結核菌感染症に与える影響である。結核菌感染症では、免疫応答においてビタミンDが果たす重要な役割は、ファゴリゾソーム形成の促進、ヒト抗菌ペプチドであるカテリシジンLL-37やディフェンシンの産生などである[114,115]。その後、ビタミンD補給と結核への影響が広範囲に研究されている[116]。さらに、血清ビタミンD濃度の測定でも、ビタミンD濃度が後天性免疫不全症候群を含む他の感染症や呼吸器疾患、特に肺炎と関連していることが報告されている[117] [118]。実際、ビタミンD濃度の低さが疾患の原因であるのか、それとも結果であるのかはまだ議論の余地がある。しかし、重篤な感染症の経過の中で、エネルギー消費量の増加とそれに密接に関係するATPとMgの需要の増加は、ビタミンDの免疫調節作用の有効性を低下させる可能性があると考えられる。
前述したように、ビタミンDが免疫調節ホルモンであることは説得力のある証拠が示している[97]が、ビタミンDの欠乏は、上気道感染症や腸管感染症、肺炎、中耳炎、クロストリジウム感染症、膣炎、尿路感染症、敗血症、インフルエンザ、デング熱、B型肝炎、C型肝炎、HIV感染症などの様々な感染症と関連している[119,120]。感染症時にビタミンDが発揮する保護特性は、食細胞や上皮細胞におけるカテリシジンとβデフェンシン2の発現のアップレギュレーションに起因していると考えられている[119]。これには、タイトジャンクション、ギャップジャンクション、アドヒアレンスジャンクションの維持、ウイルス複製サイクルを妨害する抗ウイルスサイトカインの誘導、さらには抗菌ペプチド、すなわちヒトカテリシジンLL-37やデフェンシンの誘導による細胞性自然免疫への影響も含まれている[120,121]。
我々は、低ビタミンDステータスが多くの慢性疾患と頻繁に関連していることを引用した [95-97]。介入試験では、高齢者の死亡率を除いて、治療または予防策としてのビタミンD補給の有益性が示されることはほとんどない[122]。25のRCTと0~95歳の10,933人のデータを含む最近のメタアナリシスでは、すべての参加者においてビタミンD補給が急性呼吸器感染症のリスクを低下させることが示された。サブグループ分析では、ボーラス投与群と比較して、毎日または週1回の投与を受けている群の方が保護効果が高く、ベースラインの25(OH)Dが25 nmol/L(10 ng/mL)未満の群では、急性呼吸器感染症の発生率が70%低下していることが明らかになった[123]。
4.3. Mg と感染症
MgとビタミンDの密接な関係と、前のサブセクションで議論したビタミンDの合成、輸送、活性化のための最適なMg状態の必要性は、ビタミンD欠乏症に関連する感染症の高い発生率は、少なくとも部分的にMgの欠乏によって説明することができることを示唆している。貧しいMgの状態と貧しい免疫系の機能との間の直接的な関連性に関するほとんどの研究は、動物モデル( “Mgと免疫応答 “に関する上記のセクションを参照)に由来している場合でも、ヒトでは、Mgの欠乏は、特に高齢者を考慮した場合には、感染症の高い率に関連付けられているように思われる。前述したように、免疫における Mg 輸送の機能的重要性は、MAGT1 の遺伝的欠損により、T リンパ球の活性化と慢性的なエプ スタインバーウイルス感染症を呈する XMEN 疾患が発見され、Mg が細胞内シグナル伝達のセカンド メッセンジャーとして機能することを初めて示したことで証明された [12-14] 。最近の研究では、免疫不全と慢性エプスタインバーウイルス感染症の発症を説明する新たな機序が追加されている[43,44]。
Mg欠乏は、肝臓疾患、特にミトコンドリア機能の障害、欠損したプロテインC転座、炎症反応、酸化ストレス、または代謝障害のためにそれらの進行において役割を果たす可能性が示唆されている[124]。Mgは、HBV感染から肝細胞がん(HCC)への進行を抑制する上で重要な役割を果たす可能性がある [125]。HBV感染が確立されると、ウイルス制御タンパク質であるB型肝炎ウイルスXがトランスフォーミング成長因子(TGF)-βシグナルを増幅し、これが腫瘍プロモーターとして機能し、HCCによるがんの転移や浸潤を促進する。Mgの投与は、プロテインホスファターゼMg依存性1Aの発現を増加させ、p-Smad2/3を脱リン酸化することでTGF-βシグナルを遮断し、その結果、HCCの増殖に必要な特定の遺伝子の転写を阻害することができる[125]。
最近の研究では、細菌性肺炎に罹患した高齢者において、変化したMg状態が予後を左右する役割を持っているように思われることが示された。興味あることに、低マグネシウム血症と高マグネシウム血症はともに、血清Mgの正常値と比較して、それぞれ18.4%と50%の過剰な短期死亡率と関連していた[126]。さらに、高齢者を対象としたレトロスペクティブ研究において、血清Mgの低値は、慢性閉塞性肺疾患(COPD)の急性増悪に対する再入院の頻度の有意な予測因子であった[127]。
5. 高齢者の感染症
感染症は、様々な生理的変化および恒常性メカニズムの進行性の悪化により、高齢者における罹患率および死亡率の増加の一般的な原因となっており、臓器の変化、機能低下、多病、虚弱、障害、および関連する医療介入につながる [128] 、および加齢に伴う免疫反応の変化につながる [129]。高齢者の感染症は通常、若年層に比べて傷害性が高く、一連の合併症を引き起こすことが多く、人的・経済的負担が大きい[3]。これは特に長期療養施設の入所者に当てはまる[130]。
1998年~2006年の全米入院患者サンプルを用いた米国の第1位の感染症(ID)入院のデータから、急性感染症による死亡率は、30~50歳の人に比べて65歳以上の人の方が50倍以上高いことが示された [131];高齢者は一般人口に比べて急性感染症で入院するリスクが4倍高い [132]。実際、感染症は高齢者における入院の頻繁な原因であり、入院自体が、侵襲的な診断処置や尿道および静脈カテーテルの不適切な使用によって引き起こされることが多い、生命を脅かす院内感染につながる可能性がある[133]。重篤な感染症から生き残った高齢者は、その後、機能的に悪化し、後に自給自足の喪失につながることがある [134,135]。例えば、肺炎は入院後の長期的な罹患率および死亡率を上昇させる;生存した患者の70%以上が肺炎で入院してから3年以内に少なくとも1回は再入院すると報告されている[136]。
過去100年の間に、米国などの先進国では感染症の減少傾向が顕著で、1900年には人口797:10万人だった感染症が1996年には人口97:10万人にまで減少した[131,137]。逆に高齢者のみを考慮した場合、感染症の入院率は1990年から 2002年にかけて13%増加した[137]。
「免疫老化」(表1)という用語で説明されるように、加齢に伴う免疫系の変化は、外部からの毒素を克服する生物の能力を変化させる。すべての高齢者は、重症度にばらつきがある免疫新生の特徴を示す;それにもかかわらず、虚弱性の程度は免疫能力の程度と関連している[138]。高齢になるにつれて、免疫系は感染症と戦う正常な能力を失い、感染症にかかりやすくなり、新生物および自己免疫を発症しやすくなり、皮膚病変を治癒する能力が低下する[129,139]。一般に、高齢者は、加齢に伴う臓器の衰え、多臓器症、栄養不良、虚弱、機能不全、老年症候群、およびポリファーマシー療法に加えて、免疫産生に起因する軽度の免疫抑制を有する。これらすべての要因が一緒になって、感染症を持つ高齢者の予後を悪化させる[128,138]。
機能低下および免疫系能力の低下は、年代的な年齢よりもむしろ疾患負荷に関連している。慢性疾患(例えば、COPD、心不全、糖尿病)を有する高齢者は、併存疾患のない高齢者と比較して、一般的な感染症に罹患しやすく、ワクチンへの反応が低下している [140]。したがって、すべての高齢者がワクチン接種に対して低反応性を示すわけではなく、一部の高齢者は老年期に完全に機能する免疫系を維持することができる。しかし、免疫応答の悪化のために、どのような感染症も虚弱高齢者における合併症または死亡の高いリスクと関連している可能性がある。例えば、インフルエンザ感染症は、良性で自己制限的であるかもしれないが、より脆弱な高齢者患者においては、合併症や死亡につながるか、または入院を必要とすることもある。現在のCOVID-19パンデミックでは、高齢者および既往症(すなわち、心疾患および脳血管疾患、糖尿病、COPD、悪性腫瘍、慢性腎臓病、認知症)を有する患者は、人口の最も虚弱なグループに影響を与えている本疾患の最も高い致死率を負担している者である[141,142]。
6. マグネシウムとCOVID-19パンデミック
中国の武漢省が起源と考えられるコロナウイルスの亜種である重症急性呼吸器症候群コロナウイルス2(SARS-CoV2)によるCOVID-19のアウトブレイク[143]は 2020年3月に世界保健機関(WHO)によりパンデミックと宣言された。WHOによると、本レビュー執筆時点(2020年12月14日)で世界で報告された確定症例数は7,000万人を超え、関連死は1,605,091人である[144]。
これらの患者の一部は間質性肺炎を発症し、急性呼吸窮迫症候群(ARDS)に発展する可能性があり、致死的な転帰を伴う可能性のある積極的な高酸素換気を必要とする[145]。COVID-19は肺に影響を及ぼすだけでなく、ウイルスは心血管系、腎臓、腸、肝臓、および脳を含む他の多くの臓器やシステムにも影響を及ぼし、深刻な影響を及ぼす可能性がある;したがって、現在では全身性疾患と考えられている。COVID-19は、軽度のインフルエンザ様症状から生命を脅かす肺炎、サイトカインストーム、多臓器不全に至るまで、異質な臨床症状が特徴である。高齢者ほど、重症化しやすく、ICUに入院しやすく、この疾患で死亡する可能性が高い [146,147]。この傾向は発症時から持続しており、特に長期療養ホームで暮らす高齢者では、高齢化、健康状態の悪さ、複数の慢性疾患、生活環境、免疫老化、および無症状の可能性のある介護者への曝露などの理由から、この傾向が高い[148]。これまでのところ、COVID-19に対して有効な治療法は存在しない;したがって、現在のところ、この疾患を持つ患者の管理の主要な柱として支持療法が用いられている[149]。COVID-19の呼吸器病変と多臓器不全のメカニズムは完全には解明されておらず、現在調査中であるが、サイトカインストームはこの疾患の最も重篤な症状の発症に大きく寄与しているようである[145]。
COVID-19の病態および予後には、栄養学的問題が重要であるようである。例えば、低Mg摂取量に関連する状態である肥満は、COVID-19に罹患した人の死亡率および入院を増加させる負の因子であるように思われる[150,151]。さらに、前に述べたように、図1に示すように、MgはビタミンDの生合成、輸送、活性化に必要な補酵素であり、MgとビタミンDの両方の欠乏は、いくつかの慢性疾患と関連している。いくつかの研究[121,154-159]で報告されているように、MgとビタミンDの両方の欠乏は、COVID-19の発症に重要であるように思われる。COVID-19は、関連する肺障害[160]および心臓障害[161]と関連している。ここでも文献は、Mgが肺および心臓機能において重要な役割を果たしていることを示唆している[11,15,45-47,162]。肥満に加えて、高血圧[163]、糖尿病[164]、および主に老年期[165]などの他の共存状態は、COVID-19の重症度の増加と関連しているが、これは根底にある慢性炎症状態または免疫反応による臓器機能障害の発生のための閾値が低いためであると考えられる。老年期および上述した慢性炎症状態を含むこれらすべての状態は、低Mg状態と関連している[7,11,15,166]。
COVID-19の重篤な症状を有する患者は、集中治療室(ICU)への入院を必要とする可能性がある。興味深いことに、集中治療室(ICU)に入院している重篤な患者の 60%までがある程度の Mg 欠乏症を呈していることが報告されており[167-169]、このような患者は、結果として低カリウム血症や低カルシウム血症が発生するため、重篤な、さらには生命を脅かすような影響を受けやすくなっている。残念ながら、これまでのところ、COVID-19におけるMgの重要性に関する直接的な データは得られていない。これは、Mgが主要なデータベースや研究で日常的に 測定されていないためであろう。さらに、全身のMgのわずか1%を占める血清濃度は、細胞内濃度、そして最終的には全身の状態を正確に反映していない[15]。Wallace は、思慮深いレビューの中で、適切な場合には再補充を伴うイオン化 Mg の状態の常時モニタリングは、疾患の収縮と進行に影響を与えるための効果的な戦略である可能性があると報告している[155]。この点に関して、文献は、NF-κB、IL-6,CRP [54]、および他の関連する内分泌撹乱因子の下流への抑制につながる「カルシウム チャネル遮断」効果、腎カリウム損失の調節における役割、ビタミン D [158]の機能を活性化し強化する能力など、抗 COVID-19 栄養素としての Mg のいくつかの側面を支持している[155]。Tanらによるコホート観察研究では、50歳以上のCOVID-19の連続入院患者43人のうち、入院時に酸素療法を必要としない患者を対象に、17人にはビタミンD3 1000IU、Mg 150mg、ビタミンB12 500mcgを1日1回経口投与したが、26人には投与されなかった。その結果、入院中に酸素療法(17.6 vs. 61.5%)や集中治療(6 vs. 32%)を必要とした患者は対照群に比べて少なく、臨床経過に有意な差が認められた。この小規模ではあるが重要な研究は、COVID-19と戦っている間に必要量が最も高くなる可能性が高い状況下で、これらの栄養素を十分に補給することの重要性を示している[156]。SARS-Cov2感染に対するMgの潜在的な作用を検討している他の著者は、COVID-19患者、特に重症患者および/または合併症のリスクが最も高い患者(妊婦も含めて)[154,157]の治療をサポートする可能性があるとしてMgを指摘している[157]。
COVID-19 肺炎が血管性肺炎に関係している可能性があるという仮説は有力である[170,171]。繰り返しになるが、Mgは頑健な抗血栓作用を有する[52]一方で、低Mg濃度は内皮機能障害と関連している[172,173]。最近のシステマティックレビューとメタアナリシスでは、経口Mg補給の血管機能に対する効果をRCTでまとめている。利用可能な研究が少なく、研究間の異質性が高かったとしても、 サブグループ分析では、不健康な人、50 歳以上の高齢者、BMI が 25 kg/m2 以上の人を含む 6 ヶ 月以上の研究では、経口 Mg は流量介在性拡張を有意に改善していた[174]。したがって、老年期に非常に頻繁に見られる慢性的な Mg 欠乏が、COVID-19 の主な特徴である血栓塞栓症を促進するためのウイルスにとって好ましい微小環境を作り出している可能性がある[154]。
COVID-19 に対する予防接種(あるいは決定的な治療法)はないため、感染症、特にウイルス感染症にお ける炎症、酸化ストレス、内皮機能障害、免疫応答における Mg の役割は、前臨床および臨床のエビデンスによ り大きく裏付けられているため、この感染症における Mg の役割に関する具体的な研究を奨励す る。
ここでは、COVID-19 の研究の中で、これまでの研究で Mg との関連性が示されているいくつかの重要な点について、以下に述べる。これらは、COVID-19の重症度と合併症に対抗するために最適なMgの状態を維持することを示唆する、もっともらしいメカニズムである。
6.1. COVID-19におけるサイトカインストーム
COVID-19の病因および臨床経過の極端な変動性については、まだ多くの未解決の疑問があるとしても、利用可能な証拠は、いわゆる「サイトカインストーム」と呼ばれる、炎症の可溶性マーカーの制御不能な過剰産生を意味し、その結果、異常な全身性炎症反応を維持することが、ARDSの発生の主な原因であることを示している[145]。
免疫反応が病原体を排除しようとする際に、炎症性メディエーターの過剰産生によって引き起こされる巻き添え被害は、病原体そのものよりも有害であるように思われる。このような過剰な炎症性反応は、感染を制御するために最初は適切であるかもしれないが、制御されずに継続的であれば、二次的な多臓器不全が続く可能性がある。サイトカインストーム中に放出される炎症性メディエーターのカスケードには、インターフェロン、インターロイキン、ケモカイン、コロニー刺激因子、およびTNF-αなどの多くの免疫活性分子が含まれる[175]。上述したように、実験動物およびヒトにおける観察研究において、低Mg状態が、炎症マーカー、特にIL-6,TNF-α、およびIL-33/ST2軸のレベルの上昇を伴う慢性炎症状態と関連していることを確認する広範な証拠が存在する(サブセクション「マグネシウム、炎症、および酸化ストレス」を参照)。したがって、加齢、高血圧、糖尿病[7,11,15,166]などのCOVID-19の有害な経過を有利にする状態に関連した先行するMgの欠乏状態、および重症患者で頻繁に見られるMg欠乏[167-169]は、SARS-CoV2によって誘導される炎症反応を悪化させる可能性があり、その結果、細胞内レベルのさらなる低下をもたらすMg消費量の増加を決定し、制御されていない炎症反応、またはサイトカインストームを維持し、伝播させる可能性がある。
Mgのもう一つのよく知られた作用は、そのカルシウムチャネルアンタゴニスト特性に関連している[176,177]。実際、Mgは合成カルシウム拮抗薬と同様に、生理的カルシウムブロッカーとしてカルシウムに対抗している[178]。興味深いことに、Mg のカルシウムチャネル遮断作用は、NF-κB、IL-6,および CRP [54] の下流への抑制につながり、全身の炎症を制限する可能性がある(図 2)。
図2
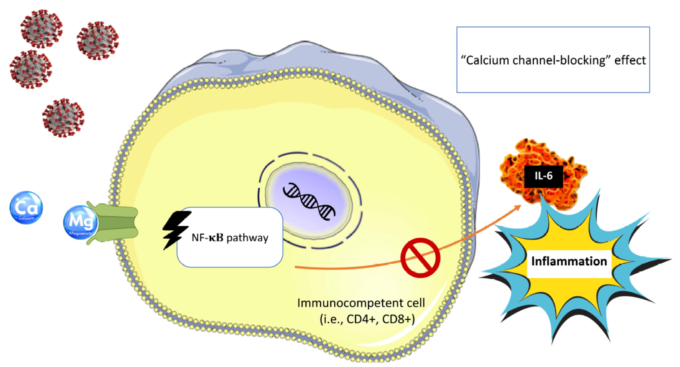
Mgの「カルシウムチャネル遮断」効果により、NF-κB、IL-6の下流抑制につながり、全身の炎症を制限する可能性がある。NF-κB:活性化B細胞の核内因子70κ-光鎖エンハンサー;IL-6:インターロイキン6;CD4+。Tヘルパー細胞;CD8+:細胞傷害性T細胞。
6.2. COVID-19 と内皮機能障害
COVID-19のプロテアン発現とその多臓器関与を説明するために医学文献で広く議論されてきたもう一つの病態生理学的機序は、血管内皮機能不全である[171]。血管内皮は恒常性の維持に極めて重要であり、線溶、血管運動、炎症、酸化ストレス、血管伝染性、および構造を制御している。これらの機能はすべて協調して作用し、外部毒素に対する多くの宿主防御機構を調節しているが、COVID-19 [179]で報告されているように、通常の恒常性機能が過剰に働き、宿主に逆らってしまうと、複数のレベルで疾患の一因となりうる。
SARS-CoV-2はアンジオテンシン変換酵素(ACE2)受容体を介して宿主に感染するが、この受容体は肺、心臓、腎臓、および腸を含むいくつかの器官で発現している。ACE2受容体は内皮細胞によっても発現している[179]。COVID-19における血管の変化が、ウイルスによる内皮細胞の関与によるものかどうかは不明である。しかし、異なる臓器の血管床をまたいだ内皮細胞の関与は、COVID-19の一連の患者で報告されており[180]、血栓塞栓性合併症の予防のために抗凝固剤治療(すなわち、ヘパリン)が検討されている[181]。
Mgは、内皮機能と血管の完全性を維持するために重要である。細胞外Mgの低濃度は、内皮細胞の増殖を低下させ、単球の接着を刺激し、一酸化窒素やプロスタサイクリンなどの血管作動性分子を障害する[182]。Mg欠乏は血小板の凝集を促進し、βトロンボグロブリンやトロンボキサンの放出を促進する[183]。ヒトでは、経口的なMg補給は、冠動脈疾患患者[173]および糖尿病高齢者[172]において、上腕動脈の内皮機能および運動耐性の改善と有意に関連している。最近のシステマティックレビューとメタアナリシスでは、不健康な人、50歳以上の高齢者、BMI>25kg/m2の人を含む、追跡期間6ヶ月以上のMg補給を行った研究において、フロー媒介性拡張が有意に改善されたことが報告されている[174]。
6.3. COVID-19とビタミンD
前述したように、ビタミンDが免疫調節ホルモンであり、その欠乏が様々な感染症と関連していることを示す説得力のある証拠がある(サブセクション「ビタミンDと感染症」を参照)。最近のレビューでは、Grantらは、ビタミンDは自然免疫をサポートし、タイトジャンクションと肺関門の完全性を維持し、免疫調節活性を提供し、レニン-アンジオテンシン系を調節しており、これはCOVID-19患者で観察された急性肺炎および高炎症に関連する可能性のあるすべての因子であると論じている[121](図3および4)。
図3
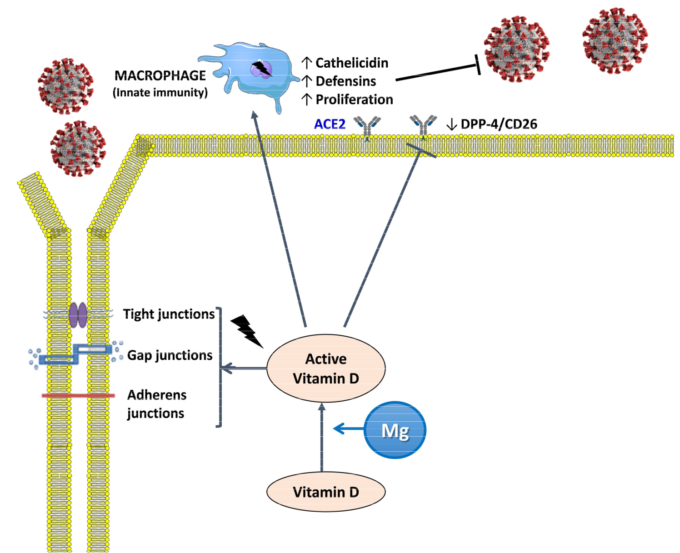
活性型ビタミンD(カルシトリオールまたはジヒドロキシコレカルシフェロール)は、SARS-CoV2の拡散を防ぐためにタイトジャンクション、ギャップジャンクション、およびアドヒアレンスジャンクションを維持するのに役立ち、マクロファージの増殖およびカテリシジンおよびディフェンシンの放出を誘導する。MgはビタミンDの合成、輸送、活性化に必要な補酵素であり、ACE2:アンジオテンシン変換酵素2受容体、DPP-4/CD26:ジペプチジルペプチダーゼ-4受容体。
ビタミンDは、(i)呼吸器上皮における抗菌ペプチドの産生をサポートし、ウイルス感染やCOVID-19症状の発現を抑制すること、(ii)SARS-CoV-2感染に対する炎症反応を抑制することにより、COVID-19感染に対する反応に影響を与えることが提案されている。この反応の調節障害はCOVID-19の特徴であり、過剰活性化の程度は予後不良と関連している。
図4 ビタミンDとMgがCOVID-19に対して作用を発揮するメカニズム
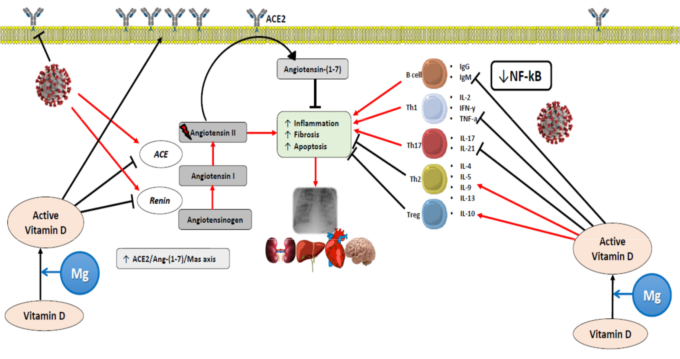
ACE、アンジオテンシン変換酵素;ACE2:アンジオテンシン変換酵素2;Ang-(1-7)アンジオテンシン(1-7);Ig、免疫グロブリン;IFN-γ、インターフェロンγ;IL、インターロイキン;NF-κB、活性化B細胞の核内因子κ-光鎖エンハンサー;TNF-a、腫瘍壊死因子α;Th、Tヘルパー細胞;Treg、調節性T細胞。
COVID-19におけるビタミンDの作用の可能性についての医学的文献は、ここ数ヶ月で爆発的に増加している。小規模な観察研究および試験では、心強い結果が示されている。例えば、単一施設でのレトロスペクティブ研究では、ビタミンDの欠乏がCOVID-19リスクの増加と関連していることが示され[159]、27件の研究のメタアナリシスでは、COVID-19の重症例は軽症例と比較してビタミンD欠乏を有することが多く、一方でビタミンDの欠乏は入院および死亡の可能性の増加と関連していることが示された[184]。重症COVID-19の186例を対象とした別のレトロスペクティブ観察試験では、入院時の25(OH)Dレベルの低さがCOVID-19の病期および死亡率と関連していることが明らかになった[185]。無症状の参加者91人とCOVID-19の重症患者63人を含む研究では、それぞれ33%と97%のビタミンD欠乏が報告されている。血清炎症性マーカーと死亡率は、ビタミンD欠乏症の患者の方が高かった[186]。これらの結果はいずれも心強いものであるが、MgはビタミンDの合成、輸送、活性化に不可欠な補酵素であることを念頭に置いておく必要がある(図1)。前述したように、COVID-19患者のサンプルにおいて、Mg、ビタミンD、ビタミンB12を経口的に補給することで、酸素サポート、集中治療入院、またはその両方の必要性が減少することが示された[156]。したがって、ビタミンDの欠乏だけでなく、Mgの欠乏も是正することが望ましいと考えられる。
7.結論
このレビューでは、感染症、特にこの基本的なカチオンの欠乏によって頻繁に影響を受ける人口である高齢者に影響を与えるものでは、Mgの潜在的な役割を報告した。これらの種類の疾患におけるMgの重要性に関する証拠は、低Mgの食事は、免疫応答、酸化ストレス、および炎症性マーカーの好ましくないプロファイルに関連付けられていたことを報告する動物モデルから得られている。これらの知見は、疫学的観察研究によってヒトで確認されている。慢性的なエプスタインバーウイルス感染によって特徴づけられる免疫不全症であるXMENの発見は、カチオンが細胞内シグナル伝達におけるセカンドメッセンジャーとなりうることを初めて実証し、ウイルス感染におけるMgの潜在的な重要な役割を明らかにした、特に興味深い研究分野の幕開けとなった。MgはビタミンDの合成、輸送、活性化のための補因子であり、現在のCOVID-19パンデミックの原因となったSARS-Cov2感染症を含むいくつかの感染症において重要な免疫調節因子であることが証明されている。サイトカインストームにつながる炎症性メディエーターの過剰放出を伴う免疫過剰反応性、内皮機能障害、血栓性合併症、および老齢、糖尿病、高血圧などのCOVID-19の臨床経過の予後を悪化させる既往の素因状態など、COVID-19に記載されている他のメカニズムは、すべてMg欠損と関連している。直接的なデータはまだ得られていないが、これらの概念は、最近のパンデミックであるCOVID-19におけるMgの重要性を紹介している、Mg欠乏症のリスクが高く、決定的な治療法やワクチン接種がまだ利用できない高齢者にも特に有害である。最適な Mg の状態はまた、健康な人や SARS-Cov2/COVID-19 に対する ワクチン接種を受ける予定の患者にも、上記で提案したような治療作用や疾患調節作用の可能性があるのと同じ機序によ り、より良い耐性を与える可能性があることが予想される。
図5は、最適なMg状態を維持することがCOVID-19に有益である可能性のあるメカニズムをまとめたもの
図5 COVID-19で考えられるMgの効果のまとめ
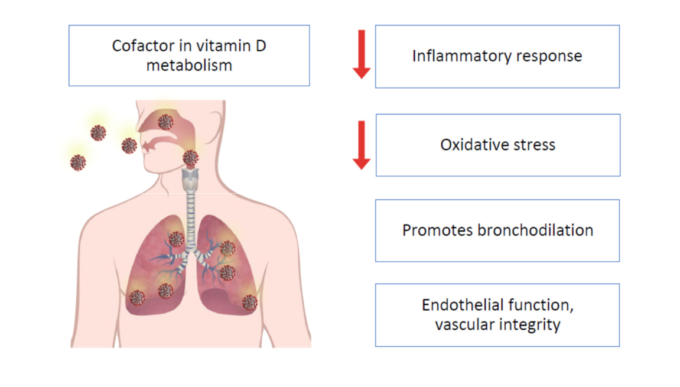
2019年12月以降、医療提供者から科学者、経済学者、社会学者、支配者に至るまで、誰もが警鐘を鳴らしてきた新たな未知のハザードを解読するのに苦労している。Mgが治癒的でない場合でも、最終的にCOVID-19の臨床コースの重症度を軽減するのに役立つために、その赤字の是正を確実にすることが重要だ。それにもかかわらず、貧弱なMg状態とCOVID-19の有病率および転帰との間の潜在的な関連を示すさらなる研究が、結果的に必要である。