Contents
academic.oup.com/brain/advance-article/doi/10.1093/brain/awaa219/5895260
ジョン・L・ロビンソン、シルビア・ポルタ、フィリップ・G・ギャレット、パンパン・チャン、シャロン・X・謝、ウンラン・スー、ヴィヴィアンナ・M・ヴァン・デアリン、エリン・L・アブナー、グレゴリー・A・ジチャ、ジャスティン・M・バーバー… もっと見る
要旨
TAR-DNA結合蛋白質-43(TDP-43)プロテインオパシーは、複数の脳疾患で見られる。最近、一般的な加齢性TDP-43プロテインオパシーの標準化された用語が推奨された:大脳辺縁系優位型老年期TDP-43脳症(LATE)およびその基礎となる神経病理学的変化であるLATE-神経病理学的変化である。LATE-神経病理学的変化はアルツハイマー病の神経病理学的変化(AD-神経病理学的変化)と共存している可能性がある。
しかし、LATE-神経病理学的変化、AD-神経病理学的変化、TDP-43(FTLD-TDP)を伴う前頭側頭葉変性症の間では、診断上の分類が不明確である。現実的な課題としては、異なる剖検コホートは異なる研究ボランティアのグループで構成されていることが挙げられる。また、神経病理学的手法も研究室によって異なっている。
ここでは、ペンシルバニア大学とケンタッキー大学の2つの研究センターの症例と神経病理医の診断を組み合わせた。本研究は、FTLD-TDPと病理学的に重症なLATE-神経病理学的変化の神経病理学的所見を比較することを目的とした。まず、ペンシルバニア大学から、FTLD-TDP(n = 33)または重度のLATE-神経病理学的変化(ほとんどがステージ3)で、AD-神経病理学的変化を併存している症例(n = 30)のいずれかの病理診断を受けた症例を選択した。ペンシルバニア大学のこれらの症例からの切片は、扁桃体、前帯状体、上・中側頭葉、および中前頭回から切除された。
これらの切片をphospho-TDP-43免疫組織化学的に染色し、ケンタッキー大学の神経病理医2名が症例データを盲検化して独自に評価した。FTLD-TDPとLATE-神経病理学的変化を鑑別するために、大脳新皮質領域におけるTDP-43免疫反応性神経細胞質内包物の密度に基づいて、仮説的にFTLD-TDPとLATE-神経病理学的変化を鑑別するための一連の単純な基準が作成された。重度のLATE-神経病理学的変化とFTLD-TDPを盲検評価で鑑別した場合の感度と特異度は約90%であった。
高齢者のTDP-43プロテインオパシーに関連するもう一つの神経病理学的特徴は扁桃体の「α」と「β」であることが提案された。アルファとベータの状態は、両大学の神経病理学者によって診断された(n = 5人の評価者)。アルファ/ベータ分類の評価者間信頼性は不良であった(平均κ=0.31)。次に、ケンタッキー大学のFTLD-TDP(n = 8)または比較的「純粋な」重度のLATE-神経病理学的変化(中間または重度のAD-神経病理学的変化を欠く;n = 14)のいずれかを有する症例の別個のコホートを試験した。
単純な基準は、ペンシルバニア大学での先行診断を盲検化した神経病理医によって適用された。ここでも、LATE-神経病理学的変化とFTLD-TDPの鑑別基準は有効であり、感度と特異度は約90%であった。もし各コホートの代表的な症例(重症度の低いTDP-43蛋白症を含む)が含まれていれば、LATE-神経病理学的変化を同定するための全体的な精度は両コホートとも98%以上と推定された。また、両コホートともFTLD-TDPの症例はLATE-神経病理学的変化の症例よりも若く死亡していた(P < 0.0001)。我々は、ほとんどの症例において、重度のLATE-神経病理学的変化とFTLD-TDPは、単純な神経病理学的基準を適用することで鑑別できると結論した。
序論
TAR-DNA結合タンパク質-43(TDP-43)プロテインオパシーは、異常にリン酸化されたおよび/または誤局在化したTDP-43タンパク質によって特徴付けられる。世界中の何百万人もの個人が加齢に伴うTDP-43プロテインオパシーの影響を受けているという一般的な合意がある(Nelson er al)。、 2019a)。将来の治療戦略のいくつかは、患者の特定のサブセットには有効であるが、他の患者には必ずしも有効ではないかもしれないので、疾患特異的な診断は重要である。しかしながら、これらの神経変性疾患の分類システムに関する重要な疑問が残っている。
TDP-43プロテインオパシーは、筋萎縮性側索硬化症(ALS)および前頭側頭葉変性症(FTLD-TDP)を含む、一見異なるいくつかの神経疾患を有する患者の間で病理学的バイオマーカーとして発見されたが、TDP-43プロテインオパシーを含む多くの重複する特徴は、これらの疾患が病理学的に関連していることを示唆している(Neumann et al 2006)。ALS/FTLDの臨床病理学的スペクトルにおいて、TDP-43をコードする遺伝子であるTARDBPの変異を有する患者はごく一部である(Sreedharan er al)。、 2008; Van Deerlin er al)。、 2008)。しかしながら、ALS/FTLDスペクトルの外には、神経学的障害を伴うTDP-43プロテインオパシーを駆動する多くの追加の遺伝的および環境的要因がある(Chornenkyy et al 2019)。
圧倒的に、TDP-43プロテインオパシーの最も有病率の高い既知のサブセット(s)は、進行した老年期に発生する;TDP-43プロテインオパシーは、85歳を超えて死亡する個体の30〜50%で観察される(Nelson er al)。、 2019a)。この文脈では、TDP-43プロテインオパシーは、特にエピソード記憶の認知領域において、実質的な認知障害と関連している(Nag et al 2017; Robinson et al 2018a)。通常、罹患した個体は、前頭側頭型認知症(FTD)の臨床的特徴、例えば、失語症および重度の抑制性(Nelson et al 2013、2019a; Jung et al 2014)を欠いている。
TDP-43プロテインオパシーに対する複数の分類システムが提案されている。国際的な専門家グループは最近、共通の(生涯リスクが10人に1人以上)加齢に関連したTDP-43プロテインオパシーについて協議した(Nelson er al)。、 2019a)。新しい用語が推奨された:大脳辺縁優位、加齢性TDP-43脳症(LATE)およびその基礎となるLATE神経病理学的変化の基質(LATE-神経病理学的変化)。LATE-神経病理学的変化は、併存するアルツハイマー病の神経病理学的変化(AD-神経病理学的変化)の有無にかかわらず起こりうる。しかしながら、提案されている加齢性TDP-43プロテインオパシーのLATE-神経病理学的変化としての分類は問題がある(Josephs et al 2019a)が、その理由の一部は、AD-神経病理学的変化およびFTLD-TDPに関連する診断境界領域の問題が現在不明確に定義されているからである。高齢者におけるTDP-43蛋白質障害に関連する別の提案された神経病理学的特徴は、扁桃体におけるTDP-43免疫反応性の「α」(FTLD-TDP病理学的タイプAに類似している)対「β」(AD-神経病理学的変化タイプのタウのもつれ構造および/またはその近傍で起こる)パターンである(Josephs et al 2019b)。
これは複雑な主題領域である。LATE-神経病理学的変化とFTLD-TDPを比較すると、疫学的、遺伝的、神経画像学的特徴に違いがある(Nelson et al 2019a)。しかしながら、LATE-神経病理学的変化の特定の神経病理学的特徴は、FTLD-TDPタイプAで見られるものに類似している(Aoki er al)。、 2015)。さらに、LATE-神経病理学的変化は8-20%の症例で上側頭皮質と中前頭前野の両方に影響を及ぼすことから、LATE-神経病理学的変化は明確な臨床病理学的実体ではなく、FTLD-TDP病理学の発達における軽度または初期段階を表しているのではないかとの推測を促している(Josephs et al 2016)。FTLD-TDPとLATE-神経病理学的変化の間には、AD-神経病理学的変化とLATE-神経病理学的変化の間、およびタオパチーとパーキンソン病の間にあるように、遺伝的リスクの共有要素がある(Murray et al 2014;Dickson et al 2015;Nelson et al 2016)。神経病理学的観点からは、AD-神経病理学的変化、海馬硬化症、および脳動脈硬化症はすべて、LATE-神経病理学的変化を有する個体において比較的頻度が高い(Amador-Ortiz et al 2007; Neltner et al 2014; Smith et al 2017)。残念ながら、LATE-神経病理学的変化とFTLD-TDPは系統的に比較されていないが、これはFTLD-TDPの症例が多い研究コホートでは「純粋な」LATE-神経病理学的変化症例が不足している可能性があり、またその逆もあるからである。
本研究では、LATE-神経病理学的変化とFTLD-TDPが神経病理学的に鑑別可能かどうかを検証した。ペンシルバニア大学神経変性疾患研究センター(CNDR at UPENN)とケンタッキー大学アルツハイマー病センター(UK-アルツハイマー病C)から症例を入手した。LATE-神経病理学的変化症例とFTLD-TDP症例の大多数が分化した病理学的特徴を有していることを明らかにした。
材料と方法
ケース選択
本研究の全体的なデザインとワークフローを図 1 に示す。本研究では、FTLD-TDP症例と比較するために、病理学的に重篤なLATE-神経病理学的変化症例を選択して評価することを先験的な目標とした。その理由は、LATE-神経病理学的変化とFTLD-TDPの区別に関連して診断上の課題となる可能性が高い症例に焦点を当てるためである。最初にUPENNで診断された症例をUK-アルツハイマー病Cの神経病理医が盲検で評価した。次に、UK-アルツハイマー病Cで診断された症例をUPENNの神経病理医がブラインドで評価した。死亡時の年齢は除外基準には含めなかった。FTDの臨床的特徴としては、FTDの行動変型(bvFTD)は、行動抑制、無気力、共感性の喪失、強迫的行動、および実行機能障害(Rascovsky et al 2007)によってシグナルが示され、脱力と痙縮を特徴とする運動ニューロン疾患の有無にかかわらず起こりうる(Strong et al 2017)。原発性進行性失語症(PPA)は、単語や物体の命名と理解のいずれかの障害(PPAの意味的変種)、または発話の遅発、または文法の困難と無言(非流暢/agrammatic PPA)を伴う言語障害である(Gorno-Tempini et al 2011)。
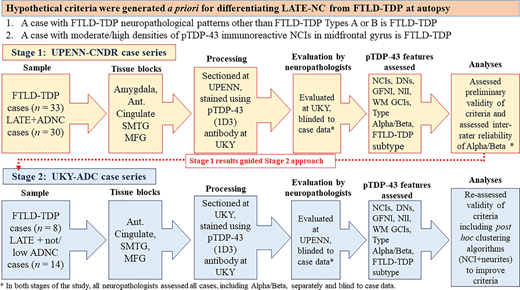
図1
全体的な研究デザイン。症例を採点する前に、LATE-神経病理学的変化とFTLD-TDPを区別するための仮説的な基準を作成した。これらの基準は2つの仮定に基づいていた。(i) FTLD-TDPのC、D、E型を表すと解釈されるTDP-43免疫組織化学染色のパターンはFTLD-TDPを示すものであり、LATE-神経病理学的変化とは一致しない;(ii) TDP-43免疫反応性神経細胞質内包物(神経病理学的変化I)の密度が前頭皮質で中等度または高かった場合は、LATE-神経病理学的変化ではなくFTLD-TDPを示すものであった。次に、2段階の研究デザインを踏襲した。最初のペンシルバニア大学(UPENN)の症例シリーズは、FTLD-TDPが33例、比較的重度のLATE-神経病理学的変化が30例で、大多数はAD-神経病理学的変化を併存していた。研究のために扁桃体、前帯状体、上・中側頭回、中前頭回からパラフィン切片を選択した。切片はケンタッキー大学(UKY)でphospho-TDP-43で染色され、TDP-43病理学は2人のUKY神経病理医によって評価され、LATE-神経病理学的変化またはFTLD-TDPの鑑別診断のためのその場限りの基準を適用した。次に、UKYからの別のコホートを選択し、n = FTLD-TDPを有する8例と比較的重度のLATE-神経病理学的変化を有するn = 14例で構成され、併存するAD-神経病理学的変化を欠いた。これらの切片はUKYでphospho-TDP-43の免疫染色を行い、TDP-43病理は2人のUPENN神経病理医によって評価され、LATE-神経病理学的変化またはFTLD-TDPの鑑別診断に同じアドホック基準を適用した。Ant Cingulate = anterior cingulate; DN = 様々なタイプのTDP-43免疫反応性ジストロフィー性神経突起; GFNI = 顆粒状糸状神経細胞内包物; NII = 神経細胞内核内包物; MFG = 中前頭回; SMTG = 上側頭回および中側頭回; WM GCI = 白質グリア細胞質内包物。
全体的な研究デザイン。症例を採点する前に、LATE-神経病理学的変化とFTLD-TDPを区別するための仮説的な基準を作成した。これらの基準は2つの仮定に基づいていた。(i) FTLD-TDPのC、D、E型を表すと解釈されるTDP-43免疫組織化学染色のパターンはFTLD-TDPを示すものであり、LATE-神経病理学的変化とは一致しない;(ii) TDP-43免疫反応性神経細胞質内包物(神経病理学的変化I)の密度が前頭皮質で中等度または高かった場合は、LATE-神経病理学的変化ではなくFTLD-TDPを示すものであった。次に、2段階の研究デザインを踏襲した。最初のペンシルバニア大学(UPENN)の症例シリーズは、FTLD-TDPが33例、比較的重度のLATE-神経病理学的変化が30例で、大多数はAD-神経病理学的変化を併存していた。研究のために扁桃体、前帯状体、上・中側頭回、中前頭回からパラフィン切片を選択した。切片はケンタッキー大学(UKY)でphospho-TDP-43で染色され、TDP-43病理学は2人のUKY神経病理医によって評価され、LATE-神経病理学的変化またはFTLD-TDPの鑑別診断のためのその場限りの基準を適用した。次に、UKYからの別のコホートを選択し、n = FTLD-TDPを有する8例と比較的重度のLATE-神経病理学的変化を有するn = 14例で構成され、併存するAD-神経病理学的変化を欠いた。これらの切片はUKYでphospho-TDP-43の免疫染色を行い、TDP-43病理は2人のUPENN神経病理医によって評価され、LATE-神経病理学的変化またはFTLD-TDPの鑑別診断に同じアドホック基準を適用した。Ant Cingulate = anterior cingulate; DN = 様々なタイプのTDP-43免疫反応性ジストロフィー性ニューロン;GFNI = 顆粒状糸状ニューロン介在物;NII = ニューロン核内介在物;MFG = 中前頭回;SMTG = 上側頭回および中側頭回;WM GCI = 白質グリア細胞質介在物。
UPENN CNDR脳提供プログラムに参加した患者からFTLD-TDPおよびLATEの一連の症例を集めた(表1)(Mackenzie et al 2011年;Toledo et al 2014年;Lee et al 2017)。FTLD-TDPコホートは、FTLD-TDPの一次神経病理学的診断を受けたCNDRコホートの患者125人のサブセットであった。44人の患者は臨床的前頭側頭型認知症、行動変型(bvFTD)の一次または二次診断を受けていた。このうち35例は、追加の臨床検査[Mini-Mental State Examination (MMSE)および/またはBoston Naming score]を行った特徴のある研究参加者であり、33例は中前頭前皮質、上側頭前皮質、前帯状体および扁桃体の組織が利用可能であった;これら33例が含まれていた。このコホートには、UPENNの神経病理医によって診断されたFTLD-TDPタイプA、B、C、Eが含まれていた(Mackenzie and Rademakers、 2007)。散発的な症例と遺伝的な症例が混在しており、19例はC9orf72、GRN、またはTBK1の変異を有することが知られていた。UPENNからのLATE-神経病理学的変化コホートは、無症状の成人脳、原発性加齢性タオパシー(PART)、アルギロフィル性穀物病、病理学的老化、主に脳血管病理、またはAD-神経病理学的変化の一次神経病理診断を受け、最終的な臨床診断が無障害、認知障害、血管性認知症、またはProbable Alzheimer’s diseaseを含む患者533人のサブセットであった。このコホートから 205人の患者がLATE-神経病理学的変化の神経病理学的診断を受けた。これらの205例の各々は、Josephsら(2016)の病期分類スキームに類似したTDP-43蛋白質障害重症度ステージ(範囲0〜6)およびLATE-神経病理学的変化ステージ(範囲0〜3)を割り当てられた(Nelson et al 2019a)。最高のTDP-43重症度ステージを有し、利用可能な中前頭前皮質、上側頭皮質、前帯状体および扁桃体組織を有する30例のLATE-神経病理学的変化症例を、本研究に含めるために選択した(n = 30)。
表1 UPENN CNDRおよびUK-アルツハイマー病Cによるコホート人口統計
ウペンCNDR
イギリスアルツハイマー病C
FTLD-TDP LATE-神経病理学的変化 FTLD-TDP LATE-神経病理学的変化
n 33 30 8 14
死亡時年齢(平均±SD) 66.6±9.3 88.6±6.4 62.9±9.8 90.9±8.5
最終検査時の臨床診断
記録された障害なし 0 0 2 0
軽度認知障害 0 3 0 0
血管性認知症 0 1 0 2
アルツハイマー型認知症の可能性 2 26 0 12
bvFTD-FTLD 2 0 2 0
bvFTD-FTLD/MND 5 0 2 0
bvFTD-FTLD/PPA 5 0 2 0
遺伝学
C9orf72 拡張 11 0 N/A N/A
GRN バリアント 7 0 N/A N/A
TBK1 バリアント 1 0 N/A N/A
VCP 変異 0 0 0 1 N/A
エフティーエルディーディーティーディーピータイプ
タイプ A または B 23 該当なし 4 該当なし
タイプC 6 該当なし 2 該当なし
タイプ D 0 N/A 1 N/A
タイプ E 4 該当なし 1 該当なし
レイト神経病理学的変化ステージ
ステージ 0 N/A 0 N/A 0
ステージ1 該当なし 0 該当なし 0
ステージ 2 該当なし 2 該当なし 9
ステージ 3 該当なし 28 該当なし 5
中・高 AD-神経病理学的変化b 4 28 0 0 0
bvFTD = 行動変型FTD;MND = 運動ニューロン病;N/A = 評価されていない;PPA = 原発性進行性失語症。
a 臨床診断基準と定義については、「材料と方法」の項を参照のこと。
b NIA-AAの神経病理学的基準によると(66)。
英国アルツハイマー病CのバイオバンクからFTLD-TDPとLATE-神経病理学的変化の別のシリーズを作成した(表1)。FTLD-TDPコホートには、UK-アルツハイマー病Cブレインバンク全体(n = 8)からの非TAU FTD/FTLD症例が含まれていた。注目すべきは、UK-アルツハイマー病C Brain Bankの大多数の症例は、大規模な縦断的追跡調査のために地域社会から募集された(募集時の認知状態が正常である)のに対し、UK-アルツハイマー病Cに含まれるFTLD-TDP症例はすべて、関連する記憶障害診療所から募集されたことである。このFTLD-TDP症例のうち1例はVCP変異(c.464G>A、 p.R155H)を有しており、今回の研究の一環としてジェノタイピングが行われた。UK-アルツハイマー病CのLATE-神経病理学的変化シリーズは、以下の基準を満たすように選択された。(i) 文書化された認知症を有していること(LATE-神経病理学的変化症例と、かなりの疾患負荷を有するFTLD-TDP症例とを比較したかったため)、(ii) National Institute on Aging Alzheimer Association (NIA-AA)のコンセンサス基準(Montine er al)。、 2012)に基づく「中等度」または「重度」のAD-神経病理学的変化を有していないこと、(iii) 新皮質レビー小体病理のような他の重篤な病理を有していないこと、(iv) 最も重篤なTDP-43蛋白症を有していること、である。上記の基準に基づき、脳腫瘍、新皮質レビー小体病、またはまれな(プリオンなどの)脳疾患を有する症例を除外した。UK-アルツハイマー病Cコホートでは、レトロスペクティブにLATE-神経病理学的変化と診断された症例が189例あった。このうち、46例は低/小のAD-神経病理学的変化を有していた。しかし、これら46例の中には、認知症以外の最終的な臨床状態が記録されている症例(n = 21)、実質的なレビー小体病理(n = 12)、および/または他の除外基準(例:脳がん)を満たしている症例もあった。症例のサブセットは、以前に詳述したようにLATE-神経病理学的変化遺伝的リスク対立遺伝子について評価された(Nelson et al 2019c)。今回の研究では、LATE-神経病理学的変化を有するが有意なAD-神経病理学的変化を欠く症例のうち、14例が対象に選ばれたが、そのすべてが認知症の診断を文書化した症例であった。すべてのLATE-神経病理学的変化症例は少なくともLATE-神経病理学的変化ステージ2、すなわち海馬にTDP-43蛋白質障害が認められた(Nelson er al)。、 2019a)。LATE-神経病理学的変化ステージの状態によって層別化された、さらなる解析のために含まれた、および除外された各コホートの症例数については、補足表1を参照のこと。
免疫組織化学
脳組織を10%ホルムアルデヒドで固定し、パラフィンブロックで処理し、切片を8μmの厚さで切断した。phospho-TDP-43(1D3クローン、1:500希釈、EMD Milliporeから購入)の免疫組織化学染色を、以前に記載されたように行った(Smith et al 2017; Gal et al 2018)。
神経病理学的評価
TDP-43プロテインオパシーのサブタイプのスコアは、リン脂質-TDP-43免疫組織化学を用いて診断可能な8つの脳変化のサブタイプについて、4段階の半定量的尺度(0~3の範囲)で割り付けられた。TDP-43の神経病理学的特徴は以下の通りであった。(i)神経細胞質内包物;(ii)神経細胞内核内包物;(iii)グリア細胞質内包物;(iv)顆粒フィラメント性神経細胞質内包物(Lee et al 2017);および(v)血管周囲コンパクト内包物[Lin et al 2009)によって記載されている血管周囲コンパクト内包物]である。TDP-43-免疫反応性ジストロフィーニューライトの様々なタイプを、ローピー型、ロングタイプC型、およびパンク状ジストロフィーニューライトを含めてスコアリングした(図2)。この半定量的な操作の基準は、病理学的なphospho-TDP-43免疫反応性がない=0、倍率40倍の高出力顕微鏡視野(hpf)あたり1-2構造体=1、3-15構造体/hpf=2、15構造体/hpf以上=3とした。また、扁桃体におけるβ型介在物の有無を評価することにより、LATE-神経病理学的変化とFTLD-TDPとの鑑別が改善されるかどうかを評価した。タイプβ介在物の有無は、UPENNからの63例について指摘された(Josephs et al 2019b)。全体的なFTLD-TDPサブタイプは、事前に発表された推奨事項(Cairns et al 2007年;Lee et al 2017年;MackenzieおよびNeumann、2017)に基づいて割り当てられた。簡単に言えば、FTLD-TDPサブタイプは、補足表2に詳細に記載されている形態学的基準を用いて、pTDP-43(1D3クローン)で染色された大脳新皮質切片の検査によって評価された。病理学的評価については、各評価者は、臨床診断、症例に関するその他の情報、およびレビューのためのその他の病理学的データまたはスライドを盲検化した。症例は、匿名化されたスライドラベルを用いてランダム化された順序で分析した。UPENN症例シリーズについては、病理学はP.N.(UK-1)とF.G.(UK-2)によって独立して評価された。UK-アルツハイマー病Cコホートでは、病理学的評価はS.P. (UP-1)とJ.R. (UP-2)が独立して行った。タイプβの割り当ては、F.G.、P.N.、J.R.、S.P.およびE.L.(UP-3)によって行われた。
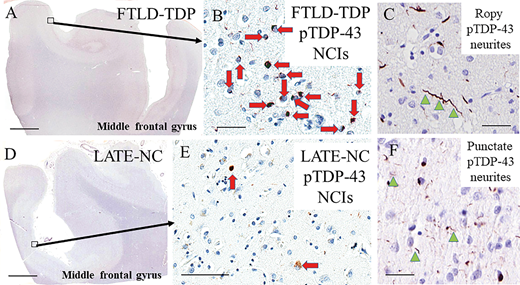
図2 LATE-神経病理学的変化およびFTLD-TDPにおけるTDP-43免疫反応性の特徴を示す代表的な写真。
FTLD-TDPタイプA/B(A-C)およびLATE-神経病理学的変化(D-F)におけるTDP-43神経病理学的特徴は、形態的には類似しているが、重症度によってしばしば異なる。FTLD-TDPタイプAの中前頭回では、神経細胞質内包物(神経病理学的変化I、赤矢印、B)とジストロフィー性神経突起(緑矢印で示すジストロフィー性神経突起、C)が表層の大脳新皮質層に認められる。 スケールバー=3mm(A、D)、50μm(B、C、F)、100μm(E)。
新しいタブで開くスライドを
LATE-神経病理学的変化およびFTLD-TDPにおけるTDP-43免疫反応性の特徴を示す代表的な写真。FTLD-TDPタイプA/B(A-C)およびLATE-神経病理学的変化(D-F)におけるTDP-43神経病理学的特徴は、形態的には類似しているが、重症度によってしばしば異なる。FTLD-TDPタイプAの中前頭回では、神経細胞質内包物(神経病理学的変化I、赤矢印、B)とジストロフィー性神経突起(緑矢印で示すジストロフィー性神経突起、C)が表層の大脳新皮質層に認められる。 スケールバー=AとDで3mm、B、C、Fで50μm、Eで100μm。
表2 UPENNの症例:UK-アルツハイマー病C神経病理医の診断精度
Pathologista UK-アルツハイマー病C盲検診断 UPENN LATE-神経病理学的変化診断 UPENN FTLD-TDP診断 特異性 (%) 感度 (%)
UK-1 LATE-神経病理学的変化 (n = 32) 29 3 91 97
FTLD-TDP (n = 31) 1 30 97 91
UK-2 LATE-神経病理学的変化 (n = 26) 24 2 94 80
FTLD-TDP (n = 37) 6 31 80 94
a
UK-1はアテンディングニューロパソロジスト(P.N.)、UK-2はトレーニング中のニューロパソロジーフェロー(F.G.)である。
統計情報
統計解析には R ソフトウェア 3.3.2 を用いた。FTLD-TDPとLATEの死亡時年齢は、正規性の仮定を確認するためにShapiro-Wilk検定を実行した後、Welchのt-検定を用いて比較した。UK-1データセットとUK-2データセットの間の個々のTDP-43形態に関する評価者の一致度は、加重Cohenのκによって計算された。タイプベータ相関は、標準的な非加重Cohen’s κ(教師なし)により計算した。FTLD-TDPおよびLATE-神経病理学的変化症例のTDP-43病理組織学的重症度スコアをMann-Whitney-Wilcoxon検定で比較し、多重検査を扱うための偽発見率(FDR)補正を導入した場合のP値を決定した。クラスタリング分析は、k = 2、3および4についてk-meansクラスタリング法を用いて行った。すべての統計検定は両側検定とした。統計的有意性は0.05レベルとした。
データの利用可能性
著者らは、本研究の知見を裏付けるデータが論文内、特に補足表で入手可能であることを確認している。
生データはケンタッキー大学とペンシルバニア大学で作成した。データの大部分は上記のように論文に掲載されているが、本研究の知見を裏付ける派生データは、リクエストに応じて対応する著者(P.T.N.)から入手可能である。
研究成果
我々は、LATE-神経病理学的変化がFTLD-TDPと病理学的に区別できるかどうかを、皮質TDP-43介在物の重症度および/またはC-E型病理学の存在によって検証した。また、扁桃体におけるβ型介在物の存在を評価することで、LATE-神経病理学的変化の鑑別が可能かどうかを評価した。これらの仮説を検証するために、FTLD-TDP症例と病理学的に重篤なLATE-神経病理学的変化症例を抽出した(表1)。
UPENN症例シリーズでは、FTLD-TDP症例とLATE-神経病理学的変化症例をグループごとに比較したところ、FTLD-TDP症例とLATE-神経病理学的変化症例では、死亡時年齢と臨床症状が異なっていた。平均死亡年齢は、FTLD-TDP症例(66.6±9.3歳)がLATE-神経病理学的変化症例(88.6±6.4歳)に比べて大幅に低かった。臨床的には、FTLD-TDP群は通常bvFTDを呈していたが、LATE-神経病理学的変化群ではアルツハイマー病と診断される可能性が高かった。AD-神経病理学的変化はFTLD-TDP群では限られており、中等度または高度のAD-神経病理学的変化はまれであった(12%、n=4/33)。しかし、LATE-神経病理学的変化群では、大多数が中等度または高度のAD-神経病理学的変化を有していた(93%、n = 28/30)。遺伝学的には、FTLD-TDP症例の43%が散発性と考えられ(n = 14/33)、既知の病原性対立遺伝子を持つ者の中では、C9orf72拡張とGRN変異キャリアが33%、GRN変異キャリアが21%と、最も一般的な遺伝的関連性を示した。
UPENNからの各症例について、8つのTDP-43病理サブタイプの重症度を扁桃体と3つの皮質領域でスコア化した。これらの病理組織のいくつかの例を図2に示す。スコアは、典型的な神経細胞質介在物(図2BおよびE)、ロピー性ジストロフィー性神経突起(図2C)、パンク状ジストロフィー性神経突起(図2F)、コンパクトな血管周囲介在物(Lin et al 2009)、および白質グリア細胞質介在物の重症度に割り当てられた。特定のFTLD-TDPサブタイプに関連する形態は、タイプC長ジストロフィー性神経突起、タイプD神経核内包物、およびタイプE顆粒フィラメント性神経細胞質内包物を含んでいた(Lee et al 2017)。FTLD-TDPタイプがどのように操作されたかの詳細な記述については、補足表2を参照のこと。最後に、扁桃体におけるβ型介在物の有無(Josephs et al 2019b)を各症例について記載した。
UPENN症例を評価するために、2人のUK-アルツハイマー病C神経病理医が、各症例の元の神経病理診断および人口統計学的診断を盲検化して、各症例にLATE-神経病理学的変化またはFTLD-TDPのいずれかの病理診断を独立して割り当てた(表2)。これらの神経病理医が利用できるのは、TDP-43免疫染色スライド4枚のみであった。しかし、両神経病理医の診断精度は、先行診断を予測するという点では、かなり高いものであった。特異性はLATE-神経病理学的変化が91-94%、FTLD-TDPが80-97%であった。LATE-神経病理学的変化とFTLD-TDPの感度はそれぞれ80-97%、91-94%と同様に高かった。
神経病理学的なTDP-43特徴のどのサブセットがLATE-神経病理学的変化とFTLD-TDPを最もよく区別するかを理解するために、スコアリングされたTDP-43蛋白症サブタイプのいずれかが神経病理医間で確実に診断されているかどうかを尋ねた。FTLD-TDPは稀な神経変性疾患であり(Knopman and Roberts、 2011; Coyle-Gilchristら、 2016)、ここで評価した病理学的形態の多く、特にタイプ特異的な形態は、ほとんどの実践神経病理医が観察することはほとんどない。さらに、各神経病理医の経験は、各形態の重症度の評価に影響を与える可能性がある。ここでは、UK-アルツハイマー病Cの神経病理医のうち1人はアテンディング神経病理医(P.N.)であり、もう1人は研修中の神経病理フェロー(F.G.)であった。加重コーエンのκテストでは、各形態について2人のUK-アルツハイマー病C神経病理医のスコアの一致度を測定した。ロピージストロフィー性神経突起が最も信頼性の高いスコア(0.77)であり、次いで顆粒状フィラメント性神経細胞質内包物(0.69)、タイプCジストロフィー性神経突起(0.65)、典型的な神経細胞質内包物(0.64)となった。神経病理医間では、グリア細胞質介在物(0.49)、穿孔性ジストロフィー性ニューライト(0.45)、ニューロン核内介在物(0.36)、血管周囲コンパクト介在物(0.19)のスコアが低かった(補足表3)。我々は、信頼性を評価するために、有無の基準ではなく、比較的保守的なアプローチを用いたことを強調している(例えば、スコアが2および3の場合は不一致とみなされる)。これらの結果は、UK-アルツハイマー病Cの症例をUPENNで評価し、神経細胞質内包物とローピー性ジストロフィー性神経突起に焦点を当てた研究の第二段階を支持するものであった。
表3 FTLD-TDPタイプA/B対LATE-神経病理学的変化の病理学的重症度の違い
TDP-43病理学的特徴 FTLD-TDP型A/B症例のみ対LATE-神経病理学的変化病理学的特徴による比較。P値
扁桃体 前帯状体 上側頭中前頭部
ロピーDN 0.17 <0.001 <0.001 <0.001
神経病理学的変化I 0.57 <0.001 <0.001 <0.001
WM GCI 0.001 <0.001 <0.001 <0.001
Punctate DN 0.03 <0.001 0.003 <0.001
NII 0.05 <0.001 <0.001 <0.001
コンパクトPV 0.16 0.17 0.45 0.04
LATE-神経病理学的変化 症例(n = 30)と FTLD-TDP Type A/B 症例(n = 24)の比較のための Mann-Whitney-Wilcoxon 検定の P 値、すなわち FTLD-TDP Type C-E 症例はこの解析では除外された。UK-アルツハイマー病Cの神経病理医によるUPENN症例の結果を示す。コンパクトPV = Linら(2009)に記載されたコンパクトな血管周囲病変。DN = さまざまなタイプのTDP-43免疫反応性ジストロフィー性神経突起;神経病理学的変化I = 神経細胞質内包物;NII = 神経細胞内包物;WM GCI = 白質グリア細胞質内包物。
以前に定義されたように(Josephs et al 2019b)、β型の形態学は扁桃体の病理学の有無として評価された。我々の先験的仮説では、ベータ型はLATE-神経病理学的変化症例の約50%で診断され、FTLD-TDP症例では診断されないというものであった(Josephs er al)。、 2019b)。代わりに、タイプβは、LATE-神経病理学的変化症例の50〜80%、およびFTLD-TDP症例の18〜33%で変動的に記録された(補足表4)。その後、同じスライドをUPENNの3人の追加研究者によってブラインドで評価した。ベータ型は、LATE-神経病理学的変化の30~67%、FTLD-TDPの6~19%で再び変動的に観察された。全体的にκは-0.02~0.59の範囲であり、研究者間の一致度は低かった(補足表5)。アドホックなコンセンサスの基準(5 人中 3 人以上の評価者が同意した)を適用すると、LATE-神経病理学的変化 症例の 57%、FTLD-TDP 症例の 12%に Beta 型が認められた。このことから、LATE-神経病理学的変化とFTLD-TDPではBeta型が濃縮されているように見えるが、Cohen’s κが低いため、信頼性の低い指標とは言えないと結論づけた。
表 4 UK-アルツハイマー病Cの症例:UPENN神経病理医の診断精度
オブザーバー UPENN 盲検診断 UK-アルツハイマー病C LATE-神経病理学的変化 診断 UK-アルツハイマー病C FTLD-TDP 診断 特異性 (%) 感度 (%)
UP-1 LATE-神経病理学的変化(n = 14) 13 1 88 93
FTLD-TDP (n = 8) 1 7 93 88
UP-2 LATE-神経病理学的変化 (n = 12) 11 1 88 79
FTLD-TDP (n = 10) 3 7 79 88
この表の被験者の中には、中等度または高度のアルツハイマー病の神経病理学的変化を有する者はおらず、全員が認知症を有していた。
特定のTDP-43病理学的特徴がFTLD-TDPとLATE-神経病理学的変化を区別しているかどうかを理解するために、脳領域別の平均病理学的重症度スコアを調べた(図3)。TDP-43プロテインオパシーのサブタイプに関連する主要な症例レベルのデータを補足表6に示す。我々は、海馬形成(コルヌアンモニス、小群、および内葉皮質)上のp-TDP-43免疫組織化学染色を追加で実施し、これらのデータを補足表7に報告する。FTLD-TDP群とLATE-神経病理学的変化群の両方で扁桃体の病理学的負担が類似していたが(サンプルは重度のLATE-神経病理学的変化に非常に濃縮されていた)、皮質の病理学的負担はFTLD-TDP群の方がLATE-神経病理学的変化群よりも典型的に重度であった。FTLD-TDPでは、中等度から重度の神経細胞質内包物およびロピー性ジストロフィー性神経突起が皮質領域で観察されたが、LATE-神経病理学的変化ではこれらはほとんどが稀であり、軽度であった。FTLD-TDPでは、神経細胞質内包物やローピー性ジストロフィー性神経突起に加え、白質グリア細胞質内包物、パンク状ジストロフィー性神経突起、神経核内包物もLATE-神経病理学的変化に比べて前帯状突起と中前頭前野で重症化していた(P値≦0.0001)。FTLD-TDPのE型顆粒糸状神経細胞質介在物とFTLD-TDPのC型ジストロフィー性神経突起は少数の症例でしか認められず、LATE-神経病理学的変化では皮質領域ではほとんど認められなかった。コンパクトな血管周囲介在物はすべての領域でばらつきがあり、扁桃体のみでFTLD-TDPとLATE-神経病理学的変化の間に差があった(P値<0.05)が、サンプルサイズが控えめであることに関連した注意点がある。
図3 LATE-神経病理学的変化またはFTLDの診断で層別化した脳領域別のTDP-43蛋白病理学的特徴のスコア。
皮質病理は、FTLD-TDP(赤)ではLATE-神経病理学的変化症例(緑)に比べてより重篤である。TDP-43病理は、症例および領域ごとに個々の形態について個別にスコアリングした。扁桃体におけるTDP-43病理学の負担は、重度のLATE-神経病理学的変化症例とFTLD-TDP症例の間で類似しており、典型的には神経細胞質内包物(神経病理学的変化I)、ロピージストロフィックニューライト(DN)、パンク状ジストロフィックニューライトの存在を特徴としていた。LATE-神経病理学的変化では前帯状回、上側頭葉、中側頭葉、中前頭葉の皮質病理がより限定的であった。FTLD-TDPでは、中等度から重度の神経細胞質内包物とロピー性ジストロフィー性神経突起が認められたが、これらはLATE-神経病理学的変化では軽度から稀であった。ボックスプロットとウィスカープロットは中央値(実線)を示し、ウィスカーは上下の四分位外の変動を示す(2人の神経病理医、UK-1とUK-2からのデータセットの平均)。*P < 0.05、 **P < 0.01、 ***P < 0.001、 ****P < 0.0001 Mann-Whitney-Wilcoxon 分析。DN=様々なタイプのTDP-43免疫反応性ジストロフィー性神経突起(FTLD type C(Type C DN)に特徴的なDN、ローピーDN、パンク状DNを含む)、GFNI=顆粒糸状神経細胞内包物、NII=神経細胞内包物、PV=血管周囲TDP-43蛋白質症、WM GCI=白質グリア細胞質内包物を含む)。
新しいタブで開くスライドを
LATE-神経病理学的変化またはFTLDの診断で層別化した脳領域別のTDP-43蛋白病理学的特徴のスコア。皮質病理は、FTLD-TDP(赤)ではLATE-神経病理学的変化症例(緑)に比べてより重篤である。TDP-43病理は、症例および領域ごとに個々の形態について個別にスコアリングした。扁桃体におけるTDP-43病理学の負担は、重度のLATE-神経病理学的変化症例とFTLD-TDP症例の間で類似しており、典型的には神経細胞質内包物(神経病理学的変化I)、ロピージストロフィックニューライト(DN)、パンク状ジストロフィックニューライトの存在を特徴としていた。LATE-神経病理学的変化では前帯状回、上側頭葉、中側頭葉、中前頭葉の皮質病理がより限定的であった。FTLD-TDPでは、中等度から重度の神経細胞質内包物とロピー性ジストロフィー性神経突起が認められたが、これらはLATE-神経病理学的変化では軽度から稀であった。ボックスプロットとウィスカープロットは中央値(実線)を示し、ウィスカーは上下の四分位外の変動を示す(2人の神経病理医、UK-1とUK-2からのデータセットの平均)。*P < 0.05、 **P < 0.01、 ***P < 0.001、 ****P < 0.0001 Mann-Whitney-Wilcoxon 分析。DN=様々なタイプのTDP-43免疫反応性ジストロフィー性神経突起(FTLD type C(Type C DN)に特徴的なDN、ローピーDNおよびパンクテートDNを含む);GFNI=顆粒繊毛状神経細胞内包物;NII=神経細胞内核内包物;PV=血管周囲TDP-43蛋白質症;WM GCI=白質グリア細胞質内包物。
我々のデータが病理学的特徴の異なるクラスタの存在を支持することを確認するために、4つの異なる脳領域にまたがるTDP-43蛋白質障害の特徴の8つのサブタイプすべてを用いて、k = 2、3、4について教師なしのk-meansクラスタ分析を行った(補足表8および9)。k = 2の場合、1つのクラスターのLATE-神経病理学的変化の精度は79%であり、もう1つのクラスターのFTLD-TDPの精度は83%であった。k = 3では、1つのクラスターはLATE-神経病理学的変化の精度が79%であり、他の2つのクラスターは主にFTLD-TDPの症例であった:精度83%の大クラスターと、FTLD-TDPの精度100%のn = 7の小クラスターであり、これらのクラスターにはE型の症例もすべて含まれていた。k = 4では、より精度の高いLATE-神経病理学的変化クラスターが97%の精度で定義され、これがLATE-神経病理学的変化症例の大部分を占めていた。残りのクラスターは主にFTLD-TDPの症例であった:精度83%の大クラスター、FTLD-TDPの精度100%でタイプEの症例を含むn = 7の小クラスター、FTLD-TDPの精度100%でタイプCの症例を含むn = 6の小クラスターである。先験的には、FTLD-TDPタイプC-Eの神経病理学的パターンはFTLD-TDPの症例でのみ見られるが、LATE-神経病理学的変化では見られないというのが我々の仮説であった。k = 4 のクラスタリング解析により、FTLD-TDP タイプ C、タイプ E、タイプ A/B、LATE-神経病理学的変化 の病理学的グループが高い特異性をもって存在することが裏付けられた。
FTLD-TDPタイプC-Eの存在は、FTLD-TDPとLATE-神経病理学的変化の明確な鑑別を可能にする病理学的特徴を定義しているので、次に、FTLD-TDPタイプA/BとLATE-神経病理学的変化を区別する地域的形態を尋ねた。Mann-Whitney-Wilcoxon解析の結果、FTLD-TDPタイプA/Bでは、LATE-神経病理学的変化よりも前帯状皮質、上側頭葉、中前頭葉の神経細胞質内包物とロピー性ジストロフィー性神経突起が重度であることが明らかになった(P値<0.001、表3)。LATE-神経病理学的変化をすべてのFTLD-TDPタイプA~Eと比較した場合も、予想通り同様の結果が得られた(補足表10)。これらの同じ領域では、軽度から中等度のパンク状ジストロフィー性神経突起、軽度の神経核内包物、および軽度の白質グリア細胞質内包物の負担もまた、FTLD-TDPとLATE-神経病理学的変化の症例を比較して異なっていた(P値<0.01)。我々は、中等度から重度の神経細胞質内包物および複数の皮質領域におけるローピー性ジストロフィー性神経突起の存在が、FTLD-TDPタイプA/Bと重度のLATE-神経病理学的変化を確実に区別するのに十分な基準であると結論づけた。
FTLD-TDPタイプのC-E病理の存在、または中等度から重度の皮質病理の負担のいずれかがFTLD-TDPとLATE-神経病理学的変化を区別するという仮説を検証するために、我々はUK-アルツハイマー病Cバイオバンクから追加の症例シリーズを作成した(表1)。先験的な目標は、重度のLATE-神経病理学的変化とFTLD-TDPの診断上のジレンマとなりうるすべての症例をこのバイオバンクから含めることであった。また、実質的なAD-神経病理学的変化を伴わずにTDP-43蛋白症が発生した症例を評価したいと考えた。これらの目的を達成するために、TDP-43蛋白質障害が著明で、臨床的に認知症が認められるが、中等度または重度のAD-神経病理学的変化が認められないLATE-神経病理学的変化の症例を便宜的にサンプルとした。FTLD-TDPコホートには、UK-アルツハイマー病Cバイオバンク全体のFTLD-TDP症例(n = 8)が含まれていた。これらの症例はすべてケンタッキー大学付属の認知症診療所からUK-アルツハイマー病Cに紹介されたもので、ほとんどが臨床的にbvFTDを呈し、死亡時の平均年齢は62.9歳(±9.8歳標準偏差、SD)であった。対照的に、LATE-神経病理学的変化群は地域に根ざしたコホートであり、ほとんどが臨床的にアルツハイマー病の可能性が高いと診断され、死亡時の平均年齢は90.9歳±8.5歳SDであった。UPENNと同様に、FTLD-TDPとLATE-神経病理学的変化の年齢幅の重複は最小限であった(補足図1)。
UPENNのデータセットの中でケンタッキー大学(UK-1)の評価者によって誤診された4例のうち、FTLD-TDPがLATE-神経病理学的変化と呼ばれていたのは3例であり、1例はその逆であった。特筆すべきは、LATE-神経病理学的変化と誤診されたFTLD-TDP症例はそれぞれ遺伝子変異を有していたことである。2例はC9orf72拡大陽性、1例はGRN変異を有していた。このことは、遺伝子解析が誤診の数を減らすのに役立つことを示している;さらに、C9orf72症例はp62免疫組織化学染色を加えることで正確に診断できる(Mackenzie et al 2014)。誤診された4例のすべては、5人の読者のコンセンサスによるとα型としてスコア化された(補足表7)が、将来的にα/β評価を統合することで、困難な症例に役立つ可能性があることを示唆しているかもしれない。海馬形成リン酸化TDP-43免疫組織化学染色の結果が、誤診例の数が4例にとどまったことに注意を払いつつ、追加的に有用な情報を提供したという証拠は見出されなかった(補足表7)。
UK-アルツハイマー病Cコホートの脳組織を切除して染色した後、2人の独立したUPENN研究者が、各症例の人口統計学やその他の情報を盲検化し、単純なアドホック基準(表4)を用いて、各症例にLATE-神経病理学的変化またはFTLD-TDPの病理学的診断を割り当てた。この解析では、前帯状皮質、側頭葉、中前頭前野のスライドのみを解析した。すべてのFTLD-TDPタイプC、D、Eの症例をFTLD-TDPと診断した後、中等度の神経細胞質内包物とロピー性ジストロフィー性神経突起のスコアを有する残りの症例をFTLD-TDPと診断した。UPENNの読者がUK-アルツハイマー病Cコホートの症例について行ったこれらの診断基準は非常に正確であった。LATE-神経病理学的変化の特異度は88-93%、FTLD-TDPの特異度は79-88%であった。LATE-神経病理学的変化とFTLD-TDPの診断感度はそれぞれ88-93%と88%と同様に高かった。
表2および表4に示されたLATE-神経病理学的変化を正しく診断するための推定感度に基づいて、我々は、我々のそれぞれの脳バンクでLATE-神経病理学的変化であったすべての症例を含めることが結果にどのような影響を与えるかを検討した。FTLD-TDPの診断には中等度から高度の側頭回におけるTDP-43蛋白症が必要であり、また、ステージ1およびステージ2のLATE-神経病理学的変化には中側頭回にTDP-43が存在しないことから、ステージ1およびステージ2の症例がFLTD-TDPとして誤分類されることはないと仮定した。除外された症例と同程度の感度であると仮定した場合、LATE-神経病理学的変化とFLTD-TDPを識別するための感度はUK-アルツハイマー病CとUPENNの両方で99%であった。このように、ステージ1またはステージ2のLATE-神経病理学的変化の症例数がステージ3に比べてかなり多いことから、LATE-神経病理学的変化とFTLD-TDPを識別する感度は上昇するであろう。
前頭皮質のTDP-43蛋白症で染色された189例のUK-アルツハイマー病Cのうち、79例の脳は病理学的TDP-43免疫反応を有し、TDP-43蛋白症を有する46例の脳は重度のAD-神経病理学的変化を欠いていた。これらの46のTDP[+]AD-神経病理学的変化[-]個体のうち、1例は実質的なTDP-43プロテインオパチーを示し、UPENNの両読者によってFTLD-TDPと診断された。この症例の詳細を図4に示す。臨床病歴には、臨床的なFTD-言語障害(率直な進行性失語症ではないが)、抑制、食欲障害との「重複」を示唆する特徴があったことに注意が必要である。それでも、死亡前の全体的な臨床像はアルツハイマー病性認知症の可能性が高いと考えられた。この個体に関連する放射線画像や遺伝学的な結果を含むその他の所見は、図4とその凡例に記載されている。この少数例(UK-アルツハイマー病Cコホートでは全例の1%、LATE-神経病理学的変化例の2.5%)は、LATE-神経病理学的変化とFTLD-TDPの特徴が重複していることを示している。
図4 LATE-神経病理学的変化と推定された研究対象者の詳細情報。
臨床病理学的特徴としては、アルツハイマー病とFTDに関連した徴候や症状、FTLD-TDPタイプAに類似した神経病理学的特徴を有していた。全体的な臨床像はアルツハイマー病と一致していたが、FTD様症状(食欲抑制や言語障害を含む)が特に晩年の5年間に認められた(補足表11)。MCIと診断された90歳時のCTスキャン(B)では、前頭部および側頭部の萎縮が認められた。遺伝学的所見では、APOE対立遺伝子の状態はε2/ε3、TMEM106Bリスク対立遺伝子ホモ接合体(rs1990622 status TT)、ABCC9リスク対立遺伝子ホモ接合体(rs704180 status AA)、非リスクGRN対立遺伝子ホモ接合体(rs5848 status CC)であった。剖検時の神経病理学(C)では、中程度の数の神経細胞質内包物(赤矢印)とジストロフィー性神経突起が中前頭回を含む複数の皮質領域にわたって認められた。スケールバー=50μm。海馬硬化症病理も認められたが、脳アミロイド-βは実質的に認められなかった(図示せず)。特筆すべきは、この地域密着型コホートの症例の4分の1がLATE-神経病理学的変化を有していたが、重度のAD-神経病理学的変化を欠いていたのに対し、TDP-43病理学を有するUK-アルツハイマー病C症例のうち、中等度の重度の前頭前野TDP-43蛋白症を有していたのは2/79例のみであったことである(D)。
新しいタブで開くスライドを
LATE-神経病理学的変化と推定された研究対象者の詳細情報。臨床病理学的特徴としては、アルツハイマー病とFTDに関連した徴候や症状、FTLD-TDPタイプAに類似した神経病理学的特徴を有していた。全体的な臨床像はアルツハイマー病と一致していたが、FTD様症状(食欲抑制や言語障害を含む)が特に晩年の5年間に認められた(補足表11)。MCIと診断された90歳時のCTスキャン(B)では、前頭部および側頭部の萎縮が認められた。遺伝学的所見では、APOE対立遺伝子の状態はε2/ε3、TMEM106Bリスク対立遺伝子ホモ接合体(rs1990622 status TT)、ABCC9リスク対立遺伝子ホモ接合体(rs704180 status AA)、非リスクGRN対立遺伝子ホモ接合体(rs5848 status CC)であった。剖検時の神経病理学(C)では、中程度の数の神経細胞質内包物(赤矢印)とジストロフィー性神経突起が中前頭回を含む複数の皮質領域にわたって認められた。スケールバー=50μm。海馬硬化症病理も認められたが、脳アミロイド-βは実質的に認められなかった(図示せず)。特筆すべきは、このコミュニティベースのコホートからの症例の4分の1がLATE-神経病理学的変化を持っていたが、重度のAD-神経病理学的変化を欠いていたのに対し、TDP-43病理学を持つUK-アルツハイマー病Cの症例の2/79のみが中等度の重度の前頭皮質TDP-43蛋白質障害を持っていたことである(D)。
考察
TDP-43蛋白質障害は、FTLD-TDPと重症LATE-神経病理学的変化の病理学的特徴を比較するために、複数の神経病理医によって盲検的に評価された。2つの施設の神経病理医が、FTLD-TDPを有する症例、AD-神経病理学的変化を併存する重症LATE-神経病理学的変化、AD-神経病理学的変化を欠く重症LATE-神経病理学的変化を含む300以上のスライドをそれぞれ評価した。UPENN CNDRコホート(認知症診療所ベースのサンプル)では、FTLD-TDPの所見を重度のLATE-神経病理学的変化とAD-神経病理学的変化を併存する症例と比較した。UK-アルツハイマー病Cコホートでは、FTLD-TDPと重度のLATE-神経病理学的変化および併存するAD-神経病理学的変化を欠く症例を比較した。UK-アルツハイマー病CのLATE-神経病理学的変化症例は、地域に根ざした剖検コホートから募集され、ほとんどの症例は正常な認知状態のベースラインから追跡された。その結果、LATE-神経病理学的変化とFTLD-TDPの神経病理学的特徴は同一ではなく、FTLD-TDPの大脳皮質領域におけるTDP-43蛋白症の密度は、重度のLATE-神経病理学的変化症例(AD-神経病理学的変化の併存の有無にかかわらず)よりもFTLD-TDP症例の方が重度であった。我々は、FTLD-TDPとLATE-神経病理学的変化を90%程度の信頼度で区別できる基準を作成した。しかし、一部の被験者では、LATE型の臨床症状とFTD/FTLDを区別できない病理学的特徴を有していることもわかった。扁桃体TDP-43蛋白症を有する症例を評価する際に、Alpha/Betaスキーマを適用する際の神経病理医間の評価者間の信頼性が低いことがわかった。
加齢性TDP-43プロテインオパシーは、動きが早く、論争の的になっている研究分野である(Josephs et al 2019a; Nelson et al 2019b)。治療戦略の領域で成功を収めることができれば、疾患実体を鑑別するための有用な基準を持つことが、より一層重要になるかもしれない。神経病理学は、神経変性疾患の存在および重症度を決定するためのゴールドスタンダードと考えられている(Jack et al 2018)。一般的な病理医の間では、少なくともいくつかの臨床情報を考慮して剖検が行われている。しかし、近年、神経変性疾患の病理学的研究の分野では、臨床情報の統合を必要としない神経病理学的診断のための基準を作成することに重点が置かれている(Jack et al 2018)。このアプローチの利点は、疾患(病理学的特徴によって定義される)が進行期に存在していることを認めることである。疾患の存在と重症度の識別を操作可能にするための特定の基準を適用することで、臨床と病理学的な相関関係についても検証可能な仮説を提示することができる。
本研究の主な方法論的特徴は、両機関の複数の神経病理医と研究者がそれぞれのスライドをブラインドで独立してレビューするという、比較的オープンエンドな研究デザインであることである。すべての神経病理医は、症例の臨床的特徴についての情報を得ることなく、限られたサブサンプルのスライドのみをレビューすることができた。これらのスライドは以前に診断されていたものであり、私たちが問題としたのは、FTLD-TDPと重症のLATE-神経病理学的変化を区別できるかどうかということであった。FTLD-TDPとLATE-神経病理学的変化の所見が広範囲に重複している場合は、その旨を報告した。均一性のために、TDP-43の免疫組織化学染色は、TDP-43のphospho-Ser409/Ser410残基を認識する1D3抗体を用いて行った(Neumann et al 2009)。これは、ほとんどの(約3分の2の)アメリカのアルツハイマー病研究センターがTDP-43免疫組織化学的評価に使用している試薬である(Katsumata et al 2018)。
LATE-神経病理学的変化とFTLD-TDPとの間の臨床的および病理学的境界は、LATE-神経病理学的変化に関するコンセンサスワーキンググループの報告書で議論されたように、完全には定義されていない(Nelson er al)。 しかしながら、LATE-神経病理学的変化の病理組織学がFTLD-TDPのA型に見られるものに類似していることが以前に示されていた(Aoki er al)。、 2015)。LATE-神経病理学的変化とFTLD-TDPの間の共通性の議論には、剖検で証明されたLATE-神経病理学的変化を有する症例における前頭および側頭の萎縮の神経画像学的所見が含まれ、FTLD-TDP症例よりも全体的に劇的な萎縮は少ないが、依然として同じ領域に存在する(Kotrotsou er al)。、 2015; Nelson er al)。、 2019a)。また、神経変性疾患の遺伝的危険因子はプリーオトロピックな傾向があり、LATE-神経病理学的変化とFTLD-TDPの遺伝的危険因子は同一ではないが、遺伝的危険因子の点では重複する領域がある(Chornenkyy et al 2019)。
本研究では、リン酸化TDP-43を免疫染色した脳切片の数枚のスライドの評価に基づいて、大多数のLATE-神経病理学的変化症例をFTLD-TDP症例と確実に鑑別することができた。我々は簡単な診断基準を作成し、適用した。LATE-神経病理学的変化では、前帯状皮質および前頭前野中皮質領域において、TDP-43免疫反応性ニューロンの細胞質内包物の密度が低く、ローピー性ジストロフィー性ニューロンの密度が高かった。我々の試験例では、この基準を用いた診断の正答率は約90%であったが、もし我々がLATE-神経病理学的変化の症例を盲目的に選択していたならば、この数字はもっと高かったであろう。これは重要なポイントである:UK-アルツハイマー病CおよびUPENNコホートでは、LATE-神経病理学的変化症例の95%以上は、おそらく我々の基準を用いてFTLD-TDPと鑑別されるであろう。FTLD-TDPとLATE-神経病理学的変化の最大の相違点は、疫学と臨床的特徴である。LATE-神経病理学的変化の方がはるかに一般的であり、(本研究で強調されているように)高齢者に影響を与え、臨床転帰も異なる(Nelson er al)。
FTLD-TDPにおけるTDP-43病理学的な新皮質関与はLATE-神経病理学的変化よりも有意に高かったが、いくつかの個体(1つの例外的な症例を詳細に図4に示す)は、アルツハイマー病性認知症の後期発症の臨床的特徴を有していたが、FTLD-TDPに類似した病理学的特徴を有していた。これらの症例では、大脳新皮質にTDP-43の神経細胞質内包物が相当量存在していた。他の神経病理学的実体の境界領域にも同様の症例が存在するため、個々の神経病理学者によって正しい診断の仕方が異なることに注意が必要である。例えば、慢性外傷性脳症、他のタオパチー、および他の疾患カテゴリーでは、改善された診断ツールおよび基準が存在するにもかかわらず、異常な症例は診断上の課題を構成し得る(Schneider et al 1997年;若林および高橋、2004年;Boeve et al 2013年;Kovacs et al 2018年;Forrest et al 2019年;Iverson et al 2019年;Malek-Ahmadi et al 2019)。FTLD-TDPおよびLATE-神経病理学的変化が、AD-神経病理学的変化の若年性/希少性および高齢性/一般的なオンセットバージョンに類似した、ユニット化された連続体を真に表していることは、まだ理論的に可能である。しかし、アルツハイマー病とは異なり、高齢者に影響を及ぼす病態(LATE-神経病理学的変化)は、通常、異なる臨床表現型とより明確な病理学的分布を有することは注目すべきことである。
2つの病態が高齢脳で頻繁に共起するため、相乗的なメカニズムがAD-神経病理学的変化とLATE-神経病理学的変化の両方に影響を与えるように見える(Josephs et al 2008、2019a; Nag et al 2017; Smith et al 2017)。しかし、この傾向は批判的に評価する必要がある。一部のAD-神経病理学的変化は、すべての高齢者の脳(LATE-神経病理学的変化または臨床的認知症の有無にかかわらず)の約80%で検出可能である(Braak et al 2011)ので、LATE-神経病理学的変化を伴うAD-神経病理学的変化の共通所見は、その文脈で判断する必要がある:病理学的特徴が互いに独立していたとしても、LATE-神経病理学的変化を有する個体の80%は、併存するAD-神経病理学的変化を有するであろう。さらに、重度のAD-神経病理学的変化を有する高齢者の多くはLATE-神経病理学的変化を有しておらず、AD-神経病理学的変化が必然的にLATE-神経病理学的変化につながるわけではないことを示している。逆に、本研究や他の場所(Nelson et al 2011;Nag et al 2015)で示されているように、LATE-神経病理学的変化は共存するAD-神経病理学的変化がない場合にしばしば起こる。AD-神経病理学的変化の文脈でのTDP-43プロテインオパシーは、扁桃体のレビー小体病理に類似した、単に「追加された」病理であることが示唆されている(Josephs et al 2019a)。しかしながら、LATE-神経病理学的変化を伴うAD-神経病理学的変化はLATE-神経病理学的変化を伴わないAD-神経病理学的変化よりも重篤な臨床表現型を有するので、併存AD-神経病理学的変化を伴う症例におけるLATE-神経病理学的変化の存在は依然として診断上の注意に非常に価値がある(Nelson er al)。、 2010; Robinson er al)。、 2013)。最近の画像化研究はまた、AD-神経病理学的変化およびco-morbid LATE-神経病理学的変化を有する脳は、AD-神経病理学的変化単独を有する脳よりも萎縮した海馬を有することを示唆している(Dawe er al)。、 2011; Josephs er al)。、 2017; Sahoo er al)。、 2018; Bejanin er al)。、 2019; Nelson er al)。、 2019a)。ここで、重要なことに、我々は、FTLD-TDPとLATE-神経病理学的変化の鑑別において、併存AD-神経病理学的変化の有無にかかわらず、同様の精度を見出した。
我々はまた、TDP-43プロテインオパシーのαおよびβパターンによる症例の層別化が診断的に有用であるという知見を再現することを試みた(Josephs et al 2019b)。発表された診断基準を、一緒に議論した上で適用することを試みた。5人の異なる研究者が同じ症例のパネルを判定した。アルファ型とベータ型を区別するための診断的相互評価者の信頼性は低かった(補足表3)。また、これらの診断的手がかりはUPENNサンプルにおけるLATE-神経病理学的変化とFTLD-TDPの鑑別にもあまり役に立たなかった。LATE-神経病理学的変化では57%、FTLD-TDPでは12%でβ型の形態がコンセンサスで記述されていたが、今回の研究ではその診断は実用性に欠けていた。LATE-神経病理学的変化のα型およびβ型の診断基準は、将来的には、診断基準の前提条件である評価者間の信頼性を向上させるために研ぎ澄まされる可能性がある。
この研究には限界と潜在的な交絡因子があった。例えば、ヒトの脳における併存疾患の有無は年齢によって異なり、また、研究ボランティアを募集する際に適用される基準によっても変化する傾向がある。さらに、FTLD-TDPの生涯リスクは∼1:1000である(Knopman and Roberts、 2011; Coyle-Gilchristら、 2016; Nelsonら、 2019a)が、FTLD-TDPは、認知症診療所または病院から引き出された剖検コホートにおいて高度に濃縮されている可能性がある。対照的に、併存AD-神経病理学的変化を欠く症例を含むLATE-神経病理学的変化は、コミュニティベースのコホートではより一般的である(Keage et al 2014;Nag et al 2017、2018)。ここでは、2つの機関から派生した被験者を、1つのクリニックベースのコホートを代表して、主にコミュニティベースのサンプルであった第2のコホートを含めた。しかし、これらのコホートはいずれも民族的に多様ではなく、より人口を代表するサンプルではより多くの研究が必要である。
さらに、これらの便宜的なサンプルには症例選択のバイアスがあった。研究デザインはFTLD-TDPと重度のLATE-神経病理学的変化を比較するように偏っていた。なぜならば、初期または中等度の重度のLATE-神経病理学的変化と推定される症例の大多数が除外されたからである。対照的に、神経病理学的特徴が重複している可能性が高く、新皮質TDP-43病理学的特徴を有し、率直な認知症を有する症例が優先的に含まれた。FTLD-TDPの初期および軽度認知障害(MCI)期の神経病理学的特徴をLATE-神経病理学的変化とどのように比較するかは未解決の問題である。残念ながら、これを評価するのに十分な症例がなかった。我々は、FTLD-TDPとLATE-神経病理学的変化を区別するための予備的な基準を提供することができたが、それは、臨床症状、発症年齢、遺伝情報を予知することなく、比較的重度の大脳新皮質TDP-43病理に富むLATE-神経病理学的変化脳であっても同様であった。将来の基準は、遺伝学的データを統合することによって、さらに、非リン酸化TDP-43蛋白症や他の脳領域の病理学的病変などの他の情報を統合することによって、より具体的なものになる可能性がある(Hunter et al 2020)。
LATE-神経病理学的変化におけるTDP-43プロテインオパシーの傾向は顕著であるが、AD-神経病理学的変化を併存していない高齢者であっても、前頭および帯状皮質の病変が重度のレベルにまで進行しない。アミロイドβプラークが存在しない場合には、タウのもつれの解剖学的進行はBraak神経原線維性もつれステージIVを超えて進行しないというPARTとの平行性があると推測したくなる(Nelson et al 2009; Crary et al 2014)。LATE-神経病理学的変化およびFTLD-TDPで観察された現象は、FTLD-TDPではLATE-神経病理学的変化に欠けている相加的な病原性メカニズムまたは因子が存在することを示している可能性がある。より一般的には、LATE-神経病理学的変化での観察結果は、個々の神経変性疾患は時間の経過とともに臨床的・病理学的に異なる進行経路をたどる傾向があり、必ずしも同じ疾患を定義する臨床的・病理学的終末点を持つわけではないことを強調している。
