Pathology and hippocampal atrophy in Alzheimer’s disease
www.thelancet.com/journals/laneur/article/PIIS1474-4422(17)30343-5/fulltext
2017年11月01日
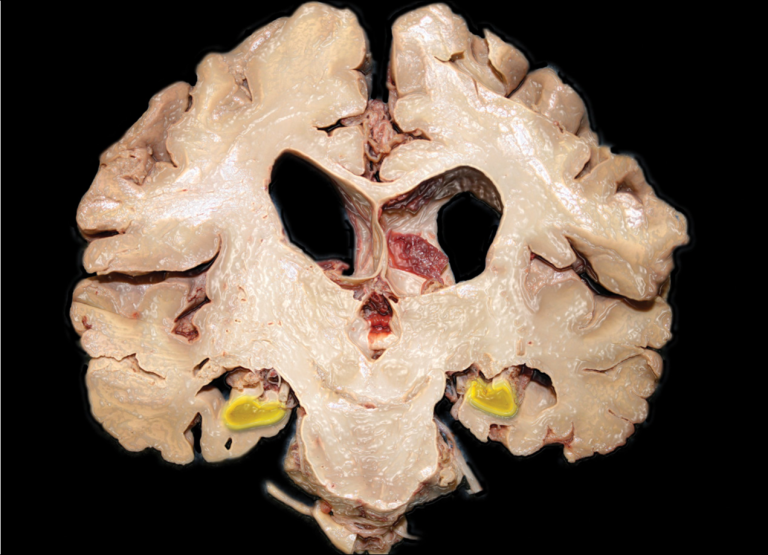
海馬の損傷は、アルツハイマー病の病理学的基準に組み込まれており、少なくとも海馬に神経原線維のもつれがあること、連合皮質にβアミロイドが沈着して中程度の神経細胞が浸潤していることという、2つの領域に分けられる病理学的特徴が必要とされている2。発症時の海馬のもつれ形成の重症度は、非常に多様である(一部の神経細胞が関与するものから、ほぼすべての神経細胞が関与するものまで)。多くの研究により、アルツハイマー病に伴う進行性の海馬の萎縮と最も密接に関連しているのは、先行するタウタンパク質の沈着ではなく、海馬における神経細胞の喪失の重症度であることが示されている。このような変性プロセスは、細胞内のタウ自体の再分布、神経末端や樹状突起におけるβアミロイドタンパク質との相互作用、あるいはその両方によって引き起こされると考えられてきた。メカニズム的な研究は、この2つのタンパク質の間の病原性相互作用の概念を確実に裏付けている3。
アルツハイマー病の診断基準の改善と並行して2,コホート研究や集団ベースの剖検研究の結果、80歳以上の高齢者の比較的高い割合で、脳の加齢に伴う TAR DNA結合タンパク質43 (TDP-43) の沈着と海馬の硬化が見られることが明らかになった4。重要なことは、TDP-43の沈着は通常アミロイドを形成せず、タウやβアミロイドの沈着とは異なることである5。さらに、TDP-43の沈着は通常、局所的な急速な神経細胞死を伴うが、これはTDP-43の必須のRNA結合・輸送プロセスやプリオン様ドメインが破壊されているためと考えられる6。
The Lancet Neurology誌に掲載されたKeith Josephsらの研究7では、アルツハイマー病における海馬の萎縮率の変化の原因となる病理の概念に取り組んでいる。アルツハイマー病における経時的な萎縮には、大きく分けて4つのパターンがあると言われている。59%の患者が典型的な海馬と皮質の進行性萎縮を示し、19%が海馬のみの進行性萎縮を示し、12%が皮質のみの進行性萎縮を示し、10%がいずれの領域も経時的には萎縮しないとされている8。これらの研究8,9は、アルツハイマー病患者の病理学的転帰に関連して、脳の局所的な萎縮率が変化することを示している。
Josephsら7による今回の研究では、アルツハイマー病において非常に一般的な問題でありながら、これまでの研究では見過ごされてきた細胞病理の影響を取り上げており、この見落としが現在の臨床試験の失敗率の原因となっている可能性がある。Josephsらはこれまでに、アルツハイマー病患者におけるTDP-43沈着は、多くの認知スコアで悪い結果を示し、海馬が小さい高齢者に発生することを示してきた10。その後、他の研究により、TDP-43病理はアルツハイマー病で非常に一般的であり、独立してアルツハイマー病の臨床診断の可能性を高めることが確認された11。Josephsらは、アルツハイマー病におけるTDP-43の沈着の分布は、前頭側頭型認知症や筋萎縮性側索硬化症におけるTDP-43の沈着とは異なる特徴的なパターンを示すが、側頭葉に集中しているという点では、脳の加齢に伴うTDP-43の硬化症と類似していることも示した12,13。Josephs博士らは、メイヨークリニックの加齢およびアルツハイマー病研究で剖検されたより大規模な長期追跡コホートを対象とした本研究7において、海馬における追加的なTDP-43病理は、タウタンパク質の沈着だけで観察されるよりも有意に大きな萎縮率と関連していることをさらに証明している(それぞれ、4~39%対3~11%の年間減少)。最近の共同研究では、TDP-43包接体の25%がタウ免疫反応性のタングルを持つ海馬ニューロンで発生することが示されており14,二次的なメカニズムの可能性が示唆されている。Josephsらの研究7では、海馬におけるこのような病理の集合体が、時間の経過とともにより実質的な変性や萎縮を引き起こすことを示唆しており、そのような追加的なメカニズムを標的とすることが必要であると考えられる。興味深いことに、タウとα-シヌクレインの両方が沈着しているレビー小体型認知症患者では、海馬の萎縮が抑制されている15。
これらのデータを総合すると、機能的に多様なこれらの神経細胞タンパク質が海馬に沈着すると、神経毒性のレベルがかなり異なることが示唆される。この毒性の違いは、これらの疾患における海馬の萎縮に関連していることが知られているミクログリアの変化に反映されているかもしれない16。これらの病理学的変化を、アルツハイマー病患者の集団で以前に確認された萎縮の異なるパターンにマッピングし、TDP-43が海馬に沈着している患者は辺縁部優位の萎縮を示し、α-シンヌクレインが沈着している患者は海馬を残しているのかどうかを明らかにすることが重要である。いずれにしても、Jospehsらの研究で示されたデータ7は、TDP-43の病理が、治療に焦点を当てるべき新たな神経毒性メカニズムを介して、神経変性の増加と関連していることを示している。