www.ncbi.nlm.nih.gov/pmc/articles/PMC6536849/
要旨
最近認知された疾患である大脳辺縁優位性加齢性TDP-43脳症(LATE)について述べる。LATE神経病理学的変化(LATE-NC)は、海馬硬化症の病理を併存するか否かにかかわらず、高齢者におけるステレオタイプのTDP-43蛋白症によって定義される。
LATE-NCは一般的なTDP-43蛋白症であり、レトロスペクティブな剖検研究ではアルツハイマー型認知症を模倣した無気力性認知症症候群と関連している。LATEは、その疫学(LATEは一般的に高齢者が罹患するおよびTDP-43蛋白質障害の神経解剖学的分布が比較的限定されていることから TDP-43病理を伴う前頭側頭葉変性症とは区別される。
コミュニティベースの剖検コホートでは、約25%の脳にLATE-NCの負荷があり、識別可能な認知機能障害と関連していた。LATE-NCを有する多くの被験者は、アミロイドβプラークやタウパチーを含む併存する脳病理学的疾患を有している。
「高齢者」はLATE-NCの最大のリスクを有しており、多くの国で高齢者が急速に増加している人口統計学的グループを構成していることを考えると、LATEは公衆衛生に与える影響は拡大しているが、まだ十分に認識されていない。これらの理由から 研究の活性化と認知症への道筋の認知を促進することを目的として、LATEの診断基準を開発するためのワーキンググループが召集された。
本研究では、LATE-NCの診断と病期分類のガイドラインを含む、コンセンサスに基づいた推奨事項を報告する。LATE-NCのルーチンの剖検では、解剖学的な予備的病期分類として、扁桃体、海馬、中前頭前野の3つの脳領域の組織を対象にTDP-43免疫組織化学検査を行うことを提案している。LATE-NCは内側側頭葉構造に優先的に影響を及ぼすようであるが、他の領域にも影響を及ぼす。神経画像研究では、LATE-NCを有する被験者は、内側側頭葉、前頭前野、およびその他の脳領域でも萎縮を示すことが示された。
これまでの遺伝子研究により、LATE-NCのリスク対立遺伝子としてGRN、TMEM106B、ABCC9,KCNMB2,APOEの5つの遺伝子が示唆されている。これらのリスク遺伝子の発見は、LATEが前頭側頭葉変性症やアルツハイマー病と病態メカニズムを共有していることを示しているだけでなく、疾患特異的なメカニズムを示唆している。
LATEに関する我々の理解には大きなギャップが残っている。予防、診断、治療の進歩のためには、試験管内試験(試験管内試験)や動物モデルを含め、LATEに焦点を当てた研究が急務となっている。臨床の進展の障害となっているのは、LATEを死後に検出するためのバイオマーカー(バイオ流体や神経画像バイオマーカー)のような診断ツールがないことである。疾患バイオマーカーの開発は、LATEの危険因子、自然経過、臨床的特徴をより明確にするための観察研究を強化し、最終的には臨床試験での標的治療のために被験者を募集することになるだろう。
キーワード PET、MRI、FTLD、疫学、SNAP
はじめに
大脳辺縁系のトランスアクティブ応答性DNA結合タンパク質43kDa(TDP-43)プロテインオパシーは、80歳を過ぎた被験者によく見られる。このプロテインオパシーは、レトロスペクティブな研究ではアルツハイマー病の臨床症候群に類似した認知機能障害と関連している。
加齢性TDP-43プロテインオパシーの公衆衛生への影響については、多くの情報源から証明されているにもかかわらず、コンセンサスに基づいた命名法はまだ存在しない。この問題に対処するために、我々は新しい用語を提案する:辺縁筋優位性加齢性TDP-43脳症(LATE)。LATE神経病理学的変化(LATE-NC)の剖検評価および病期分類のガイドラインを提案する。
認知症状、神経画像、公衆衛生への影響、遺伝学など、LATEに関連する医学文献をレビューする。神経変性の一因としてのLATEの重要性を強調し、特定のLATEバイオマーカー開発、TDP-43に焦点を当てた創薬、そして最終的な臨床試験の必要性を強調する。最後に、LATEに関する重要な知識のギャップと将来の研究の方向性を強調して締めくくる。
まとめのポイントをBox 1に示す。
ボックス1
LATEとLATE-NCのまとめポイント
- LATE-NCの特徴
- TDP-43蛋白症の解剖学的分布を特徴づけるために、日常的な剖検診断のためのサンプリングおよび病期分類システムを提案する。
- ステージ1:扁桃体のみ
- ステージ2:+海馬カンプス
- ステージ3:+中前頭回
- 海馬硬化症の病態が観察されることがある(報告すべきである)が、LATE-NCの診断には必要でも十分でもない。
- 大規模なコミュニティベースの剖検シリーズによると、80歳を過ぎた人の20%以上(最大50%)にLATE-NCが存在する。
- LATEは、実質的な疾患特異的認知障害、通常は無気力性認知症症候群(「アルツハイマー型認知症」)と関連している。
- LATEの全体的な公衆衛生への影響は、アルツハイマー病の神経病理学的変化と同程度であり、これらの疾患はしばしば併存しているが、どちらの病理がより深刻であるかは個人差が大きい。
- LATEの遺伝的危険因子は、FTLD-TDPとアルツハイマー病との重複がある。
- LATEの分子特異的バイオマーカーは存在しない。これは、臨床試験(アルツハイマー病臨床試験の潜在的な除外基準としての使用を含む)や、LATEの臨床的および病理学的進行の縦断的研究での使用が必要とされる重要な領域である。
背景
アルツハイマー病の神経病理学的変化(アルツハイマー病NC)が、無気力性軽度認知障害および高齢者のアルツハイマー臨床症候群に関連する複数の神経病理学的基質の一つに過ぎないという認識が高まっている(Korczyn、 2002; Zekry et al 2002; Zekry et al 2002; Bennett et al 2006; Jellinger et al 2007; Schneider et al 2007; Crary et al 2014; Murray et al 2014; Rahimi et al Kovacs et al 2014)。2002; Bennett et al 2006; Jellinger and Attems 2007; Schneider et al 2007; Crary et al 2014; Murray et al 2014; Rahimi and Kovacs 2014; James et al 2016)。) 最近の研究では、認知状態のスペクトルにわたる大群の被験者から豊富な臨床データを収集し、これらの臨床所見を剖検時の新たな病理学的マーカーと相関させ、その後、強力な統計的手法を用いてデータを分析している。これらの研究は、高齢化したヒトの脳の疾患が複雑であることを示唆している:複数の併存する病態が通常であり、神経病理学的表現型にはかなりの個人差がある(Neuropathology Group. Medical Research Council Cognitive and Aging、 2001; Brayne et al 2009; Kovacs et al 2013; Murray et al 2014; Rahimi and Kovacs、 2014; White et al 2016; Abner et al 2017; Kapasi et al 2017; Suemoto et al 2017; Tanskanen et al 2017; Robinson et al 2018b、 c)。) すべての年齢層において重度のADNCと認知機能障害との間には強い関連があるが(Nelson et al 2009;Abner et al 201180歳以降に死亡した被験者は、ADNCの重度を考慮すると予想以上の認知機能低下を示すことが多い(KawasおよびCorrada 2006;Savva et al 2009;Nelson et al 2012)。LATE-NCはこの明らかな臨床病理学的ミスマッチに重要な貢献者である(下記参照)。
歴史的に、LATEの病理学的症状として最初に認識されたのは、深遠な海馬ニューロンの喪失とグリア症であり、総称して海馬硬化症と呼ばれている。Dicksonら(1994)は画期的な研究で、認知症と海馬硬化症を有する13人の高齢者を同定したが、実質的なADNCを欠いていた。認知症と海馬硬化症の被験者を含む他のより大きな剖検シリーズが後に報告された(Crystal et al 2000;Barker et al 2002;Leverenz et al 2002;White et al 2002;Zarow et al 2005;Attems and Jellinger 2006;Brayne et al 2009)。2006年に、リン酸化TDP-43が、FTLD-TDPとして知られる、筋萎縮性側索硬化症(ALS)およびほとんどの症例の前頭側頭葉変性(FTLD)の徴候であるユビキチン化介在物中の疾患タンパク質として発見された(Neumann et al 2006; Cairns et al 2007a)。TARDBP遺伝子(Ou et al 1995)によってコードされるTDP-43タンパク質は、他のタンパク質と同様にRNAおよびDNAに結合するタンパク質であり、転写および翻訳の両方のレベルで遺伝子発現調節において複数の機能を果たす(Cohen et al 2011; GuoおよびShorter 2017)。ほとんどのヒト組織および細胞型で発現するTDP-43は、主に非リン酸化型であり、ほとんどが核内に局在しているが、疾患状態ではリン酸化型であり、しばしば細胞質に移動する(Neumann er al 2006)。
FTLD-TDPおよび大多数のALS症例におけるTDP-43プロテインオパチーの検出(Mackenzie et al 2007)に続いて、FTLDまたはALSを伴わないが、しばしば海馬硬化症および/またはADNCを併存する80歳以上の被験者の脳においてもTDP-43プロテインオパチーが発見された(Amador-Ortiz et al 2007a、b)。ADNCを有する被験者では、LATE-NCは、認知症を発症する閾値を低下させる一般的な併存病変を示す(Josephs et al 2014b 2015)。レトロスペクティブ研究において、加齢に伴うTDP-43プロテインオパシーは、アルツハイマー臨床症候群を模倣した進行性無気力症候群と関連している(Pao et al 2011; Brenowitz et al 2014)。TDP-43プロテインオパシー、海馬硬化症の病理学的存在、および関連する無気力性認知症は、高齢になるにつれて増加する一方で、重度のADNCの有病率は極端な高齢になると減少する(Nelson et al 2011a、b 2013; Brenowitz et al 2014)。これらの症例における病理学的TDP-43の存在は、高齢者における新しい疾患メカニズムを示唆している。現在のところ、一般的な加齢性TDP-43蛋白症の用語や病期分類システムについて普遍的に合意されたものがないため、認知症研究分野の研究者の間でも、この疾患は十分に研究されておらず、認知されていないのが現状である。この疾患の研究を促進し、認知度を高めることが、LATEという新しい用語を開発した主な動機であり、それに続く勧告でもある。
LATEの神経病理学的変化
LATE-NCは、特に80歳以上の高齢者にみられる進行性のTDP-43蛋白症である。アルツハイマー病の神経病理学的基準のためのワーキンググループによって提案された規約(Montine et al 2012)に従って、我々は、本疾患を参照するためにLATEを使用し、LATE神経病理学的変化を示す用語としてLATE-NCを使用する。LATEという用語は、認知障害に関連する可能性のあるTDP-43蛋白質障害に関連して以前に使用されたいくつかの呼称を包含することを意図しており、海馬硬化症、加齢性海馬硬化症、海馬硬化症認知症、硬化症を伴う脳年齢関連TDP-43,および高齢者におけるTDP-43病理学的変化を含む(レビューは、Kuslansky et al 2004;LippaおよびDickson 2012を参照のこと。2004; Lippa and Dickson、 2004; Nelson et al 2013, 2016b; Dutra et al 2015)。)
TDP-43蛋白質障害」とは、正常な核内TDP-43免疫反応性の喪失を意味し、ニューロンの細胞質内にTDP-43蛋白質の「包接体」が存在し、さらにニューロンの核および細胞過程(ニューライトならびにオリゴデングリアおよびアストロサイトにおける異常なTDP-43蓄積(その多くはリン酸化されている)が存在する。TDP-43蛋白質障害の代表的な例は、図1 誤局在化およびリン酸化されたTDP-43はLATE-NCの必要な特徴であり、時にA型FTLD-TDPに見られる特徴に類似した特徴を有する(Lin et al 2009;Mackenzie et al 2011;Murray et al 2014;Aoki et al 2015)が、しばしば、その特徴は確立されたFTLD-TDPのサブタイプにすっきりと収まらない。実際、最近の研究では、A型FTLD-TDPとの類似点および相違点の両方を含むLATE-NCの特徴が記載されている(Josephs et al 2019)。大脳辺縁系の構造に加えて、LATEにおけるTDP-43タンパク症は、嗅球、大脳新皮質、基底核、およびより頻繁ではない脳幹においても記載されている(Josephs et al 2008;Geser et al 2010;JosephsおよびDickson 2016;Nelson et al 2018)。免疫電子顕微鏡により、TDP-43介在物は、束状の直径10-20nmの直線フィラメントからなる線状の超微細構造を有し(Lin and Dickson、 2008; Lin et al 2009しばしば電子密度の高い顆粒を伴うことが示された(Cairns et al 2007b; Robinson et al 2013)。
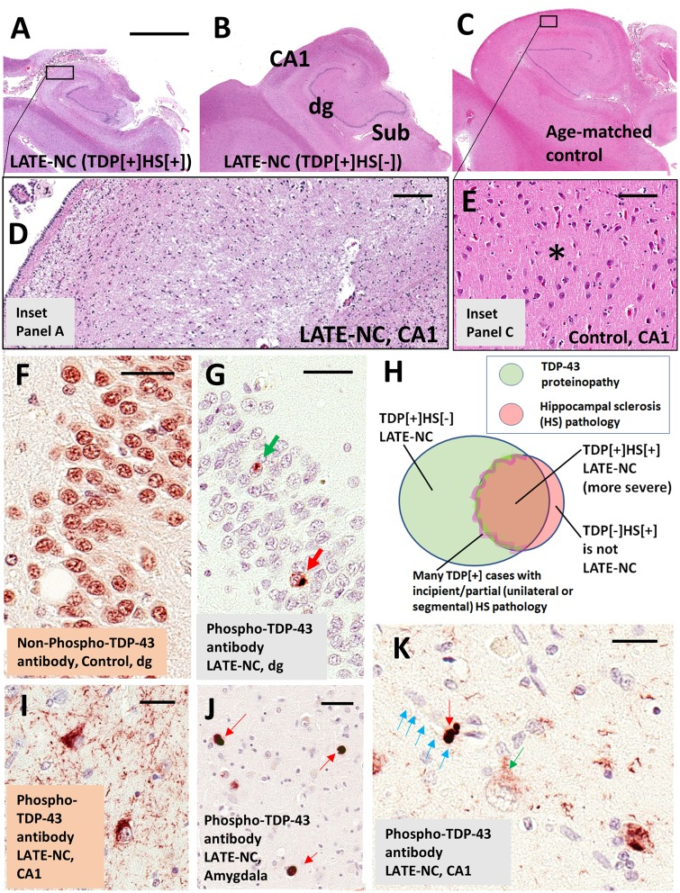
図1 LATE神経病理学的変化(LATE-NC)
A-E)ヘマトキシリンとエオジン(H&E)を使用して染色したヒト海馬の冠状切片。A-Cの写真は、同じ倍率で表示されていることに注意してほしい。A)海馬硬化症(HS)とLATE-NC。海馬は萎縮しており、神経鞘は希薄化している。D)CA1サブフィールドの高倍率、正常な細胞構造の欠如と広範なグリオシスを伴う。C)コントロールの年齢をマッチさせた海馬。E)正常な細胞アーキテクチャと無傷の好酸球性ニューロピル(アスタリスク)を示すためにコントロール海馬のCA1。Bに示されている海馬は、低倍率ではAの場合と比較して、明らかなニューロピルの破壊を伴う萎縮性が少ないです;しかし、隣接するセクションは、TDP-43タンパク質障害を明らかにした。海馬野はBでラベル付けされている: dg = 歯状顆粒層; Sub = 小胞体。TDP-43プロテインオパシーは、非リン酸化またはリン酸化TDP-43エピトープに対する抗体を用いて認識することができる。F)TDP-43病理を欠く症例の歯状顆粒細胞。細胞核は通常、非リン酸化TDP-43タンパク質に対して免疫陽性であることに注意してほしい。対照的に、LATE-NCを有する症例(G)では、リン酸化TDP-43タンパク質に対する抗体は、核(緑矢印)と細胞質(赤矢印)の病理学的介在物のみを認識する。非リン酸化TDP-43に対する抗体とは異なり、リン酸化TDP-43に対する抗体は、非病変細胞では陰性である。Gのほとんどの細胞は、細胞核を青色に染色するカウンターステインであるヘマトキシリンで可視化されている。Hのベン図は、TDP-43プロテインオパシー、海馬硬化症、およびLATE-NCを有する症例間の不完全な重複を模式的に示している。TDP-43病理を有する症例のサブセットは、併存する海馬硬化症病理を有する;非海馬硬化症症例と海馬硬化症症例の間の変化域は、多くの症例が初期の海馬ニューロン喪失およびグリアーシスを伴う移行期にあるように思われるため、不明瞭である。重要なことは、海馬硬化症の病理学的特徴はあるが、TDP-43蛋白症を認めない症例(例えば、無酸素症やてんかんを伴う海馬硬化症の病理学的特徴)は、LATE-NCには分類されないということである。(I) 海馬CA1の2つのニューロンにおけるphospho-TDP-43プロテインオパシー、phospho-TDP-43免疫反応性ジストロフィー性ニューロンとともに。J)扁桃体のもつれ状のphospho-TDP-43免疫反応性細胞質内包物(赤矢印背景にはphospho-TDP-43免疫反応性ニューロンが少ない。(K) 脳神経内のphospho-TDP-43包接体(赤矢印)と毛細血管を取り囲むphospho-TDP-43沈着体(緑矢印)(青矢印で示す);これらのTDP-43免疫反応性構造は、アストロサイトのエンドフィート内に存在することが実証されている(Lin er al)。 これらのTDP-43免疫反応性構造は、アストロサイトエンドフィート内に存在することが実証されている(Lin er al)。 A-CのためのA = 4 mmのスケールバー; D = 200μm; E = 100μm; F = 30μm; G = 35μm; I = 30μm;およびK = 25μm。
LATE-NCを持つ脳では、ヘマトキシリンとエオシン染色は、海馬のCA1セクターで神経細胞の脱落とアストロサイトーシスを明らかにすることがあるだけでなく、小群、内耳皮質、扁桃体(アマドール-オルティスとディクソン 2008)。萎縮はこれらの領域で顕著である(図1A-C)。重症化した海馬では、神経管は稀薄化し、神経細胞の損失は反応性アストロサイトーシスを伴う(Amador-Ortiz et al 2007a)。顕著な白血球浸潤または血管周囲カフは典型的には認められないが、肥大性ミクログリアは多数存在し得る(Bachstetter et al 2015)。神経細胞の喪失は、一部の被験者ではセグメント的であり、同じ脳領域からの一部の切片ではなく、すべての切片で観察される(Ighodaro er al 2015)。海馬硬化症の病理は、FTLD-TDP(Irwin et al 2018)とは異なり、両側で評価された症例の約40〜50%において片側性である(Nelson et al 2011b; Zarow et al 2012; Kero et al 2018)。
海馬硬化症は、重度のLATE-NCを有する症例のサブセットに存在し、ADNCと区別する最初の特徴的な病理学的特徴であった(Dickson et al 1994)。それにもかかわらず、海馬硬化症はLATE-NCに特異的なものでも、LATEの診断に十分なものでもない。海馬硬化症の神経病理学的診断は困難である。ADNCおよび関連疾患のための最新のコンセンサスガイドラインは、海馬硬化症の病理学は「同じ構造のアルツハイマー病神経病理学的変化に比例しない海馬形成のCA1および小群の重度の錐体細胞喪失およびグリア症によって定義される」と述べている(Montine et al 2012)。しかし、海馬変性には、地形的にも表現型的にもかなりの不均一性があり、普及のための厳密な基準を確立することが困難になっている。さらに、海馬硬化症は、てんかん、低酸素、低血糖、特定の感染症、および多数の神経変性疾患を含む様々な基礎疾患プロセスに関連する病理学的エンドポイントである(Josephs et al 2007;Thom et al 2009;Yokota et al 2010;Malek-Ahmadi et al 2013;Murray et al 2013;Ling et al 2017;Popkirov et al 2017;Sen et al 2018)。Wilhelm Sommer(Sommer、 1880; Thom、 2009)による19世紀のてんかんの研究に端を発し、海馬硬化症という用語は、発作障害の文脈で放射線科医および病理医によって今でも広く使用されている(Isnard and Bourdillon、 2015; Thom and Sisodiya、 2015)。海馬硬化症の病理組織学的特徴およびサブタイプの詳細な議論は、他の場所で見つけることができる(Probst et al 2007;Rauramaa et al 2013;Hatanpaa et al 2014;Dutra et al 2015;ThomおよびSisodiya et al 2015;Cykowski et al 2017)。海馬硬化症を有するが、TDP-43病理学を欠く脳(TDP-43-/HS+)は、LATE-NCを表さない。例えば、急性低酸素症によって引き起こされた、またはてんかんを伴う海馬硬化症を有する脳は、TDP-43蛋白質病理症に対して陰性であり(Amador-Ortiz et al 2007b;LeeおよびLee 2008;Nelson et al 2011bLATE-NCの基準を満たしていない(図1H)。まとめると、TDP-43蛋白質障害は、海馬硬化症を伴うか否かにかかわらず、LATE-NCの必要な特徴である。
他の神経変性疾患(Braak er al)。 1993, 2006; Thal er al 2000; Zaccai er al 2008; Alafuzoff er al 2009)と同様に、NIAが資金を提供しているアルツハイマー病センターのような臨床研究対象者を対象とした縦断的研究や地域社会に根ざした研究から得られた剖検データの慎重な評価は、LATEの理解を広げてきた。高齢化および海馬硬化症の被験者はしばしばTDP-43プロテインオパシーを有するが(Amador-Ortiz et al 2007b; Nelson et al 2011b; Robinson et al 2014; Nag et al 2015,2018大脳辺縁系におけるTDP-43プロテインオパシーは海馬硬化症よりも有病率が高い(Kovacs et al 2007b; Nelson et al 2011b; Robinson et al 2014; Nag et al 2015,2018)。2013; Josephs et al 2014b; Keage et al 2014; Murray et al 2014; Rahimi and Kovacs 2014; Aoki et al 2015; Nag et al 2015,2017; Hokkanen et al 2018; Robinson et al 2018b)。) TDP-43陽性(+)および海馬硬化症陰性(HS-)症例は、剖検シリーズの研究対象の5〜40%を代表するLATE-NCのサブセットである。先行研究者は、TDP-43蛋白質障害を有し、ある程度の細胞脱落およびグリアーゼを有するが、フランクな海馬硬化症を欠く脳を、「HSの前駆体」、「プレHpScl」または「プレHS-老化」として用語を使用してきた(Hatanpaa et al 2008;Aoki et al 2015;Hockanen et al 2018)。用語から示唆されるように、TDP-43+/HS-脳は、TDP-43+/HS+症例と同じ疾患連続体の初期または移行期を表しているかもしれない。剖検コホート研究から集められたLATEに関する手がかりは他にもある。例えば、海馬硬化症が片側性または分節性であった場合でも、TDP-43蛋白症はほぼ常に両側性であった(Nelson et al 2011b; Ighodaro et al 2015)。これらの観察は、LATEがどのように進化するかについての意味合いを持つが、それは依然として重要で未解決の問題である。
大規模な剖検シリーズで収集されたデータは、LATEの進行に関する仮説を検証するために分析されている。多変量回帰ベースの評価は、横断的なデータが神経病理学的変化の逐次経路の提案と一致するかどうかを検証するためのモデルを生成するために使用することができる。ラッシュ大学のコミュニティベースの剖検研究から得られたそのような経路分析の結果を図2に示す。これらの解析は以前に述べたように行われ(Power et al 2018その結果は少なくとも3つの仮説と一致している。(i) TDP-43プロテインオパチーを有する症例のサブセットは、TDP-43プロテインオパチーを促進した重複過程(s)によって、あるいはTDP-43プロテインオパチー自体によって直接引き起こされた、あるいは悪化した海馬硬化症を発症する;(ii) TDP-43プロテインオパチーは、海馬硬化症を有しない症例においても、認知症とは独立して関連している;そして(iii) ADNCと関連した病理学的メカニズム(図2では、ADNCと関連している)。2では、ニューロン性アミロイドβプラークに関するデータが提供されている)もまた、TDP-43プロテインオパシーの増加と関連している。海馬硬化症様病理を伴うTDP-43プロテインオパシーの現在のげっ歯類モデルは少ない(Ke er al 2015)。TDP-43プロテインオパシーは、アルツハイマー病脳からの病理学的タウおよびアミロイド-βに類似したマウスモデルで伝達可能であることが示されたが(Porta et al 2018発表されたTDP-43モデルは、LATEよりもFTLD-TDPに直接関連していると考えられている。今のところ、十分な縦断的バイオマーカーデータの欠如と現在の動物モデルの限界が、疾患メカニズムの研究を妨げており、さらなる調査が必要である。
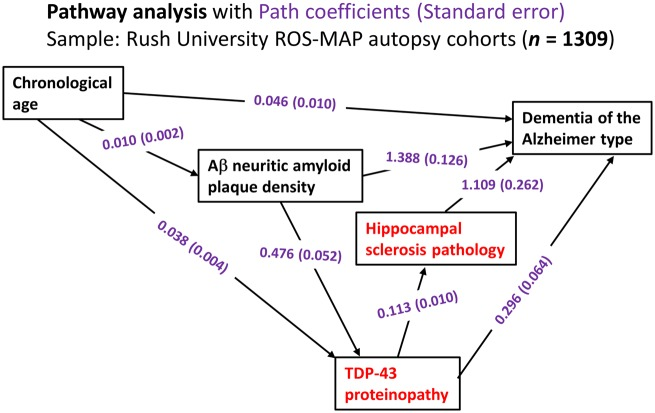
図2 パスウェイ解析の結果を描いたラッシュ大学の地域密着型剖検コホートからのLATEに関連するデータの統計解析。
データを分析したのは、以前に述べたようにラッシュ大学からの2つの老齢化に関する臨床病理学的研究の研究ボランティア(合計n=1309)であった(Power er al)。 このサンプルでは、平均死亡年齢は89.7歳であった[標準偏差(SD)6.5歳、範囲65~108歳]。これらの解析には、年齢、アミロイドβ神経アミロイドプラークの密度(ADNCの因子にTDP-43プロテインオパシー、海馬硬化症病理、アルツハイマー型臨床認知症のエンドポイントが組み込まれていた。LATE-NCと最も強く関連するパスウェイ解析の成分を赤で示す。数字はパス係数で、括弧内は標準誤差(紫で示す)。これらの数値は、個々のパスウェイの効果を定量化するのに役立つ。例えば、TDP-43プロテインオパシーから認知症に至る経路は2つあり、1つは直接的な経路(TDP-43プロテインオパシー→認知症もう1つは海馬硬化症の病態を含む間接的な経路(TDP-43プロテインオパシー→海馬硬化症→認知症)であることがデータから確認できる。さらに、このデータは、TDP-43プロテインオパシーのサブセットがADNC型神経アミロイドプラーク病理の「下流」にあることを示している。現実的な意味で、これは、神経性アミロイドプラークが多い脳ほど、他の既知のすべての因子が同じである中で、TDP-43プロテインオパシーを有する可能性が高いことを意味する。アミロイドβ=アミロイド-βである。
LATE MRI検査
MRIの研究は、LATE-NCの脳の変化についての補足的な窓を提供しており、剖検で検証されたLATE-NCの脳の内側側頭葉の内側と外側の両方の脳の萎縮を強調している。先行研究では、剖検後にMRIを受けた研究ボランティアが対象となっている。これらの研究のいくつかは海馬硬化症のサブセット(すなわち、重度のLATE-NCと推定される)に焦点を当てていたため、発表されたデータのほとんどは、重度ではない症例についての情報が不足していた。そのような注意点を念頭に置いて、MRI研究における共通の所見は、純粋なアルツハイマー病の症例よりもLATE-NCの症例の方が海馬の萎縮が大きいということである(Jagust et al 2008; Josephs et al 2008,2017a; Dawe et al 2011; Kaur et al 2014; Dallaire-Theroux et al 2017; Hanko et al 2019)。Barkhof et al 2007)は、内側側頭萎縮を有する多くの被験者には、基礎となる原発性ADNCが欠如していることを発見した。この研究コホートでは、重度の萎縮のADNCに対する感度および特異度はそれぞれ63%および69%であり、先行研究の知見と一致していた(Jack er al 2002)。Josephs et al 2008)は、LATE-NCと一致する神経病理学を有する被験者は、TDP-43-の被験者よりも高齢で、認知障害が多く、海馬の萎縮が顕著である傾向があることを報告した。Zarow et al 2011)はまた、海馬硬化症およびLATE-NCを有する者では、ADNCのみを有する者よりも海馬の萎縮および変形がかなり大きいことを報告した(Zarow et al 2011)。LATE-NCを伴う海馬硬化症では、海馬の萎縮は非対称的であることが多く、海馬の吻側-尾側勾配で進行する傾向があった。死後MRIを用いて、Dawe et al 2011)は、海馬萎縮とADNCの間よりも、海馬萎縮とLATE-NC(海馬硬化症の病理学を有する)の間の相関が強く、ADNCとLATE-NCの両方を有する被験者は、ADNCのみを有する被験者よりも海馬萎縮が大きかったことを報告した。最近の研究では、扁桃体の体積と形状が基礎となるLATE-NCと関連しており、これらの構造変化が他の病理学的指標で説明できるものを超えて認知機能の低下を示唆していることが明らかになった(Makkinejad et al 2019)。
死後のMRI研究では、LATE-NCは内側側頭葉以外の脳の実質的な萎縮と関連しているという強い証拠も提供されている(Kotrotsou et al 2015)。図3Aは、ラッシュ大学の剖検コホートからの更新データを示している。人口統計学、ADNCおよび他の年齢関連の病態をコントロールした後、LATE-NCは、内側側頭葉の萎縮だけでなく、下前頭前野、前側頭前野、および島皮質の萎縮にも関連していた。この地域的な萎縮パターンが、剖検時のTDP-43蛋白症の分布と一致していることは注目に値する(Josephs et al 2016;Nag et al 2018)(図3B)。これらのデータは、LATE-NCの病理学的研究、およびLATE-NCリスク遺伝子型を有する被験者における神経イメージングと一致しており、広範な脳への関与を示している(Neltner et al 2014;Cykowski et al 2016;Josephs et al 2016;Nelson et al 2016a;Nho et al 2016)。
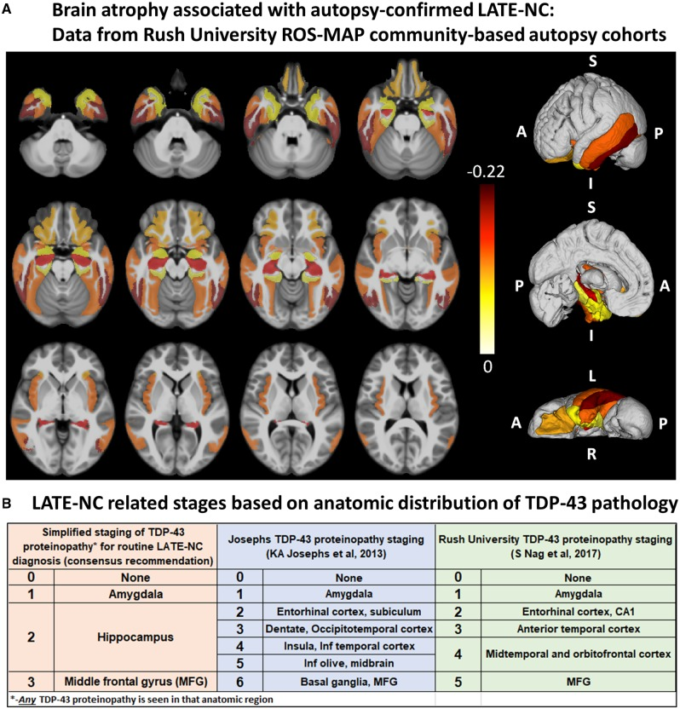
図3 LATEで影響を受ける脳領域
(A)剖検確認後の死後MRIにより、LATE-NCに関連する脳萎縮領域の識別が可能となった。これらのデータは、地域に密着した剖検標本からLATE-NCが剖検で確認された症例において、萎縮を伴う内側側頭葉内外の灰白質領域を示している。図は、Kotrotsou et al 2015)で用いた方法と同様に、いくつかの修正を加えて作成した。2つの老化のコホート研究(Rush Memory and Aging Projectと Religious Orders Study)の539人の参加者からの大脳半球を、MRIを用いてex vivoで画像化し、さらに詳細な神経病理学的特徴付けを行った。大脳皮質および皮質下灰白質を41の領域にセグメント化した。線形回帰を用いて、剖検時のLATE-NCのスコア(スコア。0 = TDP-43介在物なし、または扁桃体のみの介在物;1 = TDP-43介在物が扁桃体、内葉皮質または海馬CA1,および大脳新皮質にある。2 = 扁桃体、内耳皮質または海馬CA1,および大脳新皮質におけるTDP-43介在物、および海馬硬化症の病理学)アミロイド斑および神経原線維のもつれ、レビー小体を制御する。灰白質領域のモデル推定値(単位:mm2)は、灰白質領域の体積とLATE病理(P<0.05)の間に有意な負の相関があることが示された。灰白質領域の体積とLATE病理(P < 0.05,偽発見率補正)との間に有意な負の相関を持つモデル推定値(単位:mm2)に固有の色が割り当てられている;暗い色は、その領域での脳萎縮が大きいことを示す。結果は、IITヒト脳アトラス(v.4.2)のT1強調テンプレートの両半球に重ねて表示される。結果の側方、内側、および劣位から上位の3Dビューも示されている。(B) TDP-43蛋白質障害の解剖学的部位によるLATE-NCの分類。本ワーキンググループは、LATE-NCのルーチン評価のための簡略化された病期分類スキームを推奨した。これには、扁桃体、海馬、中前頭前野のサンプリングとTDP-43免疫組織化学染色が必要である。LATE-NCに直接関連するより詳細なTDP-43免疫組織化学的病期分類は、Josephs et al 2014a、 2016)およびNag et al 2018)によって以前に発表されている。MFG=中前頭回。
LATE-NCのルーチンの剖検評価および分類のための推奨事項
すべての高齢者において、神経病理学的評価の一環としてTDP-43免疫組織化学検査を行うことが推奨される。最低限、扁桃体、中位海馬、中位前頭回の3つの脳領域でTDP-43の免疫組織化学染色を行うことが推奨される。これらの領域は高齢者の剖検時に一般的に得られるものであり、脳内の推定されるLATE-NCの進行を捉えることができるため、これらの領域を評価することを推奨する。このサンプリングには、疾患経過の初期に影響を受ける脳領域(扁桃体、ステージ1病理学的変化が認知障害とロバストに関連する中間ステージ(海馬、ステージ2およびより進行したステージで影響を受ける領域(中前頭前野、ステージ3)が含まれる(Nag et al 2018)。検出された任意のTDP-43蛋白質障害は、解剖学的領域ベースのステージを定義するのに十分である:例えば、海馬における検出された微量のTDP-43蛋白質障害は、少なくともステージ2を示す。我々は、LATE-NC剖検スクリーニングのために提案されたサンプリングが最小限の評価であることを強調し、一方で、より詳細なサンプリングおよびステージングは、特定の研究設定のために検討されるべきである(Josephs et al 2014a 2016;内野 et al 2015;Nag et al 2017,2018;Zhang et al 2019)。図3Bは、高齢者の脳の神経病理学的評価に推奨されるサンプリングを含む、LATE-NCの病期分類を描いている。これは、ALSまたはFTLD-TDPのために開発された別個のTDP-43病理学的病期分類スキーム(Brettschneider et al 2013;Fatima et al 2015;Tan et al 2015;Verde et al 2017;NeumannおよびMackenzie 2019)で評価されるであろう領域には対応していない。
LATE-NC、FTLD-TDP、およびADNCの間の診断的な「境界ゾーン」に関連して、実際的な疑問が生じる。LATE-NCとFTLD-TDPの両方が大脳新皮質領域に影響を与え、海馬硬化症と併存する可能性がある一方で、LATE-NCは通常、発症年齢が遅く、無気力性認知症であり、病的変化の大脳辺縁優位である(Nelson er al 2011b)。一方、FTLD-TDPやLATE-NCの発症年齢の正確な範囲はまだ完全には解明されていないため、LATE-NCの推奨は年齢のカットオフを規定していない。TDP-43プロテインオパチーのサブタイプ間の病理学的比較(発症年齢とは関係ない)については、以前の研究を参考にすべきである(Amador-Ortiz et al 2007a; Tan et al 2015)。LATE-NCよりも進行したFTLD-TDPでは、より広範囲で重度の皮質萎縮が典型的にみられる。LATE-NC症例を(病理組織学的または分子学的に)FTLD-TDPのサブタイプと決定的に区別できる特徴が確かに存在するかもしれない(Arai er al 2010; Hasegawa er al 2011; Tsuji er al 2012; Laferriere er al 2019);しかしなが et al この分野ではさらなる研究が必要である。今のところ、重度のLATE-NCとFTLD-TDPを区別するための決定的な基準は、様々なTDP-43プロテインオパチーを識別する特異的な特徴の発見を待っている(Tan er al 2017a)。
LATE-NCおよびADNCは、異なる神経病理学的ホールマークによって認識されているが、それらは上流の危険因子および疾患メカニズムを共有している可能性がある。1つのタンパク質のミスフォールディング障害を素因とする遺伝的変異もまた、他のものを引き起こすか、または悪化させる可能性があり(以下を参照ミスフォールディングされたタンパク質自体の間に相互作用があるかもしれない(Trojanowski and Lee、 2000; Higashi er al 2007; Hu er al 2008; Uryu er al 2008; Kadokura er al 2009; Davis er al 2017; Spires-Jones er al 2017; Tan er al 2017b; Nelson er al 2018)。早期発症の家族性アルツハイマー病またはダウン症候群を有する一部の被験者を含むADNCを有する脳は、ADNCを欠くものよりも高い割合でTDP-43蛋白質障害も含む傾向がある(Ala et al 2000;Jellinger et al 2000;Lippa et al 2009;Davidson et al 2011;Zarow et al 2012)。タウ神経原線維性もつれ病変およびTDP-43内包物の両方を有する個々のニューロンが、特に海馬の扁桃体、内耳皮質および歯状回において記載されている(Amador-Ortiz et al 2007b; Kadokura et al 2009; Smith et al 2017; Robinson et al 2018c; Josephs et al 2019)。いくつかの発表されたアカウントは、原発性加齢性タオパシー(PART)と加齢性TDP-43蛋白質障害との間の関連を評価している(Josephs et al 2017b;Smith et al 2017;Zhang et al 2019)。2019年そしてTDP-43プロテインオパシーもまた、共存性アルギロフィル性穀粒またはグリアタウオパシーを有する脳において記載されている(Fujishiro et al 2009;横田 et al 2010;Arnold et al 2013;Kertesz et al 2015)。LATE-NCの文脈における共存アミロイド-βおよび様々なタウ病理の意味合いは、まだ不完全に理解されていないので、さらなる研究が必要である。また、レビー小体型疾患とTDP-43蛋白症が共存する可能性があるというエビデンスもある(中島-安田 et al 2007;McAleese et al 2017;三木 et al 2018;Trieu et al 2018)。一方、「末期」ADNCまたはレビー小体型疾患を有する多くの症例は、TDP-43プロテインオパチーを欠いているので、共存するアミロイド-β、タウおよび/またはαシヌクレインプロテインオパチーがある場合でも、LATE-NCの有無を別個の診断主体として報告することを推奨する。
この発展途上の分野における将来のコンセンサスに基づく推奨を導くためには、さらなる研究が必要である。TDP-43蛋白症を検出するために使用される免疫組織化学的試薬に関しては、特定の抗体を推奨できるという現在のコンセンサスはない。多くの神経病理学者は、感度の高いphospho-TDP-43抗体を使用している(Hasegawa er al 2008; Alafuzoff er al 2015);これらの試薬を使用して、小さな凝集体を容易に見ることができる。他の者は、非リン酸化エピトープに対する抗体を、特に封入体形成に先行する可能性のある初期の変化(病理学的な核から細胞質への再分配)を検出するために使用する(Vatsavayai et al 2016;Braak et al 2017;BraakおよびDel Tredici 2018;Nana et al 2019)。核内TDP-43の不在が可逆的であるかどうかは不明であるが、誘導性病原体系を用いた動物研究はそう示唆するであろう(Ke et al 2015)。さらに、TDP-43抗原性が固定化アーチファクトに対して脆弱である可能性があり、エピトープ検索方法が結果に影響を与え得ることを示すいくつかの証拠がある(Hatanpaa et al 2008)。LATE-NCを研究するための追加の実践ガイドラインは、アミロイド-β、タウ、α-シヌクレインの病理学的バイオマーカーで行われたように、正式なブラインドによるクロスバリデーション研究を必要とする。LATE-NCの病期分類、および局所病理学的重症度の評価システムを、臨床および神経画像診断の結果と関連させて検証し、改良するためには、今後の研究が必要である。
LATEの臨床的および神経認知的特徴
剖検で証明されたLATE-NCを有する対象者の臨床経過は、複数の認知領域を取り込むように進化し、最終的には日常生活活動の障害、すなわち認知症症候群に至る可能性がある無気力認知症候群として特徴づけられてきた(Nelson er al)。 認知機能障害は、ADNCまたは他の病態によって説明できる以上に大きい(Gold et al 2000;KawasおよびCorrada 2006;Imhof et al 2007;Giannakopoulos et al 2008;Nelson et al 2011b;Kravitz et al 2012;Boyle et al 2013;Erten-Lyons et al 2013)。 最近の剖検では、サンプルサイズが大きく、臨床所見や病理学的所見の範囲が広いため、各疾患タイプの相対的な影響を統計的にモデル化することが可能になった。これらの方法では、LATE-NCは他の共存する病態とは独立した実質的な認知障害と関連していた(Nelson er al 2010; Keage er al 2014; Murray er al 2014; Josephs er al 2015; Nag er al 2017)。表1は、LATE-NC(推奨されている3段階システムで層別化)と認知との関係に関する一次データを示している。LATE-NCに関連する神経学的特徴は、FTLD-TDP症例で見られる行動性または失語性の臨床症候群とは異なっていた(Nelson et al 2011b; Jung et al 2014; Wilson et al 2019)。TDP-43プロテインオパシーは、いくつかの認知機能障害のない被験者において記録されているが(Arnold et al 2013;Keage et al 2014;内野 et al 2015;Elobeid et al 2016;Nascimento et al 2016;Nag et al 2018;Nascimento et al 2018;Nascimento et al 2018年TDP-43プロテインオパシーは、認知機能障害のない被験者においても記録されているが、TDP-43プロテインオパシーは、認知機能障害のない被験者においても記録されている。2018これは、臨床症状の発症前に死亡した被験者における前臨床疾患を表している可能性が高い;病理学的変化に対するそのような臨床的回復力は、多くの障害において記載されている(Perkins et al 2003;Shojania et al 2003;Roulson et al 2005;Latimer et al 2017;Robinson et al 2018b)。
表1 LATE-NCステージ別に層別化された大規模なコミュニティベースの剖検コホートからの選択されたパラメータ
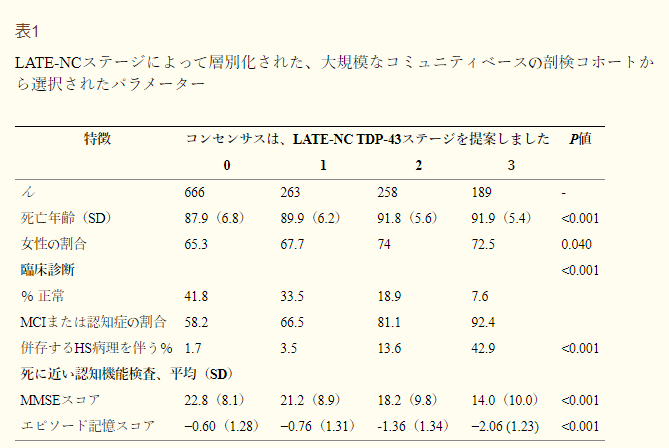
これらのデータは、Rush University Religious Orders Study(ROS)から 臨床的特徴、病理学的特徴、認知状態の特徴を示し、以前に述べたように分析された(Nag et al 2018)。海馬硬化症(HS)病理と認知機能検査を含むLATE-NC重症度(新しい推奨ステージング法で運用されている)の間の関連を強調するために、LATE-NCステージングの新しいコンセンサスガイドラインを適用した。すべてのLATE-NC病期のこれらの被験者の多くは、以前に述べたようにADNCを含む追加の病理学を有することに注意されたい(Schneider et al 2007;James et al 2016)。
MCI=軽度認知障害;MMSE=Mini-Mental State Examination。
剖検で確認されたLATE-NCとADNCの臨床的特徴には重複があるが(Pao et al 2011;Brenowitz et al 2014;Murray et al 2014;Nag et al 2017年慎重な分析により、特徴的な神経認知的特徴が同定される可能性がある。予備的な証拠は、比較的「純粋な」LATE-NC(重度の併存病理を欠く)を有する被験者は、「純粋な」ADNCを有する被験者と比較して、より緩やかな臨床的低下を示す傾向があることを示唆している(Murray et al 2014;Boyle et al 2017)。対照的に、併存するADNCおよびLATE-NCを有する者は、ADNCまたはLATE-NC単独を有する者よりも、より速い低下およびより重度の認知障害を示した(Josephs et al 2014b 2015;Nag et al 2017)。詳細な縦断的認知検査と包括的な神経病理学的評価の両方を行った研究では、LATE-NCを有する被験者は、エピソード記憶において顕著な障害を有していたが(表1他の認知領域およびグローバルな認知状態もまた、特に後期の病期において一般的に影響を受けていた(Nag et al 2015,2017,2018;Wilson et al 2019)。相関性のある研究は、言語流暢性測定などの特定の神経認知評価が海馬体積と独立して関連しているのではなく、代わりに大脳新皮質灰白質体積と相関していることを示している(Ajilore et al 2015; Pelletier et al 2017)。これに対応して、単語リスト遅延想起(海馬依存性)の重大な欠乏にもかかわらず、比較的保存された流暢な言語能力(皮質依存性)を有する被験者は、LATE-NCのリスクがあることが示されている(Nelson er al)。 )LATEにおける神経認知テストスコアのこのパターンは、ADNC単独(Nelson et al 2011b)またはFTLD-TDP(Brenowitz et al 2014)を有する被験者に見られるものとは異なる。
神経精神障害は、LATE-NCを有する一部の被験者において報告されており(Ighodaro et al 2015レトロスペクティブな横断的多施設研究では、ADNCと共存するTDP-43蛋白質障害を有する被験者において、TDP-43蛋白質障害を欠くADNCを有する被験者と比較して「激越/攻撃性」症状のリスクが増加しているという証拠を発見した(Sennik et al 2017)。しかしなが et al すべての先行研究が、LATE-NCが非アムネスティック症状と関連していることを発見したわけではない(Velakoulis et al 2009;Nelson et al 2011b;Vatsavayi et al 2014;Sahoo et al 2018)。LATEを他の変性疾患と区別する特定の神経精神医学的、運動学的、または自律神経学的徴候を調べるために、今後の調査が必要である。
LATEの公衆衛生への影響
LATEの公衆衛生への影響はかなり大きいと思われる。剖検コホートにおけるLATE-NCの認識に影響を与える2つの基本的な研究デザイン要素は、コホートの年齢範囲と研究の日付である。研究者は2006年以前はTDP-43蛋白症を認識していなかったため、それ以前の研究ではLATEの特異的な影響を評価することができなかった。LATE-NCはほとんどが高齢者にみられるが、初期の認知症の臨床病理学的相関研究(Roth et al 1966; Blessed et al 1968)では、研究対象者は70歳代前半で死亡していた。LATE-NCはすべての年齢層を含む集団研究で評価する必要がある。より最近の臨床研究では、「疑われる非アルツハイマー病の病態生理」(SNAP)が、実質的な海馬萎縮を伴うが検出可能なアミロイド-βアミロイドーシスを欠く無気力型認知障害を引き起こすバイオマーカー証拠が示されている(Caroli et al 2015;Burnham et al 2016;Jack et al 2016,2017;Abner et al 2017;Wisse et al 2018)。例えば、Mayo Clinic Study of Agingの1535人の参加者の評価では、前臨床アルツハイマー病と比較してSNAPの有病率が有意に高く、SNAPでは多病率が高くなっていた(オッズ比2.16)(Vassilaki et al 2018)。LATEは、この被験者群ではおそらく重要な寄与因子である(下記参照)。
80歳を過ぎて剖検された被験者の中で、ほとんどの研究は、脳の20%以上がLATE-NCと一致する病理学的特徴を持っていたことを示している(図4)。これらの症例の大部分には、他にも併存する病理学的特徴があったため、臨床病理学的相関(認知機能障害に対する各病理学的特徴の相対的寄与度)の測定値は、診断閾値やカットポイントの定義の仕方に依存している。剖検シリーズにおけるLATE-NCの頻度は様々であり、TDP-43免疫組織化学を用いて評価された脳の5%から50%の範囲であり、海馬硬化症病理のみを評価できる先行研究で検出された頻度の約2倍である(Leverenz er al 2002; Lippa and Dickson、 2004; Arai er al 2011; Nelson er al 2009;Nelson et al 2011b;Rauramaa et al 2011;Tremblay et al 2011;Corrada et al 2012;Zarow et al 2012;Malek-Ahmadi et al 2013;Keage et al 2014;Jellinger et al Attems。2014; Jellinger and Attems、 2015; Uchino et al 2015; Takao et al 2016; Latimer et al 2017; McAleese et al 2017; Hokkanen et al 2018; Kero et al 2018; Robinson et al 2018a)。) 病理的異常を定義するための様々な基準の適用、病理学的方法、募集戦略、およびコホートの人口統計学を含む研究デザインの違いは、すべてLATE-NCの報告された頻度の変動性に寄与する。
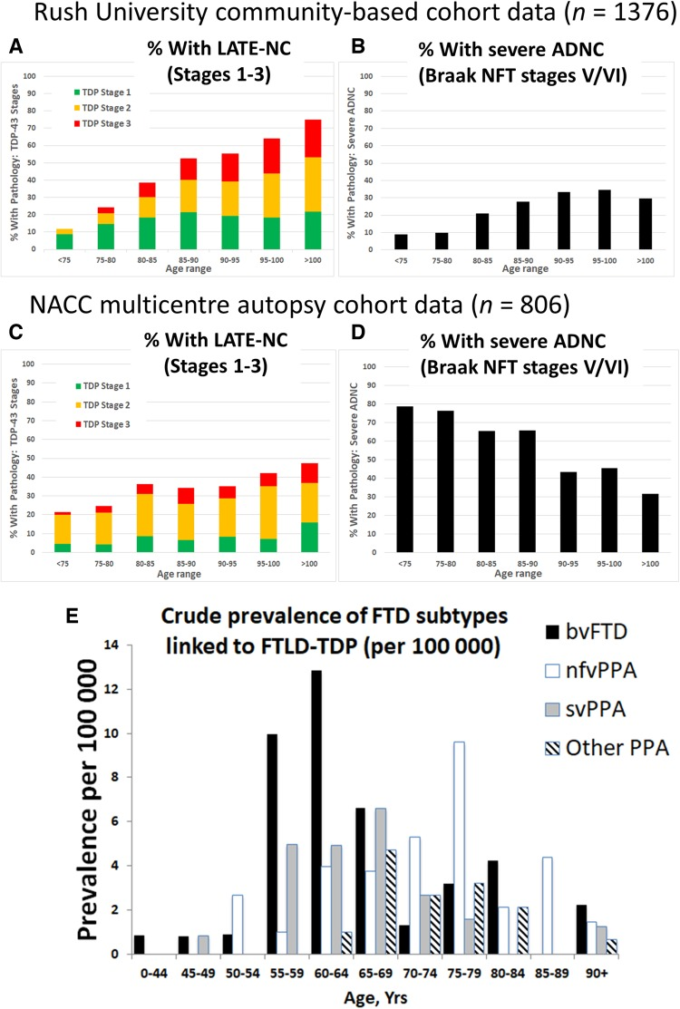
図4 年齢別に層別化された異なる神経変性疾患の病態。
LATE-NC、重度ADNC、FTD。FTD/FTLDの症例は、A-Dのデータには含まれていない。様々な疾患の有病率を推定するために公表されている研究では、重要な研究デザインが異なっていることに注意してほしい-つまり、集団ベースの剖検コホートにはFTD/FTLDの症例数が相当数ないため、Eは臨床研究(剖検なし)である。AおよびB)コミュニティベースの剖検コホート、ラッシュ大学ROS-MAPコホート(全体のn = 1376)のデータ。TDP-43病理学は、以前に記載されたように標準的な方法で運用され(Nag et al 2018その後、本論文で提案された簡略化された病期分類システムが適用された;各年齢群(年単位)のサンプルサイズは以下の通りである。<75(n = 34);75-80(n = 82);80-85(n = 192);85-90(n = 375);90-95(n = 407);95-100(n = 222);および>100(n = 64)である。この地域社会に根ざしたサンプルでは、すべての年齢群で進行ADNCを有する症例の割合が50%未満であることに注意。CおよびD)27の異なる研究センターから派生した国立アルツハイマー病調整センター(NACC)からのデータで、前述の通りである(Besser et al 2018;勝俣 et al 2018)。全体のサンプルサイズはn = 806であり、このように年齢群(年単位)によって層別化されている。<75歳未満(n = 155);75-80歳(n = 118);80-85歳(n = 165);85-90歳(n = 170);90-95歳(n = 122);95-100歳(n = 57);および>100歳(n = 19)。NACCの研究対象者は、認知症クリニックで追跡された後に剖検に来る可能性が高く、サンプルには重度ADNCを有する被験者の割合が高く含まれていた。LATE-NCを有する被験者の割合は、やはり各年齢層で20%を超えている。地域密着型コホート(A、B)と診療所型コホート(C、D)では、高齢になると重度ADNCの割合が減少する一方で、LATE-NCの割合が増加していることに注目してほしい。E)LATEとの比較のためのFTD症候群の疫学データ。FTLD-TDPと関連したFTD症候群の粗有病率のデータを掲載した。これらの臨床症候群のいくつかは、FTLD-TDPではなくFTLD-tau(bvFTDおよびnfvPPA)またはADNC(その他のPPA)を伴う症例がかなりの数である可能性が高いため、FTLD-TDP病理の実際の有病率はこれらのデータが示唆しているよりも低いと考えられる。FTLD-TDPに関連する臨床症候群の有病率はLATE-NCよりも数桁低いことに注意されたい。これらのデータは、以前に詳述した(Coyle-Gilchrist er al 2016)が、2年間にわたる多施設からの紹介から得たもので、イングランド東部のPiPPIN(Pick’s Disease and Progressive Supranuclear Palsy: Prevalence and Incidence)の集積地域を構成する英国の2つの郡で、FTDサブタイプのすべての診断済みまたは疑われる症例を同定した。PiPPINの集積地域の2つの都市はノーフォークとケンブリッジであった。診断の確認には、面接と再検査後の現在のコンセンサス診断基準を用いた。総サンプル数は、n = 986 483人であった。bvFTD=行動変型前頭側頭側頭型認知症、nfvPPA=非流暢アグラム変型原発性進行性失語症、svPPA=意味変型PPA。55歳から80歳までの被験者はFTDの最大のリスクがあり、FTLD-TDPに関連するFTD症候群の有病率は10万人あたり30人未満であることに注意してほしい(EA-Dのデータとは対照的である。
疾患の公衆衛生への影響を評価するために用いられるアプローチの一つに、帰属リスクの評価がある(Porta、 2014)。一般的には、集団における疾患の有病率に対する危険因子の影響を調べるために用いられるが(Bruzzi et al 1985この統計的手法は神経病理学的研究にも適用でき、異なる神経病理の臨床的認知症に対する相対的な影響を示すことができる。より具体的には、帰属リスクの評価は、剖検時に検出された他の一般的な脳病変と関連したLATE-NCの頻度が、認知症診断の確率とどのように関連しているかを問うことができる(Boyle et al 2019)。この分析的アプローチにより、理論的にはLATE-NCを除去できれば予防できる可能性のある認知症の割合を推定し、他の神経病理学と比較することが可能となる。Rush University Religious Orders Studyにおける帰属リスクの分析結果を表2に示す;方法は以前に詳細に記載されている(Boyle er al)。) これらのデータは、進行年齢における臨床的に診断されたアルツハイマー病認知症(すなわちアルツハイマー臨床症候群)の有意な(約15〜20%)割合がLATE-NCに起因するという仮説に適合している;その影響は、高齢者のこのグループにおけるADNCの約半分の大きさであり、その影響は血管性神経病理学の複合的な影響に類似している。
表2 ラッシュ大学の2つの加齢に関する臨床病理学的研究における研究ボランティアからの帰属リスクの統計的分析
神経病理学的指標 /帰属割合 %/ (95% CI)a
- アルツハイマー病(ADNC) 39.4 (31.5-47.4)
- 血管疾患病理b 24.8 (17.3-32.1)
- LATE-NC 17.3 (13.1-22.0)
- α-シヌクレイン症・黄体病理 11.9 (8.4-15.6)
アルツハイマー型認知症のうち、進行期における個々の神経病理学的指標に起因する認知症の割合を示す。このサンプルでは、平均死亡年齢は89.7歳(SD6.5歳、範囲65~108歳)であった。これらの解析では、多変量ロジスティック回帰モデルを用いて神経病理学的指標とアルツハイマー型臨床認知症の転帰との関連を調べ、それぞれの指標に起因する症例の割合を定量化した。方法は以前に詳細に記載されている(Boyle et al 2019)。これらのデータは、LATEの公衆衛生への影響が大きく、ADNC、血管病理、レビー小体型病理と同じオーダーであることを強く示唆している。
a95%のCIはブートストラップを用いて導出された。
b血管病理は、脳アミロイド血管症、アテローム性動脈硬化症、動脈硬化症、総梗塞などであった。
また、LATEの現在および将来の公衆衛生への影響は、この疾患のリスクが最も高い年齢層に関係している。LATE-NCは高齢者に発症する傾向があることは、後にLATE-NCとの関連が明らかになった加齢性海馬硬化症に関する画期的な研究(Crystal et al 1993年、Dickson et al 1994)以来、何十年にもわたって知られてきた。その後の複数の大規模な剖検サンプルにおいて、LATE-NCは、85歳以降の人生の各年で頻度が増加するように観察された(Nelson er al)。 これは、アミロイド-βプラークとは対照的であり、これは、すべての高齢者年齢層で一般的(被験者の50%以上で見られる)であるが、普遍的なものではなく、高齢化が進むごとに剖検でより頻繁に見られるものではない(Braak et al 2011; Nelson et al 2011a 2013; Brenowitz et al 2014; Neltner et al 2016)。LATEは、若い被験者に影響を及ぼす傾向のあるFTD症候群よりも約100倍も有病率が高いようである(Knopman and Roberts、 2011; Coyle-Gilchrist et al 2016)(図4E; y軸スケールに注意)。女性は一般的に男性よりも高度老年期まで生存する可能性が高く(Neltner et al 2016年これはLATEの生涯リスクが高くなることを意味する。それ以外では、LATEに対する感受性に強い性差または民族差を示す説得力のある証拠はこれまでにない(Brenowitz et al 2014;Murray et al 2014;Latimer et al 2017;Oveisgharan et al 2018)が、多様な集団でのさらなる研究が必要とされている。現在の関連するデータのほとんどは剖検コホートから得られたものであるため、生存バイアス(LATE-NCを有する者は高齢まで生きる)がある場合、LATE-NCの有病率は現在認識されているよりも若年者の方が高い可能性があり、臨床バイオマーカーを組み込んだより多くの縦断的研究の必要性を強調している。今後数十年の間に85歳以上の年齢層が大幅に拡大すると予測されているため(Gardner et al 2013;Nelson et al 2013年予防法や治療法が開発されない限り、LATEは将来的にはるかに大きな公衆衛生上の負担となる可能性が高いと考えられる。
LATEの遺伝学
遺伝子研究は、疾患に関連したメカニズムや将来の治療標的の可能性についての洞察を提供している。以下の5つの遺伝子(同定された年代順)は、我々がLATE-NCと呼ぶ病理学的症状に関連したリスク対立遺伝子を保有していることが報告されている。17q染色体上のグラニューリン(GRN7p染色体上の膜貫通タンパク質106B(TMEM106B12p染色体上のATP結合カセットサブファミリーメンバー9(ABCC93q染色体上のカリウムチャネルサブファミリーM調節ベータサブユニット2(KCNMB219q染色体上のアポリポタンパク質E(APOE)である(Dickson er al)。 、 2010; Pao et al 2011; Beecham et al 2014; Murray et al 2014; Nelson et al 2014,2015b; Aoki et al 2015; Katsumata et al 2017; Yang et al 2018)。) これらの遺伝子およびそれらの関連する表現型に関する要約情報については、補足表1を参照のこと。この議論のために、我々はLATE-NCではなく、発表された研究で使用されたエンドフェノタイプ(通常は海馬硬化症)を含む。
GRNおよびTMEM106Bにおける遺伝子バリアントは、これら2つの遺伝子とFTLD-TDPとの既知の関係に基づいて、対立遺伝子検査を用いて、海馬硬化症およびTDP-43プロテインオパシーリスクと関連することが示された(Baker et al 2006; Boeve et al 2006; Cruts et al 2006; Van Deerlin et al 2010)。これらの遺伝子変異は現在、LATE-NCのリスクと最も一貫して関連している。GRNと海馬硬化症との関連については、Dicksonらは、高齢者の海馬硬化症がGRN一塩基多型(SNP)rs5848のTアレルと関連していることを示した(Dickson et al 2010;Murray et al 2014)。青木らは、海馬硬化症におけるTMEM106B rs1990622のC-alleleの頻度が、海馬硬化症でない対照群に比べて低いことを報告した(Aoki er al)。 最初の研究に続いて、TMEM106B rs1990622のTアレルの各コピーに関連した海馬硬化症のリスクの増加の知見が再現された(Nelson et al 2014,2015b; Dickson et al 2015; Yu et al 2015)。
GRNおよびTMEM106Bは共にFTLD-TDPに関与していたので、LATE-NCとのそれらの強い関連は、FTLD-TDPとLATEの間の病原性重複の説得力のある証拠を提供する。メカニズムの観点から これらの遺伝子のコグネートタンパク質は、エンドソーム/リソソーム生物学において重要な役割を果たすことが示されており、これらの遺伝子産物の相互作用についての実験的証拠が存在する(Chen-Plotkin et al 2012;NicholsonおよびRademakers 2016;Klein et al 2017;Zhou et al 2017;Paushter et al 2018)。TMEM106B遺伝子は、複数の疾患に対してプリーオトロピックであるようである(Gallagher et al 2014;Ou et al 2015;Hsiao et al 2017;Cherry et al 2018;Chornenkyy et al 2019そしてTMEM106BにおけるLATE-NCリスク対立遺伝子は、健康な脳の老化に影響を及ぼす可能性がある(RhinnおよびAbeliovich 2017;Ren et al 2018)。別個の研究では、GRN遺伝子産物(グラニュリン)が炎症および創傷修復において役割を果たすことが明らかにされている(Ahmed et al 2007;Miller et al 2013)。特筆すべきことに、GRNリスクバリアントrs5848は、脳脊髄液中の炎症性メディエーター(例えば、AXLおよびCLU)の増加と関連している(Fardo et al 2017)。FTLD-TDPに関連する分子経路がLATEにどのように関与しているかをよりよく理解できるようにするためには、さらなる研究が必要である。
いくつかの異なるグループによる最近の重要な知見は、ADNCおよびレビー小体型疾患の危険因子であるAPOE ɛ4対立遺伝子が、高齢者におけるTDP-43蛋白症のリスク増加とも関連していることである(Robinson et al 2018c; Wennberg et al 2018; Yang et al 2018)。他の研究では、APOE遺伝子型と海馬硬化症のリスクとの関連は見出されなかった(Troncoso et al 1996;Leverenz et al 2002;Nelson et al 2011b;Pao et al 2011;Brenowitz et al 2014;Hall et al 2019;ただし、Farfel et al 2016を参照のこと)。APOE ɛ4対立遺伝子を有する被験者の中には、アミロイド-βプラークを持たずに高度老年期まで生存するものはほとんどなく(Saunders et al 1993; Schmechel et al 1993APOE ɛ4タンパク質がTDP-43タンパク症にどのように影響を及ぼすかは、正確には見られないままである。それにもかかわらず、大規模な研究コホートからの最近の研究は、神経変性疾患の間で共有されている病原性メカニズムの存在についてのさらなる洞察を提供している。
TMEM106B、GRN、およびAPOEにおけるリスク対立遺伝子の存在または不在は、それ自体で、または組み合わせて、所与の被験者におけるLATE-NCのリスクを自信を持って予測することができないので(Katsumata et al 2017;Nelson et al 2019疾患表現型に影響を与える他の因子が存在しなければならない。ABCC9およびKCNMB2遺伝子とLATE-NCのリスクとの関連は、ゲノムワイド関連研究(GWAS)を介して発見されたが、これは事前の機序論
的仮説に助けられるものでも偏るものでもない。ABCC9遺伝子バリアントとLATE-NCとの間の関連の発見(Nelson et al 2015bおよびMRIで検出された脳萎縮(Nho et al 2016)は、最初のGWAS(Nelson et al 2014)とは別のサンプルで報告された。ABCC9遺伝子変異体もKCNMB2遺伝子変異体も、上記以外のコホートではLATE-NCと関連していなかった。ABCC9およびKCNMB2は、カリウムチャネルを調節する役割を果たすタンパク質をコードする遺伝子である(Zarei et al 2007;Nelson et al 2015a)。ABCC9リスク遺伝子型もまた、LATE-NCにおける甲状腺ホルモン調節障害を暗示している;この遺伝子座は、甲状腺ホルモンによって誘導される遺伝子の脳内発現の変化と関連していることが見出された(Nelson er al 2016a)。甲状腺ホルモンは、最近の研究において、剖検で確定されたLATE-NCを有する被験者において調節異常であることが発見されており(Trieu et al 2018;Nelson et al 2019高いチロトロピンは、集団ベースの研究において海馬体積の減少と関連していた(Ittermann et al 2018)。SLCO1A2遺伝子とIAPP遺伝子の両方の中にあるABCC9に近い遺伝子変異もまた、アミロイドβ蓄積に不釣り合いな神経変性と関連していることがGWAS研究で発見され(Roostaei et al 2016これらの症例ではLATEを示している可能性がある。KCNMB2遺伝子は、米軍退役軍人における自殺念慮と関連しており(Kimbrel et al 2018高齢者に多いうつ病と関連している可能性がある。さらに、マウスの海馬でKCNMB2を過剰発現させると、記憶障害を回復させる(Yu et al 2018)。LATEに関与する分子経路のより良い理解と同定を可能にするためには、さらなる研究が必要である。
TDP-43プロテインオパシーおよび海馬硬化症に関する先行の遺伝学的研究は、患者の除外/除外基準、疾患の定義、および年齢構成を含む重要な点で多様であり、これは遺伝子型/フェノタイプの関連に関してそれらの異なる所見を説明する可能性がある。将来の遺伝学的発見の成功の見通しは、特異的で標準化されたLATE-NCエンドフェノタイプの開発によって改善されるであろう。FTLD-TDPは、患者の病理学的サブタイプ化が遺伝的相関研究に有益であった例を提供する:例えば、TMEM106BおよびGRN遺伝子バリアントとFTLD-TDPタイプAの病理学との間に強い関連がある(Rademakers et al 2008;青木 et al 2015)。予備的研究は、LATE-NCにおけるTDP-43型病理の形態を区別することも、遺伝的リスクに関連している可能性があることを示唆している(Josephs et al 2019)。いくつかの遺伝子型は特定の介入に対して異なる反応性を示す可能性があるため、遺伝子プロファイリングは最終的には臨床試験へのリクルート、および将来の可能性のある精密医療アプローチのための重要な考慮事項となる可能性があると我々は推測している。
LATEバイオマーカー
バイオ流体またはPETリガンドを含むLATEの最適なバイオマーカーは、疾患を定義する特徴、すなわちTDP-43蛋白質障害に特異的であろう(Steinacker et al 2018)。現時点では、バイオ流体またはPETバイオマーカーは、分子特異性のこの本質的な基準を満たしていない。また、LATEのためのPETリガンドも、近い将来の地平線上にあるようには見えない。TDP-43プロテインオパシーの細胞内位置の問題と病理学的負担の小ささは、バイオマーカーのS/N比を制限する障害となっている。
NIA-AA研究フレームワークグループは、アミロイド-βアミロイド(Aタウ(Tおよび神経変性/神経損傷(N)バイオマーカーに基づいて被験者を分類するシステムを推奨しており、これはAT(N)と呼ばれている(Burnham et al 2016; Jack et al 2016)。各バイオマーカーのカテゴリーは、陽性(+)または陰性(-)として二値化することができ、その結果、8つの可能性のあるバイオマーカープロファイルが得られる。特定のAT(N)プロファイルは、LATE-NCが存在する可能性が高いことを示す。AT(N)の’N’は、すべての病因からの累積的な脳損傷/神経変性を表しており、特定の病因に特異的ではないことを示すために括弧内に記載している。アルツハイマー病では、神経変性はタオパシーと関連しており、したがって、A+T-(N)+の被験者では、N+は共存する非アルツハイマー病の病態生理学的プロセスに起因する可能性が高いという仮定である。もし(N)+が、内側側頭部の萎縮や代謝低下などの神経変性を捉えた画像化測定によって確認された場合、非アルツハイマー病の併存疾患である可能性が高いと考えられるLATE(海馬硬化症)を暗示している。同様の論理は、A-T-(N)+プロファイルを持つ被験者にも適用され、N+はおそらく非アルツハイマー病の病理学的プロセス(es)によるものであり、(N)+測定が海馬の萎縮、または内側側頭部の低代謝であれば、LATEが関与していると考えられる(図5)。
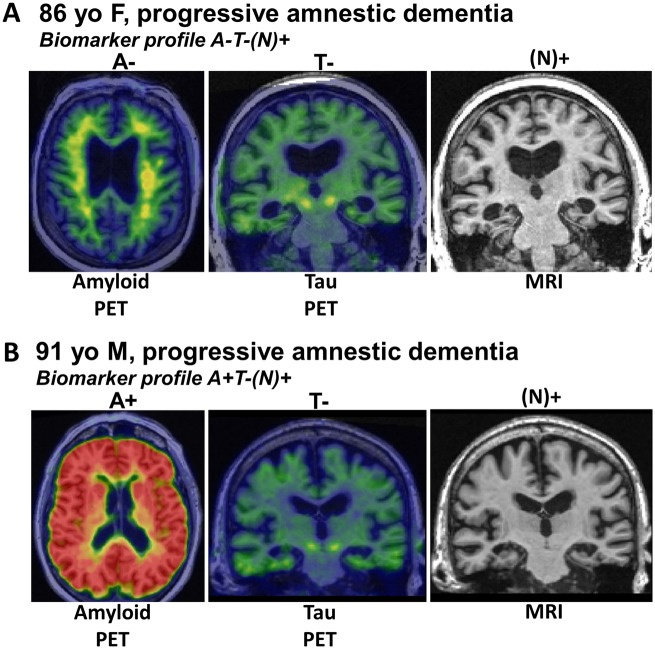
バイオマーカーは現在のところLATE-NCに特異的ではない。(A) アルツハイマー病と診断された86歳女性の画像。しかし、アミロイドβPETスキャンは陰性、タウPETスキャンも陰性、MRIでは両側内側側頭葉の萎縮が認められた。この組み合わせは「A-T-N+」とされ、生前診断では「非アルツハイマー病疑い」(SNAP)と診断された。脳スキャンから1年以内の剖検では、TDP-43病理と海馬硬化症の存在が確認され、現在ではLATE-NCと診断されている。B)もう一つの一般的なバイオマーカーの組み合わせである、認知症の91歳男性の脳内。この被験者では、アミロイドPETスキャンは陽性であったが、タウPETスキャンは陰性であった。MRIでは再び内側側頭葉の萎縮が認められた。この症例では早期ADNCと推定される早期ADNCとLATE-NCを併発しているが、これらの病態の組み合わせは、特に高齢者の脳では一般的である。
SNAPは非特異的なバイオマーカーで定義されたカテゴリーであり、先行臨床シリーズ(Jack er al 2012; Vos er al 2013; Wisse er al 2015; Burnham er al 2016; Gordon er al 2016)では被験者の約15〜30%に影響を与え、様々な非アルツハイマー病の病因を含むが、その中でも特に顕著なのはLATEである。剖検研究は、LATE-NCが他の脳病態なしに存在し得るが、一般的にADNCと共起することを示している(Jellinger、 2000; AttemsおよびJellinger、 2006; Josephs et al 2014b、 2015, 2016);バイオマーカー研究は、それらの結果と一致している。Botha et al 2018)は、タウ-PET陰性認知症がアルツハイマー病を臨床的に模倣しうることを示しており、LATEがおそらくタウ-陰性認知症の一般的な原因であることを示唆している。さらに、剖検で証明された海馬硬化症を有するLATEでは、LATE-NCを欠く剖検で証明されたアルツハイマー病症例と比較して、フルオロデオキシグルコース(FDG)PET測定値(内側側頭部代謝量に対する劣位側頭部代謝量の比)が上昇していた(Botha et al 2018)。LATE-NCは、タウ-PET陰性スキャンを受けた2人の被験者の剖検で確認されたが、いずれも下側頭部から内側側頭部のFDG代謝比が上昇していた。これらのデータは、内側側頭部の代謝低下が顕著な認知障害のあるタウ-PET陰性者はLATE-NCを有する可能性が高いという仮説と一致している。剖検所見と地域組織のT2緩和時間の死後磁気共鳴測定(Dawe et al 2014海馬の形状(Dawe et al 2011および地域皮質体積測定(Kotrotsou et al 2015)とを相関させた他の研究は、ADNCとLATE-NCの神経画像学的シグネチャーが異なる可能性があることを示している(上記参照)。LATE-NC対ADNCに関連する内側側頭葉の形状の違いは、LATEの潜在的なイメージングバイオマーカーを提供する(Dawe et al 2011; Makkinejad et al 2019)が、図3で示されているように、複数の脳領域の評価が保証されている。
累積脳損傷の非特異的バイオマーカー(N)は、LATEの文脈で有用であるかもしれない。LATEのバイオマーカーが見つからない場合は、観察された(N)バイオマーカーの大きさから 他のすべての既知のバイオマーカーの結果から予測された(N)値を差し引いた値の差が、定量的な生体内試験(生体内試験)指標となる。予測的(診断的ではないが)なLATEの指標は、他の病理学的プロセスに関するすべての既知の情報を考慮すると、観察された内側/基部側頭側頭神経変性の予想回帰の「残差」として想定することができる。最近の研究は、ニューロフィラメント軽鎖(NfL)が好ましいバイオ流体(N)バイオマーカーであるかもしれないことを示しているが(Zetterberg、 2016; Kortvelyessy et al 2018LATE(血漿または脳脊髄液)におけるNfLの摂動は、まだテストされていない。さらに、NfLのレベルの上昇は脳損傷の多くの異なる原因で起こるので、NfLは疾患特異性を欠く。
現在のところ特異的なLATEバイオマーカーは存在しないが、AT(N)システムは、AT(N)を超えるカテゴリーの新しいバイオマーカーを組み込むための拡張を可能にするように明示的に設計されている(Jack er al 2018)。LATEのバイオマーカーが検証された場合、または検証された場合、AT(N)はATL(N)に拡張され、ここで「L」はLATEの略である。最終的な目的は、バイオマーカーの組み合わせを用いた、生体内の多くの関連する脳病理の包括的な特性化であろう。将来の診断用バイオマーカーは、ADNCを中心としたものではなく、脳の老化に伴う疾患の一般的な組み合わせをより良く取り入れることができるようになるかもしれない。この概念は、補足表2に示されている。
LATEに特異的なバイオマーカーが開発されれば、最適な神経病理学的評価を開発するための継続的な努力を補完することができるかもしれない。LATE-NCは、将来的には、病期(解剖学的分布サブタイプ(特定の領域における病理組織学的パターンの違いグレード(重症度または病理学的負荷)の3つの次元に沿って評価される可能性がある。LATE-NCのサブタイプ分けやグレード分けのシステムはまだ検証されていないが、将来的には早期診断、予後の改善、治療や予防のための新たな戦略の開発に役立つ可能性がある。
アルツハイマー病とLATE臨床試験への影響
LATEの診断基準の確立と認知度の向上は、アルツハイマー病の臨床試験のデザインと解釈の指針となるはずである。ADNCとLATE-NCの併存は、年齢の上昇とともに増加しており、それぞれの病変のメカニズムは認知機能に独立した影響を与えている(Nelson er al 2010)。LATE-NCは、ADNCと共存している場合、生きている被験者の認知評価結果に対する潜在的な疾患修飾剤の効果を不明瞭にする可能性がある。疾患修飾アルツハイマー病の臨床試験における主要な転帰尺度は、当分の間、認知または機能尺度のままであろう(Cummings et al 2016;Register 2018)。したがって、LATE-NCの存在は、観察された認知転帰から推測されるアルツハイマー病特異的な治療効果の解釈を複雑にするであろう。LATEのバイオマーカーが存在するまでは、臨床試験はTDP-43プロテインオパシーを考慮してパワーを与えるべきである。
LATEは、アルツハイマー病の無症候性を模倣することができる一般的な加齢関連疾患の一つであり(Nelson et al 2013疾患修飾臨床試験の時代に臨床的疾患定義ではなく生物学的疾患定義が重要である多くの理由の一つである(Jack et al 2018)。バイオマーカーには、包含と除外の両方の役割がある。将来の疾患修飾アルツハイマー病臨床試験への被験者のリクルートの際には、臨床的特徴、遺伝学的特徴、既知のバイオマーカーを含む主要な既知の予測因子に従って層別化することが重要になるであろう。この層別化により、LATE-NCのリスクが高いと考えられる被験者を除外しつつ、ADNC連続体(Sevigny et al 2016)上の被験者を濃縮することが可能になる(Botha et al 2018)。ベースラインでの最善の努力をしたとしても、高齢の被験者の脳内で発生する疾患の多様性は、サブグループに応じた分析を必要とするだろう。これが、加齢性痴呆性疾患の臨床試験が大規模なサンプルサイズを必要とするもう一つの理由である。
アルツハイマー病に関する研究は、追加の局所的な注意事項を提供している(Gulisano et al 2018;Hunter et al 2018;Morris et al 2018)。例えば、TDP-43プロテインオパシーに関連するプロセスの性質および複雑さを根本的に誤解する危険性があり、これは、LATEの臨床診断および臨床試験にアプローチする方法に重大な偏りをもたらす可能性がある。今のところ、アルツハイマー病と同様に、誤って折り畳まれたタンパク質は疾患マーカーとなり、治療のターゲットとなる可能性がある。
LATEの予防や治療を目的とした臨床試験は、他の脳疾患との併用や単独での研究が今後の研究の大きな方向性となるだろう。このような臨床試験を最適に実施するためには、まず、特定のLATEバイオマーカーの開発が必要である。現在のところ、病気を改善する治療法を開発するためには、以下の5つの代替的なアプローチがある。(i) アルツハイマー病、レビー小体型病、LATEに共通すると思われるAPOE ɛ4などの経路や遺伝子産物に焦点を当てる、(ii) FTLD-TDPとLATEに共通するTMEM106BやGRNなどの経路や遺伝子産物に焦点を当てる、(iii) GWASで示唆されたABCC9やKCNMB2などの経路や遺伝子産物に焦点を当てる。(iv) 現在、多くのアルツハイマー病関連臨床試験から除外されているA-T-(N+)バイオマーカープロファイルを有する潜在的な研究対象に焦点を当てる;および/または(v) TDP-43凝集体を除去するための戦略またはこれらの凝集体の形成を防止するための戦略に焦点を当てる。
結論と今後の方向性
このワーキンググループの主な目標は、多くの高齢者に影響を及ぼす認知度の低い状態であるLATEに関する将来の研究を促進することであった。複数の科学分野での認知を促進し、トランスレーショナルで学際的なアプローチに焦点を当てることが重要である。
特異的な LATE バイオマーカーの開発は、科学的な優先順位の高い研究であるべきである。神経イメージングやバイオ流体を用いた感度の高い特異的なバイオマーカーが理想的であるが、他の疾患マーカーは、イメージングやバイオ流体のリスクプロファイリングの有無にかかわらず、AT(N)研究ガイドラインのような既存の指標を活用することができる。LATE患者を識別するためのバイオマーカーやその他の基準を開発することは、LATEの自然史や他の加齢関連疾患との共進化を解明しようとする観察研究を補強することになるだろう。十分な縦断的観察により、因果関係の推論が可能となり、臨床試験が実施される可能性がある。
また、さらなる病理学的研究も必要である。我々が提案するコンセンサスの病理学的分類法は、LATEについてはまだ多くのことがわかっていないため、予備的なものであると考えるべきである。病理学的サブタイピングの応用は、FTLD-TDPの文脈において有用であった(Lee et al 2017;Mackenzie and Neumann 2017;Pottier et al 2018)。現時点では、そのような基準をLATE-NCにどのように適用するか、または適用するかについてのコンセンサスはない。TDP-43の分子病理学の詳細な特徴付けが、大規模な集団代表的サンプルにおいて、脳領域を横断する異なる細胞タイプについて必要とされる。これには、TDP-43の様々なリン酸化状態、開裂断片、およびその他の翻訳後修飾の特徴付けが含まれるべきである。さらに、使用する各抗TDP-43抗体は、他のタンパク質やLATE-NCの特徴との交差反応性の可能性をin situで評価する必要がある。また、LATE-NCに関連するすべてのコ・パソロジーの有病率、TDP-43の分子構造と修飾の影響、関与する細胞タイプ、および疾患の自然史を決定することも重要になる。これらの進歩は、動物モデルの開発にも役立つであろう。
LATEの公衆衛生への影響と臨床的表現型をより明確にするためには、疫学的、臨床的、神経画像学的、遺伝学的研究の追加が重要である。さらに、LATEはより多様な集団やコホートで研究されなければならない。また、詳細な生物学的測定と剖検を行い、加齢変化の複雑さを評価できるようにするためには、経時的に、かつ高齢者層までの慎重な臨床的評価が不可欠である(Brayne、 1993)。また、LATEを持つ被験者の脳内の焦点性および拡散性の変化を決定するための生体内試験(生体内試験)およびex vivoイメージング研究も重要である。今後の研究により、LATE-NCの発生確率の増加に関連する臨床的指標や認知的特徴についてのより良い洞察が得られる可能性がある。その結果、危険因子、防御的影響、およびその他の相関関係が特定され、LATEの予防や予測に役立つ可能性がある。例えば、自己免疫疾患は、TDP-43蛋白質障害および特にLATE-NCにおいて役割を果たしている可能性がある(Miller et al 2013;Trieu et al 2018)。理想的には、将来の研究は、LATEの研究における複雑なメカニズムおよび診断または治療の可能性をより深く理解するために、従来のGWASおよび遺伝子に焦点を当てた解析をマルチオミクス研究で補完することになるだろう。
LATEに関する動物モデルと基礎科学研究は必須であるが、高齢化したヒトの脳を正確にモデル化することは困難である。TDP-43フィブリルを用いた伝達動物モデル(Porta et al 2018)またはLATE-NCを動物または細胞培養物に注入した脳からの抽出物(Laferriere et al 2019)を含む機能研究は、仮説を検定するために遺伝学的研究と組み合わせることができ、前臨床実験および仮説検定実験のために統計的な力を加えることができる。TDP-43と上流の誘因および下流の分子的帰結に焦点を当てた分子研究は、疾患のメカニズムを解明するために必要である。コ・パソロジーを考慮したモデルは現在のところまれであるが、非常に有益な情報が得られる可能性がある。最終的には、これらの共同研究が、いつの日か予防・治療戦略の成功につながることが期待されている。
