https://sashalatypova.substack.com/p/letters-from-the-underworld
2020年末、ファイザーが欧州医薬品庁(EMA)に提出した「ワクチン」のCMC(Chemistry Manufacturing and Controls)セクションの文書群、約900ページが流出し、多くのジャーナリストに送付された。この文書には、一部の審査官とEMAの上級幹部との電子メールのやり取りも含まれていた。このリークは、 British Medical Journal誌で取り上げられ、同誌はこの文書が本物であることを確認することができた。 私は、約1年後の2021年末に同僚からこれらの文書を受け取り、その多くを読み、分析に使った。私は職業柄、ファイザーの研究開発関連文書を多く見てきましたので、今回流出したものがファイザーの典型的な文書と整合性が高いことも確認できた。EMAは真偽を否定せず、一部のメールのヘッダーが変更されたことだけを述べている。
私は今、より多くのフォロワーを持ち、「コビッド・パンデミック対応」として俗に知られる世界的残虐行為を推進している犯罪カルテルの組織と疑似法的構造をより明確に理解することができた。私は、流出した電子メールが非常に重要な証拠を提供してくれると信じているので、それを再検討している。
私が読んだEMAのメールファイルには、2020年11月中旬から下旬にかけてのメールのスクリーンショットが14枚含まれている。EMAのスタッフとシニアエグゼクティブのやり取りである。私の考えでは、これらのメールは次のことを証明している。
- EMAの審査官は、承認できない危険な製品を承認するための新しい方法を考案するよう、大きな政治的圧力にさらされていた。その圧力は、米国、英国、EU政府のトップから発せられていた。
- EU委員会のウルスラ・フォンデン・ライエン委員は、ワクチン契約に関して加盟国を一つの協定に結びつけ、自国での独立した決定を先取りするために、決して果たすつもりのない約束を加盟国にした。
- EMAのスタッフがOKを出すように圧力をかけられた製品の品質には、意図的に非現実的なスケジュールを設定したため、深刻で解決できない問題があったのである。ある者は、そうすることに抵抗があり、懸念を表明した。また、明らかにでっち上げられたデータを「見過ごす」者もいた。
結局、規制当局の審査や指摘された懸念は問題ではなく、製品は関係なく販売されることになった。その理由は、規制当局がその製品を規制する権限を持っていなかったからだ。医薬品規制当局は、「対抗措置」や「製造実証」(捕虜となった米国政府とその世界的パートナーによって作られた生物兵器用薬剤を隠すコワイ言葉)として知られる軍用材料を監督することはないのだ。電子メールは、EMAのスタッフの大半がこの劇の知られざる役者であったことを示している。
英国での確認は最近出てきた。
英国の健康規制当局がコビッドワクチンの承認を否認しているのか?
ONSが自らのワクチンデータを否定したのと同じ週に、daily skepticから面白い記事を見つけた。
MHRAのFOIAへの回答に基づいている。
“コビッドワクチンと治療薬認可の決定はすべてライセンス担当大臣が行い、委任されたものではない。”
翻訳-通常、新しい医薬品を審査・承認する権限は、保健省長官(英国)からMHRAに正式に委譲されている。コビッド製品の場合、その権限委譲が存在しない。すべてマット・ハンコック氏が独断で展開したようだ(本人はもっと上の人物を指差しているが)。米国でも同様で、トランプ政権下のアレックス・アザールが米国人にこれらの不適合な生体材料を配備し、バイデン政権下のザビエル・ベセラが現在も配備を続けている。
政治的な圧力
2020年11月16日、EMAの上級管理職の間で以下のようなメールのやり取りが行われた。
ノエル・ワシオン – 副事務局長(2021年6月退任)。

Agnes Saint-Raymond – 国際部部長。

EMAのCOVID-19パンデミック・タスクフォースの議長であるMarco Cavaleri。

メールは下から上へ読むのが基本である。
3つの規制当局(米国FDA、英国MHRA、EU EMA)は、 データの正式なレビューが行われる前、諮問委員会が臨床試験結果を見て、議論し、投票する前などに、承認のタイミングを調整することに忙しくしている。 彼らは、これらの製品が市場に出るかどうかにデータは関係ないとして、そのタイミングを議論しているのである。加えて、彼らは、あたかも別々の主権国家の別々の納税者と議会/監督に責任を負う3つの機関ではなく、すでに1つのグローバル政府に統合された単なる官僚的な部門だろうかのようなやり取りをしているのだ。最後に、FDAは「アザールに押されて」(Alex Azar – 当時のHHS長官)、「トランプが糸を引いて」「EUAに突っ込む」そうだ。
多くの人が「コビッド・パンデミック対応」として組織された詐欺に何千人もの人が参加したのはなぜか、と私に尋ねる。確かに、これほど多くの人が共謀することは不可能だろう。これほど多くの人が共謀するのは不可能だ!これほど多くの人が知る必要はなかったのだ。ここで、EMAのトップであるノエル・ワシオンは、データ審査が最終的に注射剤を市場に出すかどうかに無関係であることを知らないか、巧みにそれを誤魔化している(実際、彼は知らなかったと私は思っている)。従って、彼の下にいるEMAのスタッフは意識する必要がなく、単に与えられた狭い範囲の仕事を急ぐだけである。大きな組織や複雑な構造の中で、大きな詐欺を隠蔽するためには、コンパートメント化が鍵となる。だから、彼は殺傷事件の直後に辞任・退職したのだろうか? 彼はまた、EC(欧州委員会)から承認するよう圧力を受けている。ファイザーは今、条件付き承認(CMA)ではなく、完全な販売承認(MA)を求めているのだ。注:CMAは発行されたが、ファイザー/バイオテック社はその条件を満たさないままだった。
“(Co)-Rapps” = Co-rapporteurs(共同報告者)。EMAは、これまで各国で個別に医薬品の規制・承認を行っていた加盟国の「所轄官庁」を統合して構成される欧州の組織である。欧州の仕組みでは、特定の製品ごとに技術審査チームと共同審査チームが選定される。コビッド「ワクチン」の場合、フィリップ・ジョセフソン率いるスウェーデンチームがラポータ(主査)、ジャン・ミシェル・レース率いるフランスチームがコ・ラポータ(副査)となっている。「CHMP」=Committee for Medicinal Products for Human Use(EMAの医薬品委員会)。
メールの宛先はEC(欧州委員会)のOlga Solomonで、Noelの上司であるEmer Cooke(EMAのExecutive Director、元WHOの上級幹部)がコピーされている。以下はEmer Cookeである。

ウルスラの巧妙な盟約
彼女を覚えているだろうか?

ウルスラ・ヴォンデン・ライエン – EU委員。その功績は、ファイザーCEOのアルバート・ブーラとテキストメッセージで、すべてのEU加盟国を代表して、信じられないような強引なファイザーの供給契約を交渉したことである。これらの契約では、EU諸国は国家資産を担保に入れ、品質管理、輸入、消費者保護に関する法律をすべて放棄し、国家主権を放棄しなければならなかった-すなわち、自国の議会でワクチンの責任に関する法律を変更することは許されなかった? いわゆる「ファイザーの商業的利益」を保護するために完全に編集された略奪的な契約。以下の電子メールのやりとりは、アーシュラの勇敢な努力に関連するものである。

「EC」=欧州委員会、「MS」=加盟国、「EP」=欧州議会という略語がたくさん使われている。重要なのは、ウルスラが「5条2項の使用を避けるために、関係する保健大臣を個人的に呼び出す用意がある」という一文だ。これはどういうことだろうか。Art 5(2)とは、「指令2001/83の第5条2項」、つまり、欧州加盟国がそれぞれの国で個別に与える緊急使用認可のことである。CMAは、EMAが全EU加盟国に対して同時に発行する条件付市場認可である。EUは、EUAよりもはるかに強固なプロセスであると宣伝している (強調は私が行った)。
…CMAは、緊急時使用許可にはない安全策を提供する、管理された強固な枠組みに従っている。実際には、緊急時使用承認はワクチンの承認ではなく、未承認ワクチンの一時的な使用の承認である。CMAは、すべてのファーマコビジランス、ワクチンのバッチ管理を含む製造管理、その他の承認後の義務が法的拘束力をもって適用されることを保証する […]。注目すべきは
-EUのファーマコビジランス制度を通じて、EU全域で医薬品の安全性を厳格に監視することを保証するものである。[…]
-承認後の安全性監視を確実にし、構造化された方法で追加データを収集することができる。[…].
-ワクチンや流通のためのバッチリリースを含む厳格な製造は、すべての承認済み医薬品と同じ継続的な管理の下にある。 製造工程のモニタリングにより、大規模な商業化の中で、医薬品が高い医薬品基準に従って製造・管理されていることを確認する。
EUの条件付販売許可(CMA)のもとでは、責任は販売許可証の所有者にある。製造販売承認者は、製品とその安全な使用について責任を負う。
これは理論的には素晴らしいことだ。ウルスラが加盟国の政治家に個人的に電話をかけ、腕をねじったときに約束したことである。彼らは、コビッドプロパガンダによって十分に脅かされ、自分たちを救ってくれる奇跡の「ワクチン」を待っていたのだから、腕をひねる必要さえなかったのかもしれない。問題は、ウルスラがこれらの約束を果たすつもりがなかったことだ。何しろ、医薬品に要求される安全性、有効性、製造品質でmRNA「ワクチン」を製造することは不可能なのである。ウルスラがこのプロセスで本当に必要としていたのは、「強固な」CMAを約束することによって、すべての欧州加盟国を協定で結び、自国で流通する注射に対して独立した権威を持てないようにすることであった。第5条は、各加盟国が製品を認可し、何らかの問題が検出された場合には認可を取り消す権限を持つことを意味するものであった。第5条はまた、製造者に責任放棄を与えるが、製品を強制することは不可能である。CMAのルートでは、どのMSも独立した意思決定を行うことができないため、CMAは、すべてのMSに、ファイザー、モデルナ、アストラゼネカと同じ、非常識でほとんど冗長な、とにかくすべての責任を放棄し、さらに各国が責任に関して自国の法律を変えることを禁止した契約を強制できることになるのだ!CMAのルートでは、MSが独自の決定を行うことはできず、また、そのような契約では、すべての国が自国の法律を変更することはできない。
購入者は、「ワクチンに起因し、関連し、またはその結果として生じる、あらゆる訴訟、請求、訴訟、要求、損失、損害、責任、和解、罰則、罰金、費用および経費から、ファイザーを免責し、防御し、損害を与えない」必要がある。
EMAの審査員による注目すべき主な反対意見とその欠如。
生物製剤承認申請の化学的製造管理(CMC)セクションは、規制当局による承認の主要な柱である。大量生産される医薬品や生物製剤の純度、効力、一貫性、安全性を保証するために設計された製造管理および品質管理基準(cGMP)、および一連の広範な法律と規制への適合について説明する。臨床試験で得られた安全性と有効性のデータは、製造者が規制当局や医療関係者に次のことを保証できなければ意味がない。1) 問題の製品が仕様通りに臨床試験で使用されたこと、2) 製品は一貫して製造され、純粋で高品質で再現性があり、製造工程と管理ステップが十分に特徴付けられ予測可能であること、3)試験されたものと同じ製品が 商業的に配布されること、などである。
ファイザー社の申請書のCMCセクションに問題があることが確認された。

CMCの査定員は、査定に与えられたスケジュールが、通常のスケジュールにも、加速されたスケジュールにも、すべて大差をつけて違反していることに不満を持っていた。そこで、解決策として、査定員を「追い込む」だけでよいことになった。これは、ただ一つの目的、つまり、潜在的に懸念を表明しうる人々を疲弊寸前まで追い込んで、単に諦めさせて従わせることだけが達成されたのである。結局のところ、上層部の人々は、規制当局の審査が偽の「承認」に対して何の意味も意味も持たないこと、何があろうと審査は行われることをよく知っていたのである。英国では、MHRAはこれらの注射剤を審査し承認する正式な権限委譲を受けていないことをすでに認めており、EMAもそのような権限を持っていなかったことに賭けてもよいだろう。
CMCの低レベルの審査官はこのことを知らず、非常に熱心に、そしておそらくは誠実に働いていた。11月下旬の時点で、彼らはファイザーのCMC申請に対して140以上の正式な異議を申し立てており、そこにはまだ多くの空白と情報の欠落があったのである。参考までに、通常、10-15件の異議申し立てがあると、異議申し立てが解決されるまで、医薬品の申請を進めることができなくなる。3つの主要な異議、すなわち正式なレッドフラッグについては、以下のメールに具体的に述べられている。MO#2(mRNAの完全性の欠如)については、私や他の人が広範囲に渡って書いた。以下は、審査員の一人であるEvdokia Korakianitiからのメールと、この問題と製品の有効性と安全性への影響(全く未知であり、非常に厄介な問題である可能性がある)について論じたAlexis Nolteからの回答である。

また、mRNAの分解問題については、Medicines Evaluation Board(オランダ)のSenior Biopharmaceutical Expertであり、EMAのQuality SpecialistでもあるCMC Qualityの専門家Ton van der Stappenが議論した。

と、同じくEMAのファーマシューティカル・クオリティ・スペシャリストであるBrian Dooley。

以下の画像は、同社がEMAに提出した品質評価報告書からのものである。最初の画像は、ファイザー社製品の異なるバッチにおけるmRNAの分解という、現在よく知られている問題について述べたものである。ここでは、ファイザー社から提供されたバッチ分析結果を、製造拠点別、原薬別、製品カテゴリー別に一覧にして色分けしている。原薬=製品の有効成分(mRNA単体)、製剤=脂質などに配合されている物質。mRNAの完全性は、バッチ中に検出された「完全長」mRNAの割合を示している。バッチ中の他の部分は、特性や安全性への影響が不明な壊れた断片で構成されている。規制当局は、ファイザー/バイオテック社から提供された数字をそのまま掲載しただけで、独自にチェックはしていないことに注意してほしい。

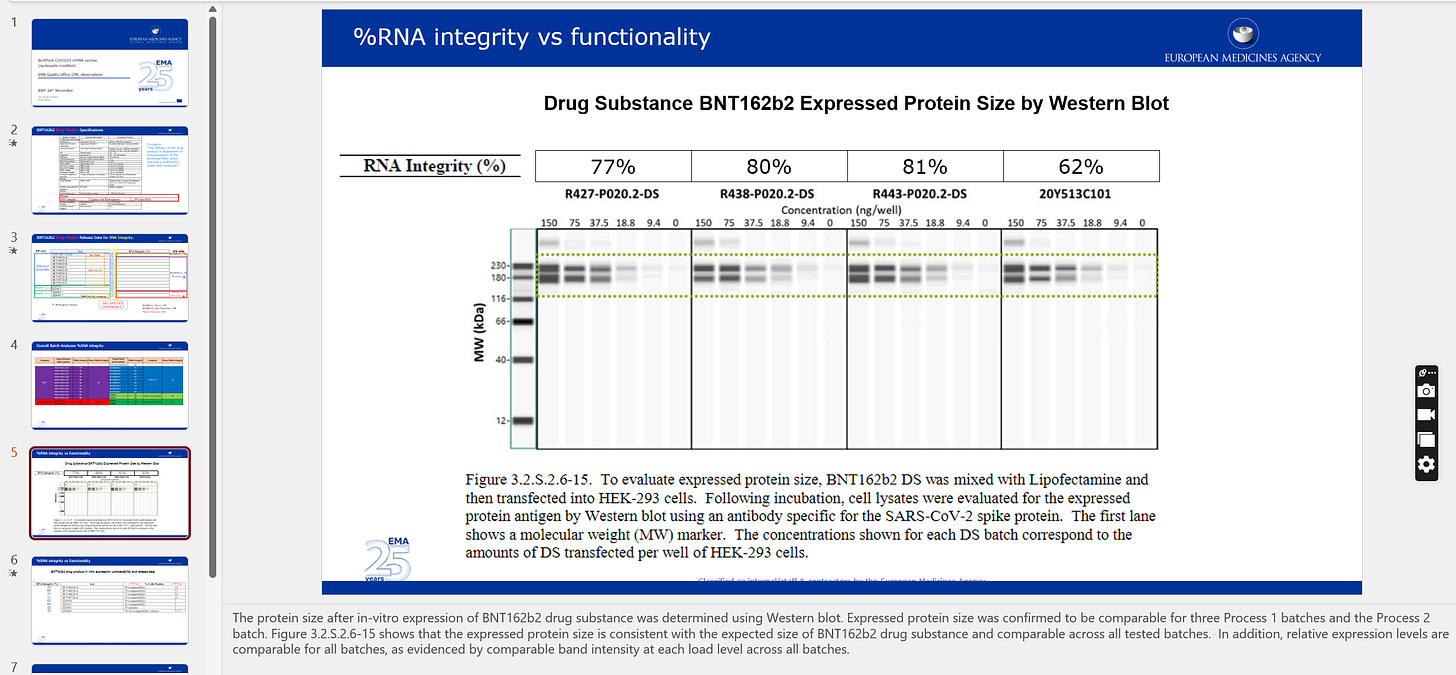
この2人の科学コンサルタントは、ウェスタンブロット結果の偽画像を確認し、受け入れたようだ
デューデリジェンスとアート
ファイザーが複数の規制当局に提出した偽のウェスタンブロット。
Jikkyleaksさんのツイート…
ファイザーがEMAに提出したもので、2020年11月24日に発表されたEMAの審査用パワーポイントに掲載されている。スライドの下の注釈を読んでほしい – 彼らはこれらの画像を本物として受け入れている。なぜ、彼らはこれに異議を唱えなかったのだろうか?その注意書きにはこうある。
BNT162b2原薬のin-vitro発現後のタンパク質サイズをウェスタンブロットで測定した。発現タンパク質サイズは、3 つの工程 1 バッチと工程 2 バッチで同程度であることが確認された。図32.S.2.6-15に示すように、発現タンパク質サイズは、BNT162b2 原薬の予想サイズと一致し、すべての試験バッチで同等である。また、すべてのバッチにおいて、各負荷レベルでのバンド強度が同等であることから、相対発現レベルは同等であることが明らかとなった。
ヴァン・デア・スタッペン博士、ドゥーレイ博士、コラキアニティさん、そしてここに紹介した人たちに、ジャーナリストはコメントを求めるべきかもしれない。
Evdokia Korakianitiが提起した回答から明らかなように、EMAの経営陣は腕を放棄し、「FDAしか見たことのないデータ」に頼ったが「楽観的」であり、FDAはmRNAの切断を「理論的懸念」と主張したのである。本当だろうか?この発言を裏付けるデータはあるのか、ナシなのか?ここに、Major Objectionsが正式に書き上げられ、その後、製品がわずか2週間後に商業的に出荷されたため、EMAによって無視されたことを示すメールがある。CMAの条件が満たされることはなかった。
EMA(あるいはFDA、カナダ保健省、MHRA、その他の規制当局)は、これらの製品に対して何の権限も持たず、無防備な一般大衆に投与されるかどうかに影響を与えることもなかったのである。最初から最後まで、すべてが劇場だったのだ。
ここでは、現在も解決されていない「3大異議点」を紹介する。

そして、ここでは、EMAの規制当局によるデータの質問や正式な評価なしに、FDAの主張を鵜呑みにして、手打ちにすることがある。

最後に言えることは、リークされた文書や電子メールを通して、この悲劇的な茶番劇を助長した約70人の人物を数えた。最も致命的な製品が、これまでにないほど多くの人々に放たれ、世界中で前例のない死傷者を出したことを「承認」したのである。おそらく、一部の例外を除いて、彼らのほとんどは2020年に騙され、戦争犯罪に参加し、致命的な詐欺に署名していることを理解していなかったのだろう。私は、彼らのほとんどが今までに知っていると信じ、彼らが自分たちが可能にしたことに十分な恐怖を感じていることを望み、これらの人々が内部告発者として前に進み、話し始めることを望む。私たちは答えを必要としている。
今日のアートピース。藤のある静物画、24×24 油彩、リネン。



