Contents
Investigating the Potential for Ultraviolet Light to Modulate Morbidity and Mortality From COVID-19: A Narrative Review and Update
オンラインで公開2020年12月23日
シェリー・ゴーマン1,*、リチャード・B・ウェラー2
要旨
COVID-19(2019年のコロナウイルス病)のパンデミックの間、研究者は、特に心血管疾患、糖尿病、および肥満などのリスクのある個人に対して、その害からの保護を提供するための低コストで入手可能な手段を模索してきた。1つの可能な方法は、安全な太陽の露出、および/または誘導された有益なメディエーター(例えば、ビタミンD)との食事の補充を介してである。このナラティブレビューでは、COVID-19に影響を与える可能性のある日光曝露および紫外線(UV)の潜在的な利点および害についての根拠および最新のエビデンスを提供する。
我々は、紫外線、日光曝露、および誘導メディエーターであるビタミンDおよび一酸化窒素、ならびにSARS-CoV-2(重症急性呼吸器疾患コロナウイルス-2)への感染によって誘導される罹患率および死亡率を調節するそれらの可能性の利点(またはそうでない場合)についての新しい証拠を提供する最近の研究をレビューする。
我々はこの研究分野に大きな関心を寄せており、すでに多くの解説やレビューが発表されていることを確認したが、これらのほとんどはビタミンDに焦点を当てており、紫外線(または日光暴露)や一酸化窒素などの他のメディエーターについてはあまり考慮されていない。
これまでに収集されたデータによると、UVAとUVBの両方の周囲レベルがCOVID-19による重症度や死亡率の低下に有益であることが示唆されているが、いくつかの一貫性のない知見もある。
現在のところ、血中25-ヒドロキシビタミンDとCOVID-19測定値との関連性は未解明であり、身体活動や個人的な日光暴露レベルなどの生活習慣因子をよりよく考慮した、より前向きなデータが必要である。もう一つの欠点は、日射量の測定が不足していることであり、それがCOVID-19の結果に影響を与える可能性があることだ。
我々はまた、太陽曝露、紫外線および誘発されたメディエーターがCOVID-19の罹患率および死亡率に影響を与える可能性のあるメカニズムについても議論している。
最後に、COVID-19とワクチン接種に対する高線量紫外線曝露の影響、ビタミンD補給の有効量と安全量など、潜在的な問題点を探る。
キーワード
COVID-19,SARS-CoV-2,紫外線、日光曝露、ビタミンD、一酸化窒素
序論
2019年12月に中国の武漢でCOVID-19(2019年のコロナウイルス病)の最初の症例が発表された。それ以来、COVID-19は世界的なパンデミックとなり、南極を除くすべての大陸で発生し、全世界で5,400万人以上の確定症例と130万人以上の死亡者(2020年11月18日、https://covid19.who.int/)が出ている。支持療法以外の治療法は(現在のところ)ほとんどないが、重篤なCOVID-19患者の全死亡率を減少させるためのコルチコステロイド(抗炎症作用を有する)などの再利用薬(1)や、複数の有望なワクチン候補などの利点があると考えられる。COVID-19の進行は3つのフェーズで特徴づけられる。まず、アンジオテンシン変換酵素2(ACE2)+鼻上皮細胞(前・症状期)がSARS-CoV-2(重症急性呼吸器疾患コロナウイルス-2)に感染する。その後、ACE2+Ⅱ型肺胞上皮細胞に感染が広がる(肺炎)。最後に、補体沈着と高炎症を伴う上皮内皮バリアの崩壊が起こる(重症COVID-19)(2)。重度のCOVID-19を発症し、致命的な転帰を起こすリスクがある人には、心血管疾患、糖尿病、高血圧および/または肥満の患者が含まれる(3-5)。このリスクの増加は、これらの慢性疾患を特徴づける低悪性度の炎症、加齢に伴う抗ウイルス免疫の低下、脆弱な組織(例えば、脂肪、心臓)におけるACE2の発現、基礎となる組織の線維化、肺機能の障害、および非医学的因子(例えば、貧困、人ごみ)と関連している可能性がある。ウイルスの疫学および進化、疾患の病態、予防および治療の側面を含む、SARS-CoV-2およびCOVID-19パンデミックの他の側面の詳細については、包括的なレビュー(6,7)
日光曝露と紫外線が心血管機能障害の予防に有益な効果をもたらす可能性があるという新たな証拠が出てきている(8, 9)。紫外線誘発性メディエーターであるビタミンDの潜在的な有益性については重要な解説があるが(以下にもレビューされている)COVID-19に対する紫外線曝露の直接的な効果についてはあまり注目されていない。結核の治療のための光線療法および日光曝露の歴史的使用(10)は、おそらく有益性があることを示唆している。ここでは、新たに得られた知見(2020年11月18日現在)を更新し、まず、低緯度地域と周囲の紫外線レベルの上昇とCOVID-19関連の転帰との間の有益な関連性、およびSARS-CoV-2ウイルスを不活化するための殺菌性UVC(254nm)放射線の能力について述べる。また、COVID-19疾患とワクチン接種の有効性の両方に対して過剰な日光暴露がもたらす潜在的な有害性についても検討しており、これとは対照的に、低レベル(非燃焼)の日光暴露が心代謝機能障害を持つ人にもたらす可能性のある有益性についても検討している。最後に、COVID-19の紫外線曝露によって誘導される「有益なメディエーター」、具体的にはビタミンDと一酸化窒素の可能性についての新しい知見をレビューする。我々は、紫外線への制御された曝露、またはこれらの有益なメディエーターを投与する介入がCOVID-19と闘うために利用され得る、抗ウイルス性、抗炎症性、および心代謝学的に有益な手段の可能性を記述している。この更新を提供するために、以下のキーワードを組み合わせたPubMedで文献検索を行った(2020年11月18日まで)。(COVID-19 OR 社会的遠距離) AND (季節、緯度、紫外線、日光、太陽光、太陽、光線療法、ビタミンD OR 一酸化窒素)。我々は紫外線と太陽曝露に焦点を当てているが、COVID-19に対するバイオレット/ブルー(400~700 nm)レッド(600~700 nm)赤外(700~1,000 nm)などの太陽スペクトル内の他の波長の光の影響もあるかもしれない(11)だけでなく、他の光ベースの治療法の予防と治療の可能性もある(12)。
紫外線、太陽曝露、およびCOVID-19
太陽光は光のスペクトルで構成されているが、そのうち紫外線成分は3つの帯域に分けられる。UVA(315-400 nm)UVB(280-315 nm)およびUVC(100-280 nm)の放射線。光のこれらの波長は大気中の酸素によってブロックされているため、すべてのUVCとほとんどのUVB(〜90%)は、地球の表面に到達していない。地球の表面(地上紫外線)に到達していない紫外線のほとんどはUVA(〜95%)であり、残りはUVBである。日焼け、皮膚がん、目の病気など、紫外線への過剰な暴露の有害な影響はよく知られており、読者は、感染症、ウイルス感染症、ワクチン接種を考慮したものを含め、人間の健康と病気に対する紫外線照射と日光暴露の影響に関する最近の包括的なレビューを参照してほしい(13,14)。本節では、日射量の指標(季節、緯度、周囲の紫外線レベルを含む)とCOVID-19との関連性の性質を記述した新たな知見をレビューし、紫外線の影響を試験中の臨床試験について説明し、日射量レベルに対する社会的距離の測定の影響に関する知見をレビューする。これらの新しい知見の「より高度な」概要については、図1を参照のこと。
図1 紫外線がCOVID-19を変調する可能性についての現在の証拠の概要
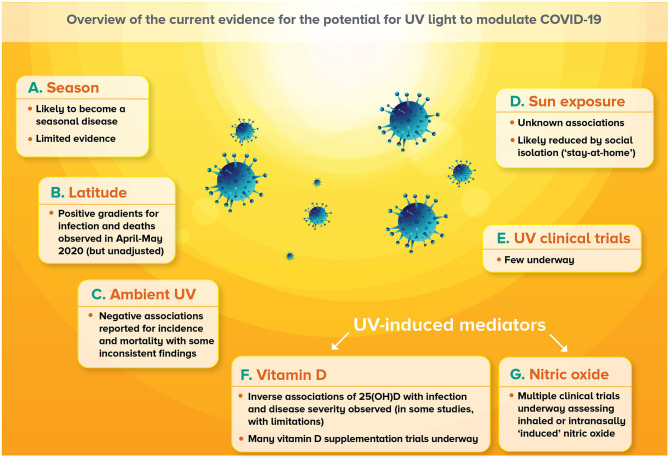
A)SARS-CoV-2への感染は季節性を確立すると予測されているが、これに関する証拠はまだ限られている。
B)2020年4月~5月にCOVID-19関連の転帰に対する正の緯度勾配が観察されたが、これらの所見は公衆衛生対策やその他の重要な因子における国全体の違いを考慮してほとんど調整されていなかった。
C)周囲のUVAまたはUVBレベルとCOVID-19関連アウトカムとの間の負の関連が観察されており、特に発生率に関しては、いくつかの一貫性のない所見が観察されている。
(D) 日光曝露とCOVID-19との関連についての情報はほとんど発表されていないが、多くの議会で実施された社会的孤立(「自宅待機」命令)が日光曝露の機会を制限していた可能性がある。
(E) 紫外線照射や日光への意図的な曝露がCOVID-19の転帰に影響を与えうるかどうかを調査した臨床試験は、現在のところほとんど行われていない。
(F) 循環中の25-ヒドロキシビタミンD [25(OH)D]レベルとCOVID-19の転帰との間に逆相関があることを示唆する証拠がいくつか出てきているが、その範囲は限られている。また、ビタミンDの補給がCOVID-19の発症率と重症度を低下させる能力を検証している臨床試験も数多くある。
(G) 吸入された一酸化窒素または一酸化窒素が化学物質の適用によって鼻腔内で生成または放出される(「誘発される」)可能性を評価する多くの臨床試験も進行中である。
季節およびSARS-CoV-2の
疾患発生率の季節的変動は、環境的、行動的、免疫学的要因によって引き起こされることがあり、これらの相対的重要性は場所や疾患によって異なる(15)。多くの感染症は、コロナウイルスによるものを含め、発生率と死亡率に季節的変動を示す(16)。コロナウイルスの季節性は、熱帯気候よりも温帯気候(季節がはっきりしていて気温の幅が広い)の方が高いかもしれない(19)。この季節性は、感染によって誘発される保護免疫の長さに影響される有効再生産数と集団レベルの感受性の変動(20)によって説明できる(17)。気温(21)湿度(22,23)紫外線(24)の自然振動は、いくつかの感染症の発生率の変動と相関している。観察研究では、季節性インフルエンザの発生率が日射量、湿度、気温に影響されることが示されている(22-24)。1918-1919年のインフルエンザパンデミックでは、米国の夏(7月)の推定UVB線量は、症例死亡率および肺炎率の低下と相関していた(25)。しかし、SARS-CoV-2感染症とCOVID-19に季節変動があるかどうか、また夏場の周囲UVレベルの上昇が保護的であるかどうかを判断するには十分な時間が経過していない(26)が、一部のモデル研究では、SARS-CoV-2感染症が2020年に北半球で冬期に発生し(27)季節的なパターンに陥ると予測している(28)。
緯度とCOVID-19
陸域の紫外線レベルは、赤道からの距離(すなわち緯度)の増加に伴って低下する。COVID-19の死亡率と緯度との間の正の勾配が2020年4月中旬に報告され、北緯35°以上のヨーロッパ諸国(主に)で死亡数の増加が観測された(29)。同様の観測は、この時期に米国でも行われた(30)。2020年4月2日までに、世界保健機関(WHO)の国別データを用いて、緯度とCOVID-19の症例(r = 0.54,p < 0.01)または死亡(r = 0.38,p < 0.01)との間の正の関連が報告された(31)。2020年4月30日までの米国と欧州の25地域から収集したデータ(32)と 2020年5月17日に88カ国から収集したデータ(33)でも、同様の知見が観察された。
これらの知見は、この期間におけるパンデミックの北部から南部への進行を示すものである可能性があるため、解釈する際には注意が必要である。さらに、これらの研究の中には、社会的遠距離戦略や感染検査率など、ウイルスの拡散を制限するために実施されている公衆衛生対策の国ごとの違いや、社会経済的地位、人口密度、都市への接続性、年齢、性別、併存疾患などの他の重要な要因を考慮していないために制限されているものもあった(34)。実際、同様の交絡因子を多変量解析に含めると 2020年3月に144の地政学的地域を対象とした世界規模の研究では、緯度とCOVID-19の症例率に関する有意な関連は観察されなかった(35)。
環境紫外線レベルとCOVID-19の発症率および死亡率
“すべての研究ではないが、ほとんどの研究で、周囲の紫外線レベルが高いこととCOVID-19の発生率が低いこととの間に「有益な」逆相関が観察されている。2020年4月までの128の国と98の州/州から収集したデータを用いて、入射紫外線レベルはSARS-CoV-2感染のピーク上昇率と逆相関しており、温度と湿度の影響は小さくなっている(28)。同様に、中国、イタリア、米国、スペイン、カナダ、オーストラリアの359地域を対象とした研究では 2020年3月23日の平均日射量(W/m2)とUV指数(UVB曝露のための赤血球加重)は 2020年3月23日の10万人あたりのCOVID-19感染者数と逆相関していた(36)。173カ国、3,235地域のデータを用いて、地表の紫外線強度レベルはCOVID-19症例の1日の増加率を減少させると推定されたが、この効果は場所ごとの社会的距離戦略によって弱められている可能性が高い(37)。米国のある州を対象とした研究では 2020年1月~3月の国内総生産(GDP)肥満率、年齢関連因子とは無関係に、紫外線指数が高いほど新規症例の発生率が低くなることも示唆された(38)。紫外線指数の上昇とCOVID-19有病率の低下との間には、日本の都道府県(39)と米国の33都市で有意な関連が観察された(40)。また、ブラジルの5都市(2020年3月~7月)で測定した感染率の低下と周囲の紫外線レベルの上昇についても、いくつかの負の関連が報告されており(41)米国の北東部および中西部(国勢調査地域1および2)の一部の郡(2020年4月~7月)で測定されていた(42)。
しかし、206の国・地域(2020年1月~4月)で収集されたデータについて、他の環境因子、GDP、世界保健安全保障指数を調整した後、7日または14日遅れのUV指数測定値とCOVID-19の発症率の間には有意な関連は観察されなかった(43)。同様に、中国の224の都市に住む人々を対象とした研究では、周囲の紫外線レベルとCOVID-19発症率(2020年1月~3月)との間に有意な関連は観察されなかった(44)。また、イランの31地域(2020年2月~3月)では、日射量とCOVID-19発症率との間に有意な関連は認められなかった(45)。最後に、インド(2020年4月27日まで)(46)およびスペイン(2020年3月~4月)では、それぞれ、日射量または日照時間のレベルがCOVID-19の感染または発生率と正の関連を示した(47)。
これまでに行われたほとんどの研究で、周囲の紫外線レベルの上昇とCOVID-19の死亡率の低下という「有益な」逆相関が検出されている。我々は、米国、英国、イタリアで実施されたトリオの研究において、平均周囲UVAレベル(衛星由来データ 2020年1月~4月に測定)とCOVID-19死亡数との間に用量依存性の相関関係を観察し、プールして、1日平均紫外線量の100 kJ/m2増加あたり0.68(95%CI 0.53~0.89)の死亡リスク比の低下を示した(48)(prelprint)。これらのデータは、ビタミンD加重太陽スペクトル(ビタミンD形成性UVB成分を除く)で補正した。ゼロインフレーション陰性二項モデルを使用し、まず最初にSARS-CoV-2に遭遇して感染する可能性(人口密度、輸送パターン、およびその人口内でのCOVID-19の有病率を考慮)を補正し、次にCOVID-19の転帰を交絡させることが知られている因子(年齢、民族性、社会経済的地位、汚染を含む)を補正した。これらのデータは、COVID-19による死亡率の減少にはビタミンDの形成とは無関係に紫外線が有効であることを示唆している。太陽光のUVB成分に対する恩恵も報告されており 2020年1月から5月にかけて、地域の天候(気温、湿度など)の他の潜在的な影響を考慮したモデリングを用いて、152カ国のデータでUV指数とCOVID-19死亡率との間に負の関係が観察された(49)。COVID-19の重症度または死亡と地域の外気紫外線レベルまたは年間平均日照時間との間には、スペイン(50)およびフランス(51)でそれぞれ有益な逆相関が観察されたが、このフランスの研究では統計的アプローチについて批判されている(52)。しかし、世界全体の多変量回帰分析において、GDPと肥満度指数は、平均紫外線指数(2019年11月~2020年4月に渡って測定)ではなく、COVID-19死亡者数(100万人当たり)の有意な予測因子であった(53)。
周囲の紫外線レベルとSARS-CoV-2の基本再生産数(R0)との間の関連の性質には不確実性がある。パキスタン(2020年4月~6月)では、UV指数とSARS-CoV-2のR0値との間に有意な逆相関が観察された(54)。しかし、中国、米国、英国の134地点(他の気象条件を調整した後)では、周囲の紫外線レベルとSARS-CoV-2のR0値との間に有意な関連は検出されなかった(55)。この観察は、中国の224の都市に住む人々を対象とした別の研究で得られた知見にも裏付けられており、環境紫外線レベルとSARS-CoV-2 R0値(2020年1月~3月)との間に有意な関連は観察されなかった(44)。これらのデータは、SARS-CoV-2の伝染性がCOVID-19の重症度への影響よりも紫外線の影響を受けにくいことを示唆している可能性がある。
上述した多くの研究の重要な注意点は、交絡因子の可能性の調整が頻繁に行われていないことであった。今後の研究でこれらの矛盾を解決するのに役立つであろう重要な交絡因子には、人口統計学(例えば、年齢、性別、GDPなど)だけでなく、地域の環境因子や気象因子、特に気温や湿度などの考慮が含まれる(28, 47, 56, 57)。実際、17の研究の系統的レビューでは、温暖で湿潤な気候の場所がSARS-CoV-2の伝播を減少させる可能性があることが確認されている(58)。しかし、これらの観察結果には論争がないわけではなく、いくつかの研究では、COVID-19の発生率に温度と湿度が非線形に影響することが報告されている(59,60)。ある研究では、気温の低下はブラジルにおけるSARS-CoV-2の2020年2月~3月の伝播を予測したが、周囲の平均日紫外線量は予測しなかった(61)。環境条件の複合効果も重要な考慮事項であり、中国全土のCOVID-19症例559グリッドセル(0.25°)を対象とした研究(2020年1月~2月)では、気温の上昇と紫外線レベルがCOVID-19の発生率の低下に関連して追加的な利益をもたらしたという報告がある(62)。他の研究では、128の国と98の州/州から収集したデータを用いて評価した場合、気温と周囲のUVレベルとの間のより複雑な相互作用が報告されている(2019年11月~2020年4月)(28)。
太陽曝露とCOVID-19
COVID-19の発症率や死亡率に個人に合わせた(アンケートや線量計による)日光曝露の影響を調査した研究はほとんどない。Asyary and Verswati(63)は、COVID-19の発症率、死亡率、回復に対する日光曝露の影響についてジャカルタ(インドネシア)からの知見を提示しており、回復と日光曝露の間に有意な相関関係が報告されている;しかしながら、インドネシアのMeterological, Climatological, and Geophysical Agency of Indonesia(63)から得られたデータであり、この研究における「日光曝露」の定義については不明である。
COVID-19に対する紫外線または日光曝露の有効性を試験した臨床試験
COVID-19関連の転帰に対する紫外線または日光曝露の効果を具体的に試験することを意図して進行中の臨床試験はほとんどないようである(ClinicalTrials.gov 2020年11月18日、キーワード:紫外線/日光曝露/光線療法(+)COVID-19で検索)。この検索で確認された1件の試験は、SARS-CoV-2の手術室環境を除染する手段としての殺菌性UVC(254 nm)の効果を評価している(NCT04443803)。2つ目の単群試験では、細菌やウイルスの負担に影響を与えるために挿管されたCOVID-19患者へのUVAの「呼吸器への適用」の能力を評価している(NCT04572399)。
社会的距離対策は太陽曝露に影響するか?
ワクチンがない場合、COVID-19の蔓延を抑制するために、社会的距離を置く手段のような非薬理学的介入が頼りにされている。これには、外出禁止令やロックダウンが含まれる。これらの命令の強さや政府による実施は、世界各地で大きく異なっている。162カ国で実施されたプレプリントの数学的モデリング研究では、ロックダウンの厳しさが「単位を増やす」ごとにCOVID-19の生育率が77%低下することが示された(64)。ロックダウン対策の日射量レベルへの影響は、その深刻度に応じて有意であると思われるが、ほとんど記述されていない。MoozhipurathとKraft(2020)の調査結果では、「最も厳しい」ロックダウン命令(すなわち、外出禁止の勧告)でさえ、UV指数の単位増加ごとにCOVID-19の成長率が17%減少し、UV指数の「保護効果」を緩和できることが示唆された。ここでの関連性は 2020年3月から4月のロックダウン期間中、ヴェローナ(イタリア)に住む肥満の子供とティーンエイジャーで観察された身体活動レベルの大幅な低下(~2時間/週)であった(65)。この年齢層では多くの身体活動が屋外で行われているため、これらの知見はまた、日射量の減少を示唆している。さらなる懸念は、これらの身体活動の減少が過体重および肥満に悪影響を及ぼし、重度のCOVID-19イベントのリスクを増加させる可能性があることである(66)。対照的に、韓国では2019年の同時期と比較して、社会的遠距離期間(2020年3月)にサイクリングネットワークの利用が増加しているという知見があり、屋外で身体活動を行う時間が増えていることを示唆している(67)。これらの異なる知見は、特定の政府が制定したロックダウンの性質と強さによって媒介されている可能性が高い。
個人の紫外線曝露に対するロックダウンの他の潜在的な影響は、大気汚染レベルの変化によって媒介される可能性があり 2020年3月から4月のロックダウン中に粒子状物質レベルが50%以上減少したインドのいくつかの都市では、太陽放射照度の増加が観測された(68)。日射量(地表に到達する日射量)は 2020年3月下旬(国家ロックダウン中)のデリー(北インド)では、太陽電池パネルが受ける紫外線の量を測定することで決定され、例年に比べて8%増加した(69)。同様に、カナール(南インド)では、ロックダウン中の日射量(ピラノメーターを使用して測定)が7%増加した(68)。メディアの報道からの逸話的証拠は 2020年4月の社会的孤立の間、インド国民は太陽の露出を求めるように勧められたことを示唆している(70)。これに関連して、「日光浴」または「ビタミンD」という言葉を使ったGoogle Trendsの相対検索ボリュームと、3月から4月のロックダウン期間中に確認されたCOVID-19の症例との間に観察された有意な相関関係があるかもしれない(r≤0.668,p < 0.001)(71)。大気汚染の減少とCOVID-19イベントに対する個人的な日光曝露を増加させるためのあらゆる推奨事項の複合効果は、まだ決定されていない。
紫外線はCOVID-19に有害または有益な影響を及ぼす可能性があるか?
消毒剤としての紫外線
紫外線は、空気中の飛沫や菌体中の SARS-CoV-2 ウイルスの生存率に直接影響を与える可能性があり、その結果、感染率が低下し、感染した人の接種体の大きさも減少し、それに伴って病気の重症度も低下する(72, 73)。殺菌性UVC(254 nm)はコロナウイルスに対して光不活化効果がある(74)。それは、食品(75)医療用空気(76)医療機器(例:光線治療装置(77))病院の廃棄物および廃水(78)個人用保護具(例:N95呼吸器(79,80))および携帯電話(81)中のSARS-CoV-2を不活化する手段として提案されている。UVCはN95呼吸器を効果的に除染する可能性があるが、時間の経過とともにその完全性や着用性に影響を与える可能性がある(82)。殺菌性UVCの潜在的な光毒性効果は重要な考慮事項であり、特に経験の浅いユーザーが家庭で使用する場合(83)、N95呼吸器の除染後に医療現場で偶発的な皮膚損傷が報告されている(84)。
UVCはSARS-CoV-2を直接不活性化する。広帯域UVC(200-280 nm)は、ガラス表面またはN95レスピレーター上のSARS-CoV-2の力価を4対数以上低下させた(85)。紫外線照射(~280 nm、37.5 mJ/cm2)は、発光ダイオードから照射された場合、10秒以内にSARS-CoV-2ウイルスの99%以上を急速に不活化させた(86)。直射日光によるウイルス不活化効果もあるかもしれない。例えば、北緯40度(1.6W/m2)の夏至を代表する模擬太陽光は、人工唾液中のSARS-CoV-2ウイルスの90%を、6-8分間の暴露後、鉄の表面に乾燥させた場合、またはエアロゾル化した場合に不活化した(87,88)。同様に、モデル研究では、ボゴタ(コロンビア;4.6°N)のような高紫外線環境下では、比較的短時間の日光暴露でSARS-CoV-2ウイルスの90%が11分で不活化することが示唆されている(89)。しかし、冬至前後のヨーロッパの多くの都市で経験されているレベルを含む低紫外線環境では、ウイルスの不活化は不可能であるかもしれない(89)。これらの知見は、他のモデル研究でもほぼ再現されている(90, 91)。殺菌効果のある UVC がより効果的である可能性があるが、遠紫外線(222 nm)UVB、UVA、可視光(400-700 nm)と赤外(92)を含む、光の他の波長の殺菌特性を持っているという証拠がある。SARS-CoV-2 の不活性化において UVA(365 nm)よりも有効であった殺菌性 UVC(254 nm)と同様の効果を得るためには、これらの波長の高用量が必要であると考えられる(93)。
紫外線量は重要な考慮事項か?
過度の日光暴露の健康被害、特に日焼け、皮膚癌、眼病を引き起こすことはよく知られている(14,94)。例えば、単純ヘルペスウイルス-1は三叉神経に潜伏し、唇や顔面に風邪のただれ(口唇ヘルペス)を形成するために再活性化する。高用量の紫外線(4×最小紅斑線量/曝露)への曝露により、太陽誘発性冷感症の既往歴のある成人(n = 20)に冷感症が誘発された(96)。この紫外線誘発性ウイルスの再活性化の背後にあるメカニズムは完全には解明されていないが、ウイルスの潜伏期間を維持するための神経節常駐型CD8+Tメモリー細胞の能力の抑制(97,98)および皮膚の神経終末への損傷と関連している可能性がある(95)。急性の灼熱量の紫外線に曝露した後、抗炎症性経路の誘導によって制御される可能性のあるプロ炎症性メディエーターの全身的誘導があり得る(13)。このプロセスは、影響を受けた各個人の基礎的な健康状態に依存している可能性が高い。例えば、多くの乾癬患者にとって、(多くの場合、日焼けしない用量の)紫外線への曝露を含む光線療法による治療は有益であると考えられ、自然免疫経路および適応免疫経路を調節し、皮膚の炎症を抑制することにより、皮膚プラークの重症度を減少させることができる。しかし、低線量でも高線量でも、紫外線は皮膚を傷つけ、一部の患者では乾癬を引き起こす可能性がある(13)。また、感染の可能性のあるリスクと、これらの治療法の潜在的な免疫抑制効果に関連する懸念から、パンデミック期間中の皮膚科クリニックでの光線治療装置の使用を制限するように求める声もある(99)。興味深いことに、生物学的製剤、腫瘍壊死因子(TNF)などの特定の炎症性タンパク質を標的とすることにより乾癬の治療に使用される他の免疫修飾剤は、COVID-19のリスクを増加させる可能性がある。イタリア在住の関節乾癬患者(n = 1,193)では、生物製剤の使用はCOVID-19感染(OR 3.4 95%CI 2.2-5.7)および入院(OR 3.6 95%CI 1.5-8.6)のリスクを増加させたが、死亡(OR 0.4 95%CI 0.0-6.6)のリスクは増加しなかった(100)。光治療は全身の炎症性サイトカインの発現を減少させることもでき、ナローバンドUVB放射(〜311nm)は乾癬患者の血中CRP値を低下させる(101)。紫外線がウイルス特異的なT細胞応答を低下させる可能性があることから、高用量の紫外線照射はCOVID-19の感受性を高める可能性があるが、紫外線とウイルスの曝露が発生するタイミングが重要な決定因子となる可能性がある。Cherrieら(48)(上述)の観察研究では、COVID-19による死亡のより大きな減少は、より低いベースラインレベルからの紫外線曝露の増加と関連していた。この効果は環境紫外線の増加に伴って減少しており、COVID-19死亡率の減少に関連する紫外線のレベルには上限があるかもしれないことを示唆している。
皮膚の色とCOVID-19
米国の黒人系アメリカ人とラテン系アメリカ人のコミュニティ(102)と英国の黒人系イギリス人とアジア人のコミュニティ(103)は、COVID-19の影響を不均衡に受けている。これは既存の健康と社会的格差(102)を部分的に反映しているが、黒人、アジア人、少数民族(BAME)の医療従事者の割合が白人の同僚の2倍以上であること(104)は、皮膚の色自体が一因である可能性を示唆している。皮膚は外部環境と人間の生物学的恒常性との間のバリアであり、皮膚の色は、ホモ・サピエンスが世界中に分散していたときに遭遇した様々な入射環境の紫外線に対する進化的な適応である(105)。皮膚科のヨーロッパ中心のバイアス(106)は、紫外線皮膚研究の焦点を淡い色素沈着の皮膚の過剰な露出に起因する問題に主に焦点を当てる結果となった。色素の濃い皮膚の過少露出に関連した対照的な全身的な健康問題は、あまり注目されていない(8)。我々は、アフリカ系アメリカ人が白人よりも紫外線曝露で血圧が低下することを実証している(107)とビタミンD合成は、より色素沈着の多い皮膚を持つ個人のUVB曝露後に減少する可能性がある(108)。より色素沈着した皮膚を介した紫外線の伝染性の低下(109, 110)は、COVID-19死亡率の紫外線による減少は、肌の色が薄い同胞と地理的に同居している人よりも肌の色が濃い人の方が少ないことを示唆している。
日光への曝露は効果的なワクチン接種を阻害する可能性はあるか?
日光への曝露がワクチン接種の効果を低下させる可能性が検討されていたが、この問題を取り上げた研究は限られており、特にヒトを対象としたものはない(94, 111, 112)。紫外線による免疫抑制は、記憶に基づく免疫反応を低下させ、ワクチンの有効性を損なう可能性がある(111, 113)が、曝露量は重要な考慮事項である。例えば、太陽シミュレートされた光の非燃焼用量(週3回;「回復期」の4週間は標準紅斑量の1.3倍、その後8週間は週1回)では、ベースライン時と4週間後にワクチン接種を行った場合、抗B型肝炎表面抗原特異的抗体のレベル(12週間後に測定)は変化しなかった(114)。HartとNorval (112)は最近、紫外線に曝露した皮膚から送達されたワクチンが免疫応答を誘導する能力について検討し、紫外線によるワクチン効果の低下は可能かもしれないが、紫外線曝露の効果の持続性、およびワクチン接種に最適な皮膚部位を決定するためには、より多くの研究が必要であると結論付けている。
心血管障害者への効果は?
COVID-19パンデミックを通して、重篤なイベントのリスクを軽減するために心代謝機能障害を制限するのに役立つ食事の改善、身体活動と睡眠の増加、および制御された日光への暴露を含む生活様式の介入が求められていた(115)。以下では、心代謝性合併症を有する患者における重度のCOVID-19のリスクを増加させる因子およびメカニズムを説明し、紫外線への曝露がリスクを有する患者にとって有益である可能性のある手段を説明する。
COVID-19と心代謝性合併症
重症度および死亡リスクの増加は、心血管疾患、糖尿病、高血圧および肥満を含む心代謝機能障害を特徴とする複数の慢性疾患全体にわたって報告されている(3-5)。これらの知見は、インフルエンザ(または他の呼吸器系)感染症と心臓発作のリスク増加との関連を想起させるものである(116)。例えば、システマティックレビューおよびメタアナリシスからの所見では、肥満のある個人ではCOVID-19による入院(OR 2.1 95%CI 1.7-2.6,19研究)および死亡(OR 1.5 95%CI 1.2-1.8,35研究)のリスクが増加することが示唆されている(4)。同様に、高血圧(OR 2.4 95%CI 1.5~3.8)および心血管疾患(OR 3.4 95%CI 1.9~6.2)のリスク増加が7研究のメタアナリシスで観察された(117)。その他の関連する危険因子としては、性別(男性)(118,119)年齢(高齢)(120)民族性(121)などが挙げられる。しかし、多嚢胞性卵巣症候群の女性は、心代謝性合併症のリスクが高いため、COVID-19のリスクがあるサブ集団である可能性がある(122)。肥満のある若年成人も、肥満ではない同年齢の人と比較してリスクが高いかもしれない(123)。ロックダウンイベントは、COVID-19が既存の不平等、人種的不平等、および肥満のスティグマを悪化させる可能性が高く、代謝機能障害および肥満と共存する人々により深刻な影響を及ぼす可能性がある(124)。
心代謝性疾患とCOVID-19の重症度リスクとの関連を説明する可能性のある様々な交差するメカニズムが仮説として立てられている。これらの疾患の多くを特徴づける低悪性度の炎症は、SARS-CoV-2感染の2週目に起こるサイトカインストームを悪化させる可能性がある(125, 126)。過度の酸化ストレスおよび免疫(特にナチュラルキラー細胞などの自然細胞活性)およびプロ炎症性経路(マクロファージ、T細胞、B細胞を含む)の障害は、重度のCOVID-19に対する感受性を増加させる可能性がある(126,127)。SARS-CoV-2のACE2受容体は、脂肪組織および他の関連組織[例えば、心臓周皮細胞、膵臓β細胞(128)]によって高度に発現しており、脂肪組織はウイルス感染の潜在的なリザーバーである(125,126)。ウイルスの侵入は、既存の内皮機能障害を介して促進される可能性がある(129)。興味深いのは、剖検したCOVID-19患者の61%(n = 39)の心臓からSARS-CoV-2が検出されたという観察結果である(130)。クレアチニンキナーゼ、アスパラギン酸アミノトランスフェラーゼ、心筋トロポニン1などの心代謝機能障害のマーカーの血中濃度の上昇が、COVID-19で死亡した患者では回復した患者と比較して検出されている(131)。これらの観察は、心筋細胞壊死、高血圧、冠動脈プラーク不安定性など、COVID-19によって誘発される心血管疾患の合併症と関連している可能性がある(131)。肺機能の低下;既存の肺損傷(肺のリポフィブロシスを含む)(132);膵β細胞機能の障害(131);機械的換気に対する反応性/能力の低下;線溶能および肺灌流の障害;内分泌機能の異常;および腸内環境異常(133,134)。リスクの増加に関連する非医学的要因には、貧困および過密な住宅事情があり、社会的隔離を推奨する個人の能力を低下させ、ウイルスの拡散を促進する可能性がある(125)。
紫外線が心代謝機能を改善する可能性のある手段
我々は以前に、光動員にリンクされている紫外線曝露による皮膚の貯蔵から循環への一酸化窒素のの心血管および代謝への利点があることを実証している(135, 136)。全死因死亡率は、紫外線曝露の増加(137)と、特に血管死亡の減少(138)に関連している。環境紫外線レベルは心筋梗塞(139)および血圧と逆相関しており、この効果は黒人よりも白人の方が強い(107)。COVID-19による死亡は黒人および少数民族で顕著に多く、これは肌の色が濃い人では紫外線の恩恵が弱まることに関係しているかもしれない(107)。糖尿病やメタボリックシンドロームの発症の季節変動や、太陽を求める行動をとる人々における同様の保護効果は、同じ紫外線駆動メカニズムによって駆動されている可能性がある(140)。我々の前臨床研究では、低用量(2-3分、非燃焼)の紫外線への定期的な暴露は、肝臓脂質レベル、耐糖能、インスリン感受性および脂肪率に有益な効果を持つ、高脂肪食を与えられたマウスの代謝機能障害を抑制することを示している(135,141,142)。血糖コントロールは、COVID-19による長期入院、集中治療室の必要性、および死亡を回避するために重要であるかもしれない(143)。
低用量紫外線の代謝的利益のいくつかは、皮膚からの一酸化窒素の光移動を介して媒介された(135,141,142);しかしながら、神経内分泌経路に影響を与える分子(144)および紫外線の抗炎症効果を媒介する分子を含む他の媒介物質の役割があると考えられる(142)。紫外線は、低用量の紫外線に曝露された雄雌両方のマウスにおいて、体重、脂肪量および脂肪率が制限された状態で、雄雌両方において心代謝的な利点を有する可能性が高い(135,141,142,145)。同様に、ナローバンドUVBへの長期治療(n = 3,229)は、白斑の男女ともに心血管系イベントおよび脳血管系イベントのリスクを減少させた(セッション数が少ない、またはない場合と比較して)。韓国の女性では、男性よりも女性の方が関連が有意であったが(146)すべてのイベントでHR 0.64,95%CI 0.52-0.78,n = 9,687)心血管系および脳血管系イベントのリスクが減少した。日光暴露は血中コレステロール値にも効果があると考えられ、特定された4つの介入研究のうち2つの研究では、日光暴露を増やすようにアドバイスを受けた人でLDL-コレステロール値が低下していた(101)。ここで重要なのは、これらの研究では屋外活動が交絡因子となる可能性があるということである。我々はまた、代謝の健康を改善するための身体活動と紫外線の複合効果において相乗的な相互作用を観察しており、低用量の紫外線に曝露した後、ランニングホイールにアクセスさせたマウスの褐色脂肪組織において、肝臓のステアトーシスが減少し、代謝および免疫経路に対する有益な効果が観察されている(147)。また、屋外での活動は、紫外線への曝露に反応して身体活動とビタミンDの皮膚産生が複合的に作用し、ビタミンDの状態を改善する手段である可能性を示唆する解説者もいる(148)。
サイトカインストームを乗り切る?紫外線への曝露によって生成される有益なメディエーター
COVID-19の関連する特徴の一つは、発病後2週目に発生することがあるサイトカインストームである。他の関連事象は、腹痛、心機能障害およびショック(149)を特徴とする、高齢の子供に記載された川崎様疾患(すなわち、子供の多炎症性症候群;MIS-C)のような、まれな炎症性疾患である可能性がある。一酸化窒素(上記のように)およびビタミンDを含む、紫外線への曝露(13)に応答して産生される抗炎症性メディエーターのカスケードが、COVID-19サイトカインストームおよび誘発された炎症を潜在的に防止するために協働して作用する可能性がある。実際、紫外線(およびそのような誘導メディエーター)への曝露は、インターロイキン-6(IL-6)およびc反応性タンパク質(101,127,142,150)を含む、COVID-19サイトカインストームイベントに連結された循環性プロ炎症性サイトカインを減少させる可能性がある。重要なことに、IL-6(70pg/mlを超える)レベルの上昇および他のサイトカイン(性、年齢、民族、合併症を多変量に調整した後)は、ニューヨーク(米国)でCOVID-19のために入院した患者の生存率の低下(HR 2.47,p < 0.0001)と関連していた(151)。以下にさらに詳細に述べるように、紫外線誘発性メディエーターであるビタミンDおよび一酸化窒素は、直接的な抗ウイルス効果を有し(143,152,153)ミトコンドリアの機能を促進して活性酸素種の形成を制限し、レニン-アンジオテンシン-アルドステロン系(RAAS)を調節して、SARS-CoV-2の病因を潜在的に制限する可能性がある(154)。実際、高齢者における重度のCOVID-19のリスクの増加は、加齢とともにこれらのメディエーターを産生する能力が低下していることと関連しているかもしれない(155)。以下では、新しい知見および紫外線誘発性ビタミンDおよび一酸化窒素が重度のCOVID-19イベントのリスクを減少させるために有益であるかもしれないより具体的なメカニズムをレビューする。
ビタミンDとCOVID-19
皮膚のUVB放射への曝露は、前駆体である7-デヒドロコレステロールからのビタミンD合成に必要である。肝臓と腎臓(および全身の細胞内)でのさらなる化学変換により、25-ヒドロキシビタミンD [25(OH)D; 血中のビタミンDの状態を定義するために使用される)と1,25-ジヒドロキシビタミンD [1,25(OH)2D]が形成される。古典的には、活性ホルモンである1,25(OH)2Dは、ビタミンD受容体(VDR)との相互作用を介して細胞レベルで作用し、次いで、ゲノム(または核)調節のためのゲノム(主にプロモーター領域)全体のビタミンD応答エレメントに結合したレチノイドX受容体とのヘテロ二量体を形成する[(156)でレビューされている]。また、1,25(OH)2Dが遺伝子発現を調節する非ゲノムシグナル伝達経路も存在する。ビタミンD補給がCOVID-19の重症度を調節する可能性については、すでに多くの解説が発表されており、少なくとも70件のレビュー、解説および見解がPubMedに掲載されている[2020年11月18日現在; 例えば、(158-160)]。一部の研究者は、ビタミンDの補充がCOVID-19に有益である可能性が高く、これまでに得られたエビデンスは、生物学的システムにおける因果関係についてのヒルの基準を満たしていることを示唆している(161)。ビタミンDには、抗ウイルス作用、免疫調節作用、および心代謝作用が幅広く認められており、これはCOVID-19との闘いに役立つ可能性がある。これらには、以下が含まれる:抗菌薬(カテリシジン、ß-デフェンシン、ヘプシジン)の誘導;肺サーファクタントレベルの調節;内皮細胞機能;オートファジー(標的となる細胞内病原体);生得的サイトカイン(例えば、IL-1ß)の調節;プロ炎症性サイトカイン産生の阻害(例えば、IL-6,TNF);および過活動性T細胞応答の調節(158,161)。以下では、ビタミンDの作用機序の可能性のある保護機構の詳細、血中25(OH)DとCOVID-19との関連性に関する新しい知見のレビュー、ビタミンD補給とこの分野における臨床試験の問題点について述べる。また、ビタミンDとCOVID-19の分野ですでに発表されている多くの解説書のレビュー(162)も掲載されており 2020年6月16日までに発表された先行研究の包括的な詳細と 2020年9月27日までに発表された研究の包括的なレビュー(161)も掲載されている。
想定される作用機序
ウイルスの侵入は1,25(OH)2Dによって制限されるのか?
活性代謝物である1,25(OH)2Dの抗ウイルス効果は報告されており、気管支上皮細胞による抗菌ペプチド産生と関連している(163, 164)。これらの効果は、1,25(OH)2Dの比較的高用量(100 nM)で、循環レベル(pMの範囲内)と比較して観察された。これらのレベルは、食事性ビタミンD補給では達成できないかもしれず、おそらく、1,25(OH)2Dの非血糖性アナログ(カルシポトリオールのような)のための可能な利点を考慮する必要がある。新しい知見は、鼻上皮細胞で増殖したSARS-CoV-2の力価が、その後の比較的高用量の1,25(OH)2D(すなわち、10μM)の処理によって有意に減少したことを示唆している(165)。Arboleda Alzateら(166)は、より生理学的に関連する用量の1,25(OH)2D(0.1 nM)が、マンノース受容体をダウンレギュレートすることにより、マクロファージへのデングウイルスの侵入を制限することを観察した(166)。興味深いことに、カルシトリオール[1,25(OH)2D]を「より高い」用量(20 nMから)で投与すると、リポ多糖類(LPS)で処理した微小血管内皮細胞においてACE2の発現が増加した(167)。SARS-CoV-2感染症に対する1,25(OH)2D治療の試験管内試験および生体内試験での抗ウイルス効果を様々な用量で決定するためには、さらなる研究が必要である。
COVID-19の重症度を低下させるためにビタミンDによって制御される可能性のある免疫系およびその他の経路
他の研究者は最近、ビタミンDがSARS-CoV-2感染の影響を制限する可能性があるとする様々な方法を検討している。その中には、オートファジーやアポトーシスを調節したり、サイトカインの過剰産生を抑制したり、ウイルス感染によって誘発される肺損傷を制限したりする能力が含まれている(168-170)。ヒト免疫不全ウイルスに感染している人では、レトロウイルス治療中にビタミンDがアジュバントとして作用する可能性があり、いくつかのVDR対立遺伝子はヒト免疫不全ウイルス感染の感受性を高めている(168)。また、ビタミンDはインターフェロン(IFN)と効果的に結合してSARS-CoV-2感染を制御し、ビタミンDはC型肝炎ウイルスやライノウイルスとの感染時にIFN刺激遺伝子の発現を調節するという仮説もある(171)。ビタミンDは、気管支上皮細胞による増殖を制限し、自然炎症反応(例えば、マトリックスメタロプロテアーゼの発現を減少させることにより)を減少させる可能性があり(153)上皮バリアの完全性に潜在的な利点を有する(170)。ビタミンDは、T調節細胞の活性を促進し、樹状細胞がTh1およびTh17細胞を含むエフェクター/プロ炎症性Tヘルパー(Th)細胞サブセットを活性化および拡大する可能性を減少させる可能性がある(153)。他の作用機序としては、ビタミンDが肺や腸内細菌叢を調節する能力、線維化や老化を抑制する効果(例えば、Klotho-pathwayを介して)などが考えられている(170)。Berthelotらは、STING(インターフェロン遺伝子刺激因子)経路のダウンレギュレーションおよびIFNßの産生を介したMIS-Cおよび血栓性凝固症を含むSARS-CoV-2感染症のいくつかの症状に対して、1,25(OH)2Dが有益である可能性があると仮説を立てた(172)。現段階では、これらはビタミンDが有益であると考えられる経路であるが、COVID-19ではまだ実証されていない。
ビタミンDが心代謝に有益であると考えられる調節機構
ビタミンDが心代謝系の健康に有益な効果を発揮するメカニズムを明らかにするために、様々な前臨床実験が行われてきた。我々は以前に、ビタミンDが代謝性健康に有益であると考えられるメカニズムについてレビューしたことがある(140, 173)。ここでは、食事性ビタミンDまたは1,25(OH)2D/関連代謝物を用いた治療が心血管の健康を調節しうる経路のいくつかをレビューする。
食事性ビタミンD
食事性ビタミンDは心臓の細胞に直接影響を与え、炎症を抑制し、脂肪の蓄積を防ぎ、コレステロール経路を調節することで、心血管系の健康を改善する可能性がある。ビタミンD欠乏ラットの心臓では、心筋細胞の増殖が増加し、心筋細胞増殖のドライバーとして知られているc-Mycタンパク質の発現量が高くなっていた(176)(177)。冠動脈再狭窄(動脈の異常狭窄)を有するマイクロスワインにおいて、食事性ビタミンD3は循環性炎症性サイトカイン(TNF、IFNγ)の発現を減少させた(178)。ビタミンD欠乏性高コレステロール血症食は、心外膜脂肪組織におけるNF-κB(活性化B細胞の核因子κ-軽鎖-エンハンサー)活性化を増加させ、豚のアテローム性プラーク形成を促進した(179)。ビタミンD欠乏マウスの大動脈根では、小胞体ストレスを伴うM2型マクロファージの数が増加し、より多くの脂肪蓄積が検出された(180)。最後に、食事性ビタミンDは、調節性Insig-2/sterol regulatory element-binding protein 2経路の活性化を介して、コレステロール合成を修飾する酵素経路を調節することにより、循環するトリグリセリドおよびLDL-コレステロール値を抑制する可能性がある(181)。
活性な1,25(OH)2D
活性型ビタミンD代謝物/ホルモンである1,25(OH)2Dは、オートファジー、哺乳類のラパマイシン標的(mTOR)およびß-カテニン経路、アポトーシスおよび内皮修復を調節することにより、心臓の健康に利益をもたらす可能性がある。心筋におけるオートファジーは、AMP活性化プロテインキナーゼのリン酸化が増加し、mTORのリン酸化が減少した1,25(OH)2D処置によって正常化された(182)。1,25(OH)2D による mTOR リン酸化の減少は、心臓オートファジーの亢進と ß-カテニン/T 細胞因子/リンパ球エンハンサー因子/グリコーゲン合成酵素キナーゼ 3ß/mTOR 経路の阻害とも関連していた(183)。mTORとß-カテニンは両方とも心臓の病態生理の中心的なメディエーターであり、グリコーゲン合成酵素キナーゼ3ßは心臓肥大のネガティブな調節因子である。1,25(OH)2Dはまた、SIRT1酵素(NAD+依存性タンパク質脱アセチル化酵素)の発現を増加させ、PARP(DNA損傷センサー)の発現を阻害することにより、心筋細胞のエネルギー代謝を改善する可能性がある(184)。1,25(OH)2Dを投与したラットの心臓では、循環乳酸脱水素酵素やクレアチンキナーゼなどの糖尿病性心筋症のマーカーと同様に、アポトーシスの徴候の減少(Fas、FasLレベルの低下)が観察された(185)。1,25(OH)2Dはまた、1,25(OH)2Dを注射したラットの大動脈で検出されたミオシン軽鎖の平滑筋アイソフォームのタンパク質の増加により、内皮修復を促進する可能性がある(186)。
その他のビタミンD代謝物
パリカルシトール(1,25(OH)2Dの低カルシウムアナログ)は、心臓における線維化(187)炎症(188)および酸化ストレスのマーカーを減少させる1,25(OH)2Dと同様の有益な効果を有する可能性がある。これらの効果には、NADPHオキシダーゼおよびスーパーオキシドジスムターゼの酵素活性の低下(189)、および心臓コレステロールレベルの低下(190)、ならびに血清および心臓アディポネクチンレベルの上昇(190)が含まれていた。アポリポタンパクE/-マウスに25(OH)D3(胃内投与)を投与した場合、高カルシウム血症を引き起こすことなく、アテローム性動脈硬化性病変の減少が観察されたが、同時に制御性T細胞を増加させ、病変部の成熟樹状細胞を減少させた(191)。これらの調節性T細胞を抗CD25モノクローナル抗体で中和すると、動脈硬化の徴候が増加した(191)。
ビタミンDとレニン-アンジオテンシン-アルドステロン系(RAAS)経路
ビタミンDによって制御される重要な経路の一つにRAASがある。これはCOVID-19にとって潜在的に重要であり、RAASの過剰活性化の間、ACE2ウイルス侵入受容体が重要な制御的役割を果たしている可能性が高い(192)。さらに、微小血管内皮細胞によるACE2発現を増加させるカルシトリオール[1,25(OH)2D]の能力(167)は、SARS-CoV-2感染性およびCOVID-19によるRAASの調節に意味を持つ可能性がある。上記のように、1,25(OH)2Dは、試験管内試験(20 nMから)およびLPS処理ラットの肺内皮細胞(167)ラット脳および微小血管細胞において、ACE2の発現を増強した[1μM 1,25(OH)2D](193)。逆に、アルファカルシドール[1,25(OH)2Dのアナログ]を投与したラットの腎臓では、ACE2 mRNAレベルが低下した(194)。レニンはRAASカスケードを開始する酵素である。RAAS経路の調節障害は高血圧と関連しており、線維化、炎症、心不全、加齢、糖尿病性障害など、心臓および代謝機能に多くの悪影響を及す(195)。この経路の重要な構成要素には、アンジオテンシノーゲン(アンジオテンシンIを形成するためにレニンによって切断される)レニン受容体およびACE(アンジオテンシン変換酵素、アンジオテンシンIをアンジオテンシンIIに切断する)が含まれる。ビタミンD欠損マウスの膵島では、レニン、レニン受容体、ACE、アンジオテンシンII 1型受容体を含むこれらの成分のいくつかの発現が増加していることが観察された(196)。高脂肪食を与えたビタミンD欠乏成人LDL受容体-/-マウスでは血清レニン活性が亢進していたが、ビタミンD補給によりこれらの観察は逆転した(180)。仮説(197)ではあるが、RAAS上の食事性ビタミンDのこれらの調節効果がCOVID-19の負の影響を軽減するために有益であるかどうかはまだ不明である。
ビタミンDの状態とCOVID-19
ビタミンDの状態[25(OH)Dの血中濃度]とSARS-CoV-2への感染、またはCOVID-19による罹患率/死亡率との関連を報告している研究には、以下のものが含まれる。(i) ヨーロッパのいくつかの国の平均的な “国内 “ビタミンDステータス(表1A);(ii) 入院時(COVID-19の場合)またはSARS-CoV-2のPCR検査後に25(OH)Dレベルを測定した(表1B);または(iii) SARS-CoV-2感染の診断前に25(OH)Dを測定した(表1C)。
表1 血中 25(OH)D レベルまたはビタミン D の状態と COVID-19 の転帰との関連を報告している研究
| 参考文献 | 時間枠 | N(国) | 主な結果 | 考えられる制限 | |
|---|---|---|---|---|---|
| A.一部のヨーロッパ諸国における平均25(oh)dレベルAとcovid-19の死亡率または症例(100万人あたり)の関連 | |||||
| アリ(198) | 2020年4月8日または2020年5月20日 | n = 20 | -25(OH)Dと死亡率(r = -0.44、p = 0.05)または症例(r = -0.44、p = 0.05)との逆相関のいくつかの証拠(2020年4月8日) -25(OH)の有意な逆相関D症例あり(r = -0.48、p = 0.03)、死亡率なし(r = -0.36、p = 0.12)(2020年5月20日) |
-過去の25(OH)Dレベルは国全体で標準化されておらず、25(OH)Dアッセイの違いについて調整も行われていません | |
| Ilie etal。(199) | 2020年4月8日 | n = 20 | -25(OH)Dと死亡率(r = -0.44、p = 0.05)または症例(r = -0.44、p = 0.05)との逆相関のいくつかの証拠 | -検査率、社会的距離戦略、人口人口統計、または併存疾患の違いについては調整が行われていません | |
| Laird etal。(200) | (日付は記載されていません、2020年5月7日公開) | n = 12 | -25(OH)Dと死亡率の有意な逆相関(r値は記載されていない、p = 0.046) | ||
| シン等。(201) | 2020年4月8日および2020年5月12日 | n = 20 | -25(OH)Dと死亡率(r = -0.44、p = 0.05)または症例(r = -0.44、p = 0.05)との逆相関のいくつかの証拠(2020年4月8日) -25(OH)の有意な逆相関D症例あり(r = -0.55、p = 0.01)、死亡率なし(r = -0.39、p = 0.09)(2020年5月12日) |
||
| # | 参照 場所 | 時間枠 | 人口 | 主な結果 | 考えられる制限 |
| B.入院時またはSARS-CoV-2のPCR検査後に測定された血液25(OH)D(可能性が高い)。 | |||||
| 1 | Abrishami etal。(202)イラン、テヘラン | 2020年2月28日〜4月19日 | – N = 73 SARS-CoVの-2についてCOVID-19及びPCR +で入院: – N = 12死んだ – N =放電した61 |
-肺への関与が少ないことに関連する25(OH)Dレベルが高い(β= -0.11(SE = 0.034)、調整モデルではp = 0.003- リスクの増加に関連するビタミンD欠乏症[25(OH)D <25 ng / mL]年齢、性別、併存疾患を調整した後の死亡率(HR 4.2、95%CI 1.1–16.2) |
-サンプルサイズが小さい -25(OH)Dの血液がいつ得られたかについての不確実性(胸部CTから3日以内?) |
| 2 | Arvinte etal。(203)米国コロラド州ソーントン | 2020年5月 | – N = 21 COVID-19と重症入院及び – N = 11人の生存 – N = 10、非生存 |
-生存者[21.3(11.3)]と非生存者(22.8(7.7)ng / mL [平均(SD)]の間で報告された25(OH)Dレベルに差はありません。 | -サンプルサイズが小さい -25(OH)Dの血液がいつ得られたかについての不確実性 -25(OH)Dアッセイの明確さの欠如 -COVID-19による診断にSARS-CoV-2 + PCRの結果が含まれていたかどうかについての言及はありません |
| 3 | Baktash etal。(204)スラウ、イギリス | 2020年3月1日〜4月30日 | – N =含む105≥65歳 、:- N = 70 COVID-19 + – N = 35 COVID-19- |
-COVID-19–(平均= 52、IQR 31.5–71.5 nmol / L)と比較してCOVID-19 +(平均= 27、IQR 20–47 nmol / L)が25(OH)D低い(p = 0.0008) -25(OH)D≤30nmol/ LのCOVID-19 +の換気の増加と依存度の高いユニット入院率、およびピークD-ダイマー血中濃度 |
-サンプルサイズが小さい -25(OH)Dは病気の前に測定されていません -25(OH)Dアッセイの明確さの欠如-25(OH)Dアッセイの 陽性ウイルスRT-PCRスワブまたはCOVID-19の証拠に基づくSARS-CoV-2感染の診断胸部X線写真またはCT |
| 4 | Carpagnano etal。(205)イタリア、バーリ | 2020年3月11日〜4月30日 | n = COVID-19による急性呼吸不全の成人42人 | -25(OH)D <10 ng / mLの患者は、25(OH)D≥10ng/ mL(5%)の患者と比較して死亡リスクが増加しました(50%)(p = 0.019) | -サンプルサイズが小さい -25(OH)Dは病気になる前に測定されていません |
| 5 | Cereda etal。(206)イタリア、パヴィア | 2020年3月〜4月 | n = COVID-19で入院した129人の患者(SARS-CoV-2のPCR +が確認された) | -年齢、性別、血中CRPレベル、心臓病、および重度の肺炎を調整した後の血中25(OH)Dと死亡リスク(OR = 1.7 95%CI = 1.1–2.7、p = 0.016)の間の正の関連 | -入院後48時間まで測定された25(OH)D |
| 6 | D’Avolio et al。、(207)スイス、テッシン州 | 2020年3月1日〜4月14日 | – N =含む107人の大人 、:- N = 27 SARS-CoVの-2 + – N = 80 SARS-CoVの-2- |
–SARS-CoV-2 +の人々は、SARS-CoV-2-の人々(中央値= 24.6、IQR 8.9–)よりも25(OH)D(中央値= 11.1、IQR 8.2–21.0 ng / mL)が有意に(p = 0.004)低かった。 30.5 ng / mL) | -サンプルサイズが小さい -PCRテストから7週間以内に測定された25(OH)D- 性別または併存疾患の有病率について調整されていない |
| 7 | De Smet etal。(208)ベルギー、西フランダース | 2020年3月1日〜4月7日 | – N = COVID-19肺炎で入院した患者186 – N = 2717個のコントロール(季節にマッチした、同様の年齢の、セックス層化) |
-コントロール(中央値21.5 ng / mL、IQR 13.9–30.8、p = 0.002)と比較してSARS-CoV-2(中央値18.6 ng / mL、IQR 12.6–25.3)の患者では25(OH)Dが低い -COVIDの進行-19の重症度(CTステージ)は、女性ではなく男性(p = 0.001)のビタミンD欠乏症の増加と有意に関連しています |
-プレプリント -25(OH)Dは病院への提示後に測定されました -併存疾患の有病率については調整されていませんが、ビタミンD欠乏症の層別化後のCOVID-19患者の慢性肺疾患、冠状動脈疾患、糖尿病の有病率に差はありません[25(OH)D <20 ng / mL] |
| 8 | フォールら。(209)アイルランド、ブランチャーズタウン | 2020年3月 | n = SARS-CoV-2肺炎で入院した33人の白人男性 | -急性呼吸窮迫症候群に進行した人(n = 12; 27±12nmol / L、平均±SD)では、進行しなかった人(n = 21; 41± )よりも25(OH)Dが有意に低かった(p = 0.03)。 19 nmol / L) | -サンプルサイズが小さい -病院への提示時に測定された25(OH)D- 糖尿病や心血管疾患のある人はいなかったが、併存疾患の有病率については調整されていない |
| 9 | Hars etal。(210)スイス、ジュネーブ | 2020年3月〜4月 | = nは160人の古い含めCOVID-19入院患者のn = 95、女性、およびN = 65、男性 | -男性の生存リスクの低下に関連するビタミンD欠乏症[25(OH)D <50 nmol / L](HR 2.5 95%CI 1.0–6.0、p = 0.044)が、年齢を調整したモデルの女性ではなく、併存症、血中CRPおよび虚弱 | -急性疾患中に測定された25(OH)D -SARS-CoV-2 + PCRの結果を介してCOVID-19と診断されたすべての個人ではありません |
| 10 | Hernandez etal。(211)スペイン | -COVID-19症例の場合は2020年3月10日から31日 -コミュニティ管理の場合は1月から3月の「過去1年」 |
– N = COVID-19で入院した患者216 – N = 197のコミュニティのコントロール |
-年齢、喫煙、併存疾患を調整した後、COVID-19患者の血中25(OH)Dは対照(21.2 95%CI 19.7–22.7)ng / mL)よりも低い(11.9 95%CI 9.6–14.3)ng / mL)、 BMIおよびその他(p <0.0001) -調整モデルでは、ビタミンD欠乏症[25(OH)D <20 ng / mL]とCOVID-19重症度(OR 1.1 95%CI 0.3–4.8)の有意な関連はありません |
-入院時に測定された25(OH)D-分析から除外されているが、ビタミンDが補充された COVID-19(n = 19)の一部の個人 |
| 11 | Im etal。(212)韓国 | 2020年2月〜6月 | – N = 50はCOVID-19で入院 – N = 150個のコントロールは、年齢と性別をマッチ |
-COVID-19(15.7±7.9 ng / dL、平均±SD)で入院した患者の25(OH)Dは、対照(25.0±13.2 ng / dL)よりも有意に低かった(p <0.001)。 | -サンプルサイズが小さい -入院後に測定された 25(OH)D – 25(OH)Dアッセイに関する不確実性-併存疾患について調整/適合されていない |
| 12 | Lau et al(213)ニューオーリンズ、米国 | 2020年3月27日〜4月21日 | n = COVID-19の患者20人 | -25(OH)Dは、ICUに入院したレベル(n = 13、19.2±10.8 ng / mL、平均±SD)とそうでないレベル(n = 7、29.8±13.3 ng / )を比較しても有意差はありません(p = 0.12)。dL)(p = 0.012) | -プレプリント -サンプルサイズが小さい -入院後に測定された25(OH)D- 年齢、性別、または併存疾患 について調整されていない-COVID-19の診断方法の定義は説明されていない |
| 13 | 羅ら (214)武漢、中国 | -COVID-19患者の場合は2020年2月27日から3月21日 -対照群の場合は2018年から2019年の同時期 |
– N = COVID-19のために入院335人の患者 – N = 560、年齢と性別をマッチさせた対照群 |
-年齢、性別、併存疾患を調整したモデルでは、COVID-19患者(3.32±0.04 nmol / L、平均±SD)のln変換25(OH)Dレベルは対照(3.46±0.02、p = 0.014)よりも有意に低かった。 BMIおよびその他 -調整モデルにおけるCOVID-19重症度の増加(OR 2.7 95%CI 1.2–6.0、p = 0.014)に関連するビタミンD欠乏症[25(OH)D <30 nmol / L] |
-入院時に測定された25(OH)D |
| 14 | マカヤら。(215)スペイン、マドリッド | 2020年3月5日〜31日 | n = COVID-19で病院の緊急事態に来院した80人の患者 | -ビタミンD欠乏症[25(OH)D <20 ng / mL]は、年齢、性別を調整したモデルで、重度のCOVID-19(OR 3.2 95%CI 0.9–11.4、p = 0.07)を発症するリスクの増加と有意に関連していませんでした。、肥満、および併存症 | -入院時または過去3か月間に測定された25(OH)D-ビタミンDを補給された 一部の患者(n = 44) |
| 15 | Maghbooli etal。(216)テヘラン、イラン | 2020年5月1日まで | n = COVID-19の235人の患者 | -重症度(RR 1.6、95%CI 1.0–2.4、p = 0.02)、無意識(RR 1.1、95%CI)の相対リスク(RR)の低下に関連するビタミンDの十分性[25(OH)D> 30 ng / ml] 1.0–1.1、p = 0.03)、血中低酸素症(RR 1.3、95%CI 1.1–1.6、p = 0.004)、c反応性タンパク質レベル(RR 1.7、95%CI 1.1–2.6、p = 0.01)およびリンパ球の割合<20%(RR 1.4、95%CI 1.0–1.8、p = 0.03) | -入院後に測定された25(OH)D- 年齢、性別、または併存疾患について調整されていない -COVID-19と診断された個人の31%のみが、SARS-CoV-2RNAのPCR +結果を示した個人を含んでいた -発現PLoS ONEの編集者からの懸念事項がこの論文で公開され、これらおよびその他の考えられる問題に焦点が当てられています(217) |
| 16 | Mendy etal。(218)米国シンシナティ | 2020年3月13日〜5月31日 | n = COVID-19と診断された689人の患者 | -入院(OR 1.8、95%CI 1.1–2.9、p = 0.03)または重症度(OR 2.0、95%CI 1.1–3.6、p = 0.03)またはICU入室(OR 2.6 )に有意に関連するビタミンD欠乏症(定義されていない)、95%CI 1.3–5.1、p = 0.03)年齢、性別、人種/民族、喫煙を調整した後 | -プレプリント-25 (OH)Dの血液がいつ得られたか についての不確実性-25(OH)Dアッセイについての不確実性 |
| 17 | Merzon etal。(219)イスラエル、テルアビブ | 2020年2月1日〜4月30日 | n = 25(OH)Dの以前の血液検査を受けたLeumit HealthServicesの7,807人のメンバー | -COVID-19 +(n = 782、平均= 19.0 ng / ml、95%CI 18.4–19.6)の25(OH)Dは、COVID-19-(n = 7,025 、平均= 20.6 ng / ml、95 )よりも有意に低い%CI 20.3–20.8) -感染リスクの増加と有意に関連する低い25(OH)Dレベル(OR 1.5、95%CI 1.1–2.0、p <0.001)が、入院ではない(OR 2.0、95%CI 1.0–4.8、p = 0.06)年齢、性別、SES、併存疾患を調整した後 |
-25(OH)Dの血液がいつ得られたか についての不確実性-25(OH)Dアッセイについての不確実性 -いくつかの併存疾患(例えば、心血管疾患)に対するCOVID-19 +間の負の関連のいくつかの予期しない観察 |
| 18 | Panagiotou et al(220)ニューカッスル・アポン・タイン、英国 | (記載なし)(2020年7月3日オンライン公開) | n = COVID-19で入院した134人の患者 | -集中治療室の25(OH)Dレベル(n = 42、33.5±16.8 nmol / L、平均±SD)とそうでないレベル(n = 92、48.1±38.2 )の間に有意差はありません(p = 0.3)nmol / L)-25(OH)Dレベルは死亡率とは関係ありません(OR 0.97、95%CI 0.42–2.23) | -COVID-19検査の前に25(OH)Dの血液が得られた場合の不確実性(「ベースライン」で測定) -25(OH)Dアッセイに関する不確実性 -コレカルシフェロール(ビタミンD 3)を補給した一部の患者(55.8%) – COVID-19がどのように診断されたかの定義は説明されていません |
| 19 | Pizzini etal。(221)オーストリア | 2020年4月29日から募集 | n = SARS-CoV-2の成人PCR + 109人 | -軽度(n = 22、64±31 nmol / L、平均±SD)、中等度(n = 34、54±19 nmol / L)の人々の間で血中25(OH)Dレベルに有意差はない(p = 0.12 ) 、または重度(n = 53、50±24 nmol / L)COVID-19は、発症から8週間後に測定した場合、軽度と中等度の症例を組み合わせた場合に違いが観察されました(n = 56、58±25 nmol / L、p <0.05)重症のみと比較 | -発症から8週間後に測定された25(OH)D -25(OH)Dアッセイに関する不確実性-ビタミンDを補給された 一部の患者(n = 10) -年齢、性別、または併存疾患について調整されていない |
| 20 | Radujkovic etal。(222)ハイデルベルク、ドイツ | 2020年3月18日〜6月18日 | n = 185 COVID-19患者(n = 92外来患者、n = 93入院患者) | -侵襲的人工呼吸または死亡(危険度(HR)6.1、95%CI 2.8–13.4、p <0.001)または死亡のリスク増加に関連する最初の症状でのビタミンD欠乏症[25(OH)D <12 ng / mL]年齢、性別、併存疾患を調整した後のみ(HR 14.7 95%CI 4.2–52.2、p <0.001) | -最初のプレゼンテーションで測定された25(OH)D-ビタミンDを補給された 一部の入院患者(n = 12) |
| 21 | Yilmaz and Sen(223)ディヤルバクル、トルコ | 2020年3月〜5月 | – N = COVID-19で入院した40人の子供(3月- 18年)は、SARS-CoVの-2 + PCRによって確認 –のn = 45健康的な「マッチ」のコントロール |
-COVID-19の小児の血中25(OH)Dレベルは、対照(34.8、3.8-77.4; p <0.001)と比較して有意に低い(13.1、4.2–69.3;平均、範囲) | -25(OH)Dの血液がいつ得られたかの不確実性 -年齢、性別、または併存疾患について調整されていない |
| 参考文献研究場所/コホート | 時間枠 | 人口 | 主な結果 | 考えられる制限 | |
|---|---|---|---|---|---|
| C.感染前に測定された血液25(OH)D | |||||
| Chodick etal。(224)イスラエル | 2020年1月1日から | – N = 14520、を含む :- N = 1,317 SARS-CoVの-2 + – N = 13203 SARS-CoVの-2- |
-(23.6±8.6 ng / mL、平均±SD)SARS-CoV-2感染のある患者の25(OH)Dレベル、(24.1±9.1 ng / mL)のない患者と同様 | -25(OH)Dアッセイの明確さの欠如 | |
| Hastie etal。(225、226)UKバイオバンク(N = 502624) | 2020年3月16日〜4月14日 | n = 348,598人の適格な参加者の確認されたCOVID-19および25(OH)Dテスト(2006–2010)の成人449人 | -民族、年齢、性別、評価月、収入、BMI、併存疾患を調整した後、確認されたCOVID-19(OR 1.00、95%CI 0.998–1.01、p = 0.208)と有意に関連しない25(OH)D | -COVID-19パンデミックの少し前に測定された25(OH)D | |
| Hastie etal。(227)UKバイオバンク(n = 502,624) | 2020年3月5日〜4月25日 | n = 656人の成人でCOVID-19および25(OH)D検査が確認され(2006–2010)、n = 203人が死亡341,484人の適格な参加者 | -重度の感染症と死亡率(HR 0.98、95%CI 0.91–1.06、p = 0.696)は、民族性、年齢、性別、評価月、収入、BMI、併存疾患の調整後、25(OH)Dと有意に関連していません | -BMIと民族性の両方が25(OH)Dに影響を与える可能性があるため、「過剰調整」の可能性[(228)からのコメント] | |
| カウフマンら(229)米国 | 2020年3月9日〜6月19日 | n = 218,372からSARS-CoV-2についてテスト | -SARS-CoV-2陽性率の低下と血中25(OH)Dレベルの上昇との間の有意な負の関係(25(OH)Dが1 ng / ml増加するごとにOR0.984、95%CI 0.983–0.986、p <0.001 )緯度、民族性、性別、年齢の調整後(25(OH)Dレベルは季節調整済み) | -併存疾患の考慮なし | |
| Meltzer et al。、(230)Chicago、USA | 2020年3月3日〜4月10日 | n = 489人の患者がCOVID-19の検査を受け、昨年25(OH)Dレベルが検査されました(SARS-CoV-2の検査で陽性となる前)。 | -COVID-19(n = 71)が陽性の検査は、ビタミンD欠乏症[25(OH)D <20 ng / ml]のリスク増加(RR 1.8 95%CI 1.1–2.1、p = 0.02)と有意に関連していました。多変量解析 | -25(OH)Dアッセイに関する不確実性 | |
| Raisi-Estabragh et al。、(231)UK Biobank(n = 497,996) | 2020年3月16日〜5月18日 | n = 1,326、COVID-19検査陽性、n = 3,184 COVID-19陰性、すべて血液25(OH)D検査(2006–2010) | -性別、年齢、およびBAME民族性も考慮したモデルにおいて、季節調整済み25(OH)DレベルとCOVID-19陽性の間に有意な関連はありません(OR 1.00 95%CI 1.00–1.00、p = 0.72)。 | -COVID-19パンデミックの少し前に測定された25(OH)D- BAME民族性OR 1.8、95%CI 1.4–2.2、p = 9.27× 10-7の有意な関連が観察された) |
|
2020年11月18日現在、PubMedで確認されている。
a各国で報告された25(OH)Dレベルの平均値。
有意性はp <0.05,25(OH)D = 25-ヒドロキシビタミンDとして定義。
CI、信頼区間、CRP、CRP、c-反応性蛋白質、HR、ハザード比、OR、オッズ比、RR、相対リスク。
BAME、黒人、アジア系および少数民族;25(OH)D、25-ヒドロキシビタミンD;CI、信頼区間;HR、ハザード比;OR、オッズ比;RR、相対リスク。
欧州12~20カ国の25(OH)Dの平均血中濃度と 2020年4月上旬のCOVID-19症例または死亡率との間には、有意な(または何らかの証拠がある)逆相関が観察された(198~201)(表1A)。COVID-19死亡率については、これらの逆相関は2020年5月中旬までにはもはや有意ではなかった(198,201)。これらの研究の考えられる限界には、過去の報告から抽出された25(OH)Dレベルの標準化、および25(OH)Dアッセイの違いに対する調整が行われていないことが含まれる。さらに、COVID-19検査率、社会的遠距離戦略、人口統計、併存疾患および/またはその他の要因における国ごとの違いについての調整も行われていない。同様の知見は、インドの 27 州およびユニオンテリトリーから得られたデータでも観察され、8 月中旬の SARS-CoV-2 感染と死亡率、および以前に発表されたデータの平均 25(OH)D 値との間には逆相関が観察された(232)。
表1Bでは、COVID-19で入院した患者、またはSARS-CoV-2(PCRによる)陽性が確認された後に入院した患者の25(OH)Dレベルを測定した21件の研究から得られた知見を報告している(表1B)。これらの研究のうち11件は、COVID-19またはSARS-CoV-2感染陽性者の25(OH)Dレベルが対照群と比較して有意に低いことを報告している(204,205,207-209,211,212,214,218,219,223)。これらの研究の多くは、サンプル数が少ないこと、25(OH)Dの測定にどのようなアッセイ法を使用したかが明確でないこと、感染が診断される前に25(OH)Dレベルが測定されていないことなどの理由で制限されていた。これは、COVID-19を含む急性疾患が血中25(OH)D濃度に影響を与える可能性があるため、重要な考慮事項である(228)。この概念は、ビタミンD欠乏または血中25(OH)Dレベルの低下が、すでにCOVID-19と診断された人のより重篤な転帰と関連していた10件の研究の知見によって支持されている(202,204,205,208,209,214,216,218,221,222)(表1B参照)。いくつかの研究における他の制限事項としては、性別、年齢、および併存疾患の違いに対する調整が行われていないこと、COVID-19の診断には必ずしもSARS-CoV-2のPCR陽性結果が含まれていないことなどが挙げられる。すべての研究がサンプル数が少ないわけではなく、2件の研究では少なくとも500人のCOVID-19患者についての所見が報告されている(218, 219)。そのうちの1件はプレプリント研究であった(218)。Merzonら(219)は、年齢、性別、社会経済状態、および併存疾患をコントロールした後、25(OH)Dレベルの低さが感染リスクの増加と関連していることを報告した(OR 1.5,95%CI 1.1-1.9;p < 0.001);しかしながら、COVID-19+といくつかの併存疾患(例えば、心血管疾患)との間に負の関連があるという「予想外」の観察があった(219)。
表1Cは、SARS-CoV-2感染またはCOVID-19診断が確認される前に25(OH)Dレベルが測定された6件の研究の要約である。これらの研究のいくつかには英国バイオバンクからのデータが含まれており、性別、年齢、民族性、および/またはボディマス指数、併存疾患および所得を調整した場合、COVID-19感染または死亡率と血中25(OH)Dとの間に有意な関連はないという一貫した知見が得られている(225-227, 231)。しかしながら、ベースラインの25(OH)Dレベルは、ビタミンDの状態が経時的に安定しているという仮定のもと、COVID-19の診断の10年以上前に行われたことに注意することが重要である[reviewed by (162)]。これらの研究は、「過剰調整」についても批判されている(228)。特筆すべき大規模研究(n = 218,372)では、緯度、民族、性別、年齢を調整した後、SARS-CoV-2陽性率の低下と血中25(OH)D濃度の上昇(25(OH)Dが1ng/ml増加するごとにOR 0.984,95%CI 0.983-0.986,p < 0.001)との間に有意な負の関係が観察された(229)。
全体的に、上記に引用した発表された研究の多くには重大な限界があり、交絡因子をよりよく考慮した25(OH)Dの血中濃度とSARS-CoV-2感染およびCOVID-19転帰との関連がどのようなものであるのか、また標準化されたアッセイを用いて25(OH)Dをプロスペクティブに測定することについて、より明確な情報が必要である。COVIDENCE UKは、12,000人(16歳以上)のCOVID-19の感染と重症度に対する食事とライフスタイルの影響を調べることを目的としている(233)など、これらの問題に対処する新しいコホート研究が進行中である。システマティックレビューおよびメタアナリシスの結果から、ビタミンD欠乏は死亡リスクの増加と有意に関連していることが示唆されている(OR 1.8,95%CI 1.1-2.6,p = 0.045,上記レビューされた5つの研究からのデータを含む)(234)。しかし、この分野の研究では、いくつかのプレプリント研究におけるデータの正確性に関する問題が提起され(235)、別の研究におけるデータの妥当性とその解釈に関する懸念表明(217)がジャーナル編集者によって提起されており、誤報の原因となる可能性がある(216)。もう一つの懸念材料は、初期の全身レビューと7つの論文のメタアナリシス(2020年4月9日から5月20日の間に発表されたもの)で、25(OH)Dレベルが「良好」(n=669)よりも「不良」(n=634)のCOVID-19予後の人の方が有意に低かったと報告している(236)。この研究で報告されたメタアナリシスは、以下の研究が含まれていることで欠陥がある可能性が高い:以前はプレプリントに掲載されていたが、現在は撤回されたと思われる研究[例:Alipio et al 2020,(236)];オリジナルの知見を引用していない書簡からのデータ(237);および性別、年齢、併存疾患およびその他の重要な因子を調整していないサンプルサイズの小さいレトロスペクティブ研究を含むこと[例:表1Bの(209, 213)など]。
ビタミンD補給は成功する可能性があるか?
COVID-19(n = 105)の患者は、感染していない人(n = 1,381)に比べてビタミンDの補給を受ける可能性が低いことを示唆するいくつかの初期の知見がある(年齢調整OR = 0.56,95%CI 0.32-0.99)が、ロンバルディア州(イタリア)のパーキンソン病患者を対象としたこの研究では、感染者は肥満および慢性閉塞性肺疾患を有する可能性も高かったが(238)。質の高いランダム化臨床試験のメタアナリシス(25試験;n=11,131,調整後OR 0.88,95%CI 0.81-0.96)で観察されたように、急性呼吸器感染症のリスクを減少させるためにビタミンDの補給には利点があるかもしれない(239)。同様の知見は、より最近のプレプリント研究でも観察され、40件の無作為化臨床試験(n = 30,956)のメタアナリシスで、ビタミンDの補給が急性呼吸器感染症のリスクを低下させた(OR 0.89,95%CI 0.81-0.98)が、若干の発表バイアスが検出されたが(240)同様の結果が得られた。本研究のサブグループ解析では、1日400-1,000IU/日(OR 0.70,95%CI 0.55-0.89)の範囲内の用量を12ヵ月間補充した人の方が転帰が良好であることが示唆されている(240)。上・下気道感染症と診断された割合、抗菌薬の使用、入院、救急外来受診などのアウトカムには効果は認められなかった(240)。ビタミンDの補給は心血管系および抗炎症性の有益性も示す可能性があり、メタアナリシスではプラセボと比較して血中総コレステロール、LDL-コレステロール、トリグリセリドレベル(241)または炎症性サイトカイン濃度(TNFなど)の低下が指摘されているが、効果の大きさは小さい(241)が、特に初期にビタミンDが不足していない人(242)では効果が認められていない。他のメタアナリシスでは、特定の集団においてビタミンDの補給が脂肪率に有益な効果をもたらす可能性があることが示唆されており、20のランダム化臨床試験(n = 3,153人)のサブグループ解析では、アジア諸国に住む女性において6ヵ月以上の補給を受けた場合、体格指数とウエスト周囲長が減少したことが示唆されている(243)。公表されているデータセットのマルチオミクス解析により、ビタミンDは(他の候補の中で)COVID-19の潜在的な予防薬であることが確認されている(244)。しかしながら、非炎症性リウマチ性疾患の治療を受けた2,000人以上を対象とした研究(2020年3月~5月)では、ビタミンDによる治療を受けてもCOVID-19の発生率に有意な変化はみられなかった(245)。
ビタミンDの投与量に関する考察
ビタミンD補給の研究で現在進行中の問題の一つは、健康を最適化するための効果的で安全な投与量は何かということである。COVID-19からの保護をもたらすビタミンDの安全な投与量は何かについては、Irish Medical Journal(246-248)やNutrients(160, 249, 250)など複数のジャーナルでかなりの議論が発表されている。いくつかは、250,000-500,000 IUのビタミンDの用量は、入院期間の短縮、および血中酸素濃度の上昇と関連していたという報告に基づいて、非常に高いボーラス用量は、換気された重篤な患者では安全である可能性が高いことを示唆している[reviewed by (251, 252)]。他の人たちは、COVID-19の安全で効果的な用量を定義するのに役立つ多施設無作為化比較試験を求めて、投与についてより慎重になっている(253)。ビタミンDの「高」日量投与は、心血管系の健康状態を示すマーカーに悪影響を及ぼす可能性がある。例えば、心不全の成人(n = 400)に1日4,000IUのビタミンDを3年間補充した場合、機械的循環支援インプラントの必要性が増加することが観察された(HR 2.0,95%CI 1.0-3.7)(254)。これらのインプラントは末期心不全患者の死亡を予防するための最後の選択肢であり、その使用量の増加はビタミンD誘発性高カルシウム血症と関連していた(254)。実際、「高用量」のビタミンD(2,800IU/日以上)を長期間(12ヵ月以上)投与すると、高カルシウム血症のリスクが高まる可能性がある(255)。急性呼吸器感染症では、メタアナリシスでは400-1,000IUのビタミンDを毎日投与すると有効性が高まることが指摘されているが(240)投与頻度(例えば、毎日投与か月1回のボーラスか)についてはさらなる論争がある。COVID-19の重症度を制限するためのビタミンD補給の有効性を比較し、1日投与量の範囲で安全性の結果を測定する臨床試験が必要である。
ビタミンDおよびCOVID-19の潜在的な保護効果を調節する因子
性別は重要な考慮事項であり、重度のCOVID-19のリスクの増加は男性であることとリンクしている(155)。この観察の理由は完全には解明されていないが、免疫、メタ炎症反応、ACE2の発現、急性呼吸窮迫症候群(ARDS)発症のリスクなどの性差を含む可能性がある(155, 256-258)。免疫応答を調節するビタミンDの能力には性差があると考えられ、女性ではT調節細胞やインターロイキン-10などの免疫抑制性サイトカインを誘導する能力が増加している[レビューは(259)で]。これらの応答は、エストロゲンやプロゲステロンなどの性ホルモンを介して媒介される可能性がある。実際、ビタミンDはプロゲステロンと協力して(潜在的にVDRをアップレギュレートすることによって)免疫を調節し、プロ炎症性サイトカインの発現を制御する可能性がある(260)。ここで重要なのは、ビタミンD欠乏症[25(OH)D < 50 nmol/L]の男性(女性ではない)はCOVID-19により死亡する「リスク」が高いという最近の所見である(210)第2の研究でも同様の所見が得られている(208)。ある研究ではCOVID-19の重症度との関連において、年齢とビタミンD欠乏との間に有意な相互作用が観察されており、年齢も考慮すべき重要な因子であると考えられる(215)。その他の重要な考慮事項としては、遺伝的影響があり、ビタミンD結合タンパク質の多型とCOVID-19の有病率および死亡率との間に有意な関連が報告されている(261)。日光曝露(またはUVB放射)に曝露された後のビタミンDを作る能力に民族性がどのように影響するかは、さらに重要な因子であり、これについても議論されている(121, 262)。一部の研究者は、アフリカ系アメリカ人のグルタチオン合成における遺伝的欠損(G6PD酵素活性の低下を介して)と、他の人と比較した場合のビタミンD欠乏と、COVID-19によって誘導される酸化ストレスからの保護との間に重要な関連性があるのではないかと仮説を立てている(263)。皮膚の色およびタイプ(Fitzpatrickなど)がCOVID-19関連の転帰に及ぼす影響については、さらなるデータが必要である。
ビタミンD補給の有効性を試験している臨床試験
小規模臨床試験および実験的研究から得られた初期の知見は、COVID-19の重症度を軽減するためのビタミンD補充に何らかの有益性があることを示唆している。
COVID-19でスペインの病院に入院した76人を対象に、経口カルシフェジオール[25(OH)D;入院日0.532mg、3日目と7日目に0.266mg、その後週1回]の標準治療の効果を比較したところ、カルシフェジオール投与群では集中治療室への入院リスクの低下が認められた(高血圧および2型糖尿病の有病率を調整した後、OR 0.03,95%CI 0.003-0.25)(264)。
フランスの2件の「準実験的」な研究から、疾患発症前に「ボーラス」ビタミンD [例えば、2-3ヵ月ごとに80,000IUのビタミンDを80,000IUずつ(265)]を定期的に補充することは、入院患者[n = 77: HR 0.07 95%CI 0.01-0.61(266)]、および介護施設で生活する人[n = 66: HR 0.11 95%CI 0.03-0.48(265)]の両方において、年齢、性別およびその他の因子で調整したモデルでCOVID-19による死亡リスクを減少させることが示された。
これらの研究の限界は、すべての SARS-CoV-2 感染が PCR によって確認されたわけではないことであった。SARS-CoV-2+(PCRによる)ビタミンD欠乏症で、後の人工呼吸を必要とせず、「有意な」併存疾患もない無症候性または軽症の成人40人を対象に、毎日60,000IUのコレクレカルシフェロール(ビタミンD3)を少なくとも7日間投与した場合の効果をプラセボと比較した(267)。コレカルシフェロール投与群(n = 16)では、14日目の時点でプラセボ投与群(n = 24)に比べてPCRでSARS-CoV-2 RNAが陰性(62%)であった(21%、p < 0.018)。
COVID-19の重症度を低下させるためのビタミンD補給(単独)の能力を試験する他の試験も進行中で 2020年11月18日現在、ClinicalTrials.govには少なくとも25件が登録されている。これらは主に成人を対象とした研究で、経口ビタミンD [または25(OH)D]の補給が以下のようなさまざまな転帰に及ぼす影響を試験している。SARS-CoV-2感染率(無症候性を含む)COVID-19入院率と滞在期間、集中治療室への入院、酸素/換気サポートの必要性、症状の重症度、心血管イベント(例:心臓発作、脳卒中)敗血症、炎症マーカー、血中25(OH)Dレベルと抗SARS-CoV-2抗体価、および有害事象。サプリメントの投与量およびレジメンも様々であり、1,000IUビタミンD/日の「低用量」からボーラスビタミンD投与(例えば、20,000IU/日を3日間投与し、その後6,000IU/日を12ヵ月間投与する;NCT04482673)に至るまで様々である。他の関連するアプローチには、複合栄養支持を介した補充があり、ノルウェーで8万人の個人を募集してタラ肝油(10μgのビタミンD3を含む5mLの用量を介して)の予防効果を試験することを計画している1つの非常に大規模な臨床試験が含まれている(NCT04609423)。
一酸化窒素とCOVID-19
一酸化窒素レベルは、複数の経路によって局所的および全身的に調節される。一酸化窒素は、酸素とL-アルギニンを一酸化窒素とL-シトルリンに変換する一酸化窒素合成酵素[NOS;例えば、誘導性(iNOS);内皮(e)NOS]の活性を介して生成される。また、無機一酸化窒素前駆体である亜硝酸塩(NO-2)および硝酸塩(NO-3)の食事源も存在し、これらは緑葉野菜、ビートルートおよび海藻に自然に存在する(268)。
硝酸塩は舌微生物叢の活動によって亜硝酸塩に還元され、唾液を介して循環に入り、肺を含む様々な組織で一酸化窒素にさらに還元される(269)。内皮機能障害を介した局所一酸化窒素の産生障害、およびeNOSの発現低下、および一酸化窒素のバイオアベイラビリティの低下は、高齢男性および肥満および高血圧などの併存疾患を有する人に起こり、COVID-19による死亡率を増加させる仮説が立てられている(270)。
eNOSの発現における遺伝的差異が、重症COVID-19に対する感受性の民族的差異を下支えしている可能性がある(271)。しかしながら、一酸化窒素は、早期に多くのウイルスの複製を阻害し、より一般的な抗ウイルス機能のために自然免疫経路を活性化することを含む、より直接的な抗ウイルス効果を有することができる(152)。
紫外線への曝露もまた、皮膚内の貯蔵物からの光放出を通じて一酸化窒素のバイオアベイラビリティを高めるもう一つの手段である(272)。一酸化窒素の「生理活性」は、その後、(亜硝酸塩として)全身循環に動員され、潜在的に血管拡張と血圧の低下を促進する(136)。以下では、抗ウイルス効果、抗炎症性および心代謝性の利点を含む、COVID-19の重症度を低下させる一酸化窒素の潜在的な作用機序について、より詳細に説明する。
次に、COVID-19の予防または治療のために検討されている一酸化窒素のバイオアベイラビリティーを改善する他の方法について、吸入一酸化窒素の提供、または(硝酸塩/亜硝酸塩を用いた)栄養補給、その他の方法を含めて議論する。
想定される作用機序
抗ウイルス効果
一酸化窒素は、コロナウイルスに対する特異的な阻害作用だけでなく、一般的な抗ウイルス作用も有している。SARS-CoV-2の試験管内試験複製は、一酸化窒素ドナーSNAP(S-ニトロソ-N-アセチルペニシラミン)を200-400μMでVero-E6細胞を処理することによって阻害された(273)。この効果は、システイン基のS-ニトロシル化を促進する一酸化窒素の能力に関連している可能性がある(274)。
実際、SARS-CoV-2 3CLシステインプロテアーゼのプロテアーゼ活性は、≧100μM SNAPによって阻害された(273)。一酸化窒素もまた、SARS-CoV-1の複製を阻害する(276)が、これは2つのS-ニトロシル化依存性の経路によって行われる。
第一に、SARS-CoV-1スパイクタンパク質のS-ニトロシル化は、その受容体(すなわちACE2)との融合に必要な翻訳後のパルミトイル化を妨げる(277)。
第二に、初期のウイルス複製は、SARS-CoV-1システインプロテアーゼに対する作用によってブロックされる。SARS-CoV-1のスパイクタンパク質は、SARS-CoV-2のそれと非常に相同性が高い(278, 279)ので、一酸化窒素がSARS-CoV-2によるACE2への結合を同様に制限することを示唆している。TMPRSS2を含むセリンプロテアーゼは、細胞の侵入を可能にするためにSARS-CoV-2のスパイクタンパク質をプライムする必要がある(280)が、このプロセスは特にニトロシル化に敏感である。一酸化窒素供与体であるフロキサンは、SARS-CoV-2のプロテアーゼ阻害剤として作用すると仮定されている(281)。
抗炎症作用
SARS-CoV-2は、幅広い肺外症状の原因となっている。これらの症状はウイルス組織の直接的な損傷を反映している可能性があり、広範な内皮細胞損傷、血栓性炎症、免疫異常などが含まれる(282)。一酸化窒素には複数の機能があり、構成性一酸化窒素合成酵素によって産生されるような低レベルでは、健康な内皮機能にとって重要であり(283)、抗血栓性である(284)。
一酸化窒素によって制御される重要な免疫細胞の一つはマクロファージであり、マクロファージはタイプ1(M1)からタイプ2の表現型(M2)へと「再分極」され、これらの細胞によるプロ炎症性メディエーターおよび反応性種の産生を効果的に中和している[(285)によるレビュー]。
紫外線照射に続いて皮膚から全身循環に動員された一酸化窒素は、これらの構成レベルの一酸化窒素放出と同じ生理活性を示し、類似の抗炎症作用を有することが期待されるであろう(136)。ヒトのトランスクリプトームは強い季節性を示しており、全遺伝子のほぼ3分の1が関与しており、健康なボランティアでは夏季に抗炎症遺伝子の広範なアップレギュレーションが観察されているが、これは日光曝露によって制御されている可能性がある(286)。
一酸化窒素による心代謝保護のメカニズム
一酸化窒素の生理学的に適切なレベルは保護効果を持つが、過剰な一酸化窒素は有害である(287)。少なすぎるとミトコンドリアの生合成と機能を損なうことができるが、例えば、一酸化窒素の高濃度は、硝化ストレスとミトコンドリアの損傷を引き起こす(288)。以下では、一酸化窒素(すなわち、無機硝酸塩と亜硝酸塩、または、欠乏)の “直接 “の食事源が心血管の健康を変調する可能性があるメカニズム(前臨床研究で同定された)をレビューする。代謝転帰に対する一酸化窒素の効果のレビューについては、他のレビュー(140,173,289)を参照されたい。
食事性硝酸塩
食事性硝酸塩は、心臓の健康を改善するために、抗炎症、-線維化、-酸化作用を有する可能性がある。食事制限による硝酸塩(または亜硝酸塩)の長期欠乏は、高血圧、内皮機能障害、メタボリックシンドローム、腸内環境異常(細菌の多様性の低下、より多くのアクチノバクテリア)を引き起こした(290)。これらの影響は硝酸塩補給によってすべて逆転した。硝酸ナトリウムの食事補給は、高炭水化物、高脂肪食を与えられたラットの血圧を低下させ、左心室の炎症と線維化の減少を伴い、関連するmRNAの心臓発現の変化(すなわち、Ctgf、Mcp1α、Mmp2の減少、Pparαの増加)を伴った(291)。硝酸ナトリウムはまた、加齢性高血圧ラットの心臓組織および腸間膜動脈における過酸化物の形成を抑制した(292)。
食事性亜硝酸塩
食餌性硝酸塩と同様に、亜硝酸塩もまた、線維化および酸化ストレスを減少させ、心血管組織のリモデリングを損なう経路を介して保護効果を有する可能性がある。食餌性亜硝酸塩は線維化の程度を減少させ、血管(187,293)と心臓(294,295)のリモデリングの両方を減少させた。食餌性亜硝酸塩の血圧降下作用と心筋への有益な効果は、骨格筋におけるSIRT3-AMPK経路の活性化と関連していた(187)。SIRT3は活性酸素のミトコンドリア調節因子である。亜硝酸はミトコンドリアの呼吸と活性酸素種の産生を抑制し、虚血発作時のATPの継続的な供給源としての効率を改善した(289)。食事性亜硝酸塩は、マウスの心臓におけるリン酸化されたAkt(心筋細胞死のメディエーター)レベルを抑制することで、心室肥大を制限する可能性がある(294)。
食事性亜硝酸塩/硝酸塩とレニン-アンジオテンシン-アルドステロン系(RAAS)経路
ビタミンDと同様に、食餌性亜硝酸塩と硝酸塩は心臓の健康を促進するためにRAAS経路を制御する可能性がある。無機亜硝酸塩は心臓のリモデリングを抑制し、アンジオテンシンIIの血漿レベル、アンジオテンシンII 1型受容体の心臓mRNAレベルを含むRAASの要素を調節した(295)。同様に、硝酸ナトリウムは加齢性高血圧ラットの動脈におけるアンジオテンシンIIシグナル伝達を「正常化」した(292)。
一酸化窒素を評価する臨床試験
吸入された一酸化窒素
吸入一酸化窒素は、その強力な選択的肺血管拡張および気管支拡張効果、安全性プロファイル、および呼吸器疾患の治療における広範な使用のために、いくつかの解説およびレビュー(296-299)でCOVID-19の治療のために提案されている。吸入された一酸化窒素は、SARS患者(n = 14,中国)を対象とした非常に小規模な試験で試験され、胸部X線撮影で測定された「肺浸潤の広がり」を有意に減少させた(300)。システマティックレビューでは、吸入一酸化窒素は血液中の酸素化を改善し、肺高血圧を抑制する可能性はあるが、ARDSによる死亡率の減少には一貫した利点はないことが示唆されている[reviewed by (285, 301)]。それでも、吸入一酸化窒素は、SARS-CoV-2に感染した小児の治療にすでに推奨され、一部の臨床医によって使用されており(302,303)「仰臥位・臥位」(すなわち、おなかの上)での患者の治療など、他の治療法とすでに併用されている可能性が高い(302,304)。
吸入一酸化窒素療法の有益性は、COVID-19患者のケーススタディで報告されており、「在宅療法」(296,306)や、外来での使用を想定して開発されたポータブルシステムを介して報告されている[レビューは(285)によって行われている]。小規模臨床研究では、吸入一酸化窒素(10~25ppmの用量)は、難治性の低酸素血症を有するCOVID-19患者の換気を行った患者のPaO2/FiO2比(酸素化の指標)を有意に変化させなかった(307~309)。わずかに高用量ではあるが、吸入一酸化窒素(30ppmから)により、COVID-19の非挿管患者39人中21人の酸素化が改善された(310)。多くの臨床試験が進行中である(n=20,ClinicalTrials.gov 2020年11月18日、キーワード:一酸化窒素(+)COVID-19を使用して)。酸素化(311)挿管を必要とする疾患の進行(312)入院率と滞在期間、死亡率、呼吸不全、回復、血液炎症マーカー、SARS-CoV-2 負荷、喀痰中の細菌負荷、有害事象(例:腎不全)肺スピロメトリー、および生活の質など、さまざまなアウトカムが試験されている。現在進行中の他の臨床試験には、「一酸化窒素放出液/薬剤」を経鼻投与する試験(例えば、NCT04443868,NCT04337918)またはCOVID-19の予防または治療のための「一酸化窒素生成液」(RESP301)の吸入試験(例えば、NCT04460183)が含まれる。1つの試験では、最近COVID-19と診断された参加者を対象に、一酸化窒素(30mg)発生ロゼンジを1日2回服用した場合の血圧およびめまいに対する能力を試験している(NCT04601077)。
栄養補助食品およびその他のアプローチ
心血管系の健康に有益な可能性があるにもかかわらず、亜硝酸塩は血管拡張や全身の血圧に複雑な用量依存性の影響を与え、毒性の問題もあるため、ヒトに慢性的に投与することはできないかもしれない(313, 314)。実際、COVID-19の転帰に対する亜硝酸塩または硝酸塩の食事療法が評価されているアクティブな臨床試験は確認されなかった(ClinicalTrials.gov 2020年11月18日、キーワードを使用して検索:亜硝酸塩(OR)硝酸塩(+)COVID-19)。他の懸念事項としては、硝酸塩が、亜硝酸塩(および硝酸塩)からの一酸化窒素の形成を触媒する酵素であるキサンチンオキシドレダクターゼを阻害することにより、亜硝酸塩に対する血管応答を減衰させ、血圧を低下させる亜硝酸塩の能力を低下させる(Wistarラットで観察されたように)という観察が挙げられる(315)。さらに、上記の詳細な研究の多くは雄の実験動物で行われたものであり、エストロゲン(および他の内因性メディエーター)の心保護効果は、一酸化窒素に特異的な経路を介して起こる可能性があるので(316,317)前臨床所見(主に雄の動物から得られた)が男女両方にどのように翻訳可能であるかを検討することは、今後重要になるであろう。COVID-19患者の治療のために一酸化窒素のバイオアベイラビリティを高める他の手段として、一酸化窒素ドナー(SNAP、RRx-001など)の適用、一酸化窒素を放出するナノ粒子などの新規技術(285,318)および食事(ビーツの摂取促進など)を介した方法(319)などが検討されている。
今後の方向性とまとめ
紫外線やビタミンDや一酸化窒素などの誘導メディエーターがCOVID-19の発症率や重症度を調節する可能性に大きな関心が寄せられていることは明らかである。これまでに収集されたデータは、環境レベルのUVAとUVBの両方がCOVID-19の発生率や重症度を低下させるのに有益であることを示唆しているが、環境と人口ベースの交絡の可能性をよりよく考慮したさらなる研究が必要である。
現在のところ、血中25(OH)DとCOVID-19との関連性の性質は解明されておらず、身体活動や個人的な日光曝露レベルなどの生活様式因子やその他の交絡因子(併存疾患など)をよりよく考慮した前向きのデータが必要である。
個人の日焼けとCOVID-19関連の転帰を考慮したデータはこれまでほとんど収集されていない。これは、周囲の紫外線レベルが必ずしも個人の日焼けと強く相関するとは限らないため、重要な考慮事項である[例えば、線量計で測定した場合; r = 0.2 (320)]。新しいワクチンやビタミンD補給の有効性を試験する臨床試験は、個人の日射量レベルやCOVID-19の結果との関連性、さらには日射量とワクチン接種やビタミンD補給の影響との相互作用についての情報を収集する機会を提供してくれるだろう。
日光曝露量の測定は、特に重度のCOVID-19イベントのリスクがある人々に対して、情報に基づいたエビデンスに基づいたアドバイスを提供するために重要である。新しい臨床試験では、ビタミンDの補充または吸入一酸化窒素と他の成功した治療法[例えば、デキサメタゾン(321)のようなコルチコステロイド]との併用効果が検討されるであろう
。我々は、紫外線および誘導されたメディエーターが抗SARS-CoV-2効果を発揮し、COVID-19の間の呼吸器および心代謝の健康に対する保護効果が仮説されていることを強調している;しかしながら、より多くの証拠が必要である。
