Contents
Impact of COVID-19 on Mitochondrial-Based Immunity in Aging and Age-Related Diseases
オンラインで公開 2021年1月12日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7835331/
Riya Ganji1 and P. Hemachandra Reddy1,2,3,4,5,*.
要旨
コロナウイルス感染症2019(COVID-19)は、死亡率が急増し、治療法のない致命的なパンデミックとなっている。COVID-19は、咳、発熱、悪寒、頭痛、息切れ、呼吸困難、筋肉痛、においや味覚の喪失などの様々な臨床症状を伴う重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によって引き起こされる。免疫力が低下している高齢者はCOVID-19の影響を強く受けやすく、死亡率は加齢と高血圧、糖尿病、心血管疾患、慢性閉塞性肺疾患などの併存疾患の存在により増加する。
新たな証拠は、COVID-19が免疫細胞のミトコンドリアをハイジャックし、ミトコンドリア構造内で複製し、細胞死につながるミトコンドリアのダイナミクスを損なうことを示唆している。ミトコンドリアは細胞のパワーハウスであり、細胞の免疫、恒常性維持、細胞の生存/死の維持に大きく関与している。COVID-19に感染した細胞のミトコンドリアは非常に脆弱であり、加齢とともに脆弱性が増すことを示唆する証拠が増えている。
我々の論文の目的は、COVID-19を持つ高齢者の死亡率を増加させる糖尿病、肥満、神経疾患などの様々な年齢に関連した併存疾患の役割をまとめることである。我々の論文はまた、免疫細胞におけるコロナウイルスとミトコンドリア動態との相互作用を強調している。
また、COVID-19からの防御に役立つ現在の治療法、生活習慣、安全対策についても強調している。COVID-19患者におけるミトコンドリアウイルスと疾患進行との間の分子メカニズムを理解するためには、さらなる研究が早急に必要である。
キーワード
COVID-19,SARS-CoV-2,アルツハイマー病、糖尿病、肥満、免疫応答、ミトコンドリア動態、ライフスタイル
序論
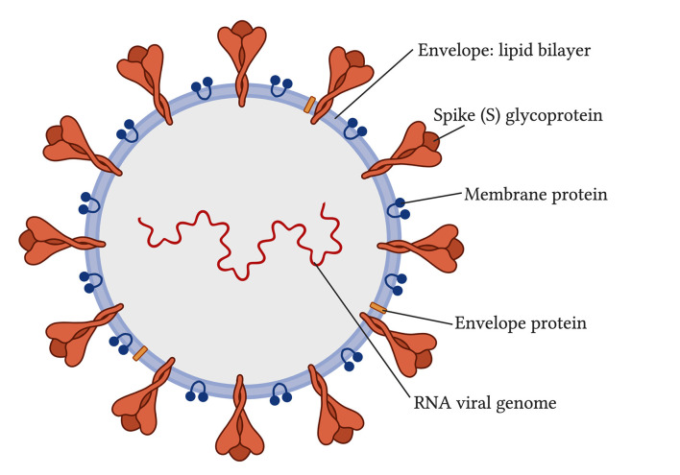
コロナウイルスは、コロナウイルス科およびニドウイルス目に属するウイルスである(Vallamkondu et al 2020)。電子顕微鏡で見ると、コロナウイルスは、そのエンベロープ上のスパイク糖タンパク質によって引き起こされる王冠のような外観を有する(図1;Vallamkondu et al 2020)。コロナウイルスは、その生存および複製のために宿主細胞としてヒト肺胞上皮細胞を使用することができる。2019年に、重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)と呼ばれる新規なコロナウイルスが出現した。それはその病気で世界的なパンデミックを引き起こし、世界保健機関(WHO)によって「2019年に発見された新型コロナウイルス病」(COVID-19)と命名された。
図1 重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2;Vallamkondu et al 2020)の構造
COVID-19は、患者の人口統計学的メイクアップおよび病歴によって異なる、さまざまな呼吸器症状を引き起こす。これらの症状には、喉の痛み、咳、発熱、悪寒、頭痛、息切れ、呼吸困難、筋肉痛、および嗅覚または味覚の喪失が含まれる(Huang et al 2020;Li et al 2020)。呼吸器飛沫を介して感染し、再生産数(R0)は2.2であり、SARS-CoV-2に感染した人が新たに約2.2人に感染することを意味する(Kandimalla et al 2020)。2020年12月現在、世界では約7,000万人の症例があり、150万人以上の死亡者が出ている[世界保健機関(WHO)2020年]が、多くの薬が有効性を検証されているが、未だに万能薬であることが証明されていない(Bhatti et al 2020)。COVID-19の症状を呈する可能性が高い患者は高齢者である;その可能性は年齢とともに増加し、高血圧、糖尿病、心血管疾患、または慢性閉塞性肺疾患などの併存疾患(Yang et al 2020;Zhang et al 2020)および肥満または認知症(Holder and Reddy 2020)の存在とともに増加する。死亡率が最も高いのは、様々な併存疾患を有する高齢の男性患者であるようである(Onder et al 2020)。
COVID-19を獲得した人の中で高齢者の有病率が高いことを考えると、加齢とCOVID-19との関連を促進しうるメカニズムを探究することが必要である。ヒトは加齢とともに、胸腺のような特定の免疫組織の喪失や、ミトコンドリアのような細胞レベルでのエネルギー代謝の低下により、免疫応答の速度と強さが弱くなる。細胞内のエネルギーは、アデノシン三リン酸(ATP)の形で来て、細胞が酸素で燃料を供給されているときにミトコンドリアによって作られるだけでなく、酸素がないときに解糖によっても作られる。また、ミトコンドリアは、ウイルス粒子がヒト宿主細胞に感染する際にウイルス粒子と相互作用し、インターフェロンやサイトカイン放出を関与させ、炎症を刺激し、ウイルスの生存と複製に影響を与えることが知られている(Khan et al 2015; Tiku et al 2020)。SARS-CoV-2に対するミトコンドリアベースの免疫を研究することは、ミトコンドリアの効率が低下した高齢者が、COVID-19に直面するための装備が悪いのかもしれない理由についての洞察を与えるかもしれない。
本研究の目的は、高齢者のミトコンドリアとSARS-CoV-2との間の分子リンクを探ることである。さらに、COVID-19を持つ高齢者の死亡率増加における糖尿病、肥満、神経疾患などの様々な年齢に関連した併存疾患の役割にも注目した。また、COVID-19から身を守るのに役立つ現在の治療法、生活習慣、安全対策についても探っている。
ミトコンドリアと免疫
ミトコンドリアは二重膜を持つ小器官であり、細胞の主要なエネルギー生産源であるATPの形で、恒常性維持、細胞増殖、細胞死、アミノ酸・脂質・ヌクレオチドの合成に寄与している。感染症の際には、ミトコンドリアがインターフェロンシステムに関与して構造を変化させ、プログラムされた細胞死(アポトーシス;太田・西山 2011)を誘導することで免疫に貢献している。
インターフェロンシグナル伝達とミトコンドリア
ウイルスに感染すると、宿主の自然免疫系は、ウイルス核酸配列やウイルスタンパク質などの特定のパターンを認識し、それらが宿主細胞膜上の受容体(細胞内および細胞外)に付着することで、炎症反応につながるシグナル伝達経路を活性化する。これらの認識は、炎症反応につながるシグナル伝達経路を活性化する。これらのウイルス成分が付着する受容体には、トール様受容体やレチノイン酸誘導性遺伝子-I様受容体(RLR)(竹内・明 2009)などの異なるタイプの受容体がある。トール様受容体は、炎症性サイトカインであるI型インターフェロンの活性化やケモカイン産生に関与しており、細胞表面、エンドソーム、小胞体膜に存在する(竹内・明 2009)。RLRは、非免疫細胞におけるI型インターフェロンの産生を開始する細胞質受容体であり(竹内・明 2009年)ミトコンドリア上に存在することができる(Tal and Iwasaki 2009)。
これらのRLRは、細胞質中のウイルスRNAを検出し、パラミクソウイルス、日本脳炎ウイルス、インフルエンザウイルス、ピコルナウイルスなどのRNAウイルスの認識に関与している(Kato et al 2006)。しかしながら、特定のサブタイプのRLRは、特定のDNAウイルスの検出にも関与している可能性がある。例えば、アデノウイルスおよび単純ヘルペスウイルス1型は、RLRに影響を与え、インターフェロン-β産生を刺激するDNA依存性RNAポリメラーゼIIIを有し、エプスタイン-バーウイルスは、RLRを活性化することができる小さなRNA断片を産生する(Samanta et al 2006; Cheng et al 2007; Chiu et al 2009)。
RLRの活性化から始まるシグナル伝達経路の構成要素は、ミトコンドリア抗ウイルスシグナル伝達タンパク質(MAVS; Kawai et al 2005)として知られている分子である。MAVSは、外側ミトコンドリア膜(OMM;Seth et al 2005)上に位置し、活性化されると、追加のインターフェロン産生をもたらす転写因子を誘発する(Zhang et al 2014)。MAVSに加えて、「インターフェロン遺伝子の刺激因子」と呼ばれるミトコンドリア関連タンパク質やミトコンドリアタンパク質のミトフシン2もまた、RLRカスケードに関与しているか、またはMAVSと協働している(石川およびバーバー 2008;安川 et al 2009)。この証拠は、ミトコンドリアが免疫系におけるインターフェロンシグナル伝達の重要な部分であることを示している。いくつかのウイルスは、インターフェロン産生を防ぐためにMAVSレベルを変化させる;インフルエンザAウイルス(Varga et al 2012年)麻疹ウイルス(Xia et al 2014年)ニューカッスル病ウイルス(Meng et al 2014年)およびC型肝炎ウイルス(太田および西山 2011)は、インターフェロンシグナル伝達を減少させることによって生存を延長する方法としてMAVSを減少または分解する。
ミトコンドリアの分裂と融合の変調
ウイルスは、ウイルスの生存に利益をもたらすために、ミトコンドリアの分裂と融合を操作することができる(Holder and Reddy, 2020)。ミトコンドリアは、ダイナミンに関連するGTPasesが関与する機能によって、そのOMMと内側ミトコンドリア膜(IMM)の分裂および融合を介して、その構造を変化させることができる(Tiku er al)。 OMMの融合はGTP加水分解を介してタンパク質Mitofusin 1とMitofusin 2によって媒介され、IMMの融合はIMMに存在するGTPaseであるoptic atrophy 1というタンパク質によって媒介される(Tiku et al 2020)。ミトコンドリアの融合は、ミトコンドリアのDNA、タンパク質、代謝物の交換に必要である(Archer, 2013)。一方、OMMの融合は、GTP加水分解を介して細胞質GTPaseダイナミン関連タンパク質1(Drp1)によって媒介される(Mears et al 2011)。ミトコンドリアの切断部位を見つけると、Drp1はミトコンドリア分裂因子およびミトコンドリアダイナミン関連タンパク質49および51と相互作用してOMMを収縮および切断する(Mears et al 2011; Loson et al 2013)。ミトコンドリアの分裂のメカニズムはよくわかっていない。分裂は、ミトコンドリアの損傷した部分を除去してマイトファジー(ミトコンドリアのオートファジー)によってクリアされるために必要であり、細胞周期の複製の間に必要である(Mao and Klionsky, 2013)。したがって、分裂の亢進は通常、マイトファジーの亢進をもたらす。
いくつかのウイルスは、MAVSのミトフシン2阻害に関与する機構を介して、ウイルスに対するインターフェロンプロ炎症反応を減少させるために、ミトコンドリア融合を促進することがある。例えば、デングウイルスは、その非構造タンパク質NS4Bを介してミトコンドリア融合を刺激し(Barbier et al 2017)HIVは、そのエンベロープタンパク質gp120を介して融合を増強する(Fields et al 2016)。SARSコロナウイルス(SARS-CoV-1)は、そのウイルス性因子ORF-9bを介して融合を増強する(Shi et al 2014)。これらのウイルス性因子は、核分裂誘導タンパク質であるDrp1のレベルを低下させるため、ミトコンドリアの不均衡な融合を引き起こし、これはミトフシン2によって駆動される。 ミトフシン2は、典型的にインターフェロンを増加させるMAVSと相互作用し、これを阻害するので(Yasukawa et al 2009)これはインターフェロン応答を妨げる可能性がある。興味深いことに、SARS-CoV-1は、同じORF-9bを使用してMAVSのレベルも直接低下させ、これはさらにインターフェロン応答を低下させる(Shi et al 2014)。
いくつかのウイルスは、ミトコンドリア分裂を誘導してマイトファジーを増強し、通常はDrp1のアップレギュレーションまたは活性化、および/またはMAVSの分解または阻害を介して、アポトーシスの速度を変化させる(Kanne et al 2015)。これらの中には、コアタンパク質およびタンパク質E1-E2を介したC型肝炎ウイルス(Kim et al 2014)ウイルスタンパク質vMIAを介したヒトサイトメガロウイルス(McCormick et al 2003)およびウイルスタンパク質HBxを介したB型肝炎ウイルス(Kim et al 2013)がある。これらの3つの特定のウイルスによって媒介される分裂は、ウイルスがより長く生存し、さらに複製することができるように、アポトーシスの抑制を導く(McCormick et al 2003; Kim et al 2013,2014)。
ミトコンドリアの融合および分裂に関するウイルスによる調節のために、それらの存在は、ミトコンドリアの数および形態の方法によるエネルギーレベルの変化につながる可能性がある。ミトコンドリアの分裂を引き起こし、アポトーシスの阻害につながるウイルスは、ウイルス粒子がより長く無傷で生存することを可能にする。ウイルス性の病気に感染すると、多くの患者さんが元気がないことから脱力感を感じることが多い。これは、分裂が増加した結果、ミトコンドリアのエネルギー産生が低下したためと考えられる。
細胞死
アポトーシス、またはプログラムされた細胞死は、ミトコンドリアの影響を受ける細胞のもう一つの重要な機能である。アポトーシスを活性化するためには、「死」受容体に結合する特定のリガンドによって制御される外因性経路と、ミトコンドリアによって制御される内因性経路がある(Brenner and Mak, 2009)。この内在性経路では、ミトコンドリア膜が伝染し、膜間空間タンパク質が細胞質に流出することにより、ミトコンドリア膜電位(MMP)が乱される(Shawgo et al 2008)。これらのタンパク質には、チトクロームc(Liu er al)。 1996)カスパーゼ-9(Du er al 2000)およびアポトーシスプロテアーゼ活性化因子1が含まれ、これらのタンパク質は、アポトソームを形成するために協働し、最終的なカスパーゼを刺激して細胞死の手順を実行する(Cain er al 2002)。
アポトーシスを引き起こすMMPの不安定化は、様々なメカニズムで起こると考えられている。第一に、選択的OMM伝染化のメカニズムである(Kuwana et al 2002)。Bcl-2タンパク質のBaxプロアポトーシスサブファミリーを構成するBaxとBakは、ミトコンドリア膜の孔として機能し、MMPを維持するとともに、ミトコンドリア内からチトクロームcやカルシウムを放出する(Nutt et al 2002)。BH3のみのサブファミリーとして知られる別のプロアポトーシスサブファミリーが活性化されたBax/Bakに付着すると、それらは伝染性を高め、アポトーシスの機会を増加させる(Chen er al)。 一方、抗アポトーシスBcl-2サブファミリー(Bcl-2およびBcl-xLを含む)は、活性化されたBax/Bakタンパク質に付着し、抗アポトーシス複合体を形成してBax/Bakを阻害し、アポトーシスの減少につながる(Shawgo et al 2008)。第二のメカニズムは、ミトコンドリア膜の脂質二重層構造に関与し、Baxが構造ストレスとホール形成をもたらす脂質の急速な再編成を作り出すことに関与する(Terrones et al 2004)。最後のメカニズムは、IMMにおける伝染性遷移孔複合体(PTPC)の刺激に関係している(Shimizu er al)。 これは、カルシウムまたは活性酸素種の過剰な量によって誘発され(Deniaud et al 2008)ミトコンドリアのあらゆる部分のタンパク質によって影響を受け得る。
ウイルスは、Bcl-2ファミリーメンバーおよびアポトーシス経路に関与する他の因子を模倣するウイルスタンパク質を使用して、細胞の寿命を適当に操作することができる。表1は、この点を説明するためのいくつかの一般的な例を示している。
表1 ミトコンドリアの内部機構によるアポトーシスに対するウイルス効果
| 抗アポトーシス | ||
|---|---|---|
| ウイルス; タンパク質 | 機構 | ノート |
| アデノウイルス; E1B-19K | Bcl-2模倣 | ハンら。(1996) |
| アフリカ豚コレラウイルス; A179L | Bcl-2模倣 | Brun etal。(1996) |
| 粘液腫ウイルス; M11L | Bcl-2模倣 | ダグラス等。(2007) |
| エプスタインバーウイルス; BHRF1 | Bcl-2模倣 | Hickish etal。(1994) |
| ヒトヘルペスウイルス8; カポジ肉腫関連Bcl-2 | Bcl-2模倣 | チェンら。(1997) |
| サイトメガロウィルス; vMIA | PTPC阻害 | ゴールドマッハー(2002) |
| SARS-CoV-1; NSP15 | 阻害されたMAVS誘導アポトーシス | スタウロスポリン誘発アポトーシスを阻害しなかったため、用量依存的かつ特異的であるLei etal。(2009)。 |
| アポトーシス促進性 | ||
| ウイルス; タンパク質 | 機構 | ノート |
| ヒトパピローマウイルス; E1およびE4 | 細胞内ケラチンネットワークを破壊し、ミトコンドリアを核の隣に蓄積させ、MMPを失います | Doorbar etal。(1991) |
| 水疱性口内炎ウイルス; マトリックスタンパク質M | Bcl-2ファミリーに干渉する | Gadaleta etal。(2005) |
| 鳥類脳脊髄炎ウイルス; 2C | カスパーゼ-9を活性化します | Liu etal。(2004) |
| C型肝炎ウイルス; NS4A | MMPを中断します | 野村瀧川ほか (2006) |
| C型肝炎ウイルス; NS3 | カスパーゼ-8を誘導します | Prikhod’ko etal。(2004) |
| インフルエンザA; PB1-F2 | MMPを中断します | Chanturiya etal。(2004) |
| ヒト免疫不全ウイルス1型; Vpr | Rapid dissipation of the MMP and interaction with components of the PTPC | Jacotot etal。(2000) |
| SARS-CoV-1; 遺伝子7a | 培養細胞で抗アポトーシスBcl-xLを阻害する | Schaecher etal。(2007) |
| SARS-CoV-1; ORF-6 | カスパーゼ-3を介したアポトーシスを誘導する | Ye etal。(2008) |
SARS-CoV-2とミトコンドリア
新規なSARS-CoV-2は、アンジオテンシン変換酵素2(ACE-2)宿主受容体(Cao et al 2020)上のスパイク糖タンパク質を用いてヒト宿主細胞に入り、宿主膜貫通型セリンプロテアーゼ2(TMPRSS2)を用いてスパイクタンパク質をプライミングして付着させる(Hoffmann et al 2020;図2)。ウイルス粒子はエンドサイトーシスを介して細胞内に入り、ウイルスの侵入が起こるためには、スパイクタンパク質が宿主酵素によって切断される必要があることが提案されている(Ou et al 2020)。ACE-2はミトコンドリアの機能に影響を与え、ACE-2の欠乏は、ATP産生の減少およびミトコンドリアにおけるNADPH酸化酵素4の変化した活性化と相関し、これは通常、活性酸素産生のために使用される(Singh et al 2020)が、病原体を破壊することによって細胞を保護するか、または感染した細胞がアポトーシスに移行するように引き金を引くことの両方を可能にする。SARS-CoV-2ウイルスがその侵入にACE-2受容体を使用することにより、通常の機能のためのACE-2の利用可能性が損なわれ、症状の発現に寄与する可能性がある。さらに、SARS-CoV-2由来のTMPRSS2は、ミトコンドリア機能の転写およびエネルギー恒常性を調節する核内受容体であるエストロゲン関連受容体αに作用することにより、ミトコンドリア機能にも影響を与えることが示唆されている研究もある(Xu et al 2018;Hoffmann et al 2020;Singh et al 2020)。
図2 肺の宿主細胞へのSARS-CoV-2の侵入
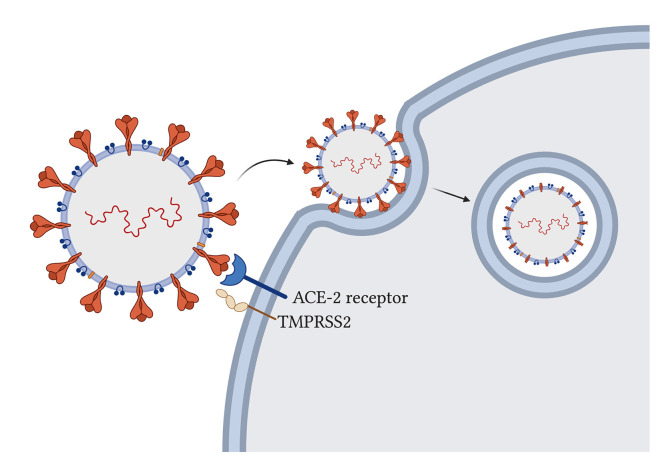
SARS-CoV-2粒子上のスパイク糖タンパク質は、侵入のためにヒトアンジオテンシン変換酵素2に付着する(Hoffmann et al 2020)。宿主膜貫通型セリンプロテアーゼ2は、スパイクタンパク質をプライミングして付着させる(Hoffmann er al)。 ウイルス粒子はエンドサイトーシスを介して侵入し、スパイクタンパク質は切断される(Ou et al 2020)。
細胞内に入ると、SARS-CoV-2は大規模な炎症反応を誘発する。上で詳述したウイルス感染時に引き金となる自然免疫機能を介して、TNF-α、INF-γ、およびインターロイキン-10などのサイトカインが感染細胞に到達し、遺伝子発現のアップレギュレーションおよび電子輸送鎖の調節を介してミトコンドリアの活性酸素産生の増加を引き起こす(Saleh et al 2020)。その後、ミトコンドリアの活性酸素は、ウイルスが持続し続けると、追加の炎症性サイトカイン産生を刺激し(Li et al 2013年)最終的には、適応免疫が間に合わない場合、過剰な炎症が致命的な害をもたらす「サイトカインストーム」を引き起こす。免疫応答はまた、ミトコンドリアがATP産生からエネルギーの一部を流用して活性酸素産生に寄与するようになり、ミトコンドリアに圧倒的な量の害を与え、膜の伝染性化およびアポトーシスにつながる(Saleh et al 2020)。重度に損傷したミトコンドリアがその内容物を細胞質空間に放出すると、COVID-19の特徴であるIL-1βおよびIL-6などのより多くのサイトカインの産生を刺激する(Saleh et al 2020)。
SARS-CoV-2によって採用されたミトコンドリア破壊の別のメカニズムは、重篤な転帰を示す患者のフェリチンの高レベルによって証明されるように、フェリチンに関係している(Aguirre and Culotta, 2012)。正常に機能しているミトコンドリアは、この鉄を利用してヘムを作り、鉄硫黄クラスターを作り、ミトコンドリアのフェリチンとして貯蔵する(Saleh et al 2020)が、鉄の過負荷は酸化ストレスを引き起こし、ミトコンドリアによる酸素消費を減少させることでミトコンドリアの機能を損なう可能性がある(Tang et al 2020)。さらに、フェリチンの過負荷は、ミトコンドリアの酸化ストレスを伴うこれらの細胞における耐糖能を混乱させることができ(Tang et al 2020年)これは糖尿病患者に意味を持つ。
SARS-CoV-2は、ミトコンドリア膜に由来する二重膜小胞を利用して細胞内に身を隠し、自らを保護しているという説がある(Singh et al 2020)。この理論は、ER由来の二重膜小胞を使用するHIVの証拠(Somasundaran et al 1994)と、齧歯類におけるコロナウイルスの点突然変異が、ER由来の小胞を減少させ、同時にミトコンドリアへのウイルスの局在化を増加させることが示されたという観察に基づいている(Clementz et al 2008)。さらに、ある研究では、SARS-CoV-2上の5′および3′の非翻訳領域がミトコンドリア局在化に特異的であることを発見したが、この知見についてはさらなる研究が必要である(Wu et al 2020)。SARS-CoV-1とSARS-CoV-2を比較すると、両方ともオープンリーディングフレームORF-9b、ORF-7a、およびORF-8bを含んでおり、これらは、SARS-CoV-1の場合にはミトコンドリアに局在化し、MAVS機能およびミトコンドリア機能を変化させる(Chen et al 2007; Shi et al 2014)。SARS-CoV-2はさらに、ORF-3aは存在するがORF-3bは欠失していた(Singh et al 2020;図3)。ミトコンドリア膜またはさらにはER膜からの二重膜小胞の形成を促すことにより、SARS-CoV-2は、その生存を脅かす活性酸素および宿主プロテアーゼからの攻撃を安全に回避することができる。一方、活性酸素は周囲に潜んでおり、健康な組織を攻撃することができる。
図3 SARS-CoV-2産物はヒト宿主細胞内のミトコンドリアに局在する
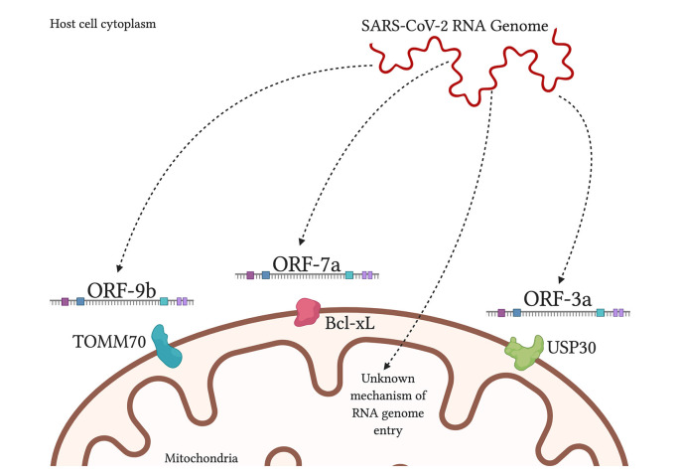
SARS-CoV-2 RNAゲノムは、未知のメカニズムによりミトコンドリアマトリックスに局在することが示されている。ウイルスタンパク質ORF-9bは、インターフェロン応答の活性化に影響を及ぼす可能性のある宿主受容体である外側ミトコンドリア膜70(TOMM70)のトランスロッカーゼと相互作用する(Gordon er al)。 ウイルスORF-7aは、OMM上の膜貫通タンパク質Bcl-xLに局在し、アポトーシスの促進を引き起こす(Schaecher et al 2007)。ウイルスORF-3aは、典型的にはミトコンドリアの分裂/融合およびマイトファジーに関与するユビキチン特異的プロテアーゼ30(USP30)に局在することが理論化されており;そしてUSP30と相互作用するORF-3aの配列は、SARS-CoV-2において見出されている(Singh et al 2020)。
SARS-CoV-1のORF-9bがプロテアソームによるDrp1の分解によりミトコンドリア融合を引き起こしているという証拠があり(Shi et al 2014; Holder and Reddy 2020)ゲノムの類似性を考えると、SARS-CoV-2のORF-9bも同様にDrp1の量を低下させ、より多くの融合を引き起こしている可能性がある。ミトコンドリアの融合は、部分的にはミトフシン2を介して行われ、MAVSの阻害を介してインターフェロン応答の阻害につながる可能性がある(Yasukawa et al 2009)。このことは、インターフェロン数の低下がインターフェロン誘導性アポトーシスを特異的に奪うことを示唆しているが(Chawla-Sarkar et al 2003)SARS-CoV-1がORF-6および-7aなどの他の因子を介してアポトーシスを誘導することが知られていることを考慮しなければならない(Schaecher et al 2007; Ye et al 2008)。両方のSARSウイルスを比較すると、SARS-CoV-2はヒト宿主細胞に対する必要性が終了したときにアポトーシスを誘導する可能性があることが示されている。さらに、鉄過負荷に伴うフェロトーシスまたはフェリチン誘導性アポトーシスの証拠がいくつかある。欠損したミトコンドリアは、通常のように鉄を代謝することができず、鉄の蓄積とフェロトーシスを引き起こす(Saleh et al 2020)。これはすべてCOVID-19での細胞死の数が増えることを暗示している。
SARS-CoV-2はまた、血小板数および凝固に干渉する可能性があり、具体的には、COVID-19の重症度が増加するにつれて凝固性が増加し、血小板数が減少する(Tang et al 2020;Terpos et al 2020)。脳卒中のリスクの増加とは別に、凝固性の増加および血小板の減少は、マイトファジーを受ける細胞の能力を障害している(Lee et al 2016)。血小板がマイトファジーを受けられなくなると、血小板はアポトーシスを受け、血栓形成の増加につながる;これは、酸化ストレスがミトコンドリアを破壊しながらマイトファジーを妨げる糖尿病患者に特に当てはまる(Lee et al 2016)。COVID-19患者は、高炎症および鉄の蓄積に苦しんでおり、その両方が血小板にストレスを与え、したがって血小板数の減少に寄与している(Saleh et al 2020)。
COVID-19では、男性の方が女性よりも重篤な転帰を示している。原因は不明であるが、TMPRSS2受容体が関与していると推測されている(Singh et al 2020)。TMPRSS2は、エストロゲンではなくアンドロゲンによって誘導され、ミトコンドリアに局在してミトコンドリア機能を調節することができる(Singh et al 2020)。また、高齢者では転帰が悪化している。老化はミトコンドリア機能の低下を伴い、これはウイルス性疾患の重症度を悪化させることが示されており、多くの加齢性疾患にも関連している。
ミトコンドリアと老化
炎症
“炎症 “とは、加齢に伴う高炎症に対する感受性の悪化を表す現象である(Hager et al 1994; Soysal et al 2016)。ミトコンドリアは、ミトコンドリア内タンパク質およびミトコンドリアDNA(mtDNA)が膜伝染に伴って細胞質空間に放出され、好中球のリクルートおよび単球からのサイトカイン産生を活性化するトール様受容体-9などの細胞内免疫受容体による認識につながるとき、炎症に寄与する可能性がある(Jang et al 2018)。さらに、循環中のmtDNAのレベルは、50歳以降の個体において着実に増加することが見出された(Pinti et al 2014)。
インフラマソーム、または自然免疫シグナル伝達の一部である多タンパク質複合体は、カスパーゼ-1を活性化する能力を介して、老化に関与し、特に加齢性疾患に関与していることが分かっている(Furman et al 2017)。カスパーゼ-1の活性化はミトコンドリアに有害である可能性があり、MAVS、ミトコンドリア膜カルジオリピン、ROS、および損傷したミトコンドリアからのmtDNAはすべて、インフラマソームを活性化することが発見された(Jang et al 2018)。さらに、SARS-CoV-2はインフラマソームを活性化する可能性があり(Shah, 2020)高齢者はさらに高炎症のリスクにさらされている。
mtDNA変異と活性酸素の増加
ミトコンドリアDNAは核内DNAよりも多くの変異を見ており、変異したmtDNAの加齢に伴う増加とROSレベルの増加は因果関係があるとされている(Reddy and Beal, 2005; Reddy, 2006; Kuka et al 2013; Kang et al 2016; Oliver D.) これは、mtDNAが呼吸鎖の活性酸素産生機械に空間的に近くに配置され(Chistiakov et al 2014)mtDNAの変異が活性酸素産生の増加およびミトコンドリアの機能不全をもたらし得る(Wallace 2010)という知見に起因していると考えられる。最も広く受け入れられている理論では、活性酸素はミトコンドリアの健康に有害な影響をもたらすだけであることを示唆しているが、一部の活性酸素は、酸化還元反応のバランスを整え、細胞を維持するための抗酸化機能を刺激するために必要であり、長寿にも寄与するという証拠もある(Schulz et al 2007; Yang and Hekimi, 2010)。それにもかかわらず、必要以上の量の活性酸素は、加齢に伴う細胞障害を引き起こす(Chistiakov et al 2014)。SARS-CoV-2が間接的に活性酸素産生を引き起こすことから、高齢者の細胞は、健康な若年者と比較して、このウイルスに感染すると、さらに大量の活性酸素にさらされる可能性がある。
ミトコンドリアの品質管理
ATP産生の減少と相まって、加齢に伴うマイトファジーの減少があり(García-Prat et al 2016)これは、制御されていない炎症ソーム活性(Jang et al 2018)に寄与するだけでなく、もはや効率的にエネルギーを生産できない可能性のあるミトコンドリアの蓄積にも寄与する。マイトファジーは、特に既に感受性の高い高齢の患者の間で、過剰炎症に寄与する可能性のある損傷したミトコンドリアを除去することにより、炎症を管理可能なレベルに保つ細胞の保護機能である。オートファジーやマイトファジーがないと、活性酸素のレベルが上昇し、酸化ストレスと関連する組織損傷を引き起こす(Yan and Finkel, 2017)。
ミトコンドリアの分裂および融合は、加齢とともに、および神経変性疾患において変化する重要な機能である(Reddy et al 2011;KandimallaおよびReddy 2016;Oliver D.およびReddy 2019)。ミトコンドリアの生合成は、質量を増加させるための成長と、数を増加させるための分裂から起こる(Chistiakov et al 2014; Pradeepkiran and Reddy 2020)。マイトファジーの減少やミトコンドリアの機能不全にもかかわらず、骨格筋では全体のミトコンドリア数が加齢とともに減少し(Crane et al 2010年)これはバイオジェネシスの減少によるものと考えられる(Chistiakov et al 2014)。核分裂と融合のバランスは加齢とともに低下する傾向があり、核分裂が減少し、ミトコンドリアの品質管理の低下やマイトファジーの減少につながる(Chistiakov et al 2014)。これは、DRP1を含む分裂に関与するタンパク質の調節障害に一部起因すると考えられる(宇田川 et al 2014)。融合は、飢餓誘発オートファゴソーム分解からミトコンドリアを保護することが明らかにされているが(Shi et al 2014)不均衡な比率は有害である可能性がある。融合のための比率が増加すると、細胞が損傷した、過剰に大きくなったミトコンドリアを処理することが困難になる。不適切に構造化されたミトコンドリアはストレスとなり、ROS産生の増加に転じ(Chistiakov et al 2014)初期の問題を追加する(図4)。SARS-CoV-1はミトコンドリアの融合を刺激することが観察されており(Shi et al 2014年)SARS-CoV-2もゲノムの類似性から同様の作用が期待できる。高齢者はすでにミトコンドリア融合の亢進を受けているため、このような能力を持つウイルスの追加的な負担をかわすには不利な立場にある。しかし、いくつかの研究では、高齢者の動物モデルにおける融合の増加を示している(Chaudhari and Kipreos, 2017)ので、一方の機能が他方の機能よりも増加しているという証拠は完全ではなく、さらなる研究と精緻化が必要である。
図4 正常なミトコンドリアの機能 vs. SARS-CoV-2の存在下でのミトコンドリアへの影響
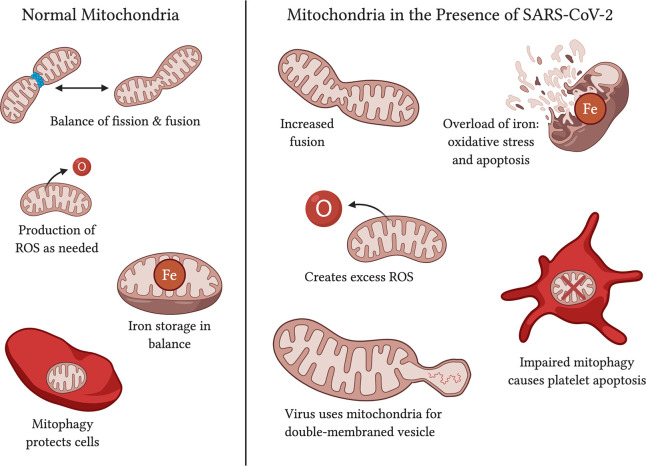
正常なミトコンドリアは分裂と融合のバランスがとれており、必要な量だけ活性酸素を産生し、バランスのとれた鉄の貯蔵を行い、機能的なミトコンドリアを維持し、細胞を損傷から守るためにマイトファジーを利用している。SARS-CoV-2の存在下では、ミトコンドリアは、融合を増加させ(Shi et al 2014;Zhang et al 2020年)ROS産生の過剰(Kuka et al 2013;Kang et al 2016年)貯蔵鉄の過剰(Saleh et al 2020年)および血小板のアポトーシスを導くマイトファジーの障害(Lee et al 2016;Tang et al 2020)を有する可能性がある。SARS-CoV-2はミトコンドリアに影響を与え、また、ウイルスが中を移動するための二重膜小胞の供給源として機能する可能性がある(Singh et al 2020)。
欠損したマイトファジーおよび融合・分裂の不均衡を通じたミトコンドリアの質の低下は、加齢に伴うエネルギー産生の低下に寄与している可能性がある。骨格筋を対象とした研究では、ミトコンドリアの呼吸能力が若い患者に比べて高齢の患者では約50%低下し、ATPの低下を伴うことが明らかになった(Conley et al 2000)。また、加齢はATP合成酵素活性を低下させることが示された(Frenzel et al 2010)。疲労や筋力低下がCOVID-19の症状の一つであることから、老化したミトコンドリアを持つ人は、このエネルギー不足にマッチしていると考えられる。
ミトコンドリアの酸化ストレスとカルシウムの異常安定化
老化におけるミトコンドリアの役割において考慮すべきもう一つの重要な因子は、ミトコンドリア伝染性遷移孔(mPTP)と関係しており、IMM上に位置し、ミトコンドリア内の過剰なカルシウムに反応して開く(Panel et al 2018)。mPTPのカルシウムに対する感受性は、細胞が酸化ストレス下にあるときに増加する(Halestrap and Richardson, 2015)。ヒトが加齢すると、基底カルシウムレベルが上昇し、より頻繁に毛穴を開くようにmPTPに影響を与える(Panel et al 2018)。これは、カルシウムが角質小胞体とミトコンドリアの間のコミュニケーションツールとして使用されるため、心筋に対してより有害な影響を及ぼすことが観察されている。調節された量で細胞質にカルシウムを放出する際のmPTPの制御がなければ、カルシウム移動の失敗、エネルギー産生の減少、および酸化ストレスの増加は、高齢者の心不全に完全に寄与する可能性がある(Szalai et al 2000; KohlhaasおよびMaack, 2013; Fernandez-Sanz et al 2014)。心臓発作の一種である心筋梗塞もまた、mPTP活性化と関連している;研究では、mPTP開通およびアポトーシスが老化した心臓細胞で増加していることが明らかになった(Fernandez-Sanz et al 2015);おそらく加齢による酸化ストレスの結果として(Ferrara et al 2008)。
神経疾患
変異したmtDNAの役割、酸化的損傷、エネルギー産生の低下、および活性酸素産生の増加は、すべて加齢に関連する神経疾患で一緒になっている。
アルツハイマー病は、フリーラジカル産生の増加および酸化ストレス、ミトコンドリア機能不全、およびATP産生の障害と関連している(Beal, 2005; Reddy and Beal, 2005, 2008)。mtDNAの変化の増加のための決定的な証拠はまだ浮上していないが、いくつかの研究では、その方向を指している(Coskun et al 2004)だけでなく、ADニューロンにおけるミトコンドリアの軸索輸送の障害に向かって(Stokin et al 2005; Calkins et al 2011)。アルツハイマー病は、ミトコンドリア膜上に存在するアミロイド前駆体タンパク質およびアミロイドβの蓄積を引き起こし(Crouch et al 2005;Manczak et al 2004年)そこでフリーラジカル産生の増加を誘導し、チトクローム酸化酵素活性を低下させ、ATP産生を低下させる(Parker et al 1990;Smith et al 1996;Gibson et al 1998)。
パーキンソン病の分析は、ミトコンドリア膜およびマトリックス中の疾患特異的なタンパク質を示している(Reddy, 2009; ReddyおよびReddy, 2011)。さらに、PINK1タンパク質の過剰発現は、呼吸障害をもたらすMMPを混乱させる(Redddy,2009;PradepkiranおよびRedddy,2020)。パーキンは、別のタンパク質であるリガーゼであり、OMMと関連し、フリーラジカル産生を誘導する(Reddy, 2009)。
ハンチントン病は、OMMに結合した変異したハンチンチンタンパク質を示し、また、フリーラジカル産生を誘導し、この疾患は、ハンチントン病に罹患した細胞におけるミトコンドリアの運動機能不全を示す(Reddy, 2009; Reddy et al 2009; Reddy and Shirendeb, 2012)。
通常機能するSOD1タンパク質は、細胞機能を保護するために活性酸素を探し出して対抗するが、筋萎縮性側索硬化症(ALS)では、変異したSOD1は、フリーラジカルに蓄積された酸化ストレスとミトコンドリアの機能不全を助長する(Reddy, 2009; Reddy and Reddy, 2011)。
加齢に伴う疾患とSARS-CoV-2の両方にミトコンドリアが関与しているという証拠を考えると、ミトコンドリアに障害がある人、特に神経疾患や糖尿病を持つ人では、ウイルスがより重篤な転帰を引き起こしやすいことは理解に難くない。
SARS-CoV-2と老化
高齢者は加齢とともに後天的な免疫力を失い、自然免疫系は、CRP-1,IL-6,およびフィブリノーゲンなどの炎症シグナルを増加させることによってそれを補おうとする(Franceschi et al 2007; Soysal et al 2016)。特筆すべきことに、C反応性タンパク質およびIL-6は、重症患者におけるSARS-CoV-2への応答において有意に増加する(Gong et al 2020)。血栓形成および血管の弱化に寄与する凝固プロセスに関与するフィブリノーゲンもまた、SARS-CoV-2への応答において増加することが観察される(Tang et al 2020;Terpos et al 2020)。持続的な炎症は、細胞破壊およびアポトーシスを引き起こし得る。SARS-CoV-2は、過剰な炎症を引き起こす可能性があり、炎症反応が過剰に刺激されやすい高齢者においては、この組み合わせは、「サイトカインストーム」による死に対してより感受性を高めることができ、高齢者集団の間で増加した死亡率の可能な説明を提供する(Jeyaraman et al 2020)。
老化細胞は、ミトコンドリア機能不全の増加から一部では老化を体現している(Wiley er al)。 先に論じたSARS-CoV-2によるミトコンドリアの健康への悪影響を考えると、高齢者は、既に弱ったミトコンドリアから始まり、ミトコンドリアに影響を与える疾患に直面している。このような進行は、結果を悪化させるだけである。老化はまた、SARS-CoV-2感染時に肺を保護する効果を持つマクロファージにも影響を与える;マクロファージが適切に機能しないと、SARS-CoV-2に対する体の反応が弱くなる(Liu er al)。 高齢者はまた、細胞質中のmtDNAのレベルが増加していることが発見され(Pinti et al 2014)自然免疫の誘導および炎症の増加におけるmtDNAの役割のために、これは、高齢のCOVID-19患者で見られる炎症の致死的レベルに寄与する別のメカニズムである可能性が高い(Singh et al 2020)。
SARS-CoV-2における糖尿病と肥満
ACE-2は、必要に応じて水分量を調整するためにレニン-アンジオテンシン系で機能する酵素であり、SARS-CoV-2が肺に入るための受容体を保持している。ACE-2は、アンジオテンシンIIを切断することで「負の」調節因子として働き、血圧の上昇で体に負担をかけないようにしている(Obukhov et al 2020)。年齢の増加および制御されていない糖尿病の両方は、ACE-2発現量の減少と相関する(Xie et al 2006;Obukhov et al 2020)。SARS-CoV-2による細胞侵入のためのACE-2受容体の使用は、その抗炎症目的のための酵素の利用可能性の低下を悪化させ、糖尿病患者における血圧および炎症の抑制されていない状態に寄与し得る。
ACE阻害剤およびアンジオテンシンII遮断剤で状態をコントロールしている糖尿病患者は、通常以上のレベルまではいかないかもしれないが、ACE-2の多少のアップレギュレーションを見る(AlGhatrif et al 2020)が、これは重度のCOVID-19から保護する可能性がある。通常糖尿病のためにメトホルミンという薬剤を服用している人は、服用していない人に比べて重度のCOVID-19感染症が少ないことも認められている(Scheen, 2020)。
肥満の人は、関連するメタ炎症、慢性的な低悪性度の炎症の状態(Mauvais-Jarvis 2020)に来る脂肪組織が増加している。これは、SARS-CoV-2がサイトカインストームを引き起こし、COVID-19のより重篤で、時には致死的な結果を引き起こす可能性が高くなる環境を作り出する(Mauvais-Jarvis, 2020)。ACE-2受容体の喪失を介した糖尿病患者のわずかに低下した抗炎症能力、肥満患者のメタ炎症、高齢患者のミトコンドリア機能と保護の質の低下を考えると、併存疾患を持つ高齢患者は、SARS-CoV-2感染をより重症化しやすいリスクのある特徴の組み合わせを持っていると推論することができる。
SARS-CoV-2の治療と予防
COVID-19患者での使用が現在承認されている薬剤には、ヒドロキシクロロキン、リバビリン、ロピナビル・リトナビル、ダルナビル、コビシスタットなどのリパーゼ薬、ファビピラビル、アルビドール、レムデシビル、および併用療法(Bhatti et al 2020;Kandimalla et al 2020)があり、そのほとんどは他のウイルスに対する抗ウイルス薬である。SARS-CoV-2に対するワクチンはまだ初期段階にあり、スパイクタンパクを標的とした様々な治療法があるが(Kandimalla et al 2020年)加齢に伴う適応免疫の低下のため、高齢者患者では効果が薄いかもしれない。
マイトファジーを標的とするために、患者は、既存のミトコンドリアの形状を保存するためにカロリー制限を使用することができる(Khraiwesh et al 2014)またはオートファジー/マイトファジーを増加させるためにポリアミンスペルミジンを使用することができる(Eisenberg et al 2016)。ザクロに含まれるウロリチンAもまた、マイトファジーを促進することが知られている(Ryu et al 2016)。マイトファジーを改善することで、炎症を抑え、高齢者に免疫反応を乗り切るチャンスを与える。実験的に、骨髄間質細胞からのミトコンドリア移植は急性肺損傷からの保護に有効であり(Islam et al 2012年)現在の使用のエビデンスはあまりないが、ここで使用できる技術である。
運動はミトコンドリアの衰えだけでなく、老化そのものを保護することが示されている(Fiuza-Luces et al 2013;Garatachea et al 2015)。筋肉量と強い血管系を維持することは、あなたのミトコンドリアを生き生きと維持するために体を励まする。何年にもわたって運動をすると、あなたの体は、よりストレスに強く、ホメオスタシスが高くなり、慢性的な病気やがんから守られるように適応する(Nilsson et al 2019)。肺に関しては、呼吸法のエクササイズが呼吸筋を鍛え、肺活量を増加させるのに有用であると推奨されていた。
それに沿って、生のカカオ、ベリー類、抹茶、ピーカン、アーティチョーク、ビーツ、ケール、ほうれん草などの抗酸化作用の高い食品を摂取することで、活性酸素によるダメージを防ぐことができる。心臓に良いオイル、魚、果物、ナッツ類、ニンニク、ハーブ、チョコレートなどの抗炎症性食品も悪くない(図5)。
図5 COVID-19のミトコンドリア中心機能障害を標的とするための提案された治療法
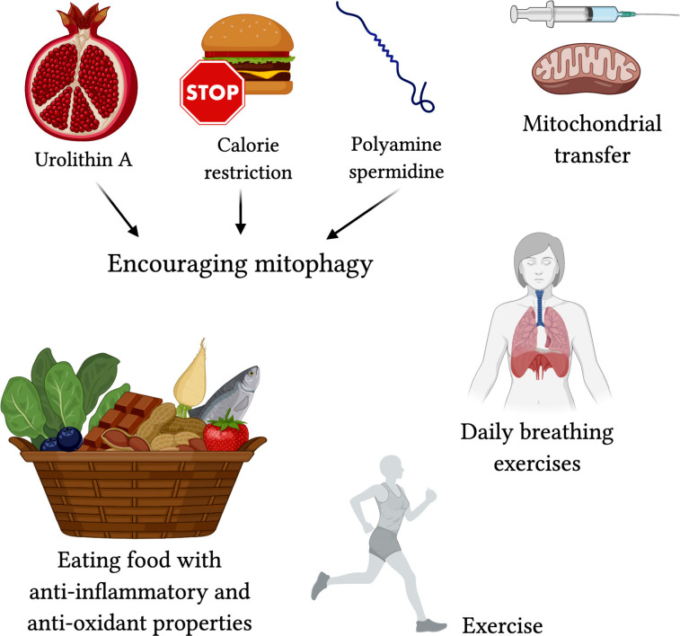
ウロリチンA(ザクロジュースに含まれる;Ryu et al 2016年)カロリー制限(Khraiwesh et al 2014年)ポリアミンスペルミジン(Eisenberg et al 2016)でマイトファジーを促すことは、COVID-19の重篤な影響を軽減する可能性がある。ミトコンドリア移植(Islam et al 2012)は急性肺損傷から保護する可能性がある。運動、呼吸法、抗酸化物質を多く含み、抗炎症作用を有する食品は、COVID-19の重篤な呼吸器症状からのより良い保護に寄与し得るライフスタイルの変化である。
結論と今後の方向性
SARS-CoV-2がなぜ高齢者、特に併存疾患を持つ高齢者に深刻な影響を与えているのかについては、炎症におけるミトコンドリアとその役割に関わる多くの研究が行われている。したがって、治療法の発見の方向性において、ミトコンドリアの役割を無視してはならない。老化したミトコンドリアと免疫力の低下との間にはいくつかの関連がある;その道筋としては、インターフェロンおよびサイトカイン放出による過剰刺激または持続的な炎症反応、分裂および融合の調節、ミトコンドリアのバイオジェネシス、およびアポトーシスおよびマイトファジーの干渉が挙げられる。多くの病原体は、細菌から寄生虫、SARS-CoV-2に類似したウイルスに至るまで、これらの機能に影響を与えることにより、細胞内に入ると宿主の行動に影響を与える方法としてミトコンドリアに影響を与える傾向を示している。
SARS-CoV-2はACE-2受容体を介して細胞内に入り、その遺伝子をミトコンドリアに送り込み、活性酸素産生、マイトファジー、鉄貯蔵、血小板凝集性、サイトカイン産生刺激などに影響を与える。これらの機能は、高齢化した患者ではすでに苦しんでいる。併存疾患を持つ患者では、ミトコンドリア機能の障害は、糖尿病におけるフェリチン貯蔵や心臓病における凝固性の亢進など、重篤な転帰に寄与する他の問題を増幅させる。このことは、COVID-19の治療で高齢の併存患者が最も重篤な転帰を示す理由を示し、薬物療法の開発に向けた一つの方向性を示していると考えられる。
世界中の科学者がCOVID-19という新しい病気の決定的な治療法を見つけようと努力している間、生存のチャンスを得るために自宅でできることはたくさんある。ミトコンドリアを強化することを目的とした薬の他にも、運動、新鮮な食べ物、呼吸法、一般的な予防医学の実践は、体を守るのに役立つだろう。
