Contents
pubmed.ncbi.nlm.nih.gov/33912931
Health effects triggered by tritium: how do we get public understanding based on scientifically supported evidence?
J Radiat Res.2021 Jul; 62(4):557-563.
オンライン公開 2021年4月28日doi:10.1093/jrr/rrab029
PMCID:PMC8273802
PMID:33912931
要旨
日本放射線学会「放射線災害対応委員会」は、トリチウムが引き起こす健康影響についてまとめた。これは、福島第一原子力発電所で発生・貯蔵されたトリチウムを含む放射性物質を高度液体処理システム(ALPS)で濾過した水を事故後に放出する問題に対応したものである。本総説では、トリチウムによって引き起こされる可能性のある健康影響について、信頼できる科学的根拠に基づき、一般市民にもわかりやすく詳細に説明した日本語の記述の内容を要約した。その上で、一般市民とのコミュニケーションに役立つよう、有機結合型トリチウム(OBT)の生化学的あるいは環境的挙動に関する追加情報をまとめた。
キーワード トリチウム、健康影響、放射線リスク、トリチウム水(HTO)
はじめに
2011年3月11日、巨大地震と津波に襲われた福島第一原子力発電所。事故後、日本の一般市民は、トリチウムによって引き起こされる可能性のある健康影響への懸念から、同発電所で生成・貯蔵されたトリチウム含有高度液体処理システム(ALPS)濾過水に活発な関心を寄せた。取り込まれたトリチウムの健康影響に関する多くの報告書が発表されている[1]が、これらの報告書はほとんどが専門家向けの専門的なものであり、一般市民を対象としたものではない。そこで、日本放射線学会「放射線災害対応委員会」では、福島第一原子力発電所で発生・保管されているトリチウム含有ALPS除染水の放出問題にちなんで、トリチウムによって引き起こされる可能性のある健康影響について、信頼できる科学的根拠に基づき、一般市民にも理解しやすいように記述した。本総説では、日本語(https://www.jrrs.org/assets/file/tritium_20191111.pdf)で作成された説明文の内容を翻訳・要約し、有機結合型トリチウム(OBT)の生物学的あるいは環境的挙動に関する追加情報を提供した。本解説は、トリチウムによって引き起こされる潜在的な健康影響について、信頼できる科学的証拠に基づき、一般市民にも理解できるように明確かつ詳細に説明している:
- (i) トリチウムとは何か。(化学物質の観点から)
- (ii) トリチウムとは何か。(放射性物質の観点から)
- (iii) 電離放射線を浴びた後、人体では何が起こるのか?
- (iv) トリチウムの曝露経路(吸入、吸収、摂取)と代謝
- (v) トリチウムによって引き起こされる健康影響。
続いて、科学者の助けになるであろう追加情報を以下に記す:
- (vi) OBTの環境中での挙動
- (vii) アカデミックな視点。
本書が英訳された目的は、世界中の一般市民の科学的理解のためだけでなく、放射線の健康影響に関する一般市民への働きかけや教育など、あらゆる科学的コミュニケーションに直面する科学者の一助となることである。従って、本総説は科学者と一般市民の双方にとって役立つものと確信している。
トリチウムとは?(化学物質の観点から)
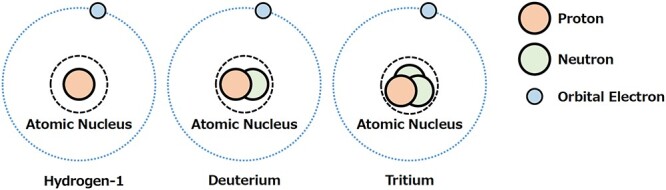
トリチウムは、天然に存在する希少な水素の放射性同位体である。1934年にM.オリファント(1901-2000)によって発見された[2]。自然界では、水素原子の圧倒的多数(99.9%以上)は原子核に陽子(1H)のみを含んでいる。重水素(2H)は、原子核に陽子と中性子を含む水素の別の同位体で、0.0115%を占める。残りは、原子核に陽子1個と中性子2個を含む三重水素(3H)である(図1)。水素1と重水素は水素原子の安定同位体であり、トリチウムは放射性同位体である。

図1 水素1とその同位体
トリチウムは、低エネルギーのβ線の形で放射線を放出することによってβ崩壊を起こす。宇宙空間にある宇宙線からの高エネルギーの中性子や陽子と大気中の酸素や窒素との反応によって自然に生成される。自然発生するトリチウム原子の数は地球表面積で0.2~1/sec/cm2[3]、すなわち1秒間に発生するトリチウム原子の総数は1~5×10-18個であり、地球表面積は5×10-14m2である。したがって、1年間に発生するトリチウム原子の総数は3.2×10-25~1.6×10-26個で、5.7×10-16~2.9×10-17Bqに相当する(ベクレルは、1秒間に1個の原子核が崩壊する放射性物質の放射能)。大気中のトリチウム濃度は、緯度によって異なるかもしれないが、約13 mBq/m3と推定されている[4]。
トリチウムは、核兵器実験や原子力発電所の副産物として、核分裂反応によって人工的に生成されることもある。こうした状況では、トリチウムは海や大気に放出される。大気中の大量のトリチウムは、核兵器実験、特に1945年から1984年にかけての水爆実験に由来する。核兵器実験によって発生したトリチウムの放射能の合計は、最大1.9×10-20 Bqと推定されている[5]。
自然および人工的に生成されたトリチウムは、大気中の酸素と直ちに反応し、反応生成物はトリチウム水(HTO)として大気/水循環に取り込まれる(図2)。

図2 水とトリチウム水の分子。
トリチウムとは?(放射性物質の観点から)
トリチウムの物理的半減期は12.3年であり[6]、1gあたりの放射能は3.6×10-14Bqである。上述のように、トリチウムは最大エネルギー18.6keV(平均5.7keV)のβ線(電子)を放出することによってβ崩壊を起こす。これに対し、動植物化石の考古学的年代測定によく使われる炭素14(14C)は、最大156keVのβ線を放出してβ崩壊する。生化学実験によく使われるリン32(32P)は、最大1,711keVのβ線を放出してβ崩壊する。従って、トリチウムからのβ線のエネルギーは極めて低く(図3)、放出される範囲は平均0.56μm、最大でも6μmと極めて短く、外部トリチウムからのβ線が動物細胞の核(直径約10μm)を通過することはまずない。したがって、トリチウムからのβ線による被ばくでは、外部被ばくではなく、HTOなどのトリチウム含有化学物質の吸入、吸収、摂取による内部被ばくを考慮しなければならない。

図3 トリチウム、炭素14、リン32からのβ線のエネルギー。
電離放射線を浴びた後、人体では何が起こるのか?
電離放射線によって引き起こされる人体への健康影響は、決定論的影響と確率論的影響の2つに分類される。
決定論的影響とは、組織反応に対する閾値以上の線量で電離放射線に被曝した場合に、組織幹細胞が死滅することによって症状が現れる健康影響のことである。組織反応の閾値線量は、1%の発生率レベルで組織傷害を誘発する線量と定義されている[7]。電離放射線被曝後、数週間にわたって症状が現れる典型的な初期影響としては、急性不妊症、永久不妊症、皮膚病変、造血障害がある。白内障は典型的な晩発性障害で、電離放射線被曝後数十年に及ぶ長い潜伏期間を経て症状が現れる。アコミア、永久不妊症、白内障の閾値線量は、それぞれ全身に3Gy、2.5-6Gy、0.5Gyである。妊婦が電離放射線に被曝した場合、胎児に誘発される決定論的影響として胚死亡と奇形がある。両者の閾値線量は、全身被ばく線量として0.1Gy(0.1Sv、ここではシーベルト[Sv]は放射線防護上、ヒトの健康リスクを評価するために用いられる放射線量の単位)であり、様々な決定論的影響の中で最小の閾値線量である。一方、確率的影響とは、電離放射線に被ばくした組織の細胞において、DNAの突然変異が蓄積することによって確率的に現れる健康影響のことである。代表的な確率的影響は固形がんや白血病である。したがって、全身被曝線量として0.1Gy(0.1Sv)以下の電離放射線が引き起こす健康影響は、確率的影響に過ぎない。しかし、0.1Gy(0.1Sv)未満の電離放射線の全身被曝によって誘発される確率的影響については、まだ証拠がない。
電離放射線は、生体を構成するDNA、タンパク質、脂質などの分子成分と相互作用し、その機能を変化させる。特に、遺伝情報をコードするDNAの化学変化は、電離放射線の生物学的影響を考える上で重要である。電離放射線は、鎖切断や構造変化などのDNA損傷を誘発する。DNA損傷が修復されないまま、あるいは誤って修復されたまま放置されると、突然変異やゲノムの不安定性が誘発され、がんの原因となる可能性がある。しかし、ヒト細胞に存在するDNA損傷修復システムは、代謝によって内因的に、あるいは電離放射線などの環境因子によって外因的に誘導されたDNA損傷を一貫して修復している。修復されなければ細胞死にもつながるDNA二本鎖切断に対しては、主に2つの修復システムが機能している。ひとつは非相同末端結合(NHEJ)修復で、切断されたDNA末端同士を結合させる。もうひとつは相同組換え(HR)修復で、損傷していないDNA鎖を鋳型としてDNAを再構築する。DNAの二本鎖切断がNHEJ経路によって修復されると、DNA配列の一部が失われることがある。しかし、ヒトゲノムにおいて、タンパク質をコードする領域はDNAのわずか2%であり、言い換えれば、ゲノムDNAの一部の配列が失われても生物学的変化につながることはほとんどない。そのため、NHEJ経路によって一部のDNA配列が失われたとしても、生物学的変化はほとんど誘導されないと一般に考えられている。HR経路では、DNAの二本鎖切断は遺伝情報を失うことなく修復される。しかしながら、HRが機能できる細胞周期の段階は特定の段階(SとG2)に限定されている。これらの段階では、HRは損傷していない姉妹染色分体DNAを鋳型として、損傷した鎖を修復する。したがって、HR経路は活発に分裂している細胞でのみ利用可能である[8]。これらのDNA修復システムに関連する多くのタンパク質分子は、DNA損傷の認識、他のタンパク質へのシグナル伝達、DNAの切断末端の結合など、個々の機能を有しているため、電離放射線被曝後の細胞では、それらの細胞内含量や局在が刻々と変化していることが解明されている[9,10]。
トリチウムの曝露経路(吸入、吸収、摂取)と代謝
トリチウムによる健康影響を理解するためには、内部被ばくを追跡する必要がある。トリチウムの被曝経路は以下のように考えられる;
-
- (i) 鼻と口から大気中のHTOを吸入する。
- (ii) 皮膚からのHTOの吸収
- (iii) 飲食物に含まれるHTO(またはトリチウム含有有機化合物)の摂取。
体内に取り込まれたHTOは体液の循環経路に浸透し、最終的に体外に排出される。体内に取り込まれたHTOは、H2Oと同様に比較的速やかに排出されるため、トリチウムの生物学的半減期は約10日である[1]。しかし、トリチウムによる内部被ばくの影響を理解するためには、トリチウム原子の一部(体内に吸収されたHTOの5~6%)が、体内のタンパク質や糖質などの有機化合物中の水素原子との交換、いわゆるOBTにより、体内成分として存在することを理解することが重要である。OBT、特に有機化合物中の炭素原子に結合したトリチウムは、有機化合物中の他の原子と交換しにくいため、体内で長く留まる。したがって、OBTの生物学的半減期は、短期成分で約40日、長期成分で約1年である。したがって、上述のように、体内に吸収されたHTOの大部分(94~95%)は、比較的速やかに排出される。UNSCEAR[1]およびICRP[11]によると、体内に取り込まれたHTOの曝露経路(吸入、吸収、摂取)と代謝は図4に描かれている。
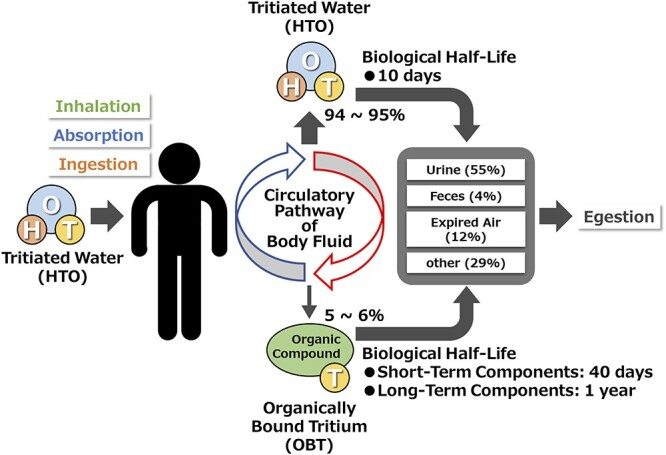
図4 人体におけるトリチウム水の代謝[1,11]。
トリチウムが引き起こす健康影響
成人の経口経路で体内に取り込まれたトリチウムの最新の公約実効線量係数は、可溶性形態で1.9×10-8 mSv/Bqであり、生物起源形態のそれは5.1×10-8 mSv/Bqである[12]。ICRP[11]に記載されている一般公衆の年齢依存係数値を表1にまとめた。これらの値は、セシウム137(137Cs)(1.3×10-5 mSv/Bq)の約1/300であり、トリチウムによって引き起こされる健康影響は、同じ取り込み量のBq(表1)の下では137Csに比べて広範囲に低いことを示唆している。
表1 トリチウム水、セシウム134、セシウム137、ヨウ素131の実効線量係数[11](mSv/Bq)
| トリチウム水 | セシウム134 | セシウム137 | ヨウ素131 | |
|---|---|---|---|---|
| 赤ちゃん(3カ月) | 6.4 ×10-8 | 2.6 ×10-5 | 2.1 ×10-5 | 4.8 ×10-5 |
| 子供(1歳) | 4.8 ×10-8 | 1.6 ×10-5 | 1.2 ×10-5 | 1.8 ×10-5 |
| 子供(5歳) | 3.1 ×10-8 | 1.3 ×10-5 | 9.6 ×10-6 | 1.0 ×10-5 |
| 小人(10歳) | 2.3 ×10-8 | 1.4 ×10-5 | 1.0 ×10-5 | 5.2 ×10-5 |
| 小人(15歳) | 1.8 ×10-8 | 1.9 ×10-5 | 1.3 ×10-5 | 3.4 ×10-5 |
| アダルト | 1.8 ×10-8 | 1.9 ×10-5 | 1.3 ×10-5 | 2.2 ×10-5 |
トリチウムによる個体死への影響
Brue らは、1.3 ×10-8から 8.4 ×10-9 BqのHTOをCF1 雌マウスに腹腔内投与し、30日以内の半数致死量(LD50/30)を解析した。その結果、LD50/30は 9 Gy であり、3.7 ×10-7 Bq/g 体重に相当した[13]。その後の報告によると、CF1雌マウスではLD50/30は8Gyで3.3×10-7 Bq/g体重に相当し[14]、(C57BL/6 N×C3H/He)F1雌マウスではLD50/30は13Gyで4.7×10-7 Bq/g体重に相当した[15]。したがって、HTOを腹腔内投与したマウスのLD50/30は、約4.0×10-7 Bq/g体重に相当する10 Gy前後であると考えられる。
トリチウムの長期摂取による人体への放射線被曝事故は、1960年代にヨーロッパの2つの時計工場で起きた2件の報告がある。当時、時計の文字盤を描くためにトリチウムを含む夜光塗料が一般的に使用されていた。あるケースでは、工場労働者が7.4年間にわたって夜光塗料に溶け込んだトリチウムを摂取した。彼の被曝線量は尿中のトリチウム含有量から3-6Svと推定された。彼は等色性貧血を発症し、その後汎血球減少症で死亡した[16]。2例目では、夜光塗料に組み込まれたトリチウムを3年間にわたって摂取し、推定積算線量が10~20Svと推定された工場労働者が、同様の経過をたどった後に汎血球減少症で死亡した[15]。この2人は、長期にわたってトリチウム以外の放射性同位元素にも被曝していたことに留意すべきである[17]。
トリチウムによる発がんへの影響
現在のところ、トリチウムのヒトに対する発がんリスクに関するデータはない。しかし、マウスを使った実験でいくつかの知見が得られている。ある実験では、約550匹のF1雌マウス(C57BL/6 N×C3H/He)に、生涯にわたって様々な濃度のHTOを継続的に摂取させ、その平均寿命、発がん集団、がんの種類を分析した[18,19]。体内のトリチウム濃度は 7日で平衡に達するため、実験開始から 7日以上経過後に採取した一部の臓器のトリチウム含有量から被ばく平均線量率(mGy/day)を推定した。
対照マウスの半数にがんが発生したが、10mGy/日以上の濃度のHTOを摂取したマウスでは、がん誘発の明らかな増加が見られた。これらのデータから、3.6 mG/日以下の線量では、がんの発生率に観察できるような影響はないことが示唆された。さらに、HTOを3.6 mGy/日以下の濃度で摂取したマウスにおけるがんの種類と発生頻度は、対照マウスと同様であった(図5)[18]。3.6mGy/日未満のHTOを摂取したマウスの平均寿命は、生涯を通じて1.4×10-8 Bq/リットルのHTOを摂取したことに相当し、対照マウスとほとんど変わらなかった(図6)。10mGy/日以上のHTOを摂取したマウスの平均寿命は、HTO濃度が高くなるにつれて短くなった。著者らはさらに、寿命短縮および胸腺リンパ腫の発生率と線量率との関係を分析した。1つは、生命短縮に対しては2mGy/日、胸腺リンパ腫に対しては12mGy/日の「必須線量率閾値」であり、もう1つは、生命短縮に対しては0.2mGy/日、発癌に対しては0.9mGy/日の「実用的な尾部閾値」である(図6、表2)[19]。これらを総合すると、HTOによって誘発される発がんに対する被曝の平均線量率の実用的な閾値は、0.9~12 mGy/日の範囲であると考えられる。つまり、3.5×10-8Bq/リットルのHTOを生涯摂取したマウスの発がん率は、対照マウスのそれとほぼ同じである。なお、これらの知見はマウス実験によるものであり、ヒトでの知見はまだ不明である。

図5 HTOを摂取したマウスに発生したがんの種類[18]。

図6 異なる投与率でHTOを摂取したマウスにおける胸腺リンパ腫の発生率と寿命の短縮[19].
表2 異なる投与率でHTOを摂取したマウスのがん発生個体数と平均寿命[19]
| 線量率(mGy/日) | 0 | 0.2 | 0.9 | 3.6 | 10 | 24 | 48 | 96 | 240 |
|---|---|---|---|---|---|---|---|---|---|
| がん罹患人口(%) | 52 | 49 | 78 | 46 | 83 | 70 | 70 | 84 | 76 |
| 平均寿命(日) | 808 | 790 | 758 | 804 | 622 | 481 | 414 | 259 | 165 |
トリチウムによる脳神経系への影響
Gaoらは、妊娠13日目にHTOを摂取した雌ラットの子宮内で46,92,273mGyで被曝したWistar系ラット胎児の脳神経系を分析した。45日齢または46日齢の乳児ラットの脳の重量は、273 mGyで被曝した群で有意に減少した。92mGyで被ばくした乳児ラットでは、海馬の紡錘形神経細胞の細胞密度の減少を伴う学習・記憶障害が認められた[20]。
腹腔内にHTOを投与した動物の子宮内で100mGyまたは300mGyを被曝した乳児のC57BL/6 Jマウスでは、認知機能障害が認められた[21]。
有機結合したトリチウムの環境中での挙動
OBTの環境中における生物学的蓄積を懸念する声もあるので、OBTの生態系における挙動について簡単にまとめておく。OBTの環境中挙動に関する科学的データはまだ限られているが、OBTを含むトリチウムの生物蓄積はそうでないことは明らかだ。ここでは、OBTの生物圏における挙動について発表された総説の要約を紹介する[22]。
環境中のOBTは、交換性OBT(E-OBT)と非交換性OBT(NE-OBT)に分類される。イネ科植物では、OBTの約65~70%がNE-OBTで、残りがE-OBTであると推定されている。生物中のE-OBTは、組織自由水トリチウム(TFWT)と容易に平衡化し、周辺環境に流出する。一方、NE-OBTは植物や土壌中の微生物、魚の体内などに長期間残留する。従って、生物中のNE-OBTは、環境中のトリチウムの過去(数ヶ月から数)の濃度を反映している可能性がある。そのため、藻類や魚類中のトリチウム濃度が調査地点の周辺水域よりも高いという報告もある[22]。地衣類や材木中のOBTは、より長期間(数年間)の環境中のトリチウムの過去の濃度の良い指標になる可能性があるが、それらの環境中のトリチウムの分析方法は正確に確立されていないことに注意すべきである。
環境中のOBTは、ヒトを含む食物連鎖に移行する可能性がある。多くの報告が、OBTの約70%がTFWTや周辺環境と交換しにくい形で隔離されている可能性を示唆している[22]。トリチウムの滞留時間は、トリチウムの物理的放射性崩壊(12.3)よりも短いが、陸上生物圏におけるOBTの貯蔵庫として機能している。これらの観察結果は、原子兵器のような人工的な供給源から大量のトリチウムが導入された場合、OBTの半分以上が食物連鎖の中で再利用され続けることを示している。従って、放射線リスクが無視できる陸上環境中のトリチウム濃度を低く保つことは、人間の健康を維持するために重要である。
学術的視点
ここでは、トリチウムの生物学的影響に関する最新の知見を、無機および有機結合の化学構造の両方についてまとめた。この総説は、トリチウムの健康影響に関する公衆教育に携わる科学者にとって大きな助けになると考える。科学的根拠に基づき、トリチウムの被ばく線量とリスクとの関係を認識すべきである。しかし、低線量あるいは低線量率放射線の生物学的影響については、放射線の種類にかかわらず、依然として議論の余地がある。HTOの生物学的影響は主に低線量・低線量率被ばくによるものであるため、トリチウムによって引き起こされる生物学的影響を評価するためには、独自の高感度実験システムが必要である。残念ながら、そのような実験系は現在ほとんどない。また、トリチウムが引き起こす生物学的影響に関する科学的証拠のほとんどはモデル動物を用いて得られたものであるため、ヒトへのリスクを正確に外挿できない可能性がある。低線量・低線量率の電離放射線被曝が引き起こす健康影響の検討と解明が、公衆衛生の確保のために将来にわたって継続されることを強く希望する。
謝辞
また、Edouard I. Azzam博士(Rutgers New Jersey Medical School)とTom Hei博士(Colombia University)には、論文の校正と多くの寛大なコメントをもらった。本研究は、日本学術振興会科研費JP19HP2003の助成を受けた。