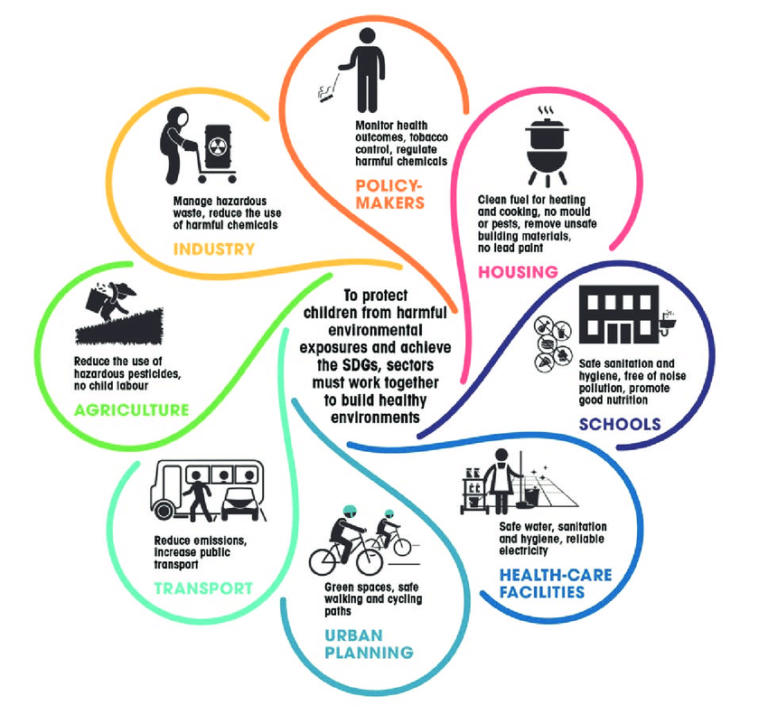
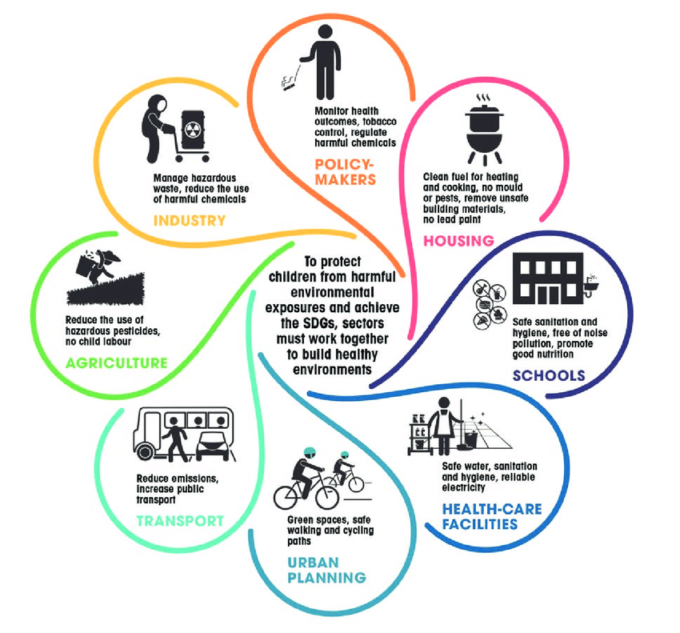
Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC6356139/
2019年1月オンライン公開
要旨
現在進行中の慢性疾患の流行は、幼少期に始まった進行性の代謝機能障害の晩期症状であると理解されている様々な臨床的実体を含んでいる。これらの疾患は不利な立場にある人々に不釣り合いに影響を与え、公衆衛生上の努力にもかかわらず続く健康格差を悪化させる。
ストレスの多い心理社会的、環境的要因への過度の暴露は、リスクの高い環境における集団レベルの格差に寄与することが知られている要因の一つである。しかし、たった一度の有害な環境暴露でさえも、特に発育期のごく早期には、文字通り生物学的に組み込まれ、将来起こるすべての有害なストレス因子に対する反応(例えば、コルチゾール、免疫、炎症)を増幅させ、その結果、病気を促進させる経路を長期にわたって誘発することが、次第に明らかになってきている。この経路は、先祖代々受け継がれてきた遺伝子変異と相互作用して、慢性疾患のリスクを変化させる可能性もある。
我々は、リスクの高い集団において、環境的に活性化された疾患促進経路が、生物学的根拠に基づく疾患感受性表現型にどのように寄与しうるかを議論している。これは、複数の有害な曝露を受けた集団において独特のダメージを与え、世代を越えて伝播する可能性が高い。この生物学的視点は、既存のモデルを補完することを意図しており、健康格差の縮小を促進する可能性のある主要な研究機会やライフステージの優先順位に焦点を当てている。
リスクの高い集団における不公平な健康状態には、心理社会的、経済的、身体的なストレスのかかる環境設定など、複雑な原因がある。1 こうしたリスクの高い集団における不健康は、一つには、こうしたストレス要因の蔓延、長期にわたって繰り返されるチャレンジの蓄積、世代を超えて続く疾患リスクの持続、こうしたストレス要因に対する生体反応を高める先祖伝来の遺伝子変異に起因している。これに対し、国立少数民族・健康格差研究所は、健康格差研究の現状と今後の方向性を広く見直すため、最近、科学ビジョン策定プロセスを招集した。本稿は、環境ストレスが慢性疾患を引き起こす生物学的メカニズムの関連性に焦点を当てたもので、ビジョン策定プロセスの様々な側面をまとめたシリーズの一部である。ライフコース・アプローチなどの主要なモデルについては、別途取り上げている。
健康格差の顕著な道筋を明らかにするために、非伝染性慢性疾患の発症における共通項としての生物学的基質、曝露と疾患の結果との間の中間的役割、そして健康格差を説明する社会学的モデルの関連要素をどのように表しているかについて検討した。最後に、有害な環境暴露によって慢性的に活性化される疾患促進生物学的経路の特定のセットが、集団レベルの健康格差の既存のモデルにどのように有用に統合されうるかを強調する。
過去20年の科学の進歩により、有害な環境条件と人間の慢性疾患リスクとの間に明確な生物学的関係が証明され2,3、有害な外部環境が文字通り個人の生物学に組み込まれる特定の病態生理メカニズムが定義されている4,5。そこで我々は、リスクの高い環境での高い曝露率によって拡大する健康格差の広がりに影響を与える可能性のある3つの生物学的要因について述べる。
- 非常に早いライフステージ(すなわち、受胎前および受胎周辺、6 妊娠中、幼児期)は、影響を受けるシステムの幅と影響の持続性の両方において、環境的に誘導された疾患促進経路の影響を最も劇的に受けやすい。特定の器官の発達に対する影響は通常不可逆であり、これらの重要な時期に予防することによって潜在的な利益が最大限に得られると考えられることが強調された。リスクの高い地域社会では、これらの最もリスクの高い段階すべてにおいて、悪条件が作用している可能性が高い。
- 初期に1回でも曝露された生物学的疾患促進経路は、将来のあらゆるストレス因子に対する身体的ストレス反応(例えば、視床下部-下垂体-副腎[HPA]およびコルチゾール軸、交感神経および炎症反応性)の長期的過敏性をもたらし、長期にわたって繰り返し曝露された有害物質の疾患促進への影響を増幅する疾患感受性表現型の一因となり得る。
- 新たな遺伝学的手法により、有害な環境刺激に対する個人の反応を修正する、祖先と関連した遺伝子変異が同定されている。疾患促進経路を深く理解することで、民族的な遺伝子変異の潜在的な作用機序を示唆することができる。
しかし、環境感受性の高い生物学的経路、その時間的軌跡、可逆性はまだ十分に定義されておらず、集団レベルでの健康格差に関する現在の理解にも統合されていない。我々は、これらのメカニズムを既存の健康格差モデルにどのように組み込むことができるかを検討し、高レベルの逆境に直面している個人やコミュニティで独自に誇張されたり、先祖に関連する遺伝子変異によって悪化したりする、病気にかかりやすい表現型の理解に貢献することができると考えている。
健康格差の最終的な共通経路
環境と関連した慢性疾患に対する認識が広まったのは、まずBarkerらによる歴史的コホート研究がきっかけであり、母体と胎児の低栄養が成人後の心血管疾患リスクを高めることが明らかになった2,3。7 不利な心理社会的ストレス要因4,8および毒素曝露9(例えば、薬物、化学物質、環境汚染物質および公害物質)も、生物学的機能不全および慢性疾患の誘因であることが十分に立証されている。疾病の結果は、心代謝系疾患だけでなく、慢性アレルギー疾患や自己免疫疾患10、特定の癌2、神経行動障害11にまで広がっている。
3つの幅広いカテゴリーの有害な環境暴露(例えば、低栄養、3心理社会的ストレス要因、12毒素9)は、慢性疾患のリスクを高めるために生涯にわたって作用する長期にわたる生物学的変化を引き起こすことが知られている(図A、パネル1[本論文のオンライン版の付録として www.ajph.org で閲覧可能])。これらの経路は、複数の身体システムで協調して作用し、将来の有害なストレス因子に対する反応性を高め、様々な慢性疾患への罹患を引き起こす(図A)。重要なことは、一度の有害なストレスにさらされたからといって、必ずしも明らかな疾病につながるとは限らないということだ。例えば、痩せ型で生まれた男性コホートでは(一撃目として出生前の栄養不良を反映)、その後、社会経済的に低い条件で育てられた人(二撃目)においてのみ冠動脈疾患のリスクが上昇することが分かっている。このことは、重大な保護因子の存在を示唆しており、すでにリスクの高い人々を保護するために、保護因子を特定し強化する必要性を強調している。
発達段階における不利な環境曝露によって誘導される生物学的疾患促進パスウェイ
| パスウェイ | 不具合のあるシステム | 分子メディエーター | 即効性のある副作用 | 長期的な影響 |
| 臓器構造および機能的能力の変化 |
|
|
減少した
|
|
| ストレスおよび闘争・逃走反応の過敏性 | HPA軸の過剰な活動
|
より高いレベルの
|
|
|
| 自然免疫系および炎症系の過敏性 | 活性化された炎症誘発系と抗炎症系、例.
|
|
炎症の原因
免疫・自己免疫反応性の亢進 |
|
| エネルギー恒常性の乱れ |
|
エビデンス
|
|
肥満がもたらすもの
|
| 神経行動学的発達および機能の障害 | 神経機能の低下による異常
|
|
報酬中枢(ドーパミン作動性)、感情(セロトニン作動性)、実行機能に関する視床下部神経回路の変化 |
|
注 ADHD = 注意欠陥/多動性障害、angII = アンギオテンシンII、CNS = 中枢神経系、GC = グルココルチコイド、HPA = 視床下部-下垂体-副腎、HTN = 高血圧、PTSD = 外傷後ストレス障害、TG = トリグリセリド、Th = Tヘルパー細胞。
これらの特徴は、21世紀の社会を覆っている慢性疾患は、その大部分が、発育期に共通の生物学的疾患促進経路によって環境的に誘導され、持続的な多系統の機能不全を生み出していることを示唆している(図A、パネル6)。リスクの高い地域社会では、栄養的、心理社会的、有害物質への曝露がより多く見られることが知られており、特に脆弱な発達期を通じてその影響が大きいことから、同じ疾患促進生物学的メカニズムが集団レベルで作動し、慢性疾患の負担を不当に増加させることが予測される。
環境感受性の勾配
環境による生物学的変化の持続性に対する個人の感受性は、特定の器官、制御システム、組織の可塑性の発達の軌跡を反映して、年齢とともに変化する。年齢の上限は定められていないが、脆弱性は胎児と乳児期にピークに達し、小児期にはそれほどでもないが持続し、思春期に再び増大し、特に脳については若年成人期まで続く(図A、パネル2)14。小児期から青年期にかけての特定の有害な曝露に対する感受性のプロファイルについてはほとんど知られておらず、成人期を通じての感受性の継続についてもあまり知られていない。また、発達期が保護的介入に対する感受性を高める時期であるかどうかについても全く知られていない。
エピジェネティックな過程
エピジェネティクスとは、環境応答性の遺伝子制御システムのことであり、環境シグナルを感知して遺伝子発現を変化させるトランスデューサーであると考えられる。エピジェネティックな反応は様々な刺激に対して偏在しているため、健康格差に関連する未解決の問題としては、格差に関連するエピジェネティックマークが特定の種類の曝露に特異的であるか、因果関係があるか、機能的に回復可能か、老化や先祖に関連する遺伝子変異と区別されるかが挙げられる17。同様に、持続的な保護育児は、社会経済的地位の低さに関連するエピジェネティックマーカーのサブセットを逆転させ、測定可能な健康上の利益と相関することが見出された19。
疾病を促進する経路
進化的に保存された生理学的システムは、環境の脅威に対する保護反応を通じて生存を促進するように設計されている。これらの生存システムは、特に発達段階において、有害な環境暴露を受けると、エピジェネティックに駆動され、構造的・機能的に長く続く変化を受ける可能性がある。この反応亢進は、一般的に生涯を通じて持続し、これらの反応パターンの変化が、健康格差を特徴付ける疾病の転帰を引き起こす疾病感受性表現型の一因となっている。この表現型に関連する5つの経路について、本ページの囲み記事で説明する。
臓器の構造と機能的能力の障害
代謝負荷に対する耐性の低下 母体-胎児間の栄養不良や心理社会的ストレスにさらされると、ある臓器の成長が遅くなり、通常、正常に機能するユニット(例えば、腎臓ネフロン、心臓心筋細胞、すい臓インスリン分泌Β細胞)の数が永久に減少する3)。21 ネフロン、心筋細胞、インスリン分泌Β細胞の数が少なく、小さく生まれた子供に見られる出生後の急激な体重増加は、その後の腎臓病、心不全、糖尿病のリスクを高める。
ストレス反応の過敏性
有害な曝露に伴うHPA軸の過敏性については、動物で広く立証されている。ヒトでは、低出生体重児、早期の親離れ、低社会経済状態が、HPAの過剰反応と関連している(S58ページのボックスを参照)4,22。過剰コルチゾール活性への慢性暴露は、ヒトではインスリン耐性、中枢脂肪蓄積、高血圧、免疫機能障害23を介することが知られているが、環境活性化慢性疾患におけるその正確な役割は十分に解明されていない。同様に、交感神経24およびレニン-アンジオテンシン系25の過活動によるホルモンメディエーターは、インスリン抵抗性と関連しており、組織の酸化ストレスと炎症を直接的に増加させる。これらの持続的な過活動は、初期の多臓器ストレスを引き起こし、傷害や機能不全へと進行し、進行性の多臓器疾患の舞台となる可能性が高い。
例えば、母親の高脂肪食や肥満26に暴露された正常体重の新生児サルの脳や肝臓、母親の低栄養に暴露されたラットの腎臓に炎症が起こっている。幼少期の暴露は、免疫細胞の発達の変化や胎児リンパ球のコルチゾール過剰暴露などの多様なメカニズムを通じて、子孫の自然免疫および適応免疫機能を直接変化させ、アレルギーや自己免疫疾患のリスクを高める可能性もある10。
エネルギー調節障害
栄養誘導型、ストレス誘導型、および一部の毒性曝露の主要な特徴であるエネルギー調節障害は、インスリン抵抗性を促進する、これまでに述べた同時活性化経路に一部起因している20, 23-25 このため、グルコース摂取が損なわれ、中枢脂肪沈着や炎症が増加する。さらに、胎児期および新生児期における曝露による脳の構造および機能の発達上の変化は、エネルギーバランスの乱れの重要な構成要素であり、発達中の視床下部の神経回路を修正して、子孫の食欲を増進し、食欲を抑制する満腹感を感知するドーパミン神経系報酬系を鈍感にする27。母体-胎児間の栄養不足および栄養過多の状態は、出生後の成長の加速およびその後の子孫の肥満をもたらす可能性がある。2,3 過度の中心性肥満は、代謝過多、炎症、インスリン抵抗性およびエネルギー不均衡をさらに増幅し、肥満の二次的な心代謝系合併症および全死因死亡率を促進する。
神経行動学的機能
脳は、発達段階において有害な曝露の標的となり、疾病を促進する機能的メディエーター(例えば、HPA軸や交感神経系の過活動を通じて;S58ページのボックスおよび図A参照)として、また曝露による傷害メディエーターの標的組織として働く。脳はさらに、小児期、思春期29、そして青年期を通じて実質的な可塑性を保持するという特徴がある。そのため、有害な環境暴露に対する感受性を保持すると同時に、その緩和策(例えば、認知行動療法)を提供する可能性もある。発達中の脳への有害な暴露は、人生を変えるような認知、精神、感情の障害を引き起こし、恵まれない環境における人間の回復力と人生の成功に制約を与える。神経行動学的機能障害は、母体-胎児期および小児期の栄養不良30 や母体の肥満への曝露と関連している。28 その結果、認知障害、注意欠陥多動性障害11 、自閉症スペクトラム障害、統合失調症、不安とうつ、摂食障害などの症状が現れる。
経路を介した影響の進行
これらの疾患促進経路は、時間とともに相乗効果を発揮し、炎症、酸化ストレス、インスリン抵抗性という3つの組織傷害の直接的な媒介因子を引き起こす(図A、パネル4)。相互の活性化因子として、これらの経路は、進行性の細胞ストレス、組織や臓器の損傷、それに伴う代謝および免疫機能不全を促進する。健康格差の研究にとって戦略的に重要なことは、さまざまな有害な環境暴露が、この共通の経路を活性化し、驚くほど類似した疾患の結果をもたらす傾向があり、一連のストレス要因に対する定型的な生体反応が示唆されていることだ。したがって、疾患を促進する生物学的経路のそれぞれを駆動する機能的遺伝子セットは、過去の有害な環境暴露のエピジェネティックおよび機能的バイオマーカーとして、また修正可能または可逆的な疾患メカニズムの発見のために、有望な候補となるものである。
補完的かつ未解明のアプローチとして、回復力を促進する生物学的因子がある。緩和因子や保護因子は、これまで述べてきたどの段階でも、個人レベルでも文脈レベルでも、有害な環境暴露に反応して生じる可能性がある(例えば、性格特性、心理的資源、行動スキル、社会的ネットワークなど)。しかし、特定の機能的な遺伝子セットが、疾患を促進する生物学的経路からどのように保護するのか、そのメカニズムは不明である。健康格差の経路を解明するためのこの補完的なアプローチは、健康(病気だけでなく)のメカニズムや、これらの保護バリアントが高リスク集団内および集団間でどのように効果を発揮するのかをより良く理解する必要がある。
リスクの世代間伝達
ヒトと動物の研究により、栄養、心理社会的ストレス要因、毒物など、様々な環境暴露に反応して環境的に誘導された疾患感受性が世代を超えて伝達されることが証明されている。曝露による伝達の例としては、毒素に曝露された精子におけるde novo遺伝的変異、母体または父体の生殖細胞エピゲノムの変化を通じた伝達、環境的に誘発された身体的形質(例えば、不十分な生殖血管構造)または機能形質(例えば、コルチゾール上昇、インスリン抵抗)を通じた伝達などがある15。慢性疾患に対する感受性の世代間伝播は、その生物学的メカニズムにかかわらず、健康格差の永続化、および将来の世代の健康を守るための現在の戦略の拡大にとって、深い意味をもっている。
健康格差の理解と予防の観点から、今日の少数民族や恵まれない人々が直面している世代間伝播の最も一般的かつ緊急な例は、母親の肥満に関連するものである。母体の肥満、妊娠糖尿病、高脂肪食など、胎児に過剰なエネルギーを供給する母体の状態が、子孫の代謝機能障害、高血圧、肥満、心血管疾患のリスクを高めることが、広範な動物実験と最近のヒトでの研究7で証明されている。母体と胎児のエネルギー過剰によって活性化される疾患促進経路(S58ページのボックスを参照)は、母体の低栄養や母体のストレスによるものと似ているが、重要な違いは、妊娠中に肥満または糖尿病になった女性の子孫に見られる心代謝機能不全の早期発症である。このことは、母体の低栄養が、成人期まで明らかな疾病を発症しないことと対照的である。スウェーデンと米国のデータでは、社会経済的地位の低い地域社会で、肥満の母親の発生率と有病率が最も高いことが示されている1,32。
母親の肥満が子孫に及ぼす特異的なメカニズムについて、ヒト以外の霊長類による高脂肪食の慢性的な摂取を何年も継続した研究から、さらに説得力のある証拠が得られている:子孫の影響としては、肝および脳の炎症、幼児成長の促進、食欲増進、早期発症脂肪率、思春期早発症などがある33。7歳児を対象とした神経行動学的研究では、妊娠前に肥満であった母親の子供だけが、注意欠陥多動性障害のスコアが上昇し、実行機能能力が低下していることが示された。11 肥満そのものが、臓器と全身の炎症、酸化ストレス、インスリン抵抗性、組織損傷と関連していることが明らかにされている。肥満が臓器や全身の炎症、酸化ストレス、インスリン抵抗性、組織傷害と関連していることは現在では明らかであり、肥満の子孫の早期発症は、子宮内でのこれらの組織傷害要素の強さと母体生殖系列を通じた肥満エピゲノムの世代間伝達を反映している可能性がある。
祖先と関連したゲノム研究
特定の集団の祖先の遺伝系統に、疾患感受性を高めることができる遺伝的変異が組み込まれた場合、疾患リスクは他の集団と比較して罹患集団で特異的に増加する。このような遺伝的変異は、特定の遺伝子のDNA配列を変化させてその機能を変更することもあれば、遺伝子調節能力を有する低分子RNAを生み出すDNA配列を変化させることもある。ある民族グループ内の慢性疾患のリスクは、先祖代々連鎖した遺伝子変異が、引用した疾患を促進する暴露や反応経路のうち1つ以上の反応性を高める場合に予想される(S58ページのボックスを参照)。
祖先から連鎖した遺伝子変異
健康格差の顕著な要因の一つは、高リスクのAPOL1遺伝子変異であり、これは、米国のアフリカ系アメリカ人集団において、米国の白人集団と比較して、慢性腎臓病の末期腎臓病への進行をより早める34。高リスクAPOL1遺伝子対立遺伝子は、アフリカ系祖先の個人の13%に見られるが、ヨーロッパ系祖先の個人にはほとんど見られない。もう一つの例は肺癌で、これは特定の人種/民族的マイノリティの喫煙者に不釣り合いに影響を与える35,36。35,36 ゲノム医学は、疾病リスクや治療経過、治療反応37を予測し、遺伝的祖先に基づいて有害反応を引き起こす可能性があるため、これまで認識されていなかった健康格差の原因を特定する可能性がある。
健康格差の遺伝学
健康格差の形成における遺伝的メカニズムの重要性が認識されているにもかかわらず、集団ベースの遺伝子配列研究の分析によると、少数民族に属する個人は参加者の20%未満であり、主にアジア系である(ゲノム研究では全体の14%)38。さらに、祖先のヨーロッパ集団で確認された多数の疾患関連遺伝子変異のうち、他の祖先集団で再現できるものはわずかである39。
健康格差の研究に遺伝学を取り入れることは、人種集団間の生物学的差異を分類する際に、遺伝的祖先背景の代用として自己申告の人種・民族(社会的・文化的構成)を用いることによって制限されてきた。最近開発された遺伝的「祖先情報マーカー」40と新しい統計手法は、こうした懸念を払拭し、格差に対する遺伝の具体的な寄与を解明する方法を提供するものである。これらの技術革新は、特定の集団に特異的に、あるいは高い頻度で存在する疾患関連遺伝子変異や、疾患に対する感受性や回復力を高める新たなメカニズムの同定に役立つ可能性がある。
研究手段としての生物学的メカニズム
健康格差は、集団レベルでは認識されているが、最終的には個人の生物学、より具体的にはストレスに対する生物学的反応に存在するものである。我々が概説した疾病促進メカニズム(S58ページのボックスおよび図Aを参照)は、さまざまな有害な曝露が、同じ慢性疾患群を引き起こす生物学的基盤の一部である。これに付随する特徴として、年齢による感受性の勾配、(一部は将来のストレス要因に対する持続的な過剰反応を通じて)時間の経過とともに自己拡張する傾向、世代を超えた伝達能力などがある。このシステムを既存のモデルシステムに組み込むことで、実験デザインを改善し、疾病の軌跡における生物学的段階の定義と可逆性を評価し、より早い段階で過去の曝露リスクを検出することができる。
感受性の高い年齢層に焦点を当てる
例えば、有害な暴露に対する感受性は年齢に依存するため、一次予防では、リスクが最も高く、したがって潜在的な利益が最も大きい発育期に重点を置く必要があることを物語っている。二次予防として、現在優先順位が高いのは、太りすぎや肥満の子供、青年、若年成人、つまり将来の親である。親の肥満を引き起こす上流因子の一次予防(ひいては肥満の世代間伝播の予防)には、生殖前後のすべてのライフステージに影響を及ぼす肥満誘発性環境に多世代で焦点を当てることが必要であろう。
生物学的データ収集の拡大
健康格差の生物学的メカニズムの解明には、医療、公衆衛生、地域社会におけるデータ収集の範囲を拡大することが重要な要件となる。例えば、過去のコホート研究により、環境暴露(例えば、社会経済的地位の低さ)によってもたらされる慢性疾患のリスクは、以前に有害な暴露(例えば、出生前の発育不良)を受けた個人にのみ発現することが示されている8。しかし、現代のコホート研究では、過去の曝露歴に関連する情報(例えば、親、妊娠、出産、出生後のイベント)は通常収集されていない。今後、親、母体-胎児、小児期の被曝の指標を日常的に系統立てて収集することが不可欠となるであろう。コホート研究デザインにおける親子3人組の価値は、このような世代を超えた情報を統合的な研究環境に取り入れることに特に適している3。
パスウェイツールを活用する
環境的に活性化された疾患促進経路は、それぞれよく知られた生物学的シグナル伝達経路を持つため、経路活性の分子学的、血清学的、機能的検査が確立されている。これらのツールは、(1) 顕著な疾患発症のかなり前に、過去の有害な曝露の影響を検出し、(2) 生体レベルで蓄積されたストレスの正味の影響を定量化し、(3) 標準的な機能ストレス検査 (HPA 軸、心電図ベースの交感神経活動など) によって個人のストレスまたは免疫・炎症反応性を定量化できる可能性を持っている。初期の組織傷害メディエーター(例えば、インスリン抵抗性、炎症、酸化ストレス)に対する集団規模のバイオマーカーの開発と検証は、信頼できる傷害前のリスク予測因子となり、現在利用できるインスリン感受性、抗炎症、抗酸化アプローチの幅広い使用とテストの両方を刺激することが可能である。リスクのある集団の設定において、このような介入は、現在生物医学的な設定で考えられているよりも、慢性疾患の軌跡のずっと早い段階で有益であることが証明されるかもしれない。これらの生物学的手法については、健康格差の観点から体系的に検討されたことはなく、特に、進行予防に最も効果的であると期待される疾患発現前の段階において検討されたことはない。
研究デザインの再考
長期介入研究において、遺伝的、エピジェネティック、分子的、および機能的パラメーターを統合することは、親子3世代からなる先祖代々および社会経済的に多様なコホートにおいて、それぞれ世代を超えたデータ注釈を付けて実施することが可能である。これにより、(1)エピジェネティックなプロファイルにおける有害な環境暴露と先祖代々の遺伝子変異の役割を明確にすること、(2)原因となるエピジェネティックマーカーと偶発的なマーカー、可逆的なものと不可逆的なものを識別すること、(3)機能経路活性と疾患の転帰との関連性を評価することが可能となるであろう。
前進のための提言
今日まで、健康格差研究の多くは、特定の集団および特定の環境における単一の疾患または状態について、健康格差の病因を説明するモデルおよび理論を、二項関連(例えば、ストレスとアロスタティック負荷)を用いて検証してきた。しかし、この分野を前進させるためには、広く学際的で統合的なアプローチが必要である。これは、リスクを抱える人々に不釣り合いに蔓延する慢性疾患は、進行性の全身性代謝機能障害の下流の症状であり、通常は発育期に開始されるとの認識が広まってきたことに起因している。最近蓄積された慢性疾患の知識、すなわち初期疾患の起源と進行の生物学的パターンを集団健康格差の理解に応用することによって、この分野は病因の理解を深め、前臨床機能障害を検出する生物学的ツールを活用し、明白な疾患のエンドポイントから、予防と標的介入の両方に適した上流段階に焦点を移すことができる。このアプローチはまた、回復力の生物学的および神経行動学的構成要素の理解を深め、最終的な共通経路の開始または永続を防止するための戦略を拡大することにつながる。健康格差の根底にあるメカニズムは多因子性であるため、それを理解するためには、協調的かつ学際的なアプローチが必要である。S61ページのボックスにまとめられたいくつかの提言は、このアプローチをサポートするものである。
BOX 2-将来の健康格差研究に生物学的メカニズムを取り入れるための推奨事項
| 発達段階にある年齢層を優先する | 生物学的に最も影響を受けやすく、最大の効果が期待できる発育期(受胎から若年成人期)を優先する。 |
| 生物学的曝露関連データ収集の開始と標準化 | 研究、医療、公衆衛生、学校、地域社会における世代を超えた曝露関連生物学的データの日常的な収集について、標準的なテンプレートを作成し体系化する。親のデータ(不利な環境、代謝の健康状態、社会経済的地位、出生情報など)、母体-胎児歴(妊娠前、妊娠中、出生パラメータ、授乳期など)、関連する小児期の被曝を含めること。 |
| 過去の有害な被ばくを早期に発見するためのツールの開発 | 生物学的経路の活性化や傷害メディエーターの存在を評価するエピジェネティック、血清学的、機能的マーカーを用いて、過去の有害な曝露の生物学的証拠を検出するためのスクリーニングツールおよびスクリーニングガイドラインを開発し、慢性疾患のリスク進行および回復力の予測に関するプロファイルを確立する。介入効果を評価する際に、研究参加者をベースラインリスクで層別化する。 |
| 世代を超えたデータ、祖先や社会経済的な多様性、縦断的な観察に対応できるような研究デザインを適応させる。 | 親子3人組からなるコホートは、祖先や社会経済的な多様性を考慮して選択すれば、親と子の曝露履歴を容易に入手でき、最も感受性の高い発達期を対象とすることができる。ゲノムワイド研究とエピゲノムワイド研究の組み合わせにより、過去と現在の曝露を考慮した上で、曝露によって誘発されるエピジェネティックな変化や機能的変化、祖先と関連した遺伝子変異、前向きな行動や回復力のある因子が疾患の進行をどの程度抑制するかについて、詳細な理解が可能になる。 |
利益相反
利益相反はない。