Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8229319/
2021年6月2日オンライン公開
要旨
簡単な概要
バクテリア、古細菌、真菌、微細藻類、ウイルスなどの微生物は、単一の浮遊細胞として存在するよりも、むしろ生態系の中で複雑な相互作用ネットワークを形成している場合がほとんどである。微生物間の相互作用は、同種間、異種間、あるいは全く異なる属、科、ドメイン間でさえも起こる。
このような相互作用は、環境を感知した後、そのシグナルを分子や遺伝子の情報に変換することで起こるが、そのメカニズムや分子クラスは多岐にわたる。微生物間相互作用の包括的な研究は、微生物が様々な異なる環境に定着し、コロニーを形成するための重要な戦略を明らかにしている。
このような微生物間相互作用のメカニズムに関する知識は、微生物の生態学的影響や生物多様性異常の発生を理解するために不可欠である。また、慢性疾患や感染症、飢餓、汚染、持続可能性など、様々な課題に対する戦略や特異的な薬剤を開発する鍵になるかもしれない。
要旨
微生物は地球上のほぼすべてのニッチに存在し、主に単独で存在するのではなく、単一種または混合種からなる群集を形成している。そのような微生物集団の中で、また微生物と真核生物宿主の間で、常に変化する環境の中で様々な微生物間相互作用が行われている。
それらの微生物間相互作用は、微生物集団の成立と維持がうまくいくために極めて重要である。相互作用の基本単位は、この群集の中の各生物の生物的または生物的刺激に対する遺伝子発現である。遺伝子発現の差は、相互作用に関与する交換可能な分子の産生を担い、最終的に群集の挙動につながる。
本総説では、細菌群集内および関連する細菌と宿主との間の協力的・競争的相互作用に焦点を当て、微生物の細胞間コミュニケーション(クオラムセンシング)に重点を置いている。さらに、微生物群集の複雑なゲノム情報、群集内の異なる微生物の機能的役割を解析し、バイオテクノロジー応用のための新規生体分子を同定するための有用なツールとして、メタゲノム解析が論じられている。
キーワード:微生物、相互作用、共生、メタオーガニズム、メタゲノミクス、バイオフィルム、クオラムセンシング、クオラムクエンシング
1.はじめに-微生物間相互作用の概要
微生物(Microorganisms)とは、細菌、古細菌、原生動物、微細藻類、真菌、ウイルスからなる3つの生命ドメインに属する単細胞生物の非常に多様なグループを含む、ミクロなスケールの種族主義である。微生物は地球上のほぼすべてのニッチに存在し、その地球規模での分布は、人間の腸内環境から陸上・海洋環境の地下深部、そして上層大気までと顕著である[1]。
原核生物(バクテリア、古細菌)とウイルスは、微生物の大部分を形成しており、その結果、このレビューの焦点にもなっている。例えば、乾燥した土壌では、バクテリアは1 × 108 cells/g、ウイルスは5 × 109 particles/gに達し、海洋では、バクテリアは5 × 105 cells/mL、ウイルスは1 × 1011 viruses/mLの密度を持つ[2]。
微生物は主に単独で存在するのではなく、単一種または混合種からなる群集を形成している[3]。そのような微生物集団の中で、また微生物と真核生物の宿主や環境との間で、細菌-細菌、細菌-真菌、細菌-ウイルス、細菌-宿主(植物、動物)相互作用に至るまで、非常に多様な微生物相互作用が起こっている[4]。
* *
それらの微生物間相互作用は、様々な環境、様々な宿主に微生物集団をうまく定着させ、維持するために極めて重要である[5]。異なる種の長年の共進化は、相互依存的な適応と特殊化をもたらし、通性、相互主義、寄生的な相互作用を促進する様々な共生関係をもたらした[5](表1に示す通り)。
相互作用は、例えば、植物の根に着生して栄養分と引き換えに窒素を固定するリゾビウム属のように、双方のパートナーにとってウィンウィンの状態を表する[6]。さらに、人間の腸内細菌は、下部消化管で必須ビタミンKを合成し、炭素源を交換する[7]。
このように、一方のパートナーだけが利益を得て、他方は影響を受けない関係を「通性」と定義し、利益を得るパートナーが他方のパートナーに害を与える「寄生」と対比している。ヒトの腸や気道に存在する常在菌が、代謝、個体発生、病原体防御などの免疫生理学的機能の制御に深く影響しているという証拠が増えつつある[8,9]。
一方、病原体として知られる寄生虫は、組織への侵入、毒素の産生、宿主細胞への直接的な損傷など、さまざまな方法で宿主に害を与える。病気を引き起こす病原体はよく研究されており、炭疽病の原因であるバチルス・アンスラシス(Bacillus anthracis)[10]、ライム病の原因であるボレリア属(Borrelia spp.)[11]、胃腸炎の原因となるカンピロバクター・ヘジュニ(Campylobacter jejuni)[12]、細菌性髄膜炎や気道感染症の原因であるヘモフィルス・インフルエンザ(Haemophilus influenza)など広く人々に知られている[13]。
特にヒトの病気に焦点を当てた寄生虫の相互作用のリストは無限に拡大できる。しかし、特に原核生物間の通性および相互作用の機構的な理解は遅れている[14]。微生物間の相互作用は、二次代謝産物、シグナル伝達分子、細胞内伝達シグナル、シデロフォア、あるいは遺伝子の交換など、分子および遺伝情報の伝達によって起こる[5]。相互作用の基本単位は、生物的または非生物的刺激に応じた各生物の遺伝子発現であり、これらの相互作用に関与する交換可能な分子の生産を担っている[15]。
表1 微生物間相互作用の種類 [16]より引用
| 相互作用 | 特徴 | 品種A | 品種B | 例 |
|---|---|---|---|---|
| 相互主義 | 特定の生息地で生き残るために必要な共生関係 | メリット | メリット | 根粒菌 [6]。 |
| 相乗効果 | もう一つは、パートナーの成長を向上させる | メリット | メリット | バクテリア間の酢酸のクロスフィードリング [17]。 |
| コメンサリズム | 一方のパートナーは利益を得、もう一方は害もなく改善もされない | メリット | 影響なし | ニトロソモナスと ニトロバクターによる硝化作用 [18]。 |
| 寄生虫対策 | ホストが危険にさらされている | メリット | 害される | Bdellovibrio sp.とBALOは、増殖にグラム陰性菌を必要とする[19]。 |
| コンペティション | 宇宙と栄養の奪い合い | 害される | 害される | 土壌細菌は菌類と養分を奪い合う [20] 。 |
| アンタゴニズム | パートナーの製品が他の製品に影響を与える | 影響なし・メリットなし | 害される | 抗生物質の生産 [21] |
以下では、微生物-微生物、微生物-宿主の相互作用の例をより詳しく紹介し、さまざまな生息環境における微生物相互作用の多様性と多様性を示している。
2. 微生物群集の相互作用
微生物は化学環境に反応し、その周辺にいる他の微生物と相互作用する[22]。相互作用の性質と重要性は、異なる感覚系を持つ微生物の存在量と種類に依存する[23]。細胞間相互作用は,1つまたは複数の個体が利益を得る協力的な効果をもたらすこともあれば,1つまたは複数のパートナーに悪影響を及ぼす微生物間の競争が発生することもある.微生物は単一のタイプの相互作用に限定されず、その反応は一過性で、化学的および/または物理的環境の影響を受け、その結果、非常に複雑な微生物群集を形成する[5]。
2.1. 真菌の相互作用
真菌は幅広い環境ニッチに生息し、世界のバイオマスの少なくとも25%を占めている。自然環境において、真菌は他の真菌やバクテリアなど、他の微生物と相互作用している(図1参照)。真菌の種内・種間相互作用は、接触やシグナル分子を介して行われ、交配、成長・発達の変化、病原性などを引き起こす[24]。
例えば、BurkholderiaはRhizopusの微胞子と共生し、イネ苗立枯病の原因菌となる。この細菌は、イネを殺す毒素であるリゾキシンを生産し、菌が感染胞子を生産することを可能にする[25]。さらに、菌類は他の生物や菌類同士で栄養分や場所などの資源を奪い合う必要がある。
競争は、例えば、二次代謝産物の分泌や、過繁殖や菌類寄生のような直接的な相互作用によって起こる[26]。ある菌が他の菌を攻撃して侵入する菌寄生が,病原菌の抑制に大きく寄与している.そのため、菌類寄生生物であるトリコデルマは、植物真菌症の生物学的防除に応用されている[27]。
さらに、菌類と細菌の相互作用によって、特定の菌類二次代謝産物の生産が可能になることが示された[28]。Aspergillus nidulansとStreptomyces rapamycinicusの密接な物理的相互作用によって、特定の芳香族ポリケチドの生産が活性化することが実証された[29]。
このように放線菌はヒストンアセチル化の変化を引き起こし、真菌の遺伝子制御に影響を与える[30]。一般に、放線菌は幅広い生物活性を持つ多くの天然物の生産者である[31]。土壌に生息するStreptomyces coelicolorと他の放線菌の相互作用に関する研究では、それぞれの相互作用で生産される化合物のほとんどが、それぞれの提携先に特有のものであることが示された。
多くの新規生理活性分子とアシルデスフェリオキサミンシデロフォアの拡張ファミリーが同定された。免疫抑制作用や抗癌作用を持つプロジジン、アクチノローディン系抗生物質、シデロフォアのコエリチェリンやアシルデスフェリオキサミンなど、合計200種類以上の差次合成化合物が同定された[32]。
このように,放線菌の種間相互作用は非常に特異かつ複雑であり,バイオテクノロジーや医学に関連する新規化合物を同定するための大きな可能性を秘めているように思われる[31]。
図1 真菌の相互作用
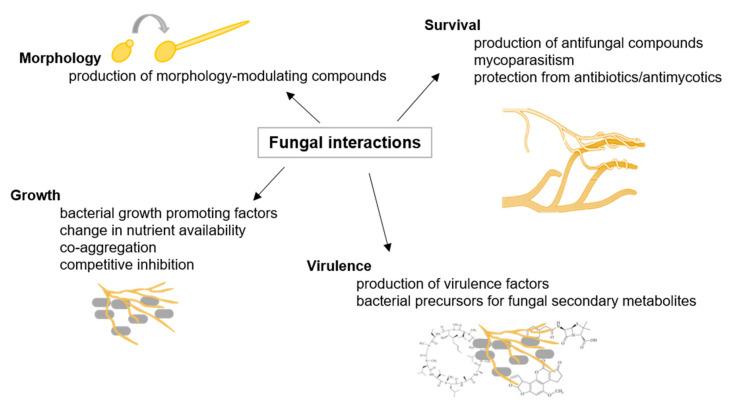
真菌の相互作用の例をそれぞれの結果とともに図示している
ここ数十年の間に,真菌の相互作用は,人間の健康を含む自然および人為的な生態系にとって極めて重要であることが明らかになった.一方,真菌の相互作用は,持続可能な農業に活用できる大きな可能性を秘めている。アーバスキュラー菌根菌は、宿主植物のリン栄養の改善、窒素吸収の促進、病害抵抗性の向上などをもたらすことがよく指摘されている。
他の微生物、例えば窒素固定細菌やリン酸可溶化細菌は、これらの菌類と相乗的に作用し、植物の発達と成長に利益をもたらす[33]。菌根菌の共生関係は、養分投入量が少ない持続可能な農業システムにおいて重要になり、作物残渣からの養分動員に不可欠な役割を果たす[34]。
* *
一方で、例えば人間の健康において有害な性質を持つ菌類の相互作用を認識することで、治療薬の改善につながる可能性がある[35]。
2.2. 古細菌の相互作用
古細菌は地球上で最も古い生物であるが[37]、古細菌同士や他の界隈の生物と相互作用する可能性があることが最近になって認識されるようになった(図2に示す)。特に、メタン生成細菌は、草食動物や硫酸還元菌などの異なるパートナーとの共生的相互作用によって、地球規模のメタン循環の重要なステップに部分的に関与している[38]。
古細菌の病原体はこれまで同定されていないが、古細菌の常在菌が間接的に細菌感染に関与している可能性はある[39]。古細菌をパートナーとする共生は、地球環境循環との関連性が高いものもあれば、極めて特異なメカニズムに関連した生態学的意義が不明なものも報告されている([38]でレビュー)。
しかし,主に非培養性生物あるいは少なくとも複雑な培養性生物間の相互作用の検出には問題があるため,古細菌の相互作用を同定し研究することは困難である[40]。それにもかかわらず,宿主Ignicoccus hospitalisとNanoarchaeum equitansの間の古細菌共生については,構造レベルでもよく記述されている[41]。
Ignicoccus (Crenarchaeota, Desulfurococcales)は嫌気性超好熱性偏性化学独立栄養の水素酸化型古細菌である。共生生物 N. equitansはイグニコーカスの特殊な外膜に直接付着し、脂質、アミノ酸、ヌクレオチドなどの必須生合成経路の遺伝子を持たないため、義務的にイグニコーカスホストに依存する[42]。
その結果,生体高分子はイグニコッカスから供給される必要がある[43](図2に図示).また、Pyrococcus furiosusとMethanopyrus kandleriが安定した古細菌の集合体を形成し、Pyrococcusが生産した水素をMethanopyrusが利用するという研究もある[44]。
このような種間水素移動は、合成栄養型のアーキア-バクテリアのコンソーシアムでも顕著である。例えば、”Methanobacillus omelianskii “のコンソーシアムは、メタン生成古細菌とグラム陰性菌からなり、これらは合成栄養でエタノールを酢酸とメタンに変換する[45,46]。
水素栄養メタン生成菌では、例えば発酵性のAcetobacteriumやSyntrophobacter [47,48]、低硫酸濃度でのDesulfovibrio [49]、好熱条件でのThermoanaerobacter, Desulfotomaculum, Pelotomaculumとの多数の合成栄養提携が報告されている[50,51,52](※1)。
また、無酸素性堆積物におけるメタン酸化の必須プロセスは、Euryarchaeota(ANME、嫌気性メタン栄養細菌)とDesulfovibrioやDesulfococcusなどの硫酸還元細菌(SRB)のコンソーシアムによって行われる。
これらの細菌は、しばしば小さな集合体から巨大なマットを形成する[53](図2)。最近、巨大な糸状菌であるThaumarchaeote candidatus、Giganthauma karukerenseと硫黄酸化細菌であるガンマプロテオバクテリウムの細胞間相互作用が報告された。この場合、細菌は単分子膜を形成し、Thaumarchaeoteの大きなフィラメントの表面を覆って、宿主細胞周辺の硫化物濃度を低下させる可能性が高い[54]。
図2 古細菌の相互作用
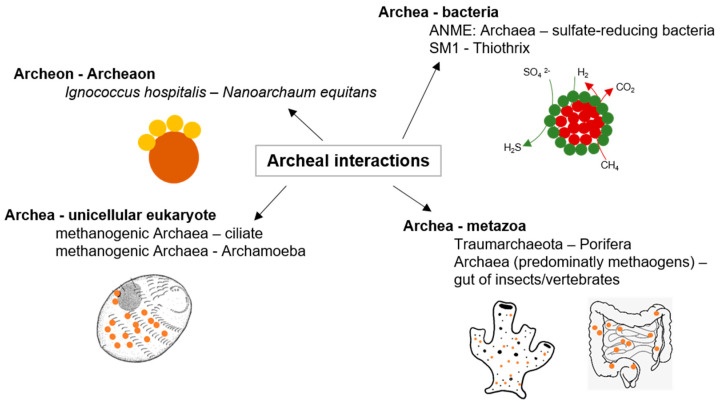
古細菌の相互作用の例は[38]から引用した
さらに、メタン生成古細菌は、栄養分解の嫌気性ニッチとして動物の腸内で嫌気条件下で有機基質をメタンと二酸化炭素に分解するのに必須である[55](図2に示すように)。驚くべきことに、単一のメタン生成代表菌であるMethanobrevibacter smithiiは、ヒトの腸内細菌叢における優勢な古細菌である[56]。
メタン生成菌とバクテロイデス・テタイオタオミクロンの共栄養的相互作用は,ノトバイオティクスマウスで研究されたように,宿主のエネルギーバランスに影響する可能性がある.MethanobrevibacterはBacteroidesの発酵産物であるギ酸を利用する。
この合成は、さらにバクテロイデス酵素の発現を決定する[57]。しかし、古細菌と真核生物の共生関係は、腸内嫌気性食物連鎖に限定されるものではない。メタン菌と原生生物との共生もよく知られている(図2)。ここでは、嫌気性原生生物や繊毛虫のヒドロゲノソームに古細菌が直接付着している[58]。
また、アーキアは海綿にも遍在し、時には優占している[59]が、その生態的役割はほとんど知られていないが、最近、海綿の窒素代謝に相関があることがわかった[60,61,62](図2に図示したとおり)。古細菌と他の生物との相互作用は、バクテリアの相互作用と同様に特異的で広範囲なものであることは間違いないが、今のところ、その基礎となるメカニズムはまだ十分に理解されていない。
以上の知見は、古細菌の相互作用の豊富さと多様性についての印象を与えるに過ぎない。今後、古細菌のモデル生物を用いた研究が進めば、大腸菌や緑膿菌のような細菌モデル生物で得られた知見に匹敵するような知見が得られるかもしれない[38]。
2.3. ウイルス-細菌相互作用
ウイルスは,様々な真核生物および原核生物の宿主において,多くの疾患の原因となるため,ウイルス間の相互作用は生態学的に重要である[63]。本総説では,細菌に感染するウイルスと,それらの(バクテリオ)ファージによる細菌群集の調節に焦点を当てる.ファージは生物圏に最も多く存在する微生物であり,その数は4.8×10^31個と推定されている[64]。
ファージはあらゆる地域に存在し,大半の生態系において宿主である細菌と並行して共存している[65]。ファージは、微生物多様性の推進役、遺伝子水平伝播のベクター、診断および遺伝子ツールの供給源、そして治療薬としてよく知られている[65]。
バクテリオファージは、細菌を自然に殺すもので、そのゲノム、形態、生物学的サイクル、または産地によって分類することができる[66]。ファージの際立った特徴は、その生物学的サイクルである[67]。図 3に示すように、溶菌サイクルと溶原サイクルという2つの主要なタイプがある。
溶菌サイクルでは、ファージは宿主細胞の表面に付着して、その核酸を細胞内に注入する。その後、宿主細胞のDNAが分解され、宿主の代謝が誘導され、ファージの生合成が開始される。ファージ核酸は菌体内で複製される。そして、ウイルス性のファージ粒子全体が組み立てられ、細菌細胞の溶解によって、感染細胞から放出される。
一方、溶菌サイクルは、ファージの遺伝物質が宿主細胞のゲノムに組み込まれ、プロファージ(または温和なファージ)が作られることによる。細菌が繁殖する際、プロファージもコピーされ、それぞれの娘細胞に受け継がれる。娘細胞はプロファージとともに複製を継続するか、プロファージが細菌の染色体から抜け出して溶菌サイクルを開始することができる[68]。
ファージの感染開始は、尾部またはカプシドのエンベロープの先端にあるファージ結合タンパク質と、宿主細胞の表面にある受容体との間の特異的な認識によって引き起こされる[69]。ファージが認識する細胞表面の受容体には、タンパク質受容体(OmpAおよびOmpC)、リポポリサッカライド(LPS)受容体、莢膜多糖類(Vi抗原)に存在する受容体、毛状突起や鞭毛などが考えられる[70]。
図3 ファージの増殖 (左)大腸菌ファージT4のような溶菌性ファージが感染すると、ウイルスが増殖し、その後宿主細菌が溶菌する
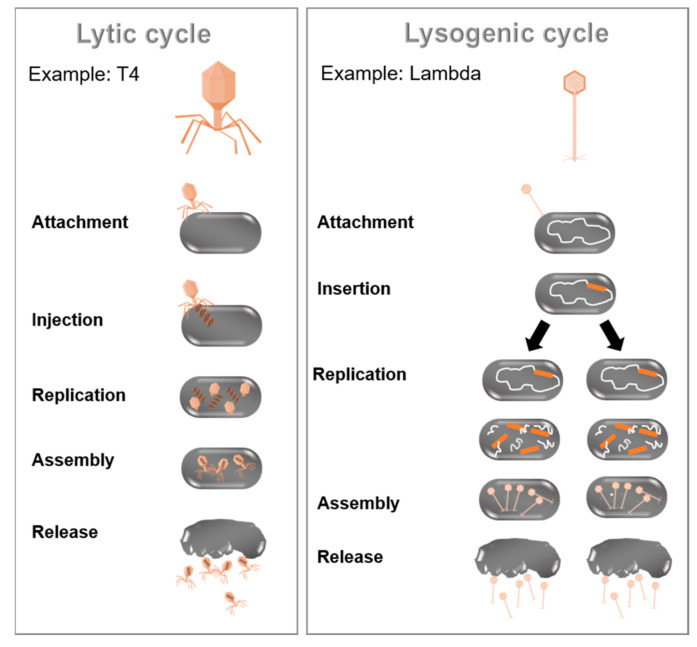
(右)溶菌サイクルでは、ファージゲノム(例:大腸菌ファージラムダ)が細菌の染色体に組み込まれ、不活性なプロファージが宿主の染色体の一部として複製される。環境因子によってファージゲノムが切り離され、溶菌サイクルに入る。
ファージとの相互作用は、新規の細菌表現型の伝達、細菌の遺伝子発現や進化の調節、細菌の死滅など、相互主義的なものから寄生的なものまで多岐にわたるため、個々の細胞やコミュニティ全体に利益や損害を与える可能性がある[71]。
大腸菌のファージMuのように、温和なファージは細菌の生理機能を調節することができ、細菌ゲノム内にランダムに組み込まれ、感染集団を変異させ、必須遺伝子に挿入がある細胞を排除する[72]。
溶菌性ファージは、感染した細胞を単に溶解することによって、微生物群集を調節する。ファージが細菌の多様性、病原性、進化性に大きな影響を与え、さらには生態系の安定性を形成しているという水生生物の証拠も増えている[73]。
ファージはまた、一般的な形質転換を介した遺伝子の水平伝播により、微生物コミュニティの構造と機能を変化させる。プロファージは、吸着、DNA注入、転写、あるいは宿主の利他的自殺の誘導など、ウイルス感染と複製のほぼすべてのステップをブロックすることによって、侵入するファージに対する細菌の防御を強化する。さらに、ファージは真核生物の生理機能を調節する[71]。
ファージによる微生物群集組成の変化は、クローン病や潰瘍性大腸炎(ファージの豊富さが拡大)、I型糖尿病(ファージの豊富さと多様性が減少)など、様々な疾患と関連していた[75]。バクテリオファージの研究は、今日では、細菌感染や汚染を治療するためのファージの可能性にますます焦点を当てている[76,77]。
抗生物質に耐性を持つ病原性細菌が世界的に増加しているため、この脅威に対抗するための代替戦略が必要とされている[78]。ファージ療法はほぼ1世紀前に遡る伝統があるが,抗生物質が発見されると欧米諸国ではさらなる発展が鈍化した[77]。
バクテリオファージの治療的利用は、医療分野、食品産業、農業・養殖業において有望な戦略の1つである。ファージの多くの特性は、汚染防止と進行中の感染症、特にバイオフィルム感染症の治療の両方によって、治療における肯定的な結果を示唆している[79]。
このように、ファージと細菌の相互作用は多岐にわたるが、その研究、特に古細菌や真菌との相互作用については、遅れている。
同様に、ファージ-ファージ間の相互作用に関する知見も乏しく、ファージ-細菌間の相互作用の経過に影響を与え、微生物群や関連する多細胞生物に影響を与える可能性がある。自然界に存在するウイルスの配列決定、ウイルスのイメージング、根本的な相互作用の分子的理解のための遺伝子工学などの新しい技術は、将来の研究を方向付け、最終的にこれらの基本的な関係に対する洞察を得ることを可能にする[65]。
2.4. 細菌-細菌間相互作用
細菌間の相互作用は、同じ種の細胞間でも、異なる細菌種間でも、自然界に数多く存在し[23](図4に示すとおり)、ユビキタスである。細菌間相互作用は,ミクソバクテリアのコミュニケーションや協調行動,Quorum Sensing(QS),Pseudomonasのバイオフィルム形成などの事例から注目されるようになった[80]。
近年,進化生物学において,細菌間の協調行動に関する考察が盛んに行われている[4]。細菌細胞が産生する細胞外シグナル分子は,他の細胞によって検出され,遺伝子の発現を制御することができる.いくつかの細菌では,微生物群集の相互作用のためにシデロフォアが合成される[23,81]。
シュードモナス属では、ピオベルジンシデロフォアは感染やバイオフィルム形成に必須であり、細菌の増殖を制御するのに役立つ可能性がある[82]。海洋環境では、外来性のシデロフォアは、鉄が制限された条件下で海洋細菌の増殖に影響を与えるシグナル物質として作用する。
多くの海洋細菌は,ビブリオ属のN, N’-ビス(2,3-ジヒドロキシベンゾイル)-O-セリルセリンなど,他の種が生産する外因性シデロフォアの存在下でのみ鉄制御外膜タンパク質を生産することが報告されている[83]。
細菌の様々な協力的・競争的な相互作用は,QS(Quality of Sustainability)と呼ばれるコミュニケーションプロセスにおいて,小さな化学シグナル分子の合成と検知に依存している.細菌のいくつかの社会的行動は、病原性、病原性、バイオフィルム形成など、QSによって引き起こされたり、影響を受けたりする[84]。
シグナル伝達分子の分子構造,感知装置の組織,シグナル伝達プロセスの機能的帰結は,異なる細菌間で著しい多様性を示しているが,これらのプロセスの生物学的類似性は否定できない[85]。以下では、自然界で最も一般的な合成栄養微生物コンソーシアムの形態であるバイオフィルムについて、より詳細に検討する。
さらに、細菌のドメイン内および異なるドメイン間の基本的かつ普遍的なコミュニケーション戦略としてのQSを検討し、QSが制御する挙動を強調する。最後に、バクテリアの細胞間コミュニケーションへの干渉(Quorum Quenching, QQ)は、自身のQSシグナルを再利用するための自然なメカニズムとして、また競争関係の文脈で議論されている。さらに、QQは(抗生物質耐性)細菌、特にバイオフィルムに埋め込まれた細菌のコロニー形成を防止・抑制するための自然発生的な戦略と考えられ、今後の応用が期待される。
図4 細菌-細菌間相互作用
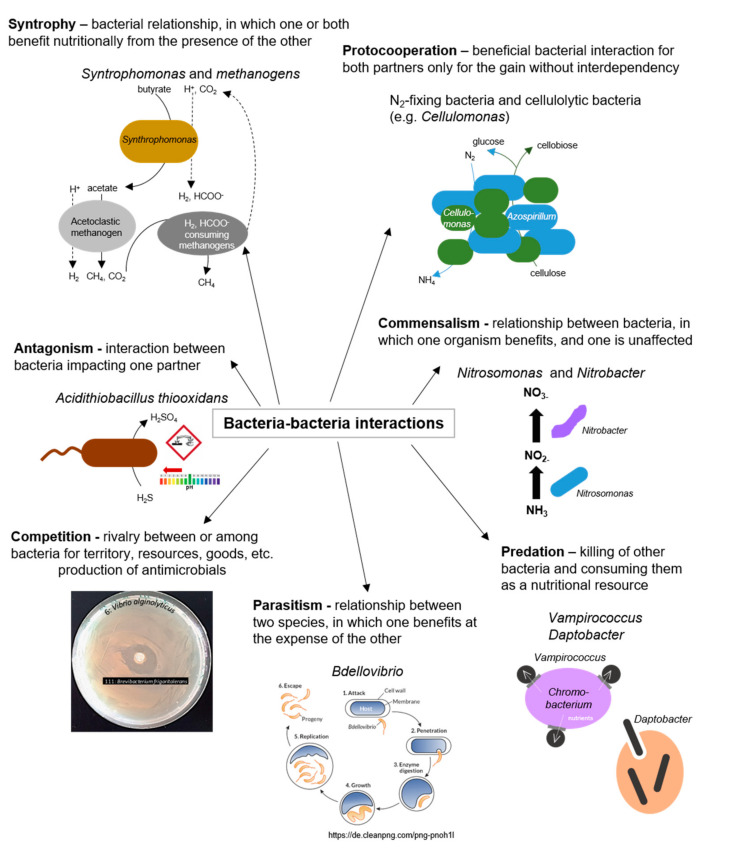
細菌種間の正と負の相互作用の例
2.4.1. バイオフィルム
バイオフィルムは,微生物生活の中で最も広く分布し,成功している様式の一つである[86]
バイオフィルムは、細胞が細胞外高分子物質(EPS)の自己産生マトリックスに埋め込まれている微生物の集合体として定義される[87]。バイオフィルムの形成は,細胞同士の相互作用によって開始される。
浮遊性細菌は,最初はvan der Waals力を介した可逆的な接着によって表面に付着すると考えられている.付着した細胞は増殖し、細胞外マトリックスを形成してマイクロコロニーを形成し、その中で生化学的シグナルによる細胞間のコミュニケーションと遺伝子交換が促進される。
このマトリックスには、外来多糖類、細胞外DNA、RNA、タンパク質が含まれている。細胞はさらに増殖し、あらゆる次元で空間構造が形成され、成熟した三次元バイオフィルムが形成される。時間の経過とともに、マイクロコロニーは、運動性細菌の活発な分散とともに、細胞死と溶解を起こす[88](図5に示されているように)。
バイオフィルムは,増殖と分散によって均衡を保つと考えられている[89]。バイオフィルムは,典型的には10^8から10^11細胞/g湿重量という高い細胞密度を持つ多くの種からなる複雑なシステムである[90]。バイオフィルムは,水,土壌,堆積物,地下環境におけるほとんどの元素の生物地球化学的循環過程を駆動している.すべての高等生物はバイオフィルムによってコロニー化されており,これはヒトを含む動植物の持続的な感染と相関することができる[1]。
さらに,バイオフィルムは,医療機器やインプラントの汚染,バイオファウリング,プロセス水や飲料水の汚染,腐食の原因となる[91]。これに対して,バイオフィルムは,飲料水のろ過,廃棄物(水)の分解,バルク・ファインケミカルやバイオ燃料の生産などのバイオテクノロジープロセスの生体触媒作用などのバイオテクノロジー用途で利用されている[92]。
図5 バイオフィルムの形成
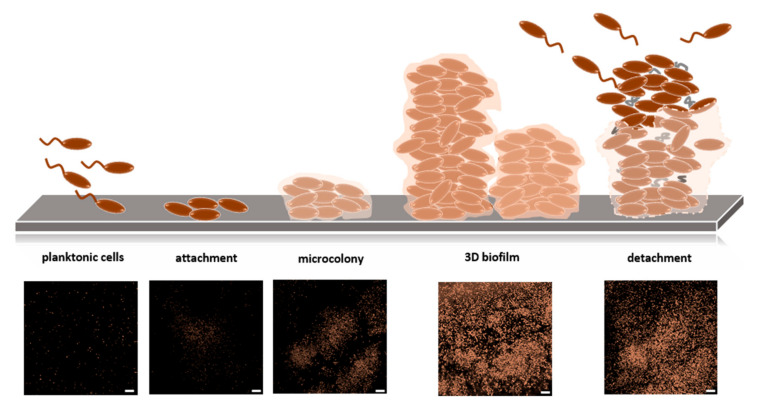
(上図)自由行動する細菌は、まず固体表面に付着し、さらにコロニーを形成する細菌は、マイクロコロニーと呼ばれる構造化された集合体を形成する。バイオフィルムは、多数のマイクロコロニーから構成され、細胞外の高分子マトリックスに包まれる。バイオフィルムは永続的に組成・分解を繰り返す。
(下段)Klebsiella oxytoca M5aIバイオフィルム形成の共焦点レーザー走査顕微鏡写真
バイオフィルムの生活様式は、自由生活する細菌細胞のそれとは異なっている。バイオフィルム共同体は,物理的,代謝的,社会的相互作用のような創発的特性を持ち,遺伝子交換の強化や抗菌剤に対する耐性の向上を含む[93]。
バイオフィルムにおける耐性は,バイオフィルム・マトリックスが抗菌剤の拡散障壁と不活性化ゾーンとして機能することと,バイオフィルム細胞の成長が遅くなり,さらには細胞の休眠に至ることの両方から生じる可能性がある.さらに,バイオフィルム内では,代謝性能が変化した静止細胞(persisters)が高い割合で検出された[93]。
バイオフィルム内の細胞の抗菌薬に対する耐性は,バイオフィルム内では遺伝的能力と移動性遺伝要素の蓄積が増大するため,水平遺伝子移動による耐性遺伝子の取り込みによっても起こり得る[94]。
バイオフィルム内の組織は、近接性を生み出すことにより、無数の生物の相互作用を可能にし、促進する。近接性によって、生物間の代謝物、シグナル伝達分子、および遺伝物質の交換が可能になる[86](図4に示すように)。さらに、異なる代謝能力や生理的勾配を持つ細胞などの異質性は、協力の機会を提供する[95]。
バイオフィルムにおける不均質な生理的活動は、電子受容体や電子供与体、pH値、酸化還元条件などの垂直勾配を生み出す[96]。勾配を成立させる最も重要な外部誘因の1つは,酸素のような電子受容体の利用可能性であり,バイオフィルムの上層に好気性マイクロコロニーが,深層に嫌気性ゾーンが形成される[97]。
バイオフィルムにおける不均質性は,微生物マットのような混合種の空間的な組織化も可能にする.ここでは、光栄養性微生物、例えば藻類、シアノバクテリア、および無酸素性光栄養細菌が有機基質を生成して滲出液として放出し、それが近接した従属栄養種から利用されて、その代謝活性が高まる[98](図4に示されているように)。
バイオフィルム内の異なる種間の代謝的相互作用は、アンモニア酸化細菌がアンモニウムを亜硝酸に変換し、その後亜硝酸酸化細菌によって酸化される硝化のプロセスでも観察することができる[18](図4に示すとおり)。
コメタボリズムや代謝共有の例は,バイオフィルムのメンバー間のより効率的な資源分配につながり,バイオフィルムのメンバーの共進化という概念をさらに支持するものである[86]。
すべてのバイオフィルムで協力が行われるとは限らず,バイオフィルムにおけるほとんどの種間相互作用は,細胞が互いに競合しているため,負の相互作用であるとさえ示唆されている[23]。
バイオフィルムにおける競合メカニズムには,抗生物質,バクテリオシン,細胞外膜小胞,VI型分泌システムなどがある.これは最終的に、バイオフィルムの初期付着、表面コロニー形成(例えば、表面での緑膿菌細胞の遊泳および群発により、競合するAgrobacterium tumefaciens細胞の付着を防ぐ[99])、または抗菌特性を有するバイオサーファクタントの生成の抑制を引き起こす(図4に示すように)。
さらに、侵入者は、アドヘシン合成のダウンレギュレーション、細胞間コミュニケーションの阻害、またはマトリックス多糖類、核酸、タンパク質の分解を通じて、バイオフィルムの成熟を阻害し、その分散を促進することができる[101]。
* *
結論として、多くのバイオフィルム研究により、バイオフィルムの重要な特性や表現型の多く(例えば、細胞間相互作用、空間構造化、不均質性)の根底にある基本原理が明らかにされた。自然環境における微生物群集の研究は、メタゲノム解析によって大きく変化したが、ほとんどの知見は、実験室におけるそれほど複雑でないバイオフィルム群から得られたものであり、微生物群集における微生物相互作用の空間的・時間的スケールが無視されていることが多い[3]。
自然界における細菌生活の主要な形態として認識されているバイオフィルム共同体の機能をどのように破壊し、または促進するかを理解することは、現代の微生物学にとって優先事項である[95]。
したがって,様々な細菌種のバイオフィルム形成において重要な役割を果たすQSに関する広範な知識の獲得は不可欠であり,微生物生態学の理解向上と微生物感染症の治療にとって計り知れない意味を持つであろう.
* *
2.4.2. 細菌のコミュニケーション-クオラムセンシング
多くの細菌は、クオラムセンシングと呼ばれる細胞間コミュニケーションシステムを用いて、集団密度に依存した行動を調整する[80]。QSは、いわゆる自己誘導物質(AI)と呼ばれる低分子量分子の合成と認識に基づいており、AIは細胞質膜上を拡散するか、積極的に輸送されて特定の受容体によって明示的に検出される(図6に示すとおり)。
AIが対応する受容体と結合すると、その後のシグナル伝達は標的遺伝子の転写を活性化し、しばしばそれぞれのAI合成酵素をコードする遺伝子を含む(autoregulation)[102]。人口密度が増加すると、シグナル伝達分子の濃度が閾値を超え(「クォーラム」)、その結果、AI合成酵素の誘導によって、より多くの自己誘導物質が合成されるようになる。
これが正のフィードバックループを形成し、受容体は完全に活性化される。受容体の活性化は、標的遺伝子の制御を変化させ、集団の転写を同期化させる[103]。こうして、細胞密度に依存した行動が調整される(総説は[104]を参照)。例えば、上記のようなコロニー形成、病原性、病原性、バイオフィルム形成などである[105,106]。
図6 クオラムセンシング(QS)システムとクオラムクエンチング(QQ)戦略

(A) グラム陰性菌は、LuxI相同合成酵素によって拡散性の自己誘導物質(AI、三角形)を産生する。AIは細胞内に拡散し、同種の受容体(LuxRホモログ)と結合する。
この複合体は、標的遺伝子のプロモーターに結合し、その転写を活性化する。(B)グラム陽性菌によって前駆体ペプチド(ループ)が生成・修飾(○)され、ATP結合カセット(ABC)を介して分泌される。2成分系でシグナル分子を検出し、リン酸化された応答タンパク質が特定のプロモーター遺伝子に結合し、その発現を調節する。
(C)V. harveyiのQSシステムは、グラム陰性とグラム陽性のQS要素を組み合わせたもので、アシルホモセリンラクトン(AI-1、三角形)がLuxLMによって合成され、第2の万能AI(AI-2、五角形)が酵素であるLuxSによって合成されている。AIは2成分系によって検出され、そのシグナルはリン酸化反応によって伝達され、ルシフェラーゼ構造オペロン(luxCDABE)の発現で終了する。(D)QQ戦略の例。
(1)AI生合成の阻害、(2)シグナル輸送の阻害、(3)AIの分解・修飾・拮抗、(4)シグナル認識の阻害
QSシステムは、グラム陰性菌とグラム陽性菌の両方で発見された[107]。グラム陰性菌はアシル化ホモセリンラクトン(AHL)を介して情報伝達を行う(図6Aに図示)[104]。QSの最初の記述は,生物発光性海洋細菌であるVibrio fischeriに関するものであった.V. fischeriは、ハワイのヤリイカEuprymna scolopesと共生し、高い細胞密度で、QSを通して生物発光を活性化し、捕食者回避の際にイカの影を隠すのをサポートする。
2つのコンポーネント、LuxIとLuxRは、例えば、V. fischeriの生物発光を担うLuxオペロン(luxICDABE)のような標的遺伝子の発現に影響を与える[108]。その後、同様のAHL QSシステムがグラム陰性菌に広く分布し、分泌毒素や病原性因子の生産、バイオフィルム形成、抱合など、多様な行動を制御していることが明らかになった。
多くの細菌は、複数のシグナル・レセプターの組み合わせを保持している[109]。例えば、緑膿菌はLasRIとRhlRIという2つの完全なLuxRI型ホモログを持ち、これらは階層的に作動する[110]。B. thailandensisはさらに3つのLuxRIホモログを持つ[111]。
異なるAHLコミュニケーションシステムをエネルギーコスト的に再利用することで、異なる環境において特定の利益をもたらす可能性があることが提案された[112]。グラム陽性菌は、修飾オリゴペプチドと2成分制御システム(図6Bに示す)を用いて情報伝達を行う。
簡単に言えば,シグナル伝達分子は,ABCエクスポータータタンパク質を介して分泌される非修飾または翻訳後修飾された低分子ペプチドである.ペプチド結合による受容体キナーゼのリン酸化は、QS標的遺伝子転写因子として作用する制御タンパク質を活性化する[113]。
セレウス菌や黄色ブドウ球菌の病原因子産生,枯草菌のコンピテンス,肺炎球菌のバイオフィルム形成は,グラム陽性菌におけるQS依存性の遺伝子制御のほんの一例である[114,115]。
QSは、細菌が自身の内部だけでなく、異なる細菌種間でもコミュニケーションをとることを可能にする。そのため,オートインデューサー-2(AI-2)は多くの異なる細菌種によって合成され,認識される.したがって、AI-2はほぼ普遍的なシグナルであるように見える(図6Cに示されているように)[116]。AI-2システムは,V.harveyiで最初に記述された[117]。
LuxSと呼ばれるAI-2合成酵素は,AI-2前駆体である4,5-ジヒドロキシ-2,3-ペンタジオン(DPD)を生成する[117]。DPDは自発的に環化し,AI-2と総称されるいくつかのアイソフォームを生成することができる[118,119,120]。
例えば,S-formはV. harveyiのシグナル受容体LuxPに,R-formはSalmonella enterica serovar Typhimuriumや大腸菌の受容体LsrBに結合する[121]など,異なるアイソフォームがシグナル受容体に結合する。例えば,S. mutansのバクテリオシン産生とバイオフィルム形成の制御,S. anginosusとListeria monocytogenesのバイオフィルム形成,S. pneumoniaとS. pyogenesの病原性制御,Clostridiumの毒素生産にAI-2が関与することが報告されている(総説あり)[122]。
一般に、ある種の自己誘導物質に対する細菌の応答は、多様であり、適応性がある。AI-2の場合のように、全く異なる細菌属が同じ化合物を検出することができる。同じ化学的分類の分子を少し変えただけで、同じ属の異なる種間で異なる反応を引き起こすことさえある[123]。これに対応して,化学的に異なる複数のQS分子が,特定の生物において共同で作用することもある[124]。
* *
最近の研究では,協力的・競争的な微生物間の相互作用におけるQSの役割にさらに焦点が当てられており,社会的行動としてのQSに集中している[80]。
QSによって制御される多くの生成物は、分泌されたプロテアーゼなどの分泌物や排泄物であり、その合成は個々の細胞にとってのみ代謝コストを意味するが、どのコミュニティメンバーによっても利用することができる[125]。
QS依存的な協力は、例えば、緑膿菌のエラスターゼの制御された生産で実証された。エラスターゼは、カゼインを唯一の炭素・エネルギー源として集団を培養したときに成長に必要となるプロテアーゼである[126,127]。また,細菌の群泳は,緑膿菌や枯草菌などいくつかの細菌種で分泌型界面活性剤の共同生産による社会形質である[128,129,130]。
一方,様々な細菌種が,分泌型あるいは細胞標的型の毒素の産生を制御するためにQSを利用しており,例えば,Streptococcus属のバクテリオシン[131,132]やB. thailandensisのタイプVI分泌エフェクター [133]などである.土壌の群集では、P. fluorescensとP. aureofaciensがQSで制御されたフェナジンを用いて、真菌Gaeumannomyces graminisと戦い、植物にコロニーを形成している[134]。
AHL依存的な競争は、同様に、慢性創傷感染でよく共培養される緑膿菌と黄色ブドウ球菌の混合群集でも観察された。緑膿菌は,黄色ブドウ球菌の酸化呼吸を阻害する化合物(4-ヒドロキシ-2-ヘプチルキノリンN-オキシドやピロシアニンなど)のQS制御による合成によって,通常黄色ブドウ球菌を追い越すか減少させている.その後,緑膿菌は,QSが制御するプロテアーゼLasAによって黄色ブドウ球菌の細胞溶解を誘導する[135]。
* *
さらに、最近の証拠は、QSがバクテリアのドメインに限定されるものではなく、バクテリアとそのホストとの間のコミュニケーションを可能にすることを示している。一方、科学者たちは、これらの細菌シグナルが哺乳類細胞のシグナル伝達を調節すること[136]、および宿主ホルモンがQSシグナルとクロストークして細菌の遺伝子発現を調節することを理解した[137]。
原核生物と真核生物は数百万年前から共存しており,真核生物の発生は細菌群に依存していたので,これらの観察は驚くには値しない[138]。「イントキングダムシグナル」の研究分野はまだ初期段階にあるが、この分野の論文数が増えていることは、微生物-宿主間のコミュニケーションが注目されていることを示している。
以下に、微生物-宿主間のコミュニケーションの顕著な例を紹介し、細菌-宿主間の相互作用におけるその重要性を開示す。細菌と植物の間のQSの最初の例は、海洋細菌V. anguillarumと緑藻Enteromorphaの関係で見いだされた[139]。
バイオフィルムを形成するビブリオ細胞はAHLを放出し、海藻の運動性生殖段階である動物胞子を誘引し、その後、特定の生息地に定着して成長するようになる。一方、いくつかのQS依存的な海藻-微生物相互作用が知られている(レビューについては、[140]を参照)。
細菌のAHLに対する植物の特異的な反応の最初の実証は、マメ科植物のPhaseolus vulgaris [141]とMedicago truncatula [142]について示された。ここでは、共生細菌(Sinorhizobium meliloti)と病原性細菌(P. aeruginosa)の両方からのAHLが、植物の遺伝子発現に大きな変化を引き起こした。
さらに、Gaoらは、M. truncatulaが細菌のコミュニケーションに対して、その低分子AHL-mimicを産生することで応答することを示している[143]。
海洋環境における植物とバクテリアの相互作用で最も研究されているのは,紅藻のDelisea pulchraであり,この藻は,汚損微生物から保護するために臭素化フラノンを分泌している.藻類は,それらの臭素化フラノンを放出し,Serratia liquefaciensの群発運動やVibrio属の生物発光,さらにVibrio属のAI-2ベースのQSなど,複数のAHL依存プロセスを阻害する[144, 145]。
ハロゲン化フラノンは,そのQS 阻害作用により,エビの養殖における疾病の治療に実用的な可能性を示し,マウスモデルにおける緑膿菌の病原性を低下させた[146]。
さらに,植物宿主との間で最もよく研究されているキングダム間シグナル伝達機構の1つが,Rhizobium属とその共生マメ科植物宿主との関係である.この共生では、細菌と植物の間で複雑なシグナル交換が行われ、細菌が生息し大気中の窒素を固定する根粒の形成に成功している[147]。
植物は、細菌のQSシグナルを解釈し、組織特異的に誘引/防御反応を開始する複数のメカニズムを進化させ、シグナル特異的でさえある[142,148]。真菌もまた、小さなシグナル分子によってコミュニケーションをとり、近傍の細菌と会話をすることさえある[149]。
しかし、真菌が細菌の自己誘導物質アナログを産生することは示されていない[150]。最も顕著な例は酵母であるCandida albicansで、そのQS分子であるファルネソールは細胞密度依存的に作用し、酵母と菌糸の間の形態的な切り替えを引き起こす[151]。
ファルネソールの発見以来、QSは他のいくつかの真菌種でも報告され、成長、ストレス耐性、形態形成、バイオフィルム形成の制御に関与していることが示された[149,152]。これまでに、真菌のQS分子として、Cryptococcus neoformansのペプチド[153]、A. nidulansのオキシリピン[154]、C. albicansのチロソールなどのアルコールやその誘導体[155]が同定されている。
さらに、細菌が哺乳類ホルモンを認識できることを示す実験的証拠も増えてきている。ここで,研究の中心は病原体であり,病原体は哺乳類ホルモンに応答して病原性因子の産生を開始する.AI-3/エピネフリン/ノルエピネフリンシグナル伝達系はその代表的な例である。腸管病原体である大腸菌は、消化管内の微生物群集が産生するAI-3を感知して病原性遺伝子を活性化し、大腸の病変を引き起こす。GI管に存在する真核生物ホルモンであるエピネフリンとノルエピネフリンは、腸管出血性大腸菌(EHEC)の病原性遺伝子の発現を活性化する[137]。
このように,EHECは真核生物ホルモンを捕獲し,その後,ヒトの大腸粘膜へのコロニー形成を促進し,大腸病変を引き起こす。このようなアドレナリンによる病原性の制御は,EHECに限ったことではないようである。In silico解析では、Salmonella spec., Shigella flexneri, Francisella tularensis, H. influenzae, Erwinia carotovoa, Pasteurella multocida, Ralstonia eutropha, Chromobacterium violaceum, V. parahaemolyticusといった他の細菌種でもこの形態の相互関係が認められた[156, 157]。
また、緑膿菌のような病原性細菌にハイジャックされる新規ホルモンとして、エンドルフィンやダイノルフィンなどのオピオイドが知られている。緑膿菌はこれらのオピオイドを認識し、QSシステムの産生を増加させることで病原性を高め、嚢胞性線維症患者の肺に緑膿菌が持続的にコロニーを形成することになる[158]。
細菌病原体におけるAIの関与について言及したことに加え、同様に真核細胞に対するAIの影響も無視できない。AI、すなわち3-oxo-C12ホモセリンラクトン(HSL)が真核生物宿主のシグナル伝達および免疫応答を調節することができるという証拠が増えつつある[159]。
また,高濃度の3-oxo-C12-HSLは小胞体からのカルシウムの動員により,アポトーシスを誘導した[160]。緑膿菌のQSシグナルによる有害な影響とは対照的に,Fujiyaらの研究は,細菌のQSを介した協力的な細菌-宿主関係を示唆している[161]。
グラム陽性枯草菌は,ペンタペプチド(competence and sporulation factor, CSF)を合成し,能力発現と胞子形成を制御している。しかしながら、CSFはまた、細胞の損傷とバリア機能の喪失を防ぐことによって、腸管上皮細胞における2つの重要なキナーゼ依存性生存経路を活性化する[161]。
* *
QSが細菌のドメイン内やドメイン間で関与し、協力的・競争的な相互作用につながる多数の例は、この基本的なコミュニケーションシステムの重要性を指摘している。多くの細菌がQSを用いて病原性因子の発現を制御し,病原性やバイオフィルム形成を制御していることから,この細胞間コミュニケーション機構を阻害することは,細菌感染症を制御するための新規かつ有望な戦略をさらに構成する[162,163,164,165]。
* *
2.4.3. 細菌間情報伝達の妨害-クオラムクエンチング
「Quorum Quenching(QQ)」という用語は、細菌の細胞間情報伝達を妨害するすべてのプロセスを表す[166]。多菌社会では,ある細菌はQSによって近隣の細胞とコミュニケーションをとっているが,他の細菌はQQメカニズムによってコミュニケーションを妨害している;したがって,長い間,主に競合相手に対する防御メカニズムとして機能していると考えられてきた[84,90,167]。
異なるQQ 機構は,QSに関与する異なるステップをブロックすることによって作動し,(i)シグナルの生成と蓄積のブロック,(ii)シグナルの受信の阻止,(iii)自己誘導と活性化の阻害からなる[109](図 6Dに示すとおり).(i)まず、シグナル分子の生合成の阻害は、アシル鎖(アシルアシルキャリアタンパク質)(ACP)やS-アデノシルメチオニン合成酵素などの関与酵素を阻害したり、LuxIホモログやLuxSなどの合成酵素そのものに干渉することで実現できる[165]。
(ii) 次に、シグナル伝達分子とそのタンパク質受容体の間の複雑な相互作用を模倣する、あるいは不活性化するいくつかの小分子が同定された[168]。模倣構造に基づいてネイティブなAHLのような機能を意味するアゴニストと、受容体結合部位をブロックしてシグナル伝達分子の結合を阻止するアンタゴニストの間に区別がなされる[169]。
例えば、緑膿菌のAHLアゴニストは、AHL(3-oxo-C12-HSL)と明白な構造的つながりを示さないが、AHLと同じ受容体タンパク質のポケットに結合すると予測されるものが同定された[170]。さらに,一連の天然由来のブロモフラノンは,強力な拮抗的QS阻害を示し,リガンド部位での競合的結合ではなく,受容体タンパク質の二量体化を妨げることによって機能すると思われる[171]。

さらに、ジケトピペラジン(DKP)は環状ジペプチドであり、哺乳類組織のシグナル伝達ペプチドと構造的な類似性を有している。緑膿菌、Proteus mirabilis、Citrobacter freundii、Enterobacter agglomeransなどの細菌[172]や、酵母、菌類、地衣類[173]などの様々な生物により生産されている。
DKPはLuxRベースのQSではAHLアンタゴニストとして、それ以外ではアゴニストとして作用する[172]。また,黄色ブドウ球菌のグラム陽性菌の自己誘導ペプチド(AIPs)による交差阻害は,黄色ブドウ球菌に存在する4つのAIPsのそれぞれが競合する黄色ブドウ球菌群のQSを特異的に阻害するため,阻害剤によるQQ機構の一例となる[174]。
各AIPはその同族受容体を特異的に活性化するが、非同族受容体への競合的結合により他の全ての受容体の活性化を阻害する。このように,各AIPは他の3つのグループのS. aureusの病原性カスケードの活性化を抑制している.2つの異なるS. aureusグループに感染すると、種内競争が起こり、最初にQSカスケードを確立したS. aureusグループは、他のグループを抑制する[175]。
S-リボシルホモシステイン(SRH)は,世界共通のシグナル分子AI-2の前駆体DPDの合成に重要であることから,いくつかの研究グループは,SRHの基質アナログがAI-2合成を標的とする阻害剤となる可能性を見いだした.SRHのアナログであるS-anhydroribosyl-L-homocysteineとS-homoribosyl-L-cysteineはLuxSに対して阻害活性を示した[176]。
さらに、いくつかのSRHアナログが、潜在的なLuxS阻害剤として報告された。キネティック研究により、これらの化合物はLuxSに対して可逆的な競合阻害剤として作用することが示されている[177]。SRHはDPDの合成に最も重要な中間体であるため,5-methylthioadenosine nucleosidase (MTAN)も合成過程の酵素として重要である.MTANは細菌のpfs遺伝子にコードされており、基質を加水分解してアデニンとS-リボシルホモシステインを生成する反応を触媒している。
MTANが触媒する反応のメカニズムに従って,いくつかの遷移状態アナログ,例えばBut-DADMe-ImmAが設計・合成され,AI-2合成を阻害している[178]。さらに,V. harveyiの受容体タンパク質 LuxPに対して,いくつかのアゴニストリガンドが報告され,その多くはDPDやAI-2 (S-THMF-borate) 類似体が天然のAI-2とLuxPへの結合を競合している[179,180]。
Renらは,天然のフラノン化合物 (5Z)-4-bromo-5-(bromomethylene)-3-butyl-2(5H)-furanoneがV. harveyiおよびE. coliのAI-2を介したQSを阻害できることを見出した[181]。
植物からの多くのサンプルのスクリーニング、ウルソール酸、および7-hydroxy indoleは、AI-2経路をブロックすることにより腸管出血性大腸菌のバイオフィルムの阻害剤として見出された[182,183]。
以前の研究では、レポーター株であるV. harveyi BB170を用いて、ある種の食品成分がAI-2シグナルを阻害することが示された[184]。鶏肉洗浄サンプル中のAI-2 QS阻害物質は、いくつかの消光性脂肪酸を同定することで特徴づけられた。
リノール酸、オレイン酸、パルミチン酸、およびステアリン酸は、約25〜99%の範囲のAI-2阻害を発現した[185]。(iii)第三に、QSシグナル分子の修飾または分解により、QSシグナルが蓄積するのを防ぐ。QSシグナルの分解は、化学的、代謝的、および酵素的なメカニズムによって媒介されることがある[186]。
化学的分解は、主にアルカリ性pHで報告されており、AHLのラクトン環の開環につながる[187]。しかし、酸性pHでは、環が再活性化し、活性が回復する。Variovorax paradoxusや緑膿菌のような少数の生物は、唯一の炭素源としてAHLを代謝することができるため、エネルギー生成と並行して競合するQS細菌を抑制することができる[188,189]。
QSシグナル分子の酵素による分解は、幅広い原核生物と真核生物で観察された。AHL-ラクトナーゼは、AHL分子のホモセリンラクトン環のエステル結合を加水分解する[190]。aiiA遺伝子によってコードされる最初のAHLラクトナーゼは、Bacillus 240B1株から特徴づけられた[191]。その後、グラム陽性菌やグラム陰性菌を含む様々な細菌でホモログが同定された。AHL-ラクトナーゼは、配列の相同性から2つのクラスターに分類される。
第一は,Bacillus属を代表とするAiiAクラスターである[192]。もう1つはAttMクラスターで、A. tumefaciensやKlebsiella pneumoniaeなどグラム陰性のメンバーがいる[193,194]。
AHL-ラクトナーゼは、既知のQQ酵素の中で最も特異的なAHL分解酵素である。短鎖と長鎖のAHLを加水分解するが、他の小分子に対する残基活性は示さない[195]。パラオキソナーゼ(PON)は哺乳類、他の脊椎動物、無脊椎動物で同定され[196,197]、AHLのホモセリンラクトン環を加水分解する能力も持っている[173]。
PON酵素は、真核生物の病原体、例えば緑膿菌がよく使う長鎖のAHL分子で最も活性が高いようである[198]。PONはラクトナーゼとは異なり、広い範囲の酵素活性を持つことがよく知られている[199]。AHL-アシラーゼは、AHLのアミド結合を切断することでAHLシグナルを不活性化し、対応する脂肪酸とホモセリンラクトンを生産する[188]。
これらの酵素は、Variovorax、Ralstonia、P. aeruginosaなど、いくつかの細菌に広く保存されている[200,201]。AHL-アシラーゼの基質特異性には顕著な違いがあり、長鎖AHLの分解に有効であることが実証されている[202]。
AHL-oxidoreductaseは、AHLを分解せず、分子の3-oxo基を修飾して対応する3-hydroxy誘導体を生成する[203]。AHL受容体の特異性に応じて、この修飾はそれぞれのAHLのシグナル伝達活性に影響を与える場合と与えない場合がある[204]。
グラム陽性シグナルの消光は、例えば、食細胞の膜に存在するNADPHオキシダーゼによって可能となる。食細胞は、宿主防御時に殺菌活性酸素の生成を担い、自然免疫系に不可欠なものである[205]。この酵素は、その酵素産物を介して自己誘導性ペプチド(AIP)を不活性化する[206]。
例えば、黄色ブドウ球菌のAIPシグナルの不活性化は、シグナルのC末端メチオニンスルファニル基が酸化されて対応するスルホキシド体になり、AIP活性が失われることによって引き起こされる[207]。様々なAHL消光機構や化合物とは対照的に,AI-2干渉機構,特にAI-2 QQ酵素はこれまでにごくわずかしか報告されていない.大腸菌のAI-2キナーゼLsrKはin vitroでAI-2をリン酸化し,大腸菌集団だけでなくSalmonella typhimuriumやV. harveyi培養物にex vivoで添加するとQS応答を低下させることがわかった[208]。
メタゲノム由来のAI-2 Quenching酵素により,Klebsiella属のAI-2制御によるバイオフィルム形成の高効率阻害が実証された.AI-2のシグナルは,同定された酸化還元酵素QQ-2によって修飾されている可能性が高い[209]。
* *
QQは,QSを介して行動を制御する生物がQSシグナルのリサイクルやクリアリングを行うために,あるいはQQを持つ生物がQSシグナル産生生物と競合する中で進化した自然機構であると考えられている[166]。例えば,A. tumefaciensでは,QSシグナルのクリアリングによって,植物のクラウンゴール病感染に重要なTi-プラスミドの転移が制御されるなど,QQはQS機能の微調整に関係していることが明らかにされた[210]。
QSシグナルのリサイクルは、主にQS分子を生産する微生物で起こる[166]。例えば,緑膿菌では,アミダーゼHacBとPvdQ,QuiPがAHLを脂肪酸とホモセリンラクトン(HSL)に変換し,さらに菌に同化させることでAHLリサイクルに寄与している[211]。
同様に,LsrFとLsrGはAI-2の分解に関与し,それによって大腸菌のlsrオペロンの誘導を停止させ,AI-2シグナル伝達サイクルを閉じている[212]。QSを産生しないが,QSシグナルの毒性に敏感な微生物では,QQ酵素が解毒に重要な役割を果たす[213]。
AHLではなくペプチドを介して情報伝達を行うグラム陽性バチルス属細菌では,AiiAラクトナーゼが同定された.バチルス属は、それらのシグナル分子を分解することでAHLから身を守っており、いくつかのグラム陽性菌に対して殺菌活性を発現している[166,214]。
さらに、QSシグナルを生成せず、QQプロセスを利用する生物によって、QSシグナル伝達が妨害される[166]。植物,動物,そしてQSを放出する病原体の宿主を含むいくつかの真核生物は,QSシグナルを不活性化することができる酵素を発現している[106]。
上述のように、いくつかの研究は、例えば病原体である緑膿菌に対する防御において、高度に保存されたパラオキソナーゼ(PON1、PON2、PON3)の関与を評価した[173,215,216]。哺乳類の血清や気管上皮細胞は、この病原体の長鎖AHLを効率的に不活性化することができた[196,197]。
多くの自然環境には多様な微生物が生息しており,その中で細菌は近隣の細菌と空間や資源をめぐって競合している.したがって,競合相手もまた,細菌のコロニー形成やコンピテンスを回避するために,QSシステムを解除するいくつかのメカニズムを進化させた.シグナル受信の阻害剤や拮抗剤[166,217]あるいは酵素による不活性化は,すでに上で指摘したように,自然環境中の細菌間で同定された[166,218,219,220]。しかし、自然環境下で検討されたモデルの数は少なく、細胞、集団、微生物群、超生物レベルでの合理的な生物学的文脈でのQQ機能の解読に向けた努力は十分ではない。
* *
また,QQの研究は,医療,農学,工業における病原体やバイオフィルム形成細菌を標的とした抗菌・抗疾患戦略の開発という応用領域にも及んでいる[221]。QS干渉に基づく治療法の開発は,しばしば効果のない抗生物質に対する代替・補完的なアプローチによって大きく推進されている[222,223,224]。
考えられるバイオテクノロジーの応用は多岐にわたり,現在までにいくつかの例が発表されているが,その応用はまだ可能性に過ぎず,その可能性を実際の使用に導くための研究が必要である.養殖業では,しばしば抗生物質耐性病原体の疾病発生に大きな影響を受けるため,抗生物質に代わる効果的な方法が緊急に求められている[225]。
耐性の発達に対抗するため、養殖業では抗生物質の投与がますます制限されるようになってきている。Vibrio sp.,Aeromonas sp.,Pseudomonas sp.などの既知の日和見病原体は,しばしばQSを介して病原性を制御する.したがって,新しい抗感染性アプローチとしてのQSの破壊は,養殖への適用の大きな可能性を秘めている[226]。
臭素化フラノンは,V. harveyi株の成長抑制効果を中和するのに有効であることが判明した.また,ブラインシュリンプのArtemia franciscanaやニジマスのOncorhynchus mykissを病原性Vibrio属の感染から保護した[229,230]など,ワムシの生存と成長を向上させた.また、いくつかの細菌代謝物が、養殖病原体のQS制御表現型をブロックすることができ、その中には、Shewanella sp.[231,232]、Halobacillus salinus[217]、および海洋真核生物の様々な腸内細菌[233]が含まれていた。
アスペルギルス属のコウジ酸を無毒の塗料に組み込むことで,人工海洋環境における細菌と珪藻のコロニー形成と成長をQS干渉によって制御することに成功した[234]。産業界では,QQは廃水処理に適用されており,汽水や海水の再生や脱塩に使用される膜バイオリアクターは,膜フィルターのバイオファウリングに制約されている[235]。
Aeromonas hydrophilaやP. putida [236]が形成するバイオフィルムのファウリングは,防汚コーティングに小信号干渉化合物を添加するか,QQ酵素やQS阻害剤を分泌するように操作した海洋生物を固定化することによって防止できる[237,238,239,240]。
QQはまた,植物栽培にも応用されている.表在性細菌は、P. syringaeのような植物病原体のQS制御された病原性を妨害することによって、病気を制御するために利用される[241,242]。QQ酵素の生産を植物や植物に関連する微生物に工学的に組み込むことは、Erwinia carotovoraの病原性を低下させるためにAiia lactonaseを異種発現した遺伝子組み換えタバコやジャガイモ植物で既に実証されたように、作物保護に役立つと期待される[190,191]。
最後に、QQは医療への応用も考えられている。多くの抗生物質に本質的に耐性があり,慢性的な感染症を引き起こす緑膿菌に対するQS阻害剤として,ニンニクの利用がRasmussenらによって実証された[243]。この処理により,バイオフィルムは,トブラマイシンなどの抗生物質や好中球による貪食に感受性を示すようになった[244]。
嚢胞性線維症に苦しむヒト患者を治療するためのQS阻害剤としてのニンニク油浸軟膏の使用に関する最初の臨床試験が2010年に報告され[245]、嚢胞性線維症患者の肺機能、体重、症状スコアがわずかに改善する結果となった。さらに,Hentzerらは,外科用インプラントやカテーテルの表面にQS阻害剤として組み込むことが可能な合成フラノンの存在下で,緑膿菌のバイオフィルム形成と病原性因子産生が減少することを示した[240,246].しかし、これらは後に有毒な副作用を示した[228]。
* *
有効なQQ化合物を見つけるための最も重要な前提条件の1つは,バイオセンサーを用いた検出である.AHLとAI-2レポーターは,QS制御プロモーターとレポーター遺伝子の融合に基づき,異なる研究者によって随所に開発された[128,144,184,236,247,248,249,250,251,252,253,254]。
これらのバイオセンサーは、QSシグナルを高感度、定量的、リアルタイムに検出することができる。レポーター株は、多くの場合、ネイティブなQSシグナルを生成できないが、Chromobacterium violaceum CV026におけるビオラチン色素生成 [249]、V. harveyi [255]またはA. tumefaciens A136 [256]における生物発光のように、外来自己誘導剤に反応し、検出可能な表現型を示すことができることがある。
ほとんどのレポーターは、当初は新しいシグナル伝達分子を同定するために設計された。QS-プロモーターは、環境中に存在する可能性のあるシグナル分子によって誘導され、それぞれの表現型の発現につながる。このバイオセンサーは、プロモーターを誘導する自己誘導物質を同時に添加することで、これらのシグナル分子を妨害するQQ化合物の同定にも使用できる。
要するに、これらは容易に識別可能な表現型を持つ自然のQSシステムを模倣しているのである[257]。驚くべきことに、ほとんどのAHL-QSベースのレポーターが発表されており、AHLアゴニスト[258]やアンタゴニスト[259]と同様に、AHL分解[218]や修飾[203]化合物などのAHL干渉化合物を識別することが可能である。
グラム陰性および種間特異的なQSに対するQQ化合物の検出レポーターとして,発光がないことで潜在的なQQ活性化合物を同定するV. harveyiが開発された[260]。このタイプのシステムに基づいて,スクリーニングは,レポーターシグナルの消失によってQS干渉性化合物を示すことになる.この手順の重大な問題の1つは、QQ化合物以外の因子も、例えば、細胞増殖を減少させることによって、シグナルの減少を引き起こし得ることだ。
したがって、レポーターシグナルの減少とモニターされたout readの減少は必ずしも比例しないため、さらなる多面的効果を示すQS妨害化合物の特異性に関する信頼できる情報を得ることは難しい場合がある[243]。Rasmussenらは、これらの問題を回避するためにQuorum Sensing Inhibitor Selector (QSIS)と呼ばれる別のタイプのスクリーニングシステムを設計した。
QSISシステムは、毒性タンパク質をコードするAHL誘導性致死遺伝子を持つ大腸菌をベースにしている。この菌株が周囲の環境中のAHLを感知すると、致死遺伝子が発現し、その結果、成長が阻害されることになる。一方、QSを阻害する化合物が存在すると、致死遺伝子の発現が誘導されず、細菌は増殖できるため、細菌は救済される[261]。
このような増殖のためのポジティブセレクションの方法は、AHL消光活性を有する合成化合物や植物・菌類の抽出物の単離に有効であることが証明されている[98]。すでに述べたように,AHLとは対照的に,AI-2 QQ化合物はこれまでにわずかしか同定されていないが,これはおそらく適切なレポーター系がないためである[165,262]。
AI-2様化合物の検出のためのいくつかのレポーター系は,原理的にはAI-2消光活性の同定に用いることができると報告されている.一例は,変異した自己誘導体合成酵素(LuxS)を持つ上記のV. harveyiベースのレポーターシステムであり,AI-2の外部蓄積を検出し,生物発光をもたらすために用いることができる[263]。
第二のレポーターシステムは、大腸菌AI-2誘導性プロモーターlsrAにlacZを融合したものである[264]。さらに、Rasmussenと共同研究者の革新的な戦略に基づいて、レポーター株AI2-QQ.1が確立され、現在では、AI-2ベースのQSを妨害する新規で無毒な生体分子を、ポジティブセレクションを用いて同定できるようになっている[254]。
今日では,細菌の分離,抽出,メタゲノムおよび合成ライブラリーを用いて,このようなバイオセンサーによるQQ化合物の迅速なスクリーニングが可能となり,さらにその化合物の応用が試されている.しかし,新しいQQ戦略の発見や,病原体や細菌バイオフィルムの制御におけるその効果的な応用は,QQ剤に対する耐性発現の可能性について疑問を投げかけた.これは議論のある議論となっている[265]。
細菌の生存率に直接的な影響を与えないことから、耐性変異体の選択と出現は、従来の抗生物質治療よりも頻度が低いのではないかという仮説が生まれた。しかし、Defoirdtらは、QSの破壊が耐性につながらないという仮説に異議を唱え、QSコア遺伝子の変動を通じて細菌の適性に影響を与えることができると示唆した[266]。
さらに,ある研究では,緑膿菌においてQQ化合物が実際にQQ耐性を生成することが実証されている[267]。細菌は,シグナル合成,検出,伝達などに関与する遺伝子など,標的とするQSシグナル伝達経路のコア遺伝子の発現を変化させることで,QQアプローチから容易に逃れることができる可能性がある.したがって,細菌がQQに対して耐性を獲得する可能性は高いが,耐性を獲得する可能性は従来の抗生物質よりも小さいことが示唆された[225]。
* *
結論として,QQ戦略は,多くの原核・真核生物において,自ら合成したQSシグナルをリサイクルあるいは消去するための機構として,あるいはQSシグナル産生生物に対する競争戦略として進化してきたと考えられる.さらに、QQは感染症や細菌性バイオフィルムに対抗するための有効な代替手段となる可能性があり、単剤あるいは抗生物質や他の代替戦略との併用が考えられる。しかし、今後は、分子レベルでのQQの基礎的なメカニズム、微生物群集における生物学的役割、毒性副作用を排除するための現実的な条件下での抗菌治療としての利用などに焦点を当てた研究が必要である。
2.5. 微生物と宿主の相互作用
半世紀前、Lynn Margulisは高等生物の進化におけるバクテリアの重要性を初めて認識した[268,269,270,271]。2007年には、Ilana Zilber-RosenbergとEugene Rosenbergによって、宿主ゲノムと関連する微生物ゲノムの合計を表す「ホロゲノム」という用語が導入された[272,273,274]。
これは、生物学における現在進行形のパラダイムシフトの基礎となった。現在では、ホロビオント/メタオーガニズムという新しい概念的枠組みが確立され、ホロビオント/メタオーガニズムは、多細胞の宿主とその関連種の合計と考えられている(図7に示すように)[275]。
ホロビオント理論では、結合のタイプ(一過性か永続的か)や機能に関係なく、すべての関連種を考慮する。メタオーガニズムの概念は、与えられた環境における宿主関連微生物叢の機能と貢献(有益または有害)に焦点を当て、それらは微生物のアイデンティティ、存在量、および活性に依存する(以下では、主に「メタオーガニズム」という用語を使用する)[272,274,276]。
多細胞生物は単独で考えることはできず、関連する微生物との相互依存性の中でしか考えられないという認識が広まったことで、2つの重要な知見が得られた。第一に、宿主の健康や体力は基本的に多生物的であり、複雑なパートナーシップの中で何らかの障害が生じると、メンバーの健康に重大な影響を及ぼす可能性があるようである。
第二に、宿主と微生物は激しく相互作用し、共進化する[277,278,279](図7に示すとおり)。特定の宿主関連微生物叢が、宿主の代謝、発生、器官形態形成、病原体防御と免疫、行動、環境感知と適応、発生遷移、生殖に寄与することが、既にいくつかの研究で示されている[278,280,281,282,283,284,285,286,287,288,289,290,291,292,293,294](図7)。
特定の微生物またはコンソーシアムの機能は、宿主の発育段階、年齢、生殖状態、または生理学的状態に依存するため、静的ではない[276,278,295]。
微生物叢が宿主の体力に大きく寄与していることは、主にここ10年で解明されてきた。病原体に対する防御と必須栄養素の供給は、宿主の健康に対する微生物相の最も一般的かつ重要な貢献であると同定された。サンゴでは、常在菌が白化病の病原体であるV. shiloiから身を守り[296]、サンゴの粘液に病原体が定着するのを抑制する物質を生産している[297]。
さらにいくつかの実験では、無菌の動物は通常の動物よりも病原体の投与後の感染や死に対してかなり敏感であることが報告されており、例えば、モルモットのShigella flexneriへの感染 [298]、マウスのV. choleraへの感染 [299] 及びウサギのBacteroides vulgatusへの感染 [300]について示されている。
同様に、ヒトにおいても、正常な微生物相は、口腔、腸、皮膚、および膣上皮における病原体による感染から保護することが示された[301,302,303,304]。シュードモナス属、フラボバクテリア属、バチルス属の代表的な微生物は、病原体と直接相互作用するか、植物宿主の全身抵抗性を誘導することにより、植物を植物病原体から保護することができる[305,306]。
一般に、植物の根圏に存在する微生物は、植物の成長促進、病気の抑制、毒性化合物の除去、および植物への栄養分の同化に不可欠である[307]。さらに、作物生産性のためにそのような有益な微生物を利用することは、植物の健康状態および品質を維持することによって作物収量および生産性を調節する効率的な方法を提示す[308,309,310]。
有益な微生物と植物の相互作用の利用は、現在、農業産業における化学ベースの合成農薬や肥料に対する標準となりつつある[307,311,312]。さらに,微生物相が宿主の栄養に寄与していることは,長年にわたって知られている.例えば、硫黄酸化細菌のような化学栄養細菌共生体は、CO2から有機物を合成し、動物宿主の主要な栄養源となっている[313]。
一方、アサリやムール貝などの宿主は、共生細菌に生息場所を提供し、そこで化学栄養の基質(O2、CO2、H2Sなどの還元性無機化合物)にアクセスすることができる[314]。ヒトでは、腸内細菌叢は、食物繊維の異化、ビタミンおよびアミノ酸の生産、および有害化学物質の解毒に不可欠な役割を果たす複雑な生態系である[315,316]。
近年、いくつかの研究により、マイクロバイオームが様々な組織、機能、臓器の発達にも寄与していることがさらに明らかになっている[273,317]。細菌に依存した発生を示す例として、多くの緑藻類が挙げられるが、これらは細菌が存在しないと異常に発生する[318]。
例えば、海産緑藻のUlva lactucaは、軸培養で典型的な葉の形態を失い、ピンクッション状のコロニーに発達する。しかし、このような異常な藻類のコロニーは、適切な海洋細菌で再コロニー化することにより、典型的な形態に回復することができる[319]。
また、腸内細菌は、発生過程における哺乳類の消化管免疫系の組織、細胞、分子プロファイルを形成することが示された[320]。微生物は、その表面にある接着分子を通して宿主細胞と相互作用し、その結果、宿主細胞の受容体との相互作用を促進し、それらの免疫反応や代謝・行動反応のうち宿主反応を誘発する[321]。
例えば,マウスを用いた最初の実験では,腸内細菌叢が脳に影響を与え,その結果,行動に影響を与えることが示された[322]。進化の過程で,腸内細菌叢のコロニー形成が,中枢神経系と行動に影響を与える脳の発達のプログラミングに組み込まれた可能性が高い[323]。
細菌は,食事性代謝産物やホルモンのレベルを変化させることで脳とコミュニケーションをとっている[324]。腸内細菌叢は、気分、認知、痛み、肥満の重要な調節因子となりうる[325]。微生物叢-腸-脳軸を理解することで、認知、性格、気分、睡眠、食行動における個人差や、感情障害から自閉症や統合失調症に至る様々な神経精神疾患に微生物がどのように寄与しているかについての新たな知見を得ることができる。
このように,宿主と微生物の複雑な相互作用を理解することは,病気に対する治療薬の開発だけでなく,将来的に感染症や障害を予防するためのプレバイオティクスやプロバイオティクスを見つけるための鍵となり得る[326]。
微生物と宿主の協力関係以外にも,サンゴホロビオントの粘液中の微生物同士の相互摂食 [327]や,動物や植物の外表面や動物の消化管にある微生物バイオフィルムにおける「公共財」の共有 [328]など,メタオーガニズム内の異種微生物間の相互作用の例は数多くあり,最終的にはメタオーガニズム全体として適性利益がもたらされることになる.微生物間の協力的な相互作用の中には、いわゆる副産物的な相互作用もある。
例えば,哺乳類の大腸で嫌気性代謝の際に細菌が生産する短鎖脂肪酸のように,細菌の代謝の副産物から宿主が利益を得ることが知られている[329,330]。
アブラムシとブナムシの共生では,宿主にとって必須であるアミノ酸を共生者がエネルギーコストをかけて過剰生産し,最終的に共生者の環境を構成するため,最終的には宿主にとっての利益も共生者,ひいてはメタ生物全体にとっての利益も持つことを例示している[331,332]。
このような多様な協力の例は,前述したように,メタオーガニズム内に存在する異なる微生物コミュニティのメンバー間の競争と矛盾しない(2.4節参照).
図7 メタオーガニズムの概念
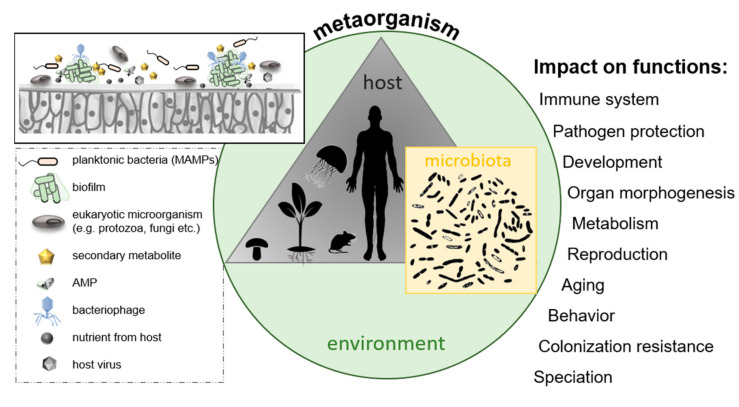
メタオーガニズムは、特定の環境に位置する多細胞の宿主とそれに関連する微生物相から構成される。
宿主表面の細菌のコロニー形成に影響を与え、最終的に宿主の様々な機能に影響を与える可能性のある因子を選択的に提示している
メタオーガニズムの概念は、多細胞宿主生物の進化が、主に関連する微生物叢との協力によって行われたという仮定を導くものである。微生物間および微生物と宿主の協力関係は、アーバスキュラー菌根菌と維管束植物の根(約4億年前)に代表されるように、数百万年かけて共進化してきた[333]。
ここでは、糸状菌門の菌類が、維管束植物の根の皮質細胞に入り込み、アーバスキュールを形成している。この菌類によって、宿主である植物は土壌からリン、硫黄、窒素、微量栄養素などの栄養分を取り込むことができる。アーバスキュラー菌根菌は、維管束植物の進化と陸上への最初の植民地化に重要な役割を果たした可能性が高い。
アーバスキュラー菌根菌は,既知の植物共生の中で最も普及していると推定され,維管束植物の80%に見られる[334]。進化した相互関係はさらに、内生藻類とサンゴ(約2億4000万年前)[335]、反芻動物とその微生物叢(約6000万年前)[336]、類人猿と腸内細菌叢(1500-2000万年前)[337,338]で知られている。
また、腸内細菌叢は、反芻動物やシロアリで微生物叢を獲得することで進化を示し、微生物が植物材料のセルロースを分解し、宿主がそれらの栄養素を代謝できるようにする[339,340]。微生物相の獲得は,新しい環境に迅速に適応できることが大きな利点の一つである.このような例は,殺虫剤に耐性を持つ細菌Burkholderiaが,さらに宿主である昆虫の殺虫剤への耐性をもたらしたことに示されている[341]。メタ生物の進化は、微生物の遺伝情報が宿主の染色体に水平移動することによっても獲得することができる[342]。
共生生物と宿主との間の水平的遺伝子転移(HGT)の例は数多く知られており,例えば,カロテノイド産生のための生合成遺伝子の菌類からアブラムシへの転移 [343] ,内部共生生物Wolbachiaから節足動物宿主への遺伝子転移 [344] ,長点間核要素(LINE-1)のヒトから病原菌Neisseria gonorrhoeaeへの転移 [345]が知られている.
* *
つまり、すべての動物や植物には微生物が生息しており、微生物が宿主の健康や体力に影響を与え、最終的には微生物群集のメンバー間および微生物と宿主の間の複雑な相互作用を保有するメタオーガニズムを形成している。宿主と微生物の相互作用に関する研究は、学際的な分野として新たに注目されるようになった。
多様で複雑なマイクロバイオームは、免疫学的、代謝学的、行動学的に有益であり、その乱れは疾病の発生につながる可能性がある。しかし、メタ生物間の相互作用を制御する分子的・細胞的メカニズムは十分に理解されておらず、関連する生物間の多くの重要な相互作用も未知のままである。今後は、特に相互作用の機能的帰結や、宿主の生活史や進化的適性に及ぼす微生物叢の影響に焦点を当てた研究が必要である。
3. 微生物間相互作用の研究方法
微生物は様々な生態系で重要な役割を果たしており、微生物間の相互作用を明らかにすることは、微生物群集の組織と機能を理解する上で不可欠なステップである[346]。微生物間の相互作用を理解するための鍵は、最先端の手法と制御された実験プラットフォームの継続的な開発である。
微生物の大部分(95~99%)が培養されていないという事実は、「メタゲノム」としてまとめられる培養に依存しないアプローチや手法の緊急の必要性を指し示している[347]。メタゲノムという用語は、1998年にJo Handelsmanによって初めて使われた[348]。
メタゲノミクスは、全DNAの直接抽出とクローニングによって、与えられた生息域の生物の集合体のゲノム解析と定義されている[349]。その結果、メタゲノミクスは、環境中に存在する膨大な未培養の微生物多様性を解き放つことができる。
メタゲノム研究により、エネルギー獲得、炭素・窒素代謝などの代謝経路をコードする多くの新規微生物遺伝子や、バイオテクノロジーに応用可能な新規遺伝子、粒子、化合物が同定された[350,351,352,353,354]。メタゲノムでは、自然環境における微生物や、メタオーガニズムのように生物学的および生物学的表面に関連した複雑なコミュニティを調査することができる[355]。
メタゲノム研究には2つの基本的なタイプがある:(i)環境サンプルからのDNAの配列決定および分析を含む配列ベースのメタゲノム、および(ii)特定の機能または活性のスクリーニングからなる機能ベースのメタゲノム[356]。配列ベースのメタゲノム解析は、ゲノムの構築、遺伝子の同定、完全な代謝経路の発見、および微生物の多様性と存在量の解析に使用でき、コミュニティ内およびメタオーガニズム内の微生物の生態に関する情報を提供する[357,358,359,360,361,362]。
機能的メタゲノム解析は、混合微生物集団またはメタ生物全体の抽出されたDNAから出発して、遺伝子機能を研究するための強力な実験アプローチである。機能的アプローチでは、メタゲノムライブラリー(環境メタゲノムからベクターバックボーンにクローニングしたDNAを含む物理的ライブラリ)の構築とスクリーニングに依存する。
コスミドまたはフォスミドベースのライブラリは、挿入サイズが大きく一定で、クローニング効率が高いため、しばしば使用される[350,351,352,353,356,363]。さらに、メタゲノム解析は、臨床、産業、バイオテクノロジーへの応用に向けた幅広い生体触媒や新規化合物の発見と特性評価につながった。
例えば、メタゲノム解析による共生菌の調査は、希少なタイプIポリケチド合成酵素の同定につながり、新規抗腫瘍性化合物の生成を可能にした[364]。メタゲノムライブラリーの解析により、土壌中に新規抗生物質が高い頻度で存在することが明らかになった[365]。
熱帯植物(ブロメリア)の水槽水に新規抗生物質であるパルミトイルプトレスシンが発見され、口腔内メタゲノムにテトラサイクリンの不活性化に関する新規細菌メカニズムが発見された[366]。さらにメタゲノム解析により、環境中の原核生物が利用する新規のゼノバイオティクス分解経路が同定され[367]、バイオテクノロジーに利用できるようになった。
メタゲノム研究の当初からの主要分野の1つは、エステラーゼ、ニトリルヒドラターゼ、アルコール還元酵素、アミダーゼ、セルラーゼ、アミラーゼ、グリコーゲン分岐酵素、ペクチン酸リアーゼなどの新規生体触媒を発見することであった[368,369,370,371,372,373,374]。
* *
メタゲノム以外にも、シーケンサーや「オーミック」技術の進歩により、微生物群集の構成や微生物の代謝活性を効果的に追跡できるようになり、さらに微生物の機能に関する相関が可能になった[375]。原核細胞および真核細胞からのRNAを同時にシーケンスすることで、宿主とそれに関連する微生物叢が遺伝子発現レベルでどのように相互作用しているかを明らかにすることができる[376]。
さらにin situの手法も、微生物の相互作用の把握に役立つ[377]。細菌の蛍光in situハイブリダイゼーションラベリングや細胞外環境成分の非侵襲的イメージングなど、標識細菌とその周辺を定量的にイメージングする技術は、微生物研究に重要な空間的次元を追加する[377,378]。
代謝標識は、微生物の活動を追跡することも可能にする[379]。現在では、合成的なアプローチも、複雑な微生物間相互作用の探索に役立っている[380,381]。一方では、合成微生物群集は複雑さを軽減し、数学的に容易にモデル化することができる[382]。
一方、合成生物学の進歩により、遺伝的に定義された特性を持つ微生物の工学的な作製が可能になった[383]。これらの人工細菌を人工環境と組み合わせることで、環境の手がかりに反応する微生物の相互作用を研究することができた。
実験的には、自然環境を模倣したマイクロチャンバーベースの手法が開発され、動的な根と微生物の相互作用を評価するマイクロ流体アッセイ[384]や、海洋微生物の行動を空間的に関連したスケールで研究するin situ化学走性アッセイ[385]などに代表されるように、自然環境を模倣した手法が開発された。しかし、微生物群集の相互作用、特に超生物で起こるすべての複雑な相互作用を理解することは、培養に依存したアプローチにも依存していることを無視してはならない[295]。
細菌の培養は、いくつかの系統群に大きく偏っている。以前は培養不可能であった細菌の生態に対する理解の向上に基づき、新しい培養コンセプトが開発されたし、今も開発され続けている。ここでは、天然の基質や栄養素の種類や濃度を模倣した培地、ハイスループット培養技術、バイオフィルム形成や細菌の相互作用を利用したアプローチなどが、培養技術を決定的に向上させた[386]。メタゲノム解析やシングルセルゲノミクスは、未知の代謝の特徴をさらに明らかにし、微生物の培養の改善や共培養に必要な情報を提供することができる[387]。
注目すべきは、宿主と微生物の相互作用に関する研究では、大部分が無菌の宿主(gnotobiotic)または完全に無菌の宿主(axenic)と培養した微生物分離株の組み合わせにより、微生物のメタオーガニズム機能への貢献について詳細な洞察を得ていることである[284,388]。
このような再コロニー化実験により、特定の微生物に機能を割り当てることができる[276,388,389]だけでなく、微生物のコロニー化ダイナミクスを決定し[388,390]、細菌-細菌相互作用を明らかにすることができる[284,391]。
紹介した技術はいずれも、微生物群集の複雑さ、微生物の機能、これらの微生物と宿主との相互作用について洞察を与えることができる。微生物群集の研究は目覚ましく進歩しているが、その全貌を解明するにはまだほど遠い。純粋な観察的アプローチだけでなく、微生物同士や微生物群集との相互作用の解釈を容易にする実験的・計算的手法を強化する必要がある。環境との相関関係を調べ、微生物の依存関係とその共進化を理解するための計算モデリングと解析ツールの開発・導入が必要である[392]。
* *
微生物の相互作用を理解する以外にも、数千年にわたり、発酵、廃棄物処理、農業などのバイオテクノロジープロセスで微生物コンソーシアムを利用するための調査にも焦点が当てられている[393]。しかし、天然の微生物生態系に対する理解が深まり、合成・設計されたコンソーシアムを構築するための新しいツールが開発されて初めて、医薬品、バイオ燃料、バイオマテリアルのバイオ生産など、多様な用途に微生物コンソーシアムを利用する可能性が大きく広がった[394]。
複数のパートナーから構成される微生物群集は、多くの場合、複雑なプロセスを共同で効率的に実行し、単一種の場合よりも高い割合で所望の生成物を得ることができる[395]。このような混合群集における微生物パートナー間の相互作用は、微生物の複合性能およびバイオプロセス全体に大きな影響を与えることが予想される。
コンソーシアムの微生物メンバー間の共存的または相互依存的な相互作用は、バイオプロセスの製品成果を著しく高め、その産業応用と長期 安定性を保証することができる[395]。
微生物間の相互作用は、単純にプラスかマイナスか、有益か阻害かということだけでなく、多様なメカニズム、依存性、動的特性を含んでいる可能性がある。このような複雑な相互作用を研究するためには、微生物間および微生物と宿主の間の多次元的かつ動的な関係を解明することができる最先端の技術をさらに発展させる必要がある。
4. 結論
微生物は互いに、また通常多くの種を含む多細胞の宿主と密接に接触して生きている。また、微生物は環境の変動にさらされ、それが相互作用に影響を与える。このように、微生物間の相互作用は非常に複雑であり、多くの機構や分子が関与している[5]。
微生物間相互作用の研究は、微生物学、植物学、動物学、生態学において重要な発見をもたらした。また、微生物間相互作用の研究は、臨床、産業、バイオテクノロジーへの応用、例えば、QS干渉化合物などの天然物を用いた抗菌薬開発などの発見を可能にした。さらに、無菌の多細胞生物は自然界には存在しないことがわかり、ホロビオン・メタオーガニズムという概念が生まれ、生命科学のパラダイムシフトが起こった。
現在では、多細胞生物を理解するためには、それに付随する微生物を考慮する必要があるが、動物や植物の知識がなくても、微生物を研究することは可能であると考えられている。微生物が使う分子機構や言語、微生物の相互作用、特に宿主との相互作用に関わる分子やシグナルについては、まだまだ理解すべきことがたくさんある。
より深く理解し、微生物の相互作用をより分子的に詳細に特徴づけるためには、in vitroやin vivoのモデルを含むツールや手法の開発・改良が急務となっている。自然界で刻々と変化する環境の中で、複雑な微生物間相互作用を解明することは、おそらく最も困難な取り組みであろう。
謝辞
この研究は、キール大学、特に一般微生物学研究所のR. A. Schmitz-Streitによって推進された。
資金提供
本研究は、VOLKSWAGENSTIFTUNG(助成金番号95546)の助成を受けた。
利益相反
著者は利益相反を宣言していない。