Contents
Fatigue and Cognitive Impairment in Post-COVID-19 Syndrome: A Systematic Review and Meta-Analysis
ハイライト
- 疲労と認知機能障害は、COVID-19後症候群の最も一般的で衰弱した症状の一つである。
- COVID-19の診断後、約3人に1人が12週間以上の疲労を経験している。
- COVID-19 の診断後 12 週間以上経過した時点で、約 5 人に 1 人が認知機能障害を示した。
- 叙述的統合により、一部の個人において炎症性マーカーの上昇とかなりの機能障害があることが明らかになった。
概要
重要性
COVID-19は、急性感染症が治癒したにもかかわらず、臨床的に重要な症状を伴う(すなわち、COVID-19後症候群)。COVID-19後症候群の最も一般的で衰弱した症状は、疲労と認知機能障害である。
目的
COVID-19と診断されてから12週間以上経過した時点で、疲労と認知障害を経験している人の割合を定量化し、COVID-19後症候群の炎症的相関関係と機能的影響を明らかにすること。
データソース
PubMed/MEDLINE,The Cochrane Library,PsycInfo,Embase,Web of Science,Google/Google Scholar,および選択した参考文献リストについて,データベースの開始から 2021年6月8日まで,言語制限なしに系統的な検索を行った。
研究の選択
COVID-19の診断が確定してから12週間以上経過した人を対象とした一次研究論文で、疲労、認知障害、炎症パラメータ、および/または機能的アウトカムについて具体的に報告しているものを選択した。
データの抽出と合成
2人の査読者が独立して発表された要約データを抽出し、方法論的品質とバイアスのリスクを評価した。ランダム効果制限付き最尤モデルを用いて、Freeman-Turkey二重アークサイン変換した比率をプールする比率のメタ分析を行った。
主要評価項目と測定法
共同主要アウトカムは、COVID-19感染後12週以上経過した時点で、疲労および認知障害を報告した人の割合であった。副次的な成果は、COVID-19感染後の症候群の炎症相関性と機能的影響であった。
結果
文献検索の結果、10,979件の研究が見つかり、81件の研究が対象となった。疲労のメタアナリシスは68件、認知機能障害のメタアナリシスは43件、ナラティブシンセシスには48件の研究が含まれた。メタ解析の結果、COVID-19の診断から12週間以上経過した時点で疲労を感じている人の割合は0.32(95% CI, 0.27, 0.37; p < 0.001; n = 25,268; I2=99.1%)であった。また、認知機能障害を示す人の割合は0.22(95%CI,0.17,0.28,p<0.001,n=13,232,I2=98.0)であった。さらに、ナラティブシンセシスにより、一部の人に炎症マーカーの上昇とかなりの機能障害が見られた。
結論と関連性
COVID-19の急性症状が治まった後も、かなりの割合の人が持続的な疲労や認知機能障害を経験している。前述の症状の頻度と衰弱の性質から、根底にある神経生物学的基質の特徴を明らかにし、これらの現象を最善の方法で治療することが求められている。
キーワード
Long-COVIDポストCOVID-19症候群ポストCOVID-19状態ブレインフォグ認知機能障害疲労炎症機能的転帰集団の健康
1. はじめに
コロナウイルス感染症2019(COVID-19)の世界の確定症例数は 2021年12月時点で2億6,500万人を超えた1。しかし、実際の症例陽性率はもっと高いと推定されており、複数のモデルが実際の症例数を確定症例数の10倍(3~24倍)と予測している2-4。この見解に従うと、26億5,000万人以上がCOVID-19に感染した可能性があると予測される。
COVID-19に感染した人のうち、無症状の場合も含めて30%以上5,COVID-197で入院した患者の約80%がpost-COVIDの後遺症を経験している。疲労、認知障害、その他の永続的な神経精神医学的症状(例:うつ病)8や身体的症状(例:呼吸困難)は、「SARS-CoV-2の急性期後遺症」(すなわち、症状が4週間以上持続すること)を構成する。米国国立医療技術評価機構(NICE)は、「COVID-19感染後症候群」(PCS)を「COVID-19感染中または感染後に発症し、12週間以上持続し、代替診断では十分に説明できない一連の症状」と定義している11。過去にSARS-CoV-2に感染したことが確認されたか、またはその可能性が高い人において、通常、発症から3カ月後に発生し、少なくとも2カ月間持続する、代替診断では説明できない持続的な症状を「ポストCOVID-19症状」と定義している12。
PCSの研究は、オンラインの患者支援団体によって始められた。彼らは、持続する症状、正式な診断の欠如、効果的な確立された治療法の欠如の結果として、生活の質や日常生活の機能が大きく損なわれることを報告している13,14 。疲労と認知障害は、PCSの最も一般的で衰弱しやすい特徴の一つであることが一貫して報告されている15-17。慢性疲労18と認知機能障害19,20は、それぞれ世界的に大きな経済的負担となっている。呼吸困難や抑うつなどのPCSの他の一般的な症状とは異なり、ウイルス感染後の疲労や認知機能障害、さらには筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)などの関連疾患に対する確立された有効な治療法はない。世界的なCOVID-19感染の発生率と、潜在的な経済的負担および生活の質の低下は、PCS関連の疲労および認知障害を支える神経生物学的基質、関連因子および決定要因、ならびに安全で効果的な治療法を特定する原動力となっている。そこで我々は、COVID-19の診断から12週間以上経過した時点で、年齢、性別、臨床的サブグループを含めて、疲労と認知障害を呈している人の割合を明らかにすることを目的とした。また、PCSの炎症性相関と機能的影響を明らかにすることも目的とした。
2. 方法
2.1. データソースと検索
本システマティックレビューおよびメタアナリシスに関するプロトコルは、PROSPEROに登録されている(CRD42021256965)。本研究は,Meta-analysis of Observational Studies in Epidemiology(MOOSE)報告ガイドライン21に従った。2020 Preferred Reporting Items for Systematic Reviews and Meta-analyses(PRISMA)ガイドライン22に基づき,PubMed/MEDLINE,Cochrane Library,PsycInfo,EMBASE,Web of Scienceを対象に,データベースの開始から 2021年6月8日までシステマティックサーチを実施した。実施した検索文字列は “long covid” OR “persistent covid” OR “post covid” OR “post-acute sequelae of SARS-CoV-2 PASC” OR “enduring COVID-19 sequelae” OR “long-haul covid” OR “long-tail covid “とした。関連論文の参考文献やGoogle Scholar/Googleを手動で検索し、追加の研究を探した。言語や出版日の制限は設けなかった。
タイトルと要旨は,2名の審査担当者(FCとSL)がCovidenceプラットフォームを用いて独自に審査した23.23 少なくとも1名の査読者によって関連性があると判断された論文を検索し,重複を削除した。フルテキストの論文は2名の査読者(FCとSL)によって独立してスクリーニングされ,不一致は議論によって解決された。適格と思われる研究の著者に連絡し,必要に応じて説明や補足データの提供を求めた。
2.2. 研究の選択
COVID-19が確認された人を対象に、最初の診断から12週間以上経過した時点で、表1に定義されている任意の一次アウトカム(すなわち、疲労、認知障害)および/または二次アウトカム(すなわち、炎症マーカー、機能的アウトカム/生活の質)の発生率について報告している論文を求めた。当初は、PCSの疲労と認知機能障害のみを二次アウトカムとして決定する予定であった。しかし、上記に関するデータが少なかったため、その後、PCSのすべての症状に関する炎症の相関関係と機能的アウトカムを含めた。論文審査に先立ち、以下のような組み入れ基準を設定した。
- 年齢、性別、民族を問わず、過去にCOVID-19と診断されたことのある個人について、少なくとも1つの主要アウトカムに関する完全な要約推定値(すなわち、正確な比率)および/または少なくとも1つの副次的アウトカムに関する質的または量的データ(表1に定義)。
- COVID-19と診断されてから、中央値または平均値で少なくとも12週間(84日)のフォローアップ期間があり、NICEのポストCOVID-19症候群の定義に従って、感染後の時間の代用となること。指標日が入院・退院、急性疾患の治癒、または症状の発現であった場合、これらの事象は診断と同時またはその後に発生したものとした。
- COVID-19(重症度を問わず)は、臨床検査、診断コードの連結、および/または臨床診断により確認された。
- 一次研究。
- フルテキストの論文(プレプリントを含む)として発表されたもの。
表1.研究変数の定義
| 主な結果 | 客観的な確認 | 主観的確認 |
|---|---|---|
| 倦怠感(無力症) | 検証済みのツール(FACIT疲労感尺度、FSSなど)によって確認された倦怠感、またはCFS / EMの臨床診断。 | 倦怠感、倦怠感/低エネルギー、筋力低下/筋力低下(重症筋無力症)、倦怠感の自己申告または未検証の測定。 |
| 認識機能障害 | パフォーマンスベースの認知機能(MoCA、TICS、SCIPなど)の検証済みツール、または認知障害の臨床診断によって確認された認知障害。 | 認知障害/「脳霧」、精神遅滞、注意力、実行力、処理力、記憶力、学習力、明瞭度、および/または精神運動協調性の欠陥の自己報告または未検証の測定。 |
| 二次的な結果 | ||
| 炎症性パラメーター | 循環または細胞内サイトカイン、CRP、D-ダイマー、および/またはプロカルシトニンの異常なレベル。研究調査員によって設定されたしきい値に従って、または対照群または確立された基準と比較して。 | 該当なし |
| 機能的転帰/生活の質 | 生活の質または機能的結果(EQ-5D、mRSなど)の検証済みツールによって確認された機能障害(活動、職業、および社会的制限を含む)123。 | 機能障害(活動、職業的、社会的制限を含む)、および一般的な活力/生活の質の自己報告または未検証の評価。123 |
頭字語。FACIT:慢性疾患治療の機能評価、FSS:疲労重症度評価尺度、CFS/EM:慢性疲労症候群/筋痛性脳脊髄炎、MoCA:モントリオール認知機能評価、TICS: 認知状態に関する電話インタビュー、SCIP:精神科における認知機能障害のスクリーニング CRP:C反応性ペプチド、Dダイマー:ドメインダイマー、N/A:該当なし、EQ-5D:欧州生活の質5次元尺度、mRS:修正Rankin尺度。
除外基準は以下の通り。
- 定量的データが不完全または不正確なもの(例:主要アウトカムの正確な比率が示されていない)。
- アウトカムが曝露に先行している(すなわち、疲労、認知障害、炎症および/または機能障害がCOVID-19感染前から存在していた、および/または12週以上のフォローアップにおいてCOVID-19感染後に重症度が増加しなかったと記載されている)。
- 分析は、急性COVID-19の消失後に生じた新しい症状に限定されている(すなわち、診断以来持続していない)。
- 一般集団、またはCOVID-19の診断を受けたことのない人のみを対象とした結果
- COVID-19に感染または診断されてからのフォローアップ期間の中央値/平均値が12週間(84日)未満のもの。
- COVID-19 が実験室での検査や ICD-10 への連結によって検証されていない、あるいは臨床的に診断されていない。
- COVID-19 患者の死後調査。
- ケースシリーズ、またはCOVID-19後の症候群の症状(アウトカム)の有無に基づいて参加者が選択される研究デザイン。
- 未発表の研究、要旨、症例報告、サンプルサイズが10未満の研究、またはプロトコル。
- 非一次研究。
2.3. データ抽出
収録された論文の発表された要約データは,2人の審査員(FCとSL)が,試験的に作成したデータ抽出フォームを用いて独立して抽出し,その後,裏付けをとり,矛盾があれば議論して解決した。抽出すべき情報は事前に設定され、研究の特徴、参加者の特徴とサブグループ、サンプルサイズとソース、確認方法、フォローアップ期間、一次または二次アウトカムに関する正確な割合(サブグループ固有のデータを含む)二次アウトカムに関する質的データ、PCSとの関連が報告されている要因などが含まれる。
2.4. 品質評価
方法論的な質とバイアスのリスクは、Newcastle-Ottawa Scale(NOS)24を用いて評価した。NOSは、該当するコホート研究とケースコントロール研究用に修正され、クロスセクション研究にも適応された。デザインが不明瞭な研究は,前向きコホートのNOSに基づいて評価した。コホート研究は,非被爆者コホートを含まない場合にはペナルティを課した。すべての構成研究は,2人の審査員(FCとLMWL)が独立して評価し,結果を裏付け,矛盾があれば議論で解決した。各研究タイプの修正されたNOSと方法論的品質のランキングを示した()。
2.5. データの統合と分析
R version 4.1.0 (R Foundation for Statistical Computing)を用いて,比率のメタ分析を行った。統計的有意性を示すために,αレベルは0.05とした。顕著な異質性を想定し、meta::metaprop 関数25 を用いて、ランダム効果制限付き最尤モデル(REML)により、疲労または認知障害を示す症例数(イベント)をサンプルの大きさ(オブザベーション)で割った比率をプールした26,27。データの重複や真の効果の大きさの偏りを防ぐため、最大の割合のみを対象とした。複数の追跡期間のデータが提供された研究では、最も早い追跡期間を主な分析に用いた。個々の研究では Clopper-Pearson 95%信頼区間(CI)を算出し、プールされた比率では Wald 95%CIを算出した。meta::forest 関数を用いて,各主要アウトカムのフォレストプロットを作成した。性別、COVID-19による入院状況、年齢層(小児と成人、それぞれ中央値/平均値が18歳未満と18歳以上と定義)追跡期間(6か月未満と6か月以上)確認方法(客観的と主観的)について、事前に設定したランダム効果サブグループ解析を、byvar引数を用いて実施し、各サブグループの研究間分散を別々に推定した。研究集団は、COVID-19で入院したことのある参加者が全体の80%以上であれば、入院したことのある集団であると分類した(外来患者の場合はその逆)。NOSの品質評価と研究デザインによる事後的な感度分析を行った。グループ間の効果の大きさの統計的に有意な差は、Wald型χ2検定により算出した。
異質性は、GRADE(Grading of Recommendations, Assessment, Development and Evaluations)基準およびCochrane Handbookの異質性スコアの解釈で推奨されているように、カットオフ値30.0%、50.0%、75.0%がそれぞれ中程度、相当、かなりの異質性を示すI2統計量を用いて定量化した28,29。出版バイアスの評価には,Egger回帰切片検定,Begg and Mazumdar順位相関検定,およびファネルプロットの非対称性の目視検査を,それぞれ meta::metabias および meta::funnel 関数を用いて行った。メタ分析を行うには十分な均質性が得られない副次的アウトカムについては、ナラティブシンセシスによる質的分析を行った。
3. 結果
3.1. 検索結果
文献検索の結果、10,979件の研究が得られた。重複を排除した後、5965件の研究をタイトルと要旨でスクリーニングし、229件の適格な研究を抽出した。さらに、148件の研究がフルテキストのスクリーニングにより除外された。研究選択の詳細は,図1に示した。合計で81件の研究がレビューに含まれた。56件の前向きコホート研究、14件のクロスセクション研究、9件のレトロスペクティブコホート研究、1件のレトロスペクティブケースコントロール研究である。すべての研究はでデザインごとに分類されている。COVID-19曝露の疲労への影響を主に評価した定量的統合(すなわち、疲労メタ分析)には68件の研究が含まれ、COVID-19曝露の認知への影響を主に評価した定量的統合(すなわち、認知障害メタ分析)には43件の研究が含まれた。また、定量分析から除外された7件を含む48件の研究が、ナラティブ・シンセシスによって質的に分析された。
3.2. 研究の特徴
イタリアから10件、スペインから9件、米国から8件、中国から7件、英国から6件、デンマーク、フランス、ノルウェーからそれぞれ3件、オーストラリア、オーストリア、ブラジル、カナダ、エジプト、ドイツ、イスラエル、ロシア、オランダからそれぞれ2件、ベルギー、チェコ、イギリス、フェロー諸島、イラン、日本、メキシコ、パキスタン、シンガポール、スウェーデン、スイス、トルコからそれぞれ1件のデータが解析された。サンプルサイズは23~2649で、追跡期間の中央値または平均値は2.8~11.2カ月であった。COVID-19の確認方法については、6人の研究者が確認を行い、1人の研究者43,44が、2つの研究の間にサンプルの重複がないことを確認し、重複の可能性があるという理由で3つ目の研究を除外するよう助言した。表2に、全81件の構成研究の詳細な特徴と該当する知見の概要を示す。
表2 COVID-19が確認された人を対象とした研究(n=81)の特徴と結果 診断後12週間以上経過した人
| 勉強 | 国 | 研究デザイン | サンプルソース | サンプル特性 | フォローアップ期間 | COVID-19の確認 | 結果の確認 | 結果 | 持続的な症状に関連する要因 |
|---|---|---|---|---|---|---|---|---|---|
| Abdallah et al。、 2021 124 | カナダ | 前向きコホート | オタワ病院 | N = 63(以前に入院した25例と以前に入院していない38例を含む)
*入院コホートに関係する**入院していないコホートに関係する |
入院患者の最初の陽性検査後の平均119.9±16。2日、入院していない患者の平均129±16。5日 | RT-PCR | 臨床フォローアップによる主観的自己報告 |
|
|
| Amin-Chowdhury et al。、 2021 a、79 | イングランド | 前向きコホート | 英国公衆衛生(ESCAPE研究) | N = 140(臨床および非臨床医療従事者)
|
COVID-19診断後の中央値7.5(7.1-7.8)か月 | 血清学およびRT-PCR | オンラインアンケートによる主観的な自己報告 |
|
|
| アーノルド他、 2020 45 | イギリス | 前向きコホート | 迅速なトリアージ(DISCOVER)研究を可能にするCOVID-19の診断および重症度マーカー(ブリストル) | N = 110(以前に入院したすべての症例)
*軽度の場合**中程度の場合***重度の場合 |
症状発現後の中央値90(80-97)日 | RT-PCRまたは臨床放射線診断 | 臨床検査(炎症パラメーター)、SF-36(生活の質)による客観的評価、および質問票による主観的自己報告 |
|
|
| オーガスティン他、 2021 80 | ドイツ | 前向きコホート | ケルン大学病院(公共メディアを通じて募集) | N=353
*すべてがフォローアップされなかった958人のCOVID-19回復期の個人の最初のコホートに関係します |
症状発現後の中央値6.8(6-8)か月 | RT-PCR | 体系的な質問票と医師による評価による主観的な自己報告 |
|
|
| Breton et al。、 2021 30 | 使用する | 後ろ向きコホート | グレーターニューヨークシティトライステートリージョンの住民 | N = 41例(以前に入院した8例を含む)
|
COVID-19感染後の平均6.1か月 | RT-PCR | 臨床検査による客観的評価(フローサイトメトリー;細胞内サイトカイン染色) |
|
|
| Common Sense et al。、 2021 125 | イタリア | 断面 | Agostino Gemelli University Hospital Foundation(ISARICの一部) | N = 68人の子供(以前に入院した6人と小児ICUの3人を含む)
|
診断後の平均162.5±113。7日 | RT-PCR | 電話インタビューまたは外来患者評価による主観的自己報告 |
|
|
| Cirulli et al。、 2020 a、81 | 使用する | 前向きコホート | Helix DNA DiscoveryProjectとHealthyNevadaProject | N = 357(以前に入院した9例を含む)
* COVID-19陽性と陰性の両方を含むコホート全体に関係します |
症状発現から90日後 | 実験室試験 | オンラインアンケートによる主観的な自己報告 |
|
|
| ダーリー他、 2021 a、82 | オーストラリア | 前向きコホート | セントビンセント病院シドニー(ADAPT研究) | N=99
|
感染後の中央値240(227-256)日 | RT-PCR | SPHERE-34による客観的評価(倦怠感、認知機能) |
|
|
| Elkan et al。、 2021 a、56 | イスラエル | 後ろ向き症例対照 | シャミール(アサフハロフェ)医療センター | N = 66(以前に入院したすべての症例)
|
退院後の中央値9(6-9)か月 | RT-PCR | RAND-36(生活の質)による客観的評価、および主観的な自己報告 |
|
|
| Evans et al。、 2021 a、49 | イギリス | 前向きコホート | 53の国民保健サービス病院(PHOSP-COVID研究) | N = 1077(以前に入院したすべての症例)
|
退院後の中央値159(120-189)日 | RT-PCRまたは臨床医が診断 | FACIT(倦怠感)、MoCA(認知機能)、EQ-5D-5L、WG-SS(生活の質と機能)、臨床検査(血清学)による客観的評価、および研究訪問と臨床フォローアップによる主観的自己報告アンケート |
|
|
| Evlice et al。、 2021 95 | 七面鳥 | 後ろ向きコホート | トルコの病院 | N = 266(ICUの11例を含む、以前に入院したすべての症例)
|
退院後の平均99.80±26。16日 | RT-PCRまたはCT | 電話調査による主観的な自己報告 |
|
|
| Fernández-de-Las-Peñas(1)etal。、2021 43 | スペイン | 後ろ向きコホート | マドリードの4つの公立病院 | N = 1142(以前に入院したすべての症例)
|
退院後の平均7.0±0.6ヶ月 | RT-PCR | 訓練を受けた研究者による体系的な電話インタビューによる主観的な自己報告 |
|
|
| Fernández-de-Las-Peñas(2)et al。、 2021 44 | スペイン | 後ろ向きコホート | マドリードの3つの公立病院 | N = 1950(ICUの129を含む、以前に入院したすべての症例)
|
退院後の平均11.2±0.5か月 | RT-PCRおよび放射線所見 | 訓練を受けた医療専門家による体系的な電話インタビューによる自己報告 |
|
|
| Ferrucci et al。、 2021 83 | イタリア | 前向きコホート | ASSTサンティパオロエカルロ病院の非集中的なCOVIDユニット | N = 38(非集中病棟で以前に入院したすべての症例)
|
退院後の平均4.43±1.22ヶ月 | RT-PCR | MoCA(認知機能)、BRB-NT(認知テストの神経学的バッテリー)、SSD(倦怠感)を介して客観的に評価されます |
|
|
| Fortini et al。、 2021 46 | イタリア | 前向きコホート | サンジョバンニディディオ病院 | N = 59(非集中病棟で以前に入院したすべての症例)
|
退院後の中央値123(116-145)日 | RT-PCR | 臨床検査による客観的評価(炎症パラメーター)、および自己記入式質問票による主観的自己報告 |
|
|
| Froidure et al。、 2021 126 | ベルギー | 前向きコホート | ベルギーの病院 | N = 126人の患者(以前に入院したすべての患者および/またはICUの症例)
|
感染後の中央値95(86-107)日 | RT-PCRおよび肺HRTCまたは胸部X線 | 臨床評価による主観的自己報告 |
|
|
| フロンテラ他、 2021 57 | 使用する | 前向きコホート | ニューヨーク地域の4つの病院 | N = 382(196の神経学的症例を含むすべての以前に入院した症例、そのうち67はICUに入院し、入院中に神経障害のない186の症例、そのうち54はICUに入院した)
*神経学的COVID-19コホート**非神経学的COVID-19コホート |
症状発現後の中央値6.7(6.5-6.8)か月 | RT-PCR | MoCA(認知機能)、バーセル指数(機能障害)による客観的評価、および電話アンケートによる主観的自己報告 |
|
|
| García-Abellánetal 。、 2021 a、 47 | スペイン | 前向きコホート | エルチェ総合大学病院 | N = 116(以前にICUに入院した15例を含む、以前に入院したすべての症例)
* 6か月のフォローアップで症状を報告している患者に関係します |
退院後6ヶ月 | RT-PCRと血清学 | 臨床検査(免疫学的パラメーター)による客観的評価、および臨床訪問中のCSQ(倦怠感)による主観的自己報告 |
|
|
| Garrigues et al。、 2020 58 | フランス | 後ろ向きコホート | ボージョン病院、COVID-19ユニット | N = 120(機械的人工呼吸を受けたICUの24例を含む、以前に入院したすべての症例)
|
入院後の平均110。9日±11.1 | RT-PCRおよび/または胸部CT | EQ-5D-5L(生活の質)による客観的評価、および訓練を受けた医師による電話アンケートによる主観的自己報告 |
|
|
| Ghosn et al。、 2021 37 | フランス | 前向きコホート | 国立衛生医学研究所 | N = 1137(ICUの288を含む、以前に入院したすべての症例)
|
入院後3ヶ月および6ヶ月(中央値194 [188-205]日) | RT-PCR | 医師の診察による主観的な自己報告 |
|
|
| ゴンザレス他、 2021 42 | スペイン | 前向きコホート | アルナウデビラノバ大学病院 | N = 62(以前のすべてのICU症例)
|
退院後3ヶ月 | RT-PCR | SF-12(生活の質)による客観的評価、および主観的な自己報告 |
|
|
| González-Hermosilloetal 。、 2021 91 | メキシコ | 前向きコホート | 国立心臓病研究所イグナシオチャベス | N = 130(以前に入院したすべての症例)
|
退院後3ヶ月および6ヶ月(平均270±32日) | RT-PCR | ME / CFS国際コンセンサス基準に基づく電話アンケートによる主観的自己報告 |
|
|
| Havervall et al。、 2021 59 | スウェーデン | 前向きコホート | ダンデリード病院 | N = 1395人の医療専門家(軽度の症例、入院状況は特定されていません)
|
症状発現から8ヶ月 | 血清学 | Sheehan Disability Scale(機能的結果)による客観的評価、およびスマートフォンアプリアンケートによる主観的自己報告 |
|
|
| Huang et al。、 2021 7 | 中国 | 両方向コホート | 金銀燕病院 | N = 1733人の患者(以前にICUに入院した76人を含むすべての以前に入院した症例)
|
症状発現後の中央値186(175-199)日 | 実験室試験 | EQ-5D-3L(生活の質)による客観的評価、およびアンケートによる主観的自己報告 |
|
|
| Jacobson et al。、 2021 60 | 使用する | 前向きコホート | スタンフォード大学に登録された臨床試験の患者 | N = 118人の参加者(以前に入院した22例を含み、そのうち11例は以前にICUに入院した)
|
診断後の平均119.3±33。0日 | RT-PCR | WPAI(機能的成果)による客観的評価、および質問票による主観的自己報告 |
|
|
| Johnsen et al。、 2021 61 | デンマーク | 断面 | ビスペビアウのコペンハーゲン大学病院 | N = 57(以前に入院した34例と入院していない34例)
|
急性疾患の退院/解消後3ヶ月 | RT-PCR | WPAI、PCFS(機能的成果)、EQ-5D-5L(生活の質)、およびCFQ、SCIP-D、およびTMT-B(認知機能)による客観的評価 |
|
|
| Kashif et al。、 2021 a、84 | パキスタン | 前向きコホート | ハメドラティフ病院 | N = 242(入院した症例と病院で医療を求めた入院していない症例を含む)
|
分泌物または症状の発現から3か月 | RT-PCR | 電話インタビューによる主観的な自己報告 |
|
|
| Klein et al。、 2021 127 | イスラエル | 後ろ向きコホート | ソーシャルメディアと口コミを通じて募集されたイスラエルの住民 | N = 103(すべての軽度の症候性症例;無症候性を除外、入院状態は特定されていない)
|
症状発現から6ヶ月 | RT-PCR | 電話アンケートによる主観的な自己報告 |
|
|
| Latronico et al。、 2021 a、62 | イタリア | 前向きコホート | Spedali Civili UniversityHospitalの3つのICU | N = 55(以前にARDSでICUに入院したすべての症例)
* ICUに入院した163人のより大きなコホートに関係しますが、すべてがフォローアップされたわけではありません |
退院後3ヶ月と6ヶ月 | RT-PCR | FSS(倦怠感)、PICS、MoCA(認知機能)、SF-36(生活の質)、バーセル指数(機能的結果)による客観的評価 |
|
|
| Leth et al。、 2021 128 | デンマーク | 前向きコホート | オーフス大学病院感染症科 | N = 49(以前にICUに入院した6例を含む、以前に入院したすべての症例)
|
退院後の中央値128(98-148)日 | RT-PCR | OMC(認知機能)による客観的評価、および直接または電話による質問による主観的な自己報告 |
|
|
| Liang et al。、 2020 129 | 中国 | 前向きコホート | 武漢ユニオン病院 | N = 76(65人の医療従事者の症例を含むすべての以前の入院、および以前にICUに入院した7人)
|
退院後3ヶ月 | RT-PCR | アンケートによる主観的な自己報告 |
|
|
| Liyanage-Don et al。、 2021 40 | 使用する | 前向きコホート | 2つのコロンビア大学病院 | N = 153(以前に入院したすべての症例)
|
退院後の中央値3.7(2.6-5.7)か月 | RT-PCR | オンラインまたは電話による質問票による主観的な自己報告 |
|
|
| Logue et al。、 2021 63 | 使用する | 前向きコホート | ワシントン大学 | N = 177(以前に外来患者145例、以前に入院した16例)
|
急性COVID-19の発症後169日中央値(範囲31-300) | RT-PCR | 電子アンケートによる主観的な自己報告 |
|
|
| Mattioli et al。、 2021 130 | イタリア | 前向きコホート | ブレシア総合大学病院産業保健ユニット | N = 150(120人の医療従事者の症例、うち2人は入院を必要とする以前の呼吸不全)および30人の医療従事者の健康管理)
*ケースに関連します |
最初のCOVID-19診断から4か月 | RT-PCR | MMSE(認知機能)による客観的評価、および臨床診断評価(質問票を含む)による主観的自己報告 |
|
|
| Mazza et al。、 2021 131 | イタリア | 前向きコホート | IRCCSサンラッファエーレ病院 | N = 226(177の入院症例と49の在宅治療症例を含む)
|
退院後の平均90.1±13。4日 | RT-PCR | BACS(認知機能)による客観的評価、およびアンケートによる主観的自己報告 |
|
|
| Mei et al。、 2021 94 | 中国 | 前向きコホート | 武漢第一病院、武昌病院、中商病院、湖北省病院 | N = 3,677(以前に入院したすべての症例)
|
退院後の中央値144(135–157)日 | RT-PCR | 臨床フォローアップ中の主観的な自己報告 |
|
|
| Menges et al。、 2021 a、64 | スイス | 断面 | チューリッヒの一般集団(チューリッヒSARS-CoV-2コホート研究) | N = 431(以前に入院した81例を含み、そのうち10例はICUにあり、350例は入院していない)
|
診断後の中央値220(181-232)日 | RT-PCR | FAS(倦怠感)、EQ-5D-5L(生活の質)による客観的評価、およびREDcapを介して実施されたオンライン調査による主観的自己報告 |
|
|
| Miskowiak et al。、 2021 65 | デンマーク | 前向きコホート | ビスペビアウ病院(IMPACT-COVID研究) | N = 129(29の以前に入院した症例、および100の一致した健康な対照)
|
退院後3〜4ヶ月 | RT-PCRと血清学 | SCIP-D、TMT-B、CFQ(認知機能)、EQ-5D-5L(生活の質)による客観的評価、およびアンケートによる主観的自己報告 |
|
|
| Miyazato et al., 202141 | Japan | 断面 | 疾病管理予防センターおよび国立国際医療研究センター | N = 63(以前に入院したすべての症例)
|
症状発現後の平均129±21日 | RT-PCR | 調査員が実施した構造化された電話インタビューによる主観的な自己報告 |
|
|
| Morin et al。、 2021 132 | フランス | 前向きコホート | ビセートル病院(パリサクレ大学病院) | N = 478(以前にICUに入院した142例を含む、以前に入院したすべての症例)
|
退院後の中央値113(94-128)日 | RT-PCRおよび/またはCTスキャン | Q3PC、MoCA、d-2R(認知機能)、診療所/外来評価中のMFI(倦怠感)による客観的評価、および電話アンケートによる主観的自己報告 |
|
|
| Munblit et al。、 2021 a、66 | ロシア | 前向きコホート | セチェノフ大学病院ネットワーク | N = 2649(以前に入院したすべての症例)
|
退院後の中央値217。5(200.4-235.5)日 | RT-PCRまたは臨床的に診断された | EQ-5D-5L(生活の質)による客観的評価、および医学生が使用する電話インタビューによる主観的自己報告 |
|
|
| O’Keefe et al。、 2021 a、 85 | 使用する | 断面 | エモリーヘルスケアの仮想外来管理クリニック(VOMC) | N = 198人の参加者がCOVID-19の外来遠隔医療プログラムから退院しました(以前に入院した35例を含む)
|
診断後の中央値119(範囲26-220)日 | RT-PCR | 電子メール調査による主観的な自己報告 |
|
|
| Ong et al。、 2021 48 | シンガポール | 前向きコホート | シンガポールの4つの公立病院 |
|
退院後の中央値181(103-191)日 | RT-PCR | イムノアッセイ(炎症パラメーター)および主観的自己報告によって評価された客観的 |
|
|
| Orrùetal 。、 2021 67 | イタリア | 断面 | イタリアに住む個人(ウェブを通じて募集) | N = 152(入院状況は特定されていません)
* 507のより大きなデータセットに関連しますが、すべてが私たちの選択基準に準拠しているわけではありません |
陽性試験後少なくとも3か月 | RT-PCR | EQ-5D-3L(生活の質)による客観的評価、およびオンライン調査による主観的自己報告 |
|
|
| Osmanov et al。、 2021 a、68 | ロシア | 前向きコホート | ZABashlyaeva小児市立臨床病院 | N = 518人の子供(以前に入院したすべての症例)
|
退院後の中央値256(223-271)日 | RT-PCR | 医学生による電話調査による主観的自己申告 |
|
|
| Peghin et al。、 2021 86 | イタリア | 前向きコホート | ウディネ病院 | N = 599(442人の外来患者、157人が以前に入院し、そのうち23人がICUに入院)
|
急性COVID-19の発症後中央値191(172-204)日 | 核酸増幅検査および/または臨床診断 | 訓練を受けた看護師が実施する電話アンケートによる主観的な自己報告 |
|
|
| ペレイラ他、 2021 69 | イギリス | 前向きコホート | ロンドン北西部の病院 | N = 38人の病院スタッフ(35人の症候性および3人の無症候性の症例、すべて入院を必要としない)
|
症状発現後7〜8ヶ月 | RT-PCR | NICEガイドラインに基づくアンケートによる主観的な自己報告 |
|
|
| Petersen et al。、 2021 92 | フェロー諸島 | 前向きコホート | フェロー人病院システム | N = 180(すべての外来患者の場合)
|
症状発現後平均125±17日 | RT-PCR | 倦怠感(倦怠感)による客観的評価 |
|
|
| Pilotto et al。、 2021 a、39 | イタリア | 前向きコホート | SpedaliCiviliブレシア病院 | N = 165(以前に入院したすべての非神経学的症例)
|
入院6ヶ月 | RT-PCR | MoCA(認知機能)による客観的評価、および臨床フォローアップチェックリストによる主観的自己報告 |
|
|
| Qu et al。、 2021 70 | 中国 | 前向きコホート | 安徽省と湖北省の6つの病院 | N = 540(以前に入院したすべての症例)
|
退院後3ヶ月 | RT-PCR | SF-36(生活の質)による客観的評価、および電子調査フォームによる主観的自己報告 |
|
|
| Rass et al。、 2021 71 | オーストリア | 前向きコホート | インスブルック医学大学、ザムス、ミュンスター内科II | N = 135(以前にICUに入院した31例、以前に病棟に入院した72例、以前に軽度の外来治療を受けた32例)
|
症状発現後の中央値102(91-110)日 | RT-PCR | MoCA(認知機能)、SF-36-v2(生活の質)、GOSEおよびmRS(機能的転帰)による客観的評価、および臨床フォローアップによる主観的自己報告 |
|
|
| Rauch et al。、 2021 a、96 | ドイツ | 前向きコホート | Life&Covidオンラインコホート研究(ルートヴィヒマクシミリアン大学) | N = 127(116人の外来患者と11人の入院患者を含む)
|
感染後6ヶ月 | RT-PCRまたは血清学 | 電子メール調査による主観的な自己報告 |
|
|
| Romero-Duarte et al。、 2021 133 | スペイン | 後ろ向きコホート | スペインの4つの病院 | N = 797(以前にICUに入院した81例を含む、以前に入院したすべての症例)
|
退院後6ヶ月 | RT-PCR | アンケートによる主観的な自己報告 |
|
|
| Savarraj et al。、 2021 a、72 | 使用する | 前向きコホート | テキサス大学健康科学センター | N = 48(以前に入院したすべての症例)
|
退院後3ヶ月 | RT-PCR | mRS(機能的結果)、BNST(認知機能)、FSS(倦怠感)による客観的評価 |
|
|
| Say et al。、 2021 38 | オーストラリア | 前向きコホート | ロイヤルチルドレンズホスピタル | N = 151人の子供(54人の無症候性、91人のほとんど軽度の症候性症例、および14人の以前に入院した症例を含む)
|
診断後3-6ヶ月 | RT-PCR | フォローアップクリニックのプロフォーマによる主観的な自己報告 |
|
|
| Shang et al。、 2021 87 | 中国 | 前向きコホート | 武漢大学中南病院、武漢第7病院、雷神山医院 | N = 796(ICUの38例を含む、以前に入院したすべての症例)
|
退院後6ヶ月 | RT-PCR | 電話インタビューによる主観的な自己報告 |
|
|
| Shendy et al。、 2021 134 | エジプト | 前向きコホート | 保健人口省 | N = 81(以前に入院した11例、入院していない70例)
|
COVID-19からの回復後3-5ヶ月 | RT-PCR | MFISによる客観的評価(倦怠感) |
|
|
| Shuwa et al., 202131 | イギリス | 前向きコホート | マンチェスターの4つの病院に基づくコロナウイルス免疫応答と臨床転帰(CIRCO)研究 | N = 83(以前に入院したすべての症例)
|
入院後の中央値158(116.5-184.5)日 | RT-PCRまたは臨床診断 | 細胞培養およびフローサイトメトリーによる客観的評価(免疫パラメーター) |
|
|
| Simani et al。、 2021 88 | イラン | 前向きコホート | テヘランの大学付属病院 | N = 120(ICUの9人を含む、以前に入院したすべて)
|
COVID-19感染から6か月 | RT-PCRまたはCT | CFS / EM(疲労)に関する福田ガイドラインに基づく以前に検証された質問票による客観的評価 |
|
|
| Skala et al。、 2021 50 | チェコ共和国 | 前向きコホート | フラデツクラーロヴェー地区 | N = 102(以前に入院した15例と外来87例を含む)
|
COVID-19診断から3か月 | RT-PCR | 臨床検査による客観的評価(炎症パラメーター)、および医師が実施する質問票による主観的自己報告 |
|
|
| Soldati et al。、 2021 73 | ブラジル | 前向きコホート | ICUユニット、ニテロイ病院コンプレックス | N = 23(すべて以前にICUに入院)
|
退院後の中央値83(37-115)日 | RT-PCR | TICS(認知機能)、EuroQol(生活の質)による客観的評価 |
|
|
| Sonnweber et al。、 2021 32 | オーストリア | 前向きコホート | インスブルック医科大学内科II、およびザムスとミュンスターにある2つの追加医療センター(CovILD研究) | N = 134(以前に入院した109人を含み、そのうち29人は以前にICUに入院した)
|
診断後平均103±21日 | RT-PCR | 臨床検査による客観的評価(血清学) |
|
|
| Soraas et al。、 2021 a、74 | ノルウェー | 前向きコホート | ノルウェーでオンラインで実施 | N = 588(以前は入院していないすべての症例)
|
ベースラインから平均248±18日(テストからベースラインまでの平均15.9±9日) | RT-PCR | RAND-36(生活の質)による客観的評価、およびオンラインアンケートによる主観的自己報告 |
|
|
| Stavem et al。、 2021 89 | ノルウェー | 断面 | アーケシュフース大学病院(アフス)とエーストフォール病院 | N = 458(入院していないすべての症例)
|
最初のCOVID-19症状から117.5(105-135)日後の中央値 | RT-PCR | ウェブまたは郵便で管理されるCFQ-11およびRAND-36(疲労)による客観的評価 |
|
|
| Suárez-Roblesetal 。、 2020 135 | スペイン | 断面 | サンカルロス臨床病院 | N = 134(以前にICUに入院した2人を含むすべて以前に入院)
|
退院後90日 | RT-PCR | 電話構造化面接による主観的自己報告 |
|
|
| サイクス、ら。、 2021、51 | 英国 | 前向きコホート | ハル大学教育病院NHSトラスト | N = 134(以前にICUに入院した27人を含むすべて以前に入院)
|
退院後の中央値113(範囲46-167)日 | RT-PCR | EQ-5D-5L(生活の質)による客観的評価、および専門看護師および/または理学療法士による標準化された臨床評価による主観的自己報告 |
|
|
| タボアダ(1)et al。、 2020 76 | スペイン | 前向きコホート | スペイン北西部にある7つの病院 | N = 91(以前にICUに入院したすべての症例)
|
ICU治療後6か月 | RT-PCR | EQ-5D-3L(生活の質)とPCFS(機能的成果)を介して客観的に評価され、訓練を受けた研究コーディネーターが実施する構造化面接を介して主観的な自己報告を行います |
|
|
| タボアダ(2)et al。、 2021 33 | スペイン | 断面 | サンティアゴ大学病院 | N = 183(ICUへの32を含む、以前に入院したすべての症例)
*フォローアップに含まれていない人を含む、インデックスで病院に入院したすべての人に関係します |
入院6ヶ月 | RT-PCR | PCFS(機能状態)による客観的評価、および訓練を受けた研究調査員による調査による主観的な自己報告 |
|
|
| Tawfik et al。、 2021 93 | エジプト | 後ろ向きコホート | アインシャムス大学と保健人口省の病院 | N = 120人の医療従事者(以前に入院した18人を含む)
|
COVID-19感染から3か月 | RT-PCRおよびCT | アンケートによる主観的な自己報告 |
|
|
| Todt et al。、 2021 34 | ブラジル | 前向きコホート | 病院市立博士MoysesDeutsch | N = 251人の患者(ICUの42人を含むすべて以前に入院)
|
退院後3ヶ月 | RT-PCR | EQ-5D-3L(生活の質)による客観的評価 |
|
|
| Valiente-De Santis et al。、 2020 a、52 | スペイン | 前向きコホート | マラガ地域大学病院外来 | N = 108(すべての外来患者; 30人の医療従事者を含む症候性および無症候性の両方)
|
急性COVID-19から12週間 | 血清学 | 電話調査による主観的な自己報告 |
|
|
| van den Borst et al。、 2020 53 | オランダ | 前向きコホート | ラドバウド大学医療センター(POSTCOVER研究) | N = 124(以前に入院したすべての症例)
|
症状発現後の平均13.0±2.2週間 | RT-PCRまたは臨床的に診断された | 臨床検査(血清学的パラメーター)、TICS、CFQ(認知機能)、SF-36およびNCSI(生活の質、倦怠感)による客観的評価 |
|
|
| Van Veenendaal et al。、 2021 a、77 | オランダ | 前向きコホート | フローニンゲン大学医療センター、ICU(COFICS) | N = 60(以前にICUに入院したすべての症例)[6か月で50]
|
ICU退室後6か月 | RT-PCR | SF-20(生活の質)、FAD-GF6 +(社会的機能)による客観的評価、および研究看護師による電話アンケート(3か月)および郵送アンケート(6か月)による主観的自己報告。 |
|
|
| Venturelli etal。、2021 54 | イタリア | 前向きコホート | パパジョバンニXXIII病院 | N = 767(ICUの66例を含む、以前に入院したすべての症例)
|
症状発現後の中央値105(84–127)日 | RT-PCRまたは血清学 | 臨床検査(血清学)、MoCA(認知機能)、バーセル指数(機能障害)、および簡単な倦怠感目録(倦怠感)による客観的評価、および質問票による主観的自己報告 |
|
|
| Walle-Hansen et al。、 2021 75 | ノルウェー | 後ろ向きコホート | ノルウェー南東部の4つの総合病院 | N = 106(ICUの28例を含む、以前に入院したすべての症例)
|
入院6ヶ月 | RT-PCR | MoCA(認知機能)およびEQ 5D-5L(生活の質)による客観的評価 |
|
|
| Wong et al。、 2020 35 | カナダ | 前向きコホート | バンクーバーのCOVID-19後の呼吸器クリニック | N = 78(以前に入院したすべての症例)
|
症状発現後の中央値13(11-14)週間 | 実験室試験 | EQ-5D-5Lによる客観的評価(生活の質) |
|
|
| Woo et al。、 2020 97 | イギリス | 断面 | ハンブルク大学医療センター-エッペンドルフ | N = 28(以前に入院した11例、以前に外来患者6例、医療を受けていない1例、および10人の健康な対照)
|
回復後の中央値85(範囲20〜105)日 | RT-PCR | TICS-M(認知機能)による客観的評価、およびアンケートによる主観的自己報告 |
|
|
| Xionget 。al。、 2020 90 | 中国 | 前向きコホート | 武漢大学人民病院 | N = 722(以前に入院した538例、および184人の健康な対照)
|
退院後の中央値97(95-102)日 | WHO暫定ガイダンスによるCOVID-19診断 | 3人の経験豊富な臨床医による電話調査による主観的な自己報告 |
|
|
| Zhao et al。、 2020 136 | 中国 | 後ろ向きコホート | 河南省の3つの三次病院 | N = 55(以前に入院したすべての症例)
|
退院後3ヶ月 | RT-PCR | 臨床フォローアップによる自己報告 |
|
|
3.3. 方法論的品質とバイアスのリスク
構成研究のNOS評価は中程度であり、前向き/双方向コホート研究の平均スコアは9点満点中6.0点、レトロスペクティブコホート研究の平均スコアは6点満点中4.0点、クロスセクション研究の平均スコアは9点満点中5.6点であったことが明らかになった。一般的な方法論上の限界は、コホート研究では非暴露群を含まなかったこと、COVID-19感染前に転帰があったかどうかを確認しなかったこと、横断研究ではサンプルサイズが正当化されなかったことであった。デザイン別に整理されたすべての構成研究の各カテゴリー内のNOSスコアを掲載した(の表S1)。
NOSランクが高い研究、中程度の研究、低い研究のプールされた割合を比較するために、事後的に感度分析を行った。NOSランクが中程度の研究では、NOSランクが低い研究および高い研究と比較して、認知機能障害を呈している人の割合が高かった(p = 0.035; 表3 )。しかし、疲労感を感じている人の割合は、NOSランクのカテゴリー間で有意な差はなかった(p = 0.885; 表3 )。
表3 主要な結果のサブグループおよび感度分析
| 研究数 | 割合 | 95%CI | p | I 2 | Q | pサブグループ(χ2検定) | |
|---|---|---|---|---|---|---|---|
| 倦怠感 | |||||||
| セックス | |||||||
| 女性 | 7 | 0.46 | (0.32,0.60) | <0.01 | 96.0% | 3.36 | 0.067 |
| 男性 | 7 | 0.30 | (0.22,0.39) | <0.01 | 92.6% | ||
| Age Groupa | |||||||
| 大人(18歳以上) | 64 | 0.34 | (0.29,0.39) | <0.001 | 99.2% | 14.59 | <0.001 |
| 子供(<18歳) | 4 | 0.11 | (0.04, 0.21) | <0.01 | 96.8% | ||
| COVID-19入院状況 | |||||||
| 入院 | 45 | 0.36 | (0.30, 0.43) | <0.001 | 99.4% | 1.76 | 0.185 |
| 入院していない | 10 | 0.44 | (0.34, 0.55) | <0.01 | 92.9% | ||
| フォローアップ期間 | |||||||
| <6か月 | 46 | 0.33 | (0.26, 0.39) | <0.001 | 99.1% | 0.10 | 0.755 |
| 6か月以上 | 26 | 0.31 | (0.24, 0.37) | <0.001 | 99.0% | ||
| 確認モードb | |||||||
| 主観的 | 55 | 0.29 | (0.24,0.35) | <0.001 | 99.2% | 7.56 | 0.006 |
| 目的 | 13 | 0.45 | (0.35, 0.55) | <0.01 | 96.4% | ||
| 米国の評価 | |||||||
| 高い | 24 | 0.28 | (0.20, 0.37) | <0.001 | 98.9% | 0.59 | 0.750 |
| 適度 | 27 | 0.32 | (0.25, 0.40) | <0.01 | 96.6% | ||
| 低い | 17 | 0.30 | (0.17, 0.46) | <0.01 | 98.4% | ||
| 研究デザイン | |||||||
| 前向きコホート | 48 | 0.28 | (0.22,0.34) | <0.001 | 97.6% | 94.84 | <0.001 |
| 後ろ向きコホート | 8 | 0.31 | (0.17,0.49) | <0.01 | 98.7% | ||
| 断面 | 10 | 0.36 | (0.21,0.53) | <0.01 | 97.1% | ||
| 両方向コホート | 1 | 0.63 | (0.60, 0.65) | 該当なし | 該当なし | ||
| 後ろ向き症例対照 | 1 | 0.50 | (0.38, 0.62) | 該当なし | 該当なし | ||
| 認識機能障害 | |||||||
| セックス | |||||||
| 女性 | 2 | 0.56 | (0.46, 0.66) | 0.960 | 0.0% | 3.46 | 0.063 |
| 男性 | 2 | 0.36 | (0.19, 0.55) | 0.020 | 82.5% | ||
| Age Groupa | |||||||
| 大人(18歳以上) | 41 | 0.23 | (0.17, 0.29) | <0.001 | 98.1% | 25.60 | <0.001 |
| 子供(<18歳) | 2 | 0.09 | (0.08, 0.10) | 0.400 | 0.0% | ||
| COVID-19入院状況 | |||||||
| 入院 | 24 | 0.30 | (0.22,0.38) | <0.01 | 96.7% | 2.77 | 0.096 |
| 入院していない | 5 | 0.20 | (0.12,0.29) | <0.01 | 70.8% | ||
| フォローアップ期間 | |||||||
| <6か月 | 31 | 0.22 | (0.15,0.30) | <0.001 | 98.2% | 0.07 | 0.794 |
| 6か月以上 | 14 | 0.21 | (0.13,0.30) | <0.01 | 97.3% | ||
| 確認モードb | |||||||
| 主観的 | 31 | 0.18 | (0.12, 0.24) | <0.01 | 97.9% | 9.97 | 0.002 |
| 目的 | 12 | 0.36 | (0.27, 0.46) | <0.01 | 94.9% | ||
| 米国の評価 | |||||||
| 高い | 12 | 0.18 | (0.10,0.29) | <0.01 | 95.7% | 10.95 | 0.004 |
| 適度 | 17 | 0.32 | (0.21,0.44) | <0.01 | 92.6% | ||
| 低い | 14 | 0.10 | (0.05, 0.18) | <0.01 | 97.4% | ||
| 研究デザイン | |||||||
| 前向きコホート | 31 | 0.18 | (0.12,0.26) | <0.01 | 97.4% | 2.01 | 0.366 |
| 後ろ向きコホート | 5 | 0.16 | (0.06,0.35) | <0.01 | 92.5% | ||
| 断面 | 7 | 0.26 | (0.16,0.44) | <0.01 | 92.9% | ||
頭字語: NOS:Newcastle-Ottawa Scale、N / A:該当なし。
3.4. 結果の統合
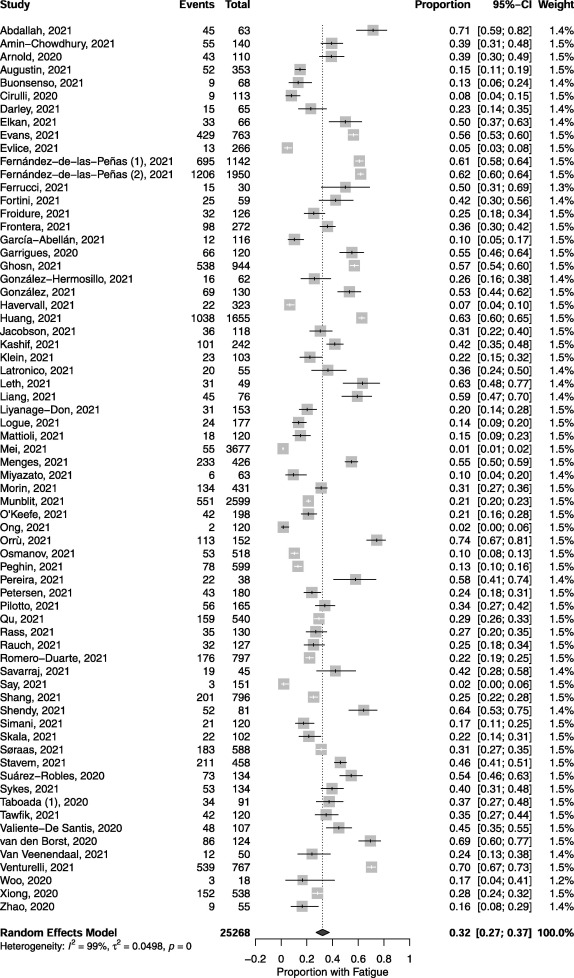
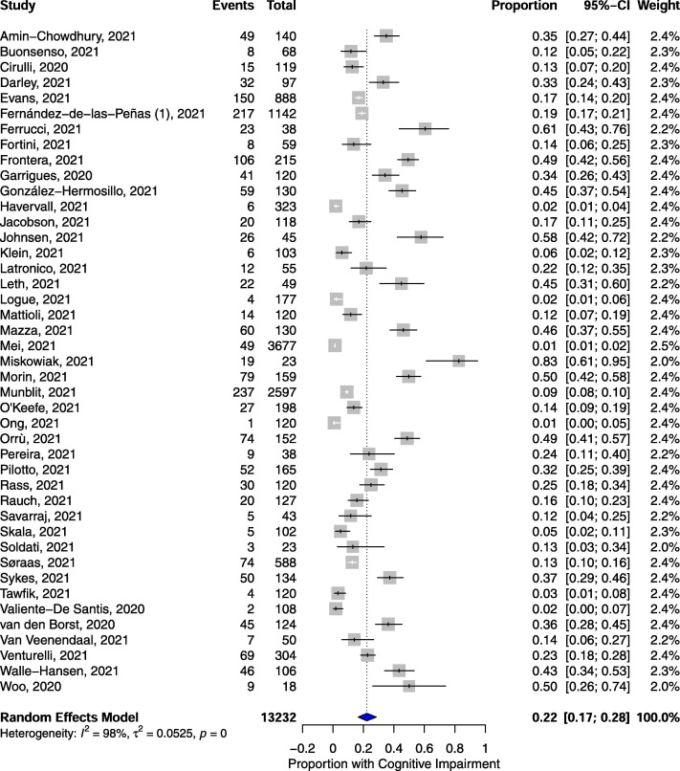
2つの主要アウトカムのメタアナリシスによると、COVID-19診断後12週間以上経過した時点で、32%の人が疲労を感じ、22%の人が認知機能障害を示した。さらに、炎症パラメータを検討した14件の研究のうち13件では、一部の患者で炎症性マーカー(炎症性サイトカイン、C反応性ペプチド、Dダイマー、プロカルシトニン)の上昇が報告された。機能的転帰を調査したすべての研究で、サンプルの一部で顕著な機能障害が報告された。
3.4.1. 疲労のメタアナリシス
COVID-19 患者のうち、診断後 12 週間以上経過した患者のうち、疲労を経験している人の割合をプールした結果は 0.32(95% CI, 0.27, 0.37; p < 0.001; n = 25,268; 図 2)であった。男性に比べて女性の方が疲労を訴える割合が高かったが、サブグループ間の差は統計的には有意ではなかった(女性0.46対男性0.30,psubgroup = 0.067,表3)。また、年齢別のサブグループ解析では、子どもに比べて大人の方が有意に多くの人が疲労を感じていることがわかった(大人0.34対子ども0.11,psubgroup < 0.001,表3)。さらに、疲労を客観的に評価した研究では、主観的に評価した場合に比べて、疲労を感じている人の割合が有意に多かった(客観的に評価した場合0.45対主観的に評価した場合0.29,psubgroup = 0.006,表3)。しかし、入院中の回答者と非入院中の回答者の間には、疲労感を訴える人の割合に統計的な有意差はなかった(入院中0.36対非入院中0.44,psubgroup = 0.185,表3)。同様に、COVID-19の診断を受けてから6ヵ月未満の時点で疲労を感じている人の割合は、6ヵ月以上の場合と比較して有意な差はなかった(6ヵ月未満の場合0.33,6ヵ月以上の場合0.31,psubgroup = 0.755,表3)。感度分析の結果、前向きコホート、後ろ向きコホート、横断的研究(すなわち、最も一般的な3つの研究デザイン)の間で効果の大きさに有意な差はなかったが、研究デザインによって層別化すると効果の大きさに統計的に有意な差が生じることがわかった。
3.4.2. 認知機能障害メタアナリシス
COVID-19患者のうち、診断から12週間以上経過した患者の認知機能障害の割合は、プールされた結果,0.22(95% CI, 0.17, 0.28; p < 0.001; n = 13,232; 図3)であった。認知機能障害を示す割合は、男性よりも女性の方が多いという有意ではない傾向が見られたが(女性0.56対男性0.36,psubgroup=0.063,表3)女性のサブグループの割合は統計的に有意ではなかった(0.56,95%CI,0.46,0.66,p=0.960,表3)。認知機能障害を示したのは、子どもよりも大人の方が多いという有意な傾向があったが(大人0.23対子ども0.09,psubgroup < 0.001,表3)認知機能障害を経験した子どものプールされたサブグループの割合は、有意ではなかった(0.09,95%CI,0.08,0.10,p = 0.400,表3)。認知機能障害を客観的に評価した研究では、主観的に評価した研究に比べて、認知機能障害のある人の割合が有意に多かった(客観的評価0.36対主観的評価0.18,psubgroup = 0.002,表3)。post-COVIDの認知機能障害を報告した入院患者と非入院患者の割合には、統計的に有意な差はなかった(入院患者0.30対非入院患者0.20,psubgroup = 0.096,表3)。同様に、6ヵ月未満と6ヵ月以上の追跡調査で認知機能障害を報告する割合にも有意な差はなかった(6ヵ月未満:0.22,6ヵ月以上:0.21,psubgroup = 0.794,表3)。疲労の場合とは異なり、デザインによって研究を層別化しても、効果の大きさに統計的に有意な差は見られなかった(psubgroup = 0.366;表3)。
図3 COVID-19 診断後 12 週間以上経過して認知機能障害を示した人のプールされた割合
3.4.3. 異質性
疲労(I2=99.1%)および認知機能障害(I2=98.0%)のメタアナリシスでは、かなりの異質性が認められた。選択したサブグループ分析により、異質性は減少した(表3)。
3.4.4. 出版バイアス
疲労度メタ解析のファネルプロットの非対称性を目視したところ、出版バイアスの存在は示唆されず(補足、図S1)Egger回帰切片検定(切片=0.538;SE=0.061;p=0.390)もBegg and Mazumdar順位相関検定(p=0.857)も統計的に有意ではなかった。逆に、認知機能障害メタ分析のファネルプロットの非対称性を目視で確認したところ、出版バイアスの存在が示唆された(補足、図S2)。Egger回帰のインターセプトテストは統計的に有意であったが(インターセプト=0.187;SE=0.040;p<0.001)Begg and Mazumdarの順位相関テストは有意ではなかった(p=0.818)。
3.4.5. 炎症性パラメータ
30-32,36,45-54 細胞内サイトカインレベルを定量化した研究のうち、Bretonらは、健康なドナーと比較してCOVID-19の既往がある人では、炎症性サイトカインであるインターロイキン(IL)-2,インターフェロン(IFN)-γ、腫瘍壊死因子(TNF)-αを発現するCD4+T細胞の数が著しく増加していることを報告した。Ongらはさらに、COVID-19の既往患者では、急性期の重症度にかかわらず、炎症性因子であるIL-1β、IL-17A、IL-12p70,幹細胞因子(SCF)MIP-1βの濃度が健常者と比較して有意に高いことを報告している48。さらに、Shuwa氏らは、中等度から重度の疾患の既往がある患者では、ほとんどのサイトカイン産生T細胞が増加し、サイトカインの産生も増加していたが、TNF-α+ B細胞の頻度には有意な差が見られなかったとしている31。Zhouらは、COVID-19の重症コホートにおいて、血清アミロイドA、TNF-α、IL-1RAが有意に増加し、IL-17AとIL-17Dが正常値よりも高く、IL-7が減少したと報告している36。post-COVIDの患者の3.9~32.2%がIL-6レベルの上昇を示し、32,46,52,García-Abellánらは、血清IL-6レベルの中央値が3 pg/mLであると報告している47。Bretonらも同様に、post-COVIDの患者は非感染者とは異なる全身のサイトカインプロファイルを示したと報告しているが30,ZhouらはすべてのグループでIL-6とIL-10のレベルが正常であったと報告している36。
患者の1.8%から24.5%がCRP値の上昇を示した32,45,49,50,52。CRP値は10 mg/L以上または2.9 mg/dL以上と定義されている。32,46,49,50,52,54 一方、Zhouらは、CRPおよびD-ダイマーの値は健常者と比較して有意に上昇していなかったが(p>0.05)TNF-αなどのサイトカインが臨床的特徴の異常と相関していたと報告している36。また、Sonnweberらは、プロカルシトニン値の上昇を9.0%(平均0.07)の患者で報告している32。
これらを総合すると、炎症パラメータを調査した14件の研究のうち13件(van den Borstらを除く)53が、患者のサブセットまたはpost-COVIDのサンプル全体で、少なくとも1つの炎症の指標の上昇を報告している(中央値/平均値として、健常対照者または標準的な基準値と比較して)。なお、14件の研究のうち9件は、サンプル中に炎症マーカーの存在と持続的な疲労および/または認知障害の両方を報告しており、45-52,54 また、いくつかの研究では、炎症指標の上昇とPCS症状との関連が指摘されている49-51。
3.4.6. 機能的転帰/生活の質
34 の研究が、COVID-19 患者を対象に、診断後 12 週以上経過した時点での機能的アウトカム(生活の質(QOL)の測定に含まれることが多い)を調査した。 -7,33 -35,37,42,44,45,49,51,53,54,56-74 9件の研究では、欧州生活の質5次元5レベル(EQ-5D-5L)スケールを用いてQOLを測定し、35,49,58,61,64-66,75 4件の研究では、EQ-5D-3Lスケールを用い、7,34,67,76 7件の研究では、36項目のショートフォーム調査(SF-36/RAND-36)を用いた45, 53,56,62,70,71,74,Barthel Indexを用いたものが3件、54,57,62,他の尺度を用いたものが11件、33,42,49,53,59,60,68,69,71-73,自己申告によるものが3件、37,44,63と、複数の評価ツールを用いた研究もあった。すべての研究で、地域の基準、非感染の対照群、またはCOVID前の状態と比較して、少なくとも1つのQOL次元で機能障害または低下が認められ(患者の最大72%)53,4つの研究ではすべてのQOL次元で低下が報告された42,45,53,66。
post-COVIDの機能障害は、21%~63%の人に認められた。33,72,76の活動障害(日常業務の遂行、セルフケア、移動の困難さを含む)は1.0%~68.4%7,34,57,59-61,64,65,67,74-76,社会的障害は5%~15%56,59,62,77,スポーツ/レクリエーション活動に参加できないと報告された人は16.0%~28.2%であった。前もって入院していた人の5人に1人は、Washington Group Short Set on Functioning(WG-SS)スケールで追加障害の閾値に達していた49。さらに、病前に就業していた人の29.0%~47.4%が復職できず、37,57,58,60,62 5%~90%がCOVID前の就業レベルに達することができず、49,62,77 8.0%~38.9%が仕事上の生活に支障をきたしたと報告している59,60,65,74 報告されているQOL尺度の平均値と中央値を含む総合的な結果を表2に示す。EQ-5Dの母集団基準は別紙に記載されている78。
3.4.7. ポストCOVID-19症候群に関連して報告された要因
全体として、81件の研究のうち53件が、それぞれの分析でPCS症状の発生率増加に関連する要因を報告した。7,33,34,37,43,47,49,51,54,64,66,70,79-90の24件の研究では、女性の性別がPCS症状(疲労や認知障害を含む場合もある)の発症リスクの増加、持続する症状の数の増加、またはQOL次元の低下と関連していたが、1件の研究では男性の性別が機能的状態/QOLの低下を予測していた76。
7,32,34,48,60,70,72,75,83,90-94の14件の研究において、年齢の上昇はPCS症状またはQOL低下の報告の増加と関連していたが、Mengesらは若年者ほど疲労を報告する頻度が高いことを指摘し、64,Valiente-De Santisらは65歳以上が症状の持続に対して保護的であることを報告している。32,34,43,49,64,68,79,89,95 さらに、19件の研究で、急性疾患の重症度の高さ、入院、または入院期間の延長がPCSの症状またはQOLの低下と関連していた7,32 -34,39,43,45,48,49,56,60,64,76,82,83,85,86,91,96 興味深いことに、Jacobsonらは、疲労の存在が長期的な活動障害と関連していると報告している60。Miskowiakらは、全体的な認知機能障害と実行機能障害の両方が、EQ-5Dの「通常の活動」と「不安と抑うつ」の領域での困難さと相関していると報告している65。さらに、Wooらは、持続的な神経認知障害は、疲労や気分の変化とは無関係であり、古典的なウイルス感染後症候群とは異なる可能性があると報告している97。
4. 考察
ここでは、COVID-19の診断確定後12週以上経過した時点で、約3分の1の人が持続的な疲労を経験し、5分の1以上の人が認知障害を示したことを明らかにした。疲労と認知機能障害の発生率は、入院中の人と非入院中の人の間でそれぞれ同程度であった。さらに、他の持続性のある症状(例:嗅覚障害)98 とは対照的に、疲労と認知機能障害は持続するようであり、感受性の高い人では時間の経過とともに悪化する可能性がある99 。また、成人に比べて小児では、疲労感と認知機能障害の発生率が低いことがわかった。さらに、一部の患者では持続的な炎症が一貫して報告されており、PCSの症状(疲労や認知障害を含む)は顕著な機能障害と関連していることがわかった。PCS症状の発生率を高める要因としては、女性、高齢、急性疾患の重症度、既往症などがよく報告されていた。今回のメタアナリシスでも、同様に、男性よりも女性の方が疲労を示す割合が高いという有意ではない傾向が認められた。
PCS における疲労と認知障害は、感染後疲労症候群 の一形態であり、感染症によって発症することが 多い ME/CFS と表現型が類似している76 。重症急性呼吸器症候群コロナウイルス(SARS)や中東呼吸器症候群コロナウイルス(MERS)など、過去に発生したコロナウイルスのパンデミック後には、同様の疲労の発生率やQOLの低下が報告されている100,101。さらに、PCSは1920年代にパンデミックしたリーサルギカ脳炎(von Economo’s encephalitis)と症状が重複している(例:疲労、認知障害、頭痛)。PCSは、1920年代にパンデミックしたフォン・エコノモ脳炎(疲労、認知障害、頭痛など)と症状が重なっており、これは1918年のスペイン・インフルエンザのパンデミックと因果関係があると考えられている102。
SARS-CoV-2 に感染すると、持続的な疲労や認知機能障害を引き起こしたり、悪化させたりするメカニズムが複数ある。神経学的機能障害は、直接的なウイルス脳炎、神経炎症(血液脳関門の損傷を含む)9,100,101 低酸素症、脳血管障害など、互いに排他的ではない要因によって生じる可能性がある9,103,104。複数の研究により、COVID-19患者の脳には、神経解剖学的変化や神経変性105,脳微小血管障害106,代謝異常(背外側前頭前野など、意欲に関連する領域の代謝低下を含む)107が確認されている。
また、内皮機能障害108,炎症亢進、自己免疫、潜伏ウイルスの再活性化109,多臓器の病理、自律神経系の機能障害などの全身的な後遺症が、前述の症状と相乗的に作用することも認識されている110。特定の炎症性サイトカイン、気分症状、認知機能低下の間の因果関係は、しっかりと確立されている111,112。我々は、COVID-19の急性感染が解消された後、一部の人が一貫して炎症マーカーを示したことを報告しており、炎症亢進がPCSにおける疲労および/または認知機能障害の原因の一つであることを示唆している。実際、他の感染後症候群(例えば、感染後脳炎)113 は、以前から炎症パラメータの上昇と関連している。
PCSの病因に関するいくつかの排他的でない仮説は、選択された患者において抗炎症薬理学的アプローチが何らかの有用性を持つことを示唆している。さらに、向精神薬(例えば、選択的セロトニン再取り込み阻害薬)114 は、炎症性サイトカインレベルを調節し、COVID-19生存者の気分や認知に有益な効果をもたらす可能性がある。115 薬理学的戦略に加えて、様々な心理社会的治療(例えば、認知的改善)もPCSの症状の治療に有効である可能性がある。また、ワクチンの種類や頻度(すなわち、ブースター)が PCS の発症、持続、重症化のリスクに影響するかどうかを判断する必要がある。完全なワクチン接種を受けたことのある人にブレイクスルー感染症が発生したという報告は、そのような人たちのリスクの特徴を明らかにする必要がある。さらに、PCSのリスクに対する医学的および精神医学的併存疾患の影響、特に認知障害、さらには健康の社会的、経済的、空間的な決定要因の影響を評価する必要がある。
5. 制限事項
ここに示した結果は、いくつかの制限事項を考慮して解釈すべきである。第一に、コンポーネント研究は観察研究であるため、因果関係を推測することはできない。第二に、大部分の研究では、COVID-19感染前に結果が存在していたかどうかを確認していない(すなわち、発生率ではなく期間有病率)が、これはNOSで説明されている制限である。したがって、疲労や認知機能障害がSARS-CoV-2感染前から存在していた可能性は排除できない(感染により症状が悪化した可能性はあるが)。第3に、ほとんどの構成研究が入院中の人を対象としているため、COVID-19に感染した大多数の人を代表する結果ではない可能性がある。さらに、パンデミックの発生以来、一般人口における抑うつ症状や不安症状の発生率が増加していることが明らかになっている116。PCS患者の一部では、疲労や認知障害は、感染の結果というよりも、COVID-19の社会的・経済的課題に起因する慢性的なストレスや抑うつ症状の結果である可能性がある。また、感染者の社会的影響が悪化している可能性があることも注目されている。大半のコホート研究では、非感染者の対照群が含まれておらず、比較の根拠がない(のTable S1参照)。
選択バイアスに関しては、ここでの分析では入院患者が多く、報告の一部は集中治療後症候群、併存疾患、薬剤に起因する可能性がある115。さらに、疲労や認知障害は、大うつ病を含むSARS-CoV-2感染の他の後遺症による二次的なものかもしれない。118 今後の研究では、天井効果のない、より感度の高いツール(例えば、精神医学のための認知障害スクリーニング(SCIP)65,119やTHINC-integrated tool(THINC-it)など)を使用することが推奨される。
もう一つの方法論的な限界は、両メタアナリシスにかなりのレベルの異質性が見られることである。これは、データ収集方法やサンプルの特性が各研究で異なることに起因すると考えられる。例えば、様々な主観的および客観的評価ツールは、異なる尺度(例えば、Yes/Noの二分法とLikert法)を使用し、様々なレベルの粒度を提供していた。また,デザイン,確認方法,品質によって研究を層別化しても,異質性は顕著に減少しなかった(表3 )。また,査読を経ていないプレプリント(表2)も対象とした。
6. 結論
81件の研究を対象とした本システマティックレビューおよびメタアナリシスでは、COVID-19の診断から12週以上経過した時点で、対象者の約3分の1が持続的な疲労を経験し、5分の1以上が認知機能障害を示したことが明らかになった。さらに、一部の患者には全身性の炎症が見られ、PCSは顕著なレベルの機能障害と関連していた。PCSにおける炎症性マーカーの上昇と認知機能障害との関連性を示唆する証拠は限られていた。今後の研究では、根本的なメカニズムを明らかにし、標準的な診断基準を開発し、PCS患者の疲労や認知機能障害を予防・治療するための治療法を確立することが望まれる。
財務情報
RSMは、Global Alliance for Chronic Diseases/Canadian Institutes of Health Research (CIHR)/National Natural Science Foundation of China’s Mental Health Team Grantから研究助成金の支援を受けている。また、Lundbeck、Janssen、Purdue、Pfizer、大塚製薬、武田薬品、Neurocrine、Sunovion、Bausch Health、Novo Nordisk、Kris、Sanofi、Eis、Intra-Cellular、NewBridge Pharmaceuticals、Abbieから講演料/コンサルタント料の支援を受けている。ロジャー・マッキンタイア博士は、Braxia Scientific Corp.のCEOである。JDRは、うつ病のケタミンおよびエスケタミン治療を行うBraxia Health(正式名称:Canadian Rapid Treatment Center of Excellence、Braxia Scientific Corp.の完全子会社)のメディカル・ディレクターであり、米国精神医学会、米国精神薬理学会、カナダ癌協会、カナダ精神医学会、Joseph M. West Family Memorial Fund、Timepeprops(米国精神医学会)から研究助成金を受けている。アメリカ精神医学会、アメリカ精神薬理学会、カナダがん協会、カナダ精神医学会、Joseph M. West Family Memorial Fund、Timeposters Fellowship、University Health Network Centre for Mental Health、トロント大学から研究助成金の支援を受け、Allergan、COMPASS、Janssen、Lundbeck、Sunovionから講演料、コンサルテーション料、研究費を得ている。YLはBraxia Scientific Corp.から個人的な報酬を受け取っている。LMWLはBraxia Scientific Corp.と契約している。KWMは、過去3年間にLundbeck社およびJanssen Cilag社から個人的な報酬を受けており、5年間のLundbeck Foundation Fellowship(助成番号:R215-2015-4121)の支援を受けている。MVは、Lundbeck社、Janssen-Cilag社、Sunovion社からコンサルタント料を受け取っている。VMは、AbbVie/Allergan、Acadia Pharmaceuticals, Inc.、Alfasigma, USA, Inc.、Alkermes, Inc.、Eisai-Purdue、Intra-Cellular Therapies、Ironshoreから講演/コンサルタント料を受けている。ヤンセン、ルンドベックA/S、ジャズ・ファーマシューティカルズ、ノーベン・ファーマシューティカルズ社、大塚アメリカファーマシューティカルズ社、セージ・ファーマシューティカルズ社、サノビオン・ファーマシューティカルズ社、スーパーナス・ファーマシューティカルズ社、武田薬品工業株式会社 KMTはBraxia Scientific Corp.から個人的な報酬を受けている。その他の著者は,利害関係を有していないことを表明している。
