Contents
Estimated doses of melatonin for treating deadly virus infections: focus on COVID-19
Received: 2020年4月19日; Accepted: 受理:2020年4月19日、受理:2020年6月3日
概要
COVID-19に対抗するためには、メラトニンがその強力な抗酸化作用、抗炎症作用、免疫調節作用により、有望な分子であることを示唆する証拠が増えている。COVID-19患者を含む致死性ウイルス感染症に対するメラトニンの適切な投与量については、よく聞かれる質問 薬の適切な投与量の黄金の基準は、安全性と有効性である。致死性ウイルス感染症や敗血症に対するメラトニンの薬物動態、動物実験、臨床試験を検討した結果、COVID-19の患者、特に重症の患者にはメラトニン8mg/kg/日の投与が適していると考えている。メラトニンの血清レベルの上昇をより長くスムーズに維持するために、この1日の投与量を5回に分けて、最初の投与量を他のサブドーズ量の2倍にすることができる。推奨される投与量は、敗血症患者の治療に臨床的に使用される範囲であり、副作用がなく、安全性が高い。この用量は、ウイルス感染マウスの死亡率を有意に減少させる有効量から算出されており、COVID-19の重症患者にも有効であると想定される。COVID-19の軽症・中等症患者の症状を改善するだけの用量や薬剤は、生物学的な意義がないと考える。なぜなら、ウイルス感染は自己限定的な疾患であり、軽症・中等症の患者は治療してもしなくても、ほとんどが自然に回復するからである。意味のある治療とは、重症患者を対象とし、その結果生じる死亡率を大幅に減少させることである。提案されたメラトニンの投与量は、したがって、主に重症のCOVID-19患者に推奨される。また,高用量のメラトニンを投与するための座薬については,別の疾患で長期の経験があることから,その可能性についても検討した。
キーワード:メラトニン、ウイルス、COVID-19,感染症、薬物動態、バイオアベイラビリティ、半減期(T1/2)。
1. 序論
2019年末に中国の武漢でCOVID-19が発生して以来、すべてのヨーロッパとアメリカの国々を襲っている。アフリカや人口の多いインドでは、感染はまだより密集しているが、対数の段階に近づいているようである。何百万人もの人々が感染し、数十万人の死亡者が出ている。WHOはCOVID-19を世界的なパンデミックに分類している。科学者たちがCOVID-19に対する効果的な治療法を開発しようと懸命に努力しているにもかかわらず、今日までに限られた成功しか収められていない。このパンデミックを食い止めるための最良の治療法がワクチンであることは疑いの余地がないが、適切なワクチンが大量に入手できるようになるのは数ヶ月から数年先のことである。このウィンドウ期間中に、大多数の人がSARS-CoV-2に感染する可能性があり、特に60歳以上の脆弱な人にとっては深刻な問題となる(1)。罹患者に有効な治療薬を見つけ、死亡率を下げることは、科学者や医師にとって依然として困難な課題である。現在、研究の中心となっているのは抗ウイルス剤で、特に、抗インフルエンザウイルス剤のロピナビル、リトナビル、抗エボラウイルス剤のレムデシビル、抗コロナウイルス活性を試験管内試験で示す抗マラリア剤など、いくつかの既存の抗ウイルス剤を再利用することが注目されている(2, 3)。また、抗インフルエンザ薬であるロピナビル、リトナビルと併用したCOVID-19の患者では、有意な効果が認められなかったという臨床試験結果が報告されている(4)。クロロキン/ヒドロキシクロロキンは、軽度から中等度の症状を持つ患者の予防および治療に有効であるという逸話がある。しかし、発表されたデータでは、これらの主張に対して限定的な支持しか得られなかった(5)。抗エボラウイルス剤であるレムデシビルについては、データが限られているため判断できない。例えば、米国のCOVID-19の最初の12人の患者のうち、3人がこの薬剤で治療を受けているが、結論は出ておらず、その潜在的な肝毒性が懸念されている(6)。症例報告では、レンデシビルが中等度の重症患者に有益な効果を示したようである(7)。現在、中国やその他の国で、いくつかの臨床試験が行われている。これらの臨床試験の結果から、近い将来、COVID-19に対するレムデシビルの治療効果について信頼できる情報が得られるだろう。COVID-19に対する抗ウイルス薬の有効性が低いことは予想外ではない。抗インフルエンザ薬を例にとってみよう。世界中の科学者が抗インフルエンザ薬の開発に多大な努力を払ってきた。しかし、薬剤耐性の増加やウイルスの継続的な変異により、この疾患を標的とする理想的な医薬品は未だに不足しており、新しいワクチンは実際に出現しているウイルスのサブタイプに何度も適合させなければならず、また、異なる標的を持つ抗体やその他の医薬品を開発するための追加的な研究も行われている(8, 9)。現在市販されている薬剤は、インフルエンザの初期段階で使用すれば、軽度から中程度の症状を緩和することができるだけで、重度の症状を持つ患者や合併症の素因を持つ患者では効果が低下する(10, 11)。このように、ウイルス性感染症は自己限定的であり、軽症から中等症の患者は治療しなくても自然に回復するため、臨床的な意義は限られている。ウイルス性感染症では、重篤な症状、すなわち大量の組織や臓器の損傷を抑え、最終的には死亡率をコントロールすることが重要である。重篤な症状は、ウイルスの細胞毒性そのものではなく、コロナウイルス感染症の重篤な病状進行にも見られるように、破壊的な炎症を引き起こす自然免疫反応の過剰反応に起因していると推測されている(12)。このことが、重症患者に抗ウイルス剤が効かない理由の一つと考えられる。抗ウイルス剤の欠点を補うためには、代わりにウイルス感染の重篤な症状を対象とした、より一般的でウイルス特異的でない治療法を検討すべきである。メラトニンはその有力な候補である。メラトニンは、優れた抗酸化作用と抗炎症作用を持ち、過剰になった自然免疫反応のバランスをとるとともに、適応免疫を促進します(13-16)。現在、COVID-19の対策として、特に重症の場合にメラトニンの使用を示唆または強く推奨する論文が増えている(17-20)。 そのため、この致命的なウイルス感染症をうまく治療するためのメラトニンの適切な投与量について多くの疑問がある。ここでは、文献をレビューするとともに、この問題について科学者や医師に意見を述べている。
2. メラトニンの安全特性
メラトニンは人工的に作られた物質と考えるべきではなく(市販品のほとんどは合成メラトニンを含んでいるが)むしろバクテリアから人間まで、ほとんどすべての生物に存在していることから、自然発生的な分子と考えるべきである(21)。また、最近ではミトコンドリアでもメラトニンの合成が可能であることがわかっている(22)。また、米、小麦、パン、肉、魚、卵、野菜、果物、ワイン、コーヒーなど、我々が日常的に口にしている食品には、かなりの量のメラトニンが含まれている。このような観点から、メラトニンは我々の体に安全であると考えられる。多くの動物実験でその安全性が証明されている。マウスの経口LD50(致死量、50%または中央致死量)は約1,250mg/kgと決定され(23)、また、極めて大量に適用した場合には単に識別できなかった(24)。生殖毒性の研究では、メスのラットに極めて大量のメラトニン(200mg/kg/日)を妊娠期間中ずっと投与しても、母親にも子犬にも副作用は見られず、メラトニンを投与した母親から生まれた新生児は対照群に比べて奇形の発生率が低いという結果さえ出ている(25)。このように、ヒトでの試験結果は、上述の動物実験と一致している。ここでは、非常に高用量のメラトニンをかなり長期間にわたって使用したいくつかのヒト試験についてのみ言及する。Nordlund & Lerner (26)は、1,000 mgのメラトニンを1日1回、3ヵ月間投与したが、これらの被験者に明らかな副作用は認められなかった。Voordouwら(27)は、メラトニンを避妊薬としてテストし、12人の女性に300mg/日のメラトニンを4ヶ月間投与したが、重大な副作用は報告されなかった。Weishauptら(28)は、重症のALS患者にメラトニン300mg/日を2年間投与したが、副作用はなかった。急性期のメラトニン治療では、外科手術を受けた患者には50mg/kgという高用量を投与することができるが、患者はこの極めて高いメラトニン投与量によく耐え、重大な副作用もなかった(29)。すべてのデータは、メラトニンを大量に投与しても、慢性投与であれ急性治療であれ、耐えられないほどの副作用や制御できないほどの副作用は起こらず、ヒトに対するメラトニンの安全マージンは、体重75kgの人で3,750mg/日まで可能であることを示している(29)。
3. メラトニンの潜在的な副作用
メラトニンの副作用として一般的に報告されているのは、頭痛、めまい、吐き気、そしてごく一部の消費者に見られる眠気です(30)。眠気はメラトニンの睡眠導入・鎮静作用に関連しており、特に概日的に正しくないタイミングで摂取した場合に発生するものであるが、それ以外の症状は、他の医薬品に関する無数の臨床試験において、プラセボ群でも典型的に観察されている。実際、臨床試験では、これらの副作用はメラトニン群とプラセボ群の両方に同じように分布していることが分かっている(31,32)。メラトニンが鮮明な夢や悪夢を引き起こすかもしれないと主張する逸話的な報告もある。メラトニンのこれらの副作用は、メラトニンの用量が異なると同一ではない作用を引き起こすため、用量に関連している可能性がある(33)。例えば、低用量のメラトニンは高用量のメラトニンよりも入眠を促進する効果があるが、高用量のメラトニンは鎮静作用の高まりを反映してより多くの眠気を引き起こす(34)。
ある症例報告では、メラトニンによって下痢が引き起こされた可能性が指摘されており(35)別の症例報告では、メラトニンが成人男性の躁病エピソードの原因となった可能性が示唆されている(36)。後者の観察結果は、特定の時間型に関連していたかもしれないが、双極性障害は概日的な側面を持っており、自発周期の長さが短い人と長い人では位相のずれが異なるため、これを一般化することはできない(37)。実際、これらの主張は最先端の臨床試験では確認されていない。最近、メラトニンを投与された乳児の突然死が報告され、原因不明とされた。驚くべきことに、末梢血中のメラトニン濃度は1,400ng/mLに達していた(38)。生き残った双子もメラトニンの補給を受けていたため、メラトニンとの関連性は不明のままで、著者は「この症例の死因と死因の結論は、これ以上決定的なものはない」と述べている。
メラトニンは免疫調整物質と考えられているため、メラトニンの自己免疫疾患に対する潜在的な副作用は興味深い問題である。広範な動物実験から得られた結果は、メラトニンによる自己免疫疾患の保護効果を支持するものであるが、これはこのレビューの中心ではない。ここでは、この問題に関連する臨床報告に焦点を当てる。初期の症例報告では、メラトニンの補給によりクローン病患者の症状が悪化したことが示されている(39)。クローン病は、腸の自己免疫疾患である。著者らは、免疫増強剤であるメラトニンが、この症例では自己免疫反応を促進したのではないかと推測している。次の研究では、同じグループが、慢性大腸炎の患者の臨床症状の悪化が、再びメラトニンの摂取と関連していることを観察した(40)。一方、現在の臨床試験では、潰瘍性大腸炎を含む慢性過敏性腸疾患(CIBD)に対するメラトニンの有益な効果が報告されている(41,42)。この保護メカニズムは、メラトニンの強い抗炎症作用によるものと考えられている。関節リウマチもまた、高齢者によく見られる自己免疫疾患である。Sulliら(43)とEl-Awadyら(44)は、患者の血清メラトニン濃度が、マッチさせた対照被験者よりも高いことを観察している。さらに、メラトニンレベルは、本疾患の症状の重さと正の相関があることがわかっている。関節リウマチの患者がメラトニンを摂取する際には注意が必要であるという警告情報がある。ストレスはメラトニン産生を増加させる可能性があるため(45)、メラトニンの増加が患者のストレスに対する反応であるかどうかは明らかではないが、一般的にはそうではなく、逆の現象も観察されている(46)。現在、Forrestら(47)は、さらに踏み込んで、関節リウマチ患者にメラトニンを投与した。その結果、この治療は患者の臨床症状を悪化させることなく、患者の抗酸化防御力を徐々に高めていくことがわかった。この結果は、関節リウマチ患者におけるメラトニンの増加は、おそらく病気の原因ではなく、結果であることを示している。自己免疫性肝炎では本当に注意が必要である。2つの症例報告では、メラトニンがこの疾患の潜在的な原因および悪化要因である可能性が指摘されている(48,49)。また、メラトニン受容体アゴニストであるラメルテオン(50)による治療でも同様の現象が認められている。
自己免疫疾患に対するメラトニンの反応の違いは、メラトニンの免疫調節作用によって説明できるかもしれない。前述のように、メラトニンは自然免疫の過剰反応とそれに伴う炎症を抑制する一方で、適応免疫反応を促進して抗体産生を促進する。一般的に、メラトニンは状況に依存して抗炎症作用と炎症促進作用の両方を発揮することができ、特に高悪性度の炎症や変性神経炎症では抗炎症作用が優先される(15, 51)。CIBDのような自己免疫疾患の主な原因が、高度に亢進した自然免疫とその結果としての炎症であるとすれば(41, 42)、メラトニンは有益な作用を示す。神経変性疾患である筋萎縮性側索硬化症(ALS)(28)では、メラトニンは酸化的損傷を減少させ、マウスモデルでは中程度の効果があった。他にも、抗炎症作用を示す例は他にもある(52,53)。しかし、活性化されたT細胞やB細胞(適応免疫系)と自己抗体の増加が、自己免疫性肝炎のような自己免疫疾患の主な原因である場合、ヘルパーT細胞細胞を介した肝臓自己抗原の認識とB細胞による自己抗体の産生が自己攻撃の引き金となっている(54)ので、メラトニンは状況を悪化させる可能性がある。ここに挙げた副作用は、主に限られた数の症例報告や逸話に基づくものであり、臨床試験から得られたものはごくわずかであることに留意する必要がある。これらのデータの解釈には十分な注意が必要である。
メラトニンのもう一つの望ましくない副作用は、2型糖尿病に関するものである。夜行性のげっ歯類におけるメラトニンの抗糖尿病作用とは逆に、メラトニンは昼間活動するヒトの耐糖能を低下させます(55-57)。この作用は、メラトニン受容体MT2のG対立遺伝子のホモ接合体保有者では強く悪化する(58)。これまで予想されていなかったこの関係の理由は、(i)MT2変異株に対するメラトニンの親和性が野生型に比べて高いこと、(ii)膵臓のβ細胞でMT2変異株の過剰発現が進行し、45歳以上の人ではそれが決定的になること、に関連していることが明らかになっている(59)。特にこのような極端な条件下では、メラトニンはアデニルシクラーゼを強く抑制し、インスリン分泌にはcAMPが必要であるため、生体はグルコースの上昇に反応しなくなる。しかし、この問題は、MT2の遺伝子型がわかっていてもいなくても、入院中の患者であれば簡単にコントロールすることができる。必要なのは、血糖値を測定し、必要に応じてインスリンを投与することだけである。したがって、COVID-19を持つ糖尿病患者に高濃度のメラトニンを使用することを否定するものではない。
4. メラトニンの他の物質との相互作用
いつものように、薬物相互作用を考慮しなければならないが、それは実際には医薬品の使用を制限する可能性があるからである。最も古い報告では、降圧剤であるβ-アドレナリン拮抗薬のプロプラノロールが、松果体のβ-アドレナリン受容体を遮断することで夜間のメラトニン産生を阻害することが示されている(60)。脳内のβ1アドレナリン受容体拮抗薬の副作用である睡眠障害、悪夢、幻覚なども、夜間のメラトニン分泌低下と関連していると言われているが、相関関係があるというだけで、直接的な証拠はない(61, 62)。催眠薬や抗不安薬として最もよく使われているベンゾジアゼピン系薬剤も、ヒトのメラトニン分泌を抑制する(63, 64)。そのメカニズムは一部不明であり、松果体のGABA作動性メカニズムに基づいている可能性があり(65)、さらに哺乳類の松果体を制御し、ベンゾジアゼピン結合部位を含む視交叉上核(66)に関する可能性もある。ベンゾジアゼピンを長期間使用すると、メラトニンの概日リズムが乱れるため、これが体重や内臓脂肪の増加に関係しているとされる(67)。逆に、メラトニンは、脳のいくつかの領域にあるGABA受容体、つまりベンゾジアゼピン結合部位を妨害することも明らかになっている(68)。コーヒーの摂取がヒトのメラトニンレベルに及ぼす影響については、一貫性がない。ある試験では、コーヒーの使用が夜間の血清メラトニン濃度を有意に増加させることが示され、これはカフェインとメラトニンが同じ異化酵素であるCYP1A2をめぐって競合していると解釈されている(69)。一般的に、フルボキサミン、シメチジン、シプロフロキサシン、エノキサシンなどのすべてのCYP1A2阻害剤や、フルタミド、ミルタザピン、オランザピン、タクリンなどの競合する基質は、原理的にメラトニンの異化分解を遅らせることができ、COVID-19の重篤な治療を受けている条件下ではまったく問題にならないと考えられる。しかし、バルビツール酸塩、プリミドン、リファンピンなどのCYP1A2誘導剤は、メラトニンの異化作用を望ましくない形で亢進させる可能性がある。一方、コーヒーによる干渉についての別の試験では、ヒトのメラトニン産生および尿中の6-ヒドロキシメラトニン排泄を減少させる可能性が指摘されている(70)。さらに別の試験では、200mgのカフェインを1日2回、7日間にわたって経口摂取した場合、唾液中のメラトニン濃度に対照と比較して有意な差がなかったと報告している(71)。メラトニンと抗凝固剤、抗血小板剤、降圧剤、抗けいれん剤などとの相互作用の注意点に関する逸話的な主張がいくつかあるが、これらの主張を裏付ける臨床試験はない。
現時点では、蓄積された証拠から、血液凝固傾向の亢進がCOVID-19の症状と負の関係にあることが示されており(72)、COVID-19患者の重症度を下げるために抗凝固剤が推奨されている(73)。また、メラトニンも抗凝固作用を示し、エボラウイルス感染症の治療薬として提案されている(74)。この観点から、COVID-19治療においてメラトニンを他の抗凝固剤と併用することは問題ないと考えられる。また、メラトニンはT1/2が短く(下記参照)医師が患者の出血傾向を把握し、この出血傾向がメラトニンと関係している場合、メラトニンの休薬はT1/2が短いため、迅速な結果が得られる。したがって、抗凝固剤とメラトニンの併用は安全であり、少なくともメラトニンの休薬後に出血が長引くことはない。
ここでは、メラトニンとクロロキン/ヒドロキシクロロキン(クロロキン/ ヒドロキシクロロキン)との相互作用の可能性について簡単に説明する。なぜなら、これらの薬剤はCOVID-19の予防と治療のために提案され、試験されているからである。我々は、メラトニンとクロロキン/ヒドロキシクロロキンは、化学構造の平面性が似ていることに気づいた(図1)。実際、メラトニンとクロロキンの両方に共通する結合部位として、これまで第3のメラトニン受容体(「MT3」)と想定されていたヒトキノン還元酵素2(hQR2,またはNQO2)が存在している(75)。hQR2の機能の全貌は明らかになっていない。キノン還元酵素1と2はともに、内因性のキノンだけでなく、いくつかの異性物質にも作用し、解毒酵素であると考えられているが、QR2はQR1とは異なり、カテコールアミンのキノンを還元する(76)。もう一つの違いは、その阻害の結果に関するものである。QR2遺伝子を破壊すると、パラキノン毒性に対する抵抗性が高まるのに対し、QR1遺伝子を破壊すると、パラキノン毒性が高まる(76)。レドックス生物学の観点から見ると、キノンとその還元産物であるセミキノンラジカルやハイドロキノンは容易に交換可能であり、有機的な酸化還元サイクルを経ることができる。これについては、別のナフタレン系化合物であるメラトニン作動性アゴニストのアゴメラチンについて考察した(77)。基質特異性が異なるため、QR2とQR1を阻害すると、異なる結果が得られる。したがって、QR2は活性酸素種(ROS)の発生や炎症に関連しており、QR1の阻害は炎症性疾患の予防に貢献していると考えられる(78)。QR2にはいくつかの異なる阻害剤が同定されており、その中にはメラトニンの他に、その前駆体であるN-アセチルセロトニン(79)や、インドールアミンよりも強力なレスベラトロール(80)があった。幅広い基質特異性を持つ酵素は、基質として適さない場合、阻害作用を持つ他の多くの分子と結合する可能性が高いため、QR2阻害剤の多様性は驚くべきことではない。 構造的には、メラトニンとクロロキンは、hQR2の同じ触媒部位を占め(81, 82)KmsがμMの範囲で同等の親和性を示す(83-85)。 機能的には、どちらの分子も、酵素の補酵素であるFADをFADH2に還元し、hQR2の構造を変化させ、この酵素を阻害する能力を持っている(81, 86)。しかし、この2つの分子の阻害方法にはいくつかの違いがある。運動学的データによると、メラトニンは酵素特異的な基質であるN-メチルジヒドロニコチンアミド(NHeM)に対して競合的な阻害剤であり、古典的な基質であるメナジオンに対しては非競合的な阻害剤である(84)が、クロロキンではこれらの性質が逆転している(85)。メラトニンとクロロキンの相互作用は,生体内でも観察されている。クロロキンとメラトニンを共投与した培養細胞では,メラトニンが創傷治癒モデルにおけるメラトニン誘発オートファジーの上昇を部分的に阻害した(87)。動物実験では、メラトニンとヒドロキシクロロキンは、MT2が介在するオートファジーの促進を介して腫瘍の成長を抑制し、相乗効果を発揮した(88)。クロロキンがMT1およびMT2メラトニン受容体に結合する証拠はなく、干渉はQR2の結合に限定されると考えられる。hQR2の阻害は、ROS形成や炎症の抑制に関係しているが(89,90)メラトニンとクロロキンのCOVID-19との関連性は根本的に異なるようである。メラトニン治療の初期データは、重症例であっても非常に心強いものであるが(本特集参照)ヒドロキシクロロキンの有効性については、最近の多施設共同試験で大きな議論がなされている(91)。著者らは、未治療の患者よりもヒドロキシクロロキン治療を受けた患者の方が死亡率がやや高いと報告している。いずれにしても、クロロキンには心毒性(92)や網膜毒性(93)などの毒性があることが知られている。前述の試験(91)では、心機能がモニターされており、著者が参照している論文(94)の提案に従っている限り、過量投与の兆候は見られなかった。これらの用量は、マラリアの抑制や関節リウマチ(95)に通常使用される用量の範囲であり、それ以上の用量は危険である。クロロキンは自殺に悪用されたこともあるが(96)、最高用量のメラトニンで自殺することは事実上不可能である。
5. ヒトにおけるメラトニンの薬物動態の諸元
メラトニンの薬物動態は、動物モデルやヒトの臨床試験で広く研究されている。ここでは、ヒトでのデータについてのみ説明する。Harpsøeら(97)は2015年にメラトニンの薬物動態を扱ったオーバーラウンドレビューを発表している。彼らの概要を繰り返す必要はない。したがって、このレビューのデータは、部分的には彼らの出版物から抽出し、部分的には2015年以降に発表された他の結果から得たものである。発表を簡単にするために、メラトニンの薬物動態に関する最も重要な3つのパラメータのみを選択している。その中には、Tmax(メラトニンが投与されてから血清中の最大濃度に達するまでの時間)T1/2(血清中の最大濃度から半分の濃度に減衰するまでの時間)バイオアベイラビリティが含まれる。これらのパラメータは、COVID-19のような致死性ウイルス感染症の患者に対するメラトニンの臨床投与量および投与頻度を推定するための参考資料となる。メラトニンを経口投与した場合のTmaxは46.8±21.5分(n=22)。この数値は、喫煙、徐放性製剤、コーヒー摂取、メラトニンと他の添加剤との併用などの潜在的な干渉要因を除いた健康な被験者から算出したものである。経口投与におけるメラトニンの典型的なT1/2は52.8±18.1分(n=21)。T1/2が極端に長い(100分以上)試験のデータは除外した。TmaxとT1/2の値は、Harpsøeら(97)とGalleyら(98)およびAndersonら(99, 100)から抽出したデータを用いて算出している。ヒトにおけるメラトニンのバイオアベイラビリティは、実験動物のそれよりもかなり低い。動物での投与量と比較する際には、この点を考慮する必要がある。ヒトにおけるメラトニンのバイオアベイラビリティは18.9%で、範囲は8.7~33%である。この数字はTanらのレビュー(45)から抽出したデータから得られたものである。現在、Andersonら(99)は、ヒトにおけるメラトニンのバイオアベイラビリティが極めて低い(3%)ことを報告しており、この値は我々の計算には含まれていない。ヒトにおけるメラトニンのバイオアベイラビリティが比較的低いのは、初回通過効果が高いこと(メラトニンが最初に肝臓を通過したときに肝臓で急速に代謝されること)またはヒトの胆汁中に極めて高いメラトニン濃度が検出されていることから、メラトニンが腸肝循環に入る可能性があることを反映している(101)。読者の便宜を図るため、メラトニンの薬物動態に関するこれらのパラメータを図2にグラフで示した。高齢者を対象とした試験はほとんどないが、新生児のメラトニンの薬物動態を調べた臨床試験がいくつかある。新生児のメラトニンのT1/2は成人に比べて著しく長く、その範囲は7.98〜15.82時間である(102,103)。(102, 103). 新生児にメラトニンを使用する際には、このT1/2の大幅な延長を考慮する必要がある。薬物動態データは、製剤(徐放性製剤など)投与方法(輸液、坐薬など)に依存し、特に高用量を投与する場合には用量に依存する可能性があることにも留意する必要がある。
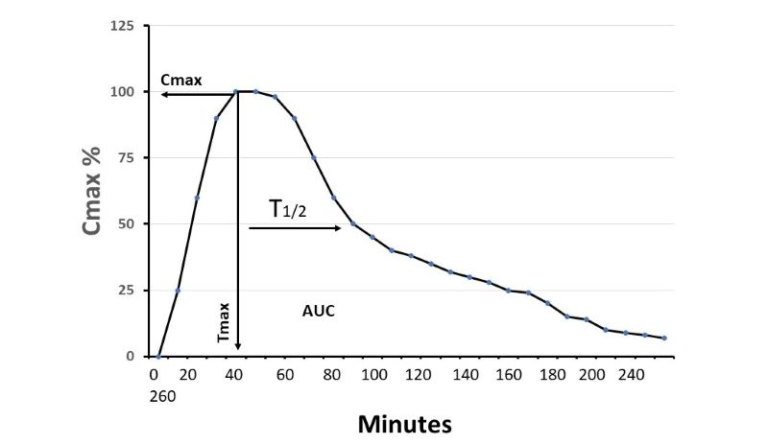
図 即時放出型メラトニンの経口投与による薬物動態の説明図
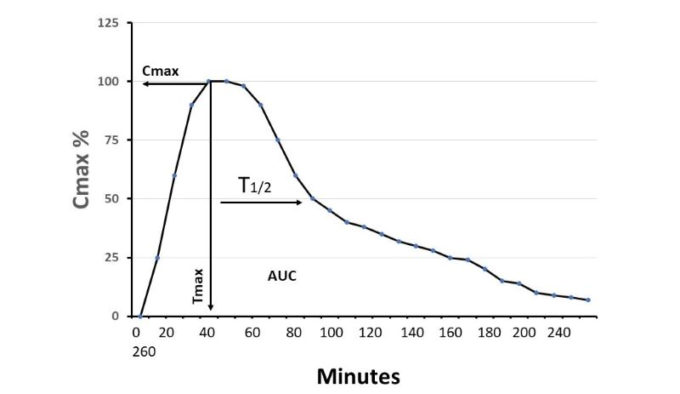
Cmax:投与後のメラトニンの血清最大濃度。ここでは理解しやすいように100%で表している。Tmax:メラトニンが投与されてから血清最大濃度に達するまでの時間、T1/2(血清最大濃度が半分になるまでの時間)AUC:曲線下面積。グラフに示すように、Tmax=46.8±21.5分、T1/2=52.8±18.1分であった。
6. 致死性ウイルス感染動物およびヒト敗血症におけるメラトニンの見かけ上の有効量
ウイルス感染症に対するメラトニンの効果を調べた臨床試験はまだない。ここでは、ウイルス感染症に対するメラトニンの保護効果に関連するいくつかの動物実験の詳細をリストアップした(表1)。これらは、ヒトの臨床試験、特にCOVID-19でのメラトニンの使用を正当化するための参考資料として使用できる。
さらに、敗血症に対するメラトニン治療に関連する臨床試験情報を表2に示した。敗血症の臨床症状は、ウイルス感染症のそれと似ている。我々の焦点は、これらの試験で使用された投与量を取り上げ、COVID-19を含む致死性のウイルス感染症に使用するために推奨される適切な投与量を正当化することである。
表1 致死性ウイルス感染症の動物に使用されたメラトニンの情報
| ウイルス | タイプ | 疾患 | 動物 | メラトニンの投与量 | 結果 | 参照。 |
| RSV | -ssRNA | 肺感染症 | マウス | 5mg / kg、感染後3日間は1日3回。 | ↑SOD、GSH; ↓TNF-α、NO、MDA、・OH。 | (104) |
| VEEV | + ssRNA | 脳脊髄炎 | マウス | 0.5mg / kg /日、感染の3日前と5日後。 | ↓死亡率は100%から45%、↓ウイルス量。 | (105) |
| VEEV | + ssRNA | 脳脊髄炎 | マウス | 1mg / kg /日。 | ↓死亡率100%から16%、↓ウイルス量、↑IgM。 | (106) |
| VEEV | + ssRNA | 脳脊髄炎 | マウス | 0.5mg / kg /日。 | ↓死亡率は100%から75%、↓ニューロンの酸化的損傷とアポトーシス。 | (107) |
| RHDV | + ssRNA | 兎出血病 | うさぎ | 10、または20 mg / kg
0、12、および24時間のip。感染後。 |
↓PARP1、Caspase3 / 8/9、Bax、Cyto C、GSSG / GSH、TBARS。↑Bcl-2、Bcl-xl(高用量がより効果的です)。 | (108) |
| RHDV | + ssRNA | 兎出血病 | うさぎ | 10、または20 mg / kg
0、12、および24時間のip。感染後。 |
↓TLR4、TNF-α、IL-6、↑NF-κB。 | (109) |
| SFV | + ssRNA | 脳炎 | マウス | 感染の3日前と10日後の0.5mg / kg(sc。)。 | ↓死亡率は100%から44%です。 | (110) |
| WNV | + ssRNA | ウエストナイル熱 | マウス | 0.17mg / kg(im)感染の2日前と8日後。 | ↓死亡率は75%から31%。 | (110) |
| A型インフルエンザウイルス | -ssRNA | インフルエンザ | マウス | 20または200mg / kg / 48時間(10または100mg / kg / 24時間)。 | わずかに20mg、200mgが有意に↓死亡率(図3)。 | (111) |
表2.ヒト敗血症で使用されるメラトニンの情報
| 処理 | N(T / C) | 用量 | mg / kg /日 | 結果 | 参照。 |
| 乳児のRDS | 60/60 | 10回投与(各10mg / kg)/ 72時間。(最初の4回の投与は2時間間隔で、5回目と6回目は4時間間隔で、7回目と8回目は8時間間隔で、9回目と10回目は12時間間隔で区切られています(iv)。 | 33 | 2人は対照群で死亡し、メラトニン治療では死亡しませんでした。悪影響はありません。↓TNF-α、IL-6、IL-8、NO。 | (112) |
| 新生児の敗血症 | 10/10 | 合計20mgのメラトニン(1時間間隔で10mgを2回投与)を経口投与します。3.5kgの平均体重。 | 5.7 | 10人中3人が対照群で死亡し、メラトニンによる死亡はありませんでした。↓MDA + 4-HAD。 | (113) |
| 外科的新生児 | 10/10 | 10回投与(各10mg / kg)/ 72時間。(最初の4回の投与は2時間間隔で、5回目と6回目は4時間間隔で、7回目と8回目は8時間間隔で、9回目と10回目は12時間間隔で、各注入には2時間かかります。 )。(iv)。 | 33 | ↓TNF-α、IL-6、IL-8、NO。WBC、ANC、CRP。臨床の改善
結果。 |
(114) |
| 日中の内毒素血症(成人) | 12/12 | 100mg(8時間の注入)(70kg /成人と仮定)。 | 1.4 | ↓IL-1β、YKL-40。 | (115) |
| 敗血症の第I相用量漸増試験 | 20 | 各グループの個人の場合、20、30、50、および100mg。平均体重76kg(最高用量を選択)。 | 1.3 | 吐き気、頭痛、嘔吐、下痢、または腹痛を報告した被験者はいませんでした。一部の被験者は眠気を報告しました。 | (98) |
| 夜間内毒素血症(成人) | 12/12 | 100mg(8時間の注入)(70kg /成人と仮定)。 | 1.4 | 炎症性サイトカインの変化はありません。 | (116) |
| 新生児敗血症 | 25/25 | 20mgを介して与えられた
オロ/鼻–胃管。平均体重2.44kg。 |
8.2 | 敗血症スコア、臨床および検査結果の改善。 | (117) |
| 新生児敗血症 | 20/20 | 経鼻胃管による単回投与としての20mgのメラトニン。平均体重2.47kg。 | 8.1 | 1人は対照群で死亡し、メラトニンによる死亡は治療されませんでした。 ↓hs-CRP、↑血小板。臨床転帰の改善。
|
(118) |
| 平均 | 11.5
(05-33) |
RDS:呼吸窮迫症候群、MDA:マロンジアルデヒド、4-HDA:4-ヒドロキシルアルケナール、CRP:C反応性タンパク、ANC:絶対好中球数、hs-CRP:高感度C反応性タンパク。N:サンプル数、T/C:処理済み/対照。メラトニンの平均量(mg/kg)を算出する際に、投与経路の違い(静脈投与、経口投与)を考慮しなかった。注入時間が2時間の研究もあれば8時間の研究もあるため、このような調整を行うのは難しい。また、経口投与されたメラトニンのバイオアベイラビリティには個人差がある。したがって、この文脈では、これらの異なる経路で投与されたメラトニンの量は等しく効率的であると仮定している。この仮定は完全ではないが、読者に基準値を提供する最もシンプルな方法である。
7. 致死性ウイルス疾患、特にCOVID-19におけるメラトニン投与量の推定値
現在、よく聞かれる質問は、COVID-19の治療に適したメラトニンの投与量である。COVID-19は全く新しい病気であり、この病気に対するメラトニンの臨床データや動物実験さえないため、これは答えにくい質問 このレビューは、この質問に確実に答えるためのものではないが、研究者や医師にできるだけシンプルな方法で情報を提供し、致死性ウイルス感染症、特にCOVID-19に使用されるメラトニンの適切な投与量の範囲をすばやく把握できるようにするためのものである。つまり、読者は、表1および表2に記載されている安全マージン、薬物動態、敗血症患者や動物実験ですでに使用された用量に基づいて、適切な投与量を選択することができる。さらに、我々の意見も述べている。
メラトニンについては、通常の投与量ガイドラインは、抗ウイルス療法とは全く異なる用途に言及している。睡眠や時差ぼけには3mgを就寝30分前に服用するのが一般的である。この3mgのメラトニンが、アメリカでどのようにして食品添加物として選ばれたのかは誰も知らない。欧州連合(EU)では、欧州医療機関(当時はEMEA)が放出制御型メラトニン(サーカジン®)を2mgに制限しているが、これは主に不眠症で長期的な治療が必要な場合に注意を促すためである。しかし、現在のところ、この規制を裏付ける確かな学術データはない。この用量は、循環中の生理的メラトニンの夜間ピークを反映しているという逸話がある。しかし、循環しているメラトニンレベルは、受容体の飽和に関連しているものの、体の他の部位における実際のメラトニンレベルを考慮していない。例えば、第三脳室や胆汁中のメラトニン濃度は、血清中のメラトニン濃度よりも数桁高い(119)。我々は、循環系のメラトニンは、ある意味、松果体で生成されたメラトニンの残留物のようなもので、主にCSFを介して視交叉上核を狙っているのではないかという仮説を立てた。つまり、納得のいくメラトニンの標準投与量はなく、メラトニン3mgの標準の由来も謎なのである。また、重症のCOVID-19患者に起こる破壊的な炎症や大規模な病理学的変化には、いわゆる生理的レベルのメラトニンでは満足できない適切な処置が必要である。適切な投与量は、表1および表2に示した敗血症の動物実験および臨床試験に基づいて決定されるべきである。表1に示したメラトニンの有効量はかなりばらつきがある。これは、ウイルスの種類や動物モデルの違いによるものと思われ、メラトニンに対する反応が異なることが予想される。しかし、Huangら(111)がH1N1ウイルスによる致死性インフルエンザの治療に使用した用量を検討することを強くお勧めする。この研究では、著者らは2種類のメラトニン用量を選択し、メラトニンがH1N1インフルエンザウイルスによる死亡率を低下させる用量相関効果を示すことを発見した。メラトニンは、10mg/kg/day(20mg/kg/48hr)の用量では、わずかな効果しか示しなかったが、100mg/kg/day(200mg/kg/48hr)の用量では、死亡率を大幅に減少させることができた。この効果は、メラトニンを早期に投与した場合や、抗ウイルス薬(リバビリン)を併用した場合に、さらに大きくなった(図3)。このマウスの投与量を、表面積に基づいて係数12.3(120)で割った標準的な用量換算に従ってヒトの投与量に変換すると、計算上のヒトの等価投与量は8.1mg/kg/day(100/12.3=8.1)となる。この投与量は、2つの新生児敗血症試験で使用された投与量(表1の最後の2つの試験に記載されている8.1および8.2mg/kg/day)と非常によく似ているが、この場合、新生児と成人の投与量の換算を考慮する必要がある。表2で得られたヒト敗血症に対する平均有効量は11.5mg/kg/dayで、範囲は0.5~33mg/kg/dayであった(表2)。マウスからヒトへの換算用量である8.1mg/kg/dayは、ヒト敗血症の平均有効量の範囲内である。重要なのは、これらの臨床試験によれば、この用量は明らかな副作用を引き起こさないことである。したがって、COVID-19を含む致死性ウイルス感染症を治療するための推定投与量は8mg/kg/day程度となる。75kgの人の場合、1日の投与量は600mg(75×8=600)となる。メラトニンのT1/2が比較的短いことから、メラトニン濃度を継続的に上昇させるためには、600mgを5回に分けて分割投与することが望ましいと考えられる。オーバーシュート型の炎症を抑制するために必要な濃度は、いずれにしても受容体飽和レベルを超えているため、概日リズムの問題はあまり重要ではないと考えられる。初回投与量は血清メラトニン濃度を速やかに上昇させるために200mgとし、維持量は4時間後(Tmax+T1/2約3)に100mgを2回目に投与し、その後は5時間ごとに100mgを投与して治療を続ける。医薬品の最も重要な特性は、有効性とは別に、安全性であり、特に重篤な状態にある患者に追加のダメージを与えないことである。この投与量のメラトニンは、新生児に対しても驚くほど安全である(表2)。この投与量である8mg/kg/dayは、重度のCOVID-19患者に使用することができる。仮に効果が不十分であっても、数日間の投与であれば害はない。軽度から中等度の重症患者には、この用量を減らすことができる。
図3.H1N1インフルエンザウイルスを接種したマウスの死亡率に対するメラトニンの効果
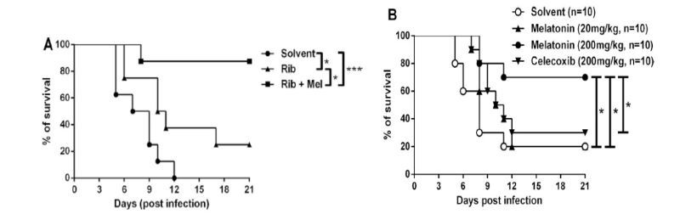
A. 感染マウスに、溶媒(n = 4)20 mg/kgリバビリン(Rib)(n = 18)または20 mg/kgリバビリン+100 mg/kgメラトニン(Rib + Mel)(n = 18)を毎日5日間投与した。B. メラトニンまたはセレコキシブは、ウイルスの鼻腔内感染の6時間前に投与し、感染後2日目および4日目に再び2回投与した。Bに記載の投与量は48時間分。数値は本文に記載の通り、10mg/kg/dayまたは100mg/kg/dayとした。*p < 0.05, ***p < 0.01. 図は参考文献から改変した。111.
8. 坐薬という別の投与方法
メラトニンは主に経口投与されるが、もう一つの可能性として、座薬を使用することができる。この方法は、ALS特有の嚥下困難者への投与を容易にするために開発されたもので、ALS患者を対象とした2年間の長期試験で使用された(28)。血中メラトニン濃度を追ってみると、夕方に投与した後、急激で非常に強い上昇が観察されたが、日中の濃度は比較的ゆっくりと減少し、日周期の測定時点ではかなりの上昇を維持していた。この投与方法では、ワックスキャリアの溶解が遅いため、ある種の徐放性効果があると思われる。さらに,直腸投与では,他の試験薬の初回通過代謝が最大で3分の2になることが知られている(121)。したがって、この方法でメラトニンを投与すると、バイオアベイラビリティが高くなる可能性がある。メラトニンを含む座薬の製造方法が記載されており、一時的に期限切れの特許が付与されていた(28, 122)。この方法の安全性は、重症患者を対象とした長期の研究によって示されている。経腸投与の利点は、1日の投与回数を、おそらく1日2回または1回に減らすことができることであろう。また、夕方と昼食後にそれぞれ使用するために、高用量と低用量の2種類の座薬を使用するなどのバリエーションも考えられる。最適な投与量は経験的に見つけなければならない。しかし、過量投与の危険性があってはならない。
9. おわりに
COVID-19患者にメラトニンを投与する際の承認された投与量はまだ存在しない。しかし、動物における他の致命的なウイルス性疾患やヒトにおける敗血症の経験は、臨床実践のためのおおよその提案とすることができる。この病気の軽症、中等症、重症の場合の正確な投与量についての相対的な不確実性は、大きな問題ではなく、心配の理由にもならないと考えられる。最も不都合な状況は、投与量の不足から生じる可能性があるが、逆に過剰摂取となっても、メラトニンの忍容性が極めて良好であるため、深刻なリスクとはならない。他の薬剤との相互作用は、ほとんどがメラトニンレベルの変化に限定されるが、これは危険ではない。他の医薬品の作用を大幅に増加させる薬物相互作用は、我々の知る限りでは報告されていない。臨床家は、COVID-19との戦いにおいてメラトニンを試すことを躊躇してはいけない。成功した場合、メラトニンの適合性は、実際の「コロナ・クライシス」の後、炎症反応がオーバーシュートする他の致命的なウイルス性疾患が出現したときにすぐに思い出すべきである。