Contents
pubmed.ncbi.nlm.nih.gov/33919194
オンライン公開 2021年4月21 日 .
PMID:33919194
要旨
CRISPR-Casシステムは、人間を含むほとんどの生物のゲノムを生体内で編集するための強力なツールである。この技術は長年にわたり、アレルギーフリーの食品作りを含む作物の改良・育種、害虫の駆除、動物品種の改良、バイオ燃料産業など、さまざまな分野で応用されてきた。
ヒトの健康への応用としては、遺伝子組み換え生物の作成による新薬の製造、ウイルス感染症の治療、病原体の制御、臨床診断への応用、体細胞変異(癌など)や遺伝性変異(メンデル病)によるヒトの遺伝性疾患の治療などが考えられる。このシステムの利用法として、最も議論の分かれる可能性のあるもののひとつは、出生前のヒトを予防または治療する目的で、ヒト胚を改変することである。しかし、この分野の技術は規制を上回るスピードで進化しており、その巨大な可能性からいくつかの懸念が提起されている。
このシナリオでは、このアプローチの利点とリスクを適切に評価するために、適切な法律を制定し、倫理的ガイドラインを作成する必要がある。本総説では、これらのゲノム編集技術の可能性とヒト胚治療への応用についてまとめる。CRISPR-Casの限界と、処理された胚に引き起こされる可能性のあるゲノム損傷について分析する。最後に、これらすべてが法律、倫理、常識にどのような影響を及ぼすかについて論じる。
1.はじめに
その最初の偶然の発見は1987年にさかのぼるが[1]、ゲノム改変のためのCRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)システムの可能性は10年も前に爆発的に広がり[2]、ジェニファー・ダウドナとエマニュエル・シャルパンティエは2020年にノーベル化学賞を受賞した[3]。CRISPRシステムは、細菌や古細菌がウイルス感染から身を守る方法である(図1)。自然界に存在するバクテリオファージの欠陥変異体は、宿主内にゲノムを注入することはできるが、そのライフサイクルを完了することができないか、あるいはその速度が遅すぎる。簡単に説明すると、宿主が最初のウイルス攻撃を生き延びた場合(図1A)、ファージゲノムの一部が短いDNAの繰り返し(長さ:23-55塩基対、bp)からなるCRISPRと呼ばれる特定の遺伝子座の内部に組み込まれ[5]、CRISPR DNAスペーサー(長さ:21-72bp)となる可能性がある(図1B)。CRISPR遺伝子座は細菌ゲノム内の複数の部位に存在し(メタノカルドコッカス属では最大23箇所)、各遺伝子座は複数のスペーサーを含むことがある(Haliangium ochraceumでは最大約600スペーサー)[6]。この過程は「適応」と呼ばれる。細菌が再び同じ種類のウイルスに感染すると(図1C)、CRISPR遺伝子座は、通常1つのCRISPRアレイあたり約50個のスペーサーを含む[5]、長いRNA(CRISPR RNA、またはcrRNA)に転写され、その後、短い干渉crRNAに切断される(図1D)(プロセス:「発現」)。これらの断片は、Casタンパク質およびtracrRNA(後述)と共に、新たに注入されたウイルスゲノムに結合し、核酸切断によってその分解を促進する(図1Dおよび図2)。ペアリングと切断を担うタンパク質は、Cas(CRISPR-associated protein)ファミリーのメンバーである。それらは、核酸の標的(DNAまたはRNA、一本鎖または二本鎖、直鎖または環状DNA、その他の構造的特徴)、切断のタイプ(鈍端またはオーバーハング)、作用の仕方が異なる。それらは合計2つのクラスに分類され、6つのタイプと33のサブタイプに分けられる[7]。DNA分解のために複数のCasタンパク質を使用するシステムはクラスIに属し、クラスIIに属するものは1つの大きなCasタンパク質のみを使用する。ゲノム編集に最も使用されるCas9エンドヌクレアーゼはクラスIIに属する。Cas9複合体は、DNA切断を担う2つのマグネシウム依存性エンドヌクレアーゼドメイン(すなわち、HNHとRuvC)と2つのRNA、crRNAとトランス活性化CRISPR RNA(tracrRNA)を含むCas9タンパク質によって形成される。RNAseIIIによって処理されると、crRNA/tracrRNA/Cas9の複合体は標的へと「誘導」されるため、「ガイドRNA」(gRNA)と呼ばれる。Cas9が媒介する標的分解において重要な役割を果たすのは、PAM(Protospacer Adjacent Motif)配列である。PAMは、非標的鎖上の切断部位に隣接する短いDNAストリング(通常3-8bpの長さで、長さと配列はCas9が由来する細菌種に依存する)である(図2B)。通常、ガイドRNAによって標的化されたDNA配列の3′末端の2-6ヌクレオチドに位置し、Casヌクレアーゼはその3ヌクレオチド上流を切断する。注目すべきことに、PAMはcrRNAの配列には存在せず(すなわち、それはウイルスゲノムの一部であるが、細菌ゲノムの一部ではない)、その不在は複合体全体の切断活性を損なうのに十分である。このため、複合体は自己と非自己のDNAを認識することができ、CRISPR遺伝子座の細菌DNAを誤って切断することを回避できる。このように、PAMの役割は、正確なDNAターゲティングのために、ゲノム工学においても同様に極めて重要である。
図1 原核生物のCRISPR抗ウイルス防御システム
ウイルスの集団には、野生型(黒)と欠損型(灰色)のファージが存在する。図の例(A)のように欠陥のあるバクテリオファージに感染すると、ウイルスゲノムの一部が細菌ゲノムのCRISPR遺伝子座のひとつに挿入される(適応、B)。2回目の感染の場合、野生型ファージであっても(C)、CRISPR遺伝子座は転写され(発現)、Casを介した部位特異的切断によってウイルスゲノムの分解を促進する(干渉、D)。
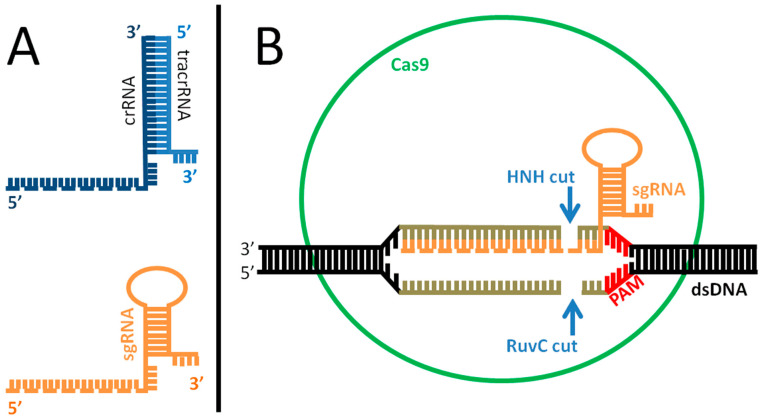
図2 Cas複合体の作用機序
(A):天然(上)と人工(下)のガイドRNA(gRNA)の違い。天然のシステムは2つの部分、crRNA(濃い青)とtracrRNA(薄い青)で構成されており、これらは対になってCas9を駆動し、侵入したウイルスDNAを標的とする。ターゲットを認識するcrRNAの部分は点線で示されている。操作された形では、合成単一ガイドRNA(sgRNA)は、標的認識部位(点線)を含む天然の対応物の形状を模倣した1分子である。(B):ゲノム編集の場合、sgRNA(オレンジ)はCas9タンパク質(緑)の内部に組み込まれ、二本鎖の標的DNA(黒灰色)を認識してペアリングを促進する。相同性があり(ペアリング配列長:21-72bp、灰色で表示)、標的DNA上にPAM配列(赤)が存在する場合、Casタンパク質はPAMの3bp上流でDNAを切断し、二本鎖切断を引き起こし、標的遺伝子の機能を不活性化する。真核細胞における標的染色体損傷の修復は、通常、エラーを起こしやすいNHEJ(非相同末端接合)機構を採用している。しかし、外来性DNA鋳型(Cas複合体とsgRNAが注入されたもの)が存在する場合、細胞は相同主導修復によって切断を修復し、目的の配列をゲノム内に導入することができる。
DoudnaとCharpentierの研究は、事実上あらゆる生物の特定のゲノム配列を標的とし、その切断を促進するために、このシステムを改変することを目的としていた。改変されたシステムは、関係する修復メカニズムに応じて、遺伝子のノックアウトとノックインの両方を可能にする。特に、DoudnaとCharpentierは、2つのRNA分子を、選択した標的DNAを見つけて切断するのに十分な合成単一ガイドRNA(sgRNA)に融合させることで、Cas9複合体をより制御しやすい2成分系に再構築した(図2A、下)。このようにして、ゲノム内の特定のターゲットにCas9エンドヌクレアーゼを誘導するカスタムメイドのsgRNAをin vitroで作成することができる。sgRNAがホモログ配列を認識すると、Cas9はDNAを切断する。これにより、宿主細胞のDNA修復機構が作動し、エラーが起こりやすいNHEJ(非相同末端接合)機構が関与し、接合末端にエラーが誘発され、遺伝子機能が不活性化される(ノックアウト)。しかし、適切な外来性鋳型(ドナーDNA)が提供されれば、これを相同性駆動型DNA修復に用いることができ、(i)野生型配列に特定の変異を導入する(ノックアウト)、(ii)変異した遺伝子の野生型コピーを復元する(遺伝子改変)、(iii)新しい遺伝子全体、あるいは複数の遺伝子を挿入する(ノックイン)のいずれかの方法で、元の配列を選択した別の配列に置き換えることができる。その結果、ドナーDNAは、遺伝子の点突然変異を標的とする数塩基対から、特定のプロモーターと追加の調節エレメントを持つ1つ以上の遺伝子を含むより大きなエレメントまで、あらゆるサイズの可能性がある。比較的容易に使用でき、DNA配列の効率的かつ正確なターゲティングが可能なため、植物、動物、そしてヒトを含む事実上すべての生物において、ゲノムDNAを改変するためにこの技術を使用することが広まった[9]。
1.1.ヒトのQOL向上のためのCRISPR応用の可能性の概要
このシステムの柔軟性は、真核生物と原核生物の両方で重要な結果を達成するために、非常に多様な方法で宿主ゲノムを改変する可能性を開いた。植物ゲノムは、CRISPRによって容易に改変することができる[10]。一般的に、この技術によって、収穫量の増加[11]、栄養価の向上[12,13]、果実の成熟制御[14,15]、寄生虫や菌類、その他の害虫に対する抵抗性[16,17,18,19]、環境ストレスに対する抵抗性[20,21]など、作物の改良が可能になる。加えて、より「美的」な目的も追求されている。例えば、果物や野菜の色を濃くしたり、サイズを大きくしたり、形を規則正しくしたり、観賞用植物の開花を改良したり[22,23,24]、あるいは新しい風味を持つ野菜を作ったり[25]。一部の改良は、人間の健康にも直接的な影響を与える。上記の栄養成分以外にも、大豆のアレルゲン含有量を減少させたり[26]、セリアック病の人々のために低/無グルテン小麦を作ったり[27,28]といったように、食品のアレルゲン含有量を低下させることに取り組んでいるグループがある。
CRISPRは、動物のゲノムを操作して病気に耐性のある系統を作り出すのに使われてきた。例えば、豚呼吸器・生殖器症候群ウイルス(PRRSV)やアフリカ豚熱に耐性を持つ豚や、ウイルスが細胞に侵入する際に認識する豚のタンパク質を操作することで、コロナウイルスに耐性を持つ豚を作出することができた。ブタはまた、異種移植と寛容を改善するためにも操作されていた[29,30]。同様の遺伝子編集アプローチは、角の除去、雄の去勢、ミュールシングなどの拡散的な慣行後の動物福祉の改善にも使用されている(総説は[31])。鳥インフルエンザウイルスや鳥白血病ウイルスなど、特定の病気を引き起こす微生物に耐性を持つニワトリやウズラの系統を作出するために、養鶏業界も深く関与している。同様に、筋肉の成長を促進し、人間の食物の重量と品質を向上させるために、多大な努力が払われている(総説は[32])。これらの動物はまた、家禽類の貴重なタンパク質を生産するための効率的なバイオリアクター・システムであるニワトリの作出にも利用されている([32]およびその中の参考文献を参照)。植物と同様に、動物においてもCRISPRは、ペットとして使用される「マイクロブタ」の作出など、美的目的のために使用されている[33]。ヤギのミルク[34]や鶏卵[35]などがその例である。

ヒトの健康における直接的な研究、さらに次のセクションで述べる胚操作における利用に関しては、ここでは、ヒトの病気を治療するためのツールとしてCRISPR/Cas9が使われたいくつかの例を簡単に思い出してみよう。CRISPR/Cas9は、疾患モデルを作ったり、新たな病因物質を発見したりするのに非常に有用であり、研究者はその生物学的理解を深めることができる。その例としては、癌、神経疾患、心血管疾患、免疫不全、感染症、鎌状赤血球症、血友病、代謝性疾患、嚢胞性線維症、網膜色素変性症、その他がある([36,37,38,39,40,41,42]に総説あり)。特に、癌の治療と特徴付けは非常に有望であり、このテーマについては何百もの論文がある(最近の総説については、例えば[43,44,45,46,47,48,49,50,51]を参照)。Pavaniとその共同研究者は、β-サラセミアの治療におけるその使用を示した[52]。ウイルス性肝炎、肝細胞癌、遺伝性チロシン血症I型などの肝疾患の治療において、CRISPRに基づくアプローチの可能性について述べた研究がいくつか存在する(総説は[54])。このシステムは、ゲノムから染色体全体を特異的に除去するのにも使われている。Zuoと共同研究者[55]は、マウスの培養細胞、胚、組織からin vivoで性染色体を特異的に除去することが可能であること、またマウス細胞から14番や21番など世代を超えて安定的に伝達されるヒト染色体を除去することが可能であることを示した。この研究[55]は、CRISPR/Cas9を、染色体過剰によって引き起こされるヒトの異数性疾患の治療戦略として用いる可能性を示唆している。
マラリアのような害虫に由来する人間の病気を根絶するために、その媒介蚊、すなわち蚊を制御しようとする研究も引用して、このセクションを締めくくる[56]。これは人工的な「遺伝子ドライブ」の典型的なケースであり、世代を通じて伝播する確率を変化させることによって、特定の遺伝子(または遺伝子のセット)を集団に広める可能性である。この技術の可能性は、CRISPRの使用によって大幅に強化された。ヘテロ接合体において、野生型遺伝子を標的とし(切断し)、変異したコピーを鋳型としてそれを修復することが可能になったからである。結果として、変異遺伝子が子孫に伝達される確率は、メンデルの法則に従って予想される50%ではなく、ほぼ100%になる。このアプローチは、特定の突然変異をゲノム内に挿入し、それが自然に拡大するのを待つという問題を克服し(自然淘汰がそれを奪い去らなければ)、特定の集団、あるいは種全体を遺伝的に改変することを可能にする。しかし、この方法は、対象となる種のゲノムを世界中で永久的に改変する可能性、その種の生態系や関連する種の生態系に影響を与える可能性、対象となる遺伝子の操作によって起こりうる副作用をすべて予見することは不可能であること、そして種の絶滅を引き起こす可能性があることなど、多くの倫理的問題を提起している[57,58]。
1.2.ヒト胚改変の技術的リスク
まず第一に、研究目的でヒト胚を改変し、データ収集後に廃棄するのと、着床を許可するのとでは、根本的な違いがあることを強調する必要がある。どちらも大きな議論を呼ぶテーマだが、後者の可能性に反対する意見には一般的なコンセンサスがある。現在施行されている法律は、まだ十分に実施されていないものの、ほとんどの国でこのような行為を禁止している。
CRISPR-Casを用いたヒト胚の編集に関する最初の報告は、わずか5年前のものであり[59]、すでに誰かが指摘しているように、遺伝子治療のためのこのアプローチがまだ始まったばかりであることを示している[60,61]。にもかかわらず、CRISPRの可能性と使いやすさは、ヒトの遺伝子編集が、遺伝性疾患(メンデル病)、あるいは(特発性癌のように)新たに出現した突然変異によって引き起こされるヒトの遺伝性疾患の少なくとも一部を個人レベルで治療し、精密医療を実現する可能性を示唆している[62]。それは、疾患や感染症の素因となる野生型(wt)の標的遺伝子を欠失させる方法と、変異した遺伝子をwtのものと置き換える方法である。両アプローチの効率は、編集可能な体細胞の数に大きく依存する。そのため、対象となる細胞の数を大幅に減らすために、接合子や胚を非常に早い段階で操作する、あるいは配偶子に作用してモザイクを大幅に減らすというアイデアがある[63]。この実験がどのような結末を迎えたかは、すでに述べた通りである[64]。さらに、この実験の理論的、技術的、方法論的な落とし穴は、過去に広く分析されている[65]。明らかに、ほとんどの努力は2番目の方法、すなわちwt配列を復元することに基づいている。ヒト胚の改変にこれらの技術を用いることの倫理的・法的問題については、以下のセクションで広範に議論され、次世代に引き継ぐためにこの変更を回避する方法(「一世代生殖細胞系列治療」)を修正する可能性についても議論されてきた[66]。特に、一世代生殖細胞系列療法は、生殖細胞系列にはほとんど手をつけずに、体細胞系列で遺伝性疾患を治療できるため、有望である。簡単に言えば、1つの遺伝子テンプレートだけでなく、以下のモジュールを含むより複雑な導入遺伝子カセットを導入する:(i)選択されたプロモーターの制御下にある目的の遺伝子(例えば、生理的プロモーターの下にある変異遺伝子の野生型コピー)、(ii)生殖細胞系列特異的プロモーターの制御下にあるDNAリコンビナーゼ(Creなど)、(iii)リコンビナーゼによって認識される特異的なフランキング配列、(iv)上流プロモーターの影響を受けて、体細胞におけるリコンビナーゼ・プロモーターの望ましくない活性化を回避するインスレーター(シス作用性DNA配列)。ソーマでは、目的の遺伝子は選択したプロモーターに特異的な刺激下で活性化されるが、リコンビナーゼ遺伝子は沈黙を保ち、カセットはゲノムに安定に挿入され、細胞分裂を経て受け継がれる。その代わりに生殖細胞系列では、リコンビナーゼのプロモーターが活性化され、タンパク質がカセット全体の切断をフランキング配列(認識部位)で促進し、染色体の完全性を回復するDNA修復機構を刺激するが、カセットはなく、わずかなDNAフットプリント、すなわち修復された切断部位に数個のDNAヌクレオチドが追加されるだけである。フットプリントが健康上の問題を引き起こさない(であろう)特定の場所にカセットを挿入する可能性は、明らかに重要である。
オフターゲットCas9の作用の副産物として起こりうる微妙な変異や、モデル胚系[67,68]やヒト体細胞[69,70]における染色体変化を誘発する可能性だけでなく、全ゲノムの完全性に対する潜在的なリスクが、2020年に発表された少なくとも3つの報告で強調されており、ヒト胚治療におけるCRISPRの使用中に生じる可能性のある、大規模で予期せぬ核型の変化が起こり、深刻な健康問題を引き起こす可能性があることを示している。最初に取り上げるのは、Alanis-Lobatoとその共同研究者による報告である[71]。遺伝子編集は、母方の対立遺伝子によって駆動される相同組換え(IH-HR)を通して起こっていることを示唆する以前の研究[63]に基づき、著者らは6番染色体のpアームにあるPOU5F1遺伝子によってコードされる多能性因子OCT4をターゲットとして実験を再現しようとした。全体的に良好な結果(すなわち、wt対立遺伝子の復元)が得られたにもかかわらず、著者らは編集されたと思われる遺伝子のPCR増幅を得ることができなかった。詳細な解析の結果、対象となったサンプルのほぼ3分の1(8/25)が6番染色体に異常を示した。特に、POU5F1遺伝子座(p-arm)に隣接する染色体断片の分節的な欠損または増生、6番染色体の全体的な増生、q-armの分節的な増生を含む多様な再配列を同定することができた。さらに、ヘテロ接合性の消失(LOH)の検索も陽性であった。2番目の論文では、Zuccaroと共同研究者[72]が、胚におけるEYS遺伝子座(6q12にマッピングされ、網膜色素変性症に関連し、失明を引き起こす[73])の置換の結果を報告した。その出発点は、遺伝子のエクソン34に早発停止コドンを形成する遺伝子内欠失のホモ接合体である男性の精子を使用したことであり、卵子における相同染色体間のDSB(二本鎖切断)を介した組換えが極めて効率的で、母方の対立遺伝子を鋳型として優先的に使用するという事実を利用した[63]。実際、Zuccaroとその共同研究者らは、解析した20サンプルのうち17サンプルでwt遺伝子型が回復していることを発見した。これは、DSB修復における細胞型の違いか、染色体切断後の細胞の生存率の違いを示唆している。何が起こったのかをよりよく理解するために、著者らはいくつかの追加解析を行い、多くの場合、EYSのwtホモ接合遺伝子型は、6番染色体の周辺領域の同時LOHで達成されることを発見した。このLOHは、(i)6q腕の遠位欠損、(ii)6q腕の増加(その結果、父方遺伝子のコピー数が増加)、およびEYS遺伝子がフランキング配列から遠く離れたり、EYS遺伝子座の内側にブレークポイントが存在したりするために、EYS遺伝子の増幅や検出が不可能になるなどの、さまざまな6番染色体の総体的な分節再配列によって引き起こされた、(iv)父方の6番染色体の1本以上の増加。これは、受精時または2細胞期にCas9 RNPを注入した胚で、スクリーニングした20サンプル中19サンプルで発生した。結論として著者らは、彼らのシステム、すなわち発生の非常に早い段階において、父方の対立遺伝子の喪失は「一般的な結果」であり、これは効率的なホモログ間修復ではなく、異数性によって起こると書いている。興味深いことに、16番染色体が関与する染色体異常と異数体が追加で検出され、そのほとんどがモザイクの形であった。これらの結果を総合すると、ヒトの着床前胚におけるDNA修復経路は、他の細胞種とは異なる、あるいは異なる挙動を示す可能性が示唆される([72]では、MMEJ-microhomology-mediated end joining-経路の関与が示唆されている[74])。この論文では、核型の変化は示されていないが、CRISPRを介したDNA損傷の結果として広範な遺伝子転換が報告されている。さらにこの場合、著者らは着床前ヘテロ接合体胚を用い、家族性肥大型心筋症(HCM)に関与する14番染色体に位置するMYH7遺伝子のエクソン22のヘテロ接合体変異を用いて実験を行った。著者らは、この系におけるDNA損傷は主に遺伝子変換によって修復されることを指摘した。遺伝子変換はHDR(相同性指向性修復)の一形態で、外来性の相同配列を修復の鋳型として用いる。興味深いことに、HDRは通常、NHEJよりも細胞内での利用がはるかに少ない。それは、HDRがDNA複製後にのみ起こりうるのに対し、もう一方は細胞周期を通して作用しうるからでもある。古典的なHDRと遺伝子変換の主な違いは、鎖のアニーリング後、修復機構が鋳型のコピーを最初の鎖の侵入に使われたマイクロホモロジー領域を越えて伸長する可能性があることで、その結果、鋳型と侵入した鎖が同一になり(非クロスオーバー組換え)、その結果、数キロベース、場合によっては染色体アーム全体に及ぶLOHを引き起こす可能性がある。加えて、これらの細胞における染色体欠失の検索は陰性であり、この実験に関与する遺伝子転換メカニズムを確認し、「DSBの大部分(41.7%、50/120)は遺伝子転換によって解決される」ことを示している[75]。同様の結果が、MYBPC3とLDLRAP1の遺伝子座をターゲットにして得られた[75]。
Liangとその共同研究者[75]が得た結果は、以前の2つの研究[69,70]とは異なるものであった、LOHを主な出力とし、染色体欠失を伴わない場合と、欠失、重複、染色体喪失を含む核型変化を伴う場合。(i)胚は、CRISPR-Cas9操作によって、体細胞と比較してDNA損傷に対して異なる反応を示すが、この違いの理由はまだ解明されていない。(ii)この操作の結果は、いくつかの異なるタイプのゲノム損傷を含め、まだほとんど予測不可能であり、非常に多様である。このような理由から、体細胞編集に用いられるのと同じプロトコルを胚に用いることは、現在のところ望ましくないと考える。これらの結果を総合すると、CRISPR-Cas9を胚ゲノムの操作に使用することは反対である。なぜなら、まだ十分に解明されていないメカニズムによって、修復されずに残ったり、誤って修復されたりする可能性のあるDSBsが形成されるからであり、また広範なLOHによって卵ゲノムの中にさらなる劣性突然変異が見つかる可能性があるからである。DNA損傷を引き起こさない別の遺伝子編集法を選択することが望ましいであろう[76]。にもかかわらず、そのアプローチでさえ、さらなる試験と検証が必要である。

2.治療の安全性と有効性を超えて、ゲノム編集は倫理的・法的な難問に直面する
CRISPRに基づくゲノム操作技術に関する倫理的懸念は、様々な理由から生じている。第一に、限られたオンターゲット編集効率、モザイク[77]、不正確なオンターゲットまたはオフターゲット編集に起因するリスクなど、CRISPR技術の範囲と限界は、まだほとんど知られていない[78]。このような欠陥は、ヒト細胞株だけでなく、動物を用いたCRISPR実験でも証明されている。それでも、この技術が徐々に洗練され、完成されていくにつれて、そのような懸念は時間の経過とともに正当化されなくなるかもしれない。とはいえ、生物医学における倫理的に耐えうる意思決定は、リスク・ベネフィット比の徹底的な評価によって、経験則に基づいて行われる必要がある。そのためには、倫理的決定は、起こりうる結果、それぞれが顕在化する可能性、そして最終結果を決定する目的と可能な正当化の徹底的な分析に基づくものでなければならない。しかし、CRISPRゲノム操作技術に関しては、遺伝子編集された生物の将来について信頼できる予測を立てることが困難であることから、潜在的なリスクと利益を許容できる精度で評価することは極めて難しいかもしれない。改変された生物が無期限に影響を受けるのかどうか、また、編集された遺伝子が将来の世代に引き継がれ、予期せぬ形で影響を与える可能性があるのかどうか、どの程度引き継がれるのかは不明である。そのため、正確なリスク・ベネフィット分析は、技術的な制約だけでなく、生物学的システムに固有の複雑さによって、かなり複雑なものとなっている。
2.1.リスク・ベネフィット分析の徹底を阻む理解不足の現状
たとえゲノム編集が成功し、期待される機能的効果が適時に得られたとしても、遺伝情報と生物学的表現型は、まだ完全には解明されていない形で関連している、と批評家たちは指摘している。実際、遺伝的多面効果は、ヒトにおける表現型のばらつきの主要な原因となっている。したがって、CRISPR-Casシステムがどのような形で多面的効果をもたらすかは、遺伝子は疾患発症の顕著な原因因子として作用することを証明できたとはいえ、まだ未解明である。いくつかの疾患表現型は、多面的効果によって変化したり、あるいは消失したりする可能性があることを強調しておく価値がある[79]。したがって、生殖細胞や体細胞における遺伝子の編集は、予測できない生物学的結果をもたらす可能性がある。実際、多種多様な生物学的形質を決定するのは、多数の遺伝子の複雑な制御作用である。そのため、生物全体のレベルで生物学的表現型を「操作」することは極めて困難である[80]。言い換えれば、単一の遺伝子が複雑な生物学的形質を形成し、発達させる唯一の要因である可能性は極めて低い。生物学的表現型の出現は、実際には、環境因子やエピジェネティック因子、そして他のいくつかの遺伝的制御因子、例えば、追加の遺伝子や遠位制御因子(エンハンサーやリプレッサー要素など)によって決定される。そのため、表現型のインスタンス化に寄与する他の独立した変数を十分に理解することは、遺伝的修飾に加えて重要な要素である。とはいえ、このような理解は、多くの正常および疾患過程においては、まだ完全とは言い難い。遺伝子の発現や修飾が、複雑な生物学的結果にどのように影響し、それを促進するのかについては、いまだ不確実性が残っているため、徹底的なリスク・ベネフィット分析を行うことは困難である[81]。加えて、先に述べたように、CRISPR技術のヒト胚への応用の可能性によって、解決不可能と思われる倫理的・法的論争に火がついた[82]。このような論争は、ヒト胚そのものの地位について倫理学者や法学者の間でコンセンサスが得られていないために、さらに複雑なものとなっている[83,84]。科学界の多くが、14日以降のヒト胚に対する実験は倫理的に耐え難いものであると主張しているにもかかわらず、ヒト胚の地位と、それがいつ「人格」を獲得するかを決定するための共通の基盤を見出すことは、ほとんど不可能である[85,86]。これが、多くの国家が体外受精による医学的幇助による子作りを、程度の差こそあれ規制している根本的な理由である[87]。
2.2.胎児の地位に関する未解決の難問
もし胚に人格的地位が認められるのであれば、胚はその不可侵の人権を支持される権利がある。一方、胚をその中間、つまり人間未満だが単なる細胞の塊以上とみなすのであれば、胚にどのような道徳的権利が認められるべきなのだろうか。確かに、ヒト胚を編集するためにCRISPRを使用した最初の実験が2015年に行われ、それ以来、世界中でこのプロセスとその可能性に注目しているチームはわずかであることを指摘する人もいる[85]が、最近の研究では、CRISPR-Cas9編集の過小評価されているリスクが浮き彫りになっている。胚が少なくともある程度の法的保護措置を受ける権利を有するとみなされた場合、そのような安全性の懸念は、この問題に関する進行中の議論に大きな影響を与える可能性が高い。このような未解決の大きな論争を踏まえて、すべての胚編集の国際的なモラトリアムを求める声もあり[88,89]、カナダをはじめとするいくつかの国では、編集された胚が着床を意図しているか否かにかかわらず、ヒト胚の遺伝子編集を禁止する政策をすでにとっている[90]。一方、米国と英国では、中間的な規制アプローチが選択されている。米国食品医薬品局は、ヒトにおけるCRISPR/Cas9遺伝子編集のいかなる使用も遺伝子治療とみなしており、FDAの生物製剤評価研究センター(CBER)によって規制されている。そのため、ヒトを対象とした遺伝子治療の臨床研究は、米国で合法的に開始する前に治験新薬承認申請書(IND)を提出する必要がある。さらに、遺伝子治療製品の販売には生物製剤承認申請書(BLA)の提出と承認が必要である。このような要件や制限の結果、私的な資金で私的な研究室を運営し、非臨床のヒト遺伝子治療研究を行うことは違法ではない。しかし、そのような治療法を米国で販売するには、臨床試験と販売に関してFDAの承認が必要である。現在、連邦法により、FDAは操作されたヒト胚を含むいかなる申請も審査・承認することができない[91]。繰り返しになるが、研究目的の胚編集と、そのような編集胚の移植とは明確に区別する必要がある。例えばイギリスでは、着床を目的とした胚のゲノム編集の使用は禁止されているが、廃棄された体外受精胚の遺伝子編集は、その胚を直後に廃棄することを条件に合法である。胚の発生から14日以降、すなわち原始筋の出現以降のヒト胚の体外培養は禁止されている。このような禁止は、1990年と2008年のヒト受精・胚発生(HFE)法に明記されている[92]。イタリアでは、法律40/2004の特定の条項が、受精の瞬間から胚に権利があると認めている[93]。この法律は、胚自体の治療的・医学的状態の改善を特に目的としない限り、いかなる研究にも胚を使用することを禁止している[94,95]。批評家たちは、このような制限の背後にある明らかなパラドックスを指摘している。特に、放棄された超数値胚を単に廃棄するよりも、人類に利益をもたらす可能性のある研究目的のために使用する方が、間違いなく倫理的に持続可能であるという事実に照らすと、胚研究をこれほど早く中止することが要求されていることに、実際、混乱を覚える人もいるかもしれない。妊娠の合法的な中止は、女性が自分の体をコントロールし、選択する権利を支持する必要性から生じているが、体外胚の研究はそのような問題を含んでいない。胚の実験に関しては、このような中間的な規制アプローチは、生命倫理の戒律を守ることと、公益のために科学の進歩を促進することとのバランスをとるという目的のために、このような技術をどの程度厳しく規制すべきかについて、現在不確実であることを物語っている。それにもかかわらず、新しい生物医学技術を規制する枠組みが緩かったり、曖昧だったり、あるいは具体的でなかったりする国は、未検証の技術が利用可能になるような「破天荒」な科学的環境をもたらす懸念がある。ミトコンドリア置換療法(MRT)は、生殖細胞系列の治療法として用いられ、ミトコンドリア病の伝染を防ぎ、妊娠に成功する可能性を高めると信じられている。MRTは、その安全性がまだ疑わしいため、多くの国で禁止されているが、スペイン、アルバニア、ロシア、ウクライナ、イスラエルのクリニックがこの方法を提供していることが判明している[98]。とはいえ、個々の国がこのような技術をどのように規制するかは別として、科学者が遺伝病を予防するためにヒト胚の編集を行うべきかどうかという問題は、それ自体が議論の的となる。たとえ胚の実験が、胚自身や他の人々への潜在的な利益によって正当化されるとしても、胚は明らかにインフォームド・コンセントを行うことができない。その上、先に述べたように、倫理的戒律と法的規定の施行と実践は、石に刻まれ普遍的に認められているとは言い難い一連の概念と表裏一体の関係にある。したがって、人間の生命(胚であれ胎児であれ)が一人前の人間であるとみなされる時期は、医療、法律・政策立案、そしてすべての人間の個人の自律という不可侵の権利という重要な領域を包含する、広範囲に及ぶ影響を及ぼす[99]。文化的・倫理的にますます多様化する私たちの社会には、簡単な答えは存在しない。もしヒト胚を完全な人格を持つ人間とみなすのであれば、それは大きな意味を持つ。1995年に故教皇ヨハネ・パウロ二世が「ヒト胚を殺すことを目的としたいかなる介入も絶対的に明確に禁止することを正当化するには、ヒトが関与している可能性があるというだけで十分である」と述べたことは有名である[100]。このアプローチは、研究目的で編集された胚と、移植するために編集された胚を区別していない。逆に、カント、ロック、フレッチャーといった著名な哲学者たちは、自己認識、他者との関係能力、自己制御、合理性、記憶の使用などと密接に結びついた人格性を特定するための基準を示している[101,102,103,104]。一方、このような複雑な問題や一見相容れない見解があろうとも、ヒト胚の研究を禁止したり制限したりすることは、科学の進歩に水を差すことになり、現在治療不可能な病気を克服する治療法の開発を妨げる可能性があることは否定できない。それは、これまで報告されてきた懸念を凌駕する道徳的・倫理的要請ではないだろうか?繰り返すが、簡単な答えはない。

2.3.応用分野の拡大
神経変性疾患の治療を目指した初期の研究では、CRISPRを他の要素、例えば非病原性ウイルスと組み合わせて使用することで、あらゆるゲノム配列の標的特異性を向上させることも可能であることが示されている[105,106]。CRISPR-Cas9は、複数のガイドRNAとプールすることも可能であり、複数の遺伝子を一度に編集することができる。このガイドRNAのプールにより、DNAを切断するCas酵素をゲノムの様々な部分に導くことができる。プールされたガイドRNAを通して一度に複数の遺伝子を標的とすることは、全身的な影響、例えば治療に対する反応や代謝がどのように影響されるかを明らかにする上で、貴重であることが証明されるかもしれない[107,108]。幹細胞は無限に分裂することができ、胚に存在する220種 の細胞のどれでも生み出すことができる。また、胚外細胞 (胎盤など)や多能性細胞(胎盤を除く全身の細胞を生み出すこ とができる)の生物学的性質も研究されている[109,110]。実際、全能性細胞と多能性細胞は、胚以外の生存可能なヒトの組織 源には存在しない。実際、受精後最初の数回の細胞分裂を経た胚細胞だけが、受精卵の初期細胞に由来する全能性細胞であり、多能性細胞は胚盤胞の内部細胞塊に見られる[111,112]。現在のパンデミックシナリオにおいて、CRISPR/Cas9は、遺伝子治療から、HIVやSARS-Cov-2そのもののような特定のウイルス感染に対する免疫学的応答の誘導に至るまで、ヒト人工多能性幹細胞(hiPSC)への応用の可能性があることが、研究により見出されている[113]。SARS-Cov-2研究を含む、抗ウイルス反応におけるCRISPR/Cas9とhiPSCの応用の可能性は、ヒトの肺を複製することを意図した試験プラットフォームを中心に、野生型(WT)-hiPSCをII型肺細胞に分化させ[114]、SARS-Cov-2感染を複製できる偽ウイルスで処理する[115]。特にSARS-Cov-2のような変異を起こしやすいウイルスに関する限り、治療への応用の将来的な見通しはまだ決定的とはいえないが、ウイルス感染から身を守ったり感染しやすくしたりする多型を導入することに加えて、ウイルス活性に関与する遺伝子の抑制やアップレギュレーションに遺伝子編集を活用できる可能性があることは確かである[116]。さらに、編集を受けた細胞は、感染と闘うための多くの化合物の能力を試験するために使用することができる。最近、CRISPR/Cas9によってウイルスRNAを標的にする、かなり多用途で明らかに効果的なアプローチが考案された。研究者たちは、SARS-CoV-2のRNAゲノムを特異的に用いて、その繁殖能力を抑制する可能性を検討している。この見通しは、急速に耐性を発達させる能力を持ち、医療システムの麻痺や医療提供における倫理的な問題といった悲劇的な結果を生む、進化の速いウイルスに効果的に対処する大きなチャンスへの道を開く可能性がある[117,118]。上記のような治療応用の事例を考慮すると、公衆衛生のために、生命倫理の戒律と科学研究のニーズや急速に発展する力学との間でバランスをとることがなぜそれほど不可欠なのかを理解するのは難しくない。その一方で、huMAN細胞における予防的抗ウイルスCRISPR(PAC-MAN)のような技術の道には、まだいくつかの障害が横たわっている。このような方法は、標的RNA分解によるウイルス遺伝子発現阻害を目的として、CRISPR-Cas13dによってヒト細胞内のRNAウイルスを阻害できることが研究で示されている。CRISPRの構成要素が大きすぎて標的細胞に入りにくいため、確実に効果的な送達メカニズムがないことが、このアプローチの難点である。実際、CRISPRの送達システムとして使用される合成分子であるリピトイドの開発という点では進歩が見られる[119]。それでもなお、PAC-MAN[120]のような臨床的に実行可能なCRISPRベースの潜在的治療オプションは、精度、適用性、コストの点で、主流の治療使用にはまだ程遠く、現在のシナリオでは実現可能な解決策とは言い難い。
3.「治療」と「強化」の境界線が曖昧になるとき
ゲノム編集技術には間違いなく治療的価値があり、不治の病に対する新たな治療法を提供するという点で大きな期待が持てることから、著名な生命倫理学者たちは、倫理的に望ましい可能性さえあると指摘し、これを提唱している[121,122]。事実、遺伝子編集技術によって、生殖補助医療で破棄される胚の数が減る可能性さえある。現時点では、遺伝性疾患の保因者が同じ疾患を持たない子供を持とうとする場合、その保因者は、その疾患の影響を受けない胚を選択する目的で、体外受精と着床前遺伝子診断(PGD)に頼ることが多い。それでもなお、体外受精はしばしば、望まれない胚を相当数作り出し、たとえ生存可能であったとしても、最終的には破棄されることを肝に銘じておくべきである。もし安全で効果的な遺伝子編集技術がすべての人に利用できるようになれば、このような倫理的に好ましくない行為は時代遅れになるだろう。実際、遺伝性疾患の保因者は、例えば嚢胞性線維症や鎌状赤血球貧血のような常染色体劣性単発性疾患の原因である常染色体劣性突然変異[123] のような、両親が保因者である遺伝的疾患に罹患していない子供を作ることを可能にするために、大量の余剰胚を生産する必要がなくなるであろう[124,125]。しかしながら、このような理論的な利点が最終的に達成不可能になるような害、オフターゲット効果、あるいは誤った編集の可能性を考えると、このような将来的な応用の実現可能性には疑問が持たれている[126]。さらに、遺伝子編集がPGDに取って代わる可能性は低く、胚の選別と同様に胚の検査が常に必要となるからである。生殖細胞系列ゲノム編集の悪影響から生じるリスクを最小化するために、実際には編集介入後も検査を実施しなければならない。したがって、編集技術がまだ100%正確にはほど遠い限り、介入後であっても胚は再び廃棄されるかもしれない[127]。米国科学アカデミー(NAS)が2020年に発表した報告書で述べているように、実際、現在利用可能な編集技術も、起こりうる標的外影響を抑制することを目的とした胚DNAの塩基配列決定も、まだ十分に信頼できるものではない。主な要因としては、疾患の性質や重症度、遺伝子型と表現型の相関関係に対する認識、出生前遺伝学的検査(PGT)や非侵襲的遺伝学的診断(NIPT)など、すでに述べた代替手段が利用可能であることなどが挙げられる[128]。遺伝可能なヒト生殖細胞系列編集のすべての可能な応用が、責任ある翻訳経路に依存できるわけではないため、徹底的なリスク-ベネフィット分析は、病気の重症度、カップルの遺伝的状況、病気の遺伝様式、提案された配列変更の性質、および代替手段の利用可能性といった、評価を行う必要のある複数の複雑な変数にかかっている[129]。しかし、治療的な可能性以外では、遺伝子編集の倫理に関する徹底的な議論から、生物医学的な強化を目的とした応用の可能性という、あまりにも関連性の高い側面を省くことはできない。現在、認知機能および/または身体的パフォーマンスを強化するための主な手段は、薬理学的なものである。薬理学的認知機能強化とは、健康な人がパフォーマンスを増強するために、適応外の薬物やサプリメントを使用することを指す。このような薬物は、向精神薬または「スマートドラッグ」と呼ばれる。向精神薬の使用は、レクリエーション目的の使用者だけでなく、専門家や学生にも普遍的であり、ますます普及している[130,131,132] 。最も普及している物質としては、メチルフェニデート[133]、フルオキセチン、シルデナフィル[134,135]がある。薬理学的増強剤は、規制当局や政策立案者にとってすでに重大かつ差し迫った課題となっているが、ゲノム編集技術を使用してまだ生まれていないヒトの能力を増強すれば、その課題はさらに深刻化するだろう。したがって、このような介入を通じて、第三者の希望や決定に従って、個々の形質や特性が妊娠中に選択される可能性がある。それは一種の「生殖細胞系列遺伝子の強化」、すなわち人間の身体と精神の限界を克服することに相当し、健康の回復や維持を意味する治療的使用をはるかに超えるものである[136]。ヒトの生物学を完全にコントロールするという夢(反対派に言わせれば悪夢)はまだ遠いかもしれないが、遺伝子編集研究はすでに大きな進歩を遂げている[137,138]。批評家たちは、このアプローチが、こうした技術やその社会実装の倫理的、社会的、法的な意味合いについての考察の必要性を生み出すことに懸念を表明している。数十年前、体外受精(IVF)は多くの人々から「不自然」であるとか、男性に属さない特権を奪っているとして厳しく批判された[139,140,141]。体外受精の技術は、親になることが可能な期間を延長することができる妊孕性温存の方法と同様に、道徳的・倫理的にいまだに論争があり、しばしば制限されている[142,143,144,145]。

3.1.エンハンスメントは危険な道に向かっているのか?
このような技術は潜在的に多大な利益をもたらす可能性があるにもかかわらず、反対派は遺伝子編集に基づく機能強化を優生学になぞらえるとまで言っている。優生学は、ダーウィンの自然淘汰に基づく功利主義哲学の教訓に根ざしている。そのおかげで、優生主義者たちは、一般的に中流階級や上流階級に属する「適性」とみなされた人々に大家族を持つことを奨励し、一方、「不適性」とみなされた困窮者は繁殖を控えるようにした。20世紀にかけて、精神的または身体的な適性に基づいて道徳的価値を判断することは、強制不妊手術、安楽死、大量虐殺といった、おぞましい規模の残虐行為につながることが明らかになった[146]。19世紀後半から優生学は、アメリカ(ロックフェラー財団、カーネギー財団、フォード財団が積極的に優生学研究に資金を提供していたことは言うまでもない)からイギリス、ドイツ、スウェーデンに至るまで、西側諸国で提唱されていたが、このような倫理的にも科学的にも弁解の余地のない考え方は、最終的には愚行として暴かれ、当然のことながら否定された。しかし現在では、人間強化の著名な支持者には、たとえ遺伝子レベルであっても、人間の能力を増大させるという願望は、確かな科学、個人の同意、自己を向上させるという決意に基づくものであり、したがって強制の要素は一切なく[147]、可能な限り最良の子どもを生み出すという道徳的義務さえ存在すると主張する学者や哲学者がいる[148]。これは哲学的に複雑で論争の的となる枠組みであり[149]、能力または「望ましい」属性に基づいて人間的価値の程度を規定することになり、おそらくは障害者や恵まれない人々に対してより低い道徳的価値を課すことになるため、私たちの見解では否定されるべきである[150,151,152]。そのような目的を追求する「義務」とされるものは、トランスヒューマニストの教義の不可欠な部分であり、その信奉者たちは、非治療的な遺伝子編集や、強化目的のためのその他の新しく出現した技術を信奉している[153]。事実、トランスヒューマニストは生殖細胞系列や強化遺伝子治療の望ましさと必然性を受け入れており、同時に研究への公的融資と安全性を確保するための規制プロセスを求めている[154]。生殖技術に適用されるゲノム編集の倫理的な実現可能性を検討する際には、まだ生まれていない胚の「道徳的義務的な」強化という考え方のような極端なものは別として、3つの側面が定義され、特定されるべきであるというのが私たちの見解である。実際、遺伝子の強化が、胚や新生児のような特に脆弱で自律性を持たない個人のアイデンティティ、尊厳、善良な生涯といった不可侵の人権に影響を与える可能性があることは否定できない[155]。結局のところ、第2回ヒトゲノム編集に関する国際サミット[156]で指摘されたように、生殖細胞系列ゲノム編集のリスクとベネフィットはまだ十分に理解・解明されておらず、少なくとも生殖細胞系列ゲノム編集の実施を認めるには至っていない。とはいえ、拡大する科学的理解と最近の研究は、将来の臨床利用のためのバランスの取れた道筋の輪郭を描き始める時期に来ているのかもしれないと指摘しているようである[157]。というのも、生殖細胞系列ゲノム編集の実行可能で一貫性のある臨床経路を定義することは、時間の経過とともに、臨床倫理と私たちの文明が築かれている核となる価値観の両方に違反するような無責任な行為を防ぐために、道徳的に必要不可欠なものとなりうるからである。
3.2.遺伝子ドライブ:環境と生態系への潜在的脅威?
前述したように、CRISPRはヒトへの治療応用に加え、動物[158]、昆虫[159]、植物[160]、微生物[161]の改変にも既に使用されている。例えば、野兎病の原因菌であるFrancisella tularensisの非公式な第4亜種であるFrancisella novicida(FnCas9)由来の新しい2型CRISPRシステムの特徴付けが最近行われた。具体的には、FnCas9は、非相同末端結合を介するDNA修復だけでなく、相同性指向性修復(HDR)を指示し、HDRの割合が高く、オフターゲッティングが極めて少ないことが判明している。意図した標的への結合という点では、かなり高度な特異性が示されており、ゲノム編集技術の視野がさらに大きく広がることを示している[163]。このような利用は、このような文脈において新たな倫理的問題を生じないように見えるかもしれないが、CRISPRが遺伝子組換え生物(GMO)の作製と公開を管理する規制に反する可能性があるという現実的なリスクは存在する。改変された生物を作り出すことは、その媒介者や侵入種を排除することによって、感染症を根絶する可能性があるという点で価値があるかもしれない[164]。2014年、EsveltたちはCRISPR/Cas9を利用してエンドヌクレアーゼ遺伝子ドライブを構築できることを示唆し[165]、その後すぐに、サッカロミセス[166]、ショウジョウバエ[167]、蚊[168]におけるCRISPRベースの遺伝子ドライブの工学的成功に関する研究が発表された。4つの研究全てによって、将来の世代にわたって効率的に遺伝の歪みが発見されている。さらに最近の実験では、CRISPR/Cas9ベースの遺伝子ドライブが、酵母、ミバエ、蚊の実験室個体群のほぼ全てに標的遺伝子を拡散できることが実証されている[169]。このような研究の顕著な例としては、デング熱を蔓延させるイエネコや、原虫を媒介するアノフェレス亜種[170,171]が挙げられる[172,173]。バイオテクノロジーの研究者たちは、病気を媒介できないようにしたり、オスの蚊に不妊症を誘発したり、子孫の寿命を縮めたりすることを究極の目的として、蚊を編集することによって病気の伝染を食い止めることを目的とした「遺伝子ドライブ」に頼っている[174]。このような方法は、致命的な病気(マラリアは2018年に2億2,800万人を襲い、40万人以上の死者を出している[175])を根絶する上で非常に有用であることが証明される可能性があるが、環境に有害な結果をもたらし、種全体の絶滅を引き起こす可能性があるとの懸念が表明されている。遺伝子操作は、編集した形質を遺伝させることができる強力なツールである。それゆえ、環境中に放出された遺伝子組み換え生物は野生型の交配相手を見つけ、その子孫は50%の確率で組み換え遺伝子を受け継ぐと推定されている[176]。とはいえ、このような危惧(と期待)は、確かな実証的研究や分析よりも、むしろ逸話的で憶測的な理論に基づくものが多く、誇張されすぎているように思われる。このような技術の進歩はともかく、それがどれほど危険で有望なものであるかはまだ証明されていない。編集された蚊やその他の害虫が少量導入されただけでは大きな影響は生じそうにないが、遺伝子操作は、CRISPRによって一方の染色体に生じた変異を相手の染色体にコピーし、編集されたゲノムを次世代に引き継ぐことが可能である[177]。このような動態は、様々な感染症の感染率を大幅に制限するのに役立つ可能性があるが、遺伝子ドライブは環境と生態系にかなりのリスクを伴う。実際、十分な封じ込めメカニズムがなければ、種全体を滅亡させたり[178,179]、食物連鎖を混乱させたり、侵入種の無秩序な増殖と拡散を招いたりする可能性がある[180,181,182]。したがって、CRISPRで改変された生物種を制御しようとする試みを妨げたり、複雑にしたりする可能性のある知識のギャップを特定することが最も重要である。個体群内の遺伝子ドライブをモデル化する試みがなされてきたとはいえ[184]、そのような評価が複雑で極めて動的な生態系を包含することは非常に困難である[185,186]。生態系や生物多様性に対するこのようなリスクや潜在的脅威に対処するため、「デイジーチェーン・ドライブ」と呼ばれるCRISPRベースの遺伝子ドライブの自己消尽型[187,188]によって、空間や範囲が限定された可逆的な改変を実現するために、遺伝子ドライブを可逆的にする方法が研究されてきた[189]。
3.3.CRISPRは潜在的なバイオセキュリティーハザードとみなすべきか?
2017年、米国国防高等研究計画局(DARPA)の「安全な遺伝子(Safe Genes)」プログラムは、遺伝子ドライブを制御、対抗、逆転させる方法に関する研究に資金を提供するため、6,500万米ドルの割り当てを発表した[190,191]。すなわち、生物に適用されるゲノム編集を空間的、時間的、可逆的に制御する技術の開発、生物のゲノム編集を食い止めたり抑制したりし、集団のゲノム背景を維持するための実行可能な予防的および治療的解決策を生み出すことを目的とした分子的対抗策、望ましくない編集遺伝子を生態系から根絶し、遺伝的ベースライン状態に戻す能力である。これらの強力な技術の開発は、安全性と責任ある方法で達成される進歩を優先する厳格な倫理的枠組みの中で展開され、進歩しなければならないことが強調されている[192]。安全な遺伝子プログラムのDARPAプログラムマネージャーは、ゲノム編集を制御、抑制、あるいは逆行させる手段や技術を「自動車のブレーキ」に例えている。同マネージャーはさらに、「ゲノム配列決定と遺伝子編集ツールキットのコストが急落し、この技術へのアクセスが容易になった」ことで、遺伝子改変を試す機会がさらに増えたと述べた。加えて、この低コストと高い利用可能性の収束は、遺伝子編集の応用が、肯定的なものであれ否定的なものであれ、伝統的な科学界の範囲や監督の外で活動する個人や国家機関から生じうることを意味する[193]。このような発言の倫理的意味合いは、このような技術が紛れもなく持っている可能性に照らすと、非常に驚くべきものである。実際、CRISPRは正確にはデュアルユース技術と見なすことができる。医学、科学、公衆衛生に幅広い潜在的利益をもたらすが、悪意を持って使用される可能性もある。米国国防総省の要請を受けた米国科学・工学・医学アカデミーによる2018年の報告書[194]で指摘されているように、バイオテクノロジーが研究・開発され続けることは極めて重要であるが、同時に、同様に重要なこととして、科学的・公共的領域におけるその革新的な応用は、特に的を絞った評価の枠組みを通じて徹底的に評価されるべきである。報告書では、既知の病原体(天然痘など)の再創造が最も深刻な懸念事項のひとつであるのに対し、新たな病原体の創造はリスクが低いとされている。実際のところ、CRISPRを使えば、ある病原体を編集して別の病原体の病原性を獲得することが可能になるかもしれないし、ゲノムが公開されている既知の病原体を不正な科学者が複製できるようになるかもしれない。CRISPRの悪用は、バイオセキュリティーに対する真の脅威となる可能性があることを認識すべきである。国家レベルでのこのような監視努力がどれほど効果的であるかは、まだわからない。確かに、誤用のリスクをゼロに近づけるための銀の弾丸のような解決策は存在しない[195]。この事実を認識すれば、遺伝子組み換え作物の試験と環境放出に関する基準を定めることを目的とした、的を絞った世界共通の規制の必要性がどれほど急務であるかが、より明確になる。このような革新的な応用は、現在の国内および国際的な規制、特にガイダンスと監視という点で、実際には十分に管理されていない。このような欠点は、遺伝子編集や遺伝子組み換え作物の安全性や実行可能性、またそのような技術を監督する役割を担う規制機関や規制団体に対する国民の不信を招く可能性が高い。この点に関する主な懸念のひとつは、遺伝子組み換え作物に対する国民の誤解と不信が、科学の進歩とCRISPRの非常に有益な応用を妨げることである。このようなCRISPRの応用に関する規制や研究倫理を十分に検討し、計画し、そして何よりも正しく理解することは、少なくとも共通の価値観を持つ国々が共有できるヒト生殖細胞系列編集の倫理的枠組みを構築する上で、大いに役立つはずである。
3.4.規制の枠組みを共有するために?
したがって、遺伝子編集に適用される共通の基準は、これまで以上に不可欠であり、研究倫理は、ある手順によって個々に影響を受ける人々からインフォームド・コンセントを得るという骨の折れるプロセスに基づく必要があるという認識に基づいている必要がある。しかし、遺伝子編集や遺伝子操作の研究は、まだ生まれてもいない生物、あるいは環境や生態系を改変することを目的としている。したがって、これらの領域における倫理に基づく研究とイノベーションの礎は、人権条約や条約に謳われている基本的な教訓に沿った、広義の研究のカテゴリーに適用される基本的な価値観に基づくものでなければならない。人権の本質は間違いなく、身体的な幸福と自律の観点から国民の権利を擁護し、健全な生活環境に依存できるようにする国家の義務の両方からなる。国連の世界人権宣言が基づいているのは、結局のところ、人間の尊厳という概念そのものなのである[196]。ゲノム編集が規制される道徳的・倫理的羅針盤を更新する目的で、国内および国際的な科学機関によるガイドラインや勧告が、貴重な参照枠として活用されなければならない。その目的のために、すでに述べたNASによる最近の分析は、遺伝子編集の最も議論を呼ぶ形態である遺伝性ヒトゲノム編集の段階的かつ監視された発展のための貴重な指針を概説している[129]。具体的には、劇的で非常に重大なブレークスルーは、安全性を優先して規制される必要がある。もちろんそのためには、徹底したリスク・ベネフィット分析に基づいて、比較的少数の初期症例を極めて慎重に選択することが必要であり、さらなる処置が許可される前に、初期の結果が見直され、評価されなければならない。さらに、手技の有効性に関して高度な不確実性が存在する場合、介入は、死亡率および/または罹患率が高く、代替手段がない臨床状態に苦しんでいる患者に焦点を当てる必要がある。このような基準を遵守することは、潜在的な有害性と有益性の最も正確な評価に沿うものであり、このような技術のヒトへの応用が、倫理的に十分なインフォームド・コンセントのプロセスを経て提供されることを保証するものである。前述したように、遺伝性のヒトゲノム編集は、その技術の結果として生まれるであろう個人の将来の存在に影響を与えるが、明らかに同意を与えることはできない。第二に、生殖細胞系列編集は、将来の世代に遺伝する可能性のある遺伝的変化をもたらす。これらの点から、解決策と基準を共有する必要性は、実現がいかに困難であろうとも、より緊急性を帯びている。このような視点は、体細胞であれ生殖細胞であれ、ヒトゲノム編集に関連する科学的、倫理的、社会的、法的な課題を掘り下げることを目的とした世界的な学際的専門家パネルである「ヒトゲノム編集のガバナンスと監視のためのグローバル基準の策定に関する世界保健機関(WHO)専門家諮問委員会」が発表した3つの報告書によってすでに強調されていた[197]。2019年3月18~19日に初会合を開催したWHO委員会は、体細胞ヒトゲノム編集介入のための適切なトランスレーショナル・パスウェイを概説し成文化した国はまだ比較的少なく、患者の安全性と国民の信頼を目的としたバランスのとれた強制力のある規制と監視機構に依存していると指摘した。したがって、WHOの専門家作業部会が設定した優先課題は、透明性と信頼性の高い実践を促進する最善の方法について理解と認識を深め、いかなる決定と認可も、NASの検討事項との明白な一致のもと、適切なリスク/ベネフィット評価に基づくことを確認することであった。
4.結論 テクノロジーが規制ガバナンスを凌駕する時、ハーモナイゼーションが鍵となるかもしれない。
私たちの社会が深く抱いている核心的価値観に疑問を投げかけるような、潜在的に革命的なテクノロジーと同様、ゲノム編集もまた、困難な試練を伴うに違いない。倫理的に複雑で、一見相容れないように見える要素も、すべての関係者の権利を守ることを目的としたバランスの取れた法的・規制的アプローチを通じて対処する必要がある。
その見通しは、広範なリスク・ベネフィット分析に頼らざるを得ない。いくつかの国際法が、このような研究を厳しく制限または禁止したり、十分な資金を提供することを妨げていることを考慮すると、これを達成することは現在困難である。ベネフィットとリスクに関する信頼できるデータはほとんど入手できない。
政府がこのような制限を設ける理由を再考し、それが本当に正当なものであり、単に恐怖に根ざしたものでないことを確認することが最も重要である。同時に、ヒト以外の生物へのCRISPRの応用は、生物学的脅威をもたらす可能性があることを見過ごすことはできない。生殖細胞系列の改変が個人と社会にとって極めて重要であることは、まだ公に議論されていない。
しかし、学際的な議論によって、政策立案者、資金提供者、研究機関、利用者が、ある技術の適切な応用と、不適切、耐え難い、あるいは危険な応用との区別を、確実かつ効率的につけることができるようになる。今後、前述のような倫理的な複雑性に対処するための最善の方法を決定する組織の設立を支持する声も多い。ヒトゲノム編集に関する国際サミットのようなイニシアチブは、少なくとも核となる価値観の共通の枠組みに基づく国家間で、中間地点と共有される解決策を見出すという究極の目標に向けた一歩である。
資金調達
この研究は外部資金援助を受けていない。
利益相反
著者らは利益相反がないことを表明している。
脚注
出版社からの注記:MDPIは出版された地図や所属機関の管轄権の主張に関しては中立を保ちます。

