Contents
コロナウイルス メモ書き
概説
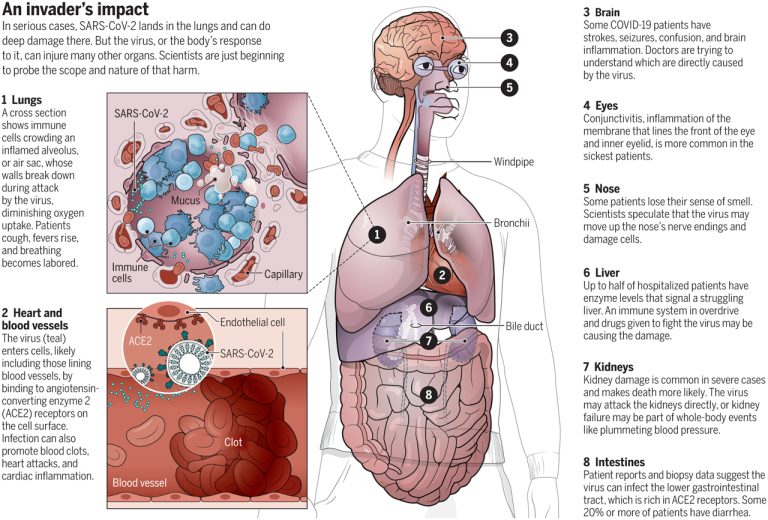
SARS-Cov2ウイルス感染の呼吸器系以外への損傷に関する現在の理解、体系的な検討 (消化器系、泌尿生殖器系、中枢神経系、循環器系)
www.sciencedirect.com/science/article/pii/S0753332220303875
COVID-19と内分泌系:未踏の領域を探る
link.springer.com/article/10.1007%2Fs40618-020-01276-8
膵臓
ACE2 は膵臓で発現し、mRNA レベルは肺よりも膵臓の方が高い。発現は膵島と同様に外分泌膵臓で見られます。外分泌膵障害は、非重症および重症のCOVID-19患者の1-2%および17%で、それぞれ血清アミラーゼおよび/またはリパーゼの上昇として発現します[2]。
どんな大きな病気でもストレスに関連した高血糖と関連する可能性がありますが、Yangらは、グルココルチコイドの投与を受けたことのないSARS(SARS-CoV、SARS-CoV-2の「いとこ」が原因)患者は、非SARS肺炎患者と比較して、空腹時血糖値が有意に高いことを報告しています
生殖腺
精巣ではACE2の発現が高く、精巣におけるACE2のmRNAとタンパク質の発現量は、人体の中で最も高いレベルにあります。さらに、ライディッヒ細胞、セルトリ細胞、精巣はすべてACE2を発現しています。
それにもかかわらず、COVID-19の血清テストステロンレベルは慎重に解釈する必要があります。なぜなら、いかなる急性重篤な病気でも視床下部-下垂体-精巣軸の抑制を引き起こし、生化学的に黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、テストステロンの低下として現れるからです。
しかし、COVID-19の男性81人を対象とした最近の研究では、年齢をマッチさせた健康な男性100人と比較して、血清総テストステロン(T)が低い(統計的には有意ではないが)一方で、血清LHが有意に高いことが示された。
血清T:LH比もCOVID-19患者では有意に低く、疾患の重症度と負の関係があった[18]。COVID-19の男性における血清LHの上昇は、視床下部-下垂体-精巣軸の抑制の可能性を否定し、原発性ライディッヒ細胞障害の可能性を示唆している。この観察によれば、SARSの合併症として睾丸炎が知られていたことに注目すべきである[19]。さらに、SARS-CoV感染は、雄マウスの血清テストステロンを有意に減少させることが示された[20]。
副腎
インフルエンザウイルスと同様に、SARS-CoVによって利用される主要な免疫侵襲戦略の一つは、宿主のコルチゾールストレス応答をノックダウンすることである。非常に興味深い仮説として提案されていたのは、宿主の副腎皮質刺激ホルモン(ACTH)の分子模倣である特定のアミノ酸配列がSARS-CoVによって発現しているということです。
このような分子模倣は、ウイルス粒子に対して産生された抗体が循環するACTHを不用意に破壊するため、ストレス誘発性コルチゾールの上昇を実際に鈍らせることができる[21]。SARS-CoV-2の蛋白質のほとんどが元のSARS-CoVの蛋白質と非常に相同性が高い(95~100%)という事実から、SARS-CoV-2も同様に分子模倣の戦略を採用しているのではないかと考えられる[22]。
したがって、重度のCOVID-19を有する患者は、重篤な疾患に関連したコルチコステロイド不全(CIRCI)を発症しやすいかもしれない。しかし、COVID-19患者のコルチゾール動態に関するデータはまだ得られていない。それにもかかわらず、臨床家はCOVID-19患者における相対的なコルチゾール欠乏の可能性に注意しなければならない。
特筆すべきは、SARS発生時に短時間、高用量のグルココルチコイドを無差別に使用したことが疑問視されており、普遍的に有用であるとは認められていないことである。COVID-19患者31人を対象とした最近の研究では、コルチコステロイド治療はウイルスクリアランス時間、入院期間、症状の持続時間とは関連していないことが示された [23]。
COVID-19におけるコルチコステロイドの有効性と安全性に関する別の臨床試験が現在進行中である(NCT04273321)。それにもかかわらず、原発性副腎不全(PAI)の患者は下気道感染症のリスクが高いため、現在進行中のパンデミックの中で特別な予防措置をとるべきである。
副腎の危機を避けるために、COVID-19の疑いがある場合には、病欠日ガイドラインに注意し、副腎皮質ステロイドの投与量を自分で増やすべきである。COVID-19を発症しているPAI患者は、グルココルチコイドの非経口投与を必要とすることがある;COVID-19患者では低カリウム血症が報告されているので、血清カリウムは厳密にモニターされるべきである[8]。
視床下部-下垂体
COVID-19患者では神経学的症状が発現し、特に低汗症が含まれる。嗅上皮支持細胞によるACE2の発現が、これらの嗅覚症状の多くを説明している可能性がある [24]。中枢神経系(CNS)へのウイルスの侵入経路は不明のままであり、血行性経路を経由するか、あるいは直接篩状板を経由するかのどちらかである。
視床下部および下垂体組織はACE2を発現しており、理論的にはウイルスの標的となりうる。実際、剖検調査では、視床下部で浮腫と神経細胞の変性、およびSARSゲノムの同定が示されています。
SARSにおける視床下部-下垂体の関与を示す生化学的証拠は、2005年にLeowらによって初めて報告された。SARS生存者61人を回復後3ヵ月およびその後も定期的に評価した。
患者の40%に中枢性低コルチゾール症の証拠が認められ、その大部分(62.5%)は1年以内に消失した。特筆すべきは、中心性低コルチゾール症を有する患者の87.5%が、最初の募集時に疲労および/または姿勢のめまいを経験していたことである。
少数の患者(5%)は中枢性甲状腺機能低下症も有していた。著者らは、可逆性の甲状腺機能低下症や直接視床下部の損傷により、視床下部-下垂体機能障害の状態になっている可能性を提案していた[25]。現在のところ、COVID-19の患者についてはそのようなデータはないが、神経症状の頻度が高いことから、SARS-CoV-2は視床下部-下垂体にも直接または免疫介在性下垂体炎を介して影響を及ぼす可能性があると考えられる。
したがって、臨床家はCOVID-19生存者、特に原因不明の疲労、倦怠感、倦怠感、倦怠感、起立性めまい、食欲不振および無気力を訴えている患者では、中枢性低コルチゾール症を疑う閾値を低くすべきである。
下垂体-視床下部障害を有する患者は、しばしば基礎となる多汗症(DI)を有している;多汗症患者におけるCOVID-19は、発熱およびタキプネアによる不可逆性の水分喪失を引き起こし、最終的には高ナトリウム血症を引き起こす可能性がある [26]。したがって、患者と治療担当医はこの点に注意する必要がある。
甲状腺
コロナウイルスによる甲状腺の関与に関するデータは最も少ない。2003年のSARS発生時に行われた研究では、SARS患者の血清T3とT4のレベルが対照群に比べて急性期と回復期の両方で低かったことが報告されている。これは単に、基礎となる副甲状腺機能不全症候群を示唆している可能性がある。
甲状腺機能不全症候群の集中治療患者は、コロイドの枯渇に伴う甲状腺濾胞サイズの減少の結果、平均甲状腺重量が低下する傾向がある [27]。しかし、SARS患者5人の剖検研究では、甲状腺の濾胞細胞と傍濾胞細胞の著しい破壊が示されている[28]。濾胞細胞の破壊はT3とT4の低下として現れ、傍濾胞細胞の損傷は理論的には血清カルシトニンの低下につながる。これは、回復したSARS患者に見られる大腿骨頭の骨壊死のもっともらしいメカニズムとして提案されている;カルシトニンの欠乏は破骨細胞の阻害を引き起こし、骨壊死を引き起こす [28]。
甲状腺機能または甲状腺病理に関するデータは、COVID-19ではまだ得られていない。英国甲状腺協会と内分泌学会(BTA/SfE)は、COVID-19パンデミック時の甲状腺機能障害に特有の問題に関するコンセンサス声明を発表している。基礎となる甲状腺機能低下症または甲状腺機能亢進症の患者には、通常通り処方された薬を継続することが推奨される。しかし、抗甲状腺薬(ATD)を服用している患者は、まれではありますが、無顆粒球症のリスクがあります。
無顆粒球症の症状はCOVID-19の症状と重なることが多く、臨床的に両者を鑑別することは困難である。したがって、無顆粒球症を示唆する症状が発現したATD患者は、直ちに本剤を中止し、早急に全血球検査を受けることが推奨される。
腎障害

重複感染

筋肉痛
せん妄
せん妄は、初期の研究では、COVID-19の患者の20~30%で示され、全年齢層の重症患者では60~70%で、入院中にせん妄や精神状態の変化を示す。 現在の診断のガイドラインには、日常的なせん妄が含まれておらず、検出不足につながる可能性がある。
academic.oup.com/ageing/advance-article/doi/10.1093/ageing/afaa094/5831131
造血
pubmed.ncbi.nlm.nih.gov/32394689/
局所造血性骨髄(BM)レニナンジオテンシン系(RAS)の存在
ホジキン病のリンパ節のリンパ腫関連マクロファージにおけるACEの発現亢進は、局所RASに関して以前に実証されている。
皮膚病変
皮膚病変は、おそらく健康な個人の皮膚血管の免疫学的応答が原因であり、COVID-19感染の晩期症状を表すと考えられる。高齢の急性COVID-19陽性患者に同様の兆候がないことは、この仮定を裏付けるものである。
onlinelibrary.wiley.com/doi/epdf/10.1111/jdv.16533
帯状疱疹はCOVID 19感染の指標か?
pubmed.ncbi.nlm.nih.gov/32544259/
COVID-19感染症の大多数は軽度・中等度の症状を呈するが、少数派(15%)では重症肺炎や急性呼吸窮迫症候群(ARDS)に進行したり、多臓器不全に進行したりすることがあることが認識されている[1]。
COVID19流行時に報告された主な皮膚症状は、モルビル状の発疹、水痘様病変、covid趾、各種病変であった[2]。最近では症候性COVID-19感染症の中に帯状疱疹感染症を発症した例が報告されている[3,4]。 そのため,COVID-19感染症の管理においては,無症候性保菌者を特定すること,あるいはその疑いを高めることが最も重要である。
症候性COVID-19感染者における帯状疱疹感染のもっともらしい説明は、感染したリンパ球と活性化誘導性の細胞死と抗ウイルス反応の障害の結果であるリンパ球減少症(これはヘルペスウイルスの再発を促進する可能性がある)である[5]。
したがって、症状のあるCOVID-19感染症の中での帯状疱疹感染のポイントは、重度のウイルス性疾患を持つ患者に広範な免疫抑制を使用する際に念頭に置くべきであり、抗炎症効果対ウイルスクリアランスの遅延の是非を検討する必要がある[6]。競合する利益。著者は利益相反を宣言していない。資金源。なし
結膜炎
onlinelibrary.wiley.com/doi/abs/10.1002/jmv.26084
合計62研究を検索し、37研究を重複して全文を読み、4研究を含めたメタ解析の結果,重症患者と非重症患者の結膜炎の発症確率[OR=0.84,95%CI(-1.66,-0.01),P=0.05]は統計学的に有意であり、COVID-19重症ではない患者では結膜炎を発症しやすいようであった。
サルコペニア
COVID-19:悪液質とサルコペニアの主な原因?
onlinelibrary.wiley.com/doi/full/10.1002/jcsm.12589
コロナウイルス病(COVID-19)は、パンデミックな割合に達している。2つの動物研究では、コロナウイルス-2は、炎症性サイトカインの増加に関連して動物に体重減少を引き起こすことが示されている。ヒトでは、COVID-19は食欲不振、体重減少、低アルブミンを引き起こす。研究が不十分ではあるが、このことは、重度のCOVID-19が悪液質と関連していることを示唆している。
アンジオテンシン変換酵素2はコロナウイルス2の受容体であり、骨格筋に存在する。COVID-19を有する者は筋痛と筋力低下を有する。COVID-19後の回復期には、寝たきり状態での安静と換気が相まって、重度のサルコペニアを引き起こす可能性がある。コロナウイルス2病(COVID-19)は、世界中で流行したパンデミックである1。
コロナウイルス2型スパイクタンパク質は、アンジオテンシン変換酵素2(ACE2)受容体を利用して細胞に結合し、ウイルスのエンベロープと細胞膜を融合させ、ウイルスの遺伝物質が細胞内に侵入する2。コロナウイルス2に感染した人の多くは、症状がないか、または最小限であることを認識することが重要である。重症化する人もいます。最もリスクが高いのは、併存疾患、糖尿病、高血圧、喫煙者、高齢者であると考えられている3。
COVID-19の影響
悪液質は「基礎疾患に関連した複雑なメタボリックシンドロームであり、筋肉の喪失を特徴とする」と定義されている4 その臨床的特徴は、体重減少、低アルブミン、食欲不振、筋肉のタンパク質分解の増加、炎症である。体重減少はCOVID-19の特徴であり、COVID-19に感染して2週間で13ポンド減量したCNNのテレビ司会者によって明確に示されている。
筋肉のACE2
筋肉にはACE2受容体があり、それがこれらの効果を説明しているのかもしれない。COVID-19の患者では、低アルブミン血症、C反応性タンパク質、腫瘍壊死アルファ、インターロイキン-1、インターロイキン-6などの炎症性サイトカインの上昇もみられる6,7。
味覚障害
食欲不振はCOVID-19の構成要素である1。これは、一部ではCOVID-19で起こる味覚障害と味覚喪失によるものであるが、食欲不振の一般的な原因である炎症性サイトカインのレベル上昇にも二次的に起因している9。
9 シリアのハムスターにコロナウイルス-2を注射すると、COVID-19の典型的な症状が現れ、体重が減少する10,11。コロナウイルス-2に感染したマウスは、リボヌクレオシドアナログによって逆転された有意な体重減少を示した。
二次性サルコペニア
13 一次性サルコペニアは年齢に関連したものであるが、二次性サルコペニアは糖尿病や慢性閉塞性肺疾患などの慢性疾患に関連したものである14 。高齢者では、COVID-19パンデミック時の社会的孤立の必要性から、日常的な身体活動が低下し、筋力と機能の低下を加速させている。COVID-19と診断された人はまた、2~3週間の機能低下が二次的なサルコペニアを引き起こす可能性が高い。COVID-19の後、多くの人が低酸素血症を伴う肺障害を起こす。高高度低酸素血症は無脂肪体重の減少と身体障害をもたらす。
ViviFrail graded exercise
身体的に孤立している人には、ViviFrailグレーデッドエクササイズセット(16 vivifrail.com)のような日常的なエクササイズを行うことが推奨されるべきである。17 重度のCOVID-19の人は、障害を予防または逆転させるために長時間の運動療法が必要であるというエビデンスがある18。
悪液質とサルコペニアは死亡率と障害の主な原因である。悪液質を克服した人は、しばしば長期間のリハビリテーションを必要とする。
同様に、ストレスの多い出来事が原因で二次的にサルコペニアを発症した人は、生涯にわたる運動と栄養療法を必要とすることが多い。COVID-19の悪液質の発生率についてもっと研究を行い、回復期のリハビリテーションにももっと注意を払う必要がある。
しもやけ
フォローアップでは全症例で自然に改善、完全な治癒が見られた。
発声障害
軽度から中等度のCOVID-19を有するジスフォニア(発声障害)患者の特徴
pubmed.ncbi.nlm.nih.gov/32600873/
ヨーロッパの軽度から中等度のCOVID-19患者における発声障害の有病率と発声障害患者の臨床的特徴を探る。
ヨーロッパの19の病院から軽度から中等度のCOVID-19患者702人の臨床および疫学的データを収集した。抽出したデータは、年齢、性別、民族、タバコ消費量、併存疾患、一般、耳鼻咽喉科的症状であった。
発声障害と耳鼻咽喉科的症状は、4 段階の尺度で自己評価した。COVID-19症状の一部である発声障害の有病率を評価した。転帰は、発声障害患者と非発声障害患者で比較した。発語障害の重症度と転帰との関連をベイズ分析により検討した。
結果
188名の患者が発語障害を有し、症例の26.8%を占めた。
女性は男性よりも高頻度に発声障害を発症した(P = 0.022)。
喫煙者の割合は、発声障害者群で有意に高かった(P = 0.042)。
咳、胸痛、粘り気のある痰、関節痛、下痢、頭痛、倦怠感、吐き気、嘔吐などの症状の有病率は、非呼吸困難患者に比べて呼吸困難患者の方が高かった。呼吸困難、嚥下困難、耳痛、顔面痛、咽頭痛、鼻閉塞の重症度は、非発声症群と比較して発声障害群で高かった。発声障害、嚥下障害、咳嗽の重症度との間には有意な関連があった。
結論
軽度から中等度のCOVID-19患者の4分の1に発声障害がみられる可能性があり、感染症の症状リストとして考慮すべきである。
発声障害のあるCOVID-19患者は、発声障害のない患者よりも症状が強い。COVID-19の臨床症状におけるジスフォニアの関連性を調べるためには、今後の研究が必要である。