COVID-19 and the liver: an adverse outcome pathway perspective
pubmed.ncbi.nlm.nih.gov/33771662/
2021年3月23日
概要
入院中のCOVID-19患者の最大半数に見られる肝障害は、SARS-CoV-2自体の作用によるものと、薬物治療によるものがある。
本論文では、SARS-CoV-2によって誘導される肝障害の経路を機械的に説明する有害事象経路の構築法を紹介する。
これは、ウイルスの直接的な結合と胆管細胞における局所的な作用によって引き起こされる可能性があるが、COVID-19患者の低酸素状態と全身性炎症の一般的な状態から間接的に生じる可能性もある。
残っている知識のギャップを埋めるために、さらなる研究が緊急に必要である。これにより、将来的にワクチンや、特に治療法をより的を絞って開発するための確固たる基盤を築くことができると期待される。
略語
ACE2angiotensin-converting enzyme 2AO(P)adverse outcome (pathway)CIAOmodelling the pathogenesis of COVID-19 using the AOP frameworkCOVID-19corona virus disease 2019IFNgamma interferon gammaKE(R)key event (relationship)MIEmolecular initiating eventSARS-CoV-2severe acute respiratory syndrome coronavirus 2TMPRSS2transmembrane serine protease 2TNFalphatumor necrosis factor alpha
キーワード
COVID-19SARS-CoV-2肝臓のメカニズムAOP
1. はじめに
全世界で1億2000万人以上が重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)に感染し、その結果発生したコロナウイルス感染症2019(COVID-19)2021年初頭の結果として270万人が死亡した(https://coronavirus.jhu.edu/)。COVID-19の最も頻繁な合併症の1つは肺炎である(Vinken, 2020a)。とはいえ、多くの場合、他の臓器もSARS-CoV-2の影響を受ける。その中でも肝臓は、体内での独特の位置と機能を持つため、一般的に病気や毒性の標的になることが多い。しかし、COVID-19における肝臓の正確な役割と関連性は、まだ解明されていない。COVID-19における肝疾患の関与を解明するためには、有害事象経路(Adverse Outcome Pathway: AOP)構築物が有効な手段となりうる。AOPは、異物が生物学的システムと相互作用することで活性化される。これにより、分子レベルから生体レベルまでの生物学的組織のさまざまなレベルで、キーイベント関係(KER)で結ばれた一連のキーイベント(KE)が誘発され、実際の有害な結果(AO)が生じる(Ankley er al)。 このような状況の中、欧州委員会の共同研究センターは、CIAO(Modelling the pathogenesis of COVID-19 using the AOP framework)という学際的なプロジェクトを開始した。その目的は、シグナルとノイズを分離するCOVID-19研究への包括的な知識の入口を提供し、科学者がAOPコンセプトを通じて通常は協力していない研究分野間の依存関係を迅速に把握する可能性を与えることである(https://ec.europa.eu/jrc/en/event/webinar/intro-webinar-ciao-project)。CIAOで精査された多くの逆境の1つが肝障害であり、本稿ではそれを記録している。
2. COVID-19と肝臓
2.1. 臨床的特徴
COVID-19における肝障害の発生率は14.8%から53%であり、主にアミノトランスフェラーゼの異常値として現れ、正常値の上限の3倍になることもある(Cai et al 2020; Metawea et al 2021)。しかし、これは肝臓だけではなく、筋肉などの他の臓器からも同様に発生する可能性がある(Bangash er al)。 また、多くの患者さんでは、γ-グルタミルトランスフェラーゼの血清量が正常値の上限の3倍にまで増加しており、胆管細胞の損傷を指摘している。アルカリホスファターゼの血清量の増加はあまり見られないようである(Cai er al 2020,Shao er al 2020)。死亡したCOVID-19患者の肝生検標本は、中程度の微小血管性脂肪症、軽度の小葉および門脈活動(すなわち、壊死、炎症および/または線維化)ならびに胆汁うっ滞を示している(Ji et al 2020,Schmit et al 2021年、Xu et al 2020)。全体として、重度のCOVID-19患者では、症状が軽い患者に比べて肝障害の発生率が高く、死亡率を予測することさえある(Boregowda et al 2020,Hundt et al 2020,Parohan et al 2020,Piano et al 2020)。実際、高齢者(Li et al 2020a;Yu et al 2020)および男性(Feng et al 2020;Kaushik et al 2020)のCOVID-19患者は、最も肝障害を発症しやすいようである。既存の肝疾患、特に非アルコール性脂肪性肝炎や代謝関連脂肪性肝疾患を有する患者は、疾患の経過においてより高い肝障害を示す(Chen et al 2021年、Gao et al 2021年、Pan et al 2021)が、他の研究者は、慢性肝疾患とCOVID-19の死亡率/重症度との間の関連性を確立できなかった(Lippi et al 2021年、Palomar-Lever et al 2020)。
2.2. メカニズムについて
COVID-19における肝障害は、SARS-CoV-2そのものの作用(すなわち病態)と、薬理学的治療(すなわち治療)のいずれかによって生じる。後者については、COVID-19の臨床管理に使用されているいくつかの薬剤が、患者の肝障害を引き起こすことが知られている。ロピナビル/リトナビル(Cai et al 2020,Fan et al 2020)ヒドロキシクロロキン(Falcão et al 2020)レムデシビル(Grein et al 2020)などである。このような薬剤による肝毒性は、典型的には脂肪沈着性肝障害または胆汁酸沈着性肝障害として現れ、いずれも確立されたAOP(有害転帰経路)が利用可能である(https://aopwiki.org/)。SARS-CoV-2の細胞侵入を促進するアンジオテンシン変換酵素2(ACE2)受容体は、胆管細胞全体の59.7%が発現しており、これは肺胞2型細胞で測定されたACE2受容体の量に匹敵するレベルである(Chai et al 2020)。そのため、SARS-CoV-2は胆管細胞を直接標的にして侵入し、ウイルスの複製や局所的な細胞障害作用を引き起こす可能性がある。ヒトの肝細胞と胆管細胞のオルガノイドを用いた試験管内試験の実験では、実際にSARS-CoV-2の感染がウイルスの複製につながることが示されている(Yang er al)。 COVID-19の肝臓損傷は、SARS-CoV-2感染後の重篤な全身性炎症反応(すなわちサイトカインストーム)の一部として間接的に発生する可能性もある。このことは、C反応性タンパク質、フェリチン、乳酸脱水素酵素、d-ダイマー、インターロイキン2および6などの炎症マーカーの血清レベルが大幅に上昇したことで示されている(Chen et al 2020,Ponti et al 2020,Zhou et al 2020a)。このことから、COVID-19患者の約3分の1の死因は、敗血症とそれに伴う多臓器不全であると考えられる。さらに、COVID-19における肝障害は、患者の酸素欠乏によって間接的に引き起こされる可能性があり、その結果、肺炎が生じる(Vinken er al 2020a)。この低酸素状態は、組織損傷を誘発する微小血栓の形成、特に肝臓における微小血栓の形成を許容することが知られている(Pilli et al 2018)。
2.3. 有害事象パスウェイ
COVID-19の肝臓への影響のメカニズムを描いた仮説的なAOPを、現在の知識と関連文献データに基づいて提案する(図1)。このAOPは、病態に関連するメカニズムのみを考慮しているため、治療による肝臓への悪影響は考慮していない。すなわち、1つの直接経路(すなわち、SARS-CoV-2が胆管細胞のACE2受容体に結合することが引き金となる)と2つの間接経路(すなわち、SARS-CoV-2が肝外のACE2受容体に結合することが引き金となる)の合計3つの経路が3つの肝障害を引き起こす。前者とは対照的に、間接経路では、他の臓器に存在するMIEを伴う多くの全身性副作用が先行し、最終的に肝臓を襲う。それぞれのKER、ひいてはKEを立証するデータは、様々なin silico、試験管内試験、ex vivo、生体内試験、臨床試験から得られている(表1)。
図1 COVID-19の肝臓への影響を記述した有害事象パスウェイ
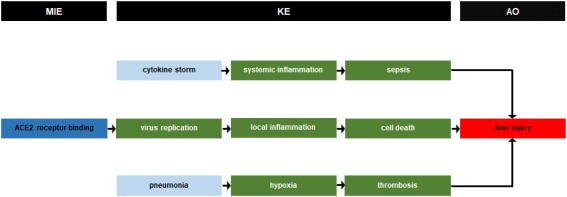
(ACE2:アンジオテンシン変換酵素2,AO:有害事象、KE:重要事象、MIE:分子的開始事象)
表1 COVID-19の肝臓への影響を記述した有害事象経路における主要事象とその関係を立証するデータ
| 重要なイベントの関係 | データ | 研究の種類 | 参照 |
|---|---|---|---|
| ACE2受容体結合(胆管細胞)→ウイルス複製 | 全ヒト胆管細胞集団の59.7%がACE2受容体を発現しており、これは肝細胞よりもはるかに高く(すなわち、細胞の2.6%)肺胞2型細胞におけるACE2受容体発現のレベルに等しい。 | エクスビボ研究(ヒト組織サンプルの分析) | チャイ他 2020年 |
| ヒト胆管細胞におけるACE2受容体、TMPRSS2およびフューリンプロテアーゼの高発現 | in silico研究/エクスビボ研究(ヒト組織サンプルの分析) | Zhou et al。 2020b | |
| ヒト胆管細胞におけるACE2受容体の高発現 | in silico研究 | Qi et al。 2020 | |
| ACE2受容体結合(肝臓)→ウイルス複製
ウイルス複製→炎症(肝臓) |
ヒト肝細胞および胆管細胞オルガノイドはSARS-CoV-2に感染し、ウイルス複製、ケモカインのアップレギュレートされた発現、および機能マーカーのダウンレギュレートされた発現を引き起こす可能性がある | 試験管内試験研究(ヒト肝細胞および胆管細胞オルガノイド) | ヤン他 2020年 |
| 炎症(肝臓)→細胞死(ピロトーシス/ネクロトーシス/アポトーシス) | SARS-CoV-2感染中に産生されるTNF-αおよびIFNγは、ピロトーシス、ネクロトーシス、およびアポトーシスを誘発する | invitro試験(マウスおよびヒトマクロファージ)/ invivo試験(マウス) | Karki et al。 2020 |
| SARS-CoV-2感染はアポトーシスとネクロトーシスを活性化する | 試験管内試験研究(ヒト肺細胞)/生体内試験研究(マウス)/臨床研究(COVID-19患者) | Li et al。 2020b | |
| ACE2受容体結合(肝臓)→ウイルス複製
細胞死(ピロトーシス/ネクロトーシス/アポトーシス)→肝障害 |
COVID-19患者の肝臓におけるSARS-CoV-2感染肝細胞はアポトーシスを示す | 臨床試験(COVID-19患者) | Wang et al。 2020 |
| ヒト肝管オルガノイドはSARS-CoV-2に感染し、ウイルス複製、細胞死、胆管細胞の機能不全を引き起こす可能性がある | invitro試験(ヒト肝管オルガノイド) | 趙 et al 2020 | |
| 炎症(全身)→敗血症
敗血症→肝障害 |
異常な肝機能検査を受けたCOVID-19患者は、より高い全身性炎症と臓器機能障害を示する | 臨床試験(COVID-19患者) | ピアノ他 2020年 |
| 重度の炎症を伴うCOVID19患者は、肝障害を発症する可能性が高くなる | 臨床試験(COVID-19患者) | Fu et al。、2021 | |
| COVID-19患者の肝障害は全身性炎症に関連している | 臨床試験(COVID-19患者) | Chu et al。 2020 | |
| COVID-19患者の肝障害の重症度は、敗血症の発生率に直接関係している | 臨床試験(COVID-19患者) | Sun et al。 2020 | |
| COVID-19患者におけるサイトカインの豊富さは、肝障害の発生率と正の関係がある | 臨床試験(COVID-19患者) | Zhang et al。 2020 | |
| 低酸素症→血栓
症血栓症→肝障害 |
低酸素症は血栓症のリスクを高める | 試験管内試験での研究(HepG2細胞)/生体内試験研究(マウス) | Pilli et al。 2018 |
| 低酸素症は深部静脈血栓症を促進する | 生体内試験研究(マウス) | ブリル他 2013年 | |
| 標高に関連する低酸素症は、独立した血栓形成促進性の危険因子です | 臨床試験(真性多血症患者) | Zangari et al。 2013 | |
| 低酸素症のCOVID-19患者は肝障害を発症する可能性が高い | 臨床試験(COVID-19患者) | Fu et al。、2021 | |
| COVID-19患者の肝障害は低酸素症に関連している | 臨床試験(COVID-19患者) | Chu et al。 2020 | |
| COVID-19患者の肝臓は、門脈および正弦波血管に血栓症を示する | 臨床試験(COVID-19患者) | Sonzogni et al。 2020 | |
| COVID-19患者の肝臓は、中心静脈に血栓症を示する | 臨床試験(COVID-19患者) | Lax et al。 2020 | |
| COVID-19患者の肝機能障害は微小血管血栓症によって誘発される | 臨床試験(COVID-19患者) | 堤ほか、2021年 | |
| COVID-19患者の血栓症は肝機能障害に関連している | 臨床試験(COVID-19患者) | Brosnahan et al。、2021 |
(ACE2:アンジオテンシン変換酵素2,IFNγ:インターフェロンγ、SARS-CoV-2:重症急性呼吸器症候群新型コロナウイルス,TMPRSS2:膜貫通型セリンプロテアーゼ2,TNF-α:腫瘍壊死因子α)。
3. 展望
AOPは複数の用途があるが、そのほとんどは、化学物質の分類、試験の優先順位付け/デリスク戦略、試験管内試験およびin silicoアッセイの開発、試験と評価の統合的アプローチの確立など、毒性学および化学物質のリスク評価の分野にある(Vinken er al)。 とはいえ、AOPsは臨床の場でもその価値を発揮する。実際、AOPsは、基礎研究やトランスレーショナルリサーチのための臨床的に適切な疾患モデル動物の開発と最適化、および新しい診断・予後バイオマーカーの特性評価に役立つ(Vinken, 2020b)。この点、CIAOプロジェクトでは、ワクチンや治療法の開発を促進するために、COVID-19の病態をモデル化しようとしている(https://ec.europa.eu/jrc/en/event/webinar/intro-webinar-ciao-project)。肝臓におけるCOVID-19関連の傷害を引き起こす経路は、このメカニズムパズルの一部に過ぎず、SARS-CoV-2によって体内で引き起こされる他の重要なメカニズムと関連付ける必要がある。SARS-CoV-2の肝臓への影響が実際にどの程度特異的なのか、したがって、肝臓がCOVID-19自体の主要な標的となるのかどうかについては、まだ調査が必要である。SARS-CoV-2は胆管細胞に直接結合して作用するが、COVID-19の肝臓での結果は、低酸素状態と全身性炎症の一般的な状態に起因するものであり、そのような状態はすべての臓器に影響を及ぼす可能性がある。AOPは、このような知識のギャップを明らかにし、将来の研究の優先順位を決定するのに役立つ。そうすることで、新たな科学的情報が生成され、新生AOPに反映され、既存のKERやKEを立証したり、新たなKERやKEを特定したりすることができる。これにより、最終的にはCOVID-19の作用機序が完全に解明され、ワクチンや、特に治療法の開発に向けた確固たる基盤が形成されることが期待される。
