Contents
Cognitive disorders associated with hospitalization of COVID-19: Results from an observational cohort study
www.ncbi.nlm.nih.gov/pmc/articles/PMC7584518/
要旨
序論
COVID-19の危険因子に関する我々の理解は、既往症や遺伝的変異を含めて限られている。既往症や遺伝的背景がCOVID-19とどの程度関係しているのかは、まだ調査が必要である。
方法
我々の研究では、英国バイオバンクのヨーロッパ系の参加者389,620人が含まれており、そのうち3,884人がCOVID-19検査を受け、1,091人がCOVID-19陽性であった。我々は、974の病状および30の血液バイオマーカーの広範なリストとCOVID-19の状態との関連を調べた。さらに、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染に関連する2つの主要遺伝子、アンジオテンシン変換酵素2(ACE2)および膜貫通型プロテアーゼセリン2(TMPRSS2)の遺伝的変異とCOVID-19またはその他の表現型との関連を調べた。
結果
COVID-19の最も有意な危険因子は、アルツハイマー病(OR = 2.29,95% CI: 1.25-4.16)認知症(OR = 2.16,95% CI: 1.36-3.42)およびせん妄、認知症、無気力、およびその他の認知障害の全体的なカテゴリー(OR = 1.90,95% CI: 1.24-2.90)であった。SARS-CoV-2感染関連遺伝子の遺伝子変異とCOVID-19(rs7282236,OR = 1.33,95%CI:1.14-1.54,p = 2.31×10-4)および免疫不全(p = 5.65×10-5)や前立腺がん(p = 1.1×10-5)などの他の表現型との関連を示唆するエビデンスが得られた。
結論
我々のバイアスのない広範な検索により、COVID-19による入院の危険因子として既往のアルツハイマー病と認知症が上位に同定され、このパンデミックの間、認知障害を持つ患者に特別な保護ケアを提供することの重要性が強調された。また、遺伝子変異とCOVID-19との直接的な関連を示唆するエビデンスも得られた。
略語
Apo(a)、アポリポ蛋白質A;COVID-19,コロナウイルス病2019;GWAS、ゲノムワイド関連研究;HDL、高密度リポ蛋白コレステロール;ICD、国際疾病分類;LDL、低密度リポ蛋白コレステロール。OR、オッズ比、PheWAS、全ゲノムワイド関連研究、SARS-CoV-2,重症急性呼吸器症候群コロナウイルス2,SNP、一塩基多型、SD、標準偏差、TC、総コレステロール、UKB、UKバイオバンク
キーワード
COVID-19,認知症、アルツハイマー病、危険因子、既往症、認知障害
1. はじめに
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス疾患2019(COVID-19)のパンデミックは 2020年5月末までに少なくとも600万人の感染確認例と37万人の死亡をもたらしている(世界保健機関 2020)。COVID-19患者の共通の特徴や、ウイルス感染と疾患進行の危険因子に関する情報が蓄積され始めている研究が増えている(Grasselli et al 2020,Richardson et al 2020,Docherty et al 2020)。高齢、男性性、アフリカ系民族、より低い社会経済的地位、およびいくつかの既往症(例えば、慢性腎臓病および肥満)は、COVID-19検査陽性および/または有害転帰と繰り返し関連している(Docherty et al 2020,Niedzwiedz et al 2020,Raisi-Estabragh et al 2005,de Lusignan et al 2020,Kumar et al 2020,Petrilli et al 2020)。これらの既存の研究の大部分は、COVID-19を有する患者の最近組み立てられたコホートに依存しており、時間的制約のため、評価されたサンプルサイズおよび危険因子の数はともに限られている(de Lusignan et al 2020,Kumar et al 2020,Petrilli et al 2020,Yang et al 2020,Guo et al 2020,Bianchetti et al 2020)。さらに、候補因子は通常、収集の容易さ、臨床経験、および過去の出版物に基づいて選択され、いくつかの病状(例えば、糖尿病、呼吸器および心血管疾患)は他の病状(例えば、認知障害)よりもはるかに注目されていた(de Lusignan et al 2020,Kumar et al 2020,Petrilli et al 2020,Yang et al 2020,Guo et al 2020,Bianchetti et al 2020)。より多くの危険因子が試験され、同定される可能性が残っている。UKバイオバンク(UBB)(Bycroft et al 2018)のような包括的な電子健康記録を有する以前に存在した集団コホートにCOVID-19の状態を追加することは、新規の危険因子を同定するために、利用可能なすべての表現型(すなわち、フェノーム)を横断した偏りのない網羅的な検索を行う貴重な機会を提供する。
SARS-CoV-2への応答における個人差の別の可能性のある源は、遺伝的変異である。これらの変異は、ウイルスの侵入および複製に直接的に影響を与え、および/またはCOVID-19の進行を悪化させる病状に個人を間接的に素因づける可能性がある。例えば、認知症およびアルツハイマー病の両方の既知の遺伝的危険因子であるApoE e4遺伝子型は、最近、重度のCOVID-19感染のリスクの増加と関連していることが示された(Kuo et al 2020)。COVID-19コホートをアセンブルし、感受性および重症度の宿主遺伝的決定因子をマッピングするために患者ゲノムをシーケンスする努力がまだ進行中であるが(Murray et al 2020年)我々は、既存のバイオバンクにおける深いゲノムおよび表現型データを活用して、SARS-CoV-2感染に不可欠であることが知られているヒト遺伝子における遺伝的変異の臨床的影響を評価することができる。ACE2によってコードされるアンジオテンシン変換酵素2は、ウイルススパイク(S)タンパク質の細胞表面受容体であり(Zhou et al 2020年)一方、TMPRSS2によってコードされる膜貫通型プロテアーゼセリン2は、Sタンパク質媒介膜融合のプライミングに不可欠である(Hoffmann et al 2020)。TMPRSS2の周囲に位置する遺伝子変異は、以前に、前立腺癌(Al Olama et al 2014)心不全および冠動脈性心疾患(He et al 2016)と関連していた。しかし、GWASカタログではACE2についての関連は報告されていない(Buniello et al 2019)が、ACE2がゲノムワイド解析において一般的に無視されているゲノムの一部であるX染色体上に位置しているためであろう(Chang et al 2014)。同様に、既存のUKBのGWASデータベースであるGeneATLASでは、性染色体、ひいてはACE2に関する情報は得られなかった(Canella-Xandri et al 2018)。ACE2およびTMPRSS2の臨床効果を調査するための非常に最近の努力は、ゲノムワイドな統計的有意性に達する関連を同定しなかった(Curtis 2005,Cirulli et al 2004,Lopera et al 2004)。より大きなサンプルサイズのコホートにおいて、より多くの表現型を含む広範な検索を行うことで、新たな知見が得られる可能性が高い。
UKBは、ヒトの疾患の遺伝的および環境的決定要因を調査するために設立された大規模な集団ベースの前向き研究である。2006年から 2010年の間に50万人以上の中年参加者が募集され、ゲノムワイドな遺伝子型、身体測定値、社会統計学的因子、ライフスタイル指標、血液や尿中のバイオマーカー、医療記録へのリンクなど、深いゲノムおよび表現型データが収集された(Bycroft et al 2018)。最近、英国公衆衛生局(Public Health England)は、UKB参加者にCOVID-19検査結果を提供した。検査は当初、入院中の患者や重度の呼吸器疾患を持つ患者に優先的に行われていたため、検査陽性は英国の重篤な疾患を示す可能性がある(Iacobucci, 2020)。このデータ駆動型の表現型ワイド関連研究(PheWAS)では、広範なUKBのリソースを活用して、(i)COVID-19患者に過剰に存在する既往症、および(ii)COVID-19との直接的な関連を含むACE2およびTMPRSS2の遺伝子変異の臨床的影響を明らかにする。
2. 方法
2.1. 英国バイオバンクコホート
UK Biobank(UK Biobank)は、中高年成人の疾患の遺伝的および非遺伝的決定要因を調査するために設立された大規模な集団ベースのプロスペクティブ研究である。2006年から 2010年までの間に、40歳から69歳までの50万人以上の個人が募集され、全員がベースライン測定を受け、生物学的物質を提供され、医療記録へのアクセスが提供された。本プロジェクトはノースウェスト多施設研究倫理委員会の承認を受け、参加者から適切なインフォームドコンセントを得た(Bycroft er al)。 本プロジェクトで使用したデータは、UKBへの承認された申請書を通じてアクセスした(申請ID:48818)。自己申告したヨーロッパ系祖先の参加者のデータを分析し、英国外で登録した場合 2019年9月以前に死亡した場合、自己申告した性別が遺伝情報と一致しない場合は、この分析から個人を除外した。合計で389,620人の参加者がこの解析に含まれた。2020年3月16日から5月18日までの間に英国内のUKB参加者に報告されたCOVID-19実験室検査の結果が含まれた。この期間中、COVID-19検査は、積極的な医学的介入を必要とする重篤な疾患を有する入院患者に主に限定されていた;したがって、これらのデータは、英国のみにおけるCOVID-19の入院の代理とみなされている(Iacobucci, 2020)。
2.2. 表現型
UKBデータベースで入手可能な3つの表現型セット(入院患者記録、がん登録、死亡登録)を解析した。国際疾病分類(ICD)第9版および第10版を用いて、病院エピソード統計の症例を同定し、罹患例と有病例の両方を含めた。自己申告による診断は考慮しなかった。表現型解析のためのICD9/ICD10の診断は、PheCODEグループ化システムにマッピングされた。ICDコードと比較して、PhecODEは、臨床実践やゲノム研究で一般的に使用されている疾患カテゴリーと密接に一致することが示されている(Wu er al)。 フェコードによって表される各疾患カテゴリーについて、フェコードを有する参加者を症例として再コード化し、標的フェコードまたはその親子フェコードを有しない参加者は対照として分類した。解析は、80%以上の統計力を得るために十分な症例数を有するフェコードに限定した。表現型の解析における症例数と対照の数を表S1に示す。性別分析は、男性と女性で別々に行った。これらの表現型に加えて、募集時に採取した血液サンプルで測定した30のバイオマーカーを関連分析に含めた(Bycroft et al 2018)。
2.3. ACE2およびTMPRSS2のタグSNP
タグSNP、ACE2およびTMPRSS2の調節領域およびコーディング領域のハプロタイプ構造をキャプチャし、共通の遺伝的バリアントを、1,000ゲノムプロジェクト(Genomes Project C、Auton A、Brooks LD、Durbin RM、Garrison EP、Kang HM、Korbel JO、Marchini JL、McCarthy S 2015)から得られた91人の英国人の全ゲノムシークエンシングデータに基づいて選択した。各遺伝子について、以下のすべての基準を満たす遺伝的変異体を解析に含めた:1)コーディング領域の上流もしくは下流に5kbあるか、またはGTExプロジェクト(共同事業 2017)のいずれかの組織における遺伝子の発現に関連するもの;2)2)バイアレルSNP;3)マイナー対立遺伝子頻度≧5%。タグSNPを、Haploview 4.2のTagger機能を用いて、r2 > 0.5でさらに選択した(Barrett et al 2005)。ACE2については17個のタグSNPが選択され、TMPRSS2については31個のタグSNPが選択された。これらのタグSNPが同定された後、英国バイオバンクでCOVID-19の入院およびフェノタイプ全体のフェノタイプとの関連を試験した。
2.4. 統計的解析
ベースライン特性は、カテゴリカル変数については参加者数(パーセンテージ)連続変数については平均(標準偏差)として示されている。各表現型とCOVID-19検査陽性の入院との関連を推定するためにロジスティック回帰分析を行い、年齢、性別、BMI(body mass index)評価センター、および10の遺伝的主成分を補正した。2種類の対照標本を使用した:まだ検査を受けていないか検査陰性の他のすべてのUKB参加者と、検査陰性の参加者のみである。各分類表現型の効果はオッズ比(OR)として測定した。血液バイオマーカー解析では、バイオマーカーレベルは正規化され、ORはバイオマーカーレベルの標準偏差(SD)が1増加するごとに対応した。各組のSNPと表現型について、年齢、性別、評価センター、ジェノタイピングアレイの種類、遺伝的主成分上位10項目を調整しながら、上記のように定義された症例と対照のロジスティック回帰分析を行い、可能性のあるすべての表現型とACE2とTMPRSS2のタグSNPとの間の関連を評価した。
タグSNPとCOVID-19検査陽性との関連を、他のすべてのUKB参加者を対照群として解析した。性層別解析は、性別以外は同じ共変量を用いて、男性と女性で別々に行った。COVID-19 患者と他の UKB 参加者との比較で評価した表現型の数については、ボンフェローニ補正を適用した。統計解析はR(バージョン3.6.2)を用いて行い、表現型全体の関連性解析を容易にするためにPheWASパッケージを使用した(Carroll et al 2014)。
3. 結果
3.1. 研究集団のベースライン特性
品質管理を行い、イギリス国外居住 2019年9月以前の死亡、一貫性のない性情報などの交絡因子を除外した後、合計389,620人の自己申告のヨーロッパ人参加者が本研究に含まれた(表1)。これらの参加者のうち、3,884人(0.997%)がCOVID-19の検査を受け、そのうち1,091人(19.75%)が入院中に少なくとも1回陽性となった。他のすべてのUKB参加者(すなわち、未検査または陰性)と比較して、COVID-19で陽性と判定された患者は、年齢が高く(p=0.024)男性である傾向があり(p=7.33×10-8)BMIが高く(p=7.27×10-18)既往喫煙者または現在喫煙者であった(p=2.84×10-5)。陰性であった参加者と比較して、COVID-19の患者は依然としてBMIが高く(p=3.9×10-3)男性である傾向があった(p=3.2×10-3)(支持情報の表S2)。年齢、性、およびBMIは、我々の分析において共変量として含まれた。
表1英国バイオバンク参加者のベースライン特性(COVID-19検査陽性別)
| 特性 | すべての参加者
|
テストネガティブ
|
COVID-19テスト陽性
|
|---|---|---|---|
| (N = 389,620) | (N = 2,793) | (N = 1,091) | |
| セックス | |||
| 男性 | 176,151 | 1,343 | 582 |
| 女性 | 213,469 | 1,450 | 509 |
| 年齢 | 56.62(8.03) | 57.71(8.59) | 57.17(9.23) |
| 募集 | |||
| BMI | 27.25(4.95) | 27.91(5.88) | 28.52(5.85) |
| 喫煙状況 | |||
| 答えられません | 1,368 | 13 | 8 |
| 決して | 211,495 | 1,282 | 492 |
| 前 | 138,423 | 1,110 | 471 |
| 電流 | 38,315 | 388 | 120 |
| アルコールの使用 | |||
| 答えられません | 329 | 6 | 2 |
| 決して | 12,195 | 101 | 30 |
| 前 | 12,885 | 144 | 67 |
| 電流 | 364,211 | 2,542 | 992 |
| 既存の条件 | |||
| 2型糖尿病 | 19,732 | 450 | 144 |
| 高血圧 | 86,337 | 306 | 394 |
| 肥満 | 15,361 | 214 | 83 |
| 認知症 | 992 | 45 | 34 |
| アルツハイマー病 | 509 | 25 | 20 |
| バイオマーカー | |||
| HDLコレステロール | 1.45(0.38) | 1.43(0.37) | 1.35(0.38) |
| アポリポプロテインA | 1.55(0.26) | 1.52(0.27) | 1.48(0.24) |
| トリグリセリド | 1.74(1.01) | 1.76(1.02) | 1.86(1.03) |
| リウマチ因子 | 24.35(19.6) | 22.1(19.6) | 27.9(18.6) |
3.2. COVID-19のフェノームワイド関連研究
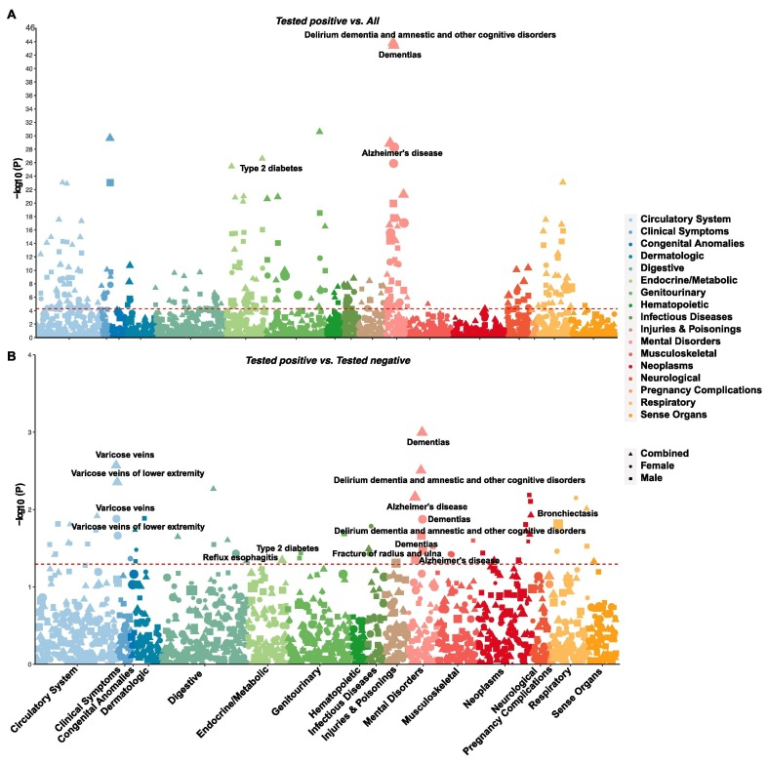
我々は、COVID-19患者に過剰発現している既往症を同定するために、974の表現型と30の血液バイオマーカーを網羅的に関連分析を行い、他のすべてのUKB参加者とCOVID-19陰性者を対照として、COVID-19患者の既往症を同定した。他のすべてのUKB参加者と比較して、ボンフェローニ補正後であっても、COVID-19患者では広範囲の既往症が過剰に表れていた(図1Aおよびサポート情報の表S3)。
最も有意な関連のいくつかは、せん妄、認知症、無気力およびその他の認知障害(p=1.36×10-44)認知症(p=3.48×10-44)腎不全(p=2. 63×10-31)アルツハイマー病(p=1.33×10-29)2型糖尿病(p=2.45×10-27)肺炎(p=8.43×10-24)高血圧(p=1.31×10-23)高脂血症(p=9.94×10-22)。
これらの過剰発現状態は、COVID-19検査を受けた個体におけるサンプリングの偏りを反映しているに過ぎないかもしれないので、我々は、COVID-19を受けた患者と検査陰性の参加者を比較することによって、この偏りに対してさらに補正を行った(図1B、図2,および支持情報の表S4)。いくつかの表現型は、COVID-19を有する患者において一貫して過剰発現していた:せん妄、認知症、無気力およびその他の認知障害の全体的なカテゴリー(OR = 1.90,95%CI:1.24-2.90,併用サンプルではOR = 2.06,95%CI:1.11-3.81)認知症(OR = 2.16,95%CI:1.36-3.42)認知症(OR = 2.16,95%CI:1.36-3.42)認知症(OR = 2.16,95%CI:1.36-3.42)。 42,複合サンプルではOR = 2.05,95%CI: 1.05-3.98,男性ではOR = 2.24,95%CI: 1.18-4.24)アルツハイマー病(OR = 2.29,95%CI: 1.25-4.16,複合サンプルではOR = 2.40,95%CI: 1.02-5.62,男性ではOR = 2.40,95%CI: 1.02-5.62)および2型糖尿病(OR = 1.25,95%CI: 1.00-1.55,複合サンプルではOR = 1.25)。また、検査陰性の参加者との比較では、COVID-19患者で過剰に発現していた以下の新規の併存疾患が明らかになった:気管支拡張症(OR = 2.95,95%CI:1.23-7.05,男性)静脈瘤(OR = 1.71,95%CI:1.20-2.42,併用サンプルではOR = 1.81,95%CI:1.13-2.89,女性)下肢静脈瘤(OR = 1.13-2.89)下肢静脈瘤(OR = 1.69,95%CI:1.69)下肢静脈瘤(OR = 1.69,95%CI:1.02-5.62,女性)。 69,95%CI:1.18-2.42の複合サンプル;OR=1.74,95%CI:1.08-2.80の女性)逆流性食道炎(OR=1.65,95%CI:1.03-2. 63人(女性)鎖骨・肩甲骨骨折(OR = 8.40,95% CI: 1.61~43.43人(女性))橈骨・尺骨骨骨折(OR = 2.5,95% CI: 1.00~6.22人(男性))(図2)。
図1 COVID-19と既往症との関連を示すマンハッタンプロット
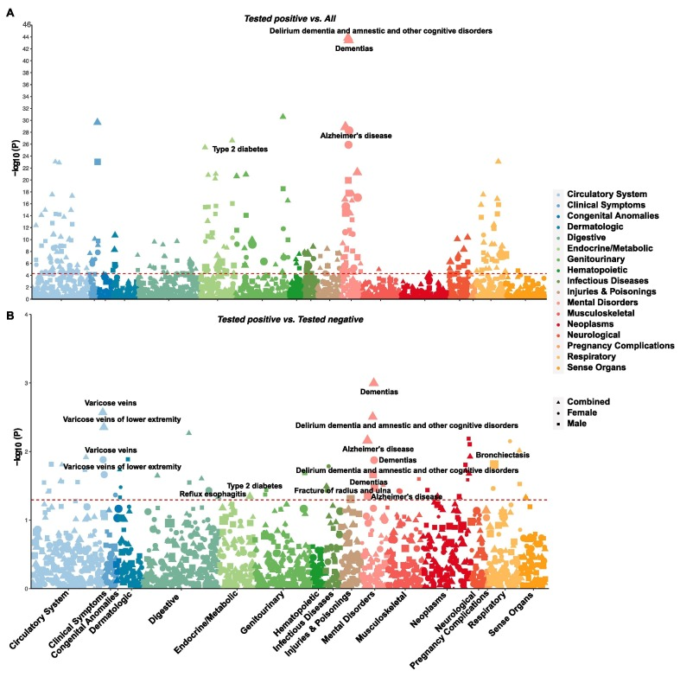
A)COVID-19患者と他のすべてのUKB参加者との比較。ボンフェローニ補正を用いた有意閾値(p < 5.13×10-5)は、赤い破線で示されている。標識された表現型はCOVID-19患者で過剰に発現しており、検査サンプルの偏りを補正した後も名目的に有意である。
(B) COVID-19患者と陰性の患者との比較。名目上の有意性(p < 0.05)は赤い破線で示されている。COVID-19患者で過剰に発現した表現型をラベルで示した。男性、女性、および組み合わせたサンプルに基づく結果は、異なる形状で示されている。形状の大きさはオッズ比に比例する。(この図の凡例の色への参照の解釈については、読者はこの記事のウェブ版を参照してほしい)。
図2 COVID-19患者で過剰発現した既往症のフォレストプロット
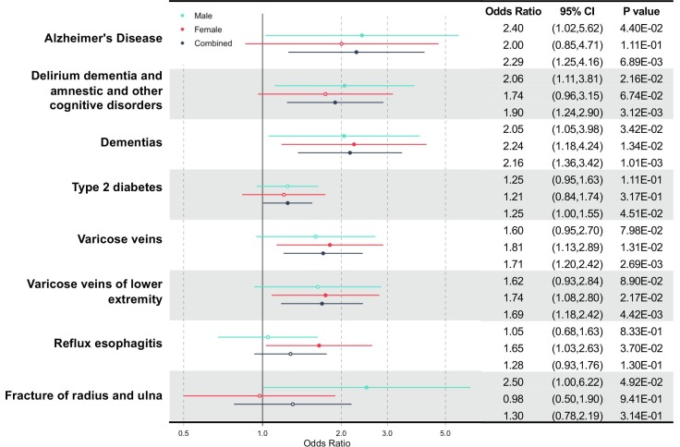
ORの点推定値は塗りつぶされた円または中空の円で表され、横線は95%信頼区間を示す。塗りつぶした円は統計的有意性を示す。男性、女性、および組み合わせたサンプルの結果は、異なる色で示されている。対応する統計量は右に示した。
血液バイオマーカー分析では、名目上の有意水準では、COVID-19患者と検査陰性の参加者との間で4つのバイオマーカーが異なっていた(図3およびサポート情報の表S5)。高密度リポ蛋白コレステロール(HDL)およびアポリポ蛋白A(Apo(a))レベルの各SD増加は、COVID-19のリスク低下と関連していた(OR=0.82,95%CI:0.75-0.90;OR=0.85,95%CI:0.78-0.92)。一方、リウマチ因子およびトリグリセリド値はリスクの増加と関連していた(OR = 1.33,95% CI: 1.03-1.72;OR = 1.08,95% CI: 1.00-1.16,それぞれ)。
全体的に、我々の広範な表現型ワイド検索により、複数の既往症、特にアルツハイマー病と認知症がCOVID-19のリスク因子として強調された。
図3 A 血液バイオマーカーとCOVID-19との関連を示すフォレストプロット
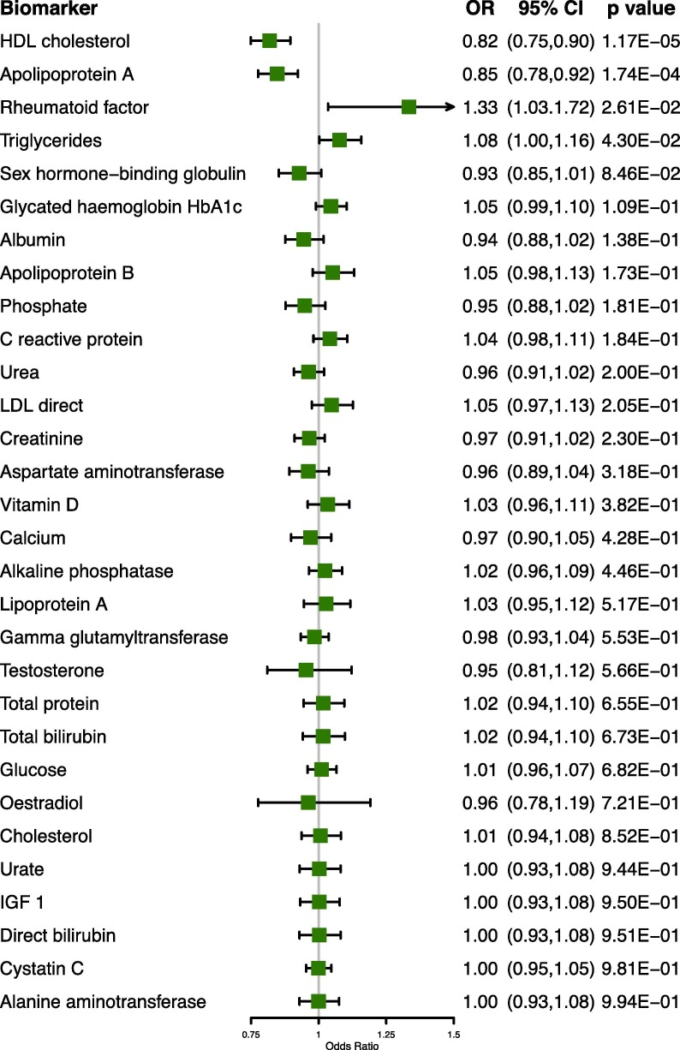
ORの点推定値は塗りつぶされた四角で表され、横線は95%信頼区間を示す。バイオマーカーは統計的有意性の高い順に並べられている。
3.3. ACE2とTMPRSS2のフェノームワイドな関連研究
SARS-CoV-2 感染を媒介するヒト遺伝子(ACE2 および TMPRSS2 など)の遺伝的変異は,ウイルス感受性に直接影響を与える可能性もあれば,間接的に既往症に影響を与える可能性もある.我々は、前者の可能性を評価するために、これら 2 つの遺伝子における共通の遺伝的変異と COVID-19 検査陽性との間の直接的な関連を評価した。ACE2とTMPRSS2の調節領域とコーディング領域のハプロタイプ構造と共通遺伝的変異を捉えるために、それぞれ17個と31個のタグSNPを選択した。ゲノム全体の有意性のカットオフに達する関連は確認されなかった(p < 5×10-8,支持情報の表S6)。しかしながら、TMPRSS2の5つのタグSNPは、他のすべてのUKB参加者および検査陰性者を対照として用いた両解析において、COVID-19検査陽性と公称的に有意なレベル(p<0.05)で関連していた(表2)。COVID-19患者と検査陰性者を比較すると、SNP rs7282236(A/G)の関連はボンフェローニ補正カットオフを通過した(図4 )。このSNPの代替対立遺伝子頻度は、他のすべてのUKB参加者で75.1%、検査陰性者で74.2%、COVID-19患者で77.7%であり、COVID-19のリスクの増加に対応していた(OR = 1.2,95%CI:1.06-1.36,p = 3.30×10-3,OR = 1.33,95%CI:1.14-1.54,p = 2.31×10-4,それぞれ)。まとめると、これらの関連シグナルは、COVID-19のリスクを調節する上でのTMPRSS2遺伝子変異の可能性を示唆している。
表2 COVID-19に関連するTMPRSS2でのタグSNPの公称有意水準でのリスト
| SNP | 21番染色体上の位置 | REF / ALT | EAF(非/否定/位置) | 位置と非
|
Pos vs. Neg
|
||
|---|---|---|---|---|---|---|---|
| または(95%CI) | p値 | または(95%CI) | p値 | ||||
| rs7282236 | 41519797 | A / G | 0.751 / 0.742 / 0.777 | 1.203(1.06,1.36) | 0.0033 | 1.327(1.14,1.54) | 0.00023 |
| rs114837856 | 41475211 | A / T | 0.494 / 0.492 / 0.477 | 0.856(0.76,0.97) | 0.013 | 0.842(0.72,0.98) | 0.025 |
| rs56695953 | 41497808 | A / G | 0.824 / 0.824 / 0.807 | 0.864(0.76,0.98) | 0.027 | 0.874(0.74,1.03) | 0.104 |
| rs8134657 | 41521981 | A / G | 0.905 / 0.910 / 0.891 | 0.839(0.71,0.98) | 0.033 | 0.765(0.63,0.94) | 0.009 |
| rs915823 | 41479527 | C / A | 0.798 / 0.796 / 0.808 | 1.140(1.00,1.29) | 0.050 | 1.186(1.01,1.39) | 0.033 |
| rs35050484 | 41471079 | A / G | 0.963 / 0.967 / 0.952 | 0.784(0.61,1.00) | 0.050 | 0.681(0.50,0.93) | 0.016 |
| rs56379149 | 41531825 | T / G | 0.529 / 0.538 / 0.508 | 0.905(0.82,1.00) | 0.055 | 0.863(0.76,0.98) | 0.018 |
SNP:一塩基多型;REF:参照対立遺伝子;ALT:代替対立遺伝子;EAF:効果対立遺伝子頻度(代替対立遺伝子は効果対立遺伝子);Non:非陽性、他のすべての英国バイオバンク参加者で未検査または検査陰性;Neg:COVID-19は陰性;Pos. Pos: COVID-19が陽性と判定された;OR: オッズ比;CI: 信頼区間。
図4
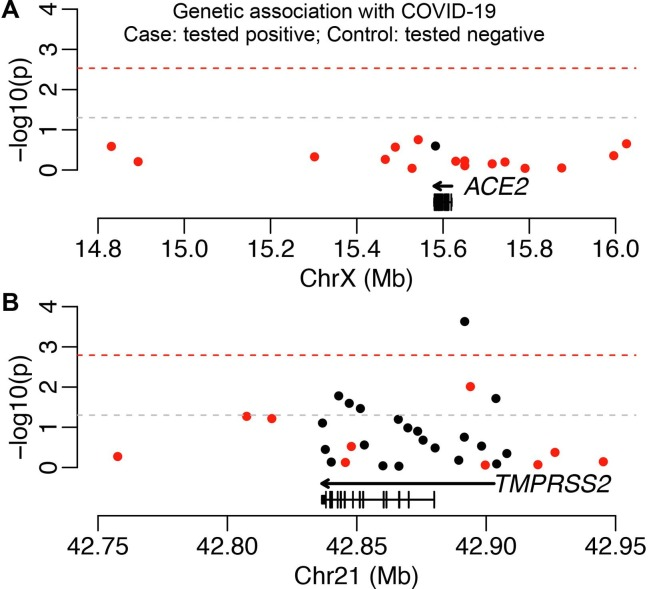
A)ACE2および(B)TMPRSS2遺伝子変異体とCOVID-19との間の関連。各ドットはタグSNP。遺伝子発現に関連するSNPは赤で示されている。名目上の有意カットオフ(p < 0.05)は灰色の破線で表され、一方、試験したSNPの数に対するボンフェローニ補正を伴う有意閾値は赤色の破線で示される。最も長い転写物のモデルは下に示され、すべての転写物をカバーする遺伝子領域は矢印で示されている。(この図の凡例の色への参照の解釈については、読者はこの記事のウェブ版を参照してほしい)。
我々は、これら2つの遺伝子の臨床効果を広く評価するために、タグSNPと848の表現型との間の関連を系統的に評価した。男性、女性、および組み合わせたサンプルについて別々の解析を行った。ゲノム全体の有意性のカットオフ値に達する関連はなかったが、検査した表現型の数に対するボンフェローニ補正により、示唆的な関連が同定された(p<5.9×10-5,図5,支持情報の表S7およびS8)。ACE2については、すべての解析において1つの関連性が示唆されただけであり、それは免疫不全であった(p = 5.65 × 10-5)。TMPRSS2については、複合解析および女性特異的解析の両方において、カットオフ値に達した唯一の表現型は非定型炎症性脊椎症(p = 4.2×10-5および4.3×10-6)であった。男性では、非感染性胃腸炎(p=1.1×10-5)前立腺がん(p=1.1×10-5)頭頸部に関わる症状(p=2.8×10-5)および行動不明の新生物(p=2.91×10-5)の4つの示唆的な関連が同定された。
図5
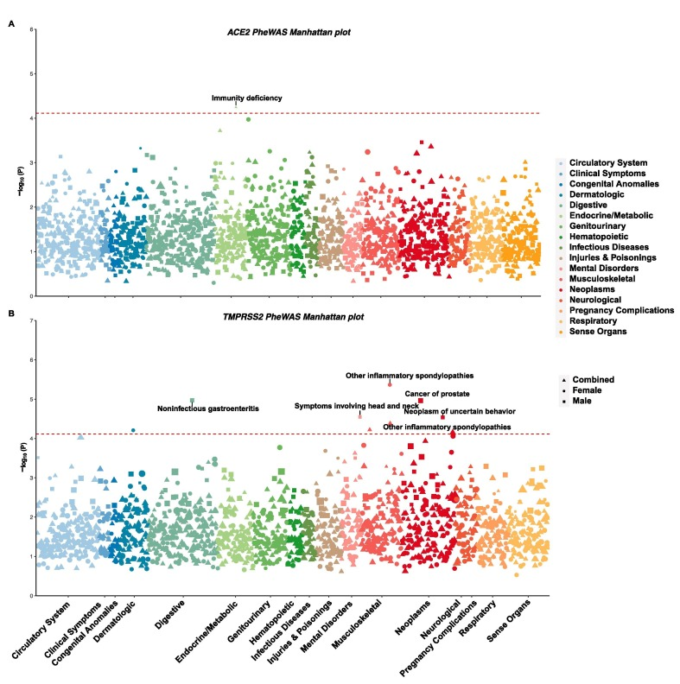
(A)ACE2および(B)TMPRSS2遺伝子変異体と疾患状態との間の関連を示すマンハッタンプロット。ボンフェローニ補正を用いた有意閾値(p < 5.82×10-5)は、赤い破線で示されている。各表現型について、最も有意なタグSNPからのp値のみを示す。雄、雌、および結合されたサンプルの結果は、異なる形状で示されている。形状の大きさはオッズ比に比例する。(この図の凡例の色への参照の解釈については、読者はこの記事のウェブ版を参照してほしい)。
4. 議論
本研究では、既存の広範なゲノムおよび表現型データと、最近 UKB で行われた COVID-19 検査結果を活用して、COVID-19 の危険因子を同定し、SARS-CoV-2 感染を制御するヒトの主要遺伝子における遺伝子変異が臨床的に及ぼす影響を評価した。
その結果、COVID-19の危険因子として、認知症、アルツハイマー病、一般認知障害、2型糖尿病などの複数の既往症が明らかになった。さらに、SARS-CoV-2感染に関連する遺伝子の遺伝子変異は、入院したCOVID-19および免疫不全や前立腺がんなどの他の表現型と示唆的な関連を持つことが明らかになった。
我々が同定した最も有意で一貫した危険因子は認知障害であり、小規模な臨床サンプルを調査したいくつかの予後予測研究と一致している。
北イタリアのCOVID-19患者627人を対象とした研究では、認知症およびその進行段階が死亡率と関連しており、これらの患者は一般的にせん妄の神経学的症状および機能状態の悪化を示した(Bianchetti et al 2020)。
中国・武漢の患者214人を対象とした別の研究では、急性脳血管障害、意識障害、骨格筋損傷を含む神経学的症状がCOVID-19患者の36.5%で観察され、重症患者ではより一般的(45.5%)であった(Mao et al 2020)。
興味深いことに、認知症はCOVID-19を有する入院患者で一般的に観察され、人口統計学的特徴、および喫煙および飲酒状態で調整したモデルにおいてCOVID-19と関連していた(表S9サポート情報)。COVID-19パンデミックの進行に伴い、神経学的症状の報告が増加している(Mao et al 2020,Ding et al 2020)。これらの顕在化は、ウイルスの感染および神経系における複製によって引き起こされる組織損傷の直接的な影響、またはウイルスが引き金となった高揚した非特異的免疫応答によって引き起こされる神経免疫病理による間接的な影響、または感染の直接的および間接的な影響の両方の組み合わせであり、COVID-19の全身的影響の神経学的合併症を顕在化させる(Ellul et al 2020)。
SARS-CoV-2感染およびそれに関連する神経病理学の重要な問題には、ウイルスの侵入経路、組織トロピズム、免疫応答、ならびに神経系における免疫病理学が含まれる(Wu et al 2020)。SARS-CoV-2は、嗅球を介して脳に侵入する可能性がある。マウスの経鼻注射の研究は、ヒトコロナウイルスが、血液脳関門を横切る感染白血球を介して中枢神経系に侵入することを示している(Desforges et al 2019)。
さらに、SARS-CoV-2は、アンジオテンシン変換酵素2受容体に結合する脳血管内皮細胞に存在する(Yan et al 2020)。したがって、中枢神経系の内部障害は、ウイルスによる直接的なものと、体内の全身感染によるものとが考えられる。COVID-19患者における認知障害の過剰発現のメカニズムを正しく解釈するためには、炎症性浸潤の詳細な特徴が決定されなければならない。
認知症は世界で4000万人以上に影響を与えているが、これまでのところ、認知症の既往とCOVID-19入院に関するデータは限られている(Ritchie et al 2016)。年齢は認知症や認知障害の最大の危険因子の一つであるため、アルツハイマー病患者の大多数は70歳以上の高齢者である。サンプルを年齢別に4つのグループに層別化したところ、70歳以上のグループではCOVID-19のリスク上昇と認知症または認知障害との関連のみが観察されたが、比較的若い年齢のグループ(<70歳)では認知症または認知障害の患者が十分な数含まれていなかった(支持情報の表S10)。また、我々の関連モデルを2020年の年齢で調整した場合も、定性的には同様の結果が観察された(補足情報の表S11)。
我々の知見によれば、認知障害は高齢群におけるリスク共存疾患である可能性が高く、重度のCOVID-19への感受性は単に高齢の結果だけではない。COVID-19に苦しむ精神障害者が多いという所見のもう一つの可能性は、セルフケア能力が限られており、介護者との交流が頻繁であるために、ウイルス感染のリスクが高いということである。全体として、これらの結果は、これらの認知状態の患者の特別なニーズに関するCOVID-19の研究を刺激するのに役立つはずである。異なるスタイルで生活する高齢者が直面する異なるリスクを考えると、今回のパンデミックや類似のパンデミックの間は、一次予防の正確なアプローチを伴うより包括的な戦略が望ましいかもしれない。
COVID-19を有する患者と検査陰性の参加者を比較したところ、4つの血液バイオマーカーとCOVID-19に関連する複数の新しい併存疾患が明らかになった。4つの血液バイオマーカーのうち3つは、HDL、Apo(a)、トリグリセリドを含む心血管の健康を示す指標である。これらの所見から、心血管系の健康状態の悪化(すなわち、HDLおよびApo(a)レベルは低下しているが、トリグリセリドレベルは上昇している)とCOVID-19検査陽性のリスクの上昇との間に一貫して関連があることが明らかになった。
これらの有意なリスクバイオマーカーと広範な神経症状との関連を探索した。心血管系の健康に関連する3つの指標は、末梢神経障害、頭痛症候群、片頭痛、炎症性および中毒性神経障害、睡眠時無呼吸、睡眠障害を含む複数の神経学的表現型と関連していた(ボンフェローニ補正したp値<0.001)が、神経学的症状はリウマチ因子のレベルとは関連していなかった(支持情報の表S12)。このように、精神的健康は心血管健康の指標と密接に関連している。
これらの血液バイオマーカーは、このパンデミックの10年前に測定され、収集されたものであるが、我々の結果は、特に中年の健康な個人の間で、より個別化されたCOVID-19予防の取り組みのための潜在的な応用を示すかもしれない。我々の結果とCOVID-19に関する現在の知識との関連性を推測することはできるが、さらなる調査のためには、患者からの縦断的で特徴のあるデータが必要である。
重要なことは、これらの危険因子は、COVID-19を有する患者を背景コホートと比較するだけでなく、陰性と判定された個人と比較することによっても同定されたことで、サンプリングバイアスを補正することができた。研究期間中、COVID-19検査は、特に検査能力が限られている場合には、高リスク群に対して優先的に実施され、いくつかの症状または既往症(例えば、肺炎)が、選択プロセスのために検査を受けた個体に過剰に存在していた(Atkins et al 2020,Ho et al 2004)。英国で使用されたポリメラーゼ連鎖反応検査では、初期検査での偽陰性率は2%から29%であった(Watson er al)。 このバイアスの補正は、真のCOVID-19危険因子を同定するために重要である(Griffith et al 2020)。したがって、検査陽性と陰性の患者の比較は、偽陰性だけでなく、COVID-19に似た症状のための入院の他の理由を除外することができる。COVID-19検査陽性の危険因子としての2型糖尿病という我々の知見もまた、これまでの研究(de Lusignan et al 2020,Kumar et al 2020)と一致している。
先行研究で報告されていない新規の危険因子には、気管支拡張症、静脈瘤、逆流性食道炎、鎖骨または肩甲骨の骨折、橈骨および尺骨の骨折などがある。これらの危険因子がCOVID-19の進行を悪化させるか、またはこれらの既往症を有する患者が感染症に曝される頻度が高くなる可能性がある。これらの関連性の根底にあるメカニズムを解明するためには、今後の研究が必要である。COVID-19患者と他のUKBサンプルとの比較において有意な関連を示す多くの既往症は、陰性の患者との比較においては有意ではなかった。陰性者の対照群はサンプルサイズが非常に小さいため、これらの既往症の解釈には注意が必要であり、十分な統計力がない可能性がある。
ACE2およびTMPRSS2の全ゲノム関連研究では、COVID-19検査陽性および他の病状との関連を示唆する証拠が明らかになった。いずれの関連もゲノムワイドの有意下限値には達していなかったが、これはごく最近の研究(Cirulli et al 2004,Lopera et al 2004)と一致している。しかし、我々の研究では、厳しいボンフェローニ補正のカットオフを通過した関連を同定した。COVID-19との直接的な関連に関しては、どの対照群を用いたかにかかわらず、TMPRSS2の1つのタグSNP、rs7282236がCOVID-19検査陽性と関連していた。ごく最近の研究では、49,953人のUKB被験者およびCOVID-19患者74人からのエクソームシークエンシングデータを使用して、ACE2およびTMPRSS2におけるまれなコーディングバリアントのCOVID-19への寄与を評価したが、関連性は見いだせなかった(Curtis, 2005)。COVID-19患者のほぼ完全なUKBコホート参加者における共通のコーディングバリアントおよび調節性バリアントに焦点を当てたことが、我々の新規発見を促進したのではないかと思われる。より広範な臨床効果については、ボンフェローニ補正のカットオフ値を満たすACE2との関連(免疫不全)が1つ観察された。
TMPRSS2との関連は、非定型炎症性脊椎症、非感染性胃腸炎、前立腺癌、頭頸部症状、性状不詳の新生物など、さらに多くの関連が確認された。特筆すべきことに、TMPRSS2と前立腺癌との関連は以前に同定されており(Al Olama et al 2014年)我々の知見の妥当性を支持している。これらの遺伝的変異体が、特定の免疫細胞型やサイトカインレベルなど、UKバイオバンクでは入手できなかった他のCOVID-19関連の表現型と関連している可能性がある。解析された仮説の中で、最も興味深いシグナルは、TMPRSS2の遺伝子変異とCOVID-19検査陽性との関連である。これらの遺伝子変異がCOVID-19患者における重症度の違いや疾患発現の違いと関連しているかどうかを評価することは非常に興味深いことである。
我々の研究には長所と限界がある。UKBは、広範なゲノムおよび表現型情報を有する大規模なプロスペクティブコホートであり、COVID-19の危険因子について仮説のない表現型ワイドスキャンを可能にしている。バックグラウンドコホートとCOVID-19の検査を受けた個人のサブグループが利用可能であることから、COVID-19患者を一般集団と比較しながら、同時にサンプリングバイアスを補正することが可能である。この比較的小さなサンプルサイズは、解析をコライダーバイアスの影響を受けやすいものにしている。我々は、コライダーバイアスを補正するために2つの方法を適用し、我々の研究の感度を調べた:i)選択されたサンプルが、対象集団を代表するサンプルからなる完全なUKBデータセット内に入れ子になっている場合、またはii)データセットが検査されたサンプルのみで構成されている場合。しかし、サンプル選択の程度を推定することは困難であり、仮にそのパラメータがわかったとしても、それがどの方法でも完全に説明されていることを証明することはできない。また、英国のバイオバンクでは、より健康で高学歴の参加者が含まれているため、コライダーバイアスが発生する可能性がある。既往症やバイオマーカーに加えて、我々の研究では、候補遺伝子を研究することで、COVID-19における遺伝的要因の可能性を評価した。また、SARS-CoV-2感染に関連する2つの主要遺伝子のゲノムワイドな解析により、それらの生物学的機能についての臨床的洞察を得ることができた。我々の研究のもう一つの限界は、COVID-19患者の特定の症状や転帰に関する追加情報を提供できなかったことであった。身体測定値、バイオマーカーレベルおよび病状は、募集時に測定されたか、医療記録から検索されたものであり、そのため、現在の健康状態を正確に反映していない可能性がある。COVID-19に関連した健康格差に影響を与えることがよく知られている民族性の潜在的な交絡効果を減らすために、我々の解析では、最大のサンプルサイズを持つヨーロッパ系の参加者に限定した。今後、他の民族を対象とした大規模なサンプルサイズの研究が早急に必要である。最後に、我々の研究は連想的な性質を持っており、危険因子の因果関係に対処することができなかった。我々の所見では、広範な既往症と遺伝子変異がCOVID-19と関連していることが明らかになった。しかしながら、COVID-19感受性に対する危険因子の実際の因果関係は、遺伝的背景、ライフスタイル、社会的つながりによって異なる可能性が高く、我々の集団レベルのスクリーニングで示されたものよりも複雑であると考えられる。
5. 結論
全体的に、英国バイオバンクにおける我々の非バイアスな表現型ワイド研究の結果、認知症、アルツハイマー病、2型糖尿病、心血管健康の血液バイオマーカー、TMPRSS2の遺伝的変異を含むCOVID-19の既知の新規危険因子が確認され、同定された。これらの系統的な発見は、COVID-19のアウトブレイクの今後の段階における管理、予防、治療についての洞察を提供すると同時に、認知障害患者に対する特別な保護ケアが緊急に必要であることを浮き彫りにしている。