Contents
pubmed.ncbi.nlm.nih.gov/18626751
Cancer is a Preventable Disease that Requires Major Lifestyle Changes
2008年7月15日オンライン公開doi:10.1007/s11095-008-9661-9.
要旨
今年、アメリカでは100万人以上、世界では1,000万人以上ががんと診断されると予想されており、一般的に予防できると言われている病気である。
がん患者のうち、遺伝的な欠陥に起因するものは5-10%に過ぎず、残りの90-95%は環境と生活習慣にその根源があると言われている。生活習慣には、タバコ、食事(揚げ物、赤身肉)、アルコール、日光浴、環境汚染物質、感染症、ストレス、肥満、運動不足などがある。
エビデンスによると、がん関連死のうち、25~30%近くがタバコによるもので、30~35%もの割合で食事との関連、15~20%ほどが感染症によるもので、残りの割合は放射線、ストレス、身体活動、環境汚染物質などのその他の要因によるものである。
したがって、がんの予防には、禁煙、果物や野菜の摂取量の増加、アルコールの適度な使用、カロリー制限、運動、直射日光を避けること、最小限の肉の消費、全粒穀物の使用、予防接種の使用、定期的な検診が必要である。
このレビューでは、炎症が、がんを引き起こす薬剤/因子とがんを予防する薬剤の間のリンクであるという証拠を提示する。さらに、がんは予防可能な病気であり、ライフスタイルを大きく変える必要があることを示す証拠も示している。
Key Words:がん、環境リスクファクター、遺伝リスクファクター、予防
序論
ゲノム研究のパイオニアであるクレイグ・ベンターは、自らのゲノムを解読した後、21世紀のためのリーダーシップ会議で、「人間の生物学は、実は私たちが想像しているよりもはるかに複雑なのである」と述べた。誰もが、父親と母親から受け継いだ遺伝子のことを話題にする。しかし、実際には、その遺伝子が人生の結果に与える影響はほとんどない。私たちの生物学はあまりにも複雑で、何十万もの独立した要因を扱っている。遺伝子は決して私たちの運命ではない。遺伝子がある病気のリスクを高めるという有益な情報を与えてくれることはあるが、ほとんどの場合、遺伝子がその病気の実際の原因や、誰かがその病気にかかる実際の発生率を決定することはないだろう。ほとんどの生物学は、遺伝子コードによって直接駆動されるのではなく、環境要因に働きかけるすべてのタンパク質と細胞の複雑な相互作用から生まれるのである」(http://indiatoday.digitaltoday.in/index.php?option=com_content&task=view&isseid=48&id=6022§ionid=30&Itemid=1)
なぜなら、がんの診断、予防、治療など、ほとんどの慢性疾患の解決策をヒトゲノムに求めることは、今日の世界では過度に強調されているからだ。しかし、観察研究によると、私たちがある国から別の国へ移住する際、ほとんどの慢性疾患と診断される確率は、出身国ではなく、移住先の国によって決まることが分かっている(1-4)。また、一卵性双生児を用いた研究では、遺伝子がほとんどの慢性疾患の原因ではないことが示唆されている。例えば、乳がんに対する一卵性双生児の一致率はわずか20%であることが判明している(5)。遺伝子の代わりに、私たちのライフスタイルと環境が、私たちの最も慢性的な病気の90-95%を占めている。
がんは、過去10年間に見られた膨大な量の研究と急速な発展にもかかわらず、世界的な殺人事件であり続けている。最近の統計によると、がんは米国における総死亡者数の約23%を占め、心臓病に次いで2番目に多い死因となっている(6)。しかし、心臓病の死亡率は、1975年から2002年にかけて、米国では高齢者、若年者ともに急減している。一方、がんの死亡率には、米国では顕著な差は認められていない(6)。
2020年には、世界人口は75億人に増加し、このうち約1500万人が新たにがんと診断され、1200万人のがん患者が死亡すると予想されている(7)。このようながん罹患率と死亡率の推移を見ると、1985年5月、ジョン・バイラー博士が、ニクソン大統領による「がんとの戦い」の宣言から14年後に、米国の国家がん対策は「失敗」と判定したことが、改めて思い出される。さらに四半世紀にわたる広範な研究の後でも、研究者たちは、がんが予防可能かどうかを見極めようとし、「もし予防可能なら、なぜ私たちはがんとの戦争に負けているのか?」と問いかけている。このレビューでは、がんの潜在的な危険因子を分析し、これらの危険因子を調節するための選択肢を探ることで、この問いに答えようと試みている。
がんは、遺伝的変異、ホルモン、免疫状態などの内的要因と、タバコ、食事、放射線、感染生物などの環境・後天的要因の両方によって引き起こされる(図1)。食事とがんの関連性は、各国の特定のがんの発生率に大きなばらつきがあることや、移住する際のがんの発生率の変化が観察されることで明らかになっている。例えば、アジア人は欧米諸国の住民に比べ、前立腺がんの発生率が25倍、乳がんの発生率が10倍低く、アジア人が欧米に移住した後にこれらのがんの発生率が大幅に上昇することが示されている(www.dietandcancerreportorg/?p=ER)。
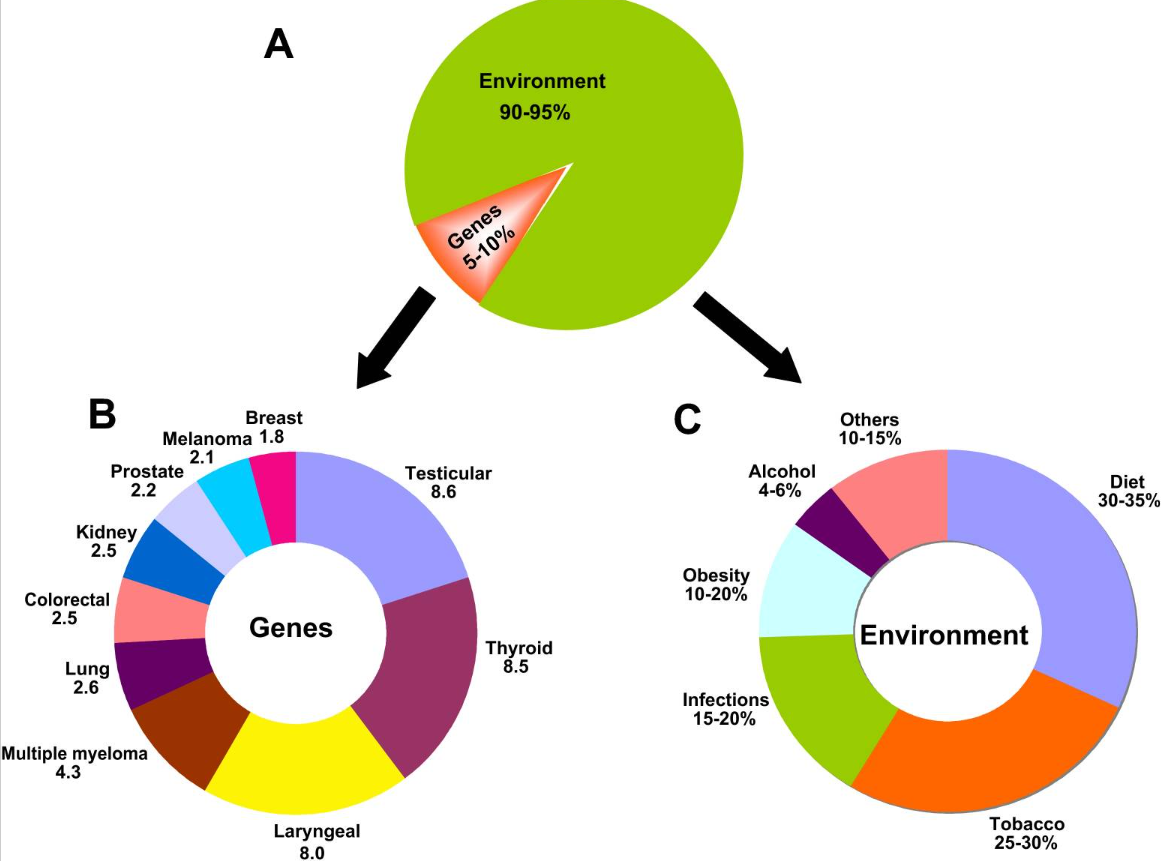
図1 癌の発生における遺伝子と環境の役割
A がんに対する遺伝要因と環境要因の寄与率。がんリスクに対する遺伝因子と環境因子の寄与率は、それぞれ5~10%、90~95%である。
B 選択したがんの家族性リスク比。数値は家族性リスク比を表し、罹患者の特定のタイプの親族に対するリスクを人口有病率で割ったものとして定義されている。ここに示したデータは、ユタ州で行われた、第一度親族(両親+兄弟+子孫)のがんの発生頻度を調べる調査から得られたものである。家族性リスク比は、第一度親族で観察されたがん症例数を、症例親族の出生年(コーホート)に基づく対照親族から得られる期待数で割った比率として評価された。要するに、これは、一般集団と比較した症例の一親等のリスク比を年齢調整したものである。
C 各環境因子の寄与率。ここに示された割合は、指定された環境リスク因子によるがん死亡の帰属分率を示す。
がんの発症における生活習慣の重要性は、一卵性双生児を対象とした研究でも示されている(8)。遺伝子の異常が原因であるがんは全体の5-10%に過ぎない。遺伝子の欠陥に関連する様々ながんを図2に示す。すべてのがんは複数の突然変異の結果であるが(9、10)、これらの突然変異は環境との相互作用によるものである(11、12)。
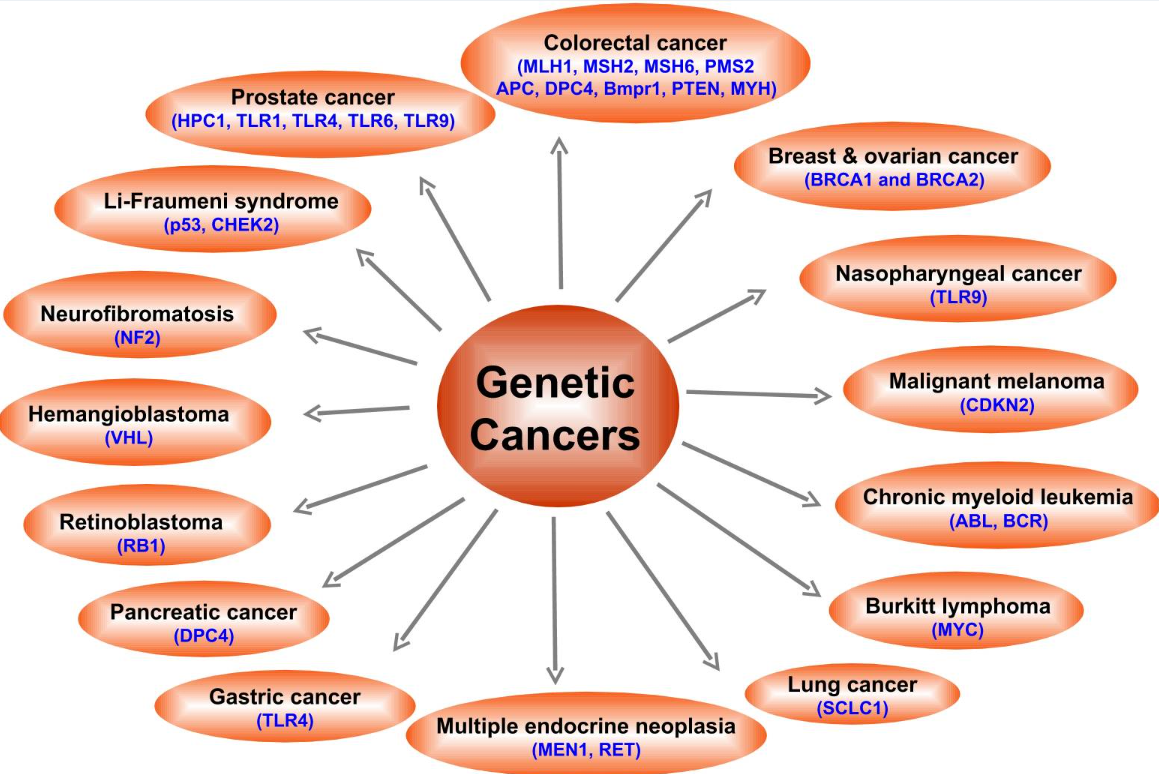
図2 さまざまながんのリスクと関連する遺伝子
これらのことから、ほとんどのがんは遺伝性ではなく、食生活、喫煙、飲酒、感染症などの生活習慣がその発生に大きな影響を与えることがわかる(13)。遺伝的要因は修正できないが、生活習慣や環境要因は修正できる可能性がある。がんの遺伝的影響の少なさと環境要因の修正可能性は、がんの予防可能性を指し示している。がんの発生率や死亡率に影響を与える重要な生活習慣の要因としては、タバコ、アルコール、食事、肥満、感染症、環境汚染物質、放射線などがあげられる。
癌の危険因子
タバコ
1964年、米国外科医総長諮問委員会報告書(http://profiles.nlm.nih.gov/NN/Views/AlphaChron/date/10006/05/01/2008)において、喫煙が肺がんの主な原因であると指摘され、以来、タバコの使用を減らすための取り組みが続けられている。タバコの使用は、少なくとも14種類のがんの発症リスクを高めると言われている(図3)。また、がんによる死亡の約25~30%、肺がんによる死亡の87%を占めている。非喫煙者に比べ、男性喫煙者は23倍、女性喫煙者は17倍も肺がんを発症しやすいと言われている(http://www.cancer.org/docroot/STT/content/STT_1x_Cancer_Facts_and_Figures_2008.asp accessed on 05/01/2008 )。

例えば、米国環境保護庁は1993年、受動喫煙による環境タバコ煙を既知の(グループA)ヒト肺がん物質として分類している(http://cfpub2.epa.gov/ncea/cfm/recordisplay.cfm?deid=2835 accessed on 05/01/2008 )。タバコには少なくとも50種類の発がん性物質が含まれている。例えば、タバコの代謝物の一つであるベンゾピレンジオールエポキシドは、肺がんとの直接的な病因的関連性を持っている(14)。トータルで考えた先進国では、喫煙の有病率は緩やかに減少しているが、世界人口の85%が居住する発展途上国では、喫煙の有病率は増加している。最近のタバコの使用動向に関する研究によると、2010年までに世界のタバコの71%を発展途上国が消費し、東アジアでは80%の増加が予測されている(http://www.fao.org/DOCREP/006/Y4956E/Y4956E00.HTM accessed on 01/11/08).タバコの使用量が増加している地域に重点を置いて、加速度的にタバコ規制プログラムを使用することが、タバコに関連するがん死亡率を減少させる唯一の方法である。
図3 アルコールと喫煙との関連が指摘されているがん。
パーセンテージは、Irigarayら(13参照)が報告した、男女のアルコールと喫煙に起因するがん死亡率を表している
喫煙がどのように癌に寄与するかは、完全には解明されていない。しかし、喫煙が多数の細胞シグナル伝達経路を変化させることは分かっている。私たちのグループの研究の結果、タバコの煙と炎症との関連性が確立された。具体的には、タバコの煙が炎症マーカーであるNF-κBの活性化を誘導することを明らかにした(15,16)。したがって、NF-κBの活性化を抑制できる抗炎症剤は、タバコの煙に対して応用できる可能性がある。
また、食用スパイスであるウコン由来のクルクミンが、タバコの煙によって誘導されるNF-κBを阻害することを明らかにした(15)。クルクミンに加え、いくつかの天然フィトケミカルも、様々な発がん物質によって誘導されるNF-κBを阻害することを発見した(17)。このように、タバコの発がん作用は、これらの食事療法剤によって軽減されるようだ。炎症をブロックし、それによって化学予防効果をもたらす食事療法剤について、より詳細な考察を次項に示す。

アルコール
アルコールと食道癌のリスク上昇との関連についての最初の報告は、1910年に発表された(18)。それ以来、多くの研究により、慢性的なアルコール摂取は、口腔、咽頭、下咽頭、喉頭、食道などの上部消化管のがん(18–21)や、肝臓、膵臓、口腔、乳房のがんの危険因子であることが明らかになっている(図3)。例えば、WilliamsとHorn(22)は、アルコールによる乳がんのリスク上昇を報告している。また、乳癌のホルモン因子を研究している共同研究グループは、女性の乳癌リスクとアルコールの関連について、世界中で実施された個々の疫学研究の80%以上を再解析して結果を発表した。その解析結果では、アルコールの摂取量が10g/日増えるごとに、乳がんの相対リスクが7.1%上昇することが示された(23)。また、Longneckerら(24)は、米国で新たに乳がんと診断された症例のうち、4%がアルコールの使用によるものであることを別の研究で明らかにしている。乳がんの危険因子であることに加え、アルコールの大量摂取(50-70g/日以上)は、肝臓がん(25)や大腸がん(26,27)の危険因子として確立されている。
また、大量のアルコール摂取とC型肝炎ウイルス(HCV)やB型肝炎ウイルス(HBV)との相乗効果も確認されており、肝硬変をより積極的に促進することで肝細胞がん(HCC)のリスクを高めると推定される。例えば、DoNATOら(28)は、アルコール飲酒者において、1日の摂取量が60gを超えるとHCCリスクが直線的に上昇することを報告している。しかし、HCV感染を併発すると、肝硬変のリスクはアルコール単独摂取の場合の2倍となった(すなわち、正の相乗効果)。また、アルコールと炎症の関係についても、特にアルコールによる肝臓の炎症については、よく知られている。
アルコールがどのように発癌に寄与するかは完全には解明されていないが、エタノールが一役買っている可能性がある。研究結果では、エタノールは発がん物質ではないが、発がん物質であることが示唆されている(29)。具体的には、エタノールが代謝されると、アセトアルデヒドとフリーラジカルが発生する。フリーラジカルは、DNAやタンパク質と結合し、葉酸を破壊して二次的な過増殖をもたらすことにより、アルコール関連発がんの主な原因となると考えられている。アルコールが発がんを促進するその他のメカニズムとしては、シトクロムP-4502E1の誘導があり、これはフリーラジカルの産生を高め、アルコール飲料に含まれる様々な発がん物質の活性化を促進することに関連している;タバコの煙や食事に関連した代謝や発がん物質の分布の変化、増殖亢進につながる細胞周期期間などの細胞周期行動の変化、メチル、ビタミンE、葉酸、ピリドキサールリン酸、亜鉛、セレンなどの栄養欠乏、免疫系の変化。肝硬変で起こるような組織傷害は、肝細胞癌の主要な前提条件である。また、アルコールはNF-κBの炎症経路を活性化し(30)、腫瘍形成に寄与する可能性もある(31)。さらに、タバコの煙の発がん物質であるベンゾピレンは、エタノールと組み合わせると食道に浸透することが示されている(32)。このように、抗炎症剤はアルコール誘発性毒性の治療に有効であると考えられる。
上部消化管では、25-68%のがんがアルコールに起因しており、これらの腫瘍の最大80%は、アルコールと喫煙を控えることで予防することができる(33)。世界的には、飲酒によるがん死亡の帰属率は3.5%と報告されている(34)。米国では、飲酒に関連することが知られているがんによる死亡者数は、6%(ユタ州)と低い場合もあれば、28%(プエルトリコ)と高い場合もある。この数字は国によって異なり、フランスでは男性で20%に近づいている(18)。
ダイエット
1981年、DollとPeto(21)は、米国におけるがん死亡の約30-35%が食事と関連していると推定した(図4)。食事ががん死亡にどの程度寄与しているかは、がんの種類によって大きく異なる(35)。例えば、大腸がんの場合、70%もの症例で食事ががん死亡に関連している。食事がどのようにがんに寄与しているかは、完全には解明されていない。硝酸塩、ニトロソアミン、農薬、ダイオキシンなど、摂取される発がん物質の多くは、食品や食品添加物から、あるいは調理から摂取される。
図4 Willettが報告した食事と関連したがん死亡数(%)(35参照)
赤肉の大量摂取は、いくつかのがんの危険因子であり、特に消化管のがんだけでなく、大腸がん(36–38)、前立腺がん(39)、膀胱がん(40)、乳がん(41)、胃がん(42)、膵臓がん、口腔がん(43)についても同様である。Dosil-Diazらによる研究(44)では、肉の摂取が肺がんのリスクを低減することが示されているが、以下の理由から、このような摂取は一般にがんのリスクとみなされる。肉を調理する際に発生する複素環アミンは発がん性物質である。食肉の炭火調理および/または煙による熟成では、発ガン作用の強い熱分解物やアミノ酸などの有害炭素化合物が生成される。例えば、PhIP(2-アミノ-1-メチル-6-フェニル-イミダゾ[4,5-b]ピリジン)は、調理した牛肉に最も多く含まれる変異原で、揚げた牛肉に見られる総変異原性の20%を占めている。アメリカ人のPhIPの1日の摂取量は、1人当たり280-460ng/日と推定されている(45)。

亜硝酸塩や硝酸塩はミオグロビンと結合してボツリヌス菌の外毒素産生を抑制するため食肉に使用されるが、強力な発がん物質である(46)。亜硝酸塩系保存料やアゾ染料などの食品添加物の長期暴露は、発癌の誘発と関連している(47)。さらに、プラスチック製食品容器に含まれるビスフェノールは食品に移行し、乳がん(48)および前立腺がん(49)のリスクを高める可能性がある。ヒ素の摂取は、膀胱がん、腎臓がん、肝臓がん、肺がんのリスクを高める可能性がある(50)。ほとんどの食品に含まれる飽和脂肪酸、トランス脂肪酸、精製糖や小麦粉も、さまざまながんと関連している。いくつかの食品発がん物質が炎症経路を活性化することが示されている。
肥満
米国癌学会の研究(51)によると、肥満は、結腸、乳房(閉経後の女性)、子宮内膜、腎臓(腎細胞)、食道(腺癌)、胃心筋、膵臓、前立腺、胆嚢、肝臓の癌による死亡率の増加と関連している(図5)。この研究から、米国におけるがんによる死亡のうち、男性で14%、女性で20%が体重超過または肥満に起因していることが示唆された。近代化の進展と欧米化された食事やライフスタイルは、多くの発展途上国における体重超過者の有病率の上昇と関連している(52)。
図5 肥満との関連性が指摘されているさまざまながん
アメリカでは、太り過ぎや肥満が、男性のがんによる死因の14%、女性の死因の20%を占める可能性があると言われている(51参照)。
研究により、肥満とがんの共通項として、神経化学物質、インスリン様成長因子1(IGF-1)、インスリン、レプチンなどのホルモン、性ステロイド、脂肪率、インスリン抵抗性、炎症が挙げられている(53)。
また、IGF/インスリン/Aktシグナル経路、レプチン/JAK/STAT経路、その他の炎症カスケードなどのシグナル経路の関与も、肥満とがんの両方に関連している(53)。例えば、高血糖は、NF-κBを活性化することが示されており(54)、これは肥満と癌を結びつける可能性がある。また、レプチン、腫瘍壊死因子(TNF)、インターロイキン-1(IL-1)など、脂肪細胞から産生されるいくつかのサイトカインもNF-κBを活性化することが知られている(55)。エネルギーバランスと発がんは密接に関連している(53)。しかし、これらのシグナル伝達カスケードを阻害することで、肥満に関連した発がんリスクを低減できるかどうかは、依然として未解決である。複数のシグナル伝達経路が関与しているため、肥満に関連するがんリスクを低減するためには、潜在的なマルチターゲット薬が必要になる可能性が高い。
感染症対策
世界では、新生物の17.8%が感染症に関連していると推定されている。この割合は、高所得国の10%未満からアフリカ諸国の25%までの幅がある(56,57)。感染症が原因となるがんの多くはウイルスが原因である(図6)。ヒトパピローマウイルス、エプスタインバーウイルス、カポジ肉腫関連ヘルペスウイルス、ヒトTリンパトロピックウイルス1、HIV、HBV、HCVは、子宮頸がん、性器がん、皮膚がん、鼻咽頭がん、バーキットリンパ腫、ホジキンリンパ腫、カポジ肉腫、成人T細胞白血病、B細胞リンパ腫、肝臓がんに対するリスクに関連する。
図6 感染症との関連が指摘されているさまざまながん
2002年における感染症起因のがんの推定総計は、世界のがん負担の17.8%にあたる。各がん種に関連する感染因子を括弧書きで示す。HPVヒト乳頭腫ウイルス、HTLVヒトT細胞白血病ウイルス、HIVヒト免疫不全ウイルス、EBVエプスタイン・バーウイルス(57参照)。
欧米先進国では、ヒトパピローマウイルスとHBVが最も頻繁に遭遇する発がん性DNAウイルスである。ヒトパピローマウイルスはウイルス遺伝子E6とE7を誘導することで直接的に変異原性を示すが(58)、HBVは慢性炎症により活性酸素を発生することで間接的に変異原性を示すと考えられている(59–61).ヒトTリンパトロピックウイルスは直接的に変異原性を示すが、HCVは(HBVと同様に)感染細胞で酸化ストレスを生じさせるため、慢性炎症を通じて間接的に作用すると考えられている(62,63)。しかし、Opisthorchis viverriniやSchistosoma haematobiumなどの寄生虫やHelicobacter pyloriなどの細菌を含む他の微生物も、補酵素や発癌物質として作用して関与している可能性がある(64).
感染症が癌を促進するメカニズムは、ますます明らかになってきている。感染に関連した炎症はがんの主要な危険因子であり、がんに関連するほぼすべてのウイルスが炎症マーカーであるNF-κBを活性化することが示されている(65)。同様に、ヘリコバクター・ピロリの成分もNF-κBを活性化することが示されている(66)。したがって、慢性炎症をブロックできる薬剤は、これらの疾患の治療に有効であるはずだ。
環境汚染
環境汚染は、さまざまながんとの関連が指摘されている(図7)。多環芳香族炭化水素(PAHs)に関連する炭素粒子による屋外大気汚染、環境タバコ煙、ホルムアルデヒド、ベンゼンや1,3-ブタジエンなどの揮発性有機化合物(特に子供に影響がある)による室内大気汚染、食品添加物や硝酸塩、農薬、ダイオキシン、その他の有機塩素などの発ガン汚染物質、発ガン金属やメタロイド、医薬品、化粧品による食品公害などである(64).
図7 環境発がん物質との関連が指摘されているさまざまながん
それぞれのがんに関連する発がん性物質を括弧内に示す。(64参照)。
PAHsのような数多くの屋外大気汚染物質は、がん、特に肺がんのリスクを増加させる。PAHsは大気中の微細な炭素粒子に付着することができるため、主に呼吸によって体内に浸透する。汚染された都市でPAHを含む空気に長期間さらされると、肺がん死亡のリスクが高まることが判明している。PAHsやその他の微細な炭素粒子とは別に、もう一つの環境汚染物質である一酸化窒素が、非喫煙者のヨーロッパ人集団において肺がんのリスクを高めることが明らかになった。他の研究でも、一酸化窒素は肺がんを誘発し、転移を促進することが示されている。また、自動車排気ガスへの曝露に伴う小児白血病のリスク上昇も報告されている(64)。
揮発性有機化合物や農薬などの室内空気汚染物質は、小児白血病やリンパ腫のリスクを高め、農薬にさらされた子供だけでなく大人も脳腫瘍、ウィルム腫瘍、ユーイング肉腫、胚細胞腫瘍のリスクが高まるとされている。環境有機汚染物質への胎内曝露は、精巣がんのリスクを高めることが判明している。また、焼却炉からの環境汚染物質であるジオキサンは、肉腫やリンパ腫のリスクを高めることが判明した。
塩素処理された飲料水への長期的な暴露は、癌のリスク増加と関連している。飲料水中の硝酸塩は、変異原性のN-ニトロソ化合物に変化し、リンパ腫、白血病、大腸がん、膀胱がんのリスクを増加させる(64)。
放射線
全がん患者の10%までが、電離および非電離の両方の放射線(64)によって誘発される可能性があり、典型的には放射性物質や紫外線、パルス電磁界によるものである。放射線によって誘発されるがんには、ある種の白血病、リンパ腫、甲状腺がん、皮膚がん、肉腫、肺がん、乳がんがある。放射線被曝後のがんのリスク増加の最も良い例として、チェルノブイリ原子力発電所からの放射性降下物の被曝後にスウェーデンで観察された全悪性腫瘍の発生率の増加があげられる。家庭や職場(鉱山など)におけるラドンやラドン崩壊生成物は、電離放射線への最も一般的な被ばく源である。ラドン、ラジウム、ウランの放射性核種が存在すると、ラットの胃がんのリスクが高まることが判明している。また、医療現場で診断や治療のために使用されるX線も放射線被曝の原因の一つである。実際、X線による乳がんのリスクは、乳房の発達が盛んな思春期に胸部照射を受けた女子で最も高くなっている。その他、患者の年齢や生理状態、放射線と発がん物質の相乗作用、放射線に対する遺伝的感受性などが、放射線によるヒトのがんに関連している。
主に太陽光に由来する非イオン化放射線には、ヒトに対して発がん性のある紫外線が含まれている。紫外線は、基底細胞がん、扁平上皮がん、メラノーマなど、さまざまな種類の皮膚がんの主要なリスクとなるため、紫外線を浴びることは、皮膚がんを引き起こす可能性がある。メラノーマは、太陽光による紫外線だけでなく、美容のための日焼けマシンによる紫外線も原因となっている可能性がある。成層圏のオゾン層の破壊は、UVBとUVCの線量強度を増加させ、皮膚がんの発生率をさらに増加させる可能性がある。
低周波の電磁場は、クラストジェニックなDNA損傷を引き起こす可能性がある。電磁波の発生源は、高圧送電線、変圧器、電気鉄道のエンジンなど、あらゆる電気機器である。小児白血病、脳腫瘍、乳がんなどのがんのリスクは、電磁場への曝露が原因であると考えられている。例えば、高圧送電線から200m以内に住む子供の白血病の相対リスクは69%であるのに対し、200~600mに住む子供の相対リスクは23%である。さらに、入手可能なすべての疫学データの最近のメタアナリシスでは、10年以上にわたる携帯電話の毎日の長期使用は、脳腫瘍のリスクを増加させるという一貫したパターンを示した(64)。
癌の予防
全がん患者のうち、遺伝的欠陥によるものは5-10%に過ぎず、残りの90-95%は環境や生活習慣によるものであるという事実は、がんを予防するための大きなチャンスとなる。米国における全がん死亡の発生率に占めるタバコ、食事、感染症、肥満などの要因の割合は、それぞれ約25〜30%、30〜35%、15〜20%、10〜20%、10〜15%であり、がんをいかに予防するかは明白である。肺がんと診断された患者のほぼ90%はタバコを吸う人であり、タバコとアルコール摂取の組み合わせは相乗的に腫瘍形成に寄与する。同様に、無煙タバコは、世界中で40万件(全癌の4%)の口腔癌の原因となっている。したがって、タバコを避け、アルコールの摂取を最小限に抑えることは、がんの発生に大きな影響を与える可能性がある。
様々な細菌やウイルスによる感染(図6)も、様々ながんの原因として非常に著名である。子宮頸がんや肝細胞がんのワクチンは、これらのがんの予防に役立つはずだが、感染症を原因とするがんの予防には、よりクリーンな環境と生活行動の改善がさらに役立つと思われる。
FDAが最初に承認した化学予防薬は、乳がんのリスクを低減するためのタモキシフェンだった。この薬剤は、高リスクの女性において、乳がんの発生率を50%減少させることが判明している。タモキシフェンでは、子宮体がん、血栓、眼球障害、高カルシウム血症、脳卒中などの重大な副作用のリスクが高まっている(http://www.fda.gov/cder/foi/appletter/1998/17970s40.pdf)。最近、骨粗鬆症治療薬のラロキシフェンが、エストロゲン受容体陽性の浸潤性乳癌の予防にタモキシフェンと同等の効果があり、タモキシフェンより副作用が少ないことが示された。副作用に関してはタモキシフェンよりも優れているものの、血栓や脳卒中を引き起こす可能性がある。ラロキシフェンのその他の潜在的な副作用には、ほてり、脚のけいれん、脚や足のむくみ、インフルエンザ様症状、関節痛、発汗などがある(http://www.fda.gov/bbs/topics/NEWS/2007/NEW01698.html)。
臨床に導入された2番目の化学予防剤は、前立腺癌のためのフィナステリドで、高リスクの男性で発生率を25%減少させることが判明している。この薬剤の副作用として、勃起不全、性欲減退、インポテンス、女性化乳房などが認められている(http://www.cancer.org/docroot/cri/content/cri_2_4_2x_can_prostate_cancer_be_prevented_36.asp)。COX-2阻害剤であるCelecoxibは、家族性腺腫性ポリポーシス(FAP)の予防薬として承認されているもう一つの薬剤である。しかし、Celecoxibの化学予防効果は、その深刻な心血管系への害と引き換えである(www.fda.gov/cder/drug/infopage/cox2/NSAIDdecisionMemo.pdf)。FDAが承認した化学予防薬の深刻な副作用は、がんを発症するかしないかわからない健康な人への長期投与を考えた場合、特に懸念される問題である。このことは、安全で効果的ながん予防薬の必要性を明確に示している。食事由来の天然物は、この目的のための潜在的な候補となるであろう。
食事、肥満、メタボリックシンドロームは、さまざまながんと非常に関係が深く、がん死亡の30~35%を占めると考えられており、食事の改善によってがん死亡のかなりの部分を防ぐことができることがわかる。幅広い研究により、果物、野菜、香辛料、穀物からなる食事が、がんを予防する可能性があることが明らかになった(図8)。また、これらの食事に含まれる、がんを予防するための具体的な物質やそのメカニズムについても、広く検討されている。果物、野菜、香辛料、穀物には、化学予防の可能性を示す様々なフィトケミカルが同定されており(図9)、適切な食事ががん予防に役立つことが多くの研究で示されている(46、67–69)。以下では、がん予防における役割を明らかにするために広く研究されている、選りすぐりの食事剤と食事由来の植物化学物質について説明する。
図8 がんを予防する可能性のある果物、野菜、スパイス、調味料、穀物

果物は、1リンゴ、2アプリコット、3バナナ、4ブラックベリー、5チェリー、6シトラスフルーツ、7デザートデーツ、8ドリアン、9ブドウ、10グアバ、11インディアングースベリー、12マンゴー、13マレーアップル、14マンゴスチン、15パイナップル、16ザクロ。

スパイス・調味料は、1ターメリック、2カルダモン、3コリアンダー、4ブラックペッパー、5クローブ、6フェンネル、7ローズマリー、8セサミシード、9マスタード、10リコリス、11ガーリック、12ジンジャー、13パセリ、14シナモン、15カレーリーフ、16カロンジ、17フェヌグリーク、18カンファー、19ペカン、20スターアニス、21フラックスシード、22ブラックマスタード、23ピスタチオ、24クルミ、25ピーナッツ、26カシューナット。

野菜は、1アーティチョーク、2アボカド、3芽キャベツ、4ブロッコリー、5キャベツ、6カリフラワー、7ニンジン、8ダイコン9コールラビ、10オニオン、11トマト、12カブ、13ウルコ、14ウォータークレス、15オクラ、16ジャガイモ、17フィドルヘッド、18ラディッキオ、19小松菜、20塩ブッシュ、21ウィンタースカッシュ、22ズッキーニ、23レタス、24スピナッチ。

穀類は、1米、2小麦、3オート麦、4ライ麦、5大麦、6トウモロコシ、7ジョワール、8ナタマメ、9アワ、10アワ、11ヒエ、12ヒエ、13インゲン豆、14ダイズ、15緑豆、16黒豆、17ピジョンピー、18グリーンピース、19スカーレットランナービーン、20ブラックベルーガ、21ブラウンスパニッシュパルディナ、22グリーン、23グリーン(エストン)、24アイボリーホワイト、25マルチカラーブレンド、26プチクリムゾン、27プチゴールデン、28レッドチーフ。
図9 果物、野菜、香辛料、調味料、穀物由来のフィトケミカルで、がんを予防する可能性があるもの。
- 1ジオスゲニン
- 2グリチルリチン
- 3グリチルレチン酸
- 418-β-グリチルレチン酸
- 5オレアンドリン
- 6オレアノール酸
- 7ベツリン酸
- 8ルペオール
- 9ググルステロン
- 10セラストロール
- 11ウルソール酸
- 12アセチル11ケトβボスウェリック酸
- 13 1′-actoxychavicol acetate
- 14アルファリポ酸15ヤクチノンA
- 16ヤクチノンB.17クルクミン
- 18ジンゲロール
- 19レスベラトロール
- 20ピセアタンノール21ゲニステイン
- 22カプサイシン
- 23ジベンゾイルメタン
- 24ピペリン
- 25カーウエル
- 26インジルイビン-3′-モノキシム
- 27カフェイン酸フェネチルエステル
- 28エモジン
- 29オイゲノール
- 30リナロール
- 31キン酸
- 32ガルシノール
- 33セサミン
- 34ザフラビン-3,3′-ジガレイト
- 35サンギナリン
- 36シリマリン
- 37マンゴスチン
- 38マンギフェリン
- 39ブテイン
- 40ベルベリン
- 41グラブリジン
- 42ミリセチン
- 43カルノソール
- 44βラパコン
- 45エボジアミン
- 46オウゴニン
- 47アピゲニン
- 48(-)-エピゲチン
- 49タンシノンIIA
- 50タンシノンI
- 51(-)-epicatechin gallate
- 52epigallocatechin gallate
- 53カルノソールをいう
- 54ゼルンボン
- 55スルフォラファン
- 56フィチン酸
- 57アリシン
- 58イソチオシアン酸ベンジル
- 59バイカリン
- 60アスコルビン酸
- 61アネトール
- 62インドール3-カルビノール
- 63イソチオシアン酸フェニル
- 64チモキノン
- 65プラムバギン
- 66γ-トコトリエノール
- 67ルテイン
- 68ベータクリプトキサンチン
- 69ベータカロチン
- 70リコペン
- 71アルファトコペロール
果物・野菜
様々な解剖学的部位に発生するがんに対する果物や野菜の保護的役割は、現在では十分に支持されている(46,69)。1966年、Wattenberg(70)は、果物や野菜に含まれる特定の成分の定期的な摂取が、がんからの保護をもたらすかもしれないことを初めて提案した。Doll and Peto(21) は、1981年に米国で診断された癌患者の75-80%が、ライフスタイルの変化によって予防できたかもしれないことを示した。1997年の推定によると、世界中のがん患者の約30〜40%は、実現可能な食事手段によって予防可能であったという(www.dietandcancerreportorg/?p=ER)。果物や野菜に含まれる有効成分のがん化学予防効果については、いくつかの研究が行われている。
25,000種類以上のフィトケミカルが同定されており、様々な癌に対する可能性が期待されている。これらのフィトケミカルは、安全であり、通常、複数の細胞シグナル伝達経路を標的とするため、利点がある(71)。果物や野菜から同定された主な化学予防化合物には、カロテノイド、ビタミン、レスベラトロール、ケルセチン、シリマリン、スルホラファン、インドール-3-カルビノールなどがある。
カロテノイド
果物や野菜に含まれる様々な天然カロテノイドは、抗炎症作用や抗発癌作用があることが報告されている。リコピンは、地中海地域の食事に含まれる主要なカロテノイドの一つであり、ヒト血清中のカロテノイドの50%を占めることができる。リコピンは、スイカ、アプリコット、ピンクグァバ、グレープフルーツ、ローズヒップ、トマトなどの果物に含まれている。トマトを使った様々な加工品が、食事性リコピンの85%以上を占めている。リコピンの抗がん作用は、試験管内試験および生体内試験の腫瘍モデルやヒトで実証されている。リコピンの抗がん作用のメカニズムとして、活性酸素の消去、解毒システムのアップレギュレーション、細胞増殖の妨害、ギャップジャンクションの誘導、細胞周期の進行の抑制、シグナル伝達経路の変調が提案されている。その他、β-カロテン、α-カロテン、ルテイン、ゼアキサンチン、β-クリプトキサンチン、フコキサンチン、アスタキサンチン、カプサンチン、クロセチン、フィトエンなどのカロテノイドが抗がん活性を有すると報告されている(72).
レスベラトロール
レスベラトロールは、ブドウ、ピーナッツ、ベリー類などの果実から発見されたスチルベンである。レスベラトロールは、リンパ系や骨髄系のがん、多発性骨髄腫、乳がん、前立腺がん、胃がん、大腸がん、膵臓がんなど、さまざまな腫瘍に対して抗がん作用を示す。レスベラトロールの成長抑制効果は、細胞周期の停止、Fas/CD95、p53、セラミド活性化、チューブリン重合、ミトコンドリアおよびアデニルシクラーゼ経路によるアポトーシス誘導、p21 p53およびBaxのアップレギュレーション、サバイビン、サイクリンD1、サイクリンE、Bcl-2、Bcl-xLおよび細胞アポトーシス阻害タンパクのダウンを介する;カスパーゼの活性化、一酸化窒素合成酵素の抑制、NF-κB、AP-1、初期成長反応-1などの転写因子の抑制、シクロオキシゲナーゼ-2(COX-2)およびリポキシゲナーゼの抑制、接着分子の抑制、血管新生・浸潤・転移の抑制。レスベラトロールは、ヒトにおける限られたデータから、薬理学的に安全であることが明らかにされている。栄養補助食品として、レスベラトロールは50μgから60mgの用量で米国とヨーロッパで市販されている。現在、バイオアベイラビリティを改善したレスベラトロールの構造類似体が、癌の化学予防および治療薬の候補として追求されている(73)。
ケルセチン
フラボンであるケルセチン(3,3′,4′,5,7-ペンタヒドロキシフラボン)は、主要な食物フラボノイドの一つで、幅広い種類の果物、野菜、お茶やワインなどの飲料に含まれており、欧米諸国の1日の摂取量は25-30mgと言われている。この分子の抗酸化作用、抗炎症作用、抗増殖作用、アポトーシス作用は、細胞培養モデルで大きく解析されており、NF-κBの活性化をブロックすることが知られている。動物モデルでは、ケルセチンが炎症を抑制し、結腸および肺がんを予防することが示されている。第1相臨床試験では、この分子を安全に投与できること、血漿レベルがリンパ球のチロシンキナーゼ活性を阻害するのに十分であることが示された。タマネギとリンゴに含まれるケルセチンの摂取は、ハワイにおける肺がんリスクと逆相関することが明らかになった。タマネギの効果は、特に扁平上皮癌に対して強かった。別の研究では、タマネギの食事後にケルセチンの血漿濃度が上昇すると、リンパ球のDNAの鎖切断に対する抵抗力が増し、尿中のいくつかの酸化的代謝物の濃度が減少した(74)。
シリマリン
フラボノイドのシリマリン(シリビン、イソシリビン、シリクリスチン、シリジアニン、タキシフォリン)は、ミルクシスル(Silybum marianum)という植物の乾燥果実によく含まれている。シリマリンの抗酸化剤および肝保護剤としての役割はよく知られているが、抗がん剤としての役割はまだ始まったばかりである。シリマリンの抗炎症作用は、COX-2、リポキシゲナーゼ(LOX)、誘導性NO合成酵素、TNF、IL-1などのNF-κB制御遺伝子産物の抑制によって媒介される。シリマリンは、紫外線、7,12-ジメチルベンズ(a)アントラセン(DMBA)、フォルボール12-ミリスチン酸13-アセテートなど、様々な発がん物質や腫瘍促進物質に対して生体内で化学予防作用を示すことが、数多くの研究で示されている。また、シリマリンは、MDRタンパク質のダウンレギュレーションやその他のメカニズムを通じて、化学療法剤に対して腫瘍を感作することが示されている。エストロゲンとアンドロゲン受容体の両方に結合し、前立腺特異抗原をダウンレギュレートする。化学予防効果に加え、シリマリンはネズミの腫瘍(前立腺や卵巣など)に対する活性を示す。様々な臨床試験により、シリマリンは生物学的に利用可能で薬理学的に安全であることが示されている。現在、様々な癌に対するシリマリンの臨床効果を実証するための研究が進行中である(75)。
インドール-3-カルビノール
フラボノイドのインドール-3-カルビノール(I3C)は、キャベツ、ブロッコリー、芽キャベツ、カリフラワー、ダイコンアーティチョークなどの野菜に含まれている。I3Cの加水分解物は、二量体の3,3′-ジインドリルメタンなど、様々な生成物に代謝される。I3Cと3,3′-ジインドリルメタンは共に様々な生物学的、生化学的効果を発揮するが、そのほとんどはI3Cがいくつかの核転写因子を調節するために起こるようだ。I3Cは、エストロゲンを含む発がん性物質を代謝する第1相および第2相酵素を誘導する。また、I3Cは再発性呼吸器乳頭腫症の一部の症例に有効であることが判明しており、他の臨床用途がある可能性がある(76)。
スルフォラファン
スルフォラファン(SFN)は、ブロッコリーなどのアブラナ科の野菜に含まれるイソチオシアネートの一種である。その化学予防効果は、試験管内試験と生体内試験の両方の研究で確立されている。SFNの作用機序としては、第1相酵素の阻害、第2相酵素の誘導による発がん物質の解毒、細胞周期の停止、アポトーシスの誘導、ヒストン脱アセチル化酵素の阻害、MAPK経路の調節、NF-κBの阻害、活性酸素の産生などが挙げられる。この化合物の前臨床試験および臨床試験では、発癌のいくつかの段階における化学予防効果が示唆されている。臨床試験では、8人の健康な女性が選択的乳房縮小術を受ける1時間前にSFNを投与した。全患者の乳房組織でNAD(P)H/キノンオキシドレダクターゼとヘムオキシゲナーゼ-1の誘導が観察され、SFNの抗がん作用が示唆された(77).
お茶・スパイス
スパイスは、食品の風味や味、栄養価を高めるために世界中で使用されている。カテキン(緑茶)、クルクミン(ウコン)、ジアリルジスルフィド(ニンニク)、チモキノン(ブラッククミン)、カプサイシン(赤唐辛子)、ジンゲロール(生姜)、アネットール(甘草)、ジオスゲニン(フェヌグリーク)、オイゲノール(クローブ、シナモン)等のフィトケミカルには、解剖学上の様々な癌の治療・予防効果があることが多くの研究から明らかにされている。その他、エラグ酸(クローブ)、フェルラ酸(フェンネル、マスタード、ゴマ)、アピゲニン(コリアンダー、パセリ)、ベツリン酸(ローズマリー)、ケンフェロール(クローブ、フェヌグリーク)、セサミン(ゴマ)、ピペリン(コショウ)、リボネン(ローズマリー)およびガンボジック酸(コクム)などがこの可能性を持つ植物化学物質である。以下、がんに関連する重要なフィトケミカルについて説明する。
カテキン
緑茶や紅茶に含まれるカテキンには、さまざまながんに対する可能性があることが、3,000件以上の研究によって示されている。また、緑茶ポリフェノールの化学的予防に関する試験から得られるデータも限られている。健康なボランティアを対象とした第1相試験では、様々な緑茶製剤の短期経口投与による基本的な生体内分布パターン、薬物動態パラメータ、予備的な安全性プロファイルが定義されている。緑茶の摂取は比較的安全であると思われる。前癌状態の確立した患者において、緑茶誘導体は、大きな毒性作用を引き起こすことなく、子宮頸癌、前立腺癌、および肝癌に対する潜在的な有効性を示している。ある新しい研究では、固形腫瘍の患者であっても、1日3回、1g(約900mlの緑茶に相当)までの緑茶固形物を安全に摂取することができると判断された。この観察は、がんの予防と治療の両方に緑茶を使用することを支持するものである(78)。

クルクミン
クルクミンは、炎症抑制やがんの化学予防について、食事から分離された化合物の中で最も広く研究されている化合物の1つであり、約3000件の研究結果が発表されていることからも明らかだ。私たちの研究室では、クルクミンがさまざまながん細胞株でNF-κBおよびNF-κB制御遺伝子発現を阻害することを示した。In vitroおよび生体内試験の研究では、この植物化学物質が乳がん、食道がん、胃がん、大腸がんモデルを含む動物モデルにおいて炎症と発がんを抑制することが示された。その他の研究では、クルクミンが潰瘍性直腸炎やクローン病を抑制することが示され、ある研究では、クルクミンがヒトにおいて潰瘍性大腸炎を抑制することが示された。また、熱帯性膵炎の患者を対象に、クルクミンとピペリンの併用による効果を評価した研究もある。家族性腺腫性ポリポーシスの患者を対象に行われたある研究では、クルクミンがこの症状を抑制する役割を果たす可能性があることが示された。その研究では、5人の患者全員にクルクミンとケルセチンを平均6カ月間投与したところ、副作用が少なく、検査で決定された異常もなく、ベースラインからポリープの数(60.4%)とサイズ(50.9%)が減少した。
大腸がん患者におけるクルクマエキスの経口投与による薬力学的および薬物動態学的効果も研究されている。標準的な化学療法に抵抗性の進行大腸がん患者を対象とした研究では、15人の患者にクルクマエキスを最長4カ月間毎日投与した。その結果、クルクマエキスの経口投与は忍容性が高く、用量制限的な毒性作用は観察されなかった。別の研究では、進行した大腸がん患者において、1日3.6gのクルクミンを投与すると、投与1時間後に採取した血液サンプルにおいて、誘導性プロスタグランジンE2産生が1日目に62%減少し、29日目に57%減少することが示された。
様々な部位(乳房37、外陰部4、口腔7、皮膚7、その他11)に外部がん病変を有するがん患者62名を対象とした初期の臨床試験では、クルクミン含有軟膏の外用により、嗅覚(90%)、かゆみ(ほぼ全員)、病変の大きさや痛み(10%)、浸出液(70%)が減少したことが報告されている。第1相臨床試験において、クルクミン1日8,000mgを3カ月間経口投与したところ、子宮頸部上皮内新生物(4例中1例)、腸管形質転換(6例中1例)、膀胱癌(2例中1例)、口腔白板症(7例中2例)の患者で前癌病変を組織学的に改善した。
私たちのグループが行った別の研究の結果、この研究に登録された29名の多発性骨髄腫患者の末梢血単核球において、クルクミンがNF-κB、COX-2、STAT3の構成的活性化を抑制することが示された。クルクミンは、2,4,8,12g/日の用量で経口投与された。クルクミンの投与は、有害事象を伴わず、良好な忍容性を示した。29名の患者のうち、12名が12週間の治療を受け、5名が1年間の治療を終えて病勢が安定した。私たちのグループの他の研究では、クルクミンが膵臓がんを抑制することを示した。クルクミンは、患者の末梢血単核細胞(そのほとんどが健康なボランティアに見られるレベルよりかなり高いベースライン値を持っていた)において、NF-κB、COX-2、およびリン酸化STAT3の発現をダウンレギュレートしたのである。これらの研究により、クルクミンが強力な抗炎症剤および化学予防剤であることが示された。クルクミンとその抗がん作用に関する詳しい説明は、私たちの最近のレビューの1つに掲載されている(79)。
ジアリルジスルフィド
ニンニクから単離されたジアリルジスルフィドは、結腸、乳房、膠芽腫、メラノーマ、神経芽腫細胞株を含む多くの癌細胞株の成長と増殖を阻害する。最近の研究では、この化合物がCOX-2、NF-κB、ERK-2を阻害することにより、Colo 320 DMヒト結腸がん細胞においてアポトーシスを誘導することが示された。ジメチルヒドラジン誘発大腸がん、ベンゾaピレン誘発新生物、マウスのグルタチオンS-トランスフェラーゼ活性、ベンゾaピレン誘発皮膚発がん、N-ニトロソメチルベンジルアミン誘発食道がん、A/J雌マウスにおけるN-ニトロソジエチルアミン誘発森林胃新生物など多くのがんの抑制が示されている;アリストロキア酸によるラット森林胃発がん、ジエチルニトロサミンによるラット肝臓のグルタチオンSトランスフェラーゼ陽性病巣、2-アミノ-3-メチルイミダゾ[4,5-f]キノリンによるラット肝発がん、ジエチルニトロサミンによるC3Hマウスの肝病巣と肝細胞腺腫。また、ジアリルジスルフィドは、カルバミン酸ビニルおよびN-ニトロソジメチルアミンによる変異原生または腫瘍形成、アフラトキシンB1誘発およびN-ニトロソジエチルアミン誘発のラットの肝前増殖巣を阻害することが示されている;ヒト前骨髄球性白血病細胞のアリールアミンN-アセチルトランスフェラーゼ活性および2-アミノフルオレン-DNA付加物、DMBA誘発マウス皮膚腫瘍、N-ニトロソメチルベンジルアミン誘発ラット食道突然変異、ジエチルスチルベステロール誘発雌ACIラットの乳房のDNA付加物。
ジアリルジスルフィドは、ラジカルの消去、グルタチオン量の増加、グルタチオンSトランスフェラーゼやカタラーゼなどの酵素活性の増加、シトクロムp4502E1やDNA修復機構の阻害、染色体損傷の防止などのメカニズムにより抗発がん作用をもたらすと考えられている(80)。
チモキノン
ブラッククミンの化学療法剤および化学保護剤には、チモキノン(TQ)、ジチモキノン(DTQ)、チモヒドロキノンがあり、これらはこの種子の油に含まれている。TQは、様々な腫瘍細胞に対して抗悪性腫瘍活性を示す。また、DTQはNigella sativaの化学療法効果に寄与している。In vitro試験の結果、DTQとTQは、いくつかの親細胞株とそれに対応する多剤耐性ヒト腫瘍細胞株に対して同等の細胞毒性があることが示された。TQは、癌細胞株において、p53依存性およびp53非依存性の経路でアポトーシスを誘導する。また、細胞周期の停止を誘導し、炎症性メディエーターのレベルを調節する。現在までのところ、TQの化学療法の可能性は検証されていないが、多くの研究により、動物モデルにおいてその有望な抗がん作用が示されている。TQは、マウスにおける発がん物質誘発性の森林胃および皮膚腫瘍形成を抑制し、皮膚腫瘍形成の初期段階における化学予防剤として機能する。さらに、TQと臨床で使用されている抗がん剤を併用すると、薬剤の治療指数が向上し、非腫瘍組織が化学療法による損傷を受けるのを防ぎ、シスプラチンやイホスファミドなどの薬剤の抗腫瘍活性を高めることが示されている。私たちのグループからの非常に最近の報告では、TQがNF-κBおよびNF-κB制御遺伝子産物を抑制することによって、NF-κBシグナル伝達経路に影響を与えることが立証された(81)。

カプサイシン
赤唐辛子の成分であるフェノール化合物カプサイシン(t8-methyl-N-vanillyl-6-nonenamide)は、広範囲に研究されている。カプサイシンは発がん性が疑われているが、化学的予防効果があることを示唆する証拠がかなり多くある。カプサイシンの抗酸化作用、抗炎症作用、抗腫瘍作用は、試験管内試験と生体内試験の両方の系で確立されている。例えば、培養HL-60細胞において、カプサイシンがTPA刺激によるNF-κBおよびAP-1の活性化を抑制することが示された。また、カプサイシンは、悪性黒色腫細胞におけるNF-κBの構成的活性化を抑制した。さらに、カプサイシンは、マウスのTPA刺激によるNF-κBの活性化および表皮のAP-1の活性化を強く抑制した。また、カプサイシンの作用機序として、様々な化学発がん物質や変異原の活性化と解毒に関与する、異種物質代謝酵素との相互作用が提案されている。肝酵素によるカプサイシンの代謝は、酵素や組織高分子の活性部位に結合できる反応性フェノキシラジカル中間体を生成する。

カプサイシンは、血小板凝集を抑制し、カルシウムイオノフォア刺激による炎症性反応(マクロファージにおけるスーパーオキシドアニオンの生成、ホスホリパーゼA2活性、膜脂質の過酸化など)を抑制することができる。実験動物の様々な臓器において、抗酸化物質として作用する。また、発がん性物質で誘発された炎症に対するカプサイシンの抗炎症作用がラットやマウスで報告されている。カプサイシンは、COX-2の抑制と関連するエタノール誘発胃粘膜傷害、出血性びらん、脂質過酸化、ミエロペルオキシダーゼ活性に対する保護効果をラットで発揮した。本質的な腫瘍促進活性はないが、カプサイシンはTPAで促進されたマウス皮膚乳頭腫の発生を抑制した(82)。
ジンゲロール
ジンゲロールは、香辛料であるショウガ(Zingiber officinale Roscoe)に主に含まれるフェノール物質で、抗酸化作用、抗アポトーシス作用、抗炎症作用など多様な薬理作用を有する。ジンゲロールは、抗がん作用や化学予防作用があり、その作用機序として、p38 MAPK-NF-κBシグナル伝達経路の遮断によるCOX-2発現抑制などが提案されている。ジンゲロールのがん予防能に関する詳細な報告は、ShuklaとSinghによる最近の総説で紹介されている(83)。
アネトール
香辛料フェンネルの主な有効成分であるアネトールは、抗がん作用を示すことが知られている。1995年、Al-Harbiら(84)は、マウスの腫瘍モデルで誘発されたEhrlich腹水癌に対するアネトールの抗腫瘍活性を研究した。その結果、アネトールは生存時間を延長し、腫瘍重量を減少させ、EATを有するマウスの体積と体重を減少させることが明らかになった。また、肉球のEAT細胞において有意な細胞毒性作用を示し、核酸やMDAの濃度を低下させ、NP-SH濃度を上昇させた。

アネトール投与後に観察された病理組織学的変化は、標準的な細胞毒性薬であるシクロホスファミドによる投与後のものと同等であった。小核の発生頻度、多色性赤血球と正常赤血球の比率から、アネトールはマウスの大腿骨細胞において分裂抑制作用と非破裂原性であることがわかった。1996年、Senら(85)は、アネトールとアネトールジチオンの誘導体のNF-κB阻害活性を研究した。その結果、アネトールは、ヒトjurkat T細胞におけるH2O2、酢酸ミリスチン酸フォルボール、TNF-αによるNF-κB活性化を抑制した(86)ラット乳腺がんモデルにおけるDMBA誘発に対するアネトールトリチオンの抗発がん活性を検討した。その結果、このフィトケミカルは用量依存的に乳腺腫瘍の成長を抑制することが示された。
中川と鈴木(87)は、新鮮な単離ラット肝細胞と培養ヒト乳ガン細胞MCF-7を用い、トランスアネトール(アネトール)の代謝と作用機序、および化合物とその代謝物のエストロゲン様活性を検討した。その結果、アネトールの生体内変換は、水酸化中間体である4OHPBの濃度に基づいて、ラット肝細胞では高濃度で細胞毒性、MCF-7細胞では低濃度でエストロゲン作用を誘導することが示唆された。前臨床試験の結果から、有機硫黄化合物であるアネトールジチオールチオンが肺がんに対する有効な化学予防剤となる可能性が示唆された。Lamら(88)は、気管支異形成の喫煙者を対象に、アネトールジチオンの第2b相試験を実施した。この臨床試験の結果から、アネトールジチオンは肺がんに対する有効な化学予防剤となる可能性があることが示唆された。
ジオスゲニン
フェヌグリークに含まれるステロイド系サポニンであるジオスゲニンは、様々な腫瘍細胞において、炎症の抑制、増殖の抑制、アポトーシスの誘導を示すことが知られている。過去10年間の研究により、ジオスゲニンが様々ながん細胞株において、増殖を抑制し、アポトーシスを誘導することが明らかになっている。ジオスゲニンの抗増殖作用は、細胞周期の停止、Ca2+ホメオスタシスの破壊、p53の活性化、アポトーシス誘導因子の放出、およびカスパーゼ3活性の調節を介して媒介されている。また、ジオスゲニンは、アゾキシメタンによって誘発される異常な結腸陰窩を抑制し、腸の炎症を抑制することが示されており、LOXおよびCOX-2の活性を調節することが知られている。また、ジオスゲニンは、炎症反応を媒介するケモカイン受容体CXCR3に結合することが示されている。ジオスゲニンは、Aktのダウンレギュレーション、IκBキナーゼの活性化、NF-κB制御の遺伝子発現を通じて、破骨細胞形成、細胞浸潤、細胞増殖を抑制することが、私たちの研究室からの結果で示されている(89)。

オイゲノール
オイゲノールは、クローブの有効成分の一つである。Ghoshら(90)が行った研究では、オイゲノールがメラノーマ細胞の増殖を抑制することが示された。B16異種移植研究において、オイゲノールを投与すると、腫瘍の成長が著しく遅延し、腫瘍の大きさがほぼ40%減少し、エンドポイントまでの時間の中央値が19%増加した。さらに重要なことは、対照群の動物の50%が転移性増殖で死亡したのに対し、オイゲノール処理群では細胞の浸潤や転移の兆候を示すものはなかったことである。1994年、Sukumaranら(91)は、オイゲノールDMBAがマウスに皮膚腫瘍を誘発することを示した。同じ研究で、オイゲノールはスーパーオキシドの形成と脂質の過酸化を抑制し、化学予防作用の原因と思われるラジカル消去活性があることが示された。今井田ら(92)の研究では、オイゲノールは1,2-ジメチルヒドラジンによる森林胃の過形成と乳頭腫の発生を促進したが、F344雄ラットにおける1-メチル-1-ニトロソウレアによる腎腎芽腫の発生率を低下させたことが示された。

Pisanoら(93)が行った別の研究では、オイゲノールと関連するビフェニル(S)-6,6′-ジブロモ-デヒドロジイゲノールが神経外胚葉腫瘍細胞に対して特異的な抗増殖活性を引き出し、部分的にアポトーシスを誘発することが示された。2003年、Kimら(94)は、オイゲノールがHT-29細胞およびリポポリサッカライド刺激マウスマクロファージRAW264.7細胞においてCOX-2 mRNA発現(炎症および発癌のプロセスに関与する主要遺伝子の1つ)を抑制することを示した。Deignerら(95)による別の研究では、1′-ヒドロキシオイゲノールは、5-リポキシゲナーゼおよびCu(2+)媒介の低密度リポタンパク質酸化の優れた阻害剤であることが示された。Rompelbergら(96)の研究では、生体内試験でラットをオイゲノールで処理するとSalmonella typhimurium変異原性アッセイでベンゾピレンの変異原性が減少するが、試験管内試験で培養細胞をオイゲノールで処理するとベンゾピレンの遺伝毒性が増加することが示された。
ホールグレインフーズ(全粒穀物)
主な全粒穀物食品は小麦、米、トウモロコシで、主なものは大麦、ソルガム、キビ、ライ麦、オート麦である。穀物はほとんどの文化圏で主食として食べられているが、西洋化した国ではほとんどが精白穀物製品として食べられている(97)。全粒穀物には、ビタミンE、トコトリエノール、フェノール酸、リグナン、フィチン酸などの化学的予防のための抗酸化物質が含まれている。全粒穀物の抗酸化物質の含有量は、一部のベリー類よりは少ないが、一般的な果物や野菜よりは多い(98)。精製工程では、炭水化物が濃縮され、外側の層が取り除かれるため、他の多量栄養素、ビタミン、ミネラルの量は減少する。実際、癌の予防作用が期待される栄養素はすべて減少している。例えば、ビタミンEは92%も減少する(99)。

全粒粉の摂取は、口腔、咽頭、食道、胆嚢、喉頭、腸、大腸、上部消化管、乳房、肝臓、子宮内膜、卵巣、前立腺、膀胱、腎臓、甲状腺、およびリンパ腫、白血病、ミエローマを含むいくつかの癌のリスクを低減することがわかっている(100,101).これらの研究では、全粒粉食品の摂取により、がんのリスクが30~70%減少した(102)。
全粒粉はどのようにしてがんのリスクを低減するのだろうか。いくつかの潜在的なメカニズムが説明されている。例えば、全粒粉の主成分である不溶性食物繊維は、腸がんのリスクを低減することができる(103)。さらに、不溶性食物繊維は発酵を受けるため、腫瘍形成の重要な抑制因子である酪酸などの短鎖脂肪酸を生成する(104)。また、全粒粉は、乳がんや大腸がんを予防する好ましいグルコース反応を媒介する(105)。また、穀物や豆類に含まれるいくつかの植物化学物質が、様々ながんに対して化学予防作用を持つことが報告されている。例えば、イソフラボン(ダイゼイン、ゲニステイン、エクオールなど)は、マメ科の植物に含まれる非ステロイド性のジフェノール化合物で、抗増殖作用がある。イソフラボンを多く含む大豆ベースの食事と、ヒトのがん発症率やがんによる死亡率の低下との間に有意な相関があることが、すべてではないがいくつかの研究で示されている。私たちの研究室では、トコフェロールではなくトコトリエノールが、ほとんどの発がん物質によって引き起こされるNF-κBの活性化を抑制し、腫瘍の増殖、生存、浸潤、血管新生に関連するさまざまな遺伝子の抑制につながることを明らかにしている(106)。
観察研究では、大豆イソフラボンを多く含む食事(典型的なアジアの食事など)が、アジアで観察される前立腺がんの発生率および死亡率が低いことの最も大きな要因の1つであることが示唆されている。日本人の食生活やダイゼイン、ゲニステイン、エクオールの尿中排泄量を欧米人と比較した結果、大豆製品に含まれるイソフラボノイドががんリスク低減の原因物質であることが提唱された。乳がんに対する効果に加えて、ゲニステインと関連するイソフラボンは、胃、膀胱、肺、前立腺、血液の細胞増殖や化学的に誘発されたがんの発生を抑制する(107)。

ビタミン類
ビタミンのがん化学予防効果については、賛否両論があるが、その評価は高まっている。ビタミン、特にビタミンC、D、Eは、明らかな毒性を伴わないがん化学予防活性を持つことが報告されている。
疫学研究の結果、様々な種類のがんに対するビタミンCの抗がん・化学予防効果は、ビタミンCの抗酸化作用、炎症およびギャップジャンクションの細胞間コミュニケーションの抑制と相関していることが示唆された。最近の疫学調査の結果、血漿中のビタミンC濃度が高いほど、がん関連死亡率と逆相関があることが示された。1997年、世界がん研究基金と米国がん研究所の専門家委員会は、ビタミンCが胃、口、咽頭、食道、肺、膵臓、子宮頸部のがんのリスクを低減できると推定した(108)。
ビタミンDの保護作用は、細胞の成長、分化、アポトーシス、および癌の発生に関わる広範な細胞メカニズムを制御する核転写因子としての役割に起因する(109)。
エクササイズ/フィジカルのアクティビティ
定期的な運動が様々な癌の発生を減少させることを示唆する広範な証拠がある。座りっぱなしのライフスタイルは、ほとんどの慢性疾患と関連している。運動不足は、乳がん、結腸がん、前立腺がん、膵臓がん、メラノーマのリスク上昇と関連している(110)。運動不足が原因とされる座りがちな女性の乳がんリスクの増加は、血清中のエストラジオール濃度が高く、ホルモン結合グロブリン濃度が低く、脂肪量が多く、血清インスリン濃度が高いことと関連している。運動不足は、大腸がんのリスクを高め(消化管通過時間が長くなり、潜在的な発がん物質との接触時間が長くなるためと考えられる)、インスリンの循環レベルを高め(大腸上皮細胞の増殖を促進)、プロスタグランジンのレベルを変え、免疫機能を低下させ、胆汁酸代謝を変更する可能性もある。さらに、運動量の少ない男性や肥満度の高い女性では、大腸がんの30~50%にみられるKi-ras変異が腫瘍にある可能性が高かった。身体活動レベルが最も高い人では、結腸がんの発生率が50%近く減少することが確認された(111)。同様に、運動不足による血中テストステロンやIGF-1値の上昇、免疫力の抑制は、前立腺がんの発生率を高める可能性がある。ある研究では、座りっぱなしの男性は週5~7日運動している人に比べて、メラノーマの発生率が56%、女性は72%高いことが示された(112)。
カロリー制限について
断食は、ほとんどの文化圏で規定されているカロリー制限(CR)の一種である。CRが癌の発生に影響を与えるというおそらく最初の報告の一つは、1940年にマウスの皮膚腫瘍と肝腫の形成について発表された(113,114)。それ以来、このテーマに関するいくつかの報告が発表されている(115,116)。食事制限、特にCRは実験的発がんにおける主要な修飾因子であり、新生物の発生率を著しく低下させることが知られている。GrossとDreyfussは、カロリー摂取を36%制限することで、放射線誘発の固形腫瘍および/または白血病が劇的に減少することを報告した(117,118)。また、Yoshidaら(119)は、CRがマウスの全身照射による単回治療で誘発される骨髄性白血病の発生率を低下させることを示した。
CRがどのように癌の発生を減少させるかは、完全には解明されていない。げっ歯類におけるCR は、血漿グルコースおよび IGF-1のレベルを低下させ、不可逆的な有害作用なしに癌および炎症を先送りまたは減衰させる(120)。齧歯類におけるCRの効果について行われた研究のほとんどは長期的なものだが、一過性のCRを日常的に行っているヒトでは、そのようなことは不可能である。一過性のCRがヒトの癌に与える影響は不明である。
結論
以上のような研究をもとに、私たちは、がんを引き起こすすべての生活習慣要因(発がん物質)と、がんを予防するすべての薬剤(化学予防物質)は、慢性炎症を介してつながっているという統一的な仮説を提案する(図10)。慢性炎症が腫瘍形成経路と密接に関連していることは、多くの証拠から明らかだ。
図10発がん物質は炎症の主要なメディエーターであるNF-κBの活性化を活性化し、化学予防剤はその活性化を抑制する
第一に、サイトカイン(TNF、IL-1、IL-6、ケモカインなど)、酵素(COX-2,5-LOX、MMP-9など)、接着分子(細胞間接着分子1、内皮白血球接着分子1、血管細胞接着分子1など)などの炎症マーカーは腫瘍形成に深く関係してきた。第二に、これらの炎症性遺伝子産物はすべて、核内転写因子であるNF-κBによって制御されていることが示されている。第三に、NF-κBは、腫瘍細胞の生存や抗アポトーシス(Bcl-2、Bcl-xL、IAP-1、IAP-2、XIAP、サバイビン、cFLIP、TRAF-1)、増殖(c-myc、サイクリンD1など)、浸潤(MMP-9)、血管新生(血管内皮増殖因子)などの腫瘍形成と関連した他の遺伝子産物の発現を制御することがわかってきた。第四に、ほとんどのがんでは、慢性炎症が腫瘍形成に先行している。
第五に、タバコの煙、肥満、アルコール、高血糖、感染症、日光、ストレス、食物発がん物質、環境汚染物質など、ほとんどの発がん物質やその他のがんの危険因子が、NF-κBを活性化することが示されている。第六に、NF-κBの構成的な活性化は、ほとんどの種類のがんで遭遇している。第7に、癌の治療に用いられる化学療法剤やγ線は、NF-κBを活性化させるものが多い。第8に、NF-κBの活性化は、化学療法抵抗性および放射線抵抗性に関連している。第9に、NF-κBの抑制は、腫瘍の増殖を抑制し、アポトーシスに導き、浸潤を抑制し、血管新生を抑制する。第10に、様々ながんで遭遇するTNF、IL-1、IL-6、サイクリンD1遺伝子の多型は、すべてNF-κBによって制御されている。また、NF-κBの阻害剤をコードする遺伝子の変異が、ある種のがんで見つかっている。第11に、上記の化学予防薬のほとんどが、NF-κBの活性化を抑制することが明らかにされている。要約すると、この総説では、がんの主要な危険因子に基づくがんの予防可能性について概説している。食事とタバコに起因するがん関連死亡の割合は、世界で60-70%と高い。
謝辞
本研究は、The Clayton Foundation for Research(B.B.A.へ)の支援を受けている。







