Contents
Melatonin Therapy in Patients with Alzheimer’s Disease
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC4665493/
オンライン 2014 Apr 10
概要
アルツハイマー病(AD)は大きな健康問題であり、その予防のための努力を政府機関と非政府機関の両方で行わなければならないという認識が高まっている。松果体の産物であるメラトニンは、時間生物学的、細胞保護的な特性を持ち、ADの様々な側面に役立つ可能性があるため、重要な意味を持っている。加齢に伴う特徴の一つとして、循環しているメラトニンの量が徐々に減少することが挙げられる。限られた数の治療試験では、メラトニンがADおよび最小限の認知障害(ADに発展する可能性がある)の治療において神経保護剤としての治療効果があることが示されている。in vitroおよびin vivoにおいて、メラトニンは、ADの実験モデルで見られる神経変性を抑制した。このような効果を得るためには、睡眠や概日リズムに影響を与えるのに必要な量よりも約2桁高いメラトニンの投与量が必要である。最近では、作用が持続する強力なメラトニンアナログの開発が注目されており、睡眠障害やうつ病の患者を対象とした臨床試験では、メラトニンの用量よりもかなり高い用量で使用されている。メラトニンアナログの相対的な効力は天然化合物よりも高いことから、ADなどの神経変性疾患に対するメラトニンの治療効果を評価するためには、メラトニンを50~100 mg/日の範囲で使用する臨床試験が早急に必要であると考えられる。
キーワード:メラトニン、アルツハイマー病、神経変性、フリーラジカル、酸化ストレス、加齢、軽度認知障害、メラトニン類似体
1. はじめに
神経変性疾患は,認知・運動・感覚系の神経細胞が選択的かつ対称的に失われることを特徴とする慢性・進行性の疾患群である。アルツハイマー病(AD)は、この種の疾患の中で最も臨床的に重要な疾患である。アルツハイマー病における特異的な神経変性の原因はいまだに解明されていないが、フリーラジカルによる損傷、ミトコンドリア機能障害、および興奮性毒性という3つの主要かつ相互に関連したプロセスが、神経細胞死を引き起こす病態生理学的メカニズムの根底にある[1]。
ADは、健康に非常に大きな影響を与える。国際アルツハイマー病協会(ADI)は、最近の発表[2]で、現在4,400万人が認知症を患っており、2050年にはこの数字が1億3,500万人にまで増加すると述べている。現在の認知症の経済的コストは、年間6040億ドルとなっている。今回の推計値は、2009年に発表された数値よりも17%増加しており、人口の高齢化がその主な要因となっていることに留意する必要がある。また、ADIの報告書では、2050年までに認知症の世界的な負担の分布が変化し、罹患者の71%が低・中所得国に住むようになると予測している。肥満、高血圧、糖尿病、運動不足、喫煙などを対象としたキャンペーンや、教育、認知機能の向上などにより、認知症の10%が回避できると推定されている。このように、ADを早期に予防する取り組みが早急に必要であるという認識が高まっている。
高齢者が抗酸化物質を定期的に摂取することは、加齢に伴うフリーラジカルを介した神経変性疾患の予防のために推奨されている戦略の一つだが、この治療法の有効性については議論がある[3]。このような背景から,メラトニンの細胞保護剤としての利用が注目されている。メラトニンは、ほとんどの植物に存在する保存状態の良いメトキシインドールで、時間生物学的特性に加えて顕著な細胞保護作用を有する。循環するメラトニンの源は松果体であり、血漿メラトニンの減少が加齢の特徴の一つであることを裏付けるデータが数多くある[4]。ここでは、神経変性プロセスに関連するメラトニンの生物学的側面について簡単に説明する。次に、ADにおけるメラトニンの理論と作用機序について説明する。最後に、ADにおけるメラトニンの治療的使用を支持する臨床研究を批判的に評価する。
2. 神経変性に関連するメラトニンの基礎生物学
哺乳類の血中メラトニンは、ほぼ松果体からのみ得られる[5]。さらに、メラトニンは、リンパ球、骨髄、胸腺、消化管、皮膚、目など、多くの細胞、組織、器官で局所的に合成されている([6,7]参照)。メラトニンの出現は脊椎動物に限らず,バクテリア,単細胞真核生物,植物など多くの分類群にほぼ遍在しているという事実[6,8]は,この分子が進化の過程で多くの付加的な機能を獲得したことを強調している。
他の動物でもヒトでも、メラトニンは、夜の長さを知らせるだけでなく、フリーラジカルの消去や免疫反応を促進するなど、多様な生理機能に関与しており、その結果、関連する細胞保護特性を示している[6]。実際、細胞保護作用があるからこそ、メラトニンがほとんどの生物に存在することができるのだろう。メラトニンの全身および細胞内での機能は、必要なアゴニストの量によって異なる。一般的に、生体リズムに対するメラトニンの効果は、ナノモル濃度で、受容体を介したメカニズムで発揮される。メラトニンの細胞保護作用には、いくつかの組織でメラトニンが細胞内に到達する量と同じ、100~1000倍の濃度が必要である[7]。
循環しているメラトニンはアルブミンと結合し[9]、主に肝臓で主にC6位の水酸化によって代謝される。この代謝は、肝ミクロソームのチトクロームP450 1A2(CYP1A2)によって選択的に行われ、肝CYP2C19、および大部分が肝外のCYP1A1とCYP1B11Aがわずかに寄与する[9,10,11,12]。生成された6-ヒドロキシメラトニンは、硫酸またはグルクロニドと結合し、尿中に排泄される。もう一つの重要な代謝物は、O-脱メチル化によって生成されるN-アセチルセロトニンで、メラトニンの投与量の20%を占めることもある[13]。
メラトニンはまた、組織内でピロール環が酸化的に切断され、キヌラミン誘導体に代謝される。主な分解産物は,N1-アセチル-N2-ホルミル-5-メトキシキヌラミン(AFMK)で,アリルアミンホルムアミダーゼまたはヘモペルオキシダーゼによって脱ホルミル化され,N1-アセチル-5-メトキシキヌラミン(AMK)となる[14]。AFMKはメラトニンの主要な活性代謝物であり,細胞保護作用を媒介することが提案されている[15]。また、メラトニンは、2つのヒドロキシルラジカルを直接消去する過程で、環状の3-ヒドロキシメラトニンに変換される[15]。メラトニンは急速に代謝されるため、半減期は約1時間と短いが、経口投与後のメラトニンの血漿レベルには顕著な個人差がある[16,17,18]。
これまでにクローニングされた2つの膜型メラトニン受容体(MT1およびMT2)は,7つの膜ドメインを持ち,Gタンパク質共役型受容体のスーパーファミリーに属している[19]。MT1およびMT2受容体は、二量体およびヘテロ二量体として細胞膜に存在する。GPR50は,メラトニン自体には結合しないGタンパク質結合型のメラトニン受容体オルソログだが,MT1受容体と二量体化し,メラトニンの結合を阻害することができる[20]。ヒトのMT2受容体は,ヒトのMT1受容体よりも低い親和性を示し,メラトニンにさらされると,おそらくは内部化によって脱感作される。
Gタンパク質共役型受容体ファミリーの代表として,MT1およびMT2受容体は,多くのシグナル伝達機構を介して作用する[19]。MT1受容体はGタンパク質に結合しており,アデニルシクラーゼの阻害やホスホリパーゼCの活性化を媒介する。MT2受容体は,アデニルシクラーゼの阻害にも結合しており,さらに可溶性グアニルシクラーゼ経路を阻害する。
非選択的な2-[125I]ヨードメラトニンリガンドを用いた受容体オートラジオグラフィーと、メラトニン受容体mRNAを標識するリアルタイム定量逆転写ポリメラーゼ連鎖反応を用いて、MT1およびMT2受容体の脳領域が特定されている。海馬のレベルでは,MT2受容体は内嗅皮質からグルタミン酸系の興奮性入力を受けるCA3およびCA4錐体細胞で検出され,MT1受容体はCA1に主に発現していた[6]。
メラトニンは,レチノイン酸受容体スーパーファミリーに属する転写因子,特にRORαのスプライスバリアント(RORα1,RORα2,RORαアイソフォームd)とRZRβにも結合する[21,22]。レチノイン酸受容体のサブフォームは,哺乳類の組織に偏在的に発現している[22]。
メラトニンは、強力な抗酸化物質であり、・OHラジカルだけでなく、その他のラジカル酸素種(ROS)やラジカル窒素種(RNS)を消去し、抗酸化特性を共有する前述の代謝物のカスケードを生成する[23]。メラトニンはまた、間接的に、抗酸化酵素の遺伝子発現を促進し、プロオキシダント酵素の遺伝子発現を抑制する作用も持っている[24,25,26,27]。特に、グルタチオンペルオキシダーゼ(GPx)とグルタチオンリダクターゼ(GRd)に作用する。これはおそらく、GPxに依存してグルタチオン(GSH)の酸化型であるGSSGが増加したことに対応していると考えられる。メラトニンは、γ-グルタミルシステイン合成酵素およびグルコース-6-リン酸デヒドロゲナーゼを介してGSHの生合成を促進することにより、脳のGSHレベルを正常に保つことに貢献している[28]。メラトニンは、ビタミンCやビタミンEよりも、酸化的ダメージからの保護やフリーラジカルの消去において優れていることが実証されている[23]。
メラトニンは、核内因子κB(NFκB)のDNAへの結合を阻害することで、シクロオキシゲナーゼ(Cox)[30]、主にCox-2[31]を阻害し、誘導性一酸化窒素(NO)合成酵素(iNOS)遺伝子の発現を抑制することで、炎症性サイトカインの合成を減少させることで、顕著な抗炎症作用を示すと考えられている[32]。メラトニンは、生理的な濃度で酸化ストレスから保護することが示されている[23,33]。抗酸化剤としてのメラトニンの直接的な作用は、ほとんどの場合、受容体の相互作用とは無関係だが[34]、メトキシインドールによる抗酸化酵素のアップレギュレーションには、核内転写や、場合によってはRZR/RORα受容体が関与している[35]。
酸化損傷を抑制するメラトニンの効果は,さまざまな神経疾患モデルで検証されている。後述するADの動物モデルに加えて、メラトニンは、カドミウム毒性[36,37]、高気圧性高酸素[38,39]、δ-アミノレブリン酸毒性[40,41,42]、γ線[43,44,45]、局所的な虚血[46,47]、脳外傷[48,49,50]、および多くの神経毒[51]による神経損傷を軽減することが示されている。
メラトニンの神経保護作用および概日リズムの乱れに対する調節作用は、ADの予防的治療における治療物質としての利点を裏付けるものである。さらに、メラトニンは抗興奮作用を示し、十分な量を摂取すると鎮静作用も示すことから[52,53]、γ-アミノ酪酸(GABA)作動性システムを介した第2の神経保護作用が存在する可能性がある。この見解は,メラトニンがGABA受容体の活性化を介してアミロイドβ(Aβ)ペプチド(ADの主要な神経毒)の毒性から神経細胞を保護することを示す研究によって支持されている[54]。
メラトニンの抗興奮性作用に関する初期の研究では,電離型グルタミン酸受容体のアゴニストであるカイネイトが用いられ,メラトニンが興奮性アミノ酸によって引き起こされる神経細胞死を防ぐという仮説が支持された[55,56]。また,一過性前脳虚血[57,58]やグルココルチコイド大量投与[59]による海馬CA1ニューロンの傷害をメラトニンの投与が軽減することも報告されている。
上記のようなさまざまなタイプの毒性は、壊死またはアポトーシスによる神経細胞死をもたらす。アポトーシスによる神経細胞の死には、RNAやタンパク質の合成、栄養因子の枯渇が必要である。アポトーシスにはDNAの一本鎖切断も含まれるが、神経栄養因子はこの種の死から神経細胞を救うことがわかっている[60]。神経栄養因子は、B細胞リンパ腫の癌原遺伝子タンパク質(Bcl-2)などの細胞性抗アポトーシス成分を介して作用すると考えられる。In vitroの研究では、メラトニンがBcl-2の発現を高め、アポトーシスを防ぐことが示されている[61,62,63]。さらに、メラトニンはmtPTPの開口部を直接阻害することで、細胞を救済する[64,65,66]。
脳の老化プロセスは、現在のところ十分に詳しく知られている[67]。多くの老化プロセスは、カルジオリピン過酸化によるアポトーシス、シトクロムCの放出、mtPTPの分解、ミトコンドリア質量の減少など、ミトコンドリアの損傷に依存している。電子輸送連鎖が遮断されると、エネルギー供給が不足し、細胞の機能と生存率が低下する。活性酸素とRNSの増加は、内皮、DNA、タンパク質、脂質にもダメージを与えることになる。さらに、カルシウム過剰を伴う神経細胞の過剰興奮やミクログリアの活性化が加齢とともに起こる。DNA損傷の結果として、テロメアの減少が起こり、免疫前駆細胞のような増殖能力の高い細胞が減少するため、免疫老化につながります [67]。このような状況は、自己免疫反応の増大や、炎症性サイトカインの増加につながる炎症プロセスを伴う。
動物実験から得られた証拠は、メラトニンが脳の老化のほとんどの側面を抑制することを示している[67]。まず,メラトニンは中枢および末梢の概日振動子に作用することで,高齢者に見られるリズムの振幅の低下やリズムの協調性の低下を改善する。メラトニンは、時計タンパク質の発現に影響を与え、老化に伴う代謝感知の乱れを調整する可能性がある。メラトニンは、ミトコンドリアの電子フラックスをサポートし、電子のオーバーフローを減少させることで、呼吸効率とエネルギー供給を改善し、アポトーシスを防ぐ。また、ラジカル消去、抗酸化酵素の増加、プロオキシダント酵素の抑制、GSHの増加、ラジカル生成の低下などにより、タンパク質、脂質、DNAの損傷が減少し、酸化物質によるテロメアの減少や神経細胞の過剰興奮が抑制される。また、メラトニンの抗炎症作用は、老化現象の抑制に不可欠であり、メトキシインドールによるインスリン感受性の向上やメタボリックシンドロームの抑制にもつながる。最後に、メラトニンは自然免疫および適応免疫を調整し、白血球、幹細胞、前駆細胞などの高い増殖能力を持つ細胞の数が増えることを介して、免疫老化を改善する[67]。
3. アルツハイマー型認知症に対するメラトニン療法の概要-理論と作用機序
アルツハイマー病は、主にAβが沈着して形成される細胞外の老人斑と、主に微小管結合タンパク質(MAP)のタウが異常にリン酸化されて生じる細胞内の神経原線維のもつれが主要な病理学的特徴である。Aβは、加齢に伴う酸化ストレスの増加や細胞のエネルギー代謝の変化などにより、神経細胞の変性を促進する重要な役割を果たしている。
Aβは,その前駆体であるアミロイド前駆体タンパク質(APP)に由来する39〜43個のアミノ酸残基から構成されている[68]。APPは,α-またはβ-セクレターゼによって,異なる経路でタンパク質分解される。α-非アミロイド生成経路では,α-セクレターゼによってAPPが切断されてAPPのN-末端フラグメントが放出され,このフラグメントはγ-セクレターゼによって切断された後,Aβの形成を妨げる[68].βアミロイド生成経路には,βセクレターゼが含まれており,これによって無傷のAβペプチドが形成され,Aβ配列のN末端とC末端でβセクレターゼとγセクレターゼが順次切断されることによって媒介される[68].
メラトニンは、様々な細胞株において、正常レベルの可溶性APPの分泌を阻害し、APPの成熟を妨げた[69]。さらに、メラトニンの投与は、in vivo [70,71]およびin vitro [69,72,73,74]でAβの生成と沈着を効率的に減少させる。一般的に、トランスジェニックマウスでの結果は、メラトニンを早い段階で投与し、APPとAβの代謝を主にその形成を防ぐことで制御し、後には抗アミロイド効果はほとんどないという見解を支持している。このように、老齢のTg2576マウスに14ヶ月齢からメラトニンを投与しても、さらなるAβ沈着を防ぐことはできなかったが[75]、同様の治療を4ヶ月齢から開始すると、Aβ沈着を減少させる効果があった[70]。アミロイドプラークの病理は,通常,10~12か月齢のTg2576マウスで見られるため[76],このデータは,メラトニンがアミロイドプラーク形成後ではなく,早期の予防に有効であることを示している.
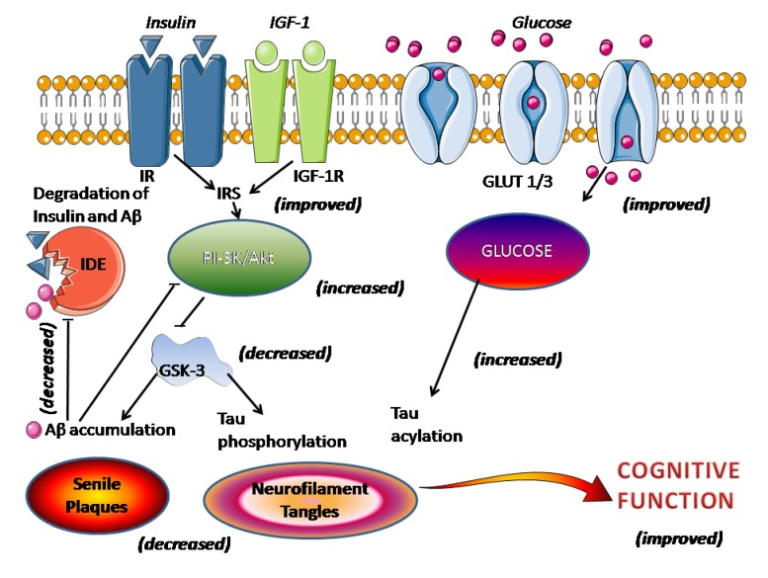
メラトニンがAβの生成を抑制する効果をどのように発揮するかは,まだ解明されていない。α-セクレターゼ経路によるAPPの蛋白分解は、多くの生理的・病理的刺激、特にプロテインキナーゼ(PK)Cの活性化とセクレターゼを介したAPPの切断によって制御されている。グリコーゲン合成酵素キナーゼ-3(GSK-3)の阻害とc-Jun N-terminalキナーゼのアップレギュレーションにより、マトリックスメタロプロテアーゼの活性が高まり、Aβの分解が促進される[77]。インスリン、Aβ、APPのレベルを調節するインスリン分解酵素(IDE)の活性は、Aβの増加後に低下した[78]。GSK-3は、γ-セクレターゼの補酵素であるプレセニリン-1と相互作用し、PKCによるGSK-3のリン酸化はγ-セクレターゼの不活性化につながる。実際、GSK-3は、Aβの生成とタウの過リン酸化を増加させる、共通のシグナル伝達経路の1つとなりうる。メラトニンは、PKCとGSK-3の経路を介してAPPの処理を制御しうる(図1)。
図1 ADにおける脳内インスリンシグナルの障害に対するメラトニンの効果
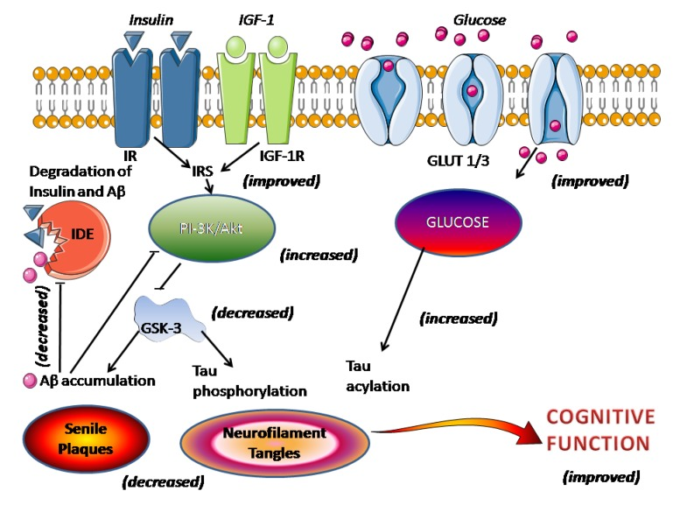
図は、インスリン/インスリン受容体の障害と老人斑や神経原線維変化を結びつけるプロセスを図式化したものである
括弧内は本文で述べたメラトニンの作用を示す。
メラトニンは,Aβ40およびAβ42と相互作用し,βシートおよび/またはアミロイド線維の進行を抑制する[79,80].メラトニンとAβの間のこの相互作用は,他のフリーラジカルスカベンジャーでは模倣できなかったことから,メラトニンの抗酸化特性よりもむしろ構造的なメラトニンの特性に依存しているようである[79]。二次シートの形成を阻害することで、メラトニンは神経毒性を軽減するだけでなく、ペプチドのクリアランスを促進し、IDEなどによるタンパク質分解を増加させる。
酸化ストレスは、Aβによる神経毒性や細胞死において中心的な役割を果たしている。メラトニンは,in vitro [81,82]およびin vivo [70,81,83,84,85]において,Aβによる酸化的損傷や細胞死から細胞を効果的に保護することを裏付けるデータが蓄積されている。Aβを投与した細胞や動物では、メラトニンは抗酸化作用を介して保護作用を発揮すると考えられるが、APPをトランスフェクトした細胞やトランスジェニック動物モデルでは、主にβシートやアミロイド線維の生成を抑制することが根本的なメカニズムであると考えられる。凝集したAβは活性酸素を発生させ、神経細胞膜の脂質、タンパク質、核酸を損傷して神経細胞を死滅させる。メラトニンは,特にミトコンドリアレベルで,Aβの毒性から保護することが観察された[86,87]。
タウの過リン酸化は、微小管の変化を防ぐタウの能力を低下させ、細胞骨格の崩壊が続く[88,89]。神経原線維病理の程度は、AD患者の認知症の重症度と相関している。AD患者の脳では、リン酸化されたタウのレベルが、正常な成人の脳に比べて3〜4倍高い[90,91]。
メラトニンは、N2aおよびSH-SY5Y神経芽細胞をワートマニン[92]、カリクリンA[93,94,95]、オカダイン酸[96,97,98,99]に曝すなど、多くの実験モデルにおいて、プロテインキナーゼおよびホスファターゼに影響を与えることで、タウの過リン酸化を効率的に抑制することがわかっている。メラトニンは、これらの薬剤によって与えられる酸化ストレスにも拮抗する[100,101]。ラットにおけるメラトニン生合成の阻害は,空間記憶の障害をもたらすだけでなく,タウリン酸化の増加を誘発したが,この効果はメラトニンの補給によって阻止された[102]。
酸化ストレスは,タウのリン酸化状態に影響を及ぼすことが知られている[103,104]。ADの脳神経細胞におけるミスフォールドしたタンパク質や凝集したタンパク質の蓄積は、加齢による分子構造の変化に加えて、酸化ストレスの結果であると考えられている[105]。メラトニンは、抗酸化剤およびフリーラジカルスカベンジャーとして、フリーラジカルの過剰生成を防ぐことから、メラトニンによるタウリン酸化の防止は、メラトニンの抗酸化活性によって一部行われていると考えられる。さらに、メラトニンが抗酸化作用とは無関係に酵素の調節因子として働く可能性を示す研究もいくつかある。例えば、メラトニンがPKA [100,101]、PKC [106,107]、Ca2+/カルモジュリン依存性キナーゼII [108,109,110]、マイトジェン活性化プロテインキナーゼ [111]を調節することなどが挙げられる。
ADの病因における重要な因子は、炎症性サイトカインの高レベルの発現をもたらすミクログリアの活性化である[112,113,114,115]。疫学的研究では、抗炎症薬の使用がADの発症率を低下させることが示されている[116]。Aβによるミクログリアの活性化は、炎症反応の主要な原因である[117]。メラトニンは,ラット脳において,Aβによって誘発される炎症性サイトカインの産生,NFκBおよびNOの産生を減弱させた[85,118]。さらに,NFκBのDNA結合活性はメラトニンによって抑制された[119,120]。
ADの病因におけるもう一つの大きな出来事は、コリン作動性機能の欠損である[121]。大脳皮質と海馬へのコリン作動性神経の主な供給源であるMeynert基底核のニューロンは、ADの脳では深い選択的な変性を受けている[122]。アセチルコリン(ACh)のレベルは、ADの初期段階で減少するが、合成・分解酵素であるコリンアセチルトランスフェラーゼ(ChAT)およびアセチルコリンエステラーゼ(AChE)の活性は、ADの後期段階になるまで変化しない[123,124]。AD患者の大脳新皮質におけるChAT活性の低下は、認知症の重症度と相関していることから、AChE阻害剤は軽度から中等度のADの標準的な治療法となっている[125]。
メラトニンには、コリン作動性システムの保護作用がある。シナプトソームやシナプス小胞におけるコリン輸送やChAT活性のペルオキシナイトによる阻害を防ぐ[126]。生後8ヶ月のAPP695トランスジェニックマウスにメラトニンを投与すると、前頭葉皮質と海馬におけるChAT活性の深刻な低下が有意に改善された[81]。また、メラトニンは、卵巣摘出ラットに見られる空間記憶の欠損とChAT活性の低下に拮抗する[127]。しかし,Aβを14日間脳室内に灌流したラットでは,メラトニンはChAT活性を回復させることができなかった[128]。メラトニンは,リポポリサッカライドおよびストレプトゾトシンによって誘発されるAChE活性の上昇を抑制した[129]。最近、AChE阻害剤であるタクラインとメラトニンのハイブリッドが、AD治療のための新しい薬剤候補として合成された[130,131]。これらのハイブリッドは,タクラインやメラトニン単独よりも優れた抗酸化作用とコリン作動性保持作用を示した。これらのハイブリッドの1つを脳内に直接投与すると、APP/PS1マウスの脳実質における誘導細胞死とAβ負荷が減少し、認知機能の回復を伴った[131]。
ADの病態における脳内インスリンシグナルの障害の役割への関心が高まっている。脳内インスリン/インスリン様成長因子1(IGF-1)シグナルの障害は、ADの主要な原因事象であると示唆されており、老人斑と神経原線維変化の両方の存在と関連しているとされている[132,133,134]。しかし、この見解は、普遍的なものではない[135]。インスリン/インスリン受容体(IR)のシグナル伝達が低下すると、インスリンを介したホスホイノシチド3キナーゼ(PI-3K)/Aktシグナル活性が低下し、その結果、GSK-3が過剰に活性化され、タウの過リン酸化やAβの蓄積、老人斑の形成が直接促進される(図1)。また,インスリン,Aβ,APPのレベルを調節するIDEの活性は,Aβ沈着後に低下した[78]。メラトニンの投与は,高血糖,脂質異常症,高インスリン血症,インスリン抵抗性,体重増加,高血圧といったメタボリックシンドロームの兆候を軽減することが報告されている[136,137]。メラトニンは、インスリン/インスリン受容体機構を回復させ、ホスホイノシチド3キナーゼ/Aktシグナル伝達活性を増加させ、その結果、GSK-3を阻害し、Aβの蓄積とタウのリン酸化を抑制する([6]参照)。さらに、インスリンシグナルが阻害されると、グルコーストランスポーター-1(GLUT-1)および-3(GLUT-3)の発現が低下し、脳内グルコースの取り込み/代謝が低下するが、この現象もメラトニンによって打ち消される。神経細胞の糖代謝が回復すると、タウのN-アセチルグルコサミンのアシル化が促進され、タウの過リン酸化が抑制される(図1)。
図2は、ADの薬物治療で考えられる主なターゲットをまとめたものである。米国食品医薬品局(FDA)は、AChE阻害剤とN-メチル-D-アスパラギン酸(NMDA)受容体遮断剤のみを臨床使用に認可している上述したように、メラトニンは、図2に示したすべての病理学的メカニズムに影響を与えるというユニークな特性を持っている。したがって、ADの神経保護剤としてのメラトニンの可能性を検討する必要がある。
図2 ADの薬物療法の標的となりうるもの。
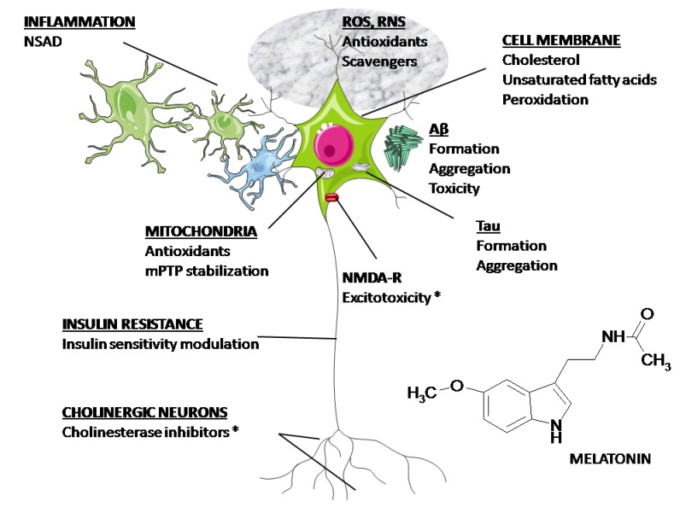
本文で述べたように、メラトニンは図に描かれているすべてのメカニズムに影響を与える可能性がある。(*) FDAで承認されている
4. メラトニンのADへの応用の臨床的側面
痴呆患者では、精神障害の重症度が夜間のメラトニン産生の障害と有意に相関していた[138]。前臨床段階であるBraak stage-1で剖検されたAD患者では、脳脊髄液(CSF)のメラトニンレベルが低下していることから、これは病気の初期兆候である可能性がある。したがって、CSFメラトニンの減少は、ADの早期発見のためのマーカーとなる可能性がある[139]。
さらに、血漿メラトニンレベルは、AD患者では低く[140,141,142,143]、この減少の原因として、網膜-SCN-松果体の結合が機能的に損なわれていると仮定された[144]。AD患者の松果体では、モノアミン酸化酵素遺伝子の発現と活性が増大し、β1-アドレナリン受容体のmRNAレベルが低下していた[145]。また、ADの海馬では、メラトニン受容体の免疫反応が変化していた[146,147]。これらの結果を総合すると、メラトニンレベルを補充することが、ADの進行を阻止するための治療戦略となりうることがわかる。
“夕暮れ症候群 “は、思考の混乱、外部刺激への注意維持能力の低下、徘徊、興奮、知覚・感情の障害などを含む時系列的な現象で、AD患者によく見られる状況である。午後遅くまたは夕方早くに現れる、時間帯に関連した現象として[148,149]、メラトニンの治療効果の可能性が検討された。表1は、メラトニンが時間生物学的薬剤として、AD患者の日暮れや不規則な睡眠-覚醒サイクルの治療に有効である可能性を示すデータをまとめたものである。
表1 アルツハイマー型認知症(AD)患者に対するメラトニンの投与を含む試験
| 設計 | 科目 | 処理 | 時間 | 測定 | 結果 | リファレンス |
|---|---|---|---|---|---|---|
| 非盲検試験 | AD患者10人 | 就寝時に3mgのメラトニンpo /日 | 3週間 | 世話人によって完成された睡眠と覚醒の質の毎日のログ | メラトニンで治療された睡眠障害のある認知症患者の10人中7人は、日没の有意な減少と入眠時間の変動の減少を示した。 | [ 155 ] |
| 非盲検試験 | 14人のAD患者 | 就寝時にメラトニン9mgを1日1回経口投与 | 22〜35か月 | 世話人によって完成された睡眠と覚醒の質の毎日のログ。神経心理学的評価 | 日没は12人の患者でもはや検出できず、2人の患者で減弱したが持続した。睡眠の質の有意な改善が見られた。彼らがメラトニンを投与されている間、病気の認知的および行動的兆候の進行の欠如 | [ 156 ] |
| 症例報告 | ADが8年の単卵性双生児 | 患者の1人は就寝時にメラトニン9mg経口/日で治療された。 | 36ヶ月 | 神経心理学的評価。ニューロイメージング | メラトニンを投与されていない双子では、メラトニンで治療された双子と比較して、睡眠と認知機能が著しく損なわれている。 | [ 157 ] |
| 非盲検試験 | 11人のAD患者 | 就寝時に3mgのメラトニンpo /日 | 3週間 | 睡眠と覚醒の質の毎日のログ | 3つのシフトすべてで興奮行動の有意な減少。日中の眠気の大幅な減少 | [ 158 ] |
| 非盲検プラセボ対照試験 | 14人のAD患者 | 就寝時またはプラセボで毎日6mgのメラトニンを経口投与 | 4週間 | 世話人によって完成された睡眠と覚醒の質の毎日のログ。アクチグラフ | メラトニンを投与されたAD患者は、プラセボ群と比較して夜間活動の割合が大幅に減少したことを示した | [159] |
| 無作為化二重盲検プラセボ対照クロスオーバー試験 | 25人のAD患者 | 就寝時に6mgの徐放性メラトニンpoまたはプラセボ | 7週間 | アクチグラフ | メラトニンは、睡眠時間の中央値、覚醒回数、睡眠効率に影響を与えなかった | [ 160 ] |
| 非盲検試験 | 45人のAD患者 | 就寝時に1日6〜9mgのメラトニンを経口投与 | 4ヶ月 | 世話人によって完成された睡眠と覚醒の質の毎日のログ。神経心理学的評価 | メラトニンは睡眠を改善し、日没を抑制した。これは、併用薬の使用に関係なく見られる効果である。 | [ 161 ] |
| ランダム化プラセボ対照臨床試験 | 157人のAD患者 | 就寝時に2.5mgの徐放性メラトニン、または10mgのメラトニンまたはプラセボ | 2ヶ月 | アクチグラフ。睡眠の質に関する介護者の評価 | メラトニン群における夜間の総睡眠時間の増加と入眠後の覚醒の減少の有意でない傾向。睡眠の質に関する介護者の評価は、プラセボと比較して、2.5mgの徐放性メラトニングループで有意な改善を示した | [ 162 ] |
| 二重盲検プラセボ対照試験 | 20人のAD患者 | プラセボまたは3mgメラトニン経口/毎日就寝時に | 4週間 | アクチグラフ。神経心理学的評価 | メラトニンは睡眠時間を大幅に延長し、夜間の活動を減少させた。メラトニンにより認知機能が改善された | [ 163 ] |
| 非盲検試験 | 7人のAD患者 | 就寝時に3mgのメラトニンpo /日 | 3週間 | アクチグラフ。神経心理学的評価。 | 昼夜のリズム障害または日没の完全寛解が4人の患者で見られ、他の2人では部分寛解が見られた。 | [ 164 ] |
| ランダム化プラセボ対照試験 | 17人のAD患者 | 就寝時にメラトニン3mgを1日1回経口投与(7人の患者)。プラセボ(10人の患者) | 2週間 | アクチグラフ。神経心理学的評価。 | メラトニン治療群では、アクチグラフの夜間活動と興奮はベースラインと比較して有意な減少を示した | [ 165 ] |
| 症例報告 | 急速眼球運動(REM)睡眠行動障害を発症したADの68歳の男性 | 就寝時に5〜10mgのメラトニンを1日1回経口投与。 | 20ヶ月 | 睡眠ポリグラフ | メラトニンはレム睡眠行動障害の抑制に効果的であった | [ 166 ] |
| ランダム化プラセボ対照試験 | AD患者50人 | 朝の光曝露(2500ルクス、1時間)および夕方の5 mgメラトニン( N = 16)またはプラセボ(N = 17) | 10週間 | アクチグラフ | 光線療法だけでは、夜間の睡眠、日中の覚醒、または休息活動のリズムは改善されなかった。光線療法とメラトニンは、日中の覚醒時間と活動レベルを増加させ、休息活動リズムを強化した | [ 167 ] |
| ランダム化プラセボ対照試験 | 41人のAD患者 | メラトニン(8.5mgの即時放出および1.5mgの持続放出)(N = 24)またはプラセボ(N = 17)を22:00時間に投与 | 10日間 | アクチグラフ | プラセボと比較して、睡眠、概日リズム、または興奮に対するメラトニンの有意な効果はなかった | [ 168 ] |
p.o.:per os。
ADにおけるメラトニンの使用に関する発表された結果のレビュー[150]では、メラトニンの有効性の可能性を支持する8つの報告(非盲検試験5件、症例報告2件)(N = 89患者)が得られた:睡眠の質が改善され、AD患者では日暮れが減少し、認知機能の低下が進行を遅らせた。6つの二重盲検無作為化プラセボ対照試験では、合計210名のAD患者が対象となった。4つの研究(N=143)では、睡眠の質が向上し、日暮れが有意に減少し、認知機能が改善したのに対し、2つの研究(N=67)では効果が認められなかった[150]。
また、1985年から2009年4月までに発表された、AD患者におけるメラトニンと日暮れに関する研究のシステマティックサーチが発表された[151]。認知症におけるメラトニン治療に関する全論文を検索し、メラトニンの概日リズム障害に対する効果を、日暮れ・興奮行動、睡眠の質、日中の機能をスコア化することで評価した。4件のランダム化比較試験(N=243)、5件のケースシリーズ(N=87)を含む計9件の論文をレビューした(表1)。無作為化比較試験のうち2件では、日暮れ・興奮行動の有意な改善が認められた。また、5つのケースシリーズではすべて改善が認められた[151]。このように、メラトニンがADの治療に価値があるかどうかは、依然として不確かである。おそらく、完全に発症したADで検討されたグループの不均一性により、少数の患者を含む研究では治療効果を開示することが困難であると思われる[152]。さらに、AD患者におけるMT2メラトニン受容体の海馬での発現[146]や、概日装置におけるMT1受容体の発現が減少していることが、この進行段階でメラトニン治療が不安定な理由を説明しているかもしれない[153,154]。
軽度認知障害(MCI)とは、認知機能に客観的かつ測定可能な障害があるが、日常生活は比較的維持されている人に診断される徴候や症状に与えられる名称である。ADへの移行率は、年間10%~15%と高く[169]、MCIは、リスクのある個人を特定し治療するための臨床的に重要な段階である。実際、ADの脳における変性プロセスは、ADの臨床的発症の20~30年前に始まっている[170,171]。この段階では、プラークとタングルの負荷が増加し、ある閾値を超えると最初の症状が現れる[172,173]。上述したように、CSFメラトニンレベルは、ADの前臨床段階で減少することから、CSFメラトニンの減少は、ADの早期の誘因およびマーカーである可能性が示唆されている[139,145]。相対的なメラトニン不足が神経変性の結果か原因かは不明だが、メラトニンの喪失は、おそらく疾患を悪化させる。
我々は以前、25名のMCI患者において、1日3~9mgの速放性メラトニン製剤を就寝時に3年間投与したところ、認知・情動パフォーマンスおよび1日の睡眠・覚醒サイクルが有意に改善したというレトロスペクティブな分析結果を報告した[174]。最近、我々は、96人のMCI外来患者のシリーズから得られたデータを報告した。そのうち61人は、速放性メラトニン製剤3~24mgを毎日就寝時にp.o.で15~60ヶ月間投与されていたが、同様のグループの35人のMCI患者は投与されなかった[175]。さらに、すべての患者は、主治医の精神科医が適切と考える個々の標準的な薬物療法を受けていた。
メラトニンを投与された患者は、Mini-Mental State ExaminationおよびAD Assessment Scaleの認知サブスケールの成績が有意に向上した。神経心理学的バッテリー(Mattis’s test、Digit-symbol test、Trail A and B task、Rey’s verbal test)を適用したところ、テストされたすべてのパラメータにおいて、メラトニン治療を受けた患者の方が優れた成績を示した[175]。メラトニン治療を受けた患者では、睡眠と覚醒の質の改善と同時に、異常に高かったBeck Depression Inventoryスコアが減少した[175]。これらの結果は、メラトニンが臨床環境においてMCIを治療するための有用なアドオン薬であることをさらに裏付けている。
したがって、メラトニン治療を早期に開始することは、治療の成功にとって決定的な意味を持つ[75]。表2では、MCIにおけるメラトニン治療に関する発表データをまとめている。6件の二重盲検無作為化プラセボ対照試験および2件の非盲検レトロスペクティブ試験(N = 782)では、毎日夕方にメラトニンを投与することでMCI患者の睡眠の質および認知能力が改善されることが一貫して示されている。したがって、メラトニン治療は神経変性疾患の初期段階で有効であると考えられる。
表2 メラトニンによる軽度認知障害(MCI)患者の治療を含む研究
| 設計 | 科目 | 処理 | 時間 | 測定 | 結果 | リファレンス |
|---|---|---|---|---|---|---|
| 二重盲検、プラセボ対照、クロスオーバー試験 | MCIの患者10人 | 就寝時に6mgのメラトニンpo /日 | 10日間 | アクチグラフ。神経心理学的評価 | メラトニンは休息活動のリズムを高め、睡眠の質を改善した。以前に学んだ項目を覚える能力は、落ち込んだ気分の大幅な減少とともに改善された | [ 206 ] |
| 二重盲検プラセボ対照パイロット試験 | 加齢に伴うMCIの患者26人 | 1 mg melatonin p.o. or placebo at bed time | 4週間 | ベースライン時と4週間時の睡眠質問票と認知テスト | メラトニン投与は、報告された朝の「安静」と夜間の目覚め後の入眠潜時を改善した。また、California Verbal LearningTest-干渉サブテストのスコアも改善された。 | [ 207 ] |
| 無作為化二重盲検プラセボ対照試験 | 加齢に伴うMCIの患者354人 | 徐放性メラトニン(サーカディン、2 mg)またはプラセボ、就寝時間の2時間前 | 3週間 | リーズの睡眠評価とピッツバーグの睡眠に関する質問臨床グローバル改善スケールスコアと生活の質。 | メラトニンは、睡眠の質、朝の覚醒、入眠潜時、生活の質に有意で臨床的に意味のある改善をもたらした。 | [ 208 ] |
| 非盲検、後ろ向き研究 | 60人のMCI外来患者 | 35人の患者が就寝時に毎日3〜9mgの速放性メラトニン製剤を経口投与された。標準的な薬に加えてメラトニンが与えられた | 9〜24か月 | 睡眠と覚醒の質の毎日のログ。最初と最後の神経心理学的評価。 | メラトニン治療を受けた患者では、異常に高いベックうつ病目録スコアが低下し、覚醒と睡眠の質が改善した。メラトニンで治療された患者は、神経心理学的評価において有意に優れたパフォーマンスを示した。 | [ 174 ] |
| 長期、二重盲検、プラセボ対照、2×2階乗ランダム化試験 | 加齢に伴う認知機能低下を伴う189人の患者 | 一日中明るい(1000ルクス)または薄暗い(300ルクス)光での長期の毎日の治療。メラトニン( 2.5mg)またはプラセボ | 1〜3。5年 | 認知および非認知症状、日常生活動作の制限、および6か月ごとに評価される副作用の標準化された尺度。 | 光は認知機能の低下を弱め、抑うつ症状を改善した。メラトニンは入眠潜時を短縮し、睡眠時間を延長したが、うつ病のスコアに悪影響を及ぼした。明るい光とメラトニンの併用治療が最高の効果を示した。 | [ 209 ] |
| 前向き、無作為化、二重盲検、プラセボ対照、研究 | 加齢に伴う認知機能低下を伴う22人の患者 | 患者は2ヶ月のメラトニン(5mg経口/日)と2ヶ月のプラセボを受けた | 2ヶ月 | 睡眠障害は、ノースサイド病院睡眠医学研究所のテストで評価された。行動障害は、Yesavage Geriatric DepressionScaleとGoldbergAnxietyScaleで評価された。 | メラトニン治療は睡眠の質のスコアを大幅に改善した。メラトニン投与後、うつ病も大幅に改善した。 | [ 210 ] |
| 無作為化二重盲検プラセボ対照試験 | 25人のMCI外来患者 | 11人の患者がメラトニン(10mg)とトリプトファン(190mg)を含むドコサヘキサエン酸-リン脂質の油性エマルジョンを受け取った | 12週間 | 方向性と認知機能、短期および長期記憶、注意能力、実行機能、視覚構築および視覚空間能力、言語および気分の神経心理学的評価。 | MCIの高齢者は、プラセボと比較して、メラトニンとトリプトファンを含む油性エマルジョンを12週間補給すると、認知機能のいくつかの測定値に有意な改善が見られた。赤血球の抗酸化能力と膜脂質組成は、治療後に改善された。 | [ 211、212 ] _ _ |
| 非盲検、後ろ向き研究 | 96人のMCI外来患者 | 61人の患者が就寝時に毎日3〜24mgの速放性メラトニン製剤を経口投与された。標準的な薬に加えてメラトニンが与えられた | 15〜60か月 | 睡眠と覚醒の質の毎日のログ。最初と最後の神経心理学的評価。 | メラトニン治療を受けた患者では、異常に高いベックうつ病目録スコアが低下し、覚醒と睡眠の質が改善した。メラトニンで治療された患者は、神経心理学的評価において有意に優れたパフォーマンスを示した。メラトニンで治療された61人の患者のうち6人だけがベンゾジアゼピンの併用治療を必要としたが、メラトニンを投与されていない35人のMCI患者のうち22人であった。 | [ 175 ] |
MCI患者にメラトニンを使用することが有益である理由は2つある。神経変性プロセスの過程では、加齢による概日組織の劣化が著しく悪化し、日暮れのような行動問題の原因となる[176]。健康な高齢者における加齢に伴う認知機能の低下は、運動行動におけるサーカディアンリズムの断片化によって予測することができる。したがって、脳内で発生している低濃度のメラトニンを補充することは、MCI患者にとって非常に有益である[139,145]。
一方、実験的研究から得られたメラトニンの神経保護特性に関する多くの情報([177,178]を参照)から、MCI患者において、疾患の進行を阻止または遅らせる目的で薬理学的用量を使用することが非常に望ましいと考えられる。松果体から分泌されるメラトニンは、血液とCSFを循環するが [179]、最近のデータでは、ヒツジやおそらくヒトでは、メラトニンの大部分を高濃度で脳組織に供給できるのは、血流のメラトニンではなくCSFのメラトニンだけであるという仮説が支持されている [180]。脳室(CSFに近い)から脳組織への有意な濃度勾配が示され、濃度は1倍から125倍に変化した。この結果は、メラトニンの生理的利用におけるCSFの役割を支持するものであり[179]、脳に到達するためには薬理学的に高濃度のメラトニンを投与しなければならないことを意味する。
MCI患者におけるメラトニンの治療効果のメカニズムは、まだ解明されていない。メラトニンの投与は、主に高齢者の徐波睡眠を促進するが [181]、MCIでは、GHおよび神経トロフィンの分泌増加など、睡眠の回復段階を増強することで有益である。
上述したように、メラトニンは、ADの発症および症状に関連する様々なレベルで作用する。抗酸化作用、ミトコンドリア作用、抗アミロイド原性作用は、ADの発症を妨げる可能性がある。したがって、メラトニン治療を開始する時期が、最終的な反応にとって決定的な意味を持つことになる[75]。
考慮すべき重要な点の1つは、採用するメラトニンの用量であり、市場に出回っているさまざまなメラトニンアゴニストの結合親和性、半減期、および相対的な効力を考慮すると、メラトニンの用量は不必要に低い可能性がある。一般的にネイティブな分子よりも強力であることに加え、メラトニンアナログはかなり多量に使用されている[182]。メラトニン受容体アゴニストであるラメルテオンの認可用量は8~32mg/日であり、アゴメラチンは大うつ病性障害の治療に25~50mg/日の用量で認可されている。健常者を対象とした臨床研究では、最近FDAに承認された別のメラトニン受容体作動薬であるtasimelteon(Vanda Pharmaceuticals, Washington, DC, USA)が20~100mg/日の用量で投与されており[183]、メラトニン受容体作動薬であるTIK-301(Tikvah Pharmaceuticals, Atlanta, GA, USA)の薬物動態、薬力学および安全性は、20~100mg/日を用いたプラセボ対照試験で検討されている[184]。したがって、100~300mg/日のメラトニン用量を用いたMCIの研究がさらに求められている。
メラトニンとメラトニン受容体作動薬の併用療法は、特にメラトニン受容体作動薬がメラトニンよりも優れた薬物動態プロファイルを有している場合、理論的にはAD患者にとって有益であると考えられる。しかし、メラトニン受容体アゴニストは、ADのマウスモデルにおいて、限られた効果しか示していない[185]。
メラトニンは血流から非常に速やかに排出されるため、メラトニンの分解や体内からの排出を阻害するような戦略は、外因性メラトニン治療の有用な追加手段となりうる。実際、CYP1A2の発現を調節する化学物質に同時にさらされると、メラトニンの薬理学的な血漿レベルが影響を受ける可能性がある。例えば、CYP1A2の強力な阻害剤であり、CYP2C19の阻害剤でもあるフルボキサミンは、血漿メラトニンレベルを増大させた[186,187]。同様に、主にCYP1A2によって代謝されるカフェインを同時に摂取すると、メラトニンの血漿レベルが2倍以上になり、バイオアベイラビリティが向上した[188]。もう一つの候補は、乾癬の治療に使用されている5-メトキシプソラレンで、内因性および外因性のメラトニンの血漿レベルを上昇させる[189,190,191]。
メラトニンの安全性は高く、通常は極めて良好な忍容性を示し、一部の研究では患者に非常に大量に投与されていることを強調しておく[16,192,193,194,195]。筋萎縮性側索硬化症患者において、メラトニン(300mg/日)を最長3年間投与したところ、酸化ストレスが減少した[192]。
筋ジストロフィーの子供では、70mg/日のメラトニンがサイトカインと脂質過酸化を減少させた[193]。健康な男性に80mgのメラトニンを1時間ごとに4時間投与したところ、眠気以外の好ましくない作用は認められなかった[16]。健康な女性に300mgのメラトニン/日を4ヶ月間投与したところ、副作用はなかった[194]。肝臓手術に紹介された50人の患者を対象とした最近の無作為化対照二重盲検臨床試験では、術前にメラトニン50mg/kg(すなわち、体重60kgの成人であれば3gに相当)を単回経腸投与することで、安全かつ良好な忍容性が得られることが示された[195]。
最近報告された研究[175]のもう1つの結果は、メラトニンを使用した場合、MCIの睡眠障害を治療するために必要なベンゾジアゼピンの量が非常に少なくなるというものであった。上述のように、メラトニンとベンゾジアゼピンは、いくつかの神経化学的特性(すなわち、脳内のGABA介在機構との相互作用[196])および行動的特性(例えば、同様の日依存性抗不安作用[46])を共有しているため、メラトニン療法は、患者に必要なベンゾジアゼピンの用量を減らすための有効な手段であると仮定された[155,197,198,199]。ドイツの処方箋データベースの最近のレトロスペクティブ分析では、10ヵ月間に徐放性メラトニン(2 mg)による治療を開始した512人の患者が特定された[200]。このグループのうち、以前にベンゾジアゼピンを使用していた112人の患者では、31%が徐放性メラトニンの治療開始から3ヵ月後にベンゾジアゼピンによる治療を中止した。中止率は、メラトニンの処方を2回または3回受けている患者で高かった[200]。ベンゾジアゼピンおよびベンゾジアゼピン受容体作動薬(Z-drugs)の長期使用は、重篤な離脱症状および潜在的な依存性に関連しており、これは公衆衛生上の問題となっており、これらの薬物の消費を減少させるための複数のキャンペーンにつながっている。最近の薬剤疫学研究では、これらのキャンペーンはメラトニンの入手可能性や市場と関連していない場合、一般的に失敗すると結論づけている[201]。
5. 結論
結論として、メラトニンがMCIの予防または治療に治療的価値があるかどうか、疾患の開始または進行の神経病理に影響を与えるかどうか、またそのメカニズムについては、さらに分析する必要がある。疾患の初期段階での抗認知症薬としてのメラトニンの可能性と有用性を調査・検討するためには、二重盲検の多施設研究が必要である。
メラトニンは、催眠作用と時間生物学的特性の両方を示すことから、加齢に伴う不眠症のほか、その他の一次および二次不眠症の治療にも用いられている[202,203]。不眠症、副眠症、概日リズム睡眠障害のエビデンスに基づく治療に関する英国精神薬理学会のコンセンサスでは、55歳以上の患者に催眠薬が適応される場合、メラトニン2mgの投与が第一選択の治療法であると結論づけられている[204]。
市販されているさまざまなメラトニンアゴニストの結合親和性、半減期、および相対的な効力が示すように、これらの低用量のメラトニンを用いた研究は、本来の分子よりも一般的に強力であることに加えて、かなり多量に使用される上述の化合物の効果と適切に比較するには不適当であることは明らかである[205]。したがって、メラトニンの治療上の神経保護作用の可能性をヒトで明らかにするには、より高用量のメラトニンを用いたさらなる研究が必要である。動物実験から、神経変性疾患などのメラトニンの予防効果の多くは、高用量のメラトニンでないと明らかにならないことがわかっている[177]。メラトニンに効果的な神経保護作用を期待するのであれば、これまで採用されてきた低用量のメラトニンはあまり有益ではないと思われる。