コンテンツ
Stroke Risk Factors, Genetics, and Prevention
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5321635/
概要
脳卒中は、米国における成人の長期障害原因の第1位、死亡原因の第5位であり、米国では毎年約795,000件の脳卒中が発生している1, 2。人口の高齢化に加え、脳卒中後の症例死亡率の低下により 2012年から 2030年の間に340万人の脳卒中有病率が増加すると予想されている3, 4。その理由はまだ不明であるが、肥満の蔓延とそれに伴う糖尿病の影響を反映している可能性がある。脳卒中の罹患率は依然として高く、医療サービス、投薬、休業などにかかる費用は年間340億ドルと推定されている3, 5。さらに、身体障害や医療費などの伝統的な指標を用いた臨床的な脳卒中の研究に基づく罹患率や費用負担の推定は、脳血管疾患の負担を過小評価している可能性がある。例えば、65歳以上の人口の最大28%が脳画像上で確認されるいわゆる「無症候性梗塞」や虚血性白質疾患を含む潜在的な脳血管疾患が、記憶喪失、認知症、歩行障害、その他の機能障害と関連していることがますます認識されている。さらに、脳卒中の世界的な負担は大きく、脳卒中は世界の死因の第4位にとどまっており、特に発展途上国での影響が大きいとされている7, 8。
脳卒中の危険因子
ほとんどの場合、冠動脈の大血管の動脈硬化性疾患が原因である心筋梗塞とは異なり、脳卒中には様々な種類があるため、脳卒中の危険因子の特定は複雑である。脳卒中は、最も基本的なレベルでは、出血性脳卒中と虚血性脳卒中に分けられる。脳卒中の大部分(約80%)は虚血性脳卒中であるが、出血性脳卒中と虚血性脳卒中の相対的な負担は、集団によって異なる。出血性脳卒中には、主に脳実質内出血とくも膜下出血がある。出血性脳卒中と虚血性脳卒中の危険因子は類似しているが、いくつかの顕著な違いがある。また、虚血性脳卒中の病因別の危険因子にも違いがある。高血圧は、出血性脳卒中の特に重要な危険因子であるが、虚血性脳卒中につながる動脈硬化性疾患の原因にもなる。一方、高脂血症は、冠動脈硬化の危険因子であるのと同様に、頭蓋外および頭蓋内の血管のアテローム性動脈硬化による脳卒中の特に重要な危険因子です10。心房細動は、心塞栓症による脳卒中の危険因子である。
虚血性脳卒中と比較して出血性脳卒中の割合が高いことは、高血圧性疾患の負担が大きい発展途上国で見られるという証拠がある。発展途上国では、高血圧症の認識と治療が改善され、多くの場合、西洋式の食生活が増加したため、出血性脳卒中の割合は減少し、虚血性脳卒中や一般的な心血管疾患の割合が増加している。高血圧性出血性脳卒中から虚血性脳卒中への移行という疫学的パターンとそれに関連する危険因子は、ここ数十年の急速な経済発展を遂げた中国・北京における脳卒中の研究において、比較的短期間で特によく示されている11。また、脳血管疾患による死亡の割合は減少し、虚血性心疾患による死亡の割合は増加している。
集団における脳卒中の負担を軽減するには、修正可能な危険因子を特定し、リスク低減の取り組みの効果を実証する必要がある。脳卒中のリスクファクターには、修正可能なもの(例:食生活、併存疾患)と修正不可能なもの(例:年齢、人種)がある。また、危険因子には、短期的なリスクや誘因(例:感染症、敗血症、ストレス)中期的な危険因子(例:高血圧、高脂血症)長期的な脳卒中の危険因子(例:性別、人種)があると考えられる。また、若年者の脳卒中の危険因子は、高齢者のそれとは異なる可能性が高い。
個人の特定の危険因子の組み合わせに基づいて脳卒中のリスクを推定することは、特に初回の脳卒中イベントについては、プライマリーケアの重要な要素である。そこで研究者たちは、脳卒中のリスクが最も高い患者を特定するための有効なリスクスコアリングシステムを開発し、脳卒中のリスクを低減するためにこれらのリスク因子を修正したり、予防治療の役割を示すリスクのしきい値を特定したりすることを目指してきた13,14。14 フラミンガム脳卒中リスクプロファイル(FSRP)は、継続的に更新され、よく知られ、広く使用されているスコアであり、年齢、収縮期血圧、降圧療法、糖尿病、喫煙、心電図による左心室肥大、心血管疾患(冠動脈疾患、末梢血管疾患、うっ血性心不全)の有無などの脳卒中予測因子を組み合わせ、性別で層別した10年間の脳卒中リスクを推定するために使用することができる(表1)。15-18 他の脳卒中リスクスコアは、異なるサンプル集団から開発されており、これらの追加スコアは、FSRPと同じリスク因子の多くを含んでいるが、身体障害、うつ病、婚姻状況などの指標が追加されている。19-21 しかし、脳卒中のみに焦点を当てたリスク予測スコアの有用性は限られていると思われる。なぜなら、脳卒中のリスクがある患者は他の心血管イベントのリスクもあるため、心血管イベントや心血管死亡を含めたリスクスコアの方が有用であると考えられるからである22。最近では、ACC/AHA Pooled Cohortの10年動脈硬化性心血管疾患(AS心血管疾患)リスク推定値に初めてアフリカ系アメリカ人のデータが大量に含まれたことで、人種を予測変数として組み込むことが可能となり、黒人社会では特に有用なものとなった23。
表1 フラミンガムの脳卒中リスクプロファイル。収縮期血圧160mmHgの70歳の男女の10年間の脳卒中発症確率
| %確率 | |||||||
| 男性 | 8% | 15% | 18% | 30% | 40% | 60% | 85% |
| 女性 | 6% | 10% | 16% | 34% | 42% | 80% | 90% |
| 他のリスク要因の影響 | |||||||
| 高血圧治療薬 | なし | + | + | + | + | + | + |
| 糖尿病 | なし | + | + | + | + | + | |
| タバコの使用 | なし | + | + | + | + | ||
| 循環器疾患 | なし | + | + | + | |||
| 心房細動 | なし | + | + | ||||
| ECG_左心室肥大 | なし | + | |||||
D’Agostino RB, Wolf PA, Belanger AJ, Kannel WBより。脳卒中リスクプロファイル。降圧薬の調整。フラミンガム研究。Stroke. 1994;25:40-43
最近行われた国際的(22カ国)症例対照研究(INTERSTROKE)では、10の修正可能な危険因子が脳卒中のリスクの90%を説明することがわかった(表2)。 24 この研究では、3000人の脳卒中患者(虚血性2337人、出血性663人)が登録され、高血圧、現在の喫煙、ウエスト・ヒップ比、ダイエット・リスク・スコア、定期的な身体活動、糖尿病、大量のアルコール摂取、心理社会的ストレスとうつ病、心疾患、アポリポ蛋白BとA1の比率などが、すべて虚血性脳卒中のリスクと関連していることがわかった。また、脳内出血のリスク要因としては、高血圧、喫煙、ウエスト/ヒップ比、食生活、大量のアルコール摂取などが挙げられた。25 高血圧、糖尿病、動脈硬化性疾患などの長期的な脳卒中の危険因子については多くのことが知られているが、脳卒中の短期的な危険因子や誘因についてはあまり知られていない26。
表2 脳卒中の主な非修正可能および修正可能な危険因子
| 変更不可能なリスク 要因 |
変更可能な危険因子 | |
|---|---|---|
| 虚血性脳卒中 | 年 | 高血圧 |
| セックス | 現在の喫煙 | |
| 人種/民族 | ウエストヒップ比 | |
| ダイエット | ||
| 運動不足 | ||
| 高脂血症 | ||
| 糖尿病 | ||
| アルコール消費量 | ||
| 心臓の原因 | ||
| アポリポタンパク質BからA1 | ||
| 遺伝学* | ||
| 出血性脳卒中 | 年 | 高血圧 |
| セックス | 現在の喫煙 | |
| 人種/民族 | ウエストヒップ比 | |
| アルコール消費量 | ||
| ダイエット | ||
| 遺伝学* | ||
*遺伝はModifiableとNon-Modifiableの間に配置されているが、これは遺伝的危険因子が直接的に、あるいは遺伝子と環境の相互作用の修正を通じて、潜在的に修正可能であると認識されつつあることを表している。
Modifiable risk factors from O’Donnell MJ, Xavier D, Liu L, Zhang H, Chin SL, Rao-Meracini P, er al)。 Risk factors for ischaemic and intracerebral haemorrhagic stroke in 22 countries (the INTERSTROKE study): A case-control study. Lancet. 2010;376:112-123
脳卒中の非修正可能な危険因子
脳卒中の修正不可能な危険因子(リスクマーカーとも呼ばれる)には、年齢、性別、人種、遺伝などがある。一般的に、脳卒中は加齢に伴う疾患である。27 2005年の虚血性脳卒中発症の平均年齢は69.2歳であった。27 2005年の虚血性脳卒中発症者の平均年齢は69.2歳であったが、最近では、虚血性脳卒中の発症率および有病率は、1993/1994年の12.9%から 2005年には18.6%へと、20~54歳の年齢層で増加していることが示唆されている。米国のNationwide Inpatient Sampleの分析では、14~44歳の成人における虚血性脳卒中の入院患者数は、1995年から 2008年まで毎年増加している29。
脳卒中リスクに対する性別の関係は、年齢によって異なる。若い年齢では、女性の脳卒中リスクは男性と同程度かそれ以上であるが、高齢になると相対リスクは男性の方がわずかに高くなる。27,32 ヨーロッパの8つの国で行われた研究によると、脳卒中のリスクは、男性では1年に9%、女性では1年に10%増加することがわかった33。
脳卒中には人種的な格差があることはよく知られている。34 アフリカ系アメリカ人は、白人と比較して、脳卒中発症リスクが2倍高く、脳卒中による死亡率も高い34-44。さらに、アメリカインディアンは、非ヒスパニック系白人に比べて脳卒中の発症率が高い45。最近、REGARDS試験で明らかになったように、人種間の格差の原因の一つは、アフリカ系アメリカ人に、高血圧、肥満、糖尿病などの脳卒中の危険因子が多く存在することであると考えられる。34, 55, 56 脳卒中リスクの人種間格差に影響を及ぼす可能性のあるその他の要因としては、疾患の他の社会的決定要因、言語、出生率などが挙げられる57-60。脳卒中死亡率の人種格差は、脳卒中発症率の人種格差によってもたらされており、少数民族を対象とした脳卒中予防介入の重要性が強調されている61 興味深いことに、黒人人種と脳卒中の関連性は、脳卒中発症時には強いものの、脳卒中再発時には見られない62。
63-65 脳卒中の他の危険因子と同様に、脳卒中の遺伝的リスクは、年齢、性別、人種によって異なる。遺伝的危険因子と遺伝率については、以下の遺伝の項で詳しく説明する。
修正可能な危険因子
修正可能な危険因子は最も重要であり、これらの因子を減らすことを目的とした介入戦略は、結果的に脳卒中のリスクを減らすことになる。修正可能な危険因子は、さらに医学的条件と行動的危険因子に分けられる27。高血圧、糖尿病、高脂血症、喫煙などの「伝統的な」危険因子が脳卒中の原因となることはよく知られている。しかし、新規の危険因子については、現在も活発な研究が行われている。
高血圧症
高血圧は、脳卒中の最も重要な修正可能な危険因子であり、血圧と脳卒中リスクの間には強い、直接的、直線的、連続的な関係がある66。高血圧の定義には、高血圧の既往歴と160/90mmHgの血圧測定値の両方が含まれており、集団帰属リスク、すなわち高血圧に起因する集団の脳卒中の割合は、54%であった。また、血圧の影響は、虚血性脳卒中よりも出血性脳卒中の方が大きかった。
高血圧と定義されていない人でも、血圧が高いほど、脳卒中のリスクは高くなる。55 高血圧の有無にかかわらず、血圧は年齢が上がるにつれて上昇し、それによって高血圧を発症する生涯リスクが高まる。68, 69 65歳以上の人のうち、3分の2以上が高血圧である。66 高血圧のコントロールは、意識や治療法の向上により改善されており 2008年には約50%がコントロールされ、米国の高血圧の有病率は29%で推移している70, 71 高血圧のコントロールのための薬物療法に加えて、高血圧患者は、高血圧の影響を軽減するために、食事の変更や運動量の増加などの行動的なライフスタイルの変化に取り組むことが推奨されている。66 薬物療法であれ生活習慣の改善であれ、高血圧の治療は、脳卒中のリスクを低減する最も効果的な戦略の一つであるが、地域社会では高血圧の治療が不十分である。
最近の研究では、血圧測定値の個人内変動、あるいは個人内の異なる時点での血圧測定値の違いが、平均血圧の上昇だけによるリスクを超えて、脳卒中リスクと関連することが示唆されている。例えば、英国の研究者は、高血圧、脳卒中の既往、または一過性脳虚血発作の既往がある患者を対象とした4つの無作為化比較試験のデータを用いて、約2年間の2〜10回の血圧測定の変動が、平均血圧とは独立した脳卒中の危険因子であることを明らかにした72。これらの結果は、カルシウム拮抗薬のように、平均血圧だけでなく変動性を低下させる血圧治療薬が、より大きな効果を発揮することを示唆している。しかし、他の研究ではこの関連性は確認されていない。例えば、Cardiovascular Health Study (CHS)では、血圧の個人内変化を考慮したモデルを用いたところ、血圧の変動は、心疾患や全死亡とは関連していたものの、脳卒中リスクとは関連していなかった73。
糖尿病
糖尿病は、脳卒中の独立した危険因子であり、糖尿病患者の脳卒中リスクは2倍に増加し、糖尿病患者の死亡の約20%を脳卒中が占めている。76 糖尿病の罹患期間も脳卒中リスクの増加と関連している。Northern Manhattan Studyでは、糖尿病の罹患期間は虚血性脳卒中と関連していた(糖尿病罹患1年あたりの調整HR=1.03,95%CI=1.02-1.04)。非糖尿病患者と比較して、糖尿病罹患期間が0〜5年(調整後HR=1.7,95%CI=1.1〜2.7)および5〜10年(調整後HR=1.8,95%CI=1.1〜3.0)の人はリスクが高く、糖尿病罹患期間が10年以上の人のリスクは顕著に増加した(調整後HR=3.2,95%CI=2.4〜4.5)74。糖尿病の増加は、若年層における脳卒中リスクの増加の一部を説明している可能性がある。77 糖尿病患者の行動修正と内科的治療の併用は、脳卒中のリスクを減少させることが示されている。78, 79 興味深いことに、糖尿病患者の血糖値コントロールだけでは、行動修正と医学的介入を組み合わせた集中的な介入がもたらすようなリスクの減少は得られない。80, 81
心房細動と心房性心疾患
心房細動(AF)は、脳卒中の主要な危険因子であることが長年にわたって認識されており、米国人口の高齢化に伴い、その危険性はますます高まっている。心房細動と脳卒中の関連は、長い間、心房細動を起こしている左心房内の血液が滞留し、血栓が形成され、脳への塞栓を引き起こすことが原因であると考えられてきた。しかし、最近のデータはこの仮定を覆すものである。第二に、細動を伴わない発作性上室性頻拍 (PSVT) も脳卒中リスクと関連しており、 保険金請求に基づくデータの分析では、 心房細動を調整した後でも、 PSVT は脳卒中リスクの 2 倍と関連していた84。第三に、心房細動に関連する遺伝子変異 (例えば、ナトリウム利尿ペプチド前駆体 A の遺伝子) を持つ患者は、心房細動の発症前であっても脳卒中を発症する可能性がある85。さらに、環境によっては心房が電気機械的に解離している場合があり、心電図では正常な洞調律であっても心房細動が発生することがある。86 N-terminal pro-brain natriuretic protein (NT-proBNP) の上昇は、 観察コホートにおいて脳卒中リスクの 2 倍と関連している。また、左心房の収縮力を反映する心電図のリードV1上のP波の異常も、心房細動とは無関係に脳卒中リスクと関連している87-89。
これらの知見は、リズムだけでなく、心房基質を重視した最新のモデルの必要性を示唆している。90 このモデルによると、 加齢と血管性危険因子が心房組織基質の異常、 すなわち「心房心臓病」を引き起こし、 それが心房と血栓塞栓症の原因となる(図1)。このモデルによれば、心房細動は、左心房機能障害に関連した脳卒中リスクの一つのマーカーに過ぎないかもしれない。90 脳卒中が発症すると、自律神経系の異常や脳卒中後の炎症状態によって、その後の心房細動のリスクはさらに一時的に増加するかもしれない。
図1 血栓塞栓症性脳卒中の心房基質モデル
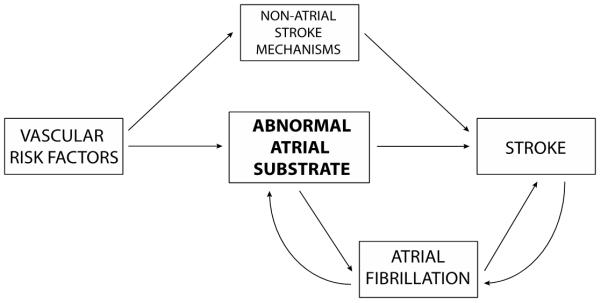
このモデルは、心房細動(AF)と脳卒中の関係を説明する上で、全身性基質と心房性基質の重要性を強調している。全身の血管危険因子が心房の組織基質の異常を引き起こし、それが心房細動と血栓塞栓症の両方を引き起こす。心房細動が発症すると、この不整脈は心房の構造的リモデリングを引き起こし、心房組織基質と心房機能不全を悪化させ、それによって血栓塞栓症のリスクをさらに高める。同時に、このプロセスを促進する全身的な危険因子は、大動脈硬化、駆出率低下を伴う心室収縮機能障害、現場での脳小血管閉塞など、心房外での脳卒中の特定のメカニズムを促進することにより、脳卒中リスクを別個に増加させる。脳卒中を発症すると、自律神経系の変化や脳卒中後の炎症状態により、一過性に心房細動のリスクが高まる可能性がある。(Kamel H, Okin P, Elkind MSV, Iadecola C. Atrial Fibrillation and Mechanisms of Strokeより。Time for a New Model. Stroke 2016;47(3):895-900.)
脂質異常症(Dyslipidemia)
脂質異常症と脳卒中リスクの関係は複雑で、総コレステロールの上昇で虚血性脳卒中リスクが上昇し、HDLコレステロールの上昇で虚血性脳卒中リスクが低下する。92-98 トリグリセリドの脳卒中リスクへの影響に関する証拠は、相反するものである。さらに、リスクは脳卒中のサブタイプに依存しているようで、大動脈の虚血性脳卒中とコレステロール値の関連は、他の虚血性脳卒中のサブタイプよりも強かった。99-101 脂質と脳内出血に関するデータは、いくつかの観察研究ではスタチン治療によって脳内出血のリスクが増加しないとされているのに対し、いくつかの治療試験では増加しているという事実によって、さらに複雑になっている102。これらの研究では、脂質異常症と虚血性脳卒中および出血性脳卒中のリスクとの間に矛盾した正反対の結果が示されている可能性があるが、一般の患者集団においては、スタチンの使用は、出血性脳卒中のリスクを明確に増加させることなく、全脳卒中および虚血性脳卒中のリスクを減少させるようである103, 104。しかし、一部の脳卒中患者、特に過去に出血、小血管障害、脳アミロイド血管症があった患者では、スタチンは脳内出血のリスクを増加させる可能性がある105,106。
座りがちな行動、食事・栄養、肥満、メタボリックシンドローム
身体活動の低下は、脳卒中を含む多くの健康被害と関連している。身体活動が活発な人は、活動していない人に比べて、脳卒中や脳卒中による死亡のリスクが低いと言われている。107 身体活動と脳卒中の関係は、血圧の低下、糖尿病の減少、過剰体重の減少に関連していると考えられる。108
食事は、脳卒中のリスクだけでなく、糖尿病、高血圧、脂質異常症などの他の脳卒中危険因子のリスクにも影響を与える。109, 110 食事調査には、リコールバイアスや測定誤差などいくつかの限界があるが、食事や栄養の特定の構成要素は、脳卒中のリスク要因として確立されているものもある。例えば、塩分の摂取は、高血圧と脳卒中のリスクを高めるが、111-115,カリウムの摂取量の増加は、脳卒中のリスクを低下させると言われている。116-119 地中海食、すなわち、果物と野菜を多く含む食事は、脳卒中のリスクを減少させる。120, 121
体重と肥満は、脳卒中の危険因子であるが、脳卒中のリスクを高める具体的な方法については議論が続いている。肥満は、高血圧や糖尿病などの脳卒中の危険因子と関連している。122, 123 97のコホート研究から180万人の参加者を集めた最近の大規模なメタ分析では、肥満の一般的な指標であるBMIが脳卒中のリスクに及ぼす影響の76%は、血圧、コレステロール、およびグルコースのレベルによって媒介されることがわかった。血圧だけで体重によるリスクの65%を占めていた。例えば、INTERSTROKEでは、BMIではなく、ウエスト-ヒップ比で測定される腹部脂肪率の増加が脳卒中リスクと関連していた。24
メタボリックシンドロームとは、肥満、脂質異常症、高血圧症、糖尿病の予備力を含む概念である。座りっぱなしの生活がメタボリックシンドロームの原因であるという証拠がある。125 メタボリックシンドロームによる虚血性脳卒中のリスクは2倍になるようで、そのリスクはシンドロームの構成要素の数が増えるほど高くなる126, 127 メタボリックシンドロームの構成要素が個別に脳卒中に関係していることを考えると、これらの危険因子の組み合わせが脳卒中のリスクの増加に関係しているはずです127。
アルコール摂取、薬物乱用、喫煙
アルコール摂取と脳卒中リスクの関係は、脳卒中のタイプによって異なる。飲酒と虚血性脳卒中のリスクにはJ字型の関係があり、軽度から中等度の飲酒(男性は1日2杯まで、女性は1日1杯まで)は脳卒中を予防し、多量の飲酒は虚血性脳卒中のリスク増加と関連しているという証拠がある。128-133 アルコール摂取は、出血性脳卒中とより直接的な線形関係があり、少量のアルコール摂取でも出血のリスクが高まるようである。大量のアルコール摂取は高血圧と関連しており、アルコールを摂取している高血圧患者では血圧のコントロールが不十分であるとされている。134-140
コカイン、ヘロイン、アンフェタミン、エクスタシーなどの違法薬物の使用は、虚血性および出血性の脳卒中のリスクを増加させる。141-143 喫煙は、脳卒中の主要な危険因子であることに変わりはなく、脳卒中のリスクをほぼ2倍にし、パックイヤーと脳卒中リスクの間に用量反応関係がある。15, 144 喫煙は、脳卒中による年間死亡者数の約15%を占めると推定されている。145 禁煙は脳卒中のリスクを急速に減少させ、過剰なリスクは禁煙後2-4年でほぼ消失する。146-149 REGARDSコホートでは、副流煙は脳卒中の独立した危険因子として同定されており、他の脳卒中危険因子を考慮した上で、副流煙にさらされた人とさらされていない人では、脳卒中のリスクが30%増加している150。
炎症と感染症
炎症性バイオマーカーのレベルは、他の心血管疾患や全死亡率のリスクと同様に、脳卒中のリスクの増加と関連している。高感度測定法(hsCRP)を用いて測定されるC反応性タンパク質は、特によく研究されているマーカーの一つである。HsCRPは、心血管イベントとの一貫した関連性、半減期の長さ、長期間冷凍保存しても安定していることから、臨床現場で選ばれる炎症マーカーとなっている。160,309人以上を対象とした54件の前向きコホート研究のメタ分析では、hsCRP値と虚血性脳卒中との間に中程度の関連性が認められた(log CRP濃度の標準偏差増加あたりの相対リスクは1.27,95%CIは1.15~1.40)151。しかし、遺伝学的研究では、hsCRPと虚血性脳卒中リスクとの因果関係は確認されていない。ある研究では、CRP遺伝子の一塩基多型がhsCRP値の上昇と関連していたが、これらの多型は脳卒中リスクの上昇とは関連していなかった153。
炎症が脳卒中リスクと関連している理由は、まだ不明である。動脈硬化は、活性化したマクロファージや炎症性メディエーターを多く含むプラークなど、炎症性の高い特徴を持つと認識されているため、炎症マーカーの上昇は、動脈硬化の負荷が高いことを反映しているのかもしれないし、あるいは動脈硬化が非常に活発であることを反映しているのかもしれない。したがって、炎症マーカーの上昇は、単にこれらのプラークからの炎症性負荷のマーカーとして機能し、hsCRPの上昇は、他の従来の危険因子による血管疾患負荷の一種のエピフェノメノンとなっているのかもしれない。観察研究では、一般に、統計的な調整を行うことにより、これらの他の危険因子による交絡を排除しようとしているが、このような危険因子やその重症度をすべて完全に測定することができないために、交絡が残る可能性がある。CRP遺伝子の変異がリスクの増加を引き起こすことを確認できなかった遺伝子研究は、残余交絡の可能性と一致している。しかし、急性期タンパク質であるCRPが脳卒中のリスクに直接関与している可能性を示すいくつかの証拠がある。例えば、単量体CRPは、他の免疫メディエーターと相互作用して、血小板や補体タンパク質を活性化する154。認識面は、Streptococcus pneumoniaeやアポトーシス細胞のC多糖体分画に含まれるホスホコリン残基、核自己抗原、リポタンパク質など、多様な構造基と結合することができる155。認識面が結合すると、エフェクター面が、内皮細胞に存在するC1qやFc受容体に結合して補体経路を活性化するような構造変化が生じる156。
炎症が脳卒中リスクに関与するもう一つの方法は、感染症によるものである。最近のデータでは、一般的な感染症に慢性的にさらされることが脳卒中の潜在的な危険因子であること、また、急性感染症も脳卒中の引き金になることが示唆されている。例えば、NOMASの分析では、いくつかの一般的な細菌およびウイルス感染(Chlamydia pneumoniae、Helicobacter pylori、単純ヘルペスウイルス1および2,サイトメガロウイルス)に対する血清検査で評価した慢性感染の複合指標を、個々の感染が脳卒中リスクに及ぼす影響で加重したところ、長期的な脳卒中リスクの増加と関連していた158。個々の感染症は、他の危険因子を調整した後も、脳卒中リスクと有意ではないが正の相関があったが、加重感染負荷指数は、人口統計や危険因子を調整した後も、すべての脳卒中リスクの上昇と関連していた(標準偏差あたりの調整ハザード比1.39,95%CI 1.02~1.90)。この結果は、炎症性バイオマーカーを調整しても同様であった。また、この感染負荷の指標は、頸動脈プラークの厚さや潰瘍、認知状態や衰えとも関連していた159-161。
最近の研究では、ヒト免疫不全ウイルス(HIV)感染は、高活性抗レトロウイルス療法が行われている時代においても、虚血性および出血性脳卒中のリスクをわずかに増加させることが明らかになった162, 163。このリスク増加のメカニズムはまだ不明であるが、CD4+ T細胞数の低下(200細胞/mm3未満)やHIV-1 RNAコピー数の増加など、免疫抑制の証拠がある人ほどリスクが高いようである。HIVは動脈壁を直接傷つける可能性がある。例えば、外向きの動脈リモデリング、すなわち動脈壁の相対的な薄化は、感染が長期化し、死亡前のウイルス量が多いHIV患者でよりよく起こるという証拠がある164。他の研究では、心血管イベントと脳血管イベントでリスクが異なる可能性はあるものの、免疫抑制が血管リスクに直接影響することは示唆されていない165。
脳卒中の引き金
脳卒中の疫学における新たな研究領域として、脳卒中の誘因の特定が挙げられる。この問題への取り組みは、脳卒中の主要な危険因子(「なぜ私が」という疑問)については十分理解しているものの、特定の時点で脳卒中が発生する理由(「なぜ今」という疑問)については、まだ初歩的であるという認識が高まっていることを反映している26。例えば、急性感染症が脳卒中の短期的な誘因となることが示唆されている。例えば、Cardiovascular Health Study(n=5888)のケースクロスオーバー解析では、最近の感染症による入院が脳卒中のリスク増加と関連していた167。この種の解析では、各個人が自分自身のコントロールとなるため、交絡因子が制限され、時間依存性の関連を発見することができる。脳卒中を発症した669人のうち、過去90日以内に感染症で入院した場合、脳卒中のリスクが上昇した(オッズ比(OR)3.4,95%CI 1.8-6.5)。また、入院後の時間間隔が短くなるほど、リスクは増加した。30日の場合はOR 7.3(95%CI 1.9-40.9)14日の場合はOR 8.0(95%CI 1.7-77.3)であった。確認的生存分析では、感染症による入院は、その後30日間に虚血性脳卒中を発症するリスクの増加と関連していた(調整後HR=2.5,95%CI 1.4-4.5)。この結果は、感染症による入院が時間の経過とともに減少することを示している。その他のエビデンスでは、より軽度の呼吸器感染や尿路感染が脳卒中リスクの上昇と関連していることや、予防接種が脳卒中の予防に役立つことが示唆されている。12,029人の参加者を対象とした8つの無作為化対照試験のコクラン・レビューでは、インフルエンザワクチン接種が心血管アウトカムを減少させるというエビデンスが示されている。また、個人内比較法を用いたケースシリーズ研究では、呼吸器感染後に脳卒中のリスクが増加したが、インフルエンザ、肺炎球菌感染症、破傷風のワクチン接種後には減少した168,169。これらのエビデンスに基づき、毎年のインフルエンザワクチン接種は脳卒中の発生率に影響を与える可能性があり、最近のガイドラインで強調されているように、脳卒中のリスクが中程度から高い人に接種することができる。
170 行政データセットを用いた研究では、敗血症が脳卒中の危険因子であることが確認されているが、敗血症後の脳卒中の絶対的なリスクは低く、リスクのある人は敗血症後1年以内はリスクが残っているようである。したがって、急性感染症イベントが脳卒中リスクの一因となる炎症促進状態の長期化につながることは、もっともなことである。一方、デンマークの人口ベースのコホート研究では、菌血症にさらされた後の心血管イベントの約80%が指標となる入院中に発生し、脳卒中のリスクは感染後3~15日目に最も高くなることが示された167, 173, 174。
急性感染症後に脳卒中リスクが上昇する短期的な状態を特定することは、治療にも直接影響を与える可能性がある。例えば、発熱時や感染時には、抗血小板剤やスタチンの投与量を増やすことが必要かもしれない。さらに、感染症で入院している間やその直後は、「治療可能な瞬間」であり、その間に患者の心血管リスクを評価し、標準的な予防戦略を導入することができるであろう。
その他の脳卒中の誘因としては、大気汚染が考えられる。大気汚染は、どこにでもある環境汚染であり、特に都市部では公衆衛生上の問題として急速に広まっている。2011年現在、米国では1億2,400万人が米国環境保護庁(EPA)の国家環境大気質基準を満たしていない地域に居住している。大気汚染は、脳卒中の新たな危険因子として認識されている。175-177 虚血性脳卒中の入院・死亡リスクと、汚染物質レベル(主に直径2.5ミクロン以下の粒子状物質(PM2.5))の短期的なピークとの関係を示す証拠は、主にケースクロスオーバー研究と時系列研究で見られている178。米国の9都市のメディケア受給者を対象とした大規模なケースクロスオーバー研究では、PM10の四分位範囲内での増加が当日の脳卒中入院の1.03%増加と関連しており、CO、NO2,SO2でも同様の結果が得られている179。長期にわたる暴露は、一般的に脳血管イベントのリスクを高めることが示されている180-183が、いくつかの研究では関連性がないことも報告されている184。メタアナリシスでは、大気汚染と脳卒中との間に一貫した正の関連性が認められている。20件の研究を分析した結果、PM2.5が5ug/m3増加すると、脳卒中のリスクが6%増加し、脳卒中による死亡率が12.5%増加することが明らかになった。185
脳卒中の遺伝的危険因子
遺伝的要因は、脳卒中のリスクに寄与するが、遺伝子変異によるリスクと家族共有の暴露によるリスクを区別することは依然として困難である。この課題は、脳卒中の異質性、脳卒中の原因となる従来の危険因子の多さ、集団や研究のばらつきによって複雑になっている。しかし、遺伝的な差異は、いくつかの潜在的なメカニズムを通じて、脳卒中のリスクに寄与する可能性がある(表3)。第一に、特定の稀な単一遺伝子疾患が、脳卒中を主症状または特異症状とする個々の家族性症候群の原因となる可能性がある(例えば、皮質下梗塞および白質脳症を伴う脳常染色体優性動脈症、またはCADASIL)。第二に、単一遺伝子の障害は、脳卒中が一つの症状に過ぎない多臓器障害を引き起こすことがある(例:鎌状赤血球貧血)。186 第4に、心房細動、糖尿病、高血圧などの従来の脳卒中危険因子の遺伝的原因も、驚くことではないが、脳卒中のリスクと関連している。例えば、心房細動のリスクを高める遺伝子変異と虚血性脳卒中との間には関連性がある。このことから、心房細動が原因である可能性が高い脳卒中の診断に遺伝子検査が役立つ可能性がある。
表3 脳卒中の主な遺伝的原因
| 疾患 | モードを 継承 |
遺伝子/タンパク質 | 脳卒中のメカニズム | 一般的な臨床 症状 |
|---|---|---|---|---|
| 主に脳卒中を引き起こす単一遺伝子障害 | ||||
| 皮質下梗塞および白質脳症を伴う脳常染色体 優性 動脈症(CADASIL) |
常染色体 優性 |
NOTCH3 / NOTCH3 | 小血管 疾患 |
虚血性脳卒中、 白質脳症、 片頭痛、精神 症状、認知症 |
| 脳常染色体 劣性 と動脈症 皮質下梗塞 や 巣性白質脳症 (CARASIL) |
常染色体 劣性 |
HTRA1 / HtrAセリン ペプチダーゼ-1 |
小血管 疾患 |
虚血性脳卒中、 白質脳症、 早期禿頭症、 脊椎症 |
| 家族性アミロイド 血管症 |
常染色体 優性 |
APP /ベータ-アミロイド 前駆体タンパク質 |
小さな皮質 血管の破裂 |
ローバーの出血、 microbleeds、 白質脳症、 認知症、「アミロイド呪文」 |
| コラーゲン4(COL4A1) 変異 |
常染色体 優性 |
IV型コラーゲンのCol4A1 /α1鎖 | 皮質および 皮質下 血管の破裂 |
表在性および深部 出血、頭蓋内 動脈瘤、血尿、嚢胞性 腎疾患 |
| 症状として脳卒中を含む遺伝性疾患 | ||||
| エーラス・ダンロス型4型 | 常染色体 優性 |
Col3A1 /タイプIII プロコラーゲン |
動脈 解離 |
大動脈、腎臓、脾臓、腸骨の 解離/破裂; 動脈瘤/仮性動脈瘤; 内臓および筋肉の破裂; 妊娠 中の子宮破裂 |
| ファブリー病 | X連鎖 | GAL / α- ガラクトシダーゼA |
大小の 動脈疾患 |
虚血性脳卒中および 血管障害、 被角血管腫、角膜 混濁および白内障、 神経障害(無汗症、 発汗低下)、腎不全 |
| マルファン症候群 | 常染色体 優性 |
FBN1 /フィブリリン1 | 動脈 解離、 心臓 塞栓症 |
虚血性脳卒中、動脈 解離、脊柱側弯症、漏斗胸 、大動脈拡張、 心臓弁膜症/心不全 、水晶体転位 |
| 乳酸と脳卒中のようなエピソードを 伴うミトコンドリア脳症(MELAS) |
母性 | ミトコンドリア DNA(MT-TL1)/ ミトコンドリアに コードされたtRNA ロイシン1(UUA / G); その他 |
エネルギー障害、 「代謝性 脳卒中」 |
血管境界を観察しない虚血性脳卒中、 低身長、発達 遅延、発作、視力喪失、 ミオパチー、糖尿病 |
| かま状赤血球症 | 常染色体 劣性 |
HBB /ベータグロビン (ヘモグロビン サブユニット) |
大 血管疾患、 もやもや 症候群 |
虚血性脳卒中、痛みを伴う危機、 血管の危機、細菌 感染 |
| 平滑筋アルファ- アクチン(ACTA2) 突然変異関連 障害 |
常染色体 優性 |
ACTA2 /平滑 筋アルファ-アクチン |
もやもや 症候群 |
虚血性脳卒中、冠状 動脈疾患、胸部大動脈 瘤、モヤモヤ 症候群 |
| 一般的な遺伝的変異 | ||||
| TSPAN2 | 一般的な バリアント |
TSPAN2 / テトラスパニン-2 |
血管の 発達; アテローム性動脈硬化症 |
大血管虚血性脳卒中; |
| FOXF2 | 一般的な バリアント |
FOXF2 /フォークヘッド 転写因子 |
小血管 疾患; 平滑筋細胞の 異常 と脳血管の周皮細胞被覆 |
すべての脳卒中、小血管の脳卒中、 時期尚早で広範囲の 白質疾患 |
| ABO | 一般的および まれなバリアント |
ABO /血液型 タンパク質 |
血栓症 | 血栓症、虚血性脳卒中 |
| HDAC9 | 一般的および まれなバリアント |
HDAC9 /ヒストン デアセチラーゼ |
アテローム性動脈硬化症 | 大血管虚血性脳卒中 |
| PITX2 | 一般的および まれなバリアント |
PITX2 | 洞房結節の 発達 と イオン チャネルの調節; 心臓伝導の 変調; 心房細動 |
心塞栓性虚血性 脳卒中、心房細動 |
| ZFHX3 | 一般的および まれなバリアント |
ZFHX3 | 心房 細動 |
心塞栓性虚血性 脳卒中、心房細動 |
現在、遺伝は一般的に修正不可能な危険因子と考えられているが、将来的には遺伝子治療がこの状況を変えるかもしれない。例えば、鎌状赤血球貧血の患者は、脳卒中のリスクを減らすために輸血を行うことができ、また、遺伝的要因の中には、治療できないまでも修正可能なものもある。例えば、鎌状赤血球貧血の方は、輸血を行うことで脳卒中のリスクを軽減することができる。また、環境因子が遺伝子変異と相互作用することもあるため(すなわち、遺伝子と環境の相互作用)遺伝的要因も修正可能な場合がある。
脳卒中の遺伝率
188 脳卒中の家族歴は、脳卒中のリスクを30%増加させる。189 一卵性双生児は、二卵性双生児に比べて脳卒中のリスクが1.65倍高い。しかし、小血管虚血性疾患のMRI検査の一致率は、一卵性双生児で0.61,二卵性双生児で0.38であり、小血管虚血性脳卒中の遺伝的感受性が示唆されている190。
脳卒中を主症状とする単一遺伝子疾患
CADASIL は、皮膚や脳を侵す小血管障害であるが、臨床症状は中枢神経系に限定される。病理学的には、小血管の中膜の変性と、顕著で進行性の白質脳症が含まれる。臨床的には、片頭痛のような頭痛、うつ病や精神病などの精神症状、脳卒中の再発を呈し、しばしば仮性球麻痺や皮質下の認知症を引き起こす。特徴的な画像所見としては、外被および前側頭極に白質病変が認められ、通常、高血圧や加齢に伴う典型的な白質変化とは区別される。
CADASILは、染色体19q12に位置するNotch3遺伝子の変異と関連している。191 これらの変異のほとんどは、細胞外受容体ドメインに発現するシステイン残基の数を変化させるミスセンス変異である。192 Notch3は体内で広く発現し、発生に重要な役割を果たしているが、CADASILは臨床的には神経系にのみ影響を及ぼす。193 皮膚生検で顆粒状の親水性物質が検出された場合、診断の病理学的根拠となり、画像診断では比較的軽微な所見で、最も一般的な変異に対する遺伝子検査の結果が陰性の患者でも本疾患が検出されることがある194。
また、脳卒中を引き起こす稀な単一遺伝子疾患には、HtrAセリンペプチダーゼ-1遺伝子の変異によって引き起こされる脳常染色体劣性動脈症(CARASIL)195,グルコーストランスポーターGLUT10をコードするSLC2A10遺伝子の変異によって引き起こされる動脈蛇行症候群197,198,シスタチンCの変異によって引き起こされる家族性脳アミロイド血管症199などがある。
脳卒中を重要な症状とする単一遺伝子多系統疾患
鎌状赤血球貧血(SCA)では、脳血管合併症がよく知られており、低酸素濃度で重合した赤血球が原因で、小血管閉塞や鎌状赤血球関連動脈疾患(もやもや症候群)を引き起こす。SCAは、脳卒中を発症した小児の約6%に見られるが、SCA患者の25%が45歳までに脳卒中を発症する。虚血性脳卒中の発症率が最も高いのは、2~5歳の時である。200 未治療の場合、脳卒中を再発するリスクは90%にも上る。201 多発する無症候性梗塞は、臨床的な梗塞よりも多く見られる可能性があり、認知処理や学業成績に支障をきたす可能性がある202。
ファブリー病は、リソソーム酵素であるα-ガラクトシダーゼAのX連鎖性欠損症であり、GLA遺伝子のミスセンスおよびナンセンス変異によって引き起こされる。α-ガラクトシダーゼAの機能が失われると、血管内皮を含む全身の細胞にグロボトリアオシルセラミドが蓄積される。ファブリー病は、リソソーム記憶障害の中で2番目に多い疾患である。脳血管の病変は、一般的に大血管と小血管の両方に起こり、特に後部循環に影響を及ぼし、若年の脳卒中患者に発生することがある。203 脳卒中のメカニズムとしては、心臓の病変による心臓塞栓症、大血管のdolichoectasiaや蛇行による大動脈血栓塞栓症、内皮や血管平滑筋細胞の糖脂質蓄積による小血管の閉塞性疾患などが挙げられる。Fabry Outcome Surveyでは、25-44歳の男性における脳卒中の発生頻度は、一般人口における予想発生頻度の約12倍であった204酵素補充療法は、この疾患の自然経過を修正することができる。
ミトコンドリア脳症・乳酸アシドーシス・脳卒中様エピソード症候群(MELAS)は、ミトコンドリアDNAの変異によって引き起こされるミトコンドリア障害であり、呼吸鎖不全とエネルギー産生の低下をもたらす。エネルギー産生の失敗は、閉塞性血管プロセスではなく、代謝的な原因によって脳組織の機能障害や損傷を引き起こすため、MELASで見られる脳病変は、通常、古典的な血管領域を認めない。患者は、脳症と局所的な神経機能障害の発作を呈し、片頭痛、吐き気、嘔吐を伴うこともある。発作は、代謝需要を増加させる発熱によって促進されることがある。複数の器官系が影響を受け、低身長、難聴、発達遅延、糖尿病などの問題を引き起こす可能性がある。家族の表現型には大きな違いがあるが、これはヘテロプラスミー、すなわち異なる組織内で変異したミトコンドリアDNAが様々に発現することによるものである。
コラーゲンの遺伝的障害は、脳血管系を含む複数の組織に影響を及ぼすこともある。エーラスダンロス・スペクトル障害は、結合組織の異常と血管の脆弱性を特徴とする遺伝性疾患のグループである。最も厄介なのはIV型で、動脈解離、脳動脈瘤、脳卒中などを引き起こす可能性がある。しかし、妊娠中の子宮破裂など、他の臓器にも合併症が生じることがある。IV型EDSは、III型コラーゲン(COL3A1)の変異が原因で発症する。また、IV型コラーゲンのα1鎖をコードする遺伝子(COL4A1)の変異でも、血管壁の整合性が損なわれる。206 頭部外傷、スポーツへの参加、抗凝固剤の使用などにより、脳出血が起こりやすくなる。
マルファン症候群や ACTA2 関連血管症などの他の遺伝性結合組織疾患も、同様に血管の脆弱性を伴い、動脈解離を引き起こす可能性がある。ACTA2遺伝子の変異は、血管平滑筋に見られるアクチンのアイソフォームであるアクチンα2をコードしており、アクチンの重合と平滑筋細胞の増殖を引き起こす。表現型としては、固定された瞳孔拡張、低張性膀胱、腸の不正回転と蠕動運動低下、肺高血圧症など、全身に平滑筋機能障害の証拠が見られる。
一般的な虚血性脳卒中や脳卒中の危険因子に関連する遺伝子
一般的な虚血性脳卒中のリスクに遺伝が関与していることを示す新たな証拠がある。いくつかの遺伝子変異が同定されているが、それぞれの遺伝子変異の影響の大きさは小さいと考えられている。凝固に関連する遺伝子の変異については、広く研究されている。メタストロークは虚血性脳卒中に関する最大の遺伝子共同研究の1つであり、ヨーロッパ、北米、オーストラリアの15の症例対照脳卒中コホートが含まれている。メタストロークは、ヨーロッパ、北米、オーストラリアの15の症例対照コホートで構成されており、参加者は虚血性脳卒中の病因別に、修正TOAST分類システムに従って分類されている。メタストロークでは、最初のヨーロッパの小規模コホートで病気を引き起こす可能性のある突然変異が検出された後、血液型遺伝子ABO(rs505922)の遺伝子変異と脳卒中の関連が確認された。
他にも脳卒中のサブタイプに特異的な遺伝子変異が確認されている。アイスランドの研究者は、心房細動のリスクを高める遺伝子変異と虚血性脳卒中、特に心臓塞栓症と考えられる脳卒中との関連を初めて報告した。興味深いことに、心房細動の診断が不十分であったためか、非心原性と分類された事象にも有意な関連が見られた。その後、メタストロークと他のいくつかのコホートとの共同解析では、PITX2遺伝子とZFHX3遺伝子も心塞栓症性脳卒中と関連し、HDAC9遺伝子と9p21遺伝子座は大血管性脳卒中と関連した。米国国立神経疾患・脳卒中研究所(NINDS)-脳卒中遺伝学ネットワーク(SiGN)プロジェクトによる別のゲノムワイド関連解析では、第1染色体のTSPAN2遺伝子近傍の遺伝子座も大動脈性脳卒中と関連していた212。例えば、PITX2は、洞房結節の形成や心臓伝導を調節するイオンチャネルの制御に関与する転写活性化因子をコードしており、ZFHX3も転写因子をコードしている。HDAC9遺伝子は、ヒストン脱アセチル化酵素をコードしているが、動脈硬化性脳卒中の原因となるメカニズムは不明である。TSPAN2は、シグナル伝達を制御し、細胞の発生と成長に役割を果たす膜貫通タンパク質のスーパーファミリーの一員であるテトラスパニン-2をコードしている。TSPAN2は動脈組織と血液細胞に発現しており、TSPAN2ノックアウトマウスではミクログリアとアストロサイトが活性化している。
ゲノムワイド関連解析の別のメタアナリシスでは、18の人口ベースのコホート、約85,000人の参加者(脳卒中患者数4348人)を対象に、第6p25染色体上のフォークヘッド転写因子FOXF2遺伝子の近傍にある新規遺伝子座(rS12204590)が同定された。この遺伝子座は、すべての脳卒中のリスクと、サブコホート(n=21,079人)では小血管疾患のマーカーであるMRIスキャンで見られる白質の高輝度負荷の両方と関連していたという。 また、他のフォークヘッド転写因子(FOXC1)の変異も白質疾患症候群と関連している。マウスを用いた機能実験では、Foxf2の欠失が脳梗塞、反応性グリオシス、微小出血と関連することが確認された。さらに、ゼブラフィッシュのFOXF2のオルソログは、脳の周皮細胞に発現しており、この遺伝子を持たないゼブラフィッシュは、脳血管の平滑筋細胞や周皮細胞の被覆に異常が見られる。これらのデータは、脳血管壁の形態形成や機能に関与する転写因子であるFOXF2が、ヒトにおいても小血管疾患の一因となっている可能性を示唆している。
これまでの研究の多くは、一般的な遺伝子の変異に焦点を当ててた。215 例えば、GUCY1A3は、早期心筋梗塞との関連が指摘されている遺伝子であるが、大血管性脳卒中との関連が認められ、リードする一塩基多型(SNP)のアリル頻度は1.5%であった。この遺伝子は、可溶性グアニルシクラーゼのα1サブユニットをコードしており、一酸化窒素による血管拡張と血小板抑制の両方に関与している。216 また、GCH1という遺伝子も、わずか1.5%の対立頻度で、小血管の脳卒中と関連していた。GCH1は、GTPシクロハイドロラーゼ1をコードしており、内皮の一酸化窒素合成酵素に関与している。GCH1はGTPシクロハイドロラーゼ1をコードしており、内皮の一酸化窒素合成酵素に関与している。
217 南ドイツ、英国、欧州、北米の大規模サンプルにおいて、この領域の15個のSNPが評価され、6個のSNPが調整後の解析で動脈硬化性または大血管性の脳卒中と関連していた。この解析から、9p21のSNPによる大血管性脳卒中の集団帰属リスクは20%と推定された218。
脳卒中の予防
脳卒中予防の目的は、集団、地域、個人レベルで採用される単一の危険因子、または複数の危険因子の集合体を標的として修正することにより、脳卒中の発生率を低下させることである。しかし、抗血小板剤の使用のように、特定の危険因子の治療としてではなく、虚血性脳卒中のリスクが高いと考えられる人々の間で、脳卒中のリスクを減少させることが知られている介入策を使用することが目的となる場合もある。脳卒中の予防には、大きく分けて3つのレベルがある。1) 原初的予防は、最も一般化されたものであり、集団レベルで適用された場合、生理学的な脳卒中危険因子の集団発生率を減少させることを目的とした健康的な生活手段を広く扱うものである。2) 一次予防は、脳卒中やTIAの既往歴のない個人の危険因子プロファイルを改善し、最初の脳血管イベントを予防することを目的としたものである。220 (図2) 脳卒中の一次予防の例としては、禁煙、健康的な食事、運動量の増加、体重管理などの取り組みが挙げられる。脳卒中の一次予防と二次予防は、高血圧や糖尿病など、生活習慣や医学的な脳卒中の危険因子を対象としている。ここでは、虚血性脳卒中の一次予防と二次予防に焦点を当てて説明する。
図2 集団における脳卒中予防のレベル
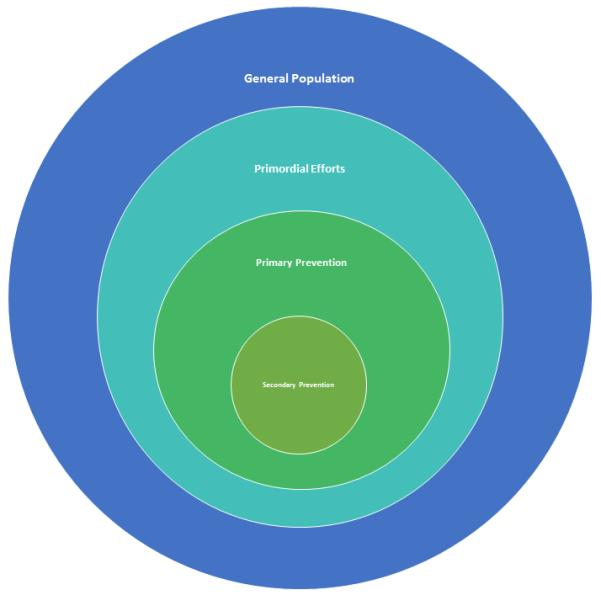
マス・アプローチ
生涯にわたる心血管疾患リスク低減の基礎となるのは、行動の修正である。219, 221 行動修正を目的とした予防活動は、公衆衛生キャンペーンのような大衆的な介入に特に適している。219, 221 行動修正を目的とした予防活動は、公衆衛生キャンペーンのような大規模な介入に特に適している。直接的な結果は脳卒中という結果からは離れているが、このようなキャンペーンは、脳卒中、冠動脈疾患、心不全、糖尿病、認知症などを含む複数の結果に影響を与える可能性がある。
最近、より具体的な形での集団ベースの心血管予防が提案されている。ポリピル(配合剤)である。これは大規模な一次予防の取り組みの一例である。224 健康な成人を対象とした第2相二重盲検無作為化対照臨床試験において、ポリピルは、単剤療法と比較して、忍容性を高めることなく、血圧、LDL、心拍数、尿中トロンボキサンB2濃度(抗血小板効果)に好影響を与えることが示された。225 脳卒中の発症率はベースラインに関わらず血圧と直線的な相関があることから、このような標準化された方法は正当化される。226 治療前の血清検査や医療フォローアップを簡素化し、副作用を抑え、最終的には関連コストを削減するために、ミニポリピルは地域の心血管疾患予防のためのより洗練された標準化された方法として最近注目されている。カンデサルタン(アンジオテンシン受容体拮抗薬)ヒドロクロロチアジド(サイアザイド系利尿薬)低用量のロスバスタチンを配合した製剤が積極的に研究されている。大量一次予防に対するこのアプローチの最も強力なエビデンスは、Heart Outcomes Prevention Evaluation(HOPE)-3試験から得られた。この試験は、2×2階調デザインの二重盲検プラセボ対照試験で、心血管疾患の既往歴はないが心血管疾患のリスクが中程度の12,705人の参加者を、ロスバスタチン10mg+プラセボ、ロスバスタチン10mg+カンデサルタンとHCTZ(ポリピル)カンデサルタンとHCTZ+プラセボ、または二重プラセボのいずれかに割り付けた。227-230 ロースバスタチンと2種類の降圧剤を投与した併用療法とプラセボの比較を報告した解析では、有効群3,180名に対し、対照群3,168名が参加した。投与群では、複合的な心血管アウトカムの絶対リスクが1.4%減少し(ハザード比[HR]、71%、95%CI 0.56-0.90)その半分は脳卒中の発症率の低下によるものであった。本試験で使用されたポリピルは、筋力低下とめまいの増加を除き、忍容性が高く、プラセボと同等の遵守率を示し、心血管疾患による入院も少なかった。本研究は、標準的な標的薬物療法の組み合わせと最小限の治療前スクリーニングによる一次予防治療のマス・アプローチの有効性を検証した初めての研究である。このような取り組みは、個別の一次予防の取り組みに疎い中・高リスク者の転帰を減らすには、集団的なアプローチが有効であるという考え方に基づいている。この方法の欠点は、低リスクの人たちも治療の副作用にさらされ、リスクとベネフィットの比率が歪んでしまうことである。このように、ポリピルのアプローチが心血管アウトカムの予防に有効であるというエビデンスがあるにもかかわらず、このような取り組みをどこでどのように臨床現場に反映させればよいのかがはっきりしていない。特に米国では、医療へのアクセスにばらつきがあるものの、世界標準と比較して比較的高い水準にあるため、このような状況になっている。
対象となる生活習慣の改善
身体活動
従来、運動強度の標準的な定義がなく、運動習慣にもばらつきがあることに加え、運動量の測定が難しく、効果を確認するのに必要な時間が長いことが、脳卒中の転帰に対する運動の効果を研究することを困難にしていた。現在、エネルギー消費量をメタボリック・イコール(METs)で報告することが標準となっている。このモデルを使用すると、身体活動は、1~1.5メッツの間は座りがち、1.6~2.9メッツの間は軽度、3~5.9メッツの間は中等度(例:バレエダンス)6メッツを超えると活発(例:屋外でのサイクリング)と分類される。 231 生物学的な妥当性と、大規模な前向きコホート研究およびレトロスペクティブケースコントロール研究のプール分析による証拠に基づき、身体運動と脳卒中の間には生涯にわたる逆相関関係があることが一般的に認められている223。232 運動不足の人(600メッツ分/週未満)と比較して、運動量の多い人(8,000メッツ分/週以上、または、1日2時間程度の活発な活動)は、脳卒中のリスクが25~30%低いと推定されている223, 233。234 現時点では、個人のライフスタイルのニーズや好みに合わせて調整できる、一般的に認められた有用な脳卒中一次予防のための推奨事項は、AHA/ACCの心血管疾患予防ガイドラインで、週に3~4日、1日あたり少なくとも40分間の中強度から高強度の運動を行うことである。
図3 心血管の健康増進のための健康的なライフスタイル関連の実践法
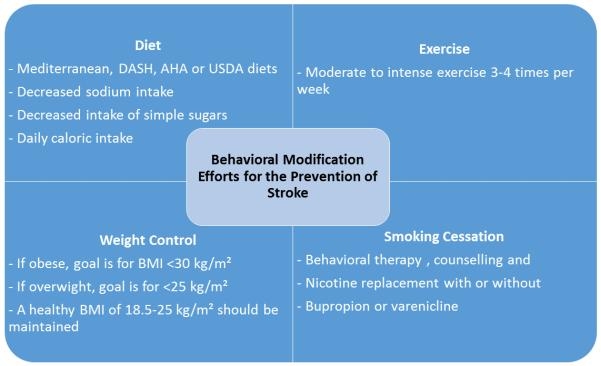
DASH: Dietary Approaches to Stop Hypertension; AHA: 米国心臓協会; USDA: 米国農務省122, 123
ダイエット
236 地中海式ダイエット、DASH(Dietary Approaches to Stop Hypertension)ダイエット、AHA(American Heart Association)ダイエット、米国農務省(USDA)フードパターンダイエットは、植物由来の微量栄養素と多量栄養素の組み合わせ、飽和脂肪とトランス脂肪に関連するカロリー摂取量の減少、果物と野菜の摂取量の増加、塩分摂取量の減少を促進するという点で共通している237。Nurses’ Health Studyは、71,768人の参加者を対象とした前向きコホートで、1984年から 1998年までの食事パターンを追跡調査した。237 Nurses’ Health Studyは、1984年から 1998年にかけて、71,768人の参加者を対象にした前向きコホートで、飽和脂肪、加工穀物、単糖類を多く含む「欧米型の食事」が脳卒中の発症率の増加と関連することを初めて示した(RR 1.58,95% CI 1.15-2.15,p < 0. 001)一方、果物と野菜、全粒穀物、豆類、魚類を多く含む「慎重な食事」の遵守は、極端な五分位を比較した場合、脳卒中の発症率の低下と関連していた(RR 0.78,95% CI 0.61-1.01)238 食事が心血管イベントを減少させることを支持する最も強力な証拠は、おそらく地中海式食事である。地中海食は、野菜、果物、豆類の摂取量が多く、主な脂肪源としてオリーブオイルを使用し、赤身の肉よりも魚や鶏肉を優先的に摂取し、乳製品の摂取量が少なく、赤ワインの摂取量を少なくするオプションがあることで定義されている240。心血管アウトカムに対する地中海食の効果を比較した多施設共同無作為化試験であるPREDIMED(Primary Prevention of Cardiovascular Disease with a Mediterranean Diet)試験では、オリーブオイルを多く含む地中海食は、標準的な低脂肪食と比較して、脳卒中の発症率が約30%(95%CI 0.46-0.98,P<0.04)減少し、ミックスナッツを多く含む地中海食は、約50%(95%CI 0.35-0.84,P<0.006)減少することがわかった241。地中海食と同様に、あるメタアナリシスでは、DASH食が脳卒中のリスクを20%近く低下させることが示されている(95% CI 0.72, 0.92)242。一般的に、心血管の健康と脳卒中の一次予防を目的とした食事としては、地中海食、DASH食、USDAフードパターン、AHA食など、植物性栄養素の大量摂取、減塩、飽和脂肪と単純糖質の抑制を中心とした食事が推奨される。また、これらの食事を補うために、週6回、30gのミックスナッツを摂取することで、ミックスナッツの摂取量を増やすことが妥当であると考えられる。241
禁煙
243 米国公衆衛生局のClinical Practice Guidelines Executive Summaryでは、医師による喫煙者のスクリーニング、カウンセリング、更なる行動支援への紹介を推奨しており、また、医学的に禁忌でない限り、禁煙を目指す人にはニコチン置換製品であるブプロピオンやバレニクリンを定期的に使用することを推奨している。治療の効果はリスクをはるかに上回ると思われるが、FDAは、バレニクリンを投与された患者において、プラセボと比較して脳卒中を含む心血管イベントのリスクが増加することを示唆する3つのシステマティックレビューに基づき、バレニクリンを投与された患者の慎重なモニタリングを推奨している。心血管疾患の予防を目的とした場合、行動療法、ニコチン置換療法、および/またはブプロピオンとバレニクリンを組み合わせて使用することは合理的であり、バレニクリンを使用している高リスクの患者を注意深くモニタリングする必要がある245。
目標とするリスクファクターの修正
高血圧症
血管疾患や脳卒中の既往のない 464,000 人の参加者を含む 147 の試験のメタアナリシスによると、 収縮期血圧を 10mmHg、拡張期血圧を 5mmHg 低下させると、脳卒中のリスクが 40%減少することがわかった。60 この効果は、正常血圧と考えられているレベルよりも低く、収縮期110mmHg、拡張期60mmHgまででも現れる。226, 246 アメリカの黒人には高血圧と糖尿病が不相応に多いことが、脳卒中の発症率を高める大きな要因となっていると考えられる。61 β遮断薬、チアジド系利尿薬、アンジオテンシン変換酵素阻害薬、アンジオテンシン受容体拮抗薬、カルシウム拮抗薬が最も広く研究されている薬剤であり、いくつかのクラスの違いはあるものの、有益性の大部分は使用されている薬剤のクラスではなく、血圧コントロールのレベルによってもたらされている。
AHA/ACC ガイドラインでは、収縮期血圧が 120~139mmHg または拡張期血圧が 80~89mmHg と定義される高血圧予備力の患者に対して、定期的な血圧スクリーニングと生活習慣の改善を推奨している。248 高血圧患者において、脳卒中の一次予防を目的とした血圧の目標値は、一般的に第 8 回米国合同委員会(JNC8)の血圧管理に関するガイドラインの推奨事項を参考にすることができる。60歳未満で、収縮期血圧140mmHg以上、拡張期血圧90mmHg以上と定義される高血圧症の人には、内科的治療が適応される。しかし、50歳以上で収縮期血圧が130mmHg以上の9,361人を対象とした最近の大規模な無作為化比較試験では、年齢による推奨値の違いが指摘されている。収縮期血圧120mmHg未満を目標とした集中治療は、140mmHg未満を目標とした標準治療と比較して、複合的な心血管アウトカムのリスクを減少させ(HR 0.75,95%CI 0.64-0.89,p<0.001)脳卒中のリスクを減少させる傾向を示した(HR 0.89,95%CI 0.63-1.25)。250 脳卒中の一次予防のためには、生活習慣の改善と薬物療法を組み合わせて、140/90mmHg未満の厳格な血圧目標を達成する必要がある。脳卒中予防への効果はまだ証明されていないが、降圧療法による合併症のリスクが低い人では、収縮期血圧の目標を120mmHg未満とすることが妥当かもしれない。また、治療効果をより正確に把握し、副作用を抑制し、血圧コントロールを最適化するために、自己測定式の血圧測定器が推奨されている248。
糖尿病
糖尿病患者の高血糖を積極的に管理しても、脳卒中の発症率を低下させることは示されておらず、むしろ有害である可能性がある。Action to Control Cardiovascular Risk in Diabetes Study (ACCORD)では、糖化ヘモグロビン(HgbA1C)の目標値を6%以下にする集中的な糖化療法と、7~7.9%の自由化された目標値を比較し、脳卒中の発症率には差がなかったが、集中管理群では全死亡率が統計学的に有意に増加した。この結果は、高血糖が脳卒中リスクに及ぼす最大の影響は、併存する心血管危険因子が存在しやすい疾患の後期ではなく、疾患の初期および糖尿病予備力の段階で蓄積されるという可能性を示唆している。この考えは、糖尿病予備力の脳卒中・TIA後にピオグリタゾンを使用した最近の無作為化比較試験で支持されている。251 この試験では、最近の脳卒中またはTIA後の3,876人が登録され、糖尿病予備力でもあった。脳卒中と心筋梗塞の再発という複合転帰は、約5年間のフォローアップ期間中、ピオグリタゾン群で9.0%、プラセボ群で11.8%に認められた(HR 0.76,95%CI 0.62-0.93)。重要なことは、糖尿病の発症率が52%減少したことである。残念ながら、ピオグリタゾンによる治療では、体重増加、浮腫、骨折の頻度が高くなり、実用性が制限された。米国糖尿病協会の2016年の勧告では、糖尿病の心血管合併症を予防する目的で、HgbA1Cの目標値を7%未満にすることが求められている。252 現時点では、糖尿病予備力が存在する場合、集中的な生活習慣への介入が必要であるが、特定の個人に対しては、例えばメトホルミンを用いた標的医療薬理療法が最適である可能性がある253。
高脂血症
コレステロールの低下、特にHMG-CoA還元酵素阻害剤(スタチン)の役割は、いくつかの観察研究や臨床試験で証明されている。35万人以上の男性を対象としたMRFIT(Multiple Risk Factor Intervention Trial)などの大規模な疫学研究では、コレステロール値の上昇と脳卒中死亡率の間に正の相関があることが示されている。脳卒中の一次予防試験において、いくつかのスタチン系薬剤は、脳卒中のリスクを11〜40%減少させることがわかっている。Heart Protection Study(HPS)は、冠動脈疾患、末梢血管疾患、糖尿病のいずれかを有する20,536人を対象としたシンバスタチン療法の多施設共同無作為化プラセボ対照試験で、プラセボと比較してシンバスタチン群で5年間の脳卒中リスクが25%減少したことが示された(p<0.0001)。重要なことは、これらの効果はLDLが100mg/dL未満の人にも残っていたことである。より積極的な治療を行うことで、さらにリスクが減少した。Treating to New Targets(TNT)試験では、アトルバスタチン10mg/日とアトルバスタチン80mg/日を比較して、脳卒中リスクが25%減少し、LDL値の低下と相関していた。さらに、脂質治療と脳卒中に関するメタアナリシスでは、LDLコレステロールが1mmol/L減少するごとに、虚血性脳卒中の相対リスクが約20%減少することが示された。255, 256
脳卒中予防におけるスタチン療法の役割は、二次予防の研究でも明らかになっている。HPSの事後解析では、脳血管疾患の既往があり冠動脈疾患を持たない患者(n=3280)において、シンバスタチンはプラセボと比較して主要な心血管イベントまたは死亡のリスクを5%減少させることが示された。 257 しかし、SPARCL(Stroke Prevention by Aggressive Reduction in Cholesterol Levels)試験は、脳卒中患者におけるスタチンの役割に関して最も直接的な証拠を提供している。SPARCL試験は、脳卒中またはTIAを発症し、ベースラインのLDL値が100〜190mg/dLの患者(n=4731)を対象に、脳卒中発症から1〜6ヵ月後にアトルバスタチン80mgとプラセボに無作為に割り付けた。アトルバスタチンは、中央値で5年間の追跡期間において、脳卒中の再発リスクを約2%絶対的に減少させ(13.1%対11.2%)相対的リスクを16%減少させた。258 リスク減少に関するスタチンの効果は、脳卒中の指標となるサブタイプにも同様に見られ、サブタイプにかかわらず、すべての虚血性脳卒中患者がスタチン治療を受けるべきであることを示唆している。アトルバスタチン投与群では、出血性脳卒中のリスクがプラセボ投与群(1.4%、ハザード比1.66,95%CI 1.08〜2.55)に比べて0.9%増加(5年後には2.3%)したが、この有害な効果は、発生頻度の高い虚血性脳卒中への効果が上回っており、脳卒中全体の予防にはアトルバスタチンが有利となった(アトルバスタチン投与群11.2%、プラセボ投与群13.1%)。
SPARCLは、脳卒中の二次予防における高用量スタチン療法の有用性を証明した最初の臨床試験であるが、その効果は、5年間の治療必要数が50人と控えめなものであった。さらに、いくつかの制限があった。例えば、無作為化の対象となった患者は、脳卒中の1ヵ月後からであったが、この時期は脳卒中の再発リスクが低下する時期であり、特にスタチンが脳卒中予防に最も効果的であると考えられる大動脈の動脈硬化を有する患者では、この時期に無作為化が行われた。現在進行中の試験では、脳卒中直後にスタチンを投与することで、脂質レベルを低下させて脳卒中の再発を予防するだけでなく、脳卒中に関連する脳障害を改善することも検討されている。例えば、Neuroprotection with Statin Therapy for Acute Recovery(NeuSTART)試験は、急性虚血性脳卒中患者を対象に、ロバスタチン640mgを1日3日間、プラセボと無作為に比較する第2相試験であり、梗塞サイズを縮小し、脳卒中の回復を促進するロバスタチンの安全性と有効性を検討しているが、これはスタチンのプレオトロピック効果の機能である可能性がある260。
スタチンの主な効果はLDL値の低下であるが、それ以外にも内皮機能を改善し、炎症を抑制する可能性があることが示されている。LDL値が正常で、hsCRP値が軽度上昇している健康な人を対象に、高用量のロスバスタチンまたはプラセボを投与したある大規模試験では、2年間の追跡調査の結果、脳卒中の発症率が治療群でプラセボ群に比べて48%低下した(絶対的リスクの低下は0.16%)261。他の心血管アウトカムのリスクがさらに減少したことは、hsCRP値が上昇しているが脂質値が正常な患者の一次予防にロスバスタチンを使用する根拠となり得る。さらに、リスクの絶対的な減少は、hsCRP値が最も高い患者で最も大きく、これらの患者は全体的に心血管イベントのリスクが高いことを反映していた。
抗血小板療法
脳卒中の二次予防では、脳卒中の再発予防に抗血小板療法が有効であることが多くのエビデンスによって裏付けられているが、脳卒中一次予防のみを目的とした抗血小板療法の使用を推奨するエビデンスはほとんどない。2009年にAntithrombotic Trialists’ Collaborationが行った、660,000人年に貢献した95,000人を対象とした6つの一次予防試験における血管イベントのメタアナリシスでは、脳卒中発症に対するアスピリンの全体的な効果は見られなかった(年間0.20% vs 0.21%、p=0.4)262。彼らは、50~59歳の高リスク者にのみ、心血管疾患一次予防のためのアスピリン使用を推奨している。例えば、CHARISMA(Clopidogrel and Aspirin versus Aspirin Alone for the Prevention of Atherothrombotic Events)試験では、心血管疾患または複数の危険因子を持つ15,603人の患者が、アスピリン75〜162mg/日の単独投与またはクロピドグレル75mg/日との併用投与に無作為に割り付けられ、28ヵ月間追跡された。主要評価項目は,心筋梗塞,脳卒中,血管死の複合病変とした。二重抗血小板剤投与群(6.8%)とアスピリン単独投与群(7.3%、p=0.22)との間に転帰の統計的な差はなかった。しかし、出血のリスクは抗血小板剤併用群で高かった。
心房細動と心不全
ビタミンK拮抗薬(VKA)であるワルファリンは、非弁膜症性心房細動患者の脳卒中の一次予防と二次予防の両方において、長年にわたり標準的な治療法とされてきた。一次予防では、AFASAK試験は、慢性心房細動患者において、ワルファリンとアスピリンまたはプラセボを比較した最初の試験であり、ワルファリンによる脳卒中リスクの有意な減少が示された265。脳卒中の既往のない患者を対象に、ワルファリン、アスピリン、プラセボを比較した二重盲検プラセボ対照試験であるStroke Prevention in Atrial Fibrillation Study(SPAF)でも、ワルファリンの有意な効果が認められ、プラセボと比較して相対リスクが76%減少(絶対リスクは5.1%減少)した。 266 また、ワルファリンとアスピリンを比較した場合、プラセボと比較して少ないながらも脳卒中の発症リスクが減少した。
これらの試験以降、血栓塞栓症の予防には、2つの異なるクラスの新規抗凝固剤が追加された。267-270 102,607人の患者を対象としたメタアナリシスでは、これらの新薬とワルファリンの間で大出血の発生率が比較された。新薬群は、消化管出血のリスクには差がなく、ICH(RR 0.53,p<0.01)を含む大出血のリスク(RR 0.72,p<0.01)が低かった。ICHの発生率は、新規薬剤群で0.51%、ワルファリン群で1.08%であった271。
臨床的な意思決定を支援するために、CHADS2や新しいCHA2DS2-VAScスコアなどの有効な心房細動スコアリングシステムを用いて、基礎心房による虚血性脳卒中発症率を概算することができる272, 273。(272 使用するスコアリングシステムによっては、多くの併存疾患が脳卒中リスクの追加予測因子となる(表4および表5)5)。どちらのスコアリングシステムでも、スコアが2以上の人には一般的に抗凝固療法が推奨される。
表4 心房細動の一般的なリスク層別化法
| CHADS 2つのアイテム | ポイント | CHA 2 DS 2 -VAScアイテム | ポイント |
|---|---|---|---|
| C =うっ血性心不全 | 1 | C =うっ血性心不全 | 1 |
| H =高血圧 | 1 | H =高血圧 | 1 |
| A = 75歳以上の年齢 | 1 | A 2 = 75歳以上の年齢(2倍の値) | 2 |
| D =糖尿病 | 1 | D =糖尿病 | 1 |
| S 2 =脳卒中、TIA、または 血栓塞栓症の病歴(2倍の 値) |
2 | S 2 =脳卒中、TIA、または 血栓塞栓症の病歴(2倍の値) |
2 |
| V =血管疾患(MI以前、 末梢動脈疾患、大動脈 プラーク) |
1 | ||
| A = 65〜74歳 | 1 | ||
| Sc =性別カテゴリー(女性の性別) | 1 | ||
| 範囲 | 0-6 | 0-9 | |
| 最大 | 6 | 9 |
表5 心房細動患者のためのガイドラインに基づく、一般的に使用されているリスク予測スキーム、年間脳卒中リスク、および抗血栓療法の推奨事項
| CHADS 2スコア | 脳卒中リスク (%/年) |
CHA 2 DS 2 -VASc スコア |
脳卒中リスク (%/年) |
CHA 2 DS 2 -VAScに基づく推奨される 抗血栓 治療(推奨のクラス、エビデンスのレベル) |
|---|---|---|---|---|
| 0 | 1.9 | 0 | 0 | なし(IIb、B) |
| 1 | 2.8 | 1 | 1.3 | なし、アスピリン、または 抗凝固剤(IIb、C) |
| 2 | 4.0 4.0 | 2 | 2.2 | 抗凝固剤(I、 A [ワルファリン]、 B [ダビガトラン、 リバロキサバン、アピキサバン] |
| 3 | 5.9 | 3 | 3.2 | |
| 4 | 8.5 | 4 | 4.0 4.0 | |
| 5 | 12.5 | 5 | 6.7 | |
| 6 | 18.2 | 6 | 9.8 | |
| 7 | 9.6 | |||
| 8 | 6.7 | |||
| 9 | 15.2 |
心房細動患者に対する抗凝固療法の新たな選択肢として、 左心房付属器閉鎖術がある。非リウマチ性心房細動患者では血栓塞栓物質の90%が心房付属器から発生すると推定されているため、274 心房付属器を閉鎖することが心房細動関連の血栓塞栓症を予防する方法として理論化された。心房虫垂を閉鎖し、機能的に廃止する方法としては、外科的結紮術と、ウォッチマンやアンプラッツァーなどの経大動脈デバイスを用いた経大動脈カテーテルアプローチの2つがある。しかし、一部の患者では、デバイスの播種が不十分で、より長期の抗凝固療法が必要とされる場合もある。PROTECT-AF(Watchman Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation)試験とPREVAIL(Prospective Randomized Evaluation of the Watchman Left Atrial Appendage Closure device in patients with atrial Fibrillation vs. long-term warfarin therapy)試験の2つの無作為化比較試験で、非弁膜症患者においてウォッチマン装置とワルファリンを比較した。両試験とも、ウォッチマンは虚血性脳卒中の予防において非劣性を示した。277,278 心嚢液貯留、術後脳卒中、デバイスの塞栓が主な合併症であった。これらの2つの研究に基づき、ウォッチマンは、a) 非弁膜症性心房細動、b) 脳卒中のリスクが高い、c) ワルファリンの適応があり、かつ、ワルファリンを服用する可能性がある、d) 抗凝固療法に代わる非薬物療法を求める理由がある、といった患者への使用がFDAにより承認された279。
Warfarin and Aspirin in Patients with Heart Failure and Sinus Rhythm(WARCEF)試験では、うっ血性心不全で駆出率(EF)が35%未満の患者を対象に、虚血性脳卒中、脳内出血、死亡の予防に対するワルファリンによる抗凝固療法の役割を、アスピリンと比較して評価した280。複合転帰には差がなかったが(26.4%対27.5%、HR 0.93,95%CI 0.79-1.10,p=0.4)虚血性脳卒中は減少したが(2.5%対4.7%、HR 0.52,95%CI 0.33-0.82,p=0.005)ICHの増加はなかった。さらに治療期間を考慮すると、追跡期間4年目まではアスピリンよりもワルファリンの方がわずかに有益であったが、ワルファリンでは消化管出血を中心とした大規模な全身性出血の発生率が高かったという。本研究では、抗凝固療法による虚血性脳卒中のリスク低下は、大出血のリスク上昇によって相殺されると結論づけている。281 3,663人の患者を対象としたメタアナリシスによると、このサブグループの患者に抗凝固療法の使用を推奨する明確なエビデンスは現時点ではない。
頭蓋外および頭蓋内アテローム性動脈硬化症
予防可能な脳梗塞のもう一つの主要な原因は、大血管の動脈硬化性疾患、特に内頸動脈の狭窄である。頸動脈の狭窄度が60%以上で周術期のリスクが低い無症候性(狭窄している側で最近の脳卒中やTIAの既往がない)の男性では、頸動脈内膜切除術(CEA)が有効であることが示された。女性や周術期リスクが3%以上の人には明確なメリットはない。283,284 狭窄度50%以下の無症候性患者にはCEAのメリットはない。
70%以上の症候性頭蓋外頸動脈狭窄を有する患者(すなわち、脳卒中またはTIAを有し、症候性側に狭窄がある患者)に対して、CEAは脳卒中のリスクを相対的に50%減少させ、2年間で約13%の絶対的なリスク減少をもたらすというエビデンスがある。287 しかし、外科的血行再建術の有用性を示した研究は、10〜25年前に行われたものである。動脈硬化性疾患に対するより積極的な内科的アプローチ、特にスタチンの登場以来、動脈硬化性頸動脈疾患の内科的治療を受けている患者の脳卒中発症率には時間的変化がみられた。医学的治療を受けた患者の脳卒中率は 2000年以降に募集を完了した研究(年間1.13%)の方が、それ以前に募集を完了した研究(年間2.38%、P < 0.001)よりも有意に低かった288。
289.無症候性頭蓋内狭窄症の患者では、ステント留置術や血管形成術が有益であるという証拠はない。289 無症候性頭蓋内狭窄症の患者では、ステント留置術や血管形成術の有益性を示す証拠はない。症候性頭蓋内狭窄症の患者でも、最近の試験では50%以上の狭窄の頭蓋内動脈をステント留置することの有益性を示す証拠はない。Comparison of Warfarin and Aspirin for Symptomatic Intracranial Stenosis(WASID)試験は、50〜99%の症候性頭蓋内狭窄を有する患者を対象に、アスピリンとワルファリンの比較を行った。この試験は、ワルファリン投与群で有害事象が多発したため、早期に中止された。その結果、ワルファリンはアスピリンに比べて有益ではなく、この患者群では有害である可能性もあるという結論に達した。続いて行われたSAMMPRIS(Stenting Versus Aggressive Medical Management of Intracranial Atherosclerotic Stenosis)試験では、症状のある高グレードの頭蓋内狭窄(70%以上)を有する患者が登録され、経皮的ステント留置術と、3ヵ月間の積極的なリスクファクターコントロールと二重抗血小板療法を行う最善の医学的管理とが比較された290。291 興味深いことに、内科的治療群では、これまでの研究で予測されていたよりも脳卒中の再発が少なかった。この結果から、特に高グレードの頭蓋内狭窄に対しては、上述の頭蓋外疾患で見られたように、現在利用可能な技術を用いて、積極的な内科的治療が介入よりも優れていることが示唆された。
結論
近年、脳卒中の危険因子と予防についての理解が飛躍的に進んだ。脳卒中の危険因子に関する研究では、出血性脳卒中と虚血性脳卒中だけでなく、脳卒中のいくつかの病因を含む異質な脳卒中のサブタイプを扱うことが多くなった。その結果、脂質が動脈硬化性脳卒中の危険因子であることや、心房細動やそれに関連する心房性心疾患が心塞栓性脳卒中と関連することが確認されている。遺伝学的解析は、特に脳卒中の特定のカテゴリーに重点を置いて行われてきた。特定の遺伝子の変異は、大血管、心臓塞栓症、小血管の脳卒中のサブタイプと関連し、再現されている。また、遺伝子の研究は、脳卒中の病因を解明するための新たな道を示唆している。これらの研究は、将来、精密医療によって、臨床医が脳血管疾患の治療に焦点を当てることができるようになることを示唆している。一方、いくつかの大規模な臨床試験では、脳卒中のリスクを減らすために、いくつかの医学的および行動的な治療が有効であることが証明されている。血圧降下、スタチン治療、抗血小板剤、抗凝固剤、頸動脈血行再建術、食生活の改善など、すべての治療法が様々な患者層で脳卒中リスクを減少させることが証明されている。同様に重要なことは、狭窄した頭蓋内血管へのステント留置などの一部の治療法は、まだ有益性が証明されていないことである。観察研究では、禁煙や定期的な身体活動など、他の行動的アプローチについても強力なエビデンスが得られている。ポリピルのような治療法を用いたマス・アプローチ、プライマリー・ケアでのリスク推定の活用、脳卒中発症後のハイリスク区間に焦点を当てるなど、一般的な予防への代替アプローチの検討も、脳卒中予防の将来を劇的に変える可能性がある。
