Contents
Gut Microbiota Status in COVID-19: An Unrecognized Player?
www.ncbi.nlm.nih.gov/pmc/articles/PMC7725702/
オンラインで公開2020年11月26日
要旨
SARS-CoV-2 ウイルスへの感染は、心肺および血管の合併症を引き起こし、その重症度は様々である。SARS-CoV2ウイルスの感染および進行の病原メカニズムを理解することは、その予防および/または治療のための新しいターゲットを提供する可能性がある。ウイルス微生物相の相互作用は、様々なウイルス感染症において研究されてきた。例えば、コロナウイルス粒子の完全性は、インフルエンザAを含む他のウイルスを標的とする細菌表面分子であるサーファクチンによって破壊される可能性がある。
このような観点から、腸内細菌叢はCOVID-19の病原性に影響を与える可能性があり、一方、SARS-CoV-2は腸内細菌叢に影響を与え、腸内細菌叢の異常や他の有害な結果を促進する可能性がある。したがって、SARS-CoV-2感染時の腸内細菌叢の健康状態とその変化は、COVID-19に対する個人の感受性と耐性を決定する上で重要な役割を果たしていると考えられる。
実際、COVID-19の最悪の臨床症状や致死率の大部分は、加齢や1つ以上の併存疾患の存在などの特定の危険因子を持つ対象者で発症している。さらに、これらの併存疾患は、「ポリファーマシー」として知られる複雑な薬理学的レジメンを必要とし、マイクロバイオームの完全性にさらに影響を与え、ウイルス感染に対する耐性を悪化させる可能性がある。このような複雑な状況は、高齢者および併存者のCOVID-19の臨床的負担に関して、さらなる過小評価されたリスクを表している可能性がある。
ここでは、COVID-19における腸内細菌叢の生物学的、生理学的、臨床的意味合いと、COVID-19の病原性と社会衛生的負担を軽減するためのシンプルで補助的な戦略として、腸内細菌叢の健全な状態を改善・維持するための戦略について議論する。
キーワード
SARS-CoV-2,COVID-19,マイクロバイオータとウイルスの相互作用、ポリファーマシー、マイクロバイオータの操作、予防的治療戦略、腸内マイクロバイオータ、腸-肺軸
序論
SARS-CoV-2は 2019年11月に中国の湖北省で初めて報告され、世界で急速に広がっている(Heymann and Shindo, 2020)SARS-CoVに類似した新規なRNAベータコロナウイルス属(Corman et al 2020; Zhu et al 2020)である。CoronaVIrus Disease 19(COVID-19)と呼ばれるこの大パンデミック性疾患は、良性から致死的なものまで、非常に変化に富んだ結果を伴う異なる症状を引き起こす(Rabi and Al Zoubi, 2020)。多くの感染者は無症状のままであるか、または軽度の上気道症状のみを示すが、他の感染者は肺炎および集中治療室(ICU)での挿管を必要とする急性呼吸窮迫症候群(ARDS)を発症し、致命的になり得る合併症を受ける可能性がある(Chen et al 2020)。COVID-19では、肺炎の発生は、無症状または軽症の症例と中等症または重症の症例を識別する重要なイベントである。肺炎を含むか否かの呼吸器系の問題と並んで、SARS-CoV-2ウイルスへの感染は、血管系の合併症、ショック、急性腎障害、および血栓塞栓性合併症を引き起こす。観察および剖検に基づくいくつかの研究では、内皮細胞への感染が血管閉塞、血管血栓症、肺水腫、内皮スロッキング、および肺灌流の異常調節をもたらすことが明らかにされている(Piva et al 2020)。低酸素血症は酸素補充に難治性であることが多く、侵襲的な機械換気と長期にわたる集中治療入院を必要とし、COVID-19パンデミアに対抗できない医療システムにとっては大きなストレスとなる。さらに、多くの機械換気患者は多臓器不全症候群を発症し、長期の入院を必要とする(Quah et al 2020)。
ウイルス攻撃に対する異なる反応は、免疫系が十分に効率的でない適応免疫系によって説明される可能性があり、または/または免疫系が反応する前に肺炎が始まる可能性がある。SARS-CoV-2に対する第一ラインの防御は自然免疫であり、その応答は適応応答とは異なり、感染後数時間以内に誘発される。疾患の自然史は、宿主の自然免疫とSARS-CoV-2との間のこの最初の相互作用、およびその後の2週間の過程での曝露、すなわち、感染が上気道で効率的に遮断されるか、または肺に到達するか、および/または腸およびその微生物相を含む他の遠位器官系に到達するかによって決定される(Raoult et al 2020)。定義された自然免疫系および適応免疫系の発達、および免疫寛容性の維持は、複雑な腸内微生物叢の獲得とともに達成される。消化管は、宿主と相互作用する複雑で多様性の高い微生物生態系を宿主とし、免疫恒常性の確立と持続を確実にする(Maslowski and Mackay, 2011; Thaiss et al 2016; Blander et al 2017)。ヒトとその腸内微生物叢は複合生物、いわゆるホロビオンを形成しており、すべてのバイオントの複合ゲノムはホロゲノームである(Postler and Ghosh, 2017)。微生物のこれらの複雑な群集は、重要なゲノムおよび酵素能力を提供し、免疫システムの誘導、発達および機能において重要な役割を果たし、それにより、病原体から保護し、無害な抗原に対する持続的な耐性を維持し、微生物相の生態を維持する。宿主免疫系と腸内マイクロバイオータの間の重要な恒常的関係は、感染症への応答を促進する細胞や組織の活性化のしきい値を較正するために極めて重要な役割を果たしている(Belkaid and Harrison, 2017)。
腸-肺軸
腸内細菌代謝異常と腸内微生物代謝物は、肺における免疫応答、炎症、および疾患発症に影響を及ぼす(図1)。まだ強調されていないが、これらの条件はCOVID-19の重症度に関して多量にカウントされる可能性がある。腸の微生物は、免疫調節および免疫グロブリンの誘導、および抗炎症効果を発揮するために血流を介して他の器官に到達することができる短鎖脂肪酸(SCFAs)などの代謝物を介して、腸から遠位の粘膜部位を調節することができる(Zhang D. et al 2020)。健康な微生物群は、インフルエンザAウイルス(IAV)(Steed and Christophi, 2017; Bradley et al 2019; Moriyama and Ichinohe, 2019)および肺炎連鎖球菌(Schuijt et al 2019)を含む呼吸器感染症に対抗することができる。2016)ヌクレオチド結合オリゴマー化ドメイン(NOD)様受容体アゴニストを介して、肺胞マクロファージおよび好中球を含むエフェクター免疫細胞の機能を調節する(Sencio et al 2020)。腸系と同様に、呼吸器マイクロバイオームは複雑であり、Bacteroidetes、Firmicutes、Proteobacteriaの各系統に属する分化した細菌群集がそれぞれのニッチに生息している。また、呼吸器マイクロバイオームは免疫において防御的な役割を果たしている(Zhang D. er al)。 インフルエンザは呼吸器細胞への病原性細菌の付着に影響を与え、生体内での感染や疾患を増加させる可能性がある(Schuijt et al 2016)ことから、腸内だけでなく、呼吸器管内でもウイルス病原体と細菌の相互作用があることが示唆されている。
図1 COVID-19の転帰に及ぼす健康な微生物群と不健康な微生物群の影響を模式的に示したもの
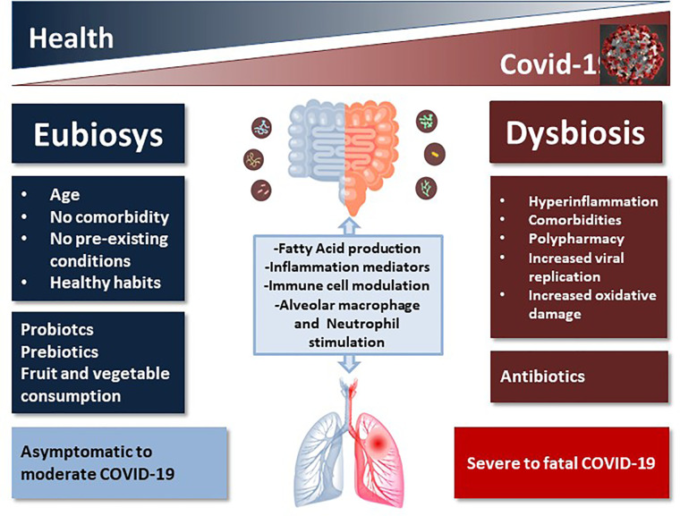
腸-肺軸を介した複雑な相互コミュニケーションは、SARS-CoV-2感染に対する気道の感受性とCOVID-19の臨床転帰を予測する上で重要である可能性があり、微生物叢の組成と豊富さの個人間変動の関数として重要である。
(Han et al 2020)は、SARS-CoV-2感染がCOVID-19合併症に寄与する肺ミクロフローラに影響を与えるかどうかを調査した。得られた結果は、SARS-CoV-2の感染が肺マイクロバイオータを深く変化させることを示している。重度の微生物叢異常はCOVID-19の被験者に認められ、Klebsiella oxytoca、乳酸菌、Faecalibacterium prausnitzii、タバコモザイクウイルス(TMV)などの病原菌が高頻度に存在していた。
肺には危険な炎症環境が認められ、Rothia mucilaginosa、TMV、SARS-CoV-2と有意な相関があった。この最初のエビデンスは、SARS-CoV-2の感染メカニズムに肺微生物叢が関与していることを示唆しており、本疾患の治療や合併症の理解に貢献する可能性がある(Han et al 2020)。
ウイルスによる呼吸器感染症の中でも上気道感染症(URTI)は非常に多い。腸内微生物叢は呼吸器の健康に影響を与え、最近の研究では、プロバイオティクスやプレバイオティクスなどの腸の健康を促進する製品がURTIへの感受性を低下させる可能性があることが示された(Donati Zeppa et al 2019)。腸内細菌叢と肺の間のクロストークは「腸-肺軸」と呼ばれ(Keely er al 2012)双方向性であるように思われる:腸内微生物代謝物は血液を介して肺に影響を与え、肺で炎症が起こると腸内細菌叢にも影響を与える(Anand and Mande, 2018;Dumas er al)。 感染、炎症、および代謝障害は、異生物学的微生物叢を用いたトランスファー実験によって実証されたように、呼吸器などの遠隔臓器においても疾患転帰を修飾しうる異生物学を引き起こす可能性があり(Sencio et al 2020年)このようにして悪循環を生じさせる。呼吸器感染症は腸内微生物叢の組成の変化と関連しており(Groves et al 2020年)このことは、新規のSARS-Cov2であっても腸内微生物叢に影響を与える可能性を示唆している。COVID-19の重篤な臨床症状の一つは肺炎とARDSへの進行であり、腸内細菌叢が重要な役割を果たしている(Dickson 2018)特に高齢で免疫不全の患者では(Lake 2020)。外表面に位置する酵素であるアンジオテンシン変換酵素2(ACE2)は、細胞内へのSARS-CoV-2の侵入およびウイルスの複製を媒介する(Xu er al)。 ACE2は、動脈および静脈内皮内膜、動脈平滑筋細胞および胆管細胞のほとんどの臓器に存在する;その発現は、腎組織、心血管系組織および消化管組織において特に高く、COVID-19が複数の臓器に関与し、肺外症状も引き起こす可能性があることを示している(Hamming et al 2004)。ACE2は、小腸腸球で高度に発現し(Zhang W. et al 2020年)腸の炎症を調節し、下痢に関与している。COVID-19は、主に呼吸器の飛沫および分泌物を介して伝播するように見えるが、COVID-19(SARS-CoV-2)の症例の10%〜20%では、消化管障害が呼吸器症状(咳、呼吸困難)と関連しているため、消化管は別の潜在的な感染経路である可能性がある。最近、COVID-19患者の便からSARS-CoV-2が検出された(Yuen et al 2020)ことから、感染には消化管が関与しているという仮説が導かれている。Kopelらは、COVID患者の約50%では、経口スワブが陰性の糞便中にもウイルスが検出されていることを報告しており、腸管内での複製があり、それゆえに活動しているだけでなく、ウイルスのより大きな永続性があるという仮説につながっている(Kopel et al 2020)。
微生物相とウイルスの相互作用
微生物とウイルスの相互作用は、ウイルスに対する微生物の正の効果と負の効果と同様に研究されてきた(Robinson and Pfeiffer, 2014)。細菌表面は、構造や折り目が異なるウイルスタンパク質と相互作用することができる。ウイルス感染は、細菌の主要なエンベロープ成分であるグラム陰性ではリポ多糖類(LPS)グラム陽性ではペプチドグリカン(PG)との相互作用によって促進される。ポリオウイルスや、レオウイルス、マウス乳腺腫瘍ウイルス、マウスノロウイルスなどの他のウイルスは、LPSとPGの両方を使用して熱安定性、受容体親和性、および同様のメカニズムを高め、生体内試験感染を促進することが示されている(Karst, 2016)。これらの結果を合わせると、真核細胞に対するウイルスの付着性、安定性および感染性を改善する上で、常在菌が重要な役割を果たしていることが示されている。一方で、マイクロバイオータは、感染を回避するための免疫応答を誘導することで、ウイルス感染に対する保護を与える可能性がある。微生物相はウイルス生物学に直接的・間接的に影響を与え、ひいては真核ウイルスは細菌生物学に影響を与える可能性がある(Neu and Mainou, 2020)。SARS-CoVおよび中東呼吸器症候群コロナウイルス(MERS-CoV)は、コウモリの腸管系で発生した(Drexler et al 2014)。これらの細菌は呼吸器系にも大量に存在するため、CoVs株は出現時に細菌を利用して感染を促進した可能性がある(Domcke et al 2015)。LPS結合トール様受容体(TLR)4の非存在は、SARS-CoVに対する免疫におけるTLR経路の役割に起因して、疾患の増強をもたらした(Totura et al 2015)。Johnson et al 2019)は、細菌表面成分とCoV感染との関係を探り、枯草菌由来のPGがCoV感染性を低下させることを見出した。CoV阻害に関与する分子は、サーファクチン、環状リポペプチド(CLP)であり、用量および温度依存性のウイルス性特性を呈する。サーファクチンは、インフルエンザA、ジカ、ドゥグベ、ニパ、クリミア・コンゴ出血熱、チクングニア、マヤロ、ウナ、およびエボラウイルスなどの他のエンベロープされたウイルスによる感染を減少させることが知られている(Johnson et al 2019)。この証拠は、ウイルス感染の増減における常在菌の役割を確認しており、ウイルスの病態や治療における微生物叢の重要性を示唆している。
抗菌ペプチド(AMP)は、Mustafa et al 2018)により、MERS-CoV感染に対する代替治療法として提案されている。ペプチド治療薬およびその模倣薬-140以上のペプチドが臨床試験で評価されている-は、コロナウイルスおよびSARS-CoV2を潜在的に含む病原体に対抗するための有望な戦略を提示している(Mustafa et al 2018)。それらは、タンパク質-タンパク質相互作用を阻害することができ、標的とすることが困難な疾患に使用することができ、副作用が少なく、高い特異性を示す;さらに、多くのペプチド阻害剤は、効率的にウイルスに対抗することが実証されている(Melnik et al 2011)。ペプチドの抗ウイルス作用のメカニズムは、ウイルス分解、宿主細胞受容体の遮断、ウイルスの融合または複製、および適応免疫応答の誘導である。抗コロナウイルスとして研究されているペプチドには、主にウイルス-宿主細胞融合を阻害するペプチドが含まれており、RBD相互作用に作用し、HR1とHR2が融合活性コアを形成するのを阻害したり、Sタンパク質を切断したりするのを防ぐことができる(Du er al)。 ウイルスの組み立ておよび放出を阻害するペプチドは、これらのプロセスがよりよく知られるようになれば、良い標的となり得る。ペプチドが有望であるとしても、米国食品医薬品局(FDA)によって承認されたCOVID-19の治療薬またはワクチンはまだ存在しない。Zhou F. et al 2020)は、COVID-19に感染した15人の患者の糞便微生物変化を分析し、疾患の重症度との興味深い関連を発見した。疾患の重症度が高いことと、コプロバチルス、クロストリジウム・ラモサム、クロストリジウム・ハテウェイイのベースラインの豊富さとの間に相関関係があり、Faecalibacterium prausnitziiとAlistipes onderdonkiiのレベルが低いことが判明した。抗生物質への曝露は、日和見病原体の濃縮と陽性共生細菌の濃縮の両方を防止した。
患者の糞便サンプルはウイルスの存在について検査され、入院時に11種が陽性であったが、そのうち6種は退院時にも陽性であった。時間の経過とともに、14種の細菌が糞便ウイルス負荷と関連していた。マウス腸内でACE2の発現をダウンレギュレートすることで知られるBacteroides ovatusは逆相関を示したが、Firmicutes Erysipelotrichaceaeの細菌2_2_2_44Aは正の相関を示した。この結果は、ジスビオスは寛解期でも持続することを示唆している(Zuo er al)。
腸内マイクロバイオームはCOVID-19の重症度に影響を与える可能性が高く、COVID-19は日和見病原体の増加とともに腸内マイクロバイオームに影響を与えることから、本疾患に対抗するためには腸内マイクロバイオームの健康状態が重要である可能性がある(図1)。
COVID-19炎症性合併症におけるマイクロバイオータの役割
SARS-CoV-2感染によって誘発される肺細胞の破壊は、マクロファージと単球のリクルート、サイトカインの放出、および主要な適応性T細胞とB細胞の介入を含む局所免疫応答を誘発する。この反応は通常は決定的なものであるが、時には機能不全に陥り、重度の肺炎とサイトカインストームを引き起こすこともある。重症患者は、インターロイキン-2,インターロイキン-7,およびインターロイキン-10(IL-2,IL-7,およびIL-10)顆粒球コロニー刺激因子(G-脳脊髄液)インターフェロン-γ誘導性タンパク質-10(IP-10)単球化学吸引性タンパク質-1(MCP1)マクロファージ炎症性タンパク質1α(MIP1α)および腫瘍壊死因子(TNF)の高レベルを有する(Huanu et al 2020)。2020)は、IL-6レベルの増加とともに(Zhou F. er al)。 特筆すべきことに、MCP1,IP-10,およびMIP1αを分泌するCD14+CD16+炎症性単球の割合が、軽症患者よりも重症患者の末梢血中に多く見られた(Zhou Y. er al)。 健常者のCOVID-19に対する感受性の大きなばらつきが、このパンデミックの間に観察されてきた。最近、Gouら(Gou et al 2012)は、異なるグループの人々の間での多様な感受性を説明することができる重要な結果を得た。COVID-19の重症化を予測する20の血中プロテオミクスバイオマーカーが同定されており、このプロテオミクスリスクスコアは主に高齢者の間ではプロ炎症性サイトカインと正の相関を示したが、若年者の間ではそうではなかった。腸内マイクロバイオータの特徴は、366人の患者でプロ炎症性サイトカインと高い相関関係があることが判明した。
COVID-19の合併症は、プロ炎症性疾患および/または免疫応答障害のある人でより頻繁に発生する。低悪性度の慢性全身性炎症は、肥満、アテローム性動脈硬化、2型糖尿病、および高血圧などのいくつかの併存疾患を伴うが、これらはCOVID-19患者の転帰に悪影響を及ぼす(Chiappetta et al 2020年)。腸-微生物-宿主-免疫軸は炎症状態に重要な役割を果たしている可能性が高く、Gou et al 2020)による糞便メタボロミクス解析では、腸内細菌叢と炎症およびCOVID-19の重症度とを結びつけるアミノ酸関連経路が明らかにされた。低悪性度炎症の増加は、細菌の多様性の低下と関連している。さらに、加齢中の腸内細菌叢の改変は、炎症を誘発し得る;古いマウスから若い胚芽のないマウスに腸内細菌叢を移すことは、TNF-αなどのプロ炎症性サイトカイン遺伝子のより高い発現、およびおそらく炎症による腸管上皮の浸透化に関連するプロ炎症性細菌化合物の循環の増加を含む「炎症」を模倣した応答を誘発する(Fransen et al 2017)。慢性的な炎症は、順番に、上皮機能の変化およびその結果として生じる疾患および感染症を引き起こす可能性があり、それは、バイオシスを引き起こす可能性がある。LPSは、グラム陰性菌の外側細胞膜に由来するエンドトキシンであり、エンドトキシン血症が存在する場合には、炎症関連プロセスを誘発する(Gunness and Gidley, 2010)。腸内毒素症は腸の透過性に影響を与え、漏れた腸のタイトジャンクションを介して消化管粘膜を横断することができるLPSなどの細菌産物の全身レベルの上昇につながる可能性がある(Gunness and Gidley, 2010)。また、細菌のトリプトファナーゼの作用によって産生される主要なトリプトファン由来の微生物代謝物の一つであるインドール(Russell et al 2013)は、ヒト宿主における炎症関連プロセスと相互作用することができる(Venkatesh et al 2014);さらに、インドール-3-プロピオン酸は、LPSの浸潤を間接的に制限し、代謝性エンドトックス血症および宿主の炎症を減少させる(Cani et al 2012)。
微生物は、発酵を介して耐性デンプンおよび食物繊維を代謝することができ、主にアセテート、プロピオン酸、および酪酸を提供し、それは、腸管上皮細胞によってエネルギーとして使用され、腸管バリアの完全性を強化し、LPSが炎症を誘発するのを防止することができる(Ohata et al 2005; Peng et al 2009; Corrêa-Oliveira et al 2016)。そのメカニズムは完全には知られていないが、SCFAsはヒストン脱アセチラーゼ(HDAC)阻害活性、走化性、増殖、分化、アポトーシスを有することから、遺伝子発現を含むいくつかのプロセスを調節する(Corrêa-Oliveira et al 2016)。SCFAsの受容体のうち、遊離脂肪酸受容体2(FFAR2)は、腸管上皮細胞や免疫系細胞に発現しており、細胞の走化性や活性化に関与していると考えられている(Stoddart et al 2008)。高繊維質の食事をマウスに与えると、SCFAsの血中濃度が上昇し、肺のアレルギー性炎症を抑制することが実証されている(Trompette et al 2014)。SCFAsは、全体的な抗炎症効果を持つ免疫細胞の遊走や増殖、サイトカインの多くの種類を減少させ、アポトーシスを誘導することにより、炎症を抑制する可能性がある(図1)。
薬物、コメディケーション、ポリファーマシー、マイクロバイオータ、COVID-19
COVID-19の重篤な臨床状態および死亡例の大部分は高齢者で発生している(Lithander et al 2020)。高齢者がCOVID-19を発症しやすいのは、加齢に関連した因子が一致しているからである。高血圧、高脂血症、心血管疾患、糖尿病、および癌のような1つまたは複数の併存疾患の存在は、COVID-19患者の死亡リスクの劇的な増加と関連している(Lithander et al 2020)。上記の併存疾患は、「ポリファーマシー」として知られる慢性的で複雑な薬理学的レジメン、すなわち、1日に5種類以上の薬を使用することを必要とする。必然的に、複数の薬剤の使用は、薬剤の副作用および副作用の比例した増加を意味するだけでなく、マイクロバイオームの完全性に影響を与え、その結果、潜在的にSARS-CoV-2を含むウイルス感染症を克服する宿主の能力を悪化させる可能性がある(TicinesiおよびMilani 2017)。このような状況は、他の交絡因子や健康上の問題と相まって、COVID-19の臨床的負担、特に高齢者の負担に関して、さらに過小評価されている要因となりうる。
残念なことに、COVID-19パンデミック以前にポリファーマシーと微生物相の問題を扱った研究論文は2本しかない(Ticinesi and Milani, 2017; Vich Vila er al)。 どちらの研究も、ポリファーマシーがマイクロバイオータ組成に有意な影響を与え、共同投与される薬剤の数を増やすとより多くの変化が観察されることを発見した。TicinesiおよびMilani(2017)は、高齢者の併存患者のマイクロバイオータは、多数の胃外病理学的意味合いを有するヘリコバクターのような病原性関連細菌の相対的な豊富さの一般的な、および宿主の心肺系の健康維持および炎症の調節を助けるLachnospiraceaeおよびSuccinivibrionaceaeの減少によって特徴付けられ、その増悪はCOVID-19の生命を脅かす合併症を表す(SestiliおよびStocchi 2020)と報告した。SiddiqiおよびMehra 2020)。) TicinesiとMilani(2017)はまた、処方された薬剤の数とマイクロバイオーム多様性指数との間に負の相関があることを発見した;重要なことに、マイクロバイオーム多様性指数が最も低い患者では死亡率の増加が観察された。
マイクロバイオームに影響を与える薬剤の関連性
薬物とマイクロバイオータとの相互作用は、単に数多くの薬物の問題ではない:むしろ、特定の薬物とその組み合わせを考慮する必要がある。残念なことに、Ticinesiらによる引用されたものとは別の別の研究(Vich Vila et al 2020)では、一般集団コホートと炎症性腸疾患と腸症候群患者の2つのコホートという、同じ地理的地域からの3つの独立したコホートにおいて、一般的に使用されている薬剤の腸内マイクロバイオータへの利用に焦点を当てた研究が行われているだけである。ここでも、3つのグループ内での薬物使用数と全体的なマイクロバイオータ組成との間に正の相関が見られた。さらに、薬物使用者と非使用者の間の分析も行われた。データの単剤分析では、41種類のうち19種類の薬剤が微生物の変化と相関していることが明らかになった。複数の薬の使用(データの多剤併用分析)に関しては、下剤、プロトンポンプ阻害剤(PPI)メトホルミン、抗生物質の存在が最も微生物組成に影響を与えていた。全体では、細菌の相対的な豊富さと 6 種類の薬剤の同時期使用との間に 47 の関連性がスコア化された。抗生物質の前提とは無関係に、多剤併用者ではビフィズス菌属の全体的な減少が認められた。機能的な観点からは、271の細菌経路がPPI、下剤、抗生物質、メトホルミンによって変化していた。
ポリファーマシーとレジストーム
興味深いことに、薬物投与は腸内細菌群集分類と代謝能力だけでなく、抵抗性遺伝子にも影響を与えた。実際、抗生物質耐性遺伝子、特にマクロライドに対する耐性に関与する遺伝子の数は、薬物使用者の3つのコホートにおいて、薬物を使用していない参加者と比較して増加した。この効果は、抗生物質(下記参照)だけでなく、15種類の非抗生物質薬、特にPPIとメトホルミンによっても促進された(Zheng et al 2019)。注目すべきことに、このような事象は、COVID-19関連気道超感染症を管理/予防するために最も処方されている抗生物質の一つであるアジスロマイシンの有効性を妨げる可能性がある(Ohe et al 2020)。
非抗生物質の薬剤がこれらの変化を誘発するメカニズムを説明するために、同じ患者に多種多様な薬剤が投与された場合には、キセノバイオティクスを代謝することが可能な菌種が、代謝しない菌種よりも競争上の優位性から利益を得て、(dys)microbic有意な変化をもたらすことが提案されている(Vich Vila et al 2020)。これは、COVID-19高齢患者の免疫学的回復力およびSARS-CoV-2感染を克服する能力に負の結果をもたらす可能性がある。
抗生物質に関しては、他のどの薬物クラスよりも、それらは、重度の腸内異臭を促進するだけでなく、多くの中で腸内細菌群集が関与するメカニズムを介して細菌抵抗性の増加も促進する(Becattini et al 2016)。したがって、抗生物質の(誤)使用やポリファーマシーの履歴は、高齢者や併存する集団における耐性菌の選択を促進する可能性があり、これらの因子は、COVID-19患者に重感染している病原体によって獲得される可能性があり、その根絶がより困難になる。残念ながら,この現象の発生状況や関連性はまだ定量化できておらず,具体的なレトロスペクティブ研究を計画する必要がある。
COVID-19の治療薬と微生物相
軽度のCOVID-19を治療するために一般的に処方される薬剤は、既存のポリファーマシーと組み合わせる必要があり、理論的には微生物相との相互作用の範囲を複雑にする可能性がある。例えば、NSAIDsはマイクロバイオータの組成に影響を与える可能性があり、その変化は胃毒性にも影響を与えるようである(Castellsague et al 2012)。パラセタモールはNSAIDのより安全な代替品として推奨されているが、COVID-19で広く使用されているので特別な言及に値する。パラセタモールは、マイクロバイオータ組成物を変化させないが、その吸収およびバイオアベイラビリティは、ジスビオティック患者において大幅に増加する(Mukhtar et al 2019)が、その後、COVID-19の経過を悪化させる可能性のある2つの条件である肝毒性およびグルタチオン枯渇を起こしやすくなる可能性がある(SestiliおよびFimognari 2020)。
上述したように、超感染症の予防/治療のための抗生物質の処方は、COVID-19患者のマイクロバイオータ、特に広汎なスペクトルの薬剤にさらに深く影響を与える可能性がある。しかし、COVID-19治療のために広く処方されている抗生物質であるアジスロマイシンについては特別な言及が必要である。したがって、アジスロマイシンは、他の薬剤よりも多くの場合、高齢で併存するCOVID-19患者の既に弱っている微生物叢の状態を急速に悪化させる可能性がある。
グルココルチコイド、特にデサメタゾンは、高炎症を抑制したり逆行させたりするための最も効果的な薬剤としてCOVID-19患者に処方されている;それらはまた、進行している基礎疾患を治療するために患者によって使用されている。これに関連して、2つの最近の研究は、グルココルチコイドがマウスの腸内微生物変化を誘導することを報告した。Schepper et al 2019)およびヒト(Qiu et al 2019)。急性横隔膜炎と診断されたヒトでは、プレドニゾンによる3ヶ月間の治療により、Firmicutesの濃縮が促進され、Bacteroidetesの枯渇が促進された(Qiu er al)。
抗ウイルス薬に関しては、レムデシビルは微生物相に影響を与えないが、ヒドロキシクロロキンはSARS-CoV-2に対しては推奨されなくなったが、ドキシサイクリンと併用することで微生物群集組成を変化させることが報告されている(Angelakis et al 2014)。
全体として、ポリファーマシーによる腸内細菌群集の変化は、多病患者における既に悪いマイクロバイオーム状態を悪化させる要因となっているが、まだ無視されてきた要因である可能性がある(図1)。
COVID-19. マイクロバイオータの健康のための治療的アプローチ
イタリアはヨーロッパの中でも抗生物質の消費量が多い国の一つで、スペイン、フランスも非常に多く、昨年はイタリアよりもさらに多くの抗生物質を消費している。抗生物質は腸内環境異常を引き起こすことが知られており、したがって、COVID-19緊急事態の影響を最も受けているこの3カ国(イタリア、スペイン、フランス)での抗生物質の乱用が危険因子であることはもっともらしい。抗生物質の乱用も何らかの形でこの悲劇の原因になっていると言えるまでには、多くのデータを相互参照する必要がある。SARS-CoV-2では糖尿病、高血圧、心房細動、認知症、脳卒中などの併存疾患が陽性で死亡していることから、COVID-19の危険因子は病気そのものなのか、それともCOVID-19を遠ざけるために服用された薬剤なのか、という疑問が湧いてく。上で報告されているように、いくつかの研究では、多くの薬物(メトホルミン、スタチン、PPI、精神科治療薬)が腸内細菌叢を変化させ、これらの変化がウイルス感染症のリスクを高めることが示されている。重度のCOVID-19の合併症に悩まされている人の平均年齢はかなり高く、高齢者の腸内細菌叢は生物多様性に乏しく「脆弱」であることが知られている。さらに、ビタミンD欠乏症は高齢者ではほぼ常に観察されており(Agostini et al 2018)最近ではCOVID-19の進行とビタミンDとの相関、およびこのビタミンと腸内細菌叢の恒常性との関係が観察されている(Sun 2018; Rhodes and Subramanian 2020)。
これまでに議論してきたことを考慮すると、COVID-19感染を予防するため、または少なくとも疾患の重症度を減少させるために、特定のサプリメントの推奨が示唆され得る。腸内マイクロバイオームの操作を標的とする新規な治療戦略には、プロバイオティクス、プレバイオティクス、天然物または食事療法が含まれ得る。プロバイオティクスは生きた非病原性微生物であり、適切な量を投与することで、特に消化管内の微生物バランスを整えることができる(Williams, 2010)。プロバイオティクスは、下痢の頻度と期間を低下させ、TLRの発現とそれに対応するシグナル伝達経路を阻害して体液性および細胞性免疫を調節することが実証されている(Mishra et al 2015)。パターン認識受容体であるTLRは、自然免疫系のタンパク質である。TLRは、自然免疫系および特異的免疫系に関与する細胞の細胞膜上に広く発現しており、身体の防御機構の一部としての重要性を示している。TLRは、まず病原体を認識し、サイトカインの異常放出および粘膜損傷の増加を伴う炎症反応の悪化につながる一連の分子カスケードを誘発する(Yao et al 2017)。さらに、それらは生体内試験および試験管内試験の両方で有意な抗酸化活性を示す(Lin and Yen, 1999; Dowarah and Verma, 2018; Noureen er al)。 Luotoらは、早産児におけるウイルス性呼吸器感染症、特にライノウイルスに起因する感染症の発生率が、プロバイオティクスおよびプレバイオティクスを生後早期に摂取した後に有意に低下したことを実証した(Luoto et al 2014)。プロバイオティクス(具体的には、ラクトバチルス属およびビフィズス菌属)のサプリメントのための急性呼吸器感染症の期間の減少は、そうでなければ健康な子供および成人において、King et al 2014)によって報告されている。ラクトバチルス属およびビフィドバクテリウム属は、呼吸器ウイルス、特にインフルエンザウイルスA型に対して最も強い抗ウイルス活性を有しており、この抗ウイルス活性は、そのようなプロバイオティクスの主なメカニズムが免疫調節であるとしても、株の特異性および宿主免疫系の状況に依存する(Al Kassaa, 2017)。同様に、早産の新生児の初期段階でのプロバイオティクスおよびプレバイオティクスの投与はまた、呼吸器系のウイルス感染症、特にライノウイルスによって引き起こされるものの発生率を有意に減少させることにつながっている(Luoto et al 2014)。COVID-19患者は、しばしば侵襲的な機械的換気を必要とする。興味深いことに、いくつかの著者は、プロバイオティクスの投与が重症患者におけるこの処置の必要性を減少させることを実証した(Zeng et al 2016)。さらに、モロー et al 2010)によって実施されたパイロット研究は、ラクトバチルスラムノサスGGの投与は、選択された、高リスクのICUの集団で人工呼吸器関連肺炎を防止した。他のプロバイオティクス株である枯草菌と腸球菌もまた、ほとんどの重症患者において機械的換気の必要性を減少させることが示されている(Zeng et al 2016)。 特定の腸内細菌であるラクトバチルス菌とビフィドバクテリウム菌の減少が、腸管異常を示す一部のCOVID-19患者で観察されている。これらの細菌は、腸管感染症からの保護、腸管機能の刺激、免疫応答の改善、および抗生物質治療中のカンジダ、シュードモナス、ブドウ球菌および大腸菌の過剰増殖の防止などの宿主有益な効果を発揮することが知られている(Xu et al 2020)。Kiousi et al 2019)は、プロバイオティクスが、局所的または腸以外の器官でのサイトカイン産生を減少させることができ、その投与が免疫系の状態および呼吸器感染症にポジティブな影響を与えることを実証した;特に、プレバイオティクスおよびプロバイオティクスは、TLR9(Toll様受容体9)を介して形質細胞様樹状細胞(pDCs)を刺激し、その結果、インターフェロン(IFN)産生がウイルスの複製および感染性を減少させることを実証した(Kiousi et al 2019)。プロバイオティクスL. lactis JCM 5805はまた、pDCを活性化し、試験管内試験でIFN産生を誘導することができるので、ヒトにおける抗ウイルス免疫を強化するためのツールであり得る(Sugimura er al)。 Starosila et al 2017)は、プロバイオティクス菌株Bacillus subtilisからペプチドP18を分離しており、これは試験管内試験でインフルエンザウイルスの完全阻害を引き起こし、マウスでは重要な抗ウイルス効果を示している。また、肺微生物叢は免疫学的恒常性にも寄与しており、その生育異常の影響を受けるとウイルス感染症の感受性が高くなる可能性がある。さらに、肺マイクロバイオータの腸内細菌叢異常症は、二次的な細菌感染症の発症を促進し、COVID-19患者の罹患率および死亡率を増加させる可能性がある(Di Pierro, 2020)。健康な口腔および肺のマイクロバイオータにおける優勢なコメンタールは、Streptococcus salivariusであり、これは、Di Pierro(2020)によって、口腔および肺のマイクロバイオータを改善し、SARS-CoV-2に対する防御力を高めるための可能なプロバイオティクス(Streptococcus salivarius K12)のアプローチとして提案されている(Streptococcus salivarius)。繊維および耐性デンプンは、腸内微生物によって消化される(De Filippis et al 2016)宿主にエネルギーを供給し、腸の健康を改善する。イヌリン、ポリデキストラン、トウモロコシ繊維、および他のプレバイオティクスは、ヒトにおいて、特に老化の間、腸の多様性および免疫を増加させることが知られている(Kleessen et al 1997; Bouhnik et al 2007)。例えば、全粒穀物からの難消化性炭水化物を消費すると、IL-6およびインスリン抵抗性の減少が認められ、一方、ブチリル化高アミローストウモロコシデンプンを想定した後にIL-10が増加したことが指摘されている(Keim and Martin, 2014)。これらの有益な効果は、SCFAsの産生が増加し、胃腸関連リンパ組織が強化されたことによるものと考えられる(Schley and Field, 2002)。また、食事中の食物繊維の増加は、肺のマイクロバイオータを改善し、肺の免疫力に影響を与えることができる(Trompette et al 2014)。したがって、プレバイオティクスとプロバイオティクスの使用は、ウイルス感染症に対抗するための斬新でシンプルな戦略として活用されるべきである。
プレバイオティクスとプロバイオティクスと並んで、他の食品成分も腸内細菌叢によって間接的に有益な効果を示す。ホエイやエンドウ豆のタンパク質抽出物はビフィズス菌や乳酸菌を増加させ、ホエイは病原性細菌であるバクテロイデス・フラギリスやクロストリジウム・ペルフーリンゲンスを減少させることが報告されている( Świątecka er al)。 さらに、脂肪は腸内微生物の状態に影響を与える可能性があり、低脂肪食はビフィドバクテリウムを増加させ、高飽和脂肪食はFaecalibacterium prausnitziiの相対的な割合を増大させる(Singh er al)。
抗炎症剤は、COVID-19と対照的に知られており、抗炎症性食品摂取量の増加(すなわち、野菜、果物および魚)は、赤肉、加工食品およびアルコールなどのプロ炎症性食品の減少とともに、ベースラインの腸内炎症を減少させ、パンデミアの管理に非常に有用であり得る(Singh et al 2017; Zabetakis et al 2020)。
植物をベースとした豊富な食物繊維の食事は、短鎖脂肪酸(SCFA)を産生することによって腸の健康を改善し、免疫力の強化を含む宿主に様々な健康上の利点を提供する微生物のアクセス可能な炭水化物の良い供給源である(Rishi er al)。
さらに、前臨床および臨床データは、野菜、果物、穀類、茶、コーヒー、ダークチョコレート、ココアパウダー、およびワインなどの食品に存在する天然由来の不均一な化合物である食餌性ポリフェノールがプレバイオティクス特性を示し、病原性の腸内微生物に対して抗菌活性を発揮し、腸内代謝および免疫に影響を与え、抗炎症特性を発揮し、異なる疾患に利益を有することを示唆している(Kumar Singh et al 2019)。
したがって、正しい個別化された食事療法が、COVID-19の影響を受けた患者の回復および臨床転帰の改善に役立つことは明らかである。
結論
腸内細菌叢は免疫応答に影響を与え、それによって疾患の進行に影響を与える。腸内細菌叢の状態に関連した免疫応答の過活動と過活動の両方がCOVID-19の重篤な臨床合併症を引き起こす可能性がある。マイクロバイオータの不健康な状態は、まだ強調されていない危険因子である可能性がある。マイクロバイオータは、十分で安全で安価なプレバイオティクスやプロバイオティクスを前提とすることで支持されうるので、それらの処方は、感染者におけるCOVID-19の進行を制限するための補助的な治療として、あるいはCOVID-19の拡大や二次波の過程でリスクのある非感染者の予防戦略として検討されるべきであろう。
