コンテンツ
The Influence of Genetic Factors and Cognitive Reserve on Structural and Functional Resting-State Brain Networks in Aging and Alzheimer’s Disease
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6414800/
要旨
磁気共鳴画像法(MRI)は、人間の脳内の神経ネットワークの複雑な構成を解明する上で重要な知見を提供している。安静時の機能的MRIデータを用いてトポロジカルマップを作成し、脳活動の変化を可視化するとともに、異なる脳領域間の構造的・機能的なつながりを表現し、評価することができる。
アルツハイマー病(アルツハイマー病)は、特にデフォルトモードネットワーク内で顕著な、この接続性の漸進的な損失と関連している。本論文では、認知症のリスクに関連する因子が脳ネットワーク構造の構成にどのような影響を与えるかについて、最近の文献をレビューする。特に、認知的予備力とAPOEとBDNFの共通遺伝的多型Val66Metに焦点を当てる。
キーワード:fMRI、アルツハイマー病、デフォルトモードネットワーク、認知的予備力、BDNF、APOE
序論
最近では、世界で4,700万人以上の高齢者が認知症の影響を受けていると推定され(Alzheimer’s Disease International, 2009; Prince et al 2016)2050年までにさらに1億3,100万人がこの健康を脅かす症候群を発症すると推定されている(Prince et al 2016)。アルツハイマー病は、行動の変化、記憶喪失、学習能力の低下を引き起こす進行性の疾患である(Anand et al 2014)世界的に認知症の最も一般的な原因である(Hardy、1997)。アルツハイマー病のほとんどの症例は75歳以上の人に発症するが、特定の遺伝子変異を持つ人を含む比較的若い人は65歳以前に発症する可能性がある(Loy et al 2014)。
アルツハイマー病に起こる脳の変化に関する知識は、20世紀後半から、関連する様々な神経変性過程に関する広範な研究により、著しく増加してきた。特に進展しているのは、アルツハイマー病の病理学的な「特徴」と呼ばれてきたものに関してである-アミロイド斑や神経原線維絡み(NFTs)の存在は、軸索、樹状突起、シナプスに悪影響を及ぼす(Vickers et al 2000,2016)。プラークは、脳内のβアミロイド(アミロイドβ)タンパク質の異常な形態の蓄積の結果である。NFTは、異常なタウタンパク質の凝集によって形成され(Vickers et al 2000;Savva et al 2009年)ニューロンの死とより直接的に関連している(Jacobs et al 2012)。大脳皮質内では、最も初期のプラークは通常大脳新皮質で発見されるが、初期のもつれの形成は内耳皮質や海馬などの内側側頭葉(MTL)構造で起こる(Price and Morris, 1999)。MTLは記憶の形成と長期記憶を司る非常に重要な領域である(Squire and Zola-Morgan, 1991)。大脳皮質全体では、長い皮質接続を提供するニューロンは、その後、アルツハイマー病で見られるシナプスの損失のパターンの下敷きになる可能性があるNFT誘発性の劣化(モリソンとホフ、1997)に最もなりやすい。内耳海馬回路は、アルツハイマー病の初期に障害され、MTLの徐々にの切断に続いて、その後、関連性ニュー皮質間の接続性の損失(MorrisonとHof、1997)。進行性および退行性の病理学のこのパターンは、加齢に伴う特定の認知機能の低下の根底にある可能性があり、最終的には率直なアルツハイマー病につながる。アミロイドβの初期の病理学的蓄積は認知機能障害と関連しており、また、空間的に離れた脳領域間の機能的連結性に影響を与える可能性がある(Delbeuck et al 2003)。健康な加齢とアルツハイマー病における機能的連結性とアミロイドβを検討した研究の要約表は、表1に記載されている。神経イメージングは、国際的な研究共同研究の重要な要素であり(Hendrix et al 2015)アルツハイマー病の経過の基礎となる中断された構造的および機能的接続性のメカニズムを調査するために使用されてきた(Dennis and Thompson 2014)。アルツハイマー病における病理学的変化が脳ネットワークの組織にどのように影響を与えるのか、あるいはこれらのネットワークがどのように反応したり、蓄積する病理学的変化に適応したりするのかをよりよく理解することで、機能的回復力の潜在的な範囲についての更なる洞察が得られるかもしれない。レジリエンスという用語は、組織が損傷に対して耐性を持つ能力として説明されている(Cosco er al)。 この点において、教育やライフスタイルなどの因子は、脳内の接続の冗長性を高め、および/または機能的な接続を温存することによって回復力を高める可能性があり、最終的にはアルツハイマー病病理の臨床発現を遅らせる可能性がある。実際、教育とアルツハイマー病における認知機能低下との関連を調査した研究では、より高学歴の人ほど、アルツハイマー病の臨床発現前に、より多くの神経病理に耐えることができることがわかっている(Bennett et al 2003)。これは、教育が脳の病理学的負荷と認知機能障害との関係(Brayne et al 2010;Valenzuela et al 2011年)および機能的接続(Marques et al 2016)を緩和するためである可能性があるからである。
表1 健康な加齢とアルツハイマー病における機能的連結性とアミロイドベータを検討した研究
健康な老化とアルツハイマー病における機能的接続性とアミロイドベータを調べる研究。
| 調査 | サンプル | イメージング対策 | 主な結果 |
|---|---|---|---|
| フィッシャー等。(2015) | CN前臨床AD(n = 12)、 年齢を一致させた対照(n = 31) |
トラクトグラフィーを使用したDTI、フルデオキシグルコースの 測定-PET |
CN前臨床AD(Aβ陽性)は、対照と比較して、臨床ADと同様の白質ネットワークの変化を示しました。たとえば、CN前臨床ADは、コントロールと比較して、パスが短く、グローバル効率が低下していました。 |
| Grandjean etal。(2014) | トランスジェニックマウス(n = 38) 野生型マウス(n = 36) |
構造MRI、 Rs-fMRI DTI |
機能的接続性の進行は、野生型マウスと比較して、ArcAβトランスジェニックマウスの体性感覚および運動皮質で破壊されました。この減少は、トランスジェニックマウスのアミロイドーシスの前でさえ顕著でした。 |
| Mormino etal。(2011) | CN古い(n = 44)、 AD(n = 22) |
構造MRI、 Rs-fMRI、 PIB-PETイメージング |
CN高齢者におけるAβの増加は、複数の後内側領域におけるデフォルトモードネットワークの機能的接続性の低下と関連しており、Aβの蓄積および関連する脳の変化が明白な認知障害の前に起こることを示唆しています。 |
| Sheline etal。(2010b) | 35 AD、68 CN古い PIB-(n = 24) PiB +(n = 20) |
構造MRI、 Rs-fMRI、および 動的PETスキャン |
Aβ沈着のあるCNの人々は、機能的接続性の障害、特にデフォルトモードネットワークの混乱を示しました。 |
| ベロら。(2012) | 若いAPP / PS1トランスジェニックマウス(n = 7) 古いAPP / PS1トランスジェニックマウス(n = 7) 若い野生型マウス(n = 13) 古い野生型マウス(n = 10) |
機能的接続性光固有信号イメージング | Aβの蓄積は、若いAPP / PS1マウスおよび野生型マウスと比較して古いAPP / PS1マウスの機能的接続性の低下に関連していた。より多くのAβを持っていた脳領域は、接続性の最も顕著な加齢に伴う減少を示しました。 |
| Hedden etal。(2009) | 38 CN高齢者、 PIB-(n = 17)、 PiB +(n = 21) |
構造MRI、 fMRI、 ダイナミックPET |
機能的接続性は、Aβ陽性のCN高齢者で破壊されました。Aβ沈着に関連する接続障害は、海馬と後帯状皮質(デフォルトモードネットワーク領域)の間で明らかであり、記憶障害に関連していました。 |
| Drzezga etal。(2011) | CN PiB-(n = 12) CN PiB +(n = 12) MCI PiB +(n = 13) |
構造MRI、 Rs-fMRI、 フルオロデオキシグルコース -PET 、PiB-PET |
Aβ負荷を伴うMCIは、CN高齢者と比較して、後部脳領域(楔前部/後帯状皮質)で代謝低下、ニューロン活動の低下、および機能的接続の破壊を示しました。 |
| Lim etal。(2013) | 165 CN PIB-(n = 116) PiB +(n = 49) BDNF Metキャリア(n = 58) BDNF Val / Val(n = 107) APOE e4(n = 70) |
構造的MRI、 PET PiBイメージング、 ベースライン時の神経心理学的評価、18か月および36か月 |
Aβ負荷陽性のBDNFMetキャリアは、BDNF Valホモ接合体と比較して、記憶機能の低下の加速と海馬容積の減少を示しました。 |
| Franzmeier etal。(2017b) | CNAβ+(n = 24) 健忘性MCIAβ(n = 44) |
構造MRI、 Rs-fMRI、 FDG-PET |
Aβ陽性の健忘性MCIとより多くの年数の教育を受けた個人は、楔前部の代謝低下の減弱と、全体的な前頭皮質の機能的接続性の比較的増加を示しました。 |
アルツハイマー病、アミロイドβアミロイドβ、APP/PS1アミロイド前駆体タンパク質プレセニリン、APOEアポリポ蛋白E、BDNF脳由来神経栄養因子、CN認知的に正常、DTI拡散テンソルイメージング。FDG フルオデオキシグルコース、MCI 軽度認知障害、MRI 磁気共鳴イメージング、PET 陽電子放出トモグラフィー、PiB ピッツバーグ化合物B、Rs-fMRI 安静時機能的磁気共鳴イメージング。
これまでの研究では、アルツハイマー病では機能的な接続性が損なわれたり中断されたりすることが示されており(Stam et al 2006,2008年)逆に、アルツハイマー病の構造的・機能的ネットワークへの影響を調べることで、脳の接続性や脳領域がどのように相互に通信しているかについて、より正確な情報が得られる可能性がある(Sheline and Raichle 2013)。本レビューでは、脳の接続性を分析する方法、アルツハイマー病で見られる構造的・機能的ネットワークの変化、脳の機能的接続性を部分的に決定する際の認知的予備力と特定の遺伝的要因の役割に焦点を当てている。この点で、機能的接続性と病理に対する抵抗性の潜在的な変化には、修正不可能な因子と修正可能な因子の両方が関与しており、それは脳システムが蓄積された病理的負担にどのように反応するかに影響を与えることになるだろう。したがって、我々は、アルツハイマー病リスク、進行および回復力に関連する遺伝的バイオマーカーおよび環境因子に関連して、構造的および機能的な脳ネットワークの特徴を議論する。
接続性を解析する方法
磁気共鳴画像法(MRI)などの神経画像技術(図1)は、解剖学的接続を調査し、病理学的変化を検出し、アルツハイマー病(図1A)を含む神経変性疾患の進行をモニタリングするために長い間使用されてきた。MRIは、画像を作成し、脳活動に関連した揺らぎ信号をマッピングするために、強い静磁場を発生させることを含む(Heeger and Ress, 2002)。MRIはまた、脳の萎縮の定量化を可能にし、これは正常な脳の老化をアルツハイマー病と区別するために使用することができる(Frankó et al 2013)。例えば、最近の研究では、認知的に健康な個体におけるMRIと認知検査は、特に健康な認知から5年後に軽度の認知障害(MCI)が出現するまでの経過を調査する場合に、アルツハイマー病の発症を予測するのに有用なツールであることが明らかになった(Albert et al 2018)。臨床症状の出現が遅れているため、前臨床段階の個体を診断することは困難である。したがって、動物モデルは、拡散テンソルイメージング(DTI;Weston et al 2015)によって測定された灰白質および白質の変化などの神経画像からの洞察を含む、初期疾患のバイオマーカーを同定する機会を提供し得る(Sabbagh et al 2013)。
図1 MRI、fMRI、DTIという撮像法の違い
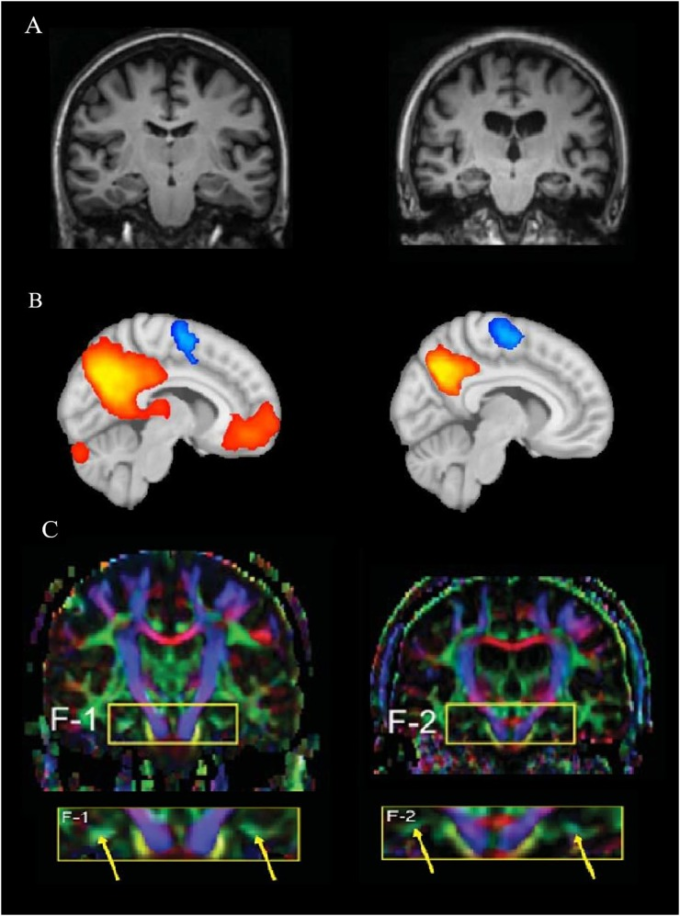
(A) 健康なヒトの脳(左)とアルツハイマー病(アルツハイマー病、右、大石 et al 2011)の病理学的変化との構造的MRIの比較。(B) 健康な人の脳(左)の安静時ネットワークの脳活性化を、仮説的なアルツハイマー病の脳活性化(右)と比較した機能的MRI。コネクティビティマップの表現は、デフォルトモードネットワーク(DMN)内の病理学的な状態に応じて脳活動がどのように低下するかを示しており、赤/オレンジは高いコネクティビティを、青は逆相関性のある活動を示している。C)認知的に健康な女性(72歳、左)とアルツハイマー病の女性(70歳、大石 et al 2011)の比較。黄色の矢印は、DTI解析後の帯状海馬部の色の強さの違いを示している。(A,C) Oishi er al)。 (2011)よりIOS Pressの許可を得て転載。この出版物は、IOS Pressのhttps://content.iospress.com/articles/journal-of-alzheimers-disease/jad0007 から入手可能である。
拡散テンソルイメージングは、水分子の拡散を測定するMRIベースの神経画像法であり、白質の繊維束構造の評価を可能にする(Jones et al 2013; Teipel et al 2016)。この手法により、例えばアルツハイマー病のある高齢者とない高齢者の間で、認知力の低下が明らかになる前に、特定の集団グループにおける白質路接続の強さや違いを比較することができる(Jones et al 2013)(López-Gil et al 2014)(図1C)。生活の上で脳の整合性にさらに洞察を得るために現在使用されている他の構造画像パラメータは、頭蓋内容積と白質の存在と数が含まれているハイパーintensities (Bartrés-Faz と Arenaza-Urquijo 2011)。
機能的MRI(fMRI)は、被験者が安静時や作業中に脳の異なる領域の活動を同時にモニターすることができる(Binder er al)。 fMRIでは、血中酸素濃度依存性(BOLD)信号を用いて血中酸素濃度を測定する(Ogawa et al 1990; Heeger and Ress, 2002)。具体的には、神経細胞の活動が活発になるためには、より多くの酸素が必要であり、それによってfMRIで検出できる信号が生成されることが前提となっている(図1B)。このように、MRIを励起してから1~2秒遅れて酸素濃度、脳血流(脳血流)容積(CBV)の変化を測定することができる。これを血行動態反応と呼ぶ(Buxton et al 2004)。脳の異なる領域からのBOLD信号が類似した同期した活動を示す場合、これらの領域は互いに通信して情報を伝達していると考えられ、これを機能的接続と定義する(Raichle, 1998)。機能的接続性は、空間的に離れた皮質脳領域間の時間的な相関関係として定義され、BOLD信号の低周波部分の変動によって明らかにされる(Ogawa er al)。 加齢とともに、機能的な接続ネットワークは徐々に減少していく(Dennis and Thompson, 2014)が、これは、初期のアルツハイマー病や、高齢の脳が追加の疾患プロセスに多かれ少なかれ影響を受けやすくなる一連の脳の変化を理解する上で重要である可能性がある。
安静時fMRIは、様々なコホート間の違いを研究するために採用される頻度の高い方法であり、安静時の脳の活動を調査するものである。安静時fMRIは、機能空間における脳の異なる領域の動作や情報の処理の仕方を調べることができる。また,安静時fMRIはタスク関連fMRIに比べて個人への負担が少なく,適用しやすいという利点もある(Sheline and Raichle, 2013).患者は横になった状態で目を閉じたまま眠りに落ちないように指示される。
安静時fMRIの解析には様々なアプローチがある。例えば、シードベース解析(Beckmann et al 2005)は、関心のある選択領域(シード領域)と脳の残りの部分との間のBOLD信号を調べる(Biswal et al 1995)。アルツハイマー病では、前楔前野は、非認知症の対照群と比較して、左海馬、左傍海馬、前帯状皮質、直腸回などの他の脳領域との機能的な接続性が低下していることが示されている(Sheline and Raichle, 2013)。脳全体の神経細胞の同時接続の調査は独立成分分析(ICA)と呼ばれ、完全にデータに基づいた分析の形態である(Beckmann et al 2005)(図2)。ICAに基づく分析を用いて、Greicius et al 2004)は、健常な高齢者と比較して、アルツハイマー病群では海馬と後帯状皮質(PCC)間の安静時機能的接続性が低下していることを報告した。
図2 脳スライスの空間マップは、DMNにおける脳の活動を示すものである
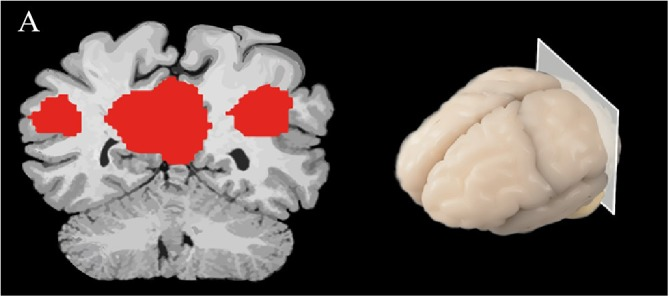
安静時の機能的接続性を調べるために使用される別の手法として、脳内の複雑な相互作用を具体的に可視化する方法を用いたグラフ解析がある(Mijalkov et al 2017)。グラフ理論を用いて、機能的接続性は、一連の「ノード」(ボクセル)と「エッジ」(ノード間の相関活性)として表現される(Watts and Strogatz, 1998; Stam et al 2007)。低周波振動を用いたヒトのfMRI研究における小世界ネットワークは、脳構造の接続性を明らかにする可能性があると予測されている。このような小世界ネットワークの解析では、脳内ネットワークを構成する2つのノード間を移動する平均最小辺数を「有効経路長」と呼ぶ。小世界ネットワークの特徴は、クラスタリング係数、高集積であり、その典型的な特徴は有効経路長が短いことである(Travers and Milgram, 1967; Rubinov and Sporns, 2010; Kaminski and Blinowska, 2018)。クラスター係数は、局所的に相互接続されているノードの測定値として記述される(Kaminski and Blinowska, 2018)。このアプローチは、構造的および機能的連結性の違いを測定し、比較する場合に特に有用であり(Bullmore and Sporns, 2009)神経変性疾患の病理学の理解を進めるために使用され得る(図3A)。グラフ理論解析のもう一つの利点は、空間内の任意の2つのノードがどれだけ近いかについての仮定をしないことである。
図3 ネットワーク組織間の違いをグラフ理論的アプローチで示す
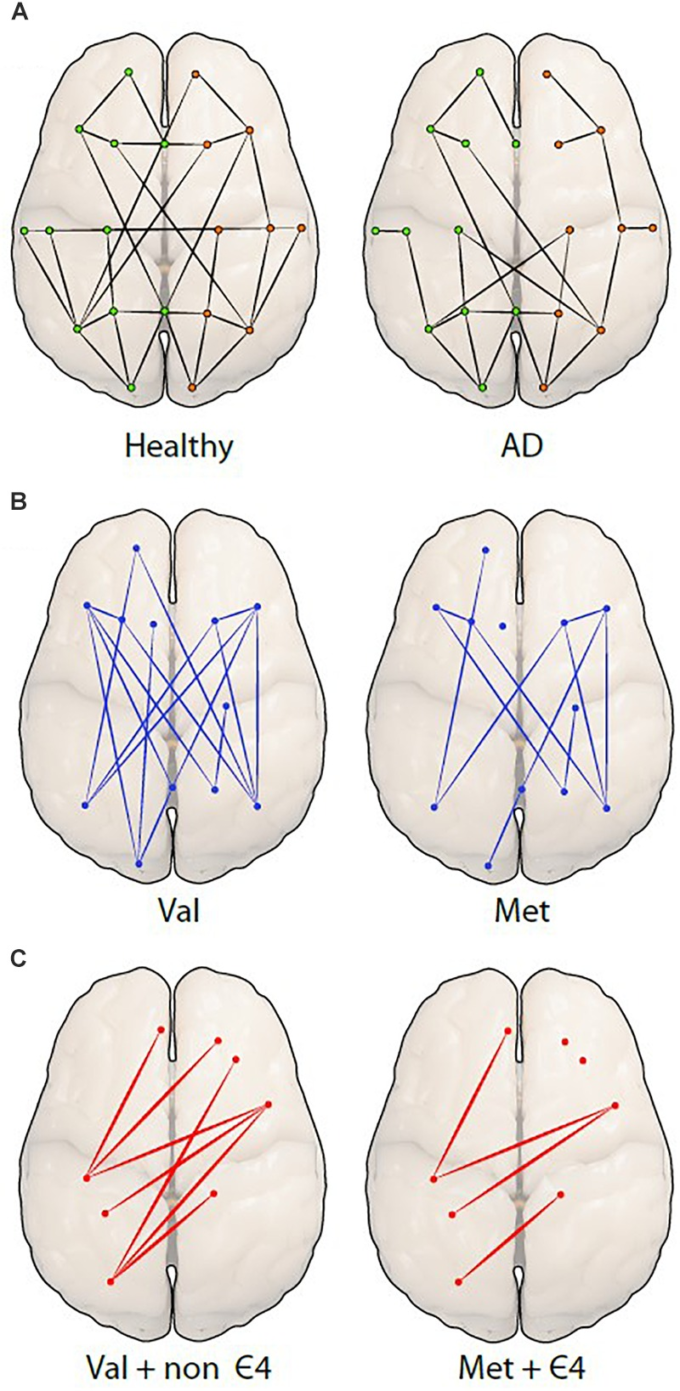
A)健康な人(左)とアルツハイマー病の人(右)のグラフを比較し、空間的に離れた脳の領域(ノードやドット)間のつながり(エッジ)がアルツハイマー病の方が少ないことを示している。緑(左)とオレンジ(右)のドットは半球を表している。
次の2つの図は、BDNF Val66Met多型(B)の仮説的な図で、Metキャリアでは接続が顕著に減少している。最後の図は、BDNFとAPOEの両方を担持した場合(C)個人のエッジとノードの明確な減少を示している。
アルツハイマー病における構造的・機能的連結性の変化
構造的接続性
アルツハイマー病では、ニューロン間の接続の喪失は、萎縮、代謝低下、NFTの蓄積などの他の構造的変化をもたらす可能性がある(Zhang et al 2009)。MRIによって同定されたアルツハイマー病における著しい萎縮は、デフォルトモードネットワーク(DMN; Greicius et al 2003)に関与する3つの構造のうちの後海馬と側頭・頭頂皮質で起こる。デフォルトモードは、個人がタスクに従事していないときに、自発的に過去や未来の出来事を考えているときに活性化される脳内ネットワークである(Buckner et al 2008)。DMNは高度に相互接続された皮質領域の集合であり、特に注意ネットワークが非活動的なときには、実質的な相関性のある活動を示す(Shulman et al 1997; Buckner et al 2008)。
アルツハイマー病患者の白質変化を調査する拡散テンソルイメージング研究は、この病気がMTLにおける白質繊維束の劣化を引き起こすことを実証している(Zhang et al 2007)が、それは明らかなエピソード性記憶障害(Sexton et al 2010)、実行機能障害(Reijmer et al 2014)、および認知障害の他の症状(Zhang et al 2007; Fischer et al 2015)よりも何年も前に存在する可能性がある。同様に、動物モデルにおいて、(López-Gil et al 2014)は、障害された執行機能の発現が起こる前の慢性高血圧ラットの構造ネットワークにおける神経細胞の違いを報告しており、これは認知症の初期段階の洞察を提供する可能性がある。さらに、Grandjean et al 2014)は、脳アミロイドβを有するトランスジェニックマウスにおいて、フラクショナル異方性値の減少を発見した。潜在的に早期アルツハイマー病の病理学的相関関係である脳内アミロイドβが上昇した認知的に健康な個体では、構造的変化は、構造的ネットワーク接続性のトポロジーの点でMCIの個体と類似しているように見える(Fischer et al 2015)。興味深いことに、あからさまな認知症状がないにもかかわらず、脳のアミロイドβ負荷が高いこれらの個体は、萎縮や皮質グルコースの減少などの主要な神経変性特徴がない場合でも、白質ネットワークにおける最短経路長の増加を示した(Fischer et al 2015)。
最後に、より少ない接続(またはエッジ)を有するアルツハイマー病を有する個体の構造的ネットワーク(またはノード)は、より多くの接続を有する個体よりも、白質路のグローバルな破壊の影響を受けやすかった(Daianu et al 2015)。さらに、変異ヒトアミロイド前駆体タンパク質(APP)およびプレセニリン遺伝子を有するラットトランスジェニックモデルもまた、非トランスジェニックラットと比較して、局所的および大域的な効率の低下、およびクラスタリングの減少を示した(Muñoz-Moreno et al 2018)。さらに、Muñoz-Moreno et al 2018)は、これらのトランスジェニックラットで右内側PFCの変化を発見し、一方、ヒトの研究では、アルツハイマー病における右内側前頭皮質領域は、健康なコントロールと比較して結節効率の低下を示した(Lo et al 2010)。要約すると、構造的連結性の変化は、機能的連結性ネットワークの強さと同様に、白質束の劣化を予測するのに有用である可能性がある(Greicius et al 2009)。
機能的連結性
認知機能の多くのドメイン内のパフォーマンスは、加齢とともにゆっくりと低下するが、重要なことに、より高い認知パフォーマンスは、高齢者における機能的接続性の増加と相関している(Arenaza-Urquijo et al 2013)。動物実験と比較して、トランスジェニックADラットモデルは、非トランスジェニックラットと同じパフォーマンスを達成するために、より長い認知訓練を必要とする。構造ネットワークは変化したが、これらの変化は、学習能力と脳内の機能ネットワークの再編成との間の関連を提案する機能ネットワークの違いには至らなかった(Muñoz-Moreno et al 2018)。それにもかかわらず、海馬と内側前頭前野皮質(PFC)の間の機能的接続性の段階的な低下は、加齢とともに予想される(Damoiseaux et al 2016)。
アルツハイマー病で観察されるような脳内機能ネットワークの断絶は、神経変性疾患の初期段階の存在、特に脳内のアミロイドβの異常蓄積に関して、重要なマーカーとなり得ることが提案されている(Stam et al 2007;Zhang and Raichle 2010)。安静時研究では、健常高齢者でアミロイドβ負荷を有する人では、後中隔領域、腹内側PFC、右角回、左中上前頭回の機能的連結性が低下していることが報告されている(Mormino et al 2011)ほか、前帯状突起と左海馬、傍海馬、前帯状突起、直腸回、後帯状突起間の機能的連結性が低下していることが報告されている(Sheline et al 2010a,b)。高齢の健康な人では、特に楔前野に早期にアミロイドβが蓄積し、海馬機能の障害をもたらすことが示唆されている(Sheline et al 2010a,b)。対照的に、Mormino et al 2011)は、アミロイドβ蓄積のある高齢の非健常者において、より高いアミロイドβ蓄積の存在に対してDMNの接続性が様々な形で応答することを報告している。具体的には、右後内側PFC、左前内側PFC、左側頭領野の領域でDMNの接続性が増加し、いくつかの後中位領域、腹内側PFC、右角回、左前頭回でDMNの接続性が低下していることを発見した(Mormino et al 2011)。DMN内の障害は、アミロイド負荷の高い健康な高齢者でも発見されている(Hedden et al 2009)。興味深いことに、これらの健康な個人(n = 38)は、MCIを持つ個人の半分(n = 46)とアルツハイマー病を持つすべての個人(n = 35)と比較して、同じ量のアミロイドβ負担を示した。
このような関連性は、動物モデルでも調査されている。Bero et al 2012)は、野生型マウスの後頭葉皮質における両側機能連結性の加齢に関連した減少を示したが、これは記憶能力との有意な関連性から神経機能障害の既存のバイオマーカーである可能性がある(Corcoran et al 2011)。興味深いことに、皮質アミロイドーシスを含むトランスジェニックADマウスモデルでは、特定の脳領域における機能的連結性の加齢による低下は、より高いアミロイドβ沈着の存在下でより深刻であることが示されている(Bero et al 2012)。Grandjean et al 2014)もまた、トランスジェニックマウスにおける機能的接続性の低下を報告しているが、この低下は、体性感覚野および運動野におけるアミロイドβの蓄積の前の初期の数ヶ月に現れた。
全脳の接続性を調査した研究では、アミロイドβ負荷のある健常な軽度認知障害者では、側頭頂皮質と楔前部/PCCの皮質ハブに異常が見られた(Drzezga et al 2011)。一般的に、より大きな萎縮は脳の接続性の低下と関連している(Hoffstaedter et al 2015)が、すべての研究でこの関連性の支持が得られているわけではない。例えば、Gili et al 2011)の研究では、機能的接続性の低下は、MCI患者のPCCにおける灰白質萎縮の量とは関連していないことが報告されている。
機能的ネットワーク間の断絶は、アルツハイマー病の必須バイオマーカーである可能性がある。例えば、アルツハイマー病患者では、下側頭葉皮質(ITC)前庭筋、右視床とPCCの間の機能的接続性の断絶が見られる(Zhang et al 2009年)左海馬とPCCの間の断絶が見られる(Sorg et al 2007年)右海馬と左右のクネウス、前庭筋、右ITCの間の断絶が見られる(Wang et al 2006)などが挙げられる。断絶のこのパターンは、記憶、処理速度、および実行機能の障害と関連している可能性が高い(Damoiseaux et al 2016)。もう一つ提案されているアルツハイマー病の初期バイオマーカーは、視覚野内で確認されている障害、特にPCCと背側と腹側の視覚経路間の接続性の障害にある可能性がある(Zhang et al 2009)。これらの変化は、アルツハイマー病における視覚機能の悪化につながることが示唆されている(Zhang et al 2009)。
アルツハイマー病における小世界ネットワーク解析では、年齢をマッチさせた非発達者と比較して、中枢、側頭、前頭の脳領域の経路長が長いことが示されている(Stam et al 2007)。クラスタリングとも呼ばれるネットワーク内の局所的な接続性の低下もまた、アルツハイマー病患者で報告されており、認知パフォーマンスの低下と相関している(Stam et al 2007)。この発見により、Stam et al 2007)は、アルツハイマー病の初期段階にある個人がスモールワールド・ネットワークのトポロジーが相対的に低下している可能性があると推測した。最近の研究では、MCIとアルツハイマー病の個人が健常なコントロールと比較して、より長い特徴的な経路長を持っていたことを実証することによって、この概念のサポートを発見した(Mijalkov et al 2017)。さらに、アルツハイマー病は、コントロールと比較した場合、ローカルノードの効率の増減と同様に、地域的にノードに接続するエッジのより多くの数と関連しているように見えた(Mijalkov et al 2017)。ネットワークトポロジーのこれらの違いを理解するためには、脳の組織に影響を与える可能性のある遺伝的変異を考慮する必要があり、それはまた、アルツハイマー病の神経変性にリンクしている可能性がある(図3A)。
機能的接続性におけるアルツハイマー病に関連する遺伝的要因の役割
アポリポ蛋白E(APOE)
アポリポタンパクE(APOE)特にAPOE ε4対立遺伝子のような遺伝子関連因子の遺伝は、アルツハイマー病のリスクの増加と関連している(Mahley et al 2006,この遺伝的多型は、脳内のアミロイドβ沈着の増加と関連している(Mahley et al 2009,Morris et al 2010,Sheline et al 2010a)。2009; Morris et al 2010; Sheline et al 2010a)おそらく脳機能的な結合性に影響を与え(Mahley et al 2009)高齢になると認知機能に影響を与える(Wisdom et al 2011)。
安静時fMRI研究では、健常者におけるAPOE多型と機能的接続性との関連性は、サンプル群の年齢に関連している可能性があると報告されている(Goveas et al 2013; Wu et al 2016)。例えば、APOE ε4対立遺伝子は、認知的に健康な個人におけるDMN機能的連結性の増加および減少の両方と関連している(Fleisher et al 2009)。APOEε4を保有していない中年(50~65歳)と非保有者を比較すると、ε4保有者は中前頭前野において高い機能的連結性を示し、一方、非保有者は右内側前頭前野においてより大きな機能的連結性を有していた(Wu et al 2016)。逆に、(Goveas et al 2013)は、認知的に健康なAPOE ε4キャリア(44~65歳)のDMN内の機能的接続性が、両側背内側PFC、上前頭回、左海馬で減少し、左葉状核と両側尾状核で機能的接続性が増加したことを示した。さらに、DMN内の大脳半球間機能連結性の低下は、健康な高齢者APOEε4キャリア(65〜80歳;Lu et al 2017)で認められた。注目すべきことに、これらの領域の大部分はアルツハイマー病においても影響を受けており、これはアルツハイマー病の前臨床段階におけるDMNの関与の重要性を強調している(Sheline et al 2010a)。より最近、(Zheng et al 2018)は、APPs/プレセニリン-1/2変異キャリアまたはAPOEε4陽性キャリアであった若年成人の機能的連結性を、これらのアルツハイマー病関連遺伝因子を持たない成人(18〜35歳)と比較して調査した。興味深いことに、APOEε4キャリアとAPP/プレセニリン-1/2変異キャリアの両方において、健康なコントロールと比較して、より大きな機能的連結性が観察された。この結合性の増加は、左海馬と両側内側PFC/前鞍部の間に認められた。APOEε4キャリアのみが右海馬と左中側頭回との間の接続性の増加を示した。ここで著者らは、若年者における機能的接続性におけるAPOEε4の「有益な」効果は、認知障害の補償メカニズムによるものである可能性があり、加齢とともに有害になる可能性があることを示唆している。
公表されているエビデンスには矛盾があるため、APOE多型が他の機能的接続性の指標とどのように関連しているかを検討することが重要である。小世界ネットワークにおけるAPOE効果を調査した研究では、健康な高齢のε4キャリアでは、非ε4キャリアと比較して、より少ない機能的ハブの感受性が高く、中心性が低下していることが報告されている(Seo et al 2013)。地域的な脳内グルコース代謝、全脳機能ネットワークのクラスタリング、および経路長は、すべてε4キャリアで減少することが報告されている(Seo et al 2013)。しかし、147人の認知的に正常な個体のより大きなサンプルサイズを用いた研究では、非キャリアと比較して、ε4キャリアではより多くのクラスタリングとより長い経路長が同定された(Goryawala et al 2015)。また、非キャリアのε4キャリアは頭頂葉と側頭葉でより多くの長距離接続を示したのに対し、非キャリアのε4キャリアは頭頂葉と後頭葉でより多くの短距離接続を示した。また、ε4対立遺伝子を持つ健康な高齢者は、前頭葉の接続部で短距離接続が少ないのに対し、両群とも前頭葉でより多くの長距離接続を示した(Goryawala et al 2015)。まとめると、本研究では、APOEε4を保有する者の脳ネットワークは、非保有者と比較して、前頭葉の接続が少なく、構造的に長い長さの接続が多い異常な構造に組織化されており、これがAPOEε4の否定的な認知表現型を部分的に説明する可能性があることが判明した。
脳由来神経栄養因子(BDNF
アルツハイマー病に関連するもう一つの遺伝因子はBDNF遺伝子である(Brown er al)。 BDNFタンパク質は神経成長因子のファミリーに属し、神経新生に影響を与える(Erickson et al 2010)だけでなく、長期増強(LTP)や活動依存性シナプス可塑性にも影響を与える(Egan et al 2003)。アルツハイマー病の死後の研究では、年齢をマッチさせた認知的に無傷の対照者と比較して、BDNFタンパク質レベルが海馬、側頭葉皮質、側頭葉、前頭葉、頭頂皮質で低下していることが示されている(Connor et al 1997; Garzon et al 2002)。BDNF濃度の低下は海馬の体積減少に関連しているかもしれないが(Erickson et al 2010)これはアルツハイマー病で起こる他の病理学的変化に二次的に関係しているかもしれない(Buchman et al 2016)。BDNF濃度は個人間で非常に変動し、生理的状態との相対的なものである;例えば、身体運動後、末梢血BDNF濃度が上昇する(Dinoff et al 2016)。最近のレビューは、トレッドミル運動後のラットおよびマウスの海馬における神経新生および可塑性の増加を報告することによって、この知見を支持し、それによって短期および長期記憶機能の改善がもたらされた(Jahangiri et al 2018)。
BDNF遺伝子における共通の一塩基多型、具体的にはコドン66におけるバリン-メチオニン置換(Val66Met)は、活性依存性BDNF分泌と同様にLTPに影響を及ぼす(Egan et al 2003)。BDNF Val66Metは、認知パフォーマンスだけでなく、アルツハイマー病の脳形態にも関連している。特に、アルツハイマー病の前臨床段階にあるBDNF Met遺伝子キャリア(60歳以上)は、Valホモ接合体と比較して、記憶機能の低下と海馬および側頭葉体積の減少を示した(Lim et al 2013;Brown et al 2014)。著者らはまた、Valホモ接合体ではより多くの運動が海馬および側頭葉体積の増加と関連しているが、Metキャリアでは関連していないことも観察した(Brown et al 2014)。特に、Metキャリアでは、身体活動は側頭葉の体積の減少と関連しており、これはより多くのアポトーシスの変化によるものと考えられる(Brown et al 2014)。同様に、Egan et al 2003)は、BDNF Met対立遺伝子が海馬の質的変化に関連していることを実証しており、これは記憶機能の不十分さを引き起こす可能性がある。アミロイドβとBDNF Val66Metとの間には、BDNF多型がアミロイドβ神経毒性の脳への影響を媒介する関係があるのではないかとの研究が提案されている(Fahnestock, 2011)。Lim et al 2013)は、海馬体積の萎縮速度が速いだけでなく、BDNF Metを持つがアミロイドβのレベルが低い健常者と比較して、アミロイドβ負荷が高いBDNF Metキャリアでは、36ヶ月間の間にエピソード記憶能力の低下が速いことを報告している。アミロイドβ負荷が低いValホモ接合体と比較して、アミロイドβ負荷が高いValホモ接合体では認知機能が低下しており、Valホモ接合体であることで認知機能の低下を防ぐ必要はないことが示唆された(Lim er al)。
遅発性うつ病の高齢者では、BDNF Metのキャリアは、両側の海馬と小脳の間の安静時機能連結性の低下と関連していた(Yin et al 2015)。晩期うつ病のBDNF Metキャリアもまた、海馬と側頭皮質間の強い(正の)機能的連結性の低下を示したが、海馬と背側前帯状皮質、背側部PFC、角回間の反相関(負の)機能的連結性の増加も認められた(Yin et al 2015)。同様に、Wang et al 2014)は、認知的に健康なBDNF Metキャリアにおいて、背外側PFCと前島皮質の間の機能的接続性の上昇を観察した。最後に、Park et al 2017)は、BDNF Val66Met多型が中年健常者の構造ネットワークに与える影響を調査した。著者らは、解析においてノードとエッジを対象とし、白質ネットワークの操作をシミュレートした。彼らは、Valホモ接合体はMetキャリアと比較して、より強固で灰白質損傷に対する耐性が高いことを実証した(Park et al 2017)。白質ネットワークの研究は、BDNF MetキャリアがValホモ接合体よりも結節障害を受けやすいことを決定した(Park et al 2017)。
BDNF MetとAPOEε4多型の相互作用は、健康な高齢者、およびMCIおよびアルツハイマー病を有する個人において、Gomar et al 2016)によって調査された。ここで著者らは、BDNF Met対立遺伝子が、主に記憶と意味的流暢性において、より低い認知パフォーマンスと関連していることを発見した。これを裏付けるように、Ward et al 2014)はBDNF Metキャリアにおいて、エピソード記憶機能におけるパフォーマンスの低下を見いだしたが、APOE ε4対立遺伝子を保有している場合のみであり、後者はおそらく両方のリスク対立遺伝子を保有していることによる累積的な影響を表している。この累積的な影響は、脳の機能的ネットワークに影響を与え、異なる脳領域間の接続を低下させている可能性がある。BDNF Metキャリアは、BDNF Valホモ接合体と比較して接続が少ない可能性があり(図3B)APOE ε4/BDNF Metキャリアは、非ε4/BDNF Valホモ接合体キャリアと比較して接続がさらに少ない可能性があり、接続性が低下する可能性がある(図3C)。
別の研究では、脳のアミロイドβレベルが高いBDNF Met/APOEε4キャリアは、BDNF Met/非APOEε4キャリアと比較して、言語および視覚的エピソード記憶および言語処理において、54ヶ月間にわたってより速い低下率を示した(Lim et al 2015)。これと比較して、高アミロイドβ負担のBDNF Val/ε4キャリアは、認知機能の比較的軽度の低下を示した。高アミロイドβ負荷を有するBDNF Met/APOEε4キャリアでは、記憶障害は3年後に検出可能であるのに対し、高アミロイドβ負荷を有するAPOEε4-/BDNF Valホモ接合体では、同じ臨床閾値に達するまでに10年かかる(Lim et al 2015)。最近のメタ解析では、APOEとBDNF Val66Metとの関係を調査し、BDNF Met多型を有するアルツハイマー病患者の女性の方が多いと結論づけた(Zhao er al)。 しかし、APOEε4キャリアとBDNF Metキャリアの間の有意な関係は、アルツハイマー病患者の男女を含む全体解析では確認されなかった。
APOE多型とBDNF多型は互いに相互作用し、機能的連結性に影響を及ぼす可能性がある。APOE ε4対立遺伝子を有するBDNF Metキャリアは、MTLでの脳活性化の低下を示した(Kauppi et al 2014)。特に内耳皮質における萎縮、およびアルツハイマー病病理の加速は、APOEε4を有するBDNF Metを有する個体における脳の補償機構の不良と関連している(Gomar et al 2016)。Ward et al 2015b)は、BDNFとAPOEが認知機能と認知的予備力に及ぼす影響を調査したが、これは、神経ネットワークが失われたニューロンや接続を補償する理論的な構成である後者のものである(Stern, 2002)。著者らは、BDNFのVal66Met多型はAPOEの変異体ではなく、執行機能と認知的予備力との関係を緩和することを観察した。別の研究では、Ward et al 2017)が同じ健康な高齢者サンプルを調査したところ、BDNF Valホモ接合体では、認知的予備群間の実行機能の差は時間の経過とともに小さくなったが、BDNF Metキャリアでは認知的予備群に関連した差がより顕著になった。これらの結果の説明は、認知的予備力がBDNF Val66Met多型に応じて異なる認知効果を有する可能性があることである(Ward et al 2017)。全体として、実験的研究は、BDNF多型が、発達および活動依存性学習に関連する主要な神経生物学的プロセスに影響を与えることを示している(Egan et al 2003)。
認知予備力と脳の接続性
BDNF 遺伝子の共通の変異は、ライフコースを通して構造的・機能的ネットワークの発達と維持に違いをもたらし、最終的には アルツハイマー病 のような神経変性疾患プロセスに対する脳の回復力の良し悪しに関連している可能性がある。発達と成人の脳の可塑性におけるBDNFの役割を考えると、この遺伝子の変異は、おそらくニューロンが障害されたニューロンや失われたニューロンを補う認知的予備力(Stern, 2002, 2006)の理論的な構成に関連して、病理に対する抵抗力の根底にある接続性のパターンの構築に影響を与えている可能性もある。
Stern (2002, 2009) は、障害や神経変性によって障害を受けた脳に関連して、2つの異なる種類の予備能を提案している。脳または神経予備能は、予備能の「受動的」モデルと呼ばれることが多く、解剖学的な脳構造、特に脳の大きさ、ニューロンとシナプスの数と構造に焦点を当てている(Katzman, 1993)。このモデルは、後にSatz (1993)によって改訂され、より高いシナプス数、樹状突起の分岐とより大きな脳体積を持つ個人は、機能的な結果なしでより多くのニューロンの損失に耐えることができるはずであり、アルツハイマー病の病理学的変化の補償を提供することを提案した(Stern, 2009)。脳の予備能モデルは、その能力の大部分が人生の初期、通常は5歳までに確立されることを示唆している(Reiss et al 1996)。それにもかかわらず、脳の予備能は修正可能であることが調査で明らかになっている。例えば、成体サルの脳は、生涯を通じて細胞を形成し、更新することができ(Eriksson et al 1998年)ヒトの脳もまた、特に歯状回において神経発生能力を有することが提案されている(Kempermann et al 2015)。
予備能の「能動的」モデルは、しばしば「認知的予備力」と呼ばれ、これは、蓄積する病理学的変化に対する脳の機能的回復力に関連する仮説的な構成である(Stern et al 1999)。認知的予備力の理論によると、より複雑な神経ネットワークを持つ脳は、より高いレベルの冗長性を内蔵しており、それによって変性や失われたニューロンを補うことができるとされている(Stern, 2002, 2006)。生涯経験、教育や職業の達成度、社会経済的地位などの要因は、認知的予備力の発達に重要な役割を果たすと考えられている(Stern, 2009, 2012)。例えば、アルツハイマー病とより高い認知的予備力(教育レベル)を有する個人は、アルツハイマー病とより低い教育レベルを有する個人と比較して、より大きなDMN接続性を有していた(Bozzali et al 2015)。一方、(Bastin et al 2012)は、高学歴の健常者では側頭頂皮質の脳病理が多く、代謝の活性が低下していると判断した。さらに、(Brayne et al 2010)は、脳内病理負担の蓄積量は教育修了年数の影響を受けないとしているが、教育到達度が高いと病理負担を背景に認知症を発症するリスクが低いことを明らかにしている。
認知刺激的な活動に生涯従事することは、認知症発症リスクを40%低下させる可能性がある(Scarmeas and Stern, 2003; Valenzuela et al 2011)。これを裏付けるように、Jahangiri et al 2018)は、さまざまな動物モデルにおいて、運動は記憶機能の改善だけでなく、神経変性疾患の発症リスクの低下と関連していることを指摘している。ヒトを対象とした研究では、(Larsson et al 2017)は、教育到達度の高い個人の方がアルツハイマー病発症リスクが低いことを報告した。同様に、健康な参加者(50~79歳)では、それ以上の大学教育を修了していない人と比較して、人生の後半の教育(少なくとも12ヶ月間の大学での学習)は、認知的予備力(現在の心理アセスメントスコアによって推定される)と正の関連があった(Lenehan et al 2016))。学歴と年齢との間の関連は、特に注意力とスピード処理の領域において明らかである(Perry er al)。 これらの知見に沿って、Summers et al 2017)は、少なくとも12ヶ月間大学に通っていた50歳以上の個人の92.5%が、認知予備力の代理となる可能性のあるドメインで認知パフォーマンスの上昇を示したことを明らかにした。
Stern(2009)は、認知的予備力が高いアルツハイマー病の個人は、より柔軟性のある神経ネットワークを持っており、神経病理学的負荷が増加しても、より高いレベルの認知パフォーマンスを保持するだろうという仮説を立てた。この神経の柔軟性という概念は、認知的に健康な高齢者で観察される脳の機能的ネットワークの再構成性において、潜在的に実証される可能性がある(Bosch et al 2010)。健康な高齢者を対象としたこの研究では、高い認知的予備力はDMNの脳活動の増加と関連していたが、音声理解に関連する領域の脳活動の減少とも関連していた。対照的に、MCIやアルツハイマー病の人では、DMNの活性が低下し、被験者の言語処理の活性が高くなることが認知的予備力の高さと関連していた(Bosch et al 2010)。
教育と認知的予備力は、機能的接続ネットワーク(Marques et al 2016)と認知機能(Bozzzali et al 2015)に正の影響を与える。認知的予備力レベルの高さはワーキングメモリと関連していたが、年齢は認知に負の影響を与えていたという証拠がある(Ward et al 2015a)。認知的予備力の高さは、健康な高齢者において、より大きな機能的連結性と関連している(Marques et al 2016)。Arenaza-Urquijo et al 2013)は、認知的に健康な高齢者集団(60~80歳)を調査し、早期の正規教育を受けた年数が多い人の方が、より良い脳代謝、より高い灰白質体積、および機能的接続性の向上を報告した。特に、著者らは、教育年数が多い人では、前帯状皮質、右海馬、右PCC、左下前頭葉、左角回などの領域において、より高い機能的連結性が認められた。
(Marques et al 2015)も同様に学歴と機能的接続性の関係を調べたところ、学歴の高い人はより大きなネットワークを持っていることがわかった。これらの拡大したネットワークは、各半球の全葉に接続されており、機能的接続にプラスの影響を与えており、年齢が脳の接続性に及ぼす影響を緩和すると予測されていた(Marques et al 2015)。さらに、(Marques et al 2016)は、健康な高齢者120人を対象に、性別と教育年数[人口統計学的特徴(DEM)として用いた]が脳の機能的ネットワークに影響を与えるかどうかを調査した。その結果、DEMは局所的(近傍領域)に、ノードの強さ、効率性、クラスタリング係数に正の効果があり、後頭葉と頭頂葉のネットワーク内でより大きなコミュニケーションを示すことが示された。また、DEMとネットワークの伝達性との間には、教育を受けた人ほど異なる神経処理を用いていることを示す関係が見出された(Marques et al 2016)。ネットワークの伝達性とは、ネットワークの中でエッジを介して互いにリンクしている2つのノード間の接続と定義されている。
さらに、(Marques et al 2016)は、教育到達度によって測定された認知的予備力が安静時fMRIにおける機能的接続性にどのような影響を与えるかを検討した。彼らは、脳内の機能的接続が多いより大きなネットワークが、より高い認知的予備力と関連していることを示した。クネウスや上側頭葉、中側頭葉の領域では、より大きな局所効率とより高い局所クラスタリングが認知的予備力の高レベルと関連していた(Marques er al)。 下側頭回は、認知的予備力と正の相関を示した結節の中心性と強さの間にあることから、認知的予備力に重要な役割を持つと予測される。認知的予備力には、ネットワーク内のすべての最短経路のうち、あるノードを通過する経路の割合を「間の中心性」と呼ぶ(Rubinov and Sporns, 2010)。下側頭回は、認知的予備力ネットワークに関与する重要な機能である単語や数字の認識と視覚化を担う重要なハブである(Grotheer et al 2016)。最後に、「機能統合の指標」であるグローバル効率性(Marques et al 2016)は、より高い認知的予備力を示す個体では、認知的予備力の低い個体と比較して、より高い認知的予備力を示す個体の方が大きかった。
(Colangeli et al 2016)は、健常な高齢者、および無症候性MCI(aMCI)やアルツハイマー病において、機能的な脳ネットワークが認知的予備力と関連しているかどうかのメタ分析を行った。すべてのサブグループでの所見では、認知刺激的なタスク(認識記憶タスクなど)を実行している間に、左半球の前帯状体の機能的な脳の活性化がより大きいことが示された。しかし、認知的に健康な高齢者群では、aMCI群やアルツハイマー病群と比較して、いくつかの脳領域でより大きな活性化を示した。これらの活性化された脳領域には、左前帯状体と左前帯状体、右帯状体回、および背外側PFCの上前頭回が含まれており、これらはすべてアルツハイマー病およびaMCIと診断された人の変性変化の影響を受けやすい(Colangeli et al 2016)。
(Bozzali et al 2015)は、健常者、aMCI、アルツハイマー病患者(平均年齢74.6歳)において、認知的予備力が安静時の機能的接続性を修飾するかどうかを調査した。機能的接続性は、DMN内の認知的予備力の代理である教育と関連していた。PCC内の機能的接続性が高いことは、アルツハイマー病患者では高学歴と関連しており、教育が補償のメカニズムを開始している可能性があると考えられた。また、教育は脳の可塑性につながり、PCCが萎縮しないようにサポートしている可能性がある。aMCI群の一部では、同様の接続強度を示したが、健常者群では強い機能的接続性は認められなかった(Bozzali et al 2015)。
(Franzmeier et al 2016)はまた、教育レベルが比較的高いMCI患者では、より高いグローバルな機能的接続性が存在することを示した。教育年数が多く、アルツハイマー病の進行性を有する個体は、前庭でのフルオロデオキシグルコース(FDG)-PETの低代謝を補うことができ、左前頭葉での接続性が高く、記憶のパフォーマンスも良好であった(Franzmeier et al 2017a,b)。さらに、(Franzmeier et al 2017b)は、教育到達度が高く、アミロイドβレベルが高いMCI患者では、年齢と性別をコントロールした場合、大域的な左前頭前野の接続性が高いことを示したが、健常者では、大域的な左前頭前野の接続性は、前楔前野の代謝とは関係がないことを示した。左外側前頭前皮質とDMNとの間の負の接続性は、高学歴を達成したMCI患者でも認められた(Franzmeier et al 2017a)。(Perry et al 2017)は、教育年数と認知機能(視覚空間、実行機能、言語など)との間に正の相関があることを示したが、教育と脳ネットワークとの間には弱い関係があり、特に脳が健康な人ではすでに加齢に関連した変化の証拠を示していた。人生の後半における加齢に関連した変化に最も大きな影響を与えるのは、特に処理速度と注意力の基礎となる感覚運動ネットワークであった(Perry et al 2017)。
まとめると、人生の早い段階での教育やその他の生涯にわたる認知刺激的な活動は、神経変性疾患に対するプロテクターになる可能性があり、人生の後半で認知的予備力を強化する可能性がある(Ward et al 2015b)。
おわりに
脳は、構造的にも機能的にもつながっている複雑なネットワークの大集合である。脳のさまざまな領域が機能的な空間で情報を共有したり、伝達したりして、ネットワークを形成している。これらのネットワークは、様々な遺伝的要因や環境的要因によって悪影響を受けたり、正の影響を受けたりする。
例えば、研究では、APOE ε4が機能的接続性の低下(Lu et al 2017)および機能的ネットワークにおける経路長の延長と関連していることが報告されている(Goryawala et al 2015)。
しかし、健康なAPOE ε4キャリアで見られる経路長の減少(Seo et al 2013)および機能的接続性の増加もあった(Wu et al 2016)。同様に、健康な高齢のBDNF Metキャリアは機能的接続性の低下と関連していたが、Valホモ接合体は脳構造においてより強固なネットワークを示した(Park et al 2017)。
認知活動および環境の豊かさは、BDNF Valホモ接合体に好ましい影響を与え、時間の経過とともにBDNF Metキャリアにも好ましい影響を与える(Ward et al 2017)。
一般的に、教育と認知的予備力が脳ネットワークの機能的接続性の増加と関連しているという証拠を提供する研究が行われた(Marques et al 2016)。これは、潜在的に脳ネットワークにポジティブな形で影響を与える可能性があり、人生の後半の認知障害を緩和し、保護し、うまくいけばアルツハイマー病の発症を遅らせるか、あるいは予防する可能性がある(Prince et al 2013)。
今後の研究では、認知的予備力と環境の豊かさが、APOE ε4やBDNF Metキャリアなどのアルツハイマー病に対するより感受性の高い遺伝的多型のネットワークに影響を与え、変化させる代償メカニズムとして働くかどうかを調査すべきである。
人生の後半の教育は、認知予備力を増加させ、脳病理学へのより多くの抵抗力と回復力を提供する可能性がある。全体として、これらの知見は、脳の機能的ネットワークが遺伝的要因と環境的要因の組み合わせによって影響を受けることを示している。神経変性の変化が脳機能にどのような影響を与えるかを十分に把握するためには、これらの関係性の理解を深めることが重要であるが、神経変性の変化に対する認知的回復力がどのように促進されるかを判断するためにも重要である。
