Contents
公開日:2017年7月28日
要旨
小脳は、長い間、随意運動活動の調整と運動学習にのみ不可欠であるとみなされてきた。しかし、解剖学的、臨床的、神経画像的研究により、神経系機能における小脳の役割の理解にパラダイムシフトが起こり、小脳が認知や感情の調節にも不可欠であることが明らかになった。小脳の認知機能への寄与を理解することで、神経変性疾患や神経精神疾患における小脳の役割を探ることへの関心が高まっている。その代表的なものがアルツハイマー病である。本論文では、アルツハイマー病における小脳の神経病理学的、構造的、機能的な神経画像研究に関して、すでに多くの文献をレビューしている。また、アルツハイマー病の特徴である認知機能障害を考慮し、アルツハイマー病の病態生理と症状に関する新たな視点を提示す。アルツハイマー病の認知障害と精神神経障害には、小脳の関与があるという統合的な仮説を提唱する。この小脳の構成要素は、神経行動障害の調節障害として現れることを示唆するために、思考のディスメトリア理論を利用する。この仮説を検討し、最終的には包括的な因果関係のある臨床病理学的疾患モデルを確立するために、今後の研究への示唆を与えるものである。
小脳、アルツハイマー病、ネットワーク、認知機能、調節機能
はじめに
アルツハイマー病は最も一般的な認知症であり、認知機能および社会・情緒機能が徐々に低下していく。この認知障害は、平均して20年先行して起こる脳の変化と関連しており、記憶をつかさどるような組織化された大規模分散ダイナミックネットワーク(Buckner and Wheeler, 2001)を反映した地形パターンに従っている(Buckner et al.)
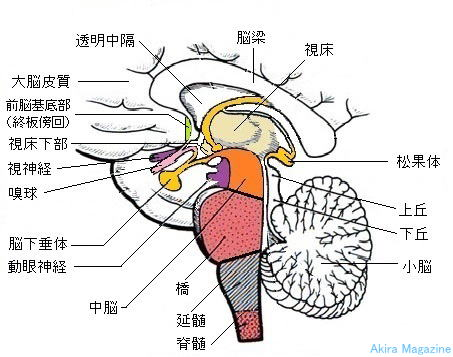
小脳の認知的役割を示す指標は、並行して行われる様々な研究から明らかになっている。進化的研究では、大脳と小脳のニューロン数が1:4の割合で相関的に直線的に増加していることが報告されている(Rilling, 2006; Herculano-Houzel, 2010; Leiner, 2010; Herculano-Houzel, 2012; Barton and Venditti, 2014; Smaers, 2014)。こうした小脳の比率の変化は、現代人においては特に後葉で顕著であり(Barton and Harvey, 2000; Whiting and Barton, 2003)、小脳を含む霊長類の脳は、認知と運動を媒介するネットワーク特異的に進化してきたという考え方の裏付けとなる(Schmahmann et al, 2001; Iriki and Taoka, 2012; Buckner and Krienen, 2013; Bruner and Iriki, 2015)。小脳認知感情症候群(CCAS; Box 1)(Schmahmann and Sherman, 1998)や小脳の神経精神医学(Schmahmann et al, 2007)の記述は、健康や病気における認知や感情に関連する神経回路に小脳が組み込まれていることを考える上で、臨床的に重みを与える。
Box 1 小脳性認知感情症候群(CCAS)
実行機能、言語処理、視覚的空間認知、感情調節の特徴的な障害を持つCCASの記述は、小脳の病変が認知、感情、人格の特徴的な変化をもたらすという事実を臨床神経科学にもたらした(Schmahmann、1998、2004; Schmahmann and Sherman、1998;Manto and Mariën、2015)。CCASの認知障害は、小脳回路への小脳の寄与が失われることで起こるとする思考障害理論(Schmahmann, 1991, 1998, 2004)により説明されてきた。小脳病変は、小脳普遍変換(UCT)を破壊し、恒常的なベースラインを中心に行動を調節することで、文脈に応じたパフォーマンスを向上させることができるとされている。小脳病変の後、神経回路の小脳成分が損傷し、振動ダンパーが影響を受け、行動が恒常的なベースライン付近で平滑化されなくなる(Schmahmann and Sherman, 1997, 1998; Schmahmann, 1998, 2004)。
Box 2 アルツハイマー病の神経病理学的特徴
アルツハイマー病の神経病理学的特徴は、神経機能障害、皮質萎縮、ひいては認知機能低下の原因となる、過リン酸化タウの細胞内凝集による神経原線維変化とアミロイドβペプチドの細胞外蓄積によるアミロイド斑である(Brack と Braak, 1991, 1997a, b; Thal et al, 2002)。これら二つの神経病理学的事象は、明確に定義された位相的順序で脳に蓄積され、それぞれが明確な空間的特徴と時間的順序を持つ(Braak and Braak, 1991, 1996; Thal et al.) 初期の剖検研究では、アミロイド斑はまず大脳皮質に存在し、病気の進行とともに皮質下領域に広がり、最終的には小脳に至ると結論づけられた。タウ神経原線維変化は、まず内側側頭部に影響を与え、その後辺縁系領域に伝播し、遅れて新皮質に至ると考えられていた。最近のアルツハイマー病の組織学的研究により、新皮質のアミロイド病理を伴わない20歳代の成人において、最初にタウが蓄積する部位が小丘であるという、異なる病理変化の順序が示されている(Box 3)(Braak and Del Tredici, 2011, 2012)。注目すべきは、小丘のタウ病理がアミロイド病理を増強する可能性があることである(Ehrenbergら、2017)。
ヒト以外の霊長類における解剖学的研究およびヒトにおける機能的MRI研究により、小脳は小脳回路によって分散型神経ネットワークに統合的に組み込まれており、様々な認知課題にわたって一貫して活性化される部位であることが明らかにされている。さらに、小脳の機能トポグラフィーは大脳皮質のそれと類似している。(Schmahmann, 1996, 1997, 2004; Stoodley and Schmahmann, 2009; Stoodley, 2012; Stoodley et al., 2012; Buckner, 2013; Balsters et al., 2014)。運動機能および感覚運動機能は前葉で、認知機能は後小脳領域で処理される。小脳は、基底膜を介したフィードフォワード投射と視床を介したフィードバック接続により、大脳の感覚運動領域と前頭前野、頭頂葉、帯状回、海馬傍回などの高次認知機能を担う領域とつながっている(Schmahmann、1996; Schmahmann and Pandya、1997; Kelly and Strick、2003)。これらの接続が認知プロセスへの小脳の関与の基質となり、プレセニリン-1(PSEN1がコードする)アルツハイマー病変異における小脳の病理が説得力のある観察結果(Sepulveda-Fallaら、2011、2014)にもかかわらず、小脳はまだアルツハイマー病の病態生理や臨床現象に関連しているとは考えられていない(Box 2)。
ボックス3 未解決の課題
アルツハイマー病における小脳の機能的関連性についての研究はまだ初期段階にあり、多くの疑問が残されている。
(i)小脳の調節能力低下の病的なイニシエーションファクターは何なのか?小脳の病態の重症度が脳幹核の病態レベルに対応していること(Coleら, 1993; Rubら, 2001, 2016; Irmlerら, 2012)、小脳凝集座から小脳への突起が保たれていること(Marcyniukら, 1986; Mannら, 1990)から、脳幹とのコミュニケーションが重要であることが示唆される。小脳全体は下垂体核と小脳座から調節入力を受け、感覚運動と記憶機能に寄与している(Berridge and Waterhouse, 2003; Sara, 2009; Hammerschmidt et al.) 小丘はタウ病理の初期部位であり、アミロイド病理を増強する可能性があると推測されている(Braak et al., 2011; Jucker and Walker, 2011; Braak and Del Tredici, 2012; Jacobs et al., 2014; Brettschneider et al., 2015; Theofilas et al., 2017)。さらに、小脳座で産生される神経調節物質であるノルアドレナリンは、他の神経伝達物質への作用を介して小脳学習の調節に中心的な役割を果たすことが示唆されている(Cartford et al.、2004)。このため、青斑核ニューロンの縮小とそれに伴うノルアドレナリンのターンオーバー速度の低下は、小脳の調節能力の低下につながる可能性がある。脳幹は認知の基盤となる小脳-小脳ネットワークの重要な部分であり、脳幹の病理学的事象は、(a)小脳皮質への求心性入力を乱す、(b)神経伝達物質のバランスと小脳の調節能力を変える可能性を持っている(Cartford et al, 2004; D’Aes and Marien, 2015; Mariën and D’Aes, 2015)、(c)小脳ニューロンやノルアドレナリンの代謝産物がアミロイドβのクリアランスを促進するので(Braak and Del Tredici, 2012)アミロイドβのクリアランスに影響を与える(Du et al.)
(ii) 標準的な神経心理学的検査やオフィスでの認知機能検査は、早期アルツハイマー病における小脳の認知・情動への影響を検出するのに十分な感度と特異性を持っているか?現在利用可能な神経心理学的検査は、大脳の病理を有する患者の認知機能を測定し、特徴付けるために設計されている(Lezak, 1995)が、認知に対する潜在的な小脳の寄与の性質や程度を評価するために設計されてはいない。その結果、患者や家族が気づいても、認知や行動の変調の早期変化を検出できないことがある(Jessenら、2014a、b;Luckら、2015)。この主観的な段階では、標準的な神経心理学的検査では、認知障害が本当に小脳機能障害から生じている場合、認知障害を見逃す可能性がある。思考障害理論は、小脳が認知に包括的な影響を及ぼすことを予測しているため、これらのテストを適応して、多くの認知領域における変調の障害を観察することが可能である。適応的認知検査には、刺激提示のペースを変えること、シーケンスや負荷を変えること、およびパフォーマンスの詳細や構造のレベル、反応時間、パフォーマンスの一貫性など、パフォーマンスのさまざまな側面を定量化することが含まれうる。このアプローチは、小脳患者で明らかになったメタ言語異常(Güell et al.、2015)、すなわち、隠喩、曖昧さ、暗黙の意味、文脈に適した文章構成を理解し生成する能力の低下によって例証されている。この結果は、初期のアルツハイマー病を検出するための予測的価値を持ち、認知と行動に対する小脳の貢献の性質に新しい洞察を与える可能性がある。
(iii) これらの観察結果はアルツハイマー病に特有のものであるか?小脳は、特定の変異型に応じて行動障害、遂行障害、言語障害を特徴とする前頭側頭型認知症患者の症状にも重要な役割を果たす可能性があり(Whitwellら、2012;Tanら、2014)、特に、小脳病理が現在よく説明されているC9orf72前頭側頭型認知症では(Mackenzieら、2014)、小脳はその役割を担っている。Guoら(2016)は、相互接続された小脳小脳機能ネットワークに対応する前頭側頭型認知症およびアルツハイマー病の変種において、小脳の局所的な萎縮領域を同定した。一方、彼らは前頭側頭型認知症の意味不明な変種では小脳の局所的な萎縮領域は観察されず、小脳に向かう皮質脳突起がない前側頭領域で主に変性することを特徴とした(Schmahmann and Pandya, 1997; Guo et al.) 今後、神経変性疾患における脳と行動の関係における領域差や小脳の役割について、さらに理解を深めるための研究が必要である。
(iv)これらの観察により、認知を改善するために脳機能を調節する新たな道が開けるかもしれない。経頭蓋近赤外光を適用した最近の動物実験では、治療群と偽薬群では小脳アミロイド病理が少なく、脳幹タウ病理が少ないことが報告されている(Purushothumanら、2015年)。また、小脳に適用される非侵襲的刺激による患者の固有結合ネットワークのアップレギュレーションは、統合失調症における安全性と原理実証試験で示されたように、情動と認知を調節する可能性がある(Demirtas-Tatlidede et al, 2010)。
(v)最後に、現在使用されている多くのソフトウェアパッケージと神経画像解析は、小脳を考慮から外しているため、本質的に結果に偏りが生じている。小脳の画像化は、その位置と形態から困難な作業であり、その結果、構造物周辺の磁場の不均一性が生じる。専用コイルと高次シミングによる高磁場MRIは、後脳領域の画質と空間分解能を向上させ、アルツハイマー病や認知・情動に影響を与える他の神経変性疾患の研究において今後使用されるべきものである。
小脳が大規模な脳機能ネットワークに関与しているという証拠と認知における小脳の臨床的関連性を考慮し、散発性アルツハイマー病とその臨床症状の病態生理における小脳の推定的役割を立証しうる証拠が文献に存在するかどうかを評価することに着手した。特にPSEN1変異による早期発症アルツハイマー病では、ミオクローヌスや錐体外路症状に加えて、運動失調などの小脳の運動現象が認められるため(Bateman et al.、2011)、早期発症アルツハイマー病における小脳の関与の可能性に関する文献についても検討した。
顕微鏡観察
小脳アミロイド病変はアルツハイマー病に共通する所見である。
アルツハイマー病変異体(AbetaPP/PS1、APPswe/PS1dE9)を持つトランスジェニックマウスは、本疾患の病態生理に光を当てている。野生型マウスは加齢に伴いアミロイド斑を形成しないが(Aso et al., 2012; Lomoio et al., 2012)、トランスジェニックマウスモデルは病気の初期に可溶性(Xiong et al., 2011)とびまん性のアミロイド蓄積を生じ(Lomoio et al., 2012)、アミロイド斑は主にプルキンエ細胞 (Brock et al., 2008) と小脳分子層(Lomoio et al., 2012)で、加齢とともに増加している。さらに、高齢になると、タウを含む神経斑も発生する。
ヒトのアルツハイマー病の病理組織学に関する初期の研究では、大脳に焦点が当てられており、アミロイド斑が小脳に検出されることは稀であった。これは、古典的な染色法の限界を反映したものと思われる。過去30年にわたる多くの研究により、より感度の高い染色技術を用いることで、小脳のアミロイドβ沈着は早期発症のアルツハイマー病で頻繁に認められることが明らかになっている。これらの沈着は、主に小脳皮質の分子層に位置し、わずかなアミロイド線維を有する拡散型アミロイドβによって特徴付けられ、一般に老人斑を含まない(Proら、1980;Azzarelliら、1985; Ogomoriら、1989;Lemereら、1996;Heckmannら、2004;Rudzinskiら、2008; Sepulveda-Fallaら、2014) (図1A、B)。
図1小脳の分子層におけるびまん性プラーク
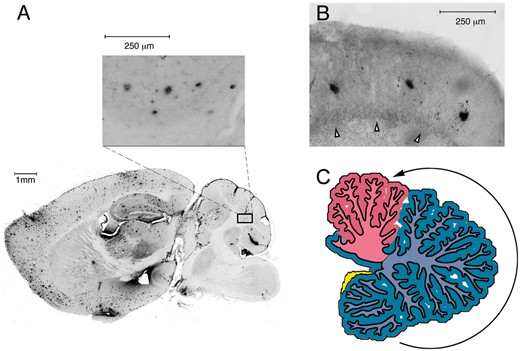
アルツハイマー病モデルマウス[575日齢、APPSwePSEN1ΔE9(85系統)(Jankowsky et al., 2004)]の小脳皮質分子層におけるアミロイドβ病理(A)小脳におけるアミロイドβ沈着(拡大図)、およびヒト(B)小脳皮質分子層におけるアミロイドβ病変を示す。ヒトの症例は、患者10(Gentier et al., 2015);84歳の女性アルツハイマー病患者(Braakステージ6)である。矢印はプルキンエ細胞層を示す。マウス:ビブラトーム切片、ヒト:ポリエチレングリコール切片、いずれも厚さ50μM以上(Bert M. Verheijen博士とFred W. van Leeuwen博士の好意による)。(C)小脳の萎縮の病期分類、後葉(青)から前葉(ピンク)へ、病気の進行中に。これは、大脳の萎縮の病期分類とそれに伴う症状の進行と並行している
小脳の分子層におけるびまん性プラーク。アルツハイマー病モデルマウス[575日齢,APPSwePSEN1ΔE9(85行目)(Jankowsky et al., 2004)]の小脳皮質分子層におけるアミロイドβ病理(A)小脳(拡大図)およびヒト(B)小脳皮質分子層におけるアミロイドβ沈着が散在していることを示している。ヒトの症例は、患者10(Gentier et al., 2015);84歳の女性アルツハイマー病患者(Braakステージ6)である。矢印はプルキンエ細胞層を示す。マウス:ビブラトーム切片、ヒト:ポリエチレングリコール切片、いずれも厚さ50μM以上(Bert M. Verheijen博士とFred W. van Leeuwen博士の好意による)。(C)小脳の萎縮の病期分類、後葉(青)から前葉(ピンク)へ、病気の進行中に。これは、大脳葉の萎縮の病期分類とそれに伴う症状の進行と並行している。
散発性アルツハイマー病においても、早期アルツハイマー病で観察されるものと同様の密度、部位、種類のアミロイド沈着がしばしば報告されている(Braakら、1989;Joachimら、1989;Dicksonら、1990;Liら、1994;福谷ら、1997;Wegielら、1999;Wolfら、1999;Wangら、2002)。ある研究では、早期発症者(Coleら、1993)では、散発性患者よりも30年早く小脳病理を示し、より重度のびまん性アミロイドβが観察されている。散発性アルツハイマー病患者でも、小脳のプルキンエ細胞層や顆粒細胞層にコンパクトなアミロイド斑が認められる。小脳のアミロイドβの程度は発症年齢と負の相関があるが、それでも66歳以降にアルツハイマー病を発症した人の発症率は75%と報告されている(Coleら、1989、1993)。このことは、より攻撃的な経過を伴う早期発症のアルツハイマー病は、小脳病変の可能性が高いことを示唆しているかもしれないが(Sepulveda-Fallaら、2014)、小脳病変を示す患者の割合が様々であることが反映されるように、遺伝的に異質なグループである(Birdら、1989)。注目すべきは、小脳アミロイドβは、他の認知症タイプや非認知症脳では見られず、これらの所見の特異性を示していることである(Braakら、1989;Mannら、1990;Suenagaら、1990;Wolfら、1999;Mavroudisら、2010)。
ほとんどの研究は、PSEN1 E280A変異を有するコロンビアの血族における2つの研究(Sepulveda-Fallaら、2011;Lalliら、2014)を除いて、小脳のタングルを報告していない。ほとんどの患者で小脳にタウ病変は認められないにもかかわらず、20世紀初頭、Cajalは小脳皮質のジストロフィー神経突起を報告している(Dicksonら、1990;Larner、1997)、アルツハイマー病との関連はまだ不明である。
大脳の線維性アミロイド斑や小脳のびまん性アミロイド斑の程度と散発性アルツハイマー病の認知障害との間に相関はない(Wegielら, 1999; Giannakopoulosら, 2003)。毒素とされる可溶性アミロイドオリゴマーは大脳連合野にのみ存在すると考えられていたにもかかわらず、散発性アルツハイマー病患者の小脳では可溶性線維性オリゴマーの存在が報告されている(Tomic et al.) 小脳の可溶性線維性オリゴマー濃度は、Mini-Mental State Examination(MMSE)の成績と逆相関し、脳プラークや脳タングルの存在と正相関していた。これらの結果は、アルツハイマー病に関連した分子変化が、おそらく前臨床期においてすでに小脳で起こっており(Mannら、1990)、アルツハイマー病の症状や病態に寄与している可能性を示す証拠となる。
巨視的観察
小脳の平均重量は、健常高齢者と比較して、早期発症および散発性アルツハイマー病患者のいずれにおいても低い(Fukutani et al, 1997; Sjobeck and Englund, 2001)。最終段階の散発性アルツハイマー病患者11名の死後調査において、小脳皮質の分子層と顆粒細胞層の体積の著しい減少、プルキンエ細胞数の32%の減少が認められ、これらは疾患の期間と重症度に相関していた(Wegielら、1999)。小脳アミロイドβの密度は小脳の萎縮と相関しないため、小脳の体積減少が小脳アミロイド、プルキンエ細胞数(Fukutani et al., 1997; Sjobeck and Englund, 2001; Andersen et al., 2012)、経神経変性(Wegiel et al., 1999)、シナプス結合の喪失(Mavroudis et al., 2010, 2013)と関連するかどうかは未確定である。
構造的神経画像:小脳の萎縮パターンは、大脳の萎縮パターンと臨床症状の進行を反映する
早期発症アルツハイマー病における構造的神経画像研究(補足表1)は、対照群と比較して、患者の小脳灰白質体積(正確な位置は特定されていない)が低いことを報告している(Canuら、2012年、Mollerら、2013年)。Reimanら(2012)は、早期発症アルツハイマー病キャリアにおいて、非キャリアと比較して小脳前葉の灰白質体積が低いことを観察している。
散発性アルツハイマー病の前駆症状である軽度認知障害(MCI)患者では、高齢者と比較して小脳灰白質容積が高い場合と低い場合の両方が観察されている。これらの矛盾は、MCI群の不均一な性質と、決定的なバイオマーカーの欠如に関連していると思われる。一般に、疾患の進行に伴い、小脳灰白質体積は減少すると考えられている。神経病理学的および神経画像学的研究の中には、小脳の神経変性過程は早期発症のアルツハイマー病に限られ、散発性患者では生じないことを示唆するものもあるが(Proら、1980;Azzarelliら、1985;Lemereら、1996;福谷ら、1997;Forteaら、2010;Reimanら、2012)、多くの研究が小脳萎縮は散発性のアルツハイマー病の特徴であることを示している。アルツハイマー病における小脳灰白質の萎縮には、予測可能なパターンがあるように思われる。初期には小脳の縦隔と後葉が侵され、進行とともに前葉が侵される(補足表1)。
小脳白質体積は灰白質体積よりも急速に減少し、これは大脳半球で観察されるパターンと類似している(Jerniganら、2001年)。早期発症アルツハイマー病における小脳白質変化に着目した研究は確認されていないが、MCIでは対照群と比較して後葉の白質完全性が低下することが報告されている(Teipelら、2010;Liら、2013;Mascalchiら、2014)。散発性アルツハイマー病患者では、白質体積の減少が前葉にまで及んでおり(Olazaranら、2013)(補足表1)、結合性の喪失が散発性アルツハイマー病の病態生理に重要な役割を果たすという仮説が支持されている(Jacobsら、2013)。
小脳体積と記憶、言語、構成的実践の指標との間に正の相関があることが報告されており、小脳の完全性の機能的意義が確認されている(Thomannら、2008年、Baldacaraら、2011年、Dos Santosら、2011年、Venneriら、2011年、Zhangら、2012年)。
早期発症のアルツハイマー病に関する小脳のデータは限られており、確固とした結論を出すことはできない。しかし、散発性アルツハイマー病では、小脳の萎縮は後葉で始まり、病気の進行とともに前葉に進行する(図1C)。これは、認知や情動の症状が早期に現れ、運動障害が遅れて発症することと矛盾しない。これは、連合野が先に発症し、その後一次運動野や感覚野が発症するという脳萎縮のトポグラフィーの時間的順序や、後期に髄鞘化した軸索ほど病理学的に脆弱であるという髄鞘化のトポグラフィーが逆転していることも反映している(Flechsig、1920; Bartzokis、2004; Braak and Del Tredici、2004; Jacobsら、2012b)。この臨床病理学的描像は、アルツハイマー病の病理がネットワーク特異的に広がるという考え方と一致する(Ahmed et al.) それは、アルツハイマー病における萎縮パターンが、アルツハイマー病の初期に影響を受ける大脳デフォルトモード領域と固有の接続性を共有する小脳領域を選択的に損なうという観察(Guoら、2016)と調和する(Jacobsら、2013)。これらの観察結果は、小脳が特定の認知回路と関連していること、および小脳への接続を含む大規模ネットワークがアルツハイマー病の病態に対して脆弱であることを示す有力な証拠となる。
機能的神経イメージング:疾患進行に伴う小脳の活性化の動的な変化
安静時機能的MRI研究では、早期アルツハイマー病における小脳を含む結合性の変化は報告されていない。MCIや散発性アルツハイマー病の研究では、主に小脳の機能的結合が対照群と比較して低下していることが報告されている(補足表2)。MCIでは、小脳内の高い機能的結合性は意味的流暢性と正の相関があり(Castellazziら、2014)、アルツハイマー病では、crus Iおよび小胞VI内の高いコヒーレンスはMMSEスコアと正の相関がある(Heら、2007)。
課題関連機能MRIについては、早期発症アルツハイマー病におけるエビデンスは、前葉と後葉(V、VIおよびcrus I)の両方で記憶課題中の小脳活性を報告した2件の研究に限られている。しかし、この信号には非キャリアのデータも含まれており、注意して解釈する必要がある(Braskie et al, 2012, 2013)。
MCI患者のタスク関連機能MRI研究では、対照群と比較して、主に後方領域で小脳の活性化が低下していることが示されたが、散発性アルツハイマー病患者では前方小脳領域も含まれていることが示された。興味深いことに、MCI患者を対象とした研究では、対照群と比較して前小脳領域の活性化が増加していることが報告されている。アルツハイマー病では、小脳皮質全体が活性化することは少なく、また、小脳皮質全体に活性化が分布していた(補足表2)。
MCIでは、病態の程度がまだ広くネットワークの崩壊に至っていないため、活性化の増加は代償機構を示唆している。アルツハイマー病患者を対象とした縦断的研究でも、エンコーディング時の小脳活動の増加と記憶能力の向上が関連し、代償過程が示唆されている(McLaren et al.、2012)。今後、小脳や大脳の活性化と認知予備能などの影響因子との相互作用を調べる研究が必要である(Bosch et al., 2010)が、疾患スペクトラムにおける活性化または結合の増加の性質を調べる必要がある。活性化の増加は、アミロイド誘発性の過剰興奮性に起因する神経活性化またはネットワーク破壊の調節を反映している可能性がある(Huijbersら、2015年)。
機能画像研究により、小脳にはかなりの程度、側方性があることが確認されている。左の小脳後葉は視空間タスクで、右は言語関連タスクでより活動するが、多くの研究では両側性の活性化も報告されている(Molinari and Leggio, 2007; Stoodley and Schmahmann, 2009; Jacobs et al, 2012a; Stoodley et al, 2012)。このような大脳半球との交差した側性は、小脳半球間の交差結合のパターンが優勢であることから予想される(Schmahmann and Pandya, 1997)。さらに、アルツハイマー病における小脳活性化の変化パターンは、内側側頭葉や頭頂葉などの病理学的に脆弱な大脳皮質領域に機能的に接続している領域に対応している(Sperlingら、2010;Jacobsら、2012a、b)。アルツハイマー病における小脳ネットワークが、大脳記憶ネットワークや認知機能障害とどのように相互作用するかは、今後の研究課題である。
散発性アルツハイマー病の症状における小脳の役割に関する考察
小脳の病理がアルツハイマー病を引き起こすわけではないが、アルツハイマー病の神経生物学と症状における小脳の役割に関して生じる疑問は、小脳の変化が臨床的に関連するのか、それとも単に他の病的事象の結果としてのサイレントバイプレイヤー(Schmahmann、2016)なのか、ということだ。
CCASをモデルとして、記憶障害性認知症はその記述の一部ではないにしても、神経病理学的なタンパク質蓄積と、特に後葉における構造的・機能的な小脳の変化が、アルツハイマー病の前駆期における普遍小脳変換(UCT)を劣化させ、行動と認知の微調整に影響すると仮定することができるだろう。後葉の構造的・機能的変化が進行し、大脳の病理学的トポロジーを反映するようになると、行動や人格の変化が起こり、患者は抑制や興味の欠如などの不適切な行動を示すようになる。さらに病気が進行すると、病理が前葉の運動小脳に侵入し、患者は歩行、平衡、四肢協調、手書き、動作に障害を生じる(Aggarwalら、2006年)。このスキーマでは、病態が進行するにつれて、認知や感情における小脳の調節的役割だけでなく、運動の計画、実行、制御も低下する。
認知障害のパターンは、アルツハイマー病の初期段階における小脳の調節的な役割を示す証拠となる。情報処理の速度、学習シーケンスの速度と変動、タイミングと時間的順序の予測、学習による自動性の発達、知覚処理、ワーキングメモリ負荷の容量は、小脳損傷患者で影響を受けるタスクである(Schmahmann、1998、2004;Bellebaum and Daum、2007;Baumann et al、2015;Leggio and Molinari、2015)。記憶障害は初期アルツハイマー病の最前線であるが、前臨床期にはより広範な認知障害も発生し、脳の機能系に病態が広がることを反映している(Salmon, 2012)。CCASに特徴的なアルツハイマー病の認知障害や精神神経障害は、少なくとも部分的には小脳の病理に起因しているのではないかというのが、我々の提案である。つまり、これらの障害は、大脳連合野や半身不随野につながる小脳小脳回路の小脳ノードにおける病態の結果として、小脳の変調の変化を反映していると考えられるのである。MCI患者では、小脳障害のある患者と同様に、時間を過小評価し、この欠損は他の領域の認知障害と相関している。軽度のアルツハイマー病患者は、大きさや量の推定にさらなる欠損がある(Carrascoら、2000;Costaら、2016)。MCI患者は、迅速で連続的な情報処理タスクのパフォーマンスが低く、アルツハイマー病に移行するとパフォーマンスはさらに低下する(Andelら、2001;Haworthら、2016)。また、MCI患者は、対照群と比較してワーキングメモリ容量が減少する(Saunders and Summers, 2010)。最後に、学習は依然として行われるが、MCI患者はエラーフルな手法よりもエラーレスな学習手法の方が恩恵を受けることから、知識形成の制御とエラー信号に基づいてこれを適応させることの困難さが示される(Roberts et al.、2016年)。このことは、記憶パフォーマンスの実行的な構成要素が、経過の初期に影響を受けることを示唆している。このように、前臨床アルツハイマー病における情報処理のモニタリング、正確性、速度、一貫性、認知パフォーマンスの漸減の性質は、本疾患の病態生理における小脳の役割があるという仮説を支持するものである。これらの障害は、認知操作に対する小脳の調節的影響を記述した思考障害理論によって予測される(Box 1)。
結論
小脳は認知や情動に関与し、大脳皮質とトポグラフィカルにコミュニケーションしている。このことは、小脳の構造と機能をどのように考えるか、また、脳のネットワークが破綻する神経系疾患の神経生物学への貢献という意味を持っている。本総説は、アルツハイマー病における小脳の神経病理、および大脳半球で観察される神経変性のトポグラフィーに適合した構造的・機能的な小脳の変化を記録した文献が豊富に存在することを示すものである。我々は、これらの知見を思考障害理論の観点から捉え、アルツハイマー病の病態生理とその臨床現象において、小脳は単なる沈黙の傍観者ではないことを提唱している。アルツハイマー病の病態が小脳でどのように進行するのか、小脳の相互作用の変化が脳結合にどのように影響するのか、小脳の変化がこの疾患や関連疾患の認知能力にどの程度影響するのかを理解するためには、さらなる研究が必要である。