Contents
Effects of milk containing only A2 beta casein versus milk containing both A1 and A2 beta casein proteins on gastrointestinal physiology, symptoms of discomfort, and cognitive behavior of people with self-reported intolerance to traditional cows’ milk
www.ncbi.nlm.nih.gov/pmc/articles/PMC4818854/
抄録
背景
牛乳には一般的にA1型とA2型の2種類のβ-カゼインが含まれている。A1型の消化物はβ-カソモルフィン-7というペプチドを産生するが、このペプチドは乳糖不耐症に類似した、牛乳摂取による消化器系への悪影響に関与している。本研究では、A1型β-カゼインを含む牛乳とA2型β-カゼインのみを含む牛乳を比較し、炎症、乳糖不耐症の被験者における乳汁摂取後の消化器不快感(消化器不快感(PD3))症状、認知処理への影響を検討した。
方法
この二重盲検、無作為化、2×2クロスオーバー試験には漢民族の被験者45人が参加し、両方のβ-カゼインを含む牛乳、またはA2β-カゼインのみを含む牛乳を摂取した。各治療期間は14日間で、ベースライン時と治療期間の間に14日間のウォッシュアウト期間を設けた。アウトカムは消化器不快感(PD3)、消化管機能(スマートピルで測定)、微妙な認知機能障害テスト(SCIT)、血清/糞便検査値バイオマーカー、有害事象であった。
結果
A2 β-カゼインのみを含む牛乳と比較して、両方のβ-カゼインを含む牛乳の摂取は、消化器不快感(PD3)症状の有意な増加、炎症関連バイオマーカーおよびβ-カソモルフィン-7の高濃度、消化管通過時間の延長および短鎖脂肪酸の低濃度、およびSCITの反応時間およびエラー率の増加と関連していた。2種類のβ-カゼインを含む牛乳の摂取は、乳糖耐性および乳糖不耐症の被験者において、ベースラインと比較して消化器不快感(PD3)症状の悪化と関連していた。A2 β-カゼインのみを含む牛乳の摂取は、乳糖耐性者および乳糖不耐症者において、ベースライン(乳製品ウォッシュアウト後)と比較して消化器不快感(PD3)の症状を悪化させなかった。
結論
A1β-カゼインを含む牛乳の摂取は、消化管炎症の増加、消化器不快感(PD3)症状の悪化、通過遅延、認知処理速度と正確性の低下と関連していた。A1 β-カゼインを除去することでこれらの効果が減衰したため、乳糖不耐症のいくつかの症状は、それが引き金となる炎症に起因している可能性があり、A2型のβ-カゼインのみを含む牛乳を摂取することで回避することができる。
背景
乳製品、特に牛乳由来の乳製品は主要な栄養成分であり、その消費量は世界的に増加し続けています。しかし、乳製品の消費量の増加は、胃腸機能障害[1-5]や免疫/炎症関連疾患[6、7]を含むいくつかの疾患のリスクの増加や症状の悪化と関連している。乳製品のこれらの効果のいくつかは、牛乳中に存在するβ-カゼインのタンパク質分解に由来するペプチド群、特にβ-カソモルフィン-7(BCM-7)に起因している。
BCM-7は、牛乳中に存在する2つの主要なタイプのβ-カゼインであるA1型β-カゼインの消化に由来するものであり、A2型β-カゼインの消化に由来するものではない。これらのタイプのどちらか、または両方が、個々の牛の遺伝的構造に応じて牛の乳に発現してい る可能性がある。牛は片方のタイプのホモ接合体であったり、ヘテロ接合体で対立遺伝子が優勢であったりして、 両方のタイプが乳汁中に発現している場合がある。2 つのタイプは 67 位のアミノ酸が置換されているため、タンパク質の構造が異なります。A2 β-カゼインおよび関連するA3およびDを含む部分変異体はこの位置にプロリン残基を含むのに対し、A1 β-カゼインおよび関連するBおよびCを含む部分変異体はこの位置にヒスチジン残基を含み、これにより先行する7つのアミノ酸残基が切断され、BCM-7が得られる[8]。β-カゼインの構造とヒトでの消化によりBCM-7を産生する可能性から、ヒト、ヤギ、ヒツジ、水牛で発現するβ-カゼインはA2型ではないが「A2様」に分類される。カゼインおよびその誘導体、特にBCM-7は、動物モデルにおいて、腸管収縮の頻度や振幅の減少[3, 9-12]、粘液分泌の増加[13-15]、リンパ球の増殖抑制[16, 17]など、消化管機能に様々な作用を及ぼすことが報告されている。
乳製品に対する不耐症は、一般的に報告されている消化器疾患であり、通常は乳糖不耐症に起因するものである[18]。しかし、BCM-7(したがってA1 β-カゼインを含む牛乳)の消化管効果から、乳製品に対する不耐症は乳糖そのものではなく、A1 β-カゼインの摂取に関連している可能性がある。我々の仮説では、A1 β-カゼインの消費は、シグナル伝達活性の変化、酸化還元障害、および遺伝子発現の変化したエピジェネティックな調節を含む一連のプロ炎症性効果をもたらすBCM-7の産生および組織の曝露につながるということである[19]。これらの変化の結果として、消化過程の障害が生じ、これが乳糖不耐症の症状として現れることがある。したがって、A1 β-カゼインを除外してA2 β-カゼインを含む牛乳を摂取することで、BCM-7に関連する消化管障害が緩和または予防される可能性がある。
しかし、これまでのところ、A2 β-カゼインのみを含む牛乳とA1 β-カゼインを含む牛乳の消化管効果をヒトで比較した研究はほとんどない[20]。そこで我々は、A2 β-カゼインのみを含む牛乳とA1 β-カゼインのみを含む牛乳の効果を、血清および糞便検査、乳製品後の消化器症状、排便回数、Bristol Stool Scale、消化管通過時間、および消化管炎症を含む消化管機能の観点から比較するために、無作為化対照二重盲検クロスオーバー試験を実施した。我々は、A1 β-カゼインを含む牛乳を摂取すると、乳糖不耐症と認識されているか確認されている被験者のコホートにおいて、乳糖不耐症と同様の全身性の炎症および消化管障害が生じるという仮説を立てた。また、A2 β-カゼインのみを含む牛乳を被験者に与えることで、A1 β-カゼインを除去することで、A1 β-カゼインのこれらの影響を回避または減衰させることができるのではないかという仮説を立てた。
A1β-カゼイン型のみを含む牛乳は市販されておらず、消費者の乳製品を代表するものではないため、A1β-カゼイン型とA2β-カゼイン型の両方を混合した通常の牛乳を用いた。A2 β-カゼインのみを含む牛乳は、A2 遺伝子型ホモ接合牛から調製されたものであることが確認された。
いくつかの研究[21-23]で報告されている乳糖不耐症や乳糖不吸収が最大 90%と非常に高率であることから、私たちは中国の漢民族に焦点を当てた。にもかかわらず、中国の牛乳消費量は増加し続けており、都市住民の一人当たりの乳製品消費量は、1992年の約6kgから2006年には18kgへと3倍に増加している[24]。
方法
スタディデザイン
本試験は、2008年にソウルで改正されたヘルシンキ宣言に準拠して実施され、上海栄養学会の倫理委員会(承認番号:SNSIRB#2014[002])により承認されました。本研究はClinicalTrials.gov(識別子:NCT02406469)に登録された。すべての被験者は、本研究に含める前に書面によるインフォームドコンセントを提供した。
本試験は、A2型β-カゼインのみを含む牛乳とA1型およびA2型β-カゼインを含む牛乳の、不耐症の症状と相関する免疫応答マーカーの血清レベルへの影響を評価するために設計された、単一施設、二重盲検、無作為化、対照、2×2クロスオーバー試験である。本研究のデザインを図1に示す。対象者は、完全な臨床評価と尿中ガラクトースの定性検査を受けたスクリーニング検査を受けた後、2週間のウォッシュアウト期間に入った。その後、無作為化スキームに従って、A2のβ-カゼインタイプのみを含む牛乳または両方のβ-カゼインタイプを含む牛乳を2週間投与する介入期間1に入った。2週間のウォッシュアウト期間の後、被験者は反対の乳製品を投与する介入期間2に入った。訪問は各介入期間の開始時、および各介入期間の7日目と14日目に予定された。被験者は各ウォッシュアウト期間中に電話で連絡を取った。研究は、上海交通大学医学部附属新華病院消化器科(中国・上海市)で実施した。
図1
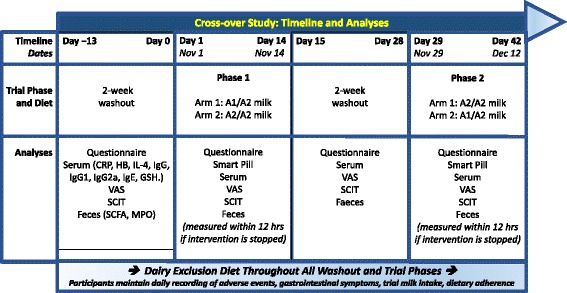
研究デザイン。A1=A1およびA2のβ-カゼインを含む牛乳;A2=A2のβ-カゼインのみを含む牛乳;hs-CRP、高感度C反応性タンパク質;Hb、ヘモグロビン;IL-4、インターロイキン-4;Ig、免疫グロブリン。BCM-7、β-カソモルフィン-7;GSH、グルタチオン;消化器不快感(PD3)、乳製品後の消化器症状の不快感;SCIT、微妙な認知障害テスト;SCFA、短鎖脂肪酸;MPO、ミエロペルオキシダーゼ
介入
A2β-カゼインのみを含む牛乳とA1とA2β-カゼインの両方を含む牛乳は、A2 Infant Nutrition Limited(ニュージーランド、オークランド)から提供され、SPRIM Chinaから試験実施地に配布された。SPRIM中国のスタッフは、研究者と被験者が各介入期間にどちらの製品を受け取ったかを盲検化できるように、すべての製品を再包装し、ラベル付けした。各介入期間において、被験者は1日2食後に牛乳250mlを14日間摂取するように指示された。被験者は、牛乳の摂取量と各介入期間の遵守状況を記録するために日記を使用した。使用済みおよび未使用のカートンを各訪問時に回収し、介入の遵守状況を評価し、盲検化が損なわれていないことを確認した。
被験者は、封印された封筒に記入された割り付け番号に従って、性別による層別化を行い、シーケンス1(A1/A2 → A2)またはシーケンス2(A2 → A1/A2)に無作為に割り付けられた。割り付けは、SPRIM Chinaが作成したコンピュータ作成リストに基づいて行った。
A2 β-カゼインタイプのみを含有する牛乳の含有量(100mlあたり)は、エネルギー271kJ、タンパク質3.1g、脂質3.6g、炭水化物5.0g、ナトリウム48mg、カリウム150mg、カルシウム117mgであった。超高性能液体クロマトグラフィーおよび質量分析法で確認したところ、両タイプのβ-カゼインを含む牛乳において、A1 β-カゼインとA2 β-カゼインの比率は約40:60であった。また、両製品は同一のものであり、タンパク質の含有量も同程度であった。
試験期間中、提供されたもの以外の乳製品の摂取は禁止され、各ウォッシュアウト期間中、被験者は牛の乳製品を摂取することはできなかった。
被験者
含める基準は以下の通りであった:男性または女性、年齢25~68歳、不規則な牛乳消費(食物摂取頻度調査票を用いて記録されている)、市販の牛乳に対する不耐性を自己申告、牛乳摂取後の軽度から中等度の消化器系の不快感を自己申告、および静かな呼吸時の心電図(ECG)と血圧が正常であること。
被験者は、以下の条件を満たしている場合に登録された:研究中に薬物、栄養補助食品、またはアシドフィルスミルクを含む他の乳製品を服用しないことに同意した;すべての要件および手順に従う意思がある;署名入りのインフォームドコンセントを提供した;本研究中に他の介入型臨床研究に参加しないことに同意した;除外基準のいずれも満たしていない(追加ファイル1参照);および本研究の性質、目的、利益、および潜在的なリスクと副作用を十分に理解している場合に登録された。過敏性腸症候群、便秘、または薬を服用していない炎症性腸疾患などの既往症のある被験者は登録されなかった。
被験者は、地域の病院の掲示板に貼られた広告によって募集された。
試験の対象
スクリーニング時に、被験者は病歴、測定(身長、体重、血圧、心電図)、身体検査、および尿中ガラクトースの定量検査のスクリーニングを含む包括的な評価を受けた。両介入期間のベースラインおよび14日目に以下の評価が行われた:微妙な認知機能障害テスト(SCIT)、乳製品後の消化器系不快感の自己申告症状、および臨床検査(追加ファイル1参照)。被験者は毎日の日記を使用して、牛乳の摂取量、アドヒアランス、胃腸症状、および有害事象を記録した。さらに、各介入期間の14日目に、被験者にスマートピル(OMOMカプセル;重慶金山科学技術[グループ]Co. Ltd.、重慶、中国)を投与した。
乳製品摂取後の消化器症状の不快感
消化器症状は、ブリストルスツールチャートを用いて毎日の日記に記録され、便の頻度と便の一貫性が含まれていた。便の一貫性は、1=別々の硬い塊で通過しにくいものから、7=固形物の欠片がない水っぽいもの、または完全に液体のものまで、7点満点のスケールで評価した。各訪問時に、乳児後の消化器症状の不快感を調査者が評価し、対象者が以下のいずれかを感じたかどうかを尋ねた:膨満感、腹痛、鼓腸、胃の重さ、およびボルボリーグミ(胃のゴロゴロ音)。各症状は、4点のLikert型スケールで、決して(スコア=0)、まれに(スコア=1)、頻繁に(スコア=2)、またはすべての時間(スコア=3)として評価された。
スマートピルを用いた消化管通過時間と炎症の測定
各介入期間の14日目にスマートピルを投与し、以下の変数を計算した:小腸通過時間(SBTT)-カプセルが小腸に入ってから盲腸に入るまでの時間、大腸通過時間(CTT)-盲腸に入ってから排便するまでの時間、全消化管通過時間(WGTT)-カプセル摂取から排便するまでの時間。
また、胃・小腸の炎症についてもスマートピルを用いて評価し、改善、悪化、変化なしの3段階で評価しました。パイロット試験として、スマートピルを限定数購入した。炎症は、スマートピルを用いて得られた画像を用いて消化器内科医が診断・評価した。炎症は、2つの介入後に得られた画像とビデオに基づいて、悪化した/全くしていない/良くなったとして等級付けされた。胃腸科医は介入を盲検化し、被験者の識別番号のみを提供された。
SCIT
SCITは情報処理の速度と有効性を測定するコンピュータベースのテストである[25]。参加者は、マウスの左ボタンまたは右ボタンを押すことで、ターゲット刺激の2本の平行な垂直線のどちらが短いかを示す。視覚的にマスクされた標的刺激が、16、32、48、64、80、96、112、128msの露光時間でランダムに提示されます;それぞれ12回ずつ、合計96回の試行が行われます。被験者の反応時間とエラー率は、刺激の暴露時間について記録される。4つの最も短い提示期間16-64msのデータ(応答曲線の「頭」と呼ばれる)は、前意識的自動処理のための2つの代表的なテストスコアを提供するためにプールされます:応答時間(SCIT-RTH)とエラー率(SCIT-EH)。4つの長い提示時間(83-133ms; 応答曲線の「尾」と呼ばれる)のデータをプールして、意識的処理の2つのより代表的なスコアを提供します:応答時間(SCIT-RTT)とエラー率(SCIT-ET)。SCITは高いテスト-再試験信頼性と内部一貫性の信頼性を持ち、中程度の内容妥当性を持っている [25]。
有害事象
有害事象は症例報告書を用いて記録され、その重症度、介入との潜在的関係、および転帰の観点から分類された。イベントの種類は、追加ファイル1に示されているコードを用いて記録された。
統計的分析
探索的研究であるため、サンプルサイズの計算は行っていない。先行の二重盲検、無作為化、8週間のクロスオーバー試験 [20] のデザインと結果を考慮して、約40人の被験者を募集することを計画した。
連続変数の正規性を評価するために、Kolmogorov-Smirnov検定を使用した。非正規分布の変数は、正規分布に近似するために平方根変換または対数変換を行った。ベースライン特性は、平均±標準偏差(SD)または被験者数(%)として記述的に示されている。SCIT、消化管通過時間、便の頻度/一貫性、および検査室変数を混合効果分散分析を用いて分析した。この場合、割り付けられた介入および介入期間は固定効果として含まれ、被験者は研究シーケンス(すなわち、シーケンス1、A1/A2 → A2;シーケンス2、A2 → A1/A2)内に入れ子にされたランダム効果として含まれていた。各エンドポイントの平均値に2つの介入間で差があるかどうか、および平均値が試験期間中に変化したかどうかを調査するために、介入および試験期間の効果を検定するために、固定効果のIII型検定を使用した。さらに、各製品の平均値を比較するために対照検定を行った。キャリーオーバー効果の存在は、交互作用「介入」×「期間」を用いて評価した。この交互作用が有意でない場合、両期間のデータが評価された。相互作用が有意であった場合は、介入第1期のデータのみを使用した。消化管症状および尿中ガラクトース検査の結果は、一般化推定方程式(GEES)を用いて評価した。この場合、介入順序および測定時間は固定効果として含まれ、被験者は研究順序内に入れ子にされたランダム効果として含まれた。多重比較のための調整は行われなかった。有害事象は、各タイプの事象があった被験者の数(%)で報告されている。
結果
対象者
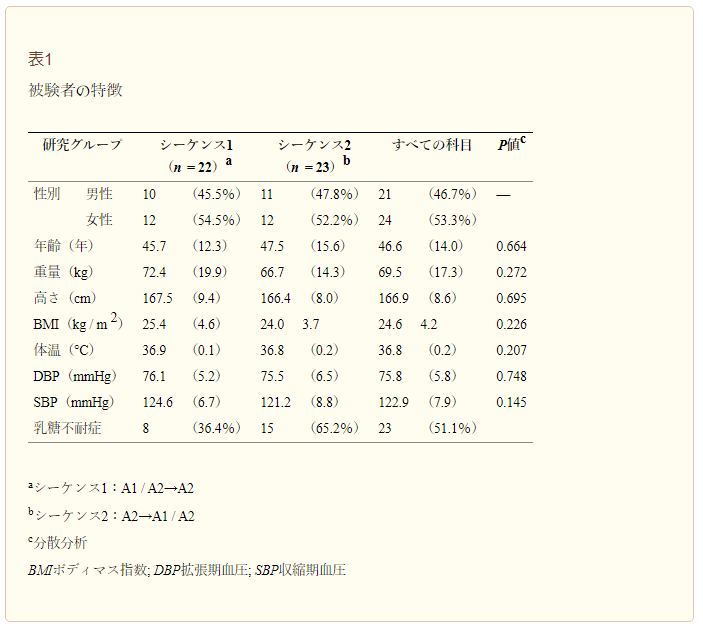
本研究は、2014 年 10 月から 2014 年 12 月の間に実施された。全体では 104 名の被験者が研究への参加に同意し、尿中ガラクトース検査を受けた。被験者は全員中国人であった。このうち、牛乳に対する自己申告による不耐性を有する45人の被験者(男性21人、女性24人、平均±SD年齢46.6±14.0歳)が適格基準を満たし、シーケンス1または2に無作為に割り付けられた。23名(第1群8名、第2群15名)が尿中ガラクトース検査の結果から乳糖不耐症であることが確認された。両シーケンスに割り付けられた被験者は、ベースラインの特徴がよく一致していた(表1)。被験者全員が、定期的に牛乳を摂取していないと報告しており、牛乳に対する不耐性を自己申告していた。
表1 被験者の特徴
血清・糞便バイオマーカー
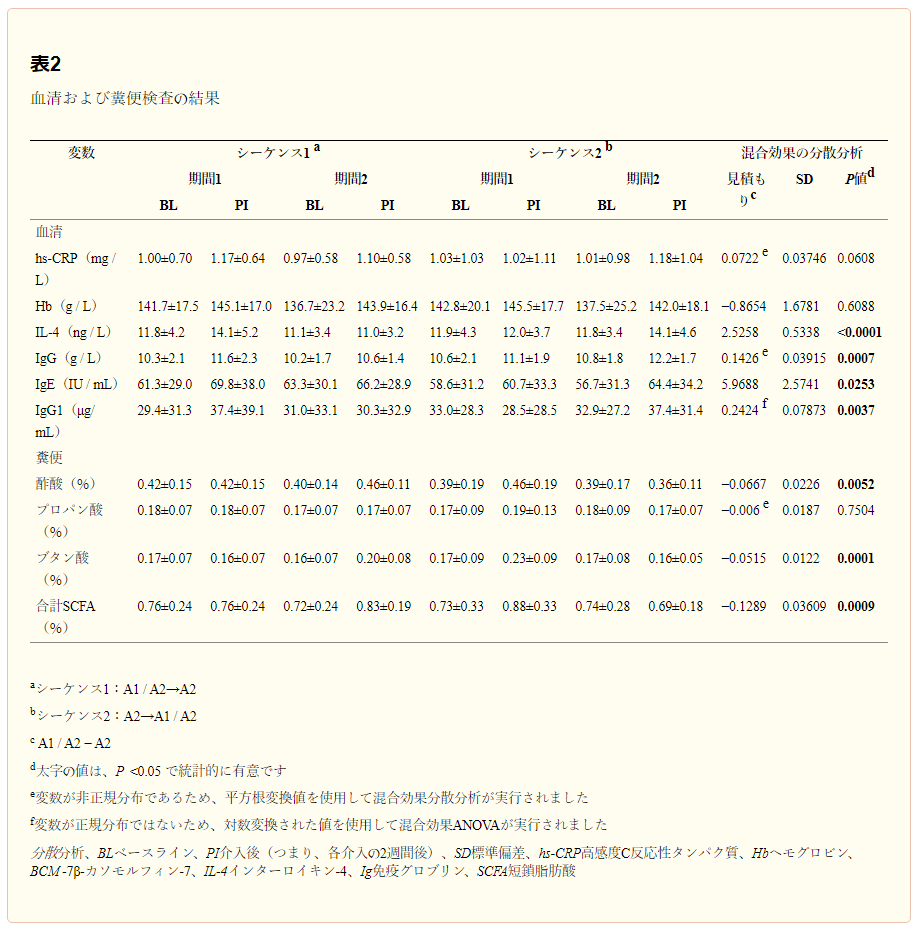
血清および糞便検査の結果を表2に示す。臨床検査値変数のいずれについても介入期間またはシーケンス効果は認められなかった(データは示されていない)。しかし、ベースライン値はすべての臨床検査値の有意な共変量であった。表2に示すように、IL-4(P < 0.0001)、IgG(P = 0.0007)、IgE(P = 0.0253)、およびIgG1(P = 0.0037)の血清濃度、および酢酸(P = 0.0052)、ブタン酸(P = 0.0001)、および総短鎖脂肪酸(SCFAs)(P = 0.0009)の糞便濃度に関して、2つの乳製品の間に有意な差があった。
表2 血清・糞便検査の結果
乳製品後の消化器症状の不快感
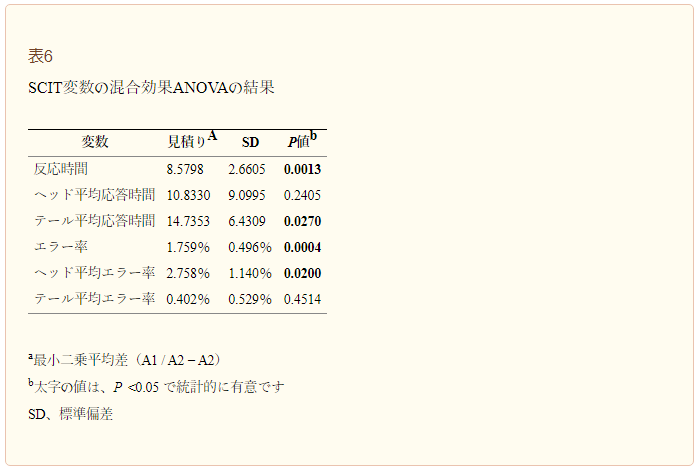
自己申告した胃腸症状を表3および4,4にまとめ、Bristol Stool Scaleのスコアを表5に示す。GEE分析では、いずれの症状についても有意な順序効果は認められなかった。膨満感、鼓腸、および眼圧の症状スコアの分布には、両シーケンスともに、シーケンス1のW1およびW2ではβ-カゼインの両方を含む牛乳を、シーケンス2のW5およびW6ではベースラインと比較して有意な差が認められた。この結果から、これらの時期には、ベースライン時よりも症状が悪化していたことが示唆された。一方、A2型のみを含む牛乳を摂取した場合には、明らかな症状の悪化は見られず、この型が消化器症状に影響を与えていないことが示唆された。便の頻度については、混合効果ANOVAにおいて、Time(P < 0.0001)およびSequence × Time(P < 0.0001)は有意な因子であったが、Sequence(P = 0.2801)は有意ではなかった。Bristol Stool Consistencyスコアについては、交互作用Sequence × Time(P = 0.0022)のみが有意因子であった。両方のβ-カゼインを含む牛乳の摂取は、ベースラインと比較して、便の頻度とBristol Stool Scaleスコアの両方の増加にも関連していた(表2および4)4)。対照的に、A2のβ-カゼインタイプのみを含む牛乳の摂取は、経時的にどちらの変数の変化にも関連していなかった。
表3 胃腸症状、週1回の便の頻度、ブリストルスツールスケールのスコア
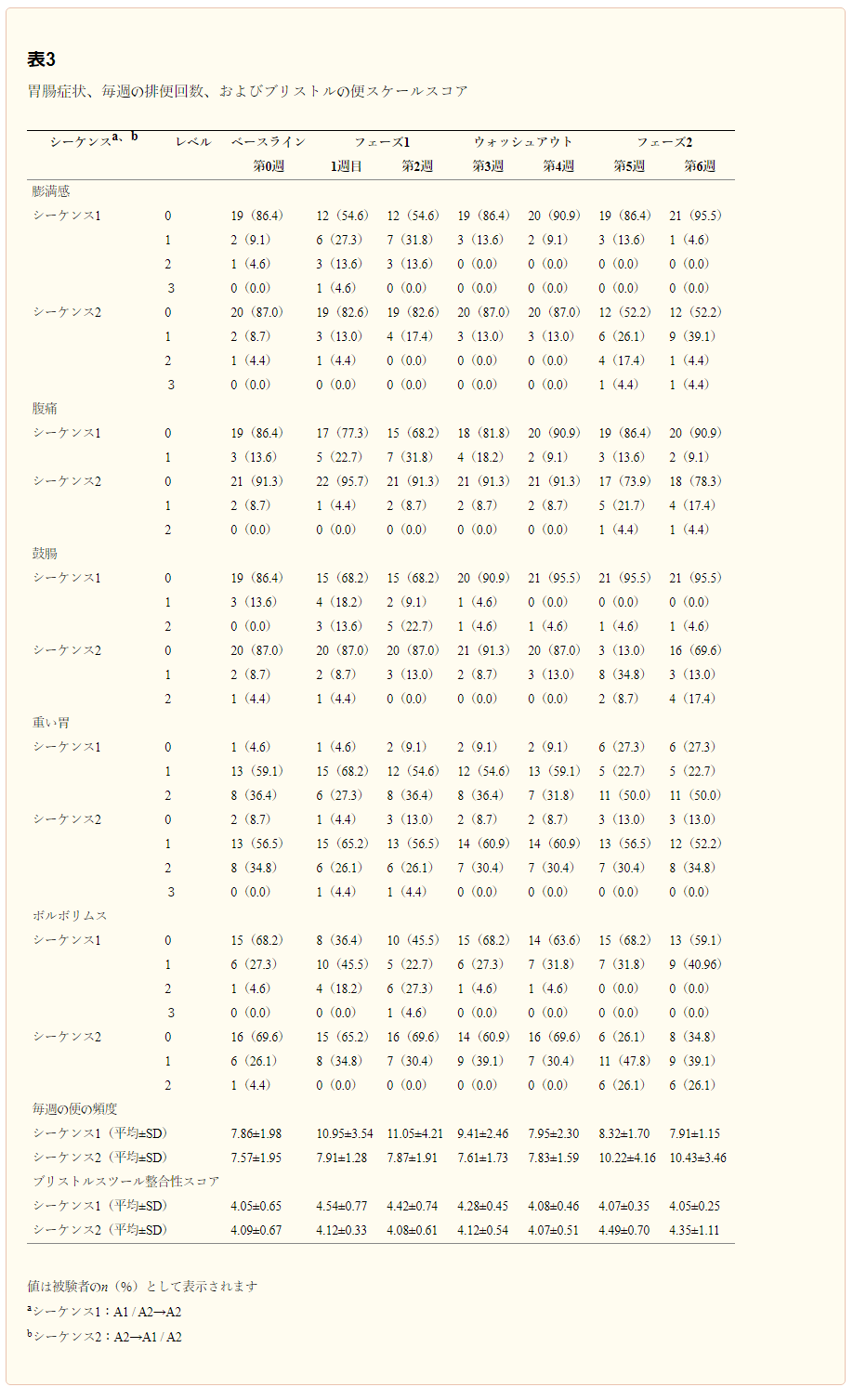
表4 順番、時間、介入が胃腸症状に及ぼす影響
表5 便の頻度とブリストル便器スケールのスコアの混合効果ANOVA
消化管通過時間
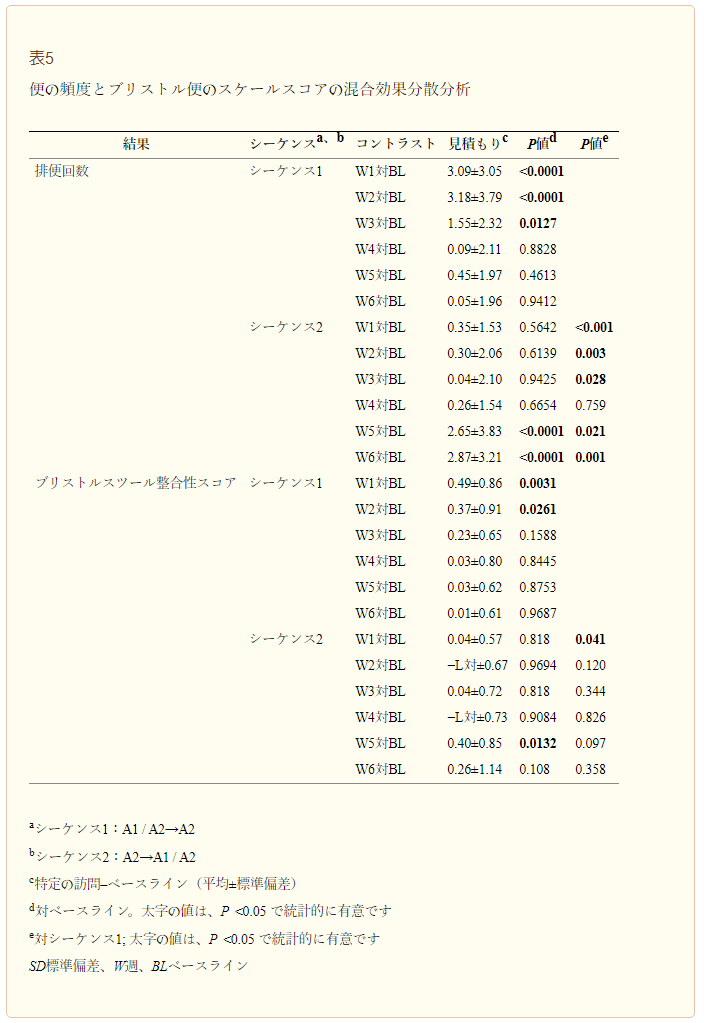
この研究のために80個のスマートピルのみを購入したため、シーケンス2(A2→A1/A2)の5人の被験者にはスマートピルは与えられなかった。図2は、スマートピルを用いて測定した局所消化管通過時間を比較したものである。固定効果のタイプIII検定により、介入はCTT(P < 0.0001)およびWGTT(P < 0.0001)において有意な因子であることが確認されたが、SBTT(P = 0.5930)においては有意ではなかった。介入期間およびシーケンスは有意な因子ではなく,これらの因子が消化管通過時間に影響を与えないことを示した。両方のβ-カゼインタイプを含む牛乳の消費は、A2のβ-カゼインタイプのみを含む牛乳と比較して、CTT(6.6 h、P < 0.0001)およびWGTT(6.3 h、P < 0.0001)は有意に長くなったが、SBTT(-0.20 h、P = 0.5903)は長引かなかった。
図2
スマートピルを用いて測定した局所消化管通過時間。値は平均値±標準偏差。A1=A1およびA2β-カゼインを含む牛乳;A2=A2β-カゼインのみを含む牛乳;CTTT=大腸通過時間;SBTTT=小腸通過時間;WGTT=全消化管通過時間
胃腸の炎症
消化管炎症に関するスマートピルのデータは、第1相(A1/A2 → A2)では22人、第2相(A2 → A1/A2)では18人の被験者について得られた。第1相と第2相の間で、小腸の炎症は、シーケンス1(A1/A2 → A2)では8人(36.4%)、14人(63.6%)、0人(0%)の被験者で改善、変化なし、悪化と評価されたのに対し、シーケンス2(A2 → A1/A2)では2人(11.1%)、15人(83.3%)、1人(5.6%)の被験者で改善、変化なし、悪化と評価された(P = 0.042)。第1期と第2期の間で、胃の炎症は、シーケンス1ではそれぞれ5人(22.7%)、17人(77.3%)、0人(0%)の被験者で改善、変化なし、悪化と評価されたのに対し、シーケンス2ではそれぞれ2人(11.1%)、16人(83.3%)、0人(0%)の被験者で評価された(P=0.427)。これらの結果から、A1/A2 β-カゼインを含む牛乳からA2 β-カゼインのみを含む牛乳に切り替えると、小腸の炎症が36.4%の被験者で改善し、胃の炎症が22.7%の被験者で改善したことが明らかになった。一方、A2 β-カゼインを含む牛乳からA1、A2 β-カゼインを含む牛乳に変更した場合、小腸の炎症と胃の炎症は11.1%の被験者で改善した。
SCIT
SCITの結果は、各シーケンスについて、フェーズ1については図3a、フェーズ2については図3bに示されている。混合効果分散分析(Mixed-effects ANOVA)により、各曝露期間の応答時間(P = 0.0013)およびエラー率(P = 0.0004)において、介入が有意な因子であることが確認された。有意な介入効果は、尾部平均応答時間(P = 0.027)および頭部平均エラー率(P = 0.020)にも認められた(表6)。すべてのSCIT変数のベースライン値は有意な共変量であったが、介入期間やシーケンス間では統計的に意味のある差は観察されなかった。
図3
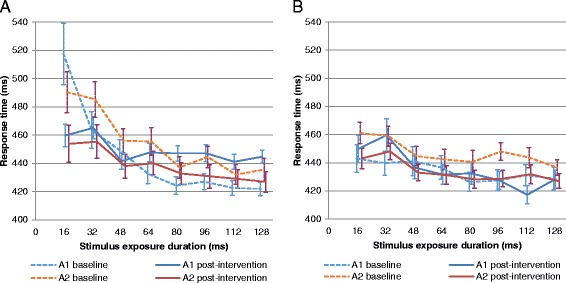
第1相(a);第2相(b)で受けた介入に応じたSCIT応答時間。A1=A1とA2のβ-カゼインを含む乳;A2=A2のβ-カゼインのみを含む乳
表6 SCIT変数の混合効果分散分析の結果
乳糖不耐症が確認された被験者のサブグループ解析
23人の被験者が尿中ガラクトース検査に基づいて乳糖不耐症であることが確認された。これらの被験者のベースラインの特徴は、乳糖不耐症の被験者と同様であった。乳糖不耐症の有無にかかわらず、乳糖不耐症の有無にかかわらず、乳製品摂取後の消化器症状の週ごとの総得点を図4に示す。β-カゼインとβ-カゼインの両方を含む牛乳の摂取は、乳糖不耐症者と乳糖耐性者のいずれの順序でも胃腸症状の有意な悪化と関連していた。対照的に、A2 β-カゼインのみを含む牛乳の摂取は、乳製品のベースラインウォッシュアウト後に観察された症状と同程度であったため、胃腸症状の悪化とは関連していなかった。両方のデータをプールしたところ、両方のβ-カゼインを含む牛乳を摂取した後の胃腸症状スコアの増加の大きさは、乳糖不耐症の被験者の方が乳糖耐性の被験者よりも大きい傾向があり、これは境界線上で有意であった(最小二乗平均差:1.087;95 % CI -0.0652, 2.2392;P = 0.0638)。対照的に、消化器症状スコアは、A2のβ-カゼインタイプのみを含む牛乳を摂取しても、乳糖不耐症者と乳糖耐性者の間で有意差はなかった(最小二乗平均差:0.494; 95 % CI -0.3247, 1.3128; P = 0.2303)。両方のβ-カゼインタイプを含む牛乳の摂取は、A2のβ-カゼインタイプのみを含む牛乳と比較して、CTTとWGTTの有意な増加と関連していたが、SBTTの増加は認められなかった(表7)。
図4
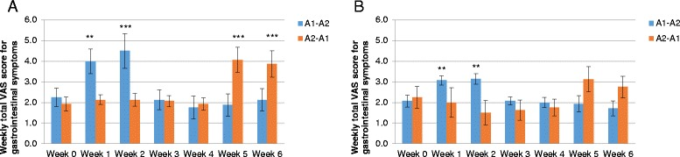
乳糖不耐症のある(a)またはない(b)被験者における週次の総消化器症状スコア(全体)。A1 = A1とA2のβ-カゼインを含む牛乳;A2 = A2のβ-カゼインのみを含む牛乳。**P < 0.01 vs. ベースライン; **P < 0.001 vs. ベースライン
表7 乳糖不耐症の有無にかかわらず消化管通過時間
各シーケンスのデータを消費された牛乳の種類に応じてプールしたところ、両方のβ-カゼインを含む牛乳の消費は消化管通過時間の有意な増加と関連していました(追加ファイル2を参照)、また血清IL-4、IgEおよびlog IgG1の有意な増加および糞便SCFAの減少と関連していました(追加ファイル3を参照)。
有害事象
45人中10人(22.2%)に13回の下痢が報告された。5人の被験者に発生した8件の事象は、両方のβ-カゼインタイプを含む牛乳の摂取に関連していると考えられ、3人の被験者に発生した3件の事象は、A2のβ-カゼインタイプを含む牛乳に関連していると考えられ、2人の被験者に発生した2件の事象は介入とは無関係であると考えられた。その他の有害事象として、咳と寒気がそれぞれ3件、2件の被験者に認められたが、これらは介入との関連性はないと考えられた。
考察
本研究では、A1 β-カゼインを含む牛乳を摂取すると、全身の炎症(炎症の血清バイオマーカーで特徴づけられる)が増加し、乳糖不耐症と認識されている、または確認されている対象者のコホートにおいて、乳糖不耐症と同様の消化管障害と関連しているという仮説を立てた。また、A2 β-カゼインのみを含む牛乳を投与することで、A1 β-カゼインを除去することで、A1 β-カゼインのこれらの影響を回避できるのではないかとの仮説を立てた。我々の仮説と一致するように、このクロスオーバー研究では、A1 β-カゼインを含む牛乳の摂取は、A2 β-カゼインのみを含む牛乳と比較して、消化器症状の増加、炎症関連バイオマーカーの高濃度、総糞便短鎖脂肪酸の低下、通過時間の延長、SCITでの反応時間の延長およびエラー率の増加と関連していることが明らかになった。両製品の組成はほぼ同じであったが、β-カゼインの含有量を除いては、A2 β-カゼインのみを含む製品ではA1とA2のβ-カゼインの比率が40:60であったのに対し、両製品を含む牛乳ではA1とA2のβ-カゼインの比率が40:60であった(牛乳100mLあたり約400と600mg)。
両タイプのβ-カゼインを含む牛乳では血清IL-4およびその他の炎症性マーカーが増加したという観察は、Ul Haqら[5]の報告と一致している。彼らは、A1様タイプのβ-カゼイン(A1/A1およびA1/A2)は、ミエロペルオキシダーゼ、単球化学吸引性タンパク質-1、抗体(IgE、IgG、IgG1およびIgG2a)、Toll様受容体1および2の増加、および腸内への白血球浸潤の増加によって示されるように、Th2経路を活性化することにより、マウスの消化管内に炎症反応を誘導することを報告した[5]。また、これらの作用はBCM-7およびBCM-5によって駆動されることも報告されている[26]。Ul Haqらによって報告され、本研究で観察されたこのサイトカイン/免疫反応は、喘息や湿疹に関連する不耐症型反応とも一致しています[27]。
また、両タイプのβ-カゼインを含む牛乳の摂取は、A2タイプのβ-カゼインのみを含む牛乳の摂取よりも有意に低いSCFA濃度と関連していた。これらの結果は、A1のβ-カゼインの消費がSCFAレベルの低下につながることを示唆している。SCFAは腸内細菌の発酵産物であり[28]、抗炎症作用[29、30]を持ち、大腸細胞機能を高める[31]。したがって、A1 β-カゼインを除外してA2 β-カゼインを摂取することは、微生物のSCFA産生をサポートし、それ故に低SCFA産生に起因する大腸の健康の障害を回避することが期待される。
A2 β-カゼインのみを含む牛乳と A1 β-カゼインのみを含む牛乳(750mL/日)の摂取に関連した消化管症状も、Ho ら [20] が実施した 8 週間のクロスオーバー試験で評価された。この研究では、A1 β-カゼインタイプを含む牛乳の摂取は、A2 β-カゼインタイプを含む牛乳の摂取と比較して、Bristol Stool Scaleのスコアが有意に高かった。さらに、腹痛スコアは、A1 β-カゼインタイプを含む牛乳を摂取した場合には便の一貫性と有意に相関した(r = 0.520、P = 0.001)が、A2 β-カゼインタイプを含む牛乳を摂取した場合には相関しなかった(r = -0.13、P = 0.43)。同様に、両タイプのβ-カゼインを含む牛乳を摂取した場合、A2タイプのβ-カゼインのみを含む牛乳を摂取した場合と比較して、消化管症状のスコアが高く、消化管通過時間が長くなり、便が軟らかくなり、下痢になることが観察された。両試験の結果から、A1型β-カゼインを含む牛乳の摂取は消化管機能に悪影響を及ぼす可能性があり、β-カゼインを含まない牛乳を摂取することでこれらの症状が緩和される可能性があることが示唆された。
また、今回の研究では、両タイプのβ-カゼインを含む牛乳の摂取は、A2タイプのβ-カゼインのみを含む牛乳の摂取に比べて、消化管通過時間、特にCTTとWGTTが長くなることが明らかになった。これらの結果は、Barnettらがげっ歯類モデルで報告した結果と一致している[4]。彼らは、二酸化チタンを消化管通過時間のマーカーとして使用した。対照的に、本研究ではスマートピルを使用しており、総消化管通過時間、および腸の特定領域を通過する時間のより正確な推定値を得ることができた[32]。
本研究では、A2 β-カゼインタイプのみを含む牛乳の摂取は、評価された変数のいずれの悪化とも関連しておらず、摂取2週間後に得られた結果は、ベースライン時(すなわち、乳製品を2週間ウォッシュアウトした後)の結果と同等であったことが明らかになった。つまり、A1 β-カゼインタイプでは、A2 β-カゼインタイプではなく、A1 β-カゼインタイプが消化管機能に悪影響を与えていたことがわかりました。
また、スマートピルを用いて、両タイプのβ-カゼインを含む牛乳を摂取した場合、A2タイプのβ-カゼインのみを含む牛乳を摂取した場合と比較して、小腸の炎症の増加が観察されました。これらの結果は、炎症関連バイオマーカーの変化と一致している。しかし、すべての被験者において変化は明らかではなく、P値は境界線上の有意性を示した(P = 0.042)。介入期間が短すぎたために、多くの被験者で炎症が誘発されなかった可能性がある。したがって、これらの所見は、より大規模なコホートまたはより長い介入期間でのさらなる検討を保証するものである。
最後に、SCITを用いて、両方のβ-カゼインを含む牛乳を摂取すると、反応時間と誤差が小さいながらも非常に有意に増加することがわかった。反応時間の増加は主に長い刺激の持続時間(尾部)で認められたが、誤認率の増加は主に短い刺激の持続時間(頭部)に限定された。このことは、両方のβ-カゼインを含む牛乳の摂取は、前意識的な自動処理の効率の低下と関連していることを示唆しているが、より長い刺激持続時間で制御されたプロセスは、処理速度を犠牲にして処理効率の欠損を減らすのに役立っている。認知機能のこのわずかな障害は、迅速な刺激の検出および/または迅速な意思決定が必要とされる状況では、かなりの影響を及ぼす可能性がある。この知見は、A1 β-カゼインタイプを含む牛乳の摂取が消化器系だけでなく、神経機能にも影響を与えることを示している。この所見は、未診断のセリアック病患者で観察される認知機能障害 [33] と同様であり、その説明は、A2 β-カゼインタイプのみを含む牛乳に比べて、両方のβ-カゼインタイプを含む牛乳の摂取に関連した血清炎症関連マーカーが増加していることにあるかもしれない。循環炎症性マーカーのレベルの上昇は、年齢やその他の健康関連因子をコントロールした後でも、記憶力、注意力、実行機能、処理速度の著しい障害と関連している [34-37]。
A1 β-カゼインタイプの消費に関連する症状の多くは、乳糖不耐症にも関連している[38]。乳糖不耐症または乳糖不吸収は腸の炎症と併存していることは注目すべきことである。したがって、乳糖不耐症と認識されている人の中には、A1 β-カゼイン型およびそのタンパク質分解によって形成されるペプチドに対して実際に有害な反応を示す人がいる可能性があります[39, 40]。
本研究では、被験者に尿中ガラクトース検査を実施したところ、約半数の被験者が乳糖不耐症に陽性反応を示した。そこで、乳糖不耐症の被験者と乳糖耐性の被験者との間で、胃腸症状の重症度および胃腸通過時間に対する両乳製品の効果を比較した。興味深いことに、2種類のβ-カゼインを含む牛乳の摂取は、両群の被験者において、ベースライン値と比較して、症状の重症度と消化管通過時間の両方において有意な増加と関連していることがわかった。特筆すべきは、観察された変化は乳糖不耐症の被験者の方が乳糖耐性の被験者よりも数値的に大きかったことである。一方、A2 β-カゼインのみを含む牛乳を摂取しても、2週間のウォッシュアウト後のベースライン値と比較して、胃腸症状の増加は認められなかった。一方、両β-カゼインを含む牛乳を摂取した場合の消化管通過時間の増加は、乳糖不耐症者の方が乳糖耐性者よりもわずかに小さかった。しかし、A2のβ-カゼインを含む牛乳を摂取しても、乳糖不耐症者と乳糖耐性者の間で胃腸通過時間に顕著な差は認められなかった。これらの知見は、乳製品の有害な胃腸作用の一部が、A1 β-カゼインを含む乳製品の消費に起因している可能性を示唆している[39、40]。これは、A2 β-カゼインを含む乳製品の摂取が、ウォッシュアウト後のベースライン値と比較して、または乳糖不耐性被験者の症状を悪化させなかったためである。どちらの乳製品にも同量の乳糖(4.8%)が含まれており、結果の違いはA1 β-カゼインの有無によって引き起こされるという概念を補強するものであった。
いくつかの研究で、A1 β-カゼイン/BCM-7と自閉症[41-44]や統合失調症[45-49]などの神経学的問題との関連が明らかにされている。また、BCM-7免疫反応の上昇が乳児の精神運動発達の遅れと関連していることも報告されている[50]。今回のデータは、A1 β-カゼインとそのペプチド誘導体が脳の情報処理にも影響を与えていることを示唆している。また、食品由来のオピオイドペプチドが、レドックスやメチル化過程に関与する遺伝子の発現、エピジェネティックな制御など、神経細胞に様々な直接的な影響を与えることも実証されている[19]。牛乳由来のペプチドは中枢神経系を含む炎症や全身の酸化を誘導する可能性があり[19]、これらの影響が発生や情報処理に影響を与える可能性があると推測されている。これらの効果を確認し、基礎となる経路を解明するためには、さらなる研究が必要である。
いくつかの制限事項について言及しておく。第一に、ベースライン時にスマートピルを使用していないため、A2 β-カゼイン型のみを含む牛乳が乳製品の洗い流しの効果以上に消化管通過時間に影響を与えたかどうかを判断することはできない。第二に、各介入期間(2週間)が短すぎて、いくつかのバイオマーカーまたは局所炎症の変化を引き出すことができなかった可能性がある。したがって、両方のβ-カゼインタイプを含む牛乳の効果、およびA2のβ-カゼインタイプを含む牛乳の消化管機能に対する有益な効果のより信頼性の高い推定値を提供するためには、より長い介入が必要であろう。第三に、A1型β-カゼインのみを含む牛乳が入手できなかったため、A1型とA2型β-カゼインの両方を含む牛乳を使用した(40:60)。しかしながら、A2 β-カゼイン型はアヘン酸受容体アゴニズム[4]に関しては「不活性」であると考えられているため、A2 β-カゼインの存在は効果を混乱させる可能性は低く、またA1 β-カゼイン型の潜在的に有害な効果を緩和する可能性もある。最後に、この研究は消化器症状のみに焦点を当てているため、調査した製品の追加的な効果は試験できなかった。
結論
結論として、本研究では、A2 β-カゼインに加えてA1 β-カゼインを含む牛乳を摂取すると、ベースライン値と比較して、
- 胃腸症状が悪化し、
- 胃腸通過時間が長くなり、
- 血清炎症マーカーが増加し、
- 総糞便SCFA含量が低下し、
- 認知処理速度が遅くなり、
- 処理精度が低下する
ことが示された。A2 β-カゼインのみを含む牛乳を摂取しても、これらの変数に悪影響はなく、両タイプのβ-カゼインを含む牛乳で観察された変化は、A1 β-カゼインの存在に起因することが示された。
さらに、両タイプのβ-カゼインを含む牛乳を摂取した場合、乳糖不耐症者では、乳糖不耐症者よりも胃腸症状および胃腸通過時間の悪化が大きかったのに対し、A2 β-カゼインのみを含む牛乳を摂取した場合は、乳糖不耐症者ではこれらの症状を悪化させることはなかった。
これらの結果から、乳糖不耐症者における牛乳に関連した胃腸症状の悪化は、乳糖そのものではなく、A1 β-カゼインに関連している可能性が示唆された。
