Contents
Will SARS-CoV-2 Infection Elicit Long-Lasting Protective or Sterilising Immunity? Implications for Vaccine Strategies (2020)
オンラインで公開2020年12月9日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7756008/
David S. Kim, 1 Sarah Rowland-Jones, 2 , * and Ester Gea-Malorquí 2
要旨
2019年12月、中国・武漢で新型コロナウイルス(SARS-CoV-2)のアウトブレイクが発生し、現在のCOVID-19グローバルパンデミックが発生した。ヒトの免疫系はこれまでこのウイルスに遭遇したことがなく、感染によって防御免疫が生成されるかどうかという重要な問題を提起している。感染後に防御免疫が実際に獲得される可能性があることを示唆する証拠が増えてきているが、再感染例は一握りしか報告されていない。しかし、SARS-CoV-2に対する免疫反応が、この病気や感染症に対するある程度の長期的な防御につながるかどうかはまだ不明である。
本レビューでは、関連ウイルスであるSARS-CoVに対する免疫の性質と寿命に関するこれまでの知見から、SARS-CoV-2に対する免疫反応に関する理解のギャップを埋めるための知見を得た。SARS-CoV-2に対する防御免疫を生み出す免疫学的特徴を解明することは、ワクチン開発の指針となるだけでなく、パンデミックの経過を予測する上でも非常に重要である。ここでは、SARS-CoV-2に対する適応免疫応答を特徴づける最近のエビデンスと、記憶応答の生成と長期的な防御の可能性について議論する。
キーワード
SARS-CoV-2,COVID-19,防御、免疫、ワクチン、免疫原性
序論
Severe Acute Respiratory Syndrome Coronavirus 2(SARS-CoV-2)は 2019年末に武漢で出現した新型コロナウイルスで、感染により世界的な大パンデミックとなるCOVID-19に急速にエスカレートした。以前の最近出現したコロナウイルス、SARSや中東呼吸器症候群(MERS)と同様に、SARS-CoV-2はコウモリからの人獣共通感染に由来する可能性が高い(1)。最近発見されたコウモリ由来のCoVであるRmYN02は、SARS-CoV-2と全ゲノムの同一性が93.3%、最長のコード遺伝子である1abの同一性が97.2%であることが明らかになった(1)。一般的に、コロナウイルスの自然な保存場所はコウモリであるが、ヒトへの感染は中間宿主を介して起こることが多く、SARS-CoV-2についてはまだ議論の余地がある。SARS-CoV-2 とパンゴリンコロナウイルスの受容体結合ドメイン(RBD)に強い類似性があることから、漢方薬に用いられる動物であるパンゴリンが中間宿主として提案されている(2)。
SARS-CoV-2のゲノム配列決定研究では、GISAIDで報告されている739個の配列について高いレベルの全ゲノム保存性(99%以上)が示されており(3)主要な変異がウイルスの適合性に悪影響を及ぼす可能性が示唆されている。SARS-CoV-2で見つかった変異の包括的な解析は、Liらによって発表されている(4)。ウイルスのスパイク蛋白質に影響を与えるD614Gという単一の突然変異がヨーロッパで出現し、支配的な循環ウイルスとなった:この変異はウイルスの感染力を高めるが、病気の重症度には影響しないことが報告されている(5)。SARS-CoV-2は 2003年のSARS発生の原因となったSARS-CoVとゲノムの79%~82%を共有しており、ヒトに感染することが知られている最も近縁のコロナウイルスです(6)。
SARS-CoV-2は、30kbの一本鎖陽性RNAゲノムを持つエンベロープ型ウイルスである(7)。SARS-CoV-2は12個の正準オープンリーディングフレーム(ORF)を含んでおり、これらのORFは宿主細胞の侵入時にゲノムまたはサブゲノムRNAから翻訳される(8)。興味深いことに、最近のコード領域の高分解能マップでは、23の他のORFが同定されている。ORF 2, 4, 5, 9aは構造タンパク質をコードしている(8)。これらのタンパク質は、スパイク(S)エンベロープ(E)膜(M)およびヌクレオカプシド(N)である。ゲノムの残りの部分は、RNA依存性RNAポリメラーゼ、プロテアーゼ、ヘリカーゼなどの非構造タンパク質(NSP)および付属タンパク質として機能する他のORFをコードしているが、これらの機能はあまり理解されていないが、ウイルスサイクルの完了を支援している。例えば、NSP1タンパク質は宿主遺伝子の発現を抑制することで免疫回避を可能にし(9)ORF7aは宿主制限因子Bone Marrow Stromal Antigen 2(BST2)に対抗する(10)。
SARS-CoVとSARS-CoV-2の両方とも、Sタンパク質の高度に保存されたRBDを介して、標的細胞に感染するための同じ受容体であるACE2(アンジオテンシン変換酵素2)を標的としている(12,13)。Sタンパク質は2つの機能的に異なるドメインから構成されている。RBDを含むサブユニットS1はACE2宿主細胞受容体と係合し、S2サブユニットはウイルスと宿主細胞膜の間の融合を仲介する(14, 15)。ACE2の結合に続いて融合が起こるためには、Sタンパク質はS1サブユニットとS2サブユニットの間でTMPRSS2プロテアーゼによって切断され、細胞内への融合を誘発する(16)。このフーリン様開裂部位(FCS)は、SARS-CoV-2のSタンパク質に特異的に存在し、これは、他の既知のβ-コロナウイルスと比較して、SARS-CoV-2の感染性が著しく高いことに寄与しているかもしれない(17)。あるいは、ウイルス粒子はエンドサイト化され、エンドソーム/リソソソーム経路に入ることができ、カテプシンLはSタンパク質を活性化し、融合の引き金となることがわかっている(15)。他の宿主因子がSARS-CoV-2細胞の侵入を促進することが示唆されている(18-24)。興味深いことに、ヒトの呼吸器上皮および嗅覚上皮に高度に存在するニューロピリン-1(NRP1)は、ACE2およびTMPRSS2の存在下で、フーリンで覆われたスパイクと相互作用することにより、SARS-CoV-2の感染性を増強することが示されている(25)。
SARS-CoV-2は、SARS-CoVよりも10〜20倍高い親和性でACE2と結合することが示されており、これは、そのより大きな伝染性を説明することができるかもしれない(14)。Spikeにおける前述のD614G変異は、「オープン」構造のSpike三量体成分の割合を増加させるようであり、これはACE2の結合を容易にし、潜在的にはより大きな感染性をもたらす(26)。Sウイルスタンパク質は、免疫原性が高いことが知られており、特にRBD領域の免疫原性が高いことが知られているため、ワクチン設計の主な焦点となっている。さらに、Sタンパク質は、ウイルスの侵入に不可欠であり、したがって、その標的化は、感染を減少させたり、予防したりする可能性がある。SARS-CoVでは、Sタンパク質単独でワクチンを接種すると、防御的な免疫応答が誘導されることが示されている(27, 28):この理由から、SARS-CoV-2に対する現在のワクチン戦略のほとんどは、Sの免疫原性に基づいている。
SARS-CoV-2に感染した個体の大多数は、軽度から中等度の疾患を経験する。正確な数はまだ議論されていないが、79の研究を系統的にレビューした結果、無症状の症例はPCRで確認された症例の20%であることがわかった(30)。入院を必要とする重症例は、確認された全症例の約14%と推定されている。COVID-19の症状は多様であるが、一般的な症状としては、発熱、乾いた咳、疲労、味覚および/または嗅覚の喪失、下痢、および息切れなどが挙げられる(31)。年齢、性別、および糖尿病や高血圧などの基礎的な併存疾患は、疾患の重症度と関連している(32)。65歳以上の患者は18-44歳と比較して入院を必要とするオッズ比が3.4である(33)。COVID-19の重症患者は、しばしば症状発現から7~10日後に急激に臨床症状が悪化し、急性呼吸窮迫症候群(ARDS)の特徴であるリンパ球減少症や炎症性マーカーの上昇を呈することが多い(34, 35)。患者の中には、感染が解消した後も数ヶ月間症状に苦しみ続ける人がいることに注意することが重要である。
異なる転帰の背景にある理由は不明である。主な仮説は、おそらく感染の初期段階で、免疫反応の調節異常が全身性の炎症亢進(サイトカインストーム)を引き起こし、それが重症化した疾患で観察されるARDSや多臓器障害を引き起こしているのではないかというものである(34, 35)。しかし、通常は緊密に制御されている炎症反応の制御が失われる理由については、まだ研究が続けられている。I型インターフェロン(IFN)経路および抗IFN自己抗体の先天的欠陥が、生命を脅かすCOVID-19で発見されている(36,37)。
初期接種のウイルス負荷の違いは、創始者ウイルスの遺伝的配列の違いとともに、感染時のウイルス負荷が高いほど強い免疫反応を引き起こす可能性があることから、患者全体の転帰に影響を及ぼす可能性のある潜在的な要因として提案されている。これまでのところ、D614G変異株は、より高いウイルス負荷とより大きなウイルス拡散に関連しているが、疾患の重症度との相関は認められていない(5)。
SARS-CoV-2感染が長期的な防御免疫を誘導するのか、もし誘導するのであれば、それは単に重症化を防ぐだけなのか、それとも殺菌免疫を提供するだけなのか、ということがまだ解明されていない重要な問題である。SARS-CoV-2の防御免疫とその持続性に関する我々の理解は、ごく最近のデータに限られており、主にヒトに感染することが知られている最も近縁のウイルスであるSARS-CoVから得られた知識に依存している。遺伝的に類似したSARS-CoVに対する長期記憶T細胞は、SARSパンデミックから 17年後も回復期の患者で検出可能であることが明らかにされている(38)。
現在までのところ、回復したSARS-CoV-2患者における免疫応答を特徴づける大規模な研究はほとんどなく、応答の寿命とその特徴を評価するには時期尚早である。マカクを対象とした最初のチャレンジ研究では、一次感染の解消後すぐに動物をチャレンジさせた場合、SARS-CoV-2感染が防御免疫の発達をもたらす可能性があることが示された(39,40)。しかし、現在では初感染から数ヶ月後にヒトへの再感染例が多数報告されており、保護免疫が長期的に持続するという考えは疑問視されている(41-47)。
本レビューでは、SARS-CoVにおける長期的な免疫の証拠と、SARS-CoV-2との免疫学的な類似性について検討する。また、SARS-CoV-2に対する免疫反応を特徴づける現在の文献を検討し、現在および将来のワクチン戦略への潜在的な影響について議論する。また、COVID-19感染から回復した個体において防御免疫が発現する可能性があるかどうか、また、防御免疫がどのくらいの期間持続すると予想されるかについての見解を提示することを目的としている。ここに掲載した論文の一部は、出版時にプレプリントサーバーで公開されていたため、査読を受けていないものもある。
体液性免疫応答
SARS-CoVおよびSARS-CoV-2感染症で誘導される抗体
前回のSARSパンデミックでは、SARS-CoV感染者の大多数で症状発症後2週間で血清転換が認められた(図1)。急性感染時にIgM抗体が出現し、その後、IgG、IgM、IgGへのクラス切り替えが進行し、感染後の最初の数週間に並行してIgG抗体価が上昇した。感染の消失と同時に、IgM抗体価は症状発現から4週間後に徐々に低下した。IgG値は4ヵ月後にピークに達し、中和抗体と非中和抗体の両方の抗体価が少なくとも2年間検出可能であることが示された。非中和性IgG抗体は、ごく一部の患者では24ヶ月後に検出されなくなった(48)。
図1 SARS-CoVおよびSARS-CoV-2に対する適応免疫応答の概要
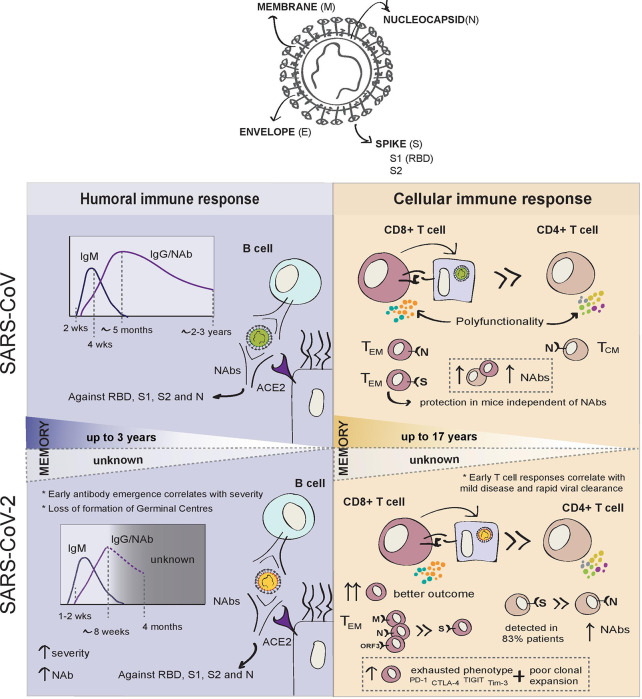
回復したSARS患者は、Sタンパク質の受容体結合ドメイン(RBD)(残基318~510)に対する中和抗体(NAbs)の高力価を有していた。これらの特異的な抗体は、感染後5ヶ月まで高力価を維持し、16ヶ月後には顕著に減少したものの、24ヶ月後の追跡調査でも血清中に測定可能な状態を維持していた(48)。
SARS-CoVにおける体液性応答の免疫相関から、SARS-CoV-2に対する抗体反応を予測するための良い基礎が得られると考えられる。特に、Sタンパク質は2つのウイルス間で高度に保存されており(76%のアミノ酸配列相同性)RBD領域を標的とした抗体が中和に重要であると考えられる(15)。SARS-CoV-2に対してヒトで作製されたSを基にした中和抗体は、構造と機能が類似しており、SARS-CoVに反応して作製された抗体と相同な速度論に従っている可能性が高い。
現在までのところ、SARS-CoVと同様に、SARS-CoV-2に感染した人は、通常、症状が発現してから7~14日後にIgAおよびIgM抗体を発現し、その後のIgGとともに、感染が解消する前に抗体が存在すると報告されている(図1)(49)。しかし、COVID-19の血清転換は、症状発症から 2日後に早くも起こりうる(50)。最大規模の研究では、症状発症後7日目に44%~56%の患者でIgG抗体が発現し、20日目までに95%の患者でIgG抗体が発現していた(51)。より最近の研究では、スパイク蛋白に対する抗体の高い力価が維持されているにもかかわらず、症状発症から8週間後にIgG抗体の力価がわずかに低下することが観察されている(49,52)。抗体反応の持続性は、その標的に依存している可能性がある。NおよびS特異的IgG抗体の抗体価は、診断後少なくとも4ヶ月間は安定していることが明らかになっているが、抗N IgMは感染初期に顕著に増加し、2ヶ月後には検出不可能なレベルにまで低下している(55)。現在のところ、回復後6ヵ月後の抗体反応の動態を明らかにした報告は1件のみで、抗S1 IgGとIgAは時間の経過とともに減少し、抗N抗体は安定したままであることがわかった。興味深いことに、抗N抗体価の上昇は感染後の症状の有病率と相関している(56)。
中和抗体と交差中和
中和抗体は、二次感染に対する殺菌免疫、特に感染を防ぐためのS-ACE2結合を標的とした抗体を提供するために重要である。多くの試験管内試験および生体内試験の研究で、NAbがSARS-CoV-2感染を制御するように見えることが示されている(57-59)。
SARS-CoV-2では、NAbsは症状発症後10日目から 15日目まで報告されており、S-標的抗体と相関があり(54)90%の血清転換者は感染後5ヶ月までに検出可能なNAbsを有する(55)。抗体価とNAbsレベルの間には、疾患の重症度との間に明確な関連がある(60)。NAb抗体価は患者のリンパ球数と逆相関があり、リンパ球数が低いと予後不良の強い指標となる(61)。軽度から中等度のCOVID-19では頑健な抗体反応が認められているが(55)、他の患者では30%の患者でNAbを検出できなかった(54)ことから、軽度または無症状の感染症を持つ一部の患者ではNAb価が非常に低いか、または存在しないことが示唆される。したがって、NAbの力価は疾患の重症度と直接相関しているように見えるが、逆説的であるが、その後のSARS-CoV-2への曝露では感染に対する防御力が高くなる可能性がある。
COVID-19患者におけるほとんどの抗体反応は、Sウイルスタンパク質、特にS1サブユニットとRBD領域を標的としているようであり、これらは最も強力な中和効果をもたらすと考えられている(62)。RBDに対する単離された強力なNAbsは、マウスやマカクにおいて、ウイルスの負担を軽減し、感染から保護することが示されている(63, 64)。
RBDの配列は2つのウイルス間で高度に保存されていることから、RBDに対するSARS-CoV-2のNAbsは、SARS-CoVで観察されたものと同様の期間持続すると考えられる。SARS-CoV-2スパイクに結合したS特異的抗体の構造から、共通のエピトープおよび保存された特徴が明らかになった(65)。Murine SARS-CoVのS抗体は、2つのウイルス間のSタンパク質の類似性と一致して、SARS-CoV-2細胞の侵入を阻害することができる(66)。2003年の発生時に回収されたSARS-CoVからの血清は、SARS-CoV-2のSエクトドメイン、S、RBDおよびS2タンパク質と交差反応し、試験管内試験でSARS-CoV-2を中和することが示されている(67,68)。さらに最近では、RBDを標的とする抗体がSARS-CoVの回復期血漿から分離され、Sタンパク質上の複数の保存されたエピトープを標的とすることでSARS-CoV-2を交差中和することが示されている(69)。しかし、ヒトにおける他の報告によると、SARS-CoVとSARS-CoV-2の回復した患者からの回復期血漿は、2つのウイルス間の交差中和が限られていることが示唆されている。これらの違いは、76%のアミノ酸の同一性があるにもかかわらず、SARS-CoVとSARS-CoV-2のS RBDでは異なる7つの重要な残基に起因すると考えられている(15)。
SARS-CoV抗体およびSARS-CoV-2抗体は交差反応を行う一般的な能力を有しているにもかかわらず、交差中和の能力は非常に特異的である可能性がある。このような特異性は、SARS-CoVおよびSARS-CoV-2のいずれかの患者の血漿中で実証されており、スパイク蛋白質との結合において交差反応することはできるが、交差中和することはできない抗体が含まれていた(70)。SARS-CoV-2 RBD NAbsの単離は、それらの中和能力がRBD結合のためにACE2と競合する能力と直接相関していることを示したが、それらのSタンパク質三量体に対して交差反応性を示したにもかかわらず、SARSまたはMERS RBDを中和することができなかった(71)。さらに、パンデミック前の血清から得られた季節性コロナウイルス(HCoV)に対する抗体は、SARS-CoV-2に対して交差中和活性を示さなかった(72,73)。
SARS-CoV-2のS2ドメインもまた、高度に保存されているようである(SARS-CoVとの配列相同性は88%)。S1と同様に、SARS-CoV感染においてS2に対して産生された抗体は、SARS-CoV-2においてS2と交差反応性であることが見出されたが、どれも中和しなかった(69)。
COVID-19患者は、SARS-CoV-2の構造タンパク質および非構造タンパク質の両方に対する抗体のスペクトルを産生する。NSP1,ORF3b、ORF7a、およびORF8を標的とするこれらの抗体は、中和以外の免疫機能を媒介して、患者にとって有益であったり有害であったりする可能性がある(74)。非構造タンパク質に対する抗体が保護に付加するかどうかは、まだ知られていない。
体液性防御
ヒトでは、血漿メモリーB細胞およびモノクローナルNAbsがSARS-CoV-2の回復期患者から分離されている(63,71)。メモリーB細胞は、検出可能な抗体価が存在しない場合に血漿中に持続し、その後の感染の際に想起され、保護を与えることができる(69)。SARS-CoVの研究から得られた知見によると、メモリーB細胞と抗体を介した保護は最大3年間持続する可能性があるが、このような保護の有効性は、循環抗体価が低下すると時間とともに低下する可能性が高い(69)。多くの臨床試験では、回復したCOVID-19患者の回復期血漿(CP)を重症患者の治療に用いることで、SARS-CoV-2感染の過程で自然に生成された抗体の潜在的な保護効果が強調されている(75-77)。しかし、最近の多施設共同無作為化比較試験では、CPを用いて治療した患者の死亡率や疾患の進行に差は見られなかった(78)。回復期血漿の有効性についてはまだ議論の余地があるが、すでに重症化している患者では体液性免疫応答の寄与が限定的である可能性があることを示唆している。
SARS-CoV-2感染が防御免疫を誘導することができるという証拠は、Chandrashekarらによって、初感染後すぐに研究されたアカゲザルで初めて示された(39)。SARS-CoV-2に感染した9羽のマカクを一次感染が解除された35日後に再チャレンジさせたところ、チャレンジしていない動物に比べて気管支肺胞ラバージ(BAL)中のウイルスRNAの測定値が有意に低かった。これは、中和抗体と細胞が媒介するウイルス特異的反応の効果的な誘導を伴っていた(39)。サルのSARS-CoV-2感染後に防御免疫が発現したことは、ヒトでも回復またはワクチン接種後に防御免疫が発現することを示唆している。しかし、このような防御免疫の持続性はまだ評価されていない。
現在までに報告された数少ない再感染例の中で、ある研究では2回目の感染時に体液性免疫応答が欠損していることが判明しており、1回目の感染時に体液性免疫応答が欠損していることが再感染しやすい原因である可能性が示唆されている(42)。さらに、Chenらは、NAb価の大きさと疾患の重症度との間に正の相関があることを示しているが、生成されるNAbの間には非常に大きな不均一性があることも報告している。特筆すべきは、無症状の患者では十分な量のNAbsを産生することができず、これらの患者の血清は試験管内試験でSARS-CoV-2偽ウイルスを中和することができなかったことである(79)。
懸念されるのは、致死的なCOVID-19症例では、SARS-CoV-2は胚中心(GC)の生成に障害を与えるようであり、ここではTフォリキュラーヘルパー(TFH)細胞の助けを借りて、B細胞は記憶B細胞または長寿血漿細胞に分化することができる(80)。興味深いことに、毛包外B細胞の活性化は重症患者で検出され、初期の抗体反応、多臓器不全、死と相関している(81)。急性SARS-CoV-2感染時に胚中心が形成されないと、長寿命の抗体応答の生成が著しく損なわれることになる。重症化した疾患では、腫瘍壊死因子α(TNF-α)が過剰に産生されるために胚中心の形成が阻害されることが提案されている。したがって、過剰な炎症反応のために体液性応答のためのメモリーコンパートメントの形成が損なわれている可能性がある。
体液性防御の相関関係を理解し、検出不能なNAb価を有する個体に対する免疫学的意味合いを考慮することが重要である。T細胞反応は、NAbが検出されない場合でも、その後の感染に対する防御を提供する可能性がある。初期の研究では、抗体反応がない場合でも、無症状または軽度のSARS-CoV-2感染において、ウイルス特異的なT細胞応答が頑健であり、発現することが示されている(82)。
これまでのところ、SARSとCOVID-19の両方に対する体液性応答には多くの類似点があることが示されている。しかし、SARS-CoV-2の体液性免疫応答を疾患の重症度に関連して特徴づけ、抗体応答の動態と幅の広さが一次感染の解消と再感染に対する防御に役割を果たしているかどうかを明らかにすることが重要である。COVID-19では、抗体反応は症状が重い人ほど強く、NAb価が高いほど重症度と相関している(37)が、若年者や無症状の症例ではNAb価は低いか検出されない(62,82)。このことは、COVID-19に対する防御免疫が無症状または軽症例では短命であることを示唆しているかもしれないが、ある医療従事者のコホートでは感染後4ヵ月後に症状に関係なくNAbsが検出されている(85)。しかし、無症状症例で保護免疫が短期間しか持続しないのであれば、自然感染後の集団免疫の生成に頼る公衆衛生政策に懸念を抱かせる理由になるかもしれない。
SARS-CoVの研究から得られたデータによると、中和抗体は最大3年間持続する可能性があることが示されている(69)。SARS-CoV-2 についても同様であれば、中和抗体が自然感染であるかワクチン誘発であるかにかかわらず、適切な保護期間が得られる可能性があるが、必ずしも生涯にわたって体液性免疫が得られるわけではない。
初期の抗体応答と抗体依存性の増強
SARSとCOVID-19の両方において、特定の既存抗体または初期に生成された抗体が病気の進行を促進するかどうかについては議論の対象となっている(86)。提案されているメカニズムは、抗体依存性増強(ADE)として知られており、ウイルスに結合した非中和抗体のFc受容体媒介による内在化を介してウイルスが細胞内に侵入することを可能にする。ADEは、ネココロナウイルスや多くのフラビウイルスの感染時に観察されており、SARSとCOVID-19の両方の免疫病理にも関与しているのではないかという懸念が提起されている(87, 88)。SARS-CoVワクチン開発中の多くの動物実験では、ワクチン接種によって誘導された特定の非中和抗体の結果としてADEによって引き起こされる劇症効果の可能性が実証されている(89,90)。しかしながら、補体とFcR-IgGの関与メカニズムは種特異的であるため、これらの研究は慎重に行うべきである。
ADEの最初の仮説は、軽度の季節性疾患を引き起こし、SARSウイルスとの相同性が比較的限られているにもかかわらず、SARS-CoV-2と抗原を共有する可能性があり(53)交差反応性のある抗体によって媒介される疾患の進行を促進するHCoVの固有株(HCoV-183 229E、HCoV-OC43,184 HCoV-NL63,およびHCoV-HKU1)に対する既存の免疫である(62)というものである。抗原性交差反応性(または「元々の抗原性の罪」)が重症化の一因となるという根拠は、重症化した症例のうち、小児や若年者に発生する症例の割合が比較的少ないという観察に基づいている。病原性HCoVが少ないことを考えると、類似の免疫学的エピトープを持つ密接に関連した固有のコロナウイルス株への過去の感染は、SARS-CoV-2感染に反応して交差反応性抗体の産生を誘発するのに十分であろう。もしそうであれば、SARS-CoV-2を中和できないメモリー抗体の誘導は、保護に失敗するだけでなく、ウイルスの侵入を促進し、予後を悪化させる可能性がある。
ADEの第二の仮説は、SARS-CoV-2に対する抗体の早期出現であり、リコール免疫反応を暗示する可能性のあるIgGの早期出現を有する患者では死亡リスクが増加しているからである(91)。ある研究では、SARS-CoV患者のごく一部(17%)で発病後2週間の間にNAbが早期に出現していたが、この早期反応者のグループでは死亡率が上昇していた(29.6%)ことが示された(92)。著者らは、中和抗体の早期出現は患者の年齢と相関があることを示唆し、早期反応はHCoVの常在菌株に対する既存の体液性記憶のプライミング効果を意味し、それが死亡率の上昇につながっていると提案している。
SARS-CoV-2 の抗体価は疾患の重症度と相関することが観察されているが、これは病理学的な原因ではなく、高ウイルス負荷に対する反応を反映している可能性が高いことを示唆するものもある(62,79,93)。しかし、最近の報告では、体液性応答の迅速な誘導と疾患の重症度との間に関連性があるだけでなく、重症度の高い疾患では初期のN-バイアス抗体反応が、軽症および中等症の疾患ではよりバランスのとれたまたはS-優勢な反応が見られることも明らかにされている(94)。この知見は、SARS-CoV-2 Nに対して早期に誘導された抗体がCOVID-19の重症度において病原性の役割を果たし得ることを示唆しているので、ADE仮説を現段階で完全に無視すべきではない。
我々の知る限りでは、最近の結果は、抗S IgG抗体がCOVID-19患者の重症度と相関している可能性があるという最初の直接的な証拠を提供している。Hoepelらは、重症患者からの血清がSARS-CoV-2スパイク蛋白質と複合体を形成し、抗体依存的な方法でマクロファージがプロ炎症性サイトカインを放出する引き金となることを試験管内試験で示した。これは、試験管内試験では内皮バリアの破壊を長期にわたって誘導した。このメカニズムは、異常なFcグリコシル化パターンと関連していることが判明したが、著者らは、下流のSyk阻害剤がマクロファージの活性化を防止できることも示した(95)。
現在の証拠は、一部の患者における疾患の重症度を説明するメカニズムとして完全に排除することはできないが、ADEがSARS-CoV-2に対する病理学的免疫反応の主要なドライバーではないという議論を支持するものである。Arvinらはレビューを発表しており、ここではこの点について深く議論されている(96)。療養用血漿を用いた治療を試みた予備的研究では、COVID-19患者ではこれまでのところ副作用は認められていない(75-77)。
SARS-CoV-2のマウスモデルを用いた最近の前臨床試験では、抗SARS-CoV-2 RBD抗体を含む回収された患者血清を用いてもADEを示すことができなかったが、同じ条件下ではジカウイルス抗体でADEが観察された(97)。SARS-CoVに関する小動物試験の多くとは対照的に、SARS-CoV-2とのチャレンジを含む3つのアカゲザル試験ではADEは観察されなかった(39,98,99)。これらの研究はすべて、SARS-CoV-2への感染、Sタンパク質ベースのウイルスベクター(ChAdOx1)ワクチンまたはDNAワクチンによる免疫化の後に、Th2反応ではなくTh1反応が誘導されることを示している(39, 98-100)。霊長類以外のARDSおよび肺損傷のモデルには、ヒトと動物の自然免疫系、危険因子、および併存疾患の違いによる限界があることに注意することが重要である(101)。
現在までに、米国ネバダ州(ネバダ州)とオランダで行われた2件の症例研究では、SARS-CoV-2再感染後、より重篤な臨床症状を呈した患者が報告されており、そのうち1件は死亡に至った(44, 46)。このことは、ADEが不良な患者の転帰に果たすことができる役割についての議論を再燃させるかもしれない。重症患者における強い体液性応答とB細胞活性もまた、抗体の病原性役割を示唆しているかもしれない(102)が、回復期血漿の使用はこれまでのところ疾患転帰を悪化させることは示されておらず、高齢患者では転帰がわずかに改善されるという証拠もある(103)。したがって、現在の証拠に基づけば、ADEがSARS-CoV-2感染症の重症化を促進しているとは考えにくい。それにもかかわらず、Hoepelらの結果は、一部の患者がADEの形をとる可能性があることを示唆しており、COVID-19における疾患増悪のメカニズムとして完全に割り引くべきではなく、したがって、ヒト試験におけるスパイクベースのワクチンの転帰は慎重に評価されるべきである。
細胞免疫応答
細胞性免疫応答は、ウイルス感染の解決と、通常、体液性応答よりも長く持続する長期的な免疫の発達の両方に重要である(図1)。メモリーB細胞は、感染の際に抗体産生プラスマブラストに呼び戻されることがある。最初のSARSパンデミック時には、メモリーB細胞と中和抗体の両方がSARS-CoV患者において感染後3年まで持続することが確認された(69)。しかし、回復した患者のSARS-CoV特異的抗体レベルは感染後6年目には検出されなかったが、N特異的メモリーT細胞は同時期に検出された(104)。同様に、その後の研究では、感染後11年目に回復した3人の患者において、SARS特異的メモリーT細胞が血中に残存していたことが示された(105)。最近、SARSに対するT細胞応答がパンデミックから 17年後に検出され、SARS-CoV-2に対して強力に交差反応することが示された(38)。これらのデータは、記憶T細胞がSARS-CoV-2に対する長期的な反応に決定的に寄与している可能性があるという考えを支持するものである。しかし、T細胞の応答が維持されるレベルが再感染に対する防御免疫を提供するのに十分であるかどうかは明らかではなく、これらの研究ではこの点は取り上げられていない。
リンパ球減少症は、重症COVID-19の定義的な臨床的特徴の一つである。SARS-CoV-2感染中、CD4+およびCD8+T細胞の両方の減少は、患者の臨床経過と強く相関する(38,53,106)。循環T細胞の減少は、細胞死と同様に肺へのリクルートによるものと思われる。肺に著しい損傷を受けた患者の剖検では、浸潤性CD8+ T細胞とマクロファージの数が肺組織に多く見られている(107)。興味深いことに、重度のCOVIDでは、他のT細胞サブセットと比較してナチュラルキラー(NK)細胞と粘膜関連自然免疫T(MAIT)細胞の優先的な枯渇が確認されており(108-111)感染部位へのリクルートを示唆し、疾患発症における型にはまらないT細胞の潜在的な役割を強調している。療養中の患者におけるSARS-CoV-2特異的T細胞応答の幅と大きさは、疾患の重症度と相関している(112)。しかし、ある急性感染症の研究では、T細胞応答の早期出現は、迅速なウイルスクリアランスおよび重症度の低い疾患と関連していた(94)。
SARS-CoVのT細胞応答
前回のSARSパンデミック時にSARS-CoVプロテオーム全体に対するT細胞応答を評価したところ、免疫原性エピトープの大部分は構造タンパク質、特にSタンパク質とNタンパク質の中に見出され、Sタンパク質が最大の応答を誘導した(113)。すべての構造タンパク質に対して誘導された70%のT細胞応答のうち、41%はSARS-CoVのSタンパク質によって誘発された(104, 113)。元SARS-CoV患者における長期的なT細胞応答を報告した最近の研究では、Nタンパク質の2つの特定領域(1-215aaおよび206-419aa)が、研究対象者の大多数においてT細胞応答を誘発することが示された。この同じ報告では、ORF1の他の非構造タンパク質(NSP7およびNSP13)もまた、応答を誘発することが示されたが、大多数の個体では認められなかった(38)。再感染に対する防御の相関関係としてのこれらの長期的なT細胞応答の役割はまだ明らかにされていない。
SARS-CoVで回復した患者から抗原特異的CD4+ T細胞を同定した数少ない研究では、応答は主にSおよびNタンパク質に対するものであった(114, 115)。興味深いことに、N -特異的CD4+ T細胞は中枢メモリー(CD45RA- CCR7+ CD62L-)を示したが、N特異的CD8+ T細胞はエフェクターメモリー(CD45RA+ CCR7- CD62L-)の表現型を示した(115, 116)。SARS-CoV特異的CD8+ T細胞応答はCD4+応答よりもはるかに大きく、CD4+およびCD8+ともに多機能性T細胞の割合が高いことを特徴とする記憶表現型を示した(113)。高レベルのCD4+ T細胞応答およびS特異的NAbsは疾患の重症度と相関したが、総T細胞応答およびCD8+ T細胞応答は臨床転帰とは相関しなかった(113)。
SARS-CoV-2のT細胞応答
SARS-CoV-2では、循環CD4+およびCD8+ T細胞の両方の枯渇は患者の臨床経過と強く関連しているが、ウイルス特異的なT細胞応答の大きさは、回復期の患者の重症度に比例することがわかった(112)。T細胞応答のレベルはNAb価と強く相関しており、T細胞依存性NAb応答と一致しており、血清Th2サイトカイン(IL-4,IL-5,およびIL-10)の増加は死亡率と相関している(117,118)。SARS-CoV-2への急性感染時のT細胞応答は、感染が解消された後に予想されるように、感染後1ヵ月で減少した(94)。興味深いことに、最近の縦断的な解析では、T細胞応答の大きさは時間の経過とともに衰えていくが、検出可能なT細胞応答を有する回復期患者の数は感染後6ヵ月で実際に増加していることが明らかになった。著者らはまた、感染後の症状が残っている患者では、T細胞応答の減少が最も顕著であり、T細胞応答がSARS-CoV-2感染の解決に重要であるという考えを補強していることも明らかにした(56)。
重度のCOVID-19は、CD4+ T細胞の喪失と比較して、優先的にCD8+リンパ球減少と相関している(119)。CD8+ T細胞応答は、SARS-CoV-2感染を解決するために重要であることが示されているが、回復したCOVID-19患者では、ウイルス特異的CD4+ T細胞が特異的CD8+ T細胞よりも頻繁に検出されている(38,53,106)。エフェクターメモリーCD8+ T細胞の数を含むCD8+ T細胞の総数は、COVID-19患者の病期進行と負の相関がある(93, 120)。SARS-CoV-2特異的T細胞の細胞障害性表現型もまた、急性感染時の重症度と相関しているようであり、回復したCOVID-19患者のウイルス特異的T細胞は多機能であり、幹のような表現型を示している(82)。
CD8+ T細胞の表現型については、疾患の全領域にわたって議論があり、多機能性と細胞毒性が低下して疲弊しているという報告もある(121-123)。
疾患の重症度は、著しいT細胞の枯渇の表現型とクローナル増殖の低下に関連している(102)が、中等度の患者では、回復期にはT細胞の強力な増殖と細胞毒性の高いエフェクターT細胞サブセットの割合が高くなり、また、グラニュライシンを発現するCD4+およびCD8+ T細胞とCD160+ナチュラルキラーT(NKT)細胞の割合も高くなる(102)。消耗したCOVID-19 CD8+ T細胞はPD-1,CTLA-4,TIGIT、およびTim-3の上昇したレベルを発現する(122,123)が、Kusnadiらは、CD8+ T細胞がより多機能であり、親生存シグネチャを示すように見える重度のCOVID-19と比較して、記憶CD8+ T細胞の消耗した表現型が軽症ではより顕著であることを示した(124)。著者らは、枯渇インポーチントの確立に失敗したことが、T細胞応答の調節障害とより大きな疾患発症につながる可能性があることを示唆しており、これは、CTL応答の明瞭な表現型が耐久性のある保護に必要であることを示唆しているかもしれない(124)。回復した患者のSARS-CoV-2特異的CD8+ T細胞は、ナイーブマーカーCD45RAの再発現とCD27+CD28+サブセットに偏った長寿命のTEMRA細胞であることが明らかになった。この理由から、SARS-CoV-2特異的なCD8+ TEMRA細胞が長生きする防御免疫に寄与している可能性が示唆されている。
しかしながら、機能アッセイを用いて分析すると、抗原特異的CD8+ T細胞は、重症および軽症の両方の症例において同様の多機能プロファイルを示した(112)。一般的に、実施された単細胞研究のほとんどは、CD8+ T細胞のエフェクター表現型を示しており、エフェクターメモリーおよび末端エフェクターCD8+ T細胞は、抗ウイルス活性と一致する炎症性マーカーのアップレギュレーションとともに、末梢血中でのクローン拡大を示している(120)。
SARS-CoV-2特異的なT細胞応答は、症状が軽度の患者と比較して、重症化から回復した患者では、より広く、より強力なものであった。軽症の患者では、CD8+:CD4+ SARS-CoV-2特異的T細胞の比率は、重症の場合よりもはるかに高いようである(112)。印象的なことに、SARS-CoV-2の免疫優勢エピトープに対するウイルス特異的CD8+ T細胞応答のパターンはSARS-CoVとは著しく異なっており、SARS-CoV-2のCD8+ T細胞応答の大部分はM、NおよびORF3aを標的としている(53)。急性感染時には、ORF7/8に対する初期のT細胞応答が軽症患者で検出されたが、回復期には実質的に存在しなかった(94)。ORF7aは最近、制限因子BST2を打ち消すことが報告されており、この制限因子は新たに産生されたウイルスを内側の形質膜に結びつけ、ウイルスの放出を阻害する(11)。これらの知見を合わせると、ORF7に対する免疫応答がウイルス制御に関与していることが示唆される。また、ORF8はMHC-Iを分解するためにリソソームコンパートメントに標的とすることで、MHC-Iをダウンレギュレートするようであるが、これはウイルスの免疫回避の古典的なメカニズムである(125)。対照的に、構造タンパク質(S、M、N、およびORF3a)に対する応答は、感染後1ヶ月間変化しないか、または増加したままであった(94)。
COVID-19患者ではCD4+ T細胞の総数が減少しているにもかかわらず、(リンパ球の中の)CD4+ T細胞の割合は一定のままであるようであり、重症化すると中心記憶CD4+ T細胞の数が著しく増加することが明らかになった(120)。ナイーブCD4+ T細胞、T regs、およびエフェクターメモリーCD4+ T細胞数は、急性感染ではすべて低下する。SARS-CoV-2感染は、Th1分極を好む強いCD4+ T細胞応答を誘導するが、Th2およびTh17応答も検出されている(106)。ウイルス特異的CD4+ T細胞は通常、中和抗体の産生の鍵を握っているので、NAb価とウイルス特異的CD4+ T細胞の頻度との間に有意な相関関係が見られるのは驚くに値しない(59)。
IL-1ß、FOS、JUNおよびKLF6を含むCOVID-19 CD4+ T細胞では、炎症性遺伝子の発現の異常が強調されている(120)。特筆すべきことに、インターフェロンγ(IFN-γ)およびGM-脳脊髄液の両方を発現するTh1細胞は、重症のICU患者でのみ認められ、軽症および健常対照ではほとんど認められず、SARS-CoV-2によって誘導されたT細胞のサブセットが潜在的に病原性を有する可能性があることを示している(126)。
COVID-19のT細胞応答は、S特異的CD4+ T細胞応答の頻度が著しく高く、CD8+応答の大部分はM、NおよびORFタンパク質に対するものであった(112)。SARS-CoV-2のS反応性CD4+ T細胞はCOVID-19患者の83%に見られ、CおよびN末端エピトープの両方を標的とし、最近の活性化マーカー(CD38およびHLA-DR)を発現していた(59)。単一のドナーでは、CD4特異的応答の約50%がスパイクタンパク質に向けられていることが判明した(53)。
細胞保護および交差反応性
T細胞応答、特にCD8+応答は、SARS-CoV-2感染に対する耐久性のある強固な保護を提供する可能性がある。体液性免疫とは無関係にウイルスを除去するためのメモリーT細胞応答の可能性は、SARS-CoVに対して明確に示されている。ウイルス特異的メモリーCD8+ T細胞は、ウイルス特異的メモリーCD4+ T細胞またはB細胞を持たないマウスにおいて、致死的なSARS-CoVチャレンジに対する保護を与えることが示されている(127)。
Sエピトープに対するメモリー細胞傷害性Tリンパ球(CTL)の反応は、SARS-CoV感染の1年後に観察された(128)。これらのエピトープはHLA-A*02:01制限(S1203-1211,S978-986およびS1167-1175)であり、回復した患者において高倍率のIFN-γ T細胞応答を引き出すことができた(129)。S436またはS525ドメインを標的とするS特異的CD8+ T細胞は、エフェクターメモリーの表現型(CD45RA+ CCR7- CD62L-)を有していた(115, 128) 興味深いことに、CTL応答はSARS-CoV感染歴のない少数の健康な患者で誘発された(129)。
SARS-CoV-2に対するT細胞の交差防御については、いくつかのグループがT細胞応答に対する交差反応性を示しているが、この交差反応が何らかのレベルの防御を提供できるかどうかについては、まだ明らかにされていない(38, 53, 130)。Grifoniらは、HCoVへの曝露によって生じる免疫がSARS-CoV-2感染に対する保護をもたらす可能性があることを提案しており、非曝露者の40-60%がSARS-CoV-2に対するCD4+ T細胞応答を生じたことを明らかにしている(53)。同様に、Braunらは、健康な人の34%がS反応性CD4+ T細胞を持っていることを発見した(130)。興味深いことに、これらのSARS-CoV-2血清陰性の健康なドナーは、C末端のエピトープにのみ反応するS反応性CD4+ T細胞を有しており、これは、一般的な風邪の20%を占めるHCoV株のC末端に見られるMHC-IIエピトープが重複しているためである可能性が高い(130,131)。Le Bertらはまた、未感染者におけるSARS-CoV-2反応性T細胞についても報告しており、COVID患者に見られるものとは異なる免疫優勢パターンを示した。しかし、著者らは、エピトープ認識を、HCoVとの相同性が低い動物性CoVの間で保存された断片に起因するとしている(38)。さらに、S、M、およびNタンパク質に対するいくつかの共通の免疫優勢エピトープクラスターがPengらによって以前に同定されたが、優勢エピトープは共通のHCoVとの構造的類似性をほとんど持たないことが示された(112)。別のグループは、COVID-19の回復期患者から得たウイルス反応性メモリーCD8+ T細胞のシングルセル(sc)-RNAシークエンシングを行い、SARS-CoV-2ペプチドで刺激した場合にパンデミック前のサンプルと類似したクラスターを発見した(124)。
これらのT細胞エピトープがどこで重複しているかを完全に解明し、これらの血清陰性者がSARS-CoV-2感染症からの保護の程度を示すかどうかを決定することが重要である。Stervboらは、SARS-CoV-2抗原と最も一般的に見られる病原体のエピトープとの類似性について、広範なin silico解析を行った。いくつかの同一のエピトープが共通のHCoV HKU1およびOC43に見出され、HLA-Iおよび-IIに結合することが予測された(132)。類似のエピトープと交差反応性エピトープがあるにもかかわらず、既存の交差反応性T細胞応答からCOVID-19を保護することに寄与しているかどうかは、まだ明らかにされていない。
全体として、COVID-19による良好な治療成績には、T細胞応答が重要であるように思われる。SARS-CoVのT細胞応答は、SARSパンデミックから 17年が経過した現在まで持続することが示されている(38)。証拠は、SARS-CoV-2に対する交差防御を提供する既存の免疫の欠如を指摘している。しかし、一般的なHCoVに対する既存免疫のT細胞がSARS-CoV-2と交差反応することができれば、既存免疫がパンデミックの拡大を緩和するために何らかの効果を発揮する可能性がある。
COVID-19の免疫病理学は長期的な保護免疫を損なう?
現在の見解では、COVID-19の病態生理は免疫学的な調節障害によって悪化すると考えられている。重症例では、リンパ球減少と炎症性サイトカイン産生の調節異常が過剰な免疫反応を引き起こし、サイトカインストームを引き起こし、その結果、組織損傷、ARDSおよび多臓器不全を引き起こす可能性がある(35, 132)。軽度および重度のCOVID患者のPBMCsからの単細胞RNA-seqでは、TNF/IL-1ß駆動の炎症に関連したすべての細胞型で炎症性の亢進を示しており、重度の患者では強いI型のIFN駆動の炎症反応と共存していることがわかった(134)。英国の病院に入院した患者を対象とした縦断的研究では、入院時の炎症亢進の程度(COV-HI(高炎症性)と定義され、血漿C反応性蛋白質が150mg/mlを超えるか、24時間以内に2倍になるか、フェリチンが1500mcg/mlを超えることで評価される)が予後不良を強く予測していた(135)。
この高炎症性反応は、記憶コンパートメントの形成とそれに続く防御免疫を損なうのだろうか?軽症の患者と比較して、重症のCOVID-19患者における記憶コンパートメントの障害を示唆する決定的な証拠はまだない。しかしながら、重症COVID-19患者における胚中心形成の欠如は、重症化に関連した高抗体価にもかかわらず、これらの患者の体液性応答は短命である可能性があることを示唆しているかもしれない(80)。重症患者の著しいT細胞リンパ球減少症は、抗体およびT細胞を介した反応が炎症性駆動のこの段階で成功するかどうかにも影響を及ぼす可能性がある。
また、T細胞の記憶形成は、慢性炎症の文脈において障害されることが知られている(136)。これが、SARS-CoV-2感染に応答するサイトカインストームの文脈で当てはまるかどうか、また、これがあるレベルの長期的に持続するT細胞免疫の障害につながるかどうかは、まだ不明である。過剰な免疫活性化を伴う重症COVID-19(COV-HI)後に生じる免疫応答が、軽症例で発現する免疫応答と異なるかどうかを理解することが急務である。重症患者でSARS-CoV-2の一次免疫応答が十分に発現しない場合、記憶免疫細胞の形成も失敗する可能性がある。したがって、抗体価や抗体やT細胞のエピトープ標的など、重症患者と比べて軽症患者で発現する適応免疫応答の違いや、メモリーコンパートメントの十分な形成が、SARS-CoV-2再感染に対する防御のレベルに影響を及ぼす可能性がある。
免疫ランドスケープの変動性
過去の免疫状態は、多くの疾患転帰に関与することが知られている。過去の感染症や併存疾患は、さらに免疫状態を変化させる可能性がある。ヒトサイトメガロウイルス(CMV)などの持続性ウイルスとの共感染は、免疫活性化を促進することでAIDSの病気の進行を促進することが知られている(137)一方で、重度のCOVID-19に関連する肥満などの併存疾患は、慢性炎症と免疫機能の低下状態につながる(138)。共感染や合併症以前の状態によって生じる免疫状態は、異なるCOVID-19の転帰と相関している可能性があり、さらなる調査が必要だ。
また、遺伝子の違いが、SARS-CoV-2感染後の異なる免疫表現型に影響を与え、異なる疾患転帰をもたらす可能性もある。最近発表された2つの論文では、生命を脅かすCOVID-19とIFNシグナル伝達経路における先天的なエラー(36)、またはIFNに対する自己抗体の獲得(37)のいずれかによるタイプIFN反応の欠陥との間に明確な関係があることが示されている。COVID-19患者では、B細胞およびT細胞応答の統合に基づいて異なる免疫型が提案されている。CD8+およびCD4+ T細胞のいずれかに対する差動活性化が、患者のサブグループで観察された。同じ研究では、COVID-19患者を活性化されたB細胞応答の2つのパターンに分離し、活性化された体液性応答の証拠がほとんどない第3のグループを同定している(119)。
最近のゲノムワイド関連解析(GWAS)および大規模な免疫フェノタイピング研究では、敗血症患者の転帰の間で免疫学的および遺伝学的プロファイルが比較されている(139)。COVID-19についても同様の機能的ゲノム研究が必要であり、患者間のばらつきを明らかにすることで、免疫病理学的に重篤な反応を示す患者が数人いる一方で、ほとんどの患者がそうでない理由に遺伝学が関与しているかどうかを理解するのに役立つと考えられる(140)。これまでに発表されたCOVID-19遺伝学の最大規模のGWASでは、重篤な疾患との有意な関連を示す染色体3p21.31上の6つの遺伝子クラスターが同定されている(141)。リスク遺伝子型は、機械的換気を必要とする患者において有意に高い頻度で存在することが明らかになった。この遺伝子座には免疫調節に関与する遺伝子が含まれており、その中には、ACE2と相互作用するSLC6A20や、肺常在性T細胞で発現し、気道感染に対する炎症反応の調節に役割を果たすことが知られているCXCR6という受容体が含まれている(142, 143)。さらに、ヒト白血球抗原(HLA)クラスIの遺伝的変異は、COVID-19の重篤な疾患に対する感受性に影響することが示されており、HLA-B*46:01対立遺伝子を持つ患者は特に脆弱である(144)。さらなる遺伝学的研究により、COVID-19の患者の転帰がこれほど劇的に異なる理由が明らかになるであろう。
SARS-CoV-2に対する宿主免疫応答の違いが、個人の過去の免疫学的履歴に起因するのか、遺伝的素因の結果なのか、そしてそれが記憶応答の生成に影響を与えるのかどうかを調べることは、ワクチン戦略を開発する上で重要な検討事項となるであろう。
ワクチンによる免疫
2020年10月29日現在、COVID-19に対するワクチン候補は合計45種が世界中で臨床試験中であり、さらに156種の候補が前臨床評価中である(145種)。そのうち、早期または限定的な使用が承認されているのは、CanSino社が1種、Gamaleya研究所がSputnik V、ベクター研究所がEpiVacCorona、シノバック・バイオテックがCoronaVac、シノファームが武漢研究所と北京生物製品研究所と共同で2種のワクチンである。承認されているワクチンのうち、3種は不活化ウイルスを含むもので、2種は非複製アデノウイルスベクターを使用しており、1種はタンパク質ベースのものである。上述の承認済みワクチンのほか、Moderna社のmRNAベースのワクチンやOxford/AstraZeneca社のChAdOx1ベクターを用いたワクチンなど、この種のワクチンでは初めて第III相臨床試験に入ったワクチンを含め、合計10種のワクチンが第III相臨床試験に入っている(145)。
SおよびNタンパク質は、SARS-CoV、SARS-CoV-2,MERS-CoVの両方に対して、体液性および細胞を介した反応を誘発するため、ワクチン開発のための強力な免疫原であることが証明されている(27, 105, 146)。ヒトの研究から得られた一般的なコンセンサスは、SARS-CoVのSタンパク質はCD4+およびCD8+ T細胞応答と同様に中和抗体を誘導する能力があり、Nタンパク質はほとんどがT細胞応答を誘発するという結論に達している(146, 147)。
最初のSARSパンデミック後、SARS-CoVに対するSタンパク質発現ワクチンは、中和抗体産生を媒介とした防御免疫を誘発することが示された(28, 148, 149)。Sタンパク質をベースにしたDNAワクチンは、高力価の中和抗体を誘導し、ウイルスの侵入を抑制することができたが、SARS-CoVに対する細胞を介した防御効果はなかった(28)。しかし、その後の動物実験では、致死量のウイルスに挑戦したマウスでは、SARS-CoVに特異的なメモリーCD4+T細胞やB細胞が存在しない場合でも、S特異的メモリーCD8+T細胞が防御免疫を誘発することが示された(127)。その後、Nタンパク質をコードするDNAワクチンや合成Nペプチドワクチンの試験では、SARS-CoVチャレンジモデルにおいて強力なCD8+ T細胞応答が得られ、防御免疫が得られた(150-152)。マウスを用いたSARS-CoVワクチンの初期の前臨床研究では、Nタンパク質をベースにしたDNAワクチンの免疫化により、強力なCTL反応が誘導されることが示されている(150)。この前臨床研究で得られた証拠は、回復した患者の高い中和抗体価の観察結果と相まって、抗Sタンパク質抗体とNタンパク質に対するCTL反応がSARS-CoVに対する免疫を提供するために必要である可能性が高いと信じるに足る十分な理由となった。しかし、SARS-CoV感染が消失したため、これらのワクチンの有効性試験は行われなかった。
SARS-CoV-2ワクチンの開発に向けての競争の中で、最初の結果は、マカクを用いたプライムブースト体制でのSベースのDNAワクチンが、回復したヒトやマカクで発見されたものと同様のNAb価を誘導することを示している(32)。これらの抗体は、完全にプレフュージョン安定化されたSタンパク質を使用したワクチン接種後、より優れた中和能力を示した。SARS-CoV-2との対戦では、ワクチンによって誘発されたNAbは、抗体の効力に直接関係するいくつかの自然免疫エフェクター機能とともに、防御の主要な相関関係にあるように思われた(39)。ChAdOx1 nCoV-19ワクチンは、Sタンパク質を発現するChAd(チンパンジーアデノウイルス)ウイルスベクターをベースにした、現在進行中の別のワクチン試験で、非ヒト霊長類でSARS-CoV-2チャレンジ後の肺病理学的予防に一定の効果があることが示された(98)。すべての免疫を受けたサル(6/6)は、対照群(2/3)に見られた肺炎の発症から保護された。免疫を受けた群では、BAL液中のウイルス負荷は有意に減少したが、鼻腔スワブ(NS)中のウイルス負荷には対照群と比較して差は見られなかった。免疫化は、ウイルス脱落の有意な減少を伴わずに、病因の重症度を低下させるようである。著者らは、ADEの兆候は見られず、鼻腔内スワブ中のウイルスの持続性は、チャレンジに使用された高濃度のウイルスのせいであるとしている(98)。これらの結果は心強いものであり、これらの最初のワクチンは、たとえ真の免疫を提供するには不十分であっても、重症化に対する保護を提供する可能性があることを示唆しているかもしれない。
ヒトでは、Modernaワクチンとして知られ、S糖タンパク質をコードするRNAをカプセル化した脂質ナノ粒子をベースにしたmRNA-1273ワクチンの2回の接種により、これまでのところ、抗体およびCD4+ T細胞応答を誘発することが証明されているが、CD8+ T細胞応答は低い(153)。ChAdOx1 nCoV-19の第I/II相試験のデータが発表されており、Sタンパク質の免疫原性が実証されており、中和抗体とウイルス特異的エフェクターT細胞応答の両方を誘発し、大きな副作用はないことが示されている(154)。中和抗体は単回の投与で誘導されたが、プライム・ブースト・レジメンは有意に高い中和抗体の力価を誘導することが示されている(以前のマカクの研究では、再感染に対する保護を与えるのに十分な大きさであると考えられていた)。現在第III相試験中のワクチンのうち少なくとも10種は、ワクチン接種に反応してNAbの力価が誘導されたと報告している(155-157)。細胞性免疫応答については限られたデータしか報告されていないが、10種すべてのワクチンはIFN-γアッセイで検出可能なウイルス特異的T細胞応答を起こしているようであるが、その大きさは様々である。現時点では、ワクチンによる免疫応答が自然感染と比較して持続性があるかどうかは定かではない。しかし、結果は、Th1型分極を伴う堅牢なウイルス特異的T細胞応答の誘導が確かに可能であることを示唆している。
様々なワクチンのサブタイプを対象とした第I/II相試験の発表結果から、アジュバントタンパク質ベースのワクチンが最も免疫原性が高く、次いでmRNAワクチン、ChAdOx1,不活化ワクチンが続き、AdV5ベースのワクチンはNAb価の点で最も免疫原性が低いことがわかったが、使用するアッセイの違いにより、これらの試験を直接比較することは困難だ(155)。AdV5ベースのワクチン(CanSino)は、特に高用量で、AdV5に対する既存の免疫を持っている可能性の高い高齢の患者では反応原性があることが示されている(158)。不活化ワクチンとmRNAワクチン(それぞれSinovac社とPfizer社から)を含む第III相候補の一部のワクチンは、すでに高齢者では免疫原性が著しく低いことが示されており、持続的な保護効果を得るためには、ブースターレジメンや高用量投与が必要となる可能性がある。
これらの研究では、Sタンパク質に対するT細胞反応の発生が指摘されているが、S特異的CD8+ T細胞の存在がどの程度の保護効果をもたらすのかについては言及されていない。例えば、mRNA-1273(Moderna)ワクチンは、Sタンパク質に対するCD4+応答は良好であり、検出可能ではあるがCD8+ T細胞応答は低いことが示された(153)。最近、軽症から回復した患者は、重症患者と比較して、Sタンパク質よりもMまたはNタンパク質に特異的なCD8+ T細胞の頻度が高いことが示された(112)。同じ研究では、Sタンパク質は実質的なCD8+ T細胞応答を生成するが、免疫優勢ではないようであることが指摘されている(112)。このことは、S抗原のみを用いたワクチン候補に大きな意味を持つ可能性があり、自然のSARS-CoV-2感染よりも狭いCD8+ T細胞応答を引き起こす可能性がある。効果的なCD8+ T細胞誘導ワクチンには、スパイクタンパク質以外の抗原が必要となる可能性がある。新たな研究では、SARS-CoV-2ゲノム全体でCD4+とCD8+の両方の応答を活性化すると予測されるエピトープが同定されており、これにより長期的な免疫が誘導される可能性がある(125)。異なるエピトープの組み合わせは、強力で効果的なワクチンによる防御を提供するために、強固な記憶応答を構築するのに役立つかもしれない。
さらに、臨床試験中の現在のワクチンの大部分は、皮膚または筋肉を介して投与されている。この投与経路では、自然感染で発生するような上気道の保護免疫反応を発生させることができない可能性がある(98)。Hassanらは、ChAdベクターSワクチンの単回の経鼻投与により、マウスの殺菌免疫を提供するのに十分な局所免疫応答が誘導されることを実証した(163)。上気道でIgA粘膜抗体反応を発生させることができるワクチンによる局所免疫は、麻疹ワクチンやBCGワクチンのエアゾール投与の成功例で示されているように、効果的な早期クリアランスのための強固な戦略を提供すると信じるに足る理由がある(164, 165)。
議論
最近のSARS-CoV-2の報告から得られた新たな証拠と、20年近くにわたるSARS-CoV研究の文献を組み合わせることで、自然感染またはワクチンを用いて、ヒトにおいてSARS-CoV-2に対する防御免疫を発現させることが可能であると考えるに足る十分な理由が得られた。長期的な防御免疫を得るためには、十分な量のNAbsの循環と、ウイルス特異的な中心記憶CD4+およびエフェクター記憶CD8+ T細胞からなる強力なT細胞応答の両方が必要であると考えられる。自然感染が再感染に対する長期的な保護を提供する体液性および細胞介在性の免疫応答を誘導するかどうか、また、これがワクチン接種によって生成された免疫応答とどのように比較できるか、炎症性応答がメモリーコンパートメントの適切な形成を損なうかどうかは、現在のところ不明である。
安全な SARS-CoV-2 ワクチンの開発は、病気の重症化を支える免疫病理学的反応の証拠があるため、より複雑なものとなっている。SARS-CoVで実施された研究では、肺胞細胞への直接的な組織損傷とともに、抗体依存性増強が指摘されており、今後のSARS-CoV-2ワクチン研究では注意が必要だ。完全長のSタンパク質配列を使用したワクチン候補は、この抗原に対する免疫病理学的反応を起こす素因を持つ特定の個体には逆効果である可能性がある:Sタンパク質に対する有害反応の生物学的基盤を解明する必要がある。
最近のサルを用いた研究では、SARS-CoV-2 Sタンパク質では逆効果の反応は観察されず、高力価の抗RBD中和抗体を誘導することで、免疫原性反応を引き起こすリスクを最小限に抑えて保護することが可能であることが示唆されており、ワクチン開発のための有望な道筋となっている。Sタンパク質のみを利用したワクチンの注意点としては、細胞性免疫応答が狭くなり、誘導される抗体のスペクトルが狭くなり、防御効果が低下する可能性があるということが挙げられる。しかし、現在臨床試験が行われているワクチンのデータは、Sタンパク質に対する強力な中和抗体価と様々な程度のウイルス特異的T細胞応答を示しており、有望視されている。Sタンパク質に対する強力な免疫反応だけで十分な防御が得られるかどうかはまだ不明であるが、先に述べた動物実験から得られた限られたエビデンスから、重症化した疾患に対する防御としては十分である可能性があると考えられる。最近では、Sタンパク質を用いた経鼻免疫の試験で、局所粘膜反応を含む幅広い範囲の抗体やT細胞反応を誘発することが示されており、ワクチンの有効性を向上させるための有望な手段となる可能性がある(163)。
私たちは、重症患者と無症状または軽症患者の間の免疫学的プロファイルの違いを解読し始めている。自己免疫疾患と同様に、このような免疫応答の異常は、初期の感染量、ウイルスや宿主の遺伝、過去の抗原曝露の個人プロファイルに基づいて、重症化する素因を持っている一般集団の特定のグループでのみ発生する可能性がある。このような理由から、COVID-19患者の大規模な免疫フェノタイピングは、ワクチン開発のための世界的な研究ロードマップ上で重要な位置を占めている。
重要なことに、SARS-CoVで実施された前臨床研究に基づいて、ワクチン接種によって疾患の増強を引き起こす免疫病理学的応答を発生させる可能性はまだ低い(86)。これまでのところ、SARS-CoV-2のワクチン候補の動物試験では、免疫増強病理学的反応やTh2に偏った反応の証拠は示されておらず(39,98)第III相臨床試験中の10のワクチン候補はすべて、これまでのところ、ワクチン接種に直接関連した有害事象は示されておらず、疾患増強を懸念するに足るものではなかった(145)。
全体として、SARS-CoVおよびSARS-CoV-2感染症の観察研究から得られたエビデンスと、42のワクチン候補の臨床試験から得られた有望なデータは、SARS-CoV-2ワクチンが安全であり、生涯ではないにしても何年も持続的な防御免疫を提供する可能性があることを推測するのに十分な理由を提供している。今後の研究では、NAbsおよび/またはウイルス特異的T細胞応答が感染、感染、重症化に対する防御を提供するかどうかについて、決定的な証拠が得られることが期待されている。保護を提供するために必要なウイルス特異的細胞応答の大きさと特徴、または抗体応答の力価を理解することは、ワクチン設計と公衆衛生政策の両方に指針を与え、感染拡大を制限することになる。
