Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC4783265/
J Photochem Photobiol B. 2016 Apr; 157: 89-96.
オンライン公開 2016 Feb 5.
Ximing Wu,a,b,c Xiaoqing Hu,b,c,d and Michael R. Hamblinb,c,e,*.
概要
紫外線血液照射(UBI)は、1940年代から1950年代にかけて、敗血症、肺炎、結核、関節炎、喘息、さらには小児麻痺を含む多くの疾患の治療に広く用いられた。初期の研究はアメリカの数人の医師によって行われ、American Journal of Surgery誌に掲載された。しかし、抗生物質の発達により、UBIの使用は減少し、現在では「時が忘れた治療法」と呼ばれている。その後の研究は、ロシアの研究者や他の東洋の国々で行われたものがほとんどであり、西洋諸国における現代の見解では、UBIは依然として非常に議論の多いものである。この総説では、感染症治療に用いられる現在の方法の代替法として、免疫調整療法として、また血液パラメーターを正常化する方法として、UBIの可能性を論じている。低用量の紫外線はDNAを損傷することにより微生物を死滅させるが、宿主細胞のDNA損傷はDNA修復酵素により迅速に修復される。しかし、敗血症の治療にUBIを用いるのは、紫外線による血流中の細菌の死滅だけが理由ではない。最適な効果を得るためには、血液量のわずか5~7%を紫外線で処理する必要があり、より高用量ではダメージを与える可能性があるからだ。ソラレンとUVA照射を用いた体外式光フェレーシス(ECP)と類似している部分があるかもしれない。しかし、UBIは免疫系を刺激する傾向があり、ECPは免疫抑制的な傾向があるという点でUBIとECPは異なっている。近年、あらゆる抗生物質に耐性を持つ細菌が出現していることから、UBIは感染症に対する代替的アプローチとして、また免疫調節療法として、より一層研究されるべきであると考えられる。
キーワード:血液への紫外線照射、全身感染症、DNA修復、血球、食細胞、リンパ球、体外式光フェレーシス、骨髄、サイトカイン
1 歴史的な紹介
紫外線(UV)は電磁スペクトルの一部で、可視光線(400-700nm)より短く、X線(100nm未満)より長い波長域(100-400nm)を持つ。紫外線は、真空紫外(100-200nm)、UVC(200-280nm)、UVB(280-315nm)、UVA(315-400nm)の4つの波長域に分類される。
1801年、ドイツのイエナ大学に勤務していたポーランド人の物理学者Johann Wilhelm Ritterは、スペクトルの紫色より先の光を発見し、「化学線」と呼び、後に「紫外線」と呼ばれるようになった[1]。1845年、ボネ[2]は、太陽光が結核性関節炎(関節の細菌感染症)の治療に利用できることを初めて報告した。
19世紀後半になると、太陽光の治療応用(ヘリオセラピーとして知られている)が徐々に普及していった。1855年、スイスのリクリがスロベニアのベルデにヘリオセラピーを提供するための温泉施設を開設した[3]。1877年、ダウンズとブラントは、偶然にも太陽光がバクテリアを殺すことを発見した[4]。彼らは、窓辺に置いた砂糖水が日陰では白濁し、日向では透明なままであることに注目した。2つの溶液を顕微鏡で観察したところ、日陰の溶液では細菌が繁殖していたが、日光に当てた溶液では繁殖していなかったのだ。
1904年、デンマークの医師ニールス・フィンセンは、紫外線による皮膚疾患の治療でノーベル生理学・医学賞を受賞した。彼は何千もの症例、主に尋常性狼瘡として知られる皮膚結核の形態で98%の成功率を記録した[5]。Walter H Udeは1920年代に100例の丹毒(Streptococcus pyogenesによる皮膚感染症)を報告し、紫外線皮膚照射で高い治癒率を得た[6]。
ワシントン州シアトルのEmmett K Knott(図1)は、皮膚への紫外線照射の有益な効果は、皮膚の表層毛細血管を循環する血液への照射によって(少なくとも部分的に)説明できるかもしれないと推論した。そこで、共同研究者のエドブロムとともに、血液に直接紫外線を照射することができる照射室をつくった。照射室は円形で、上部の石英窓の下には、入口と出口をつなぐ迷路状の通路がある。(a) 紫外線を吸収・遮断する血液膜が窓の上に形成されるのを防ぐため、(b) チャンバーを通過するすべての血液が均等に紫外線に曝露されるようにするためである [7] 。
図1 ワシントン州シアトルのエメット・K・ノット(Emmett K Knott)

Knottたちは、黄色ブドウ球菌と溶血性連鎖球菌を静脈内感染させた犬から採取した血液に紫外線を照射し、処理後の血液を再輸送する実験を繰り返した。その結果、すべての菌を直接殺すのに十分な量の血液を照射する必要がないことがわかった。また、犬の全血液量を照射する必要もないことがわかった。最適な照射量は、推定血液量の5〜7%、体重1kgあたり約3.5mLであることが判明した。これを超えると、治療の効果は失われる。治療された犬はすべて圧倒的な感染症から回復し(対照群では多くの犬が死亡した)、4ヶ月の観察後、誰も悪い影響を示さなかった[7]。
ヒトに対する最初の治療は、1928年に溶血性連鎖球菌による敗血症を合併した敗血症性流産の後、患者が死産状態にあると判断されたときに行われた。最後の手段としてUBI療法が開始され、患者は治療に反応し、完全に回復した[7]。その後、彼女は2人の子供を出産した。
HancockとKnottは、溶血性連鎖球菌による敗血症が進行した別の患者に対して同様の成功を収めた[8]。これらの研究者は、ほとんどの症例で、UBIの開始時に著しいチアノーゼが存在することを指摘した。治療中(または治療直後)にチアノーゼが急速に緩和され、呼吸が改善されるとともに、皮膚の赤みが増し、蒼白さが明らかに失われたことが確認された。
これらの観察から、肺炎を患っている患者にUBIを適用することになった。肺炎の診断がX線で確認された75例のシリーズでは、すべての患者がUBIによく反応し、体温の急速な低下、チアノーゼの消失(多くは3〜5分以内)、せん妄がある場合はその停止、脈拍の著しい減少、肺の圧排が急速に行われた。入院期間と回復期間の短縮は定期的に行われた。
これらの成功によって得られた知識は、より完全に均一な照射ができるように照射室を設計し直し、「ノット式紫外線血液照射法」につながった。設計変更された照射装置(図2)が多数製造され、この術式に関心を持つ医師の手に渡り、より多くの臨床データが蓄積されるようになった[7]。この技術は、約3.5 mL/kgの静脈血を採血し、抗凝固のためにクエン酸で処理した後、放射線室に通し、再注入するものである。単位量あたりの照射時間は約10秒で、水銀石英バーナーによるピーク波長253.7nm(紫外線C)の照射を行い、すぐに再灌流を行う[7]。
図2 ノット社の血液照射器

ペンシルベニア州フィラデルフィアのハーネマン病院のジョージ・P・マイリーは、血栓性静脈炎、ブドウ球菌性敗血症、腹膜炎、ボツリヌス中毒、小児麻痺、治癒しない傷、喘息の治療法として、一連の記事を発表した[9-22]。
1940年、ニューヨークのウィラード・パーカー病院のヘンリー・A・バレットは、多くの感染症を含む110のケースについて報告した。感染性関節炎、敗血症性流産、変形性関節症、結核腺、慢性眼瞼炎、乳様突起炎、ブドウ膜炎、癤腫症、慢性副鼻腔炎、尋常性ざ瘡、二次性貧血など29の異なる状態が反応すると記述されている [23, 24]。
ペンシルベニア州ピッツバーグのシャダイサイド病院のEV Rebbeckは、大腸菌性敗血症、中絶後敗血症、産褥性敗血症、腹膜炎、腸チフスでUBIの使用を報告した[25-29]。
NE州リンカーンのプロビデンス病院のRobert C Olneyは、胆道疾患、骨盤内蜂巣炎、ウイルス性肝炎をUBIで治療した[30-32]。
血液への紫外線照射は、1940年代から1950年代にかけて、重篤な感染症を治療する奇跡の治療法として歓迎された。しかし、運命の皮肉なことに、この時期はペニシリン系抗生物質が広く導入された時期と重なり、ペニシリン系抗生物質はさらに大きな奇跡の治療法であることが急速に判明したのである。さらに、UBIのもう一つの大きな成功であったポリオの治療も、ソークワクチンの導入に取って代わられることになった。1960年代以降、UBIは欧米で使われなくなり、現在では「時が忘れた治療法」と呼ばれている[33]。
このレビューでは、感染症に対する代替アプローチとして、また免疫系を調節する新しい方法として、UBIのメカニズムと可能性を議論する。我々の目標は、より多くの研究を続け、より多くの臨床的利用法を探求することを人々に思い出させることだ。トピックとしては、感染症(細菌性およびウイルス性の両方)に対するUBIの有効性、自己免疫疾患、疾病の治療、考えられる作用機序、体外式光フェレーシスとの比較などがある。
2 UBIの作用機序
UBIの使用は、血液の様々な成分に影響を与えることが報告されている。多くのin vitroの研究で証明されているように、UBIは白血球の機能を変化させることができる。紫外線は白血球混合培養において刺激細胞を増加させ、マイトジェン刺激培養においてヘルパー細胞を調節することができる。また、紫外線はサイトカイン産生を逆転させ、サイトカイン放出を阻害することができる。紫外線は細胞膜の動員を妨害することができる(図3)
図3 UBIの作用機序の一部
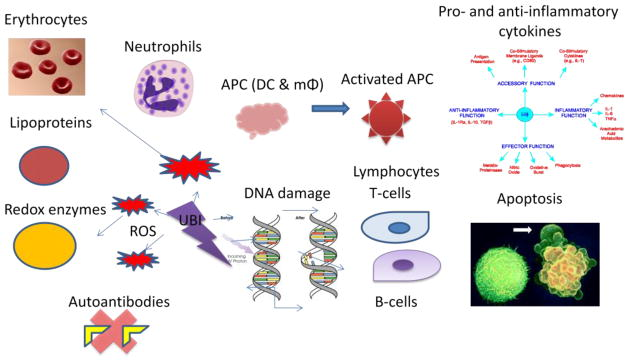
2.1 赤血球への影響
長波長紫外線が赤血球によるK+イオンの喪失を誘導するプロセスを強く制限することが、嫌気的条件下で報告された。Kabatは、紫外線照射が赤血球の浸透圧特性に影響を与え、その微細な構造を変化させ、アデニンヌクレオチドの代謝に影響を与えることを示した。照射時間(60分、120分、180分、240分、300分)を用いた。ATPは減少し、ADP、AMPおよびアデニン化合物は増加した。また、低張のNa+とK+のイオン交換とヘマトクリット値が増加することがわかった。[34]
Rh陽性の血液に紫外線を照射すると、免疫吸着活性が有意に増加した。Vasil’evaら[35]は、赤血球と白血球-血小板懸濁液の両方について、紫外線の照射レベルを変えて研究した。全血と赤血球では照射直後から免疫吸着活性が上昇したが、白血球-血小板懸濁液では2日後に免疫吸着能が失われた。
ポリデキストランを含む2相ポリマー系を用いて、自己輸血用血液の1時間紫外線照射を検討した。彼らは、循環赤血球の細胞表面特性が変化し、それが自己輸血の延長とより効果的な治療効果に寄与していることを見出した[36]。Snopovら [37] は、臨床治療として紫外線照射を行った場合、赤血球のグリコカリクスの状態におけるいくつかの構造的な障害が関係していることを示唆した。細胞化学的およびアイソセロジカルな方法を用いて、紫外線照射後に血液の自己輸血が改善されることが示された。
一木ら [38] は、赤血球の細胞体積と膜電位が紫外線照射によって変化することを示した。低線量(< 0.1 J/cm2)では多核白血球の過酸化物(H2O2)産生が増加し、異なる血液細胞の中で最も顕著であったが、線量の増加により産生は減少し、血小板の過酸化物産生は低線量では最低であるが0.4 J/cm2以上の線量で急に増加した。
2.2 好中球への影響
UBIの好中球に対する酸化促進作用は、アラキドン酸またはリゾホスファチジルコリン(LPC)、および複合体形成剤であるα-トコフェロールによって抑制される可能性があることがわかった。これらの化合物は、UVRと食細胞との相互作用を阻害した[39]。慢性炎症性疾患において、自己輸血された血液にUBIを実施すると、大きなIC-IgG、IgM、小さなIC-IgM免疫複合体の濃度は、線形および反転した相関を示した[40]。ヒト末梢血由来のUV-B照射単核細胞の機能は、デオキシリボヌクレオシド補充により増強され、またUV-BまたはUV-C照射後にTリンパ球の生存が増強された[41]。
Artiukhovは、光照射した好中球による一酸化窒素(NO)生成は、紫外線照射によってde novoアップレギュレートされたiNOS合成の活性化に起因し、TNF-α生成にも影響を与えることを示唆した。低線量(75.5J/m2)照射では、NOのネイティブレベルに対する効果により、生理的恒常性の維持が改善された。より高線量(755および2265J/m2)を好中球に照射すると、NO代謝物濃度が上昇し、異なる効果が得られた。シクロヘキシミド(タンパク質合成の転写阻害剤)存在下で紫外線照射を行った細胞は、iNOS合成の活性化を阻止することができた。血液細胞への高線量紫外線照射(755 J/m2)は、NOとTNF-αの濃度に正の相関を示した[42]。
Zor’kinaは30日間の一連のウサギ実験を行い、UBI後の低ダイナミクスを伴う慢性ストレスの緩和は、好中球の動員や凝固の低下によって引き起こされることを示唆した。これらの効果は、長期的な低ダイナミクス下での身体機能の改善と慢性ストレスの軽減に寄与していた。UBIは好中球の活性化、播種性血管内凝固の低下、アテローム性代謝の変化により、ストレスを軽減する適応過程を促進した[43]。
2.3 リンパ球への影響
UBIは深部まで浸透しない、標的細胞への吸収が限定されるなどの欠点があるが、特にUVB領域では免疫機能や免疫原性が用量依存的に抑制されうるため、臓器移植や輸血において有用であると考えられる。UBIはリンパ球の生存率を低下させるが、3つのスペクトル領域の中ではUVC照射が最も効果的であると思われる。UVBおよびUVCの照射は、in vitroにおける白血球の増殖能、刺激能、付属器官/抗原提示能を消失させることができる。細胞表面の特性、カルシウムの動員、サイトカインの産生と放出、および他のサブセルラープロセスは、UV照射によって変化する可能性がある[44]。Arelttら [45] は、ヌクレオチド切断修復の指標として鎖切断の「コメット」アッセイ(単一細胞ゲル電気泳動法)を用いて、循環ヒトTリンパ球がUV-B放射のDNA損傷および致死効果に対して絶妙な過敏性を持つことを証明し、紫外線Bが毛外Tリンパ球への直接効果を介して免疫抑制に貢献している可能性があることを提起している。
Schievenらは、表面免疫グロブリン架橋後、B細胞におけるUV誘発チロシンリン酸化は、T細胞におけるCa2+シグナル伝達後に見られるものと非常によく似ていることを観察した。つまり、リンパ球の機能に対する紫外線照射効果は、チロシンリン酸化とCa2+シグナルの両方を誘導しうるということだ。リンパ球膜の Ca2+ チャネルは紫外線に敏感であり、さらに紫外線は細胞内シグナル伝達過程の活性化を通じて DNA を傷害する可能性がある。紫外線は、線量と波長に依存して、リンパ球のチロシンリン酸化を誘導するだけでなく、Jurkat T細胞のCa2+シグナルと関連するタンパク質合成を誘導することが可能である。さらに、紫外線照射したB細胞とCa2+処理したT細胞では、表面免疫グロブリン架橋のパターンが非常に類似していた。この研究では、CD4+およびCD8+正常ヒトT-リンパ球細胞は、紫外線照射中に強い反応を示し、Ca2+反応を誘導することが判明した[46]。
別の同様の研究で、Spielbergら[47]は、紫外線によるリンパ球の抑制がCa2+ホメオスタシスの崩壊を伴うことを見出し、リンパ球膜に異なる影響を与える紫外線とガンマ線照射を比較検討した。その結果、紫外線照射に感受性のあるリンパ球膜にCa2+チャネルの存在を見出した。UVCまたはUVBを照射したヒト末梢血白血球(PBL)およびJurkat細胞において、機能アッセイと並行して、Indo-1およびサイトフルオロメトリを用いて[Ca2+]i動態を測定した。紫外線による[Ca2+]iの上昇は、主に細胞外カルシウムの流入によるものであり、非T細胞よりもT細胞で顕著であった。照射後2-3時間以内に[Ca2+]iが増加することが観察された。これらの増加は紫外線量に依存し、UVBとUVCではベースラインレベル(130 nM)の240%と180%で最大となった。紫外線照射により、T細胞では非T細胞よりも多くの[Ca2+]iが上昇し、これは細胞外カルシウムの流入に起因する。紫外線によるカルシウムシフトと紫外線の細胞膜への照射は、フィトヘマグルチニン(PHA)に対する応答感度と白血球混合培養を刺激する能力を低下させたが、これは紫外線が[Ca2+]iシフトを引き起こすためである。
Lindahl-Kiessling が最初に報告したように、一連の研究により、UVR 照射リンパ球は混合リンパ球培養(MLC)において同種細胞を誘導できないことが確認された [48-50]。樹状細胞(DC)のような特殊な付属細胞によって形成されるクラスターは、分裂促進剤または同種異系の刺激後に、リンパ球の活性化が起こるために必要であった。Aprileは、培養前のDCに紫外線を照射すると、アクセサリー活性が完全に消失し、クラスター形成と増殖の両方を阻害できることを発見した[51]。
ヒトリンパ球のUV照射による分化は、これらの細胞におけるUV照射ダメージの修復を加速させることができた[52]。紫外線照射は、予定外のDNA合成値において、紫外線照射とメタンスルホン酸メチル(MMS)の組み合わせよりも有効であり、特にMMSはDNAをアルキル化することによりDNA修復ポリメラーゼに影響を与えるため、紫外線照射の前(2時間または26時間のインキュベーションのいずれか)に投与した場合であった [53].HLA-D/DR 抗原の光化学修飾は、紫外線照射による免疫担当細胞の活性化の引き金となる可能性がある。非照射血液とUBI照射血液を異なる比率(1:10、1:40、1:160)で混合した血液からリンパ球が分離された[54]。
Pamphilonは、血小板濃縮物(PC)を紫外線(UVL)で照射し、DuPont Stericell容器で5日間保存すると、非免疫原性になる可能性があると報告した。乳酸値、β-トロンボグロブリン、血小板因子は増加し、グルコース値はDuPont Stericellバッグで平均波長310nmで3000J/m2の照射で減少した[55]。血小板濃縮液(PC)のUVB照射は、CD14のダウンレギュレーションを促進し、ICAM-1とHLA-DRのアップレギュレーションを抑制して単球の喪失を非特異的に増加させた[56]。しかし、血小板濃縮液を紫外線照射すると、細胞懸濁液で誘導される免疫学的反応が低下した[57-59]。
Deegらは、同腹の犬に輸血を行うと、移植片がDLA同一であるにもかかわらず骨髄移植片が拒絶される一方で、輸血を行っていない犬は一様に持続的な生着が得られたというモデルを研究した。輸血前の血液のUBIはin vivoでの骨髄移植片の拒絶反応を防いだ。9.2Gyの全身照射(TBI)も行い、2.8±2.1×108/Kgのドナー骨髄細胞を注入し、全血を1.35J/cm2の紫外線に30分間曝露した後、レシピエント犬に注入した。偽血を輸血した対照群では移植片が拒絶されたが、骨髄移植前に紫外線を照射した治療群では拒絶反応が起こらなかった。血液への紫外線照射は、重要なDC依存性シグナルを除去することによりDCの活性化を低下させ、その結果、その後のDLA-同一骨髄移植は成功した[60]。
Oluwoleら [61] は、心臓移植の前に紫外線照射した血液をレシピエントに輸血することで、免疫反応を抑制し、リンパ球の反応を低下させることができることを示唆した。彼の研究では、3 種類のラット系統(ACI、Lewis、W/F)が心臓移植に使用された。ACIラットにルイスラットの心臓を移植し、移植の1,2,3週間前に紫外線照射輸血の有無にかかわらずドナー型血液を1mL輸血したところ、ACIリンパ球との混合リンパ球反応はUBIなしの場合に比べてルイスリンパ球への反応が弱く、他の2系統の心臓移植でも同様の結果が得られた。ドナーアカゲザル陽性血液への紫外線照射は、アカゲザル抵触性溶血性疾患の小児における交換輸血の治療効果増大に利用できる[62]。
Kovacsら[63]は、DNA修復合成が2〜16J/cm2のUV-C光の照射量に依存していることを発見した。これは、51人の健康な血液ドナーの照射したリンパ球と未照射のリンパ球で評価されたものである。2, 4, 8, 16 J/m2の照射(253.7 nm)を行い、DNA複製合成を阻害するために照射30分前に加えたヒドロキシ尿素(2 mM/2 ×106細胞)存在下で、[3H] チミジン取り込みによりDNA合成量を測定した。17歳から74歳まで、年齢による有意な差は認められなかった。
Teunissenら [64] は、UVB照射はTh1、Th2、CD4、CD8 T細胞サブセットに選択的な影響を与えないことを示唆した。異なる線量のUVB照射を比較すると、光毒性効果はすぐには現れないが、低線量のUVB照射(LD50:0.5-1 mJ/cm2)は48-72時間後にほとんどのT細胞を殺すのに十分であった。照射後72時間ですべてのサイトカイン(IL-2、IL-4、IL-5、IFN-γ、TNF-a)の用量依存的な減少がみられた。このサイトカイン産生の減少は、生存率の低下と相関していたので、サイトカイン産生の減少は、細胞死によって直接引き起こされた可能性がある。しかし、CD4+あるいはCD8+ T細胞サブセットの比率、およびCD4とCD8の発現は、未照射対照と比較してUVBによって変化しなかったことから、2つのT細胞サブセットのいずれも選択的に影響を受けていないことが示唆された。
2.4 貪食細胞への影響
Samoı̆lovaの研究では、非照射血液と1:10容量の照射血液を混合し、単球と顆粒球のPhAを測定している。紫外線を照射した血液を健康な成人に輸血したところ、非照射血液に比べて1.4〜1.7倍ものPhAが増加したのである。PhAの増加は、その初期レベルに依存し、細胞表面成分の構造変化と同時に起こる可能性がある[65]。
Simonら[66]は、UVBがランゲルハンス細胞(LC)または脾臓付着細胞(SAC)を免疫原性から寛容性タイプのAPC(LCまたはSAC)に変換できることを示している。彼の研究では、単回照射(200J/m2)がランゲルハンス細胞とSACに用いられた。UVB-LCまたはUVB-SACで、キーホールリンペットヘモシアニン(KLH)プレインキュベーション後のTh1応答の喪失を調べた。さらに、反応性の低下は可溶性抑制因子の放出とは関係なく、Ag特異的、MHC制限的であり、長時間は続かないことを明らかにした。UVB-LC や UVB-SAC による応答性の低下は、未照射の同種 SAC では誘導できないことから、同種 LC や SAC のコスティミュレーションシグナルの伝達機能は UVB によって阻害されることがわかった。
紫外線照射は、ヒト単球および顆粒球の貪食活性を向上させた。貪食指数の向上は、照射量および初期レベルに関連していた。紫外線照射後、初期レベルが低いほど、高い初期レベルよりも比例して増加した。紫外線照射は直接的に貪食活性を高めることがわかった[67]。
2.5 低密度リポタンパク質(LDL)に対する影響
Roshchupkinら[68]は、紫外線照射が血液細胞の膜における脂質の過酸化に中核的な役割を果たすことを見いだした。血液に紫外線を照射すると、シクロオキシゲナーゼの触媒反応によってアラキドン酸が産生される。紫外線は、その後しばらくの間、フリーラジカルを生成する暗黒脂質の自己酸化のプロセスを誘発した。脂質の光酸化に寄与し、脂質のヒドロペルオキシドを生成した。
紫外線照射した脂質エマルジョンは、単球による活性酸素種(ROS)産生を大幅に促進した。また、循環系では、高度のアテローム性酸化LDLが生成される可能性がある。リポファンディン」と呼ばれる脂質エマルジョン(大部分がリポキシゲナーゼ、Fe3+または紫外線によって酸化されたリノール酸からなる)をウサギに注入し、紫外線照射を行った。リポファンディン投与前と投与6時間後にEDTAで耳介静脈から採血を行った。リポファンディンを紫外線で酸化した場合、単球からの化学発光の誘発はFe3+の酸化と比較して少なかったが、その持続時間は2.3倍であった。同濃度のチオバルビツール酸反応物質(TBARS)であっても、単球が変化したLDLよりも紫外線酸化リポファンディンの方が細胞によるH2O2産生を効果的に刺激することが示された。酸化リポフンディンを注射して6時間後、過酸化脂質含量が有意に増加したが、ウサギ血漿から分離したLDLの中性脂質は単球酸化ヒトLDLと有意差を認めなかった[69]。
Salmon [70]は、UVB (280-315 nm) 照射がLDLおよび高密度リポタンパク質 (HDL) のトリプトファン (Trp) 残基を容易に損傷することを見出した。トリプトファン残基の光酸化を測定するために、TBARSアッセイを用い、低密度及び高密度リポタンパク質不飽和脂肪酸の過酸化を伴うことを明らかにした。低密度および高密度リポタンパク質によって運ばれるビタミンEとカロテノイドもまた、UVBによって急速に破壊された。しかし、UVA放射はトリプトファン残基と脂質の光酸化を破壊しなかった。
紫外線(波長290-385 nm)は、表皮細胞を養う間質液の代表である健康なボランティアの吸引水疱液に含まれるリポ蛋白質を容易に酸化させた。LDLのアポリポタンパク質B、アポリポタンパク質A-IおよびIIは、いずれも紫外線照射により同じように変化することがわかった。アルブミンのトリプトファン1残基は、照射中の光酸化に対して非常に感受性が高かった。吸引水疱液の原液にUVAを照射すると、アポA-Iの凝集が誘発されたが、精製リポ蛋白は分解されなかった。吸引ブリスター液に紫外線を照射すると、抗原性アポリポ蛋白Bが断片化、重合化する。紫外線照射中の吸引ブリスター液中の活性化酸素ラジカルは、HDL中の過酸化脂質に由来するものであった。さらに、HDL の過酸化脂質はラジカル連鎖反応によって引き起こされ、最初の光損傷を伝達する可能性が示唆された。紫外線照射は、炎症および全身に影響を及ぼすリポ蛋白の光酸化の誘発による変性に重要な役割を果たす可能性がある。[71]
2.6 レドックス状態への影響
Artyukhovら[72]は、線量依存的な紫外線照射がドナー血液中のミエロペルオキシダーゼ(MPO)及びNADPH-オキシダーゼ系と過酸化脂質(LPO)濃度を活性化することを見出した。好中球(NP)の紫外線誘発プライミングには、2種類の紫外線照射量(75.5および151.0 J/m2)が用いられた。高線量は低線量に比べ、より多くのフリーラジカルとH2O2をNPから活性化させた。MPO活性と紫外線量(75.5から1510J/m2)の関係の種類によって、2つのグループに分けた。75.5および151.0J/m2の紫外線照射の影響下で、低い酵素活性(グループ1)は増加し、グループ2ではこのパラメータは減少した。MPO活性は、紫外線照射の線量依存性で同じ結果を示したが、1510J/m2まで線量を上げてもMPOの活性は上昇しなかった。次の一連の実験では、血液に紫外線を照射した後のLPO濃度を評価した。血中LPO濃度と紫外線照射量との関係で、2つのドナー群を区別した。低線量(75.5-151.0 J/m2)の紫外線照射は、当初高値であったLPOを減少させ、当初低値であったLPOを増加させた。食細胞では、NADPH-oxidaseが紫外線の光受容体として最も重要な役割を担っている。この酵素は、紫外線照射後に酵素複合体を活性化し、スーパーオキシド濃度を上昇させる。紫外線照射により、NADPH-オキシダーゼ複合体が活性化され、細胞内pHが低下する。
UBIは、ウサギの脊髄損傷後のフリーラジカルによるダメージを軽減し、抗酸化酵素の活性を上昇させることができる。186羽のウサギを無作為に4群に分けた(対照群、輸血群、損傷群、UBI群)。手術後47時間、60時間、72時間に紫外線照射(波長253.7nm、5.68×10-3J/cm2)を行い、治療群では紫外線照射を行った。フリーラジカル信号(FR),マロンジアルデヒド(MDA),スーパーオキシドジスムターゼ(SOD),グルタチオンペルオキシダーゼ(GSH-PX)を測定した.投与群では、SODとGSH-PXが非常に増加し、他の群と比較して有意差を示した。一方、UBI群では、FRとMDAが他の群に比較して有意に減少した。紫外線照射した血液は、脊髄組織中のMDAとFR含量を減少させた。また、紫外線照射によりSOD、GSH-PXの活性が低下し、正常レベルに戻ったこと、また、特に損傷後48時間と72時間において、FRの形成が減少し、SODとGSH-PXが増加したことであることが示唆された[73]。
3 体外式光フェレシス(ECP)の概要
UBIは、体外式光フェ レーシス(ECP)として知られる医療処置と共通する要素があるため、この2つの技術を比較対照 することは有益であると考える。ECPは、光増感剤である8-メトキシプソラレン(8-MOP)に曝露した自己末梢血単核球(PBMC)に紫外線A(UVA)を照射するアフェレシスによる免疫調節療法である。ECPは、1988年に米国食品医薬品局(FDA)から承認されて以来、皮膚T細胞リンパ腫(CTCL)の免疫療法として広く使用されている。ECPには、がん免疫賦活剤および移植環境における免疫調節剤としての作用、抗原提示細胞(APC)の誘導、処理白血球の修飾能力など、他の免疫療法と異なる多くの特徴がある[74]。ECPは、他の自己免疫疾患の治療や臓器移植の拒絶反応の予防のために研究されている。特に、CTCLや移植片対宿主病(GVHD)に対して有益である。
3.1 ECP療法の治療
ECP治療の標準的なスケジュールは、4週間間隔で2日間連続して行うものである。1987年にEdelson(81)がECPの全身的有効性を初めて報告して以来、CTCL、臓器移植拒絶反応、GVHD、クローン病、1型糖尿病に罹患した何万人もの患者がECPによって恩恵を受けている。彼の研究では、皮膚T細胞リンパ腫(CTCL)患者の皮膚症状に対する治療は、他の治療法と比較して70%を超える奏効率を達成した。Wollnia[82]は、菌状息肉症タイプのCTCL、IIa/IIb期の38歳から72歳の14人の患者(すべて男性)にαインターフェロンとECP治療を併用し、56%の総奏効率を達成した。
3.2 ECPの作用機序
UVAで活性化された8-MOPは、姉妹鎖のDNAのピリミジン塩基間に架橋を形成し、体外標的リンパ球のアポトーシスを引き起こす[83]。ECPは、無傷のCD8 T細胞に起因する紅斑性CTCLを減少させ、最小限の毒性で生存期間を延長させることができる[84]。ECPの免疫効果は、CTCLの腫瘍細胞に対する免疫賦活効果と、GVHDなどのT細胞媒介性障害に対する免疫抑制効果の2つが確認されている[85]。
3.3 UBIとECPの比較
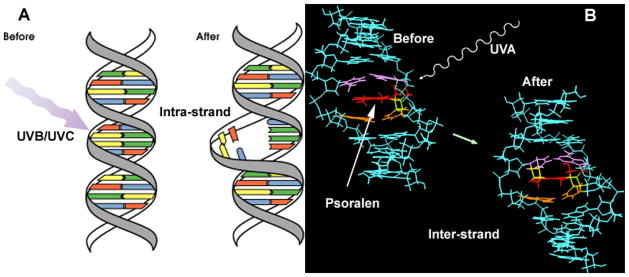
1930年から1950年の間にUBIによって成功裏に治療された全身性細菌感染症に対して、ECPが試験されたことは、我々の知る限りでは一度もない。UBIもECPも、投与量や治療対象疾患によって、免疫賦活作用と免疫抑制作用がある。UBIとECPでは、DNA損傷のタイプが異なる。UBIは鎖内架橋であるチミンダイマーや6:4光生成物を形成するのに対し、ECPは光活性化したプソラレンが両鎖の核酸塩基残基と反応して鎖間架橋を形成する[86]。
4. まとめ
UBIはもともとアメリカの発見であったが、その後、ロシアや他の東洋の国々で研究が進み、西洋では薬で治療するのが普通であった多くの病気に対して、長い間物理療法に集中していた国々で研究が進んだ。しかし、その作用機序が不明確であったため、医学界に広く受け入れられることはなかった。紫外線は水や器具の殺菌に使われるため、感染症への利用も紫外線による病原体の直接破壊に依存するはずだという考えが広く浸透し、混乱が生じた。もう一つの大きな混乱は、UBIによって治療が成功したと主張される病気の種類が多いことだ。よく、「話がうますぎる」と思われるものは、たいていそうであると言われる。
UBIの効果は、使用する紫外線の量に決定的に依存することは明らかである。実際、投与量反応はホルミシス(hormesis)の概念に支配されており、少量の投与は有益であるが、投与量を増加させると有益性が失われ、さらに投与量を増加させると有害な効果が生じる。実際、犬を用いたノットの最初の研究では、最適な利益を得るためには、血液総量の5~7%を処理すればよいことがわかった[7]。紫外線はDNA損傷を引き起こすことがよく知られており、DNA損傷が修復されない細胞はアポトーシスを起こす。紫外線照射による細胞死が、どの程度まで有益な効果に必要なのかは不明である。Knottのオリジナル技術は低圧水銀ランプからのUVC照射(253.7nm)であったことを忘れてはならない。また、上記の実験室研究の多くは、UVB光(280-315nm)を使用している。この2つの波長の紫外線の間には大きな違いがある可能性がある。UVBに対する関心は、日光による皮膚への紫外線曝露の有害な影響を理解しようとする光皮膚科学分野によって、かなり促進されてきた[88]。このため、UVBの発癌作用に加えて、免疫抑制作用に関する多くの知見が蓄積されてきた。太陽光に含まれるUVCの波長はオゾン層に吸収され、地表に到達しないため、UVCの生物学的効果はやや無視されてきた。
UBIの成功は、上記のような様々なメカニズムのうち、どれが本当に寄与しているのかはまだ不明である。紫外線照射による活性酸素の生成なのか?好中球、単球、マクロファージなどの食細胞の活性化なのか?Th1、Th2プロファイルの違いにつながるリンパ球サブセットの変化なのか。サイトカイン分泌の変化によるものか?初期のパイオニアが指摘した血液の酸素運搬能力の著しい増大は、どのような要因によるものなのだろうか?まだ多くの疑問が残っている。
この10年間で、多剤耐性菌の問題は容赦なく拡大している。多剤耐性(MDR)およびパンドラッグ耐性(PDR)細菌株とその関連感染症は、世界中の公衆衛生に対する新たな脅威となっている[89]。これらは、約2倍の死亡率の上昇と入院期間の大幅な長期化に関連している。抗生物質耐性株によって引き起こされる感染症は、治療法の選択肢が限られているため、しばしば例外的に治療が困難である[91]。最近2015年2月に、抗菌薬耐性に関するレビューで、「薬剤耐性感染症は、取り組まなければ、2050年までに世界中で毎年1000万人が余分に死亡する可能性がある。この日までに、それらはまた、失われた生産で世界に約100兆ドルの損失を与える可能性がある:現在の世界経済の規模よりも大きく、世界は35年間、毎年英国経済の生産高を失うことにほぼ等しい。」[92]。[92]
敗血症は、サイトカインの大量放出、広範囲の炎症を伴う感染に対する制御不能な反応であり、血栓と血管の漏出を引き起こす。その後、多臓器不全に陥ることもある。毎年、100万人以上のアメリカ人が重度の敗血症に襲われている。これらの人々の28〜50%が死亡すると推定されている。敗血症の患者は、通常、病院の集中治療室で、幅広い抗生物質、酸素、輸液を投与され、血中酸素濃度と血圧を正常に保つための治療を受ける。数十年にわたる研究にもかかわらず、敗血症を特徴づける攻撃的な免疫反応を特異的に標的とする薬剤は開発されていない[93]。
我々は、選択肢がなくなってきた(あるいはすでになくなってしまった)患者において、多剤耐性グラム陽性菌やグラム陰性菌による全身感染症の治療法として、UBIを再考・再研究することを提案したいと思う。また、敗血症で死亡するリスクのある患者も、UBIの候補となりえる。UBIの作用機序については、さらなる研究が必要である。UBIが医学の主流となりうるのか、それとも過去50年間忘れられてきた「代替・補完医療」のカテゴリーに属し、「光線療法」と呼ばれることもあるのか、という論争には、治療中と治療後にいったい何が起こっているのかという現在の混乱が大きく影響している。
図4 (A) UVBまたはUVCによるDNA損傷(鎖内架橋)、(B)プソラレンとUVAによるDNA損傷(ECP、鎖間架橋)の比較
謝辞
Hamblin研究室の研究は、米国NIHの助成金R01AI050875によって支援されている。
