Contents
To Clot or Not to Clot? Ad is the Question – Insights on Mechanisms
Related to Vaccine Induced Thrombotic Thrombocytopenia
onlinelibrary.wiley.com/doi/10.1111/jth.15485
Maha Othman1,2, Alexander T Baker3,4, Elena Gupalo5, Abdelrahman Elsebaie1, Carly M. Bliss4, Matthew T. Rondina6,7, David Lillicrap8, Alan L. Parker4
10.1111/jth.15485
1.クイーンズ大学医学部生物医学・分子科学科カナダ、オンタリオ州、キングストン
2.セントローレンスカレッジ看護学部(カナダ・オンタリオ州キングストン
3.メイヨー・クリニック個別化医療センター(米国アリゾナ州スコッツデール市
4.カーディフ大学医学部 癌・遺伝学部門(イギリス・カーディフ
5.国立心臓病医学研究センター(ロシア・モスクワ
6.内科、病理学教室、分子医学プログラム米国ユタ州ソルトレイクシティ、ユタ大学保健学部
7.内科およびGRECC、George E. Wahlen VAMC、ソルトレイクシティ、アメリカ ユタ州、米国
8. Department of Pathology and Molecular Medicine, Queen’s University, Kingston, ON, Canada.
共著者 Maha Othman MD PhD
教授 クイーンズ大学医学部生物医学・分子科学科
クイーンズ大学医学部 ボットレルホール
ランニングタイトル ワクチン誘発性血栓性血小板減少症(VITT)
概要
ワクチンによる免疫性血栓性血小板減少症(VITT)が世界的に問題となっている。VITTは,AstraZeneca社のChAdOx1 nCov-19およびJanssen社のAd26.COV2.Sワクチンを用いたCOVID-19ワクチン接種後の血栓症および血小板減少症を特徴とする.
患者は血栓症を呈し、ワクチンの初回接種後5日から24日後に重度の血小板減少症が発症し、Dダイマーの上昇、血小板の活性化を示すPF4抗体の上昇が見られる。
2021年6月1日時点で、全世界で19億3000万回以上のCOVID-19ワクチンが接種されている。現在、英国、欧州、カナダ、オーストラリアで467件のVITT症例(0.000024%)が報告されている。VITTの診断と管理に関するガイダンスが報告されているが、その発症メカニズムはまだ完全には解明されていない。
ここでは、アデノウイルスによるVITTの誘発に関連する潜在的なメカニズムを提案し、議論する。また、VITTの発症メカニズムを解明するためには、未解決の問題を解決することが必要である。VITTの病態モデルを確立するためには,さらなる研究が必要である。
ディスクロージャー すべての著者には利益相反はない
はじめに-VITTについて何がわかっているのか?
ワクチン起因性免疫性血栓性血小板減少症(VITT)または血栓性血小板減少症(TTS)と呼ばれる新規かつ稀な症候群は、医師、研究者、そして一般市民の間で世界的な関心を呼んでいる。VITTは、COVID-19ワクチン接種後に発生する血栓症および血小板減少症を特徴としており、これまでのところ、アストラゼネカ社のChAdOx1 nCov-19ワクチンおよびヤンセン社のAd26.COV2.Sワクチンによる治療後にのみ報告されている。VITTの臨床的特徴としては、血栓症、特に脳静脈洞血栓症(CVST)(ただし、多くの患者はCVST以外の血栓症を有しており、数名は他の部位にも血栓症を併発している)[1,2]、ワクチン初回接種後5~24日目に発症する重度の血小板減少症(血小板数の中央値は2~3万)およびDダイマーの上昇が挙げられる。VITT患者の特徴として、血小板の活性化を示す血小板第4因子(PF4)に特異的な抗体の存在が挙げられる。VITTにおけるこの自己免疫的要素は、自己免疫性ヘパリン誘発性血小板減少症(aHIT) [3] (HIT/T [4]またはHITとしても知られている)を模倣している。この血小板減少症は、ヘパリンへの曝露時に血小板因子4(PF4)に対する免疫グロブリンG(IgG)抗体が形成されることによって引き起こされるが [5, 6]、より正確には、過去にヘパリンへの曝露がない「自然発症/自己免疫性HIT」です [7, 8]。
これまでの研究で、aHIT患者はいくつかのクラスの抗PF4抗体を発現していることがわかっている。グループ1は、PF4/ヘパリン複合体に弱く結合するだけで、血小板の凝集や活性化を引き起こすことはできない。グループ2は、PF4とヘパリンの複合体を凝集させ、FcyRIIaを介して血小板を活性化させることができる。グループ3は最も強く結合し,ヘパリンや他のポリアニオンがなくてもPF4を凝集させることができる[9]。COVID-19患者では、ヘパリン投与歴がないにもかかわらず、非血小板活性化抗PF4/ヘパリン抗体が生じることが観察されている[10]。しかし、現在までに報告されているVITT患者はすべて、aHITを模倣して、ヘパリン非存在下でPF4に結合することができる特に強いタイプの抗体に陽性となった[10]。VITTにおけるPF4抗体の動態は、HITTと比較して現在のところ不明であり、さらなる研究が必要である。これまでのところ、提案されている治療パラダイムは、HITと同様にVITTを治療することである。これは、ヘパリンベースの治療を中止し、ヘパリンベースではない代替の抗トロンビン阻害剤に切り替えることである。また、血小板表面のFcγRIIaに結合したIgGを競合的に阻害する高用量免疫グロブリン静注療法もVITT患者に使用されており、血小板の活性化と凝固の低下という良好な結果が得られている。VITTの診断と管理に関するISTHのガイダンスが報告されている[11]。
この副作用の正確な発生率を判断することは困難であるが、今のところ極めて低い値を維持している。2021年6月1日時点で、全世界で19億3,000万回以上のCOVID-19ワクチンが接種されている[12]。現在、イギリス(英国)北欧、カナダ、オーストラリアで合計467件(0.000024%)のVITT症例が報告されているが、さらに多くの症例が継続して報告されている[13-18]。2021年6月1日現在、初回接種(アストラゼネカのみではない)の総数に基づいたVITTの推定発生率は、英国、カナダ、オーストラリア、中央ヨーロッパでそれぞれ約0.00086%,0.000127%,0.00028%,0.000087%となっている[13-19]。最近の研究では、ChAdOx1ワクチンの接種者におけるVITTの発生率が一般人口を上回っていること、またBioNTech mRNAワクチンの接種者には同様の影響が見られないことがしっかりと示されている[20]が、BNT162b2では血小板減少(血栓症を伴わない)が示されている[21]。遺伝的背景の異なる他の集団で同様の発生率が観察されるかどうかはまだ不明である。
VITTの発症メカニズムはまだ検証されていないが、今のところすべての証拠がワクチン材料の役割を示唆している。実験の結果、PF4を認識するIgG抗体は、Fcγ-receptor IIA(FcγRIIA)を介して血小板を活性化することが明らかになった。これはELISA試験によって検証されている[5, 6, 13]。しかし、何がきっかけでこれらの抗体が産生されるのかはまだ不明である。これまでのところ、VITTはアデノウイルスベクターを用いたDNAウイルスワクチンに関連してのみ報告されており、mRNA/脂質ベースのワクチンでは報告されていないことから、この症候群がベクターに関連しているのか、あるいはワクチン調製時の他の構成要素に関連しているのかという疑問が生じている。
ここでは,アデノウイルスの免疫原性と,血小板や他の宿主タンパク質との相互作用について議論し,分析した。また,VITTのメカニズム解明の手がかりとなるようなアデノウイルスの性質を検討し,いくつかの未解決の問題点を明らかにし,潜在的な病原性メカニズムについて考察する。
COVID-19ワクチンの有力候補としてのアデノウイルス
アデノウイルスは、遺伝子導入手段として人気があり、強力な治療法である。しかし、その価値は、導入遺伝子の発現期間が通常7-10日と限られていることによって制限されている。しかし、アデノウイルスは、導入遺伝子の過剰発現により抗原特異的な反応が得られること[22]、RNAウイルスに比べて二本鎖DNAゲノムの操作が容易であること、高力価へのスケールアップが可能であること[23]などから、ワクチンのプラットフォームとして魅力的な候補となっている。
ヒトのアデノウイルスには幅広い系統があるにもかかわらず、前臨床および臨床開発では、主に1つの血清型であるC種セロタイプ5(Ad5)に焦点が当てられてきた。Ad5は、導入された導入遺伝子に対して強力な抗原特異的T細胞応答を誘導することが知られており、ワクチンとして有力な候補となっている[24]。しかし,Ad5を用いたワクチンの臨床試験には波乱万丈の歴史があり,その使用によって防御免疫が得られるという証拠は限られている[25, 26].Ad5ベースのHIV STEP試験の結果では、他の変数に加えて、集団内に広く存在する既存の抗Ad5免疫が、ワクチンの有効性の欠如と関連していることが示された[27]。これらの研究は、高い血清有病率がいかにAd5ベースのワクチンの有効性を阻害するかを示している。このことから、ヒト集団における血清有病率が低い、あるいはゼロであっても有効なアデノウイルスベースのワクチンを開発するために、ヒトアデノウイルスの系統樹内の多様性、およびヒト以外のアデノウイルスを探索する方向に転換した。
100種類以上のヒトのアデノウイルスと、シミアン由来のものを含む100種類以上の近縁種を含む多様な系統樹の中から(http://hadvwg.gmu. すなわち、D種のヒトアデノウイルス血清型26(Ad26,Janssen Ltd.が開発)と、ChAdOx1とも呼ばれるチンパンジーアデノウイルス分離株Y25(Jenner Instituteが開発)に由来するワクチンであるが、系統的にはAd4に近いが、ヘキソンタンパク質とファイバータンパク質はそれぞれD種とC種のものと相同性がある。どちらのワクチンも 2019年のSARS-CoV-2パンデミックの前に、いくつかの適応症で広く臨床評価されており、幅広い抗原に対するT細胞および抗体反応を誘導する強固な能力が実証されている[28, 29]。副作用に関しては、両ウイルスベクターの初期段階の臨床試験では、一過性の局所および全身性のイベントに限定した軽度/中程度の有害事象(AE)が一般的に認められ、ワクチンに関連する重篤なAEは報告されなかった[30, 31]。
この良好な安全性プロファイルに加え、持続的で強固な抗体およびT細胞反応を誘導する能力により、Ad26とChAdOx1は、COVID-19パンデミックを軽減するためのSARS-CoV-2ワクチンの開発競争において、明らかにトップランナーとなっている。
アデノウイルスは血小板の活性化を誘発し、血液凝固を促進する アデノウイルスと血小板の相互作用は、アデノウイルスの静脈注射後に一貫して報告されている血小板減少症のため、細心の注意が必要である
その一方で、血栓塞栓症のイベントは以前には観察されておらず、COVID-19ワクチンは筋肉内に投与されていることに留意してほしい[32-34]。実験データでは、アデノウイルスをマウスに静脈内投与してから5~24時間後に血小板減少症が起こることが示されている[35]。血小板減少症は,ヒトにおけるさまざまなウイルス感染症のよく知られた合併症である。複数のメカニズムが提案されている。これらには、循環免疫複合体の血小板表面への沈着による血小板の非特異的破壊の増加、特異的な抗血小板抗体の出現、血小板産生の減少、巨核球形成に対するウイルスの直接的な影響、または血小板とウイルスの直接的な相互作用が含まれる[36, 37]。これらの相互作用は、宿主防御プロセスにおける血小板の複雑な役割の一部であると考えられる。活性化された血小板は網膜内皮系によって循環から除去されるので、宿主防御の役割を果たすためには、微生物を除去するために血小板を活性化する必要があることは確かである[38, 39]。試験管内試験で血小板血漿(PRP)にアデノウイルスを添加すると、ADPおよびリストセチンによる血小板の自発的な凝集が起こり、血小板表面にP-セレクチンとCD41aが発現する。後者は血小板の活性化を示す2つのマーカーである[40, 41]。
また、マウスにアデノウイルス(Ad5)を静脈内注射すると、血小板や白血球由来のマイクロプ放出におけるP-セレクチンの増加が観察される。このことが、内皮に付着して転がる血小板-白血球の凝集体形成の引き金となっている[35]。von Willebrand factor(VWF)が血小板減少症の媒介に重要な役割を果たしていることが、生体内試験での実験で示された。この役割は、マウス[35]やアカゲザル[34]におけるアデノウイルス注入後の血漿中の高濃度のVWFや超高分子量VWF多量体(UL-VWF)の出現に基づいている。このことは、VWF KOマウスにウイルスを注射しても血小板減少が顕著ではなかったという事実からも裏付けられる[35]。
アデノウイルスの感染は,血小板の結合や内在化などの一連の血小板反応を刺激する。しかし,血小板の活性化の動態や,血小板のどの成分が内在化過程に関与しているかについては,まだ明らかになっていない.ウイルスpは,電子顕微鏡で見る限り,細胞表面と関連しており,開いたカニクラシステムに局在していることがわかった[40].Ad5の細胞表面への付着には,繊維状のノブプロテインがコクサッキーやアデノウイルス受容体(CAR)に結合することが必要であるが[42],これが血小板の付着に必要な条件であるかどうかは不明である.ある研究では,ヒトの安静時血小板の約3.5±1.9%がCoxsackie and Adenovirus (CAR)を発現していることが示されているが,CARは細胞と細胞が接触する部位の細胞内凝集体に主に局在している[43]。このことは,CARの発現が血小板の活性化に応じて上昇する可能性を示している[43]。CARに加えて,アデノウイルスは,「コ・レセプター」として働き,細胞の内在化を促進する多くのタンパク質や接着分子を利用している。Ad5は,RGDモチーフを含むペントンベースのタンパク質を介して,αV-インテグリンファミリーのメンバーであるαVβ3[44]およびαVβ5[45]と相互作用することが示されている[46]。血小板凝集およびフィブリノゲンエンドサイトーシスの強力な蛋白質阻害剤であるキストリンによるαIIbβ3およびαVβ3の二重阻害は,試験管内試験でのアデノウイルスの血小板結合やウイルスの内在化を妨げず[40],追加の受容体結合パートナーが内在化を促進する可能性を示している[47]。内在化が変わらないにもかかわらず,キストリンを使用すると血小板の活性化が減少する.可能性としては,アデノウイルス投与後の血小板の活性化と,ウイルスの取り込みという2つの独立したプロセスが存在することが挙げられる.アデノウイルスと血小板の結合は,必ずしもウイルスの立体化とそれに続く血流からの排除をもたらすとは限らないと推測される。この仮説は,オンコロイド・アデノウイルスを静脈内投与した癌患者の血液中に血小板関連ウイルスがほとんど認められなかったことや,全血を研究対象のアデノウイルスとインキュベートした試験管内試験実験でも支持されている[48].血小板の活性化は,宿主の防御プロセスにおいて血小板が役割を果たすための前提条件であると考えられる。
上記の効果は、ワクチンのような複製能力のないベクターではなく、血液を介して複製するウイルスに適用されることに注意することが重要だ。アデノウイルスベースのワクチンは、一般的に静脈内ではなく筋肉内に投与されるが、注射部位の漏れた血管系や毛細血管の損傷を介して少量のベクターが血中に入る可能性は高いと思われる。したがって、アデノウイルスベクターの中には、血液や内皮細胞と相互作用するものがあることは、もっともなことである。
アデノウイルスと宿主タンパク質との相互作用
現在、ChAdOx1ベクターとして一般的に知られているチンパンジーのY25分離株は、ヒトアデノウイルスのE種と系統的に近縁であるとマッピングされている[49]。この種の唯一のヒトアデノウイルスであるAd4は、ChAdOx1と非常に相同性が高く、過去に人獣共通感染症のイベントでチンパンジーから渡ってきたと考えられている[50, 51]。アデノウイルスの人獣共通感染症は例外的に少ないようであるが、前例はある。Titi monkeyのアデノウイルスの種を越えた感染は、少なくとも2人の人間に感染を引き起こすことが観察され、そのうち1人は動物取扱者であった[52]。アデノウイルス、特にAd4は、時折ではあるが、軍の新兵の間での深刻なアウトブレイクと関連しており[53]、そのため、減衰していない複製能力のあるAd4ワクチンが経口投与されている(このベクターの投与経路は非病原性です)[54, 55]。複製能力のあるAd4ベクターは、インフルエンザウイルスの経口/経鼻ワクチンベクターとして、第1相臨床試験で評価されている[56-58]。炭疽菌の経口ワクチンベクター[59]やHIVの筋肉内/経鼻ワクチンベクター[60-62]。Ad4は,CAR受容体を利用して細胞内に侵入することが示されている[63]。以前の研究では、この受容体がChAdOx1のエントリー受容体であることを示唆していたが[64]、最近のプレプリントでは、生物学的および構造的研究を用いて、ChAdOx1がAd5と同様の結合親和性で、CARを主要な細胞付着受容体として利用できることを示している[65]。同じ研究では、B1種のアデノウイルスに広く使用されている受容体であるCD46は、ChAdOx1ファイバーノブタンパク質と相互作用できないことが観察された。
Desmoglein-2 (DSG-2)やシアル酸を持つ糖鎖のような他の主要な侵入受容体との相互作用は、まだ可能性として除外されていない。将来的には、インテグリンのようなChAdOx1の共同受容体の利用を調べることも重要である。
D型アデノウイルスであるAd26の主要な受容体の使い方については、長年にわたって論争が続いていた。マウスやヒトのPBMCを用いた初期の感染研究では,CD46がAd26の主要な受容体であることが示唆された[66].しかし,これらの結論は,少数の細胞への感染から得られたデータに基づいており,高倍率の感染でもごく一部の細胞にしか感染しなかった。
最近の構造学的・生物学的研究では,CD46がAd26のファイバーノブタンパク質が関与する侵入受容体であることは否定されている(ただし,CD46がヘクソンタンパク質に結合するという新しいメカニズムが最近提案されている[67]).これらの研究は、CARがAd26の受容体であることを示しているが、この相互作用の親和性は、Ad5と比較して、CARの結合を立体的に阻害するファイバーノブタンパク質の拡張ループの存在によって低下している[68]。生物学的には,この立体的な衝突によって,CARの親和性はAd5に比べて約15倍低下すると推定されている。Ad26は第2の受容体結合機構を進化させたようで,シアル酸を持つ糖鎖に高い親和性で結合している[69]。この機構は,パンデミック性角結膜炎(EKC)を引き起こすAd26のようなアデノウイルスにしっかりと保存されている[70]。また,αvβ3インテグリンの関与を伴う細胞侵入の代替メカニズムも提案されているが[71],アデノウイルスのペントンベースタンパク質によるコ・レセプターとしてのインテグリンの関与は,腸管種のF型アデノウイルス(Ad40,Ad41)を除いて,すべてのアデノウイルス種でよく知られている[72].
アデノウイルスは、細胞内受容体や共受容体との相互作用と同様に、血液中の様々なタンパク質と相互作用することがよく知られている。このような相互作用の一つに,主要なアデノウイルスカプシドタンパク質であるヘクソンと,循環血液凝固因子であるFXとの高親和性相互作用がある[73-75]。Ad5の場合,これは高親和性のCa2+依存性の相互作用として記録されており,ヘパラン硫酸プロテオグリカン受容体(HSPG)を介して肝細胞を伝達するアデノウイルスの効率的な肝遺伝子伝達の原因となっている[74, 76]。この相互作用は、FXの活性化状態とは無関係に起こりうるが(すなわち、FXaはFXと同様に効率的にAd5と相互作用する)単独でも、FVIIや組織因子を提示する細胞の存在下でも、FXがFXaに変換されることはない(補足図1)。さらに、ChAdOx1のFX結合能力は本稿執筆時点では評価されていないが、Ad26は同じメカニズムでFXと結合しないことが知られている[74, 77]。Ad5 hexonは、微妙に異なる方法でFVIIと結合することが示された[78]。我々は以前,プロテインC,FVII,FIX,FX(相同ドメイン)が結合し,Ad5の取り込みを促進する可能性を示した[79].プロトロンビン(第II因子)もまた、FXと結合してヘキソン結合部位を争う可能性があるが、SPドメインを欠いているため、HSPGとの相互作用が妨げられる。FXの場合は、FXのセリンプロテアーゼ(SP)ドメイン内の塩基性アミノ酸のストレッチによって媒介されることが知られており[80]、これらは推定的なヘパラン結合エキソサイトを形成している。FXは、肝遺伝子導入の主要なプレーヤーであるようである。FVIIとFXが自然免疫と肝細胞の線維化に影響を与える可能性があることは言及しておくべきであろう[81]。よく知られている血液凝固因子との相互作用に加えて、アデノウイルスと補体タンパク質C3[82]やCR1[83]、さらにはvon Willebrand因子やp-セレクチン[33]との相互作用も文献に記載されている。
VITT – どのワクチン?
VITTは、アストラゼネカ社のChAdOx1 nCoV-19ワクチンとヤンセン社のAd26.COV2.Sワクチンの両方を接種した後に観察されている。本稿執筆時点では、ChAdOx1ワクチンとPfizer/BioNTechワクチンの受領者における血栓症イベントの最近の比較で確認されたように、mRNAワクチンなどの非アデノウイルスベクターワクチン接種には関連していない[20]。主にロシアで実施されたスプートニクVのAd5/Ad26ワクチンレジメンや、Ad5ベクターのCanSinoワクチンの接種者など、他のアデノウイルスベクターワクチンの接種者にVITTが見られるかどうかについては、現在のところ情報が不足している。
VITTの提案されたメカニズム
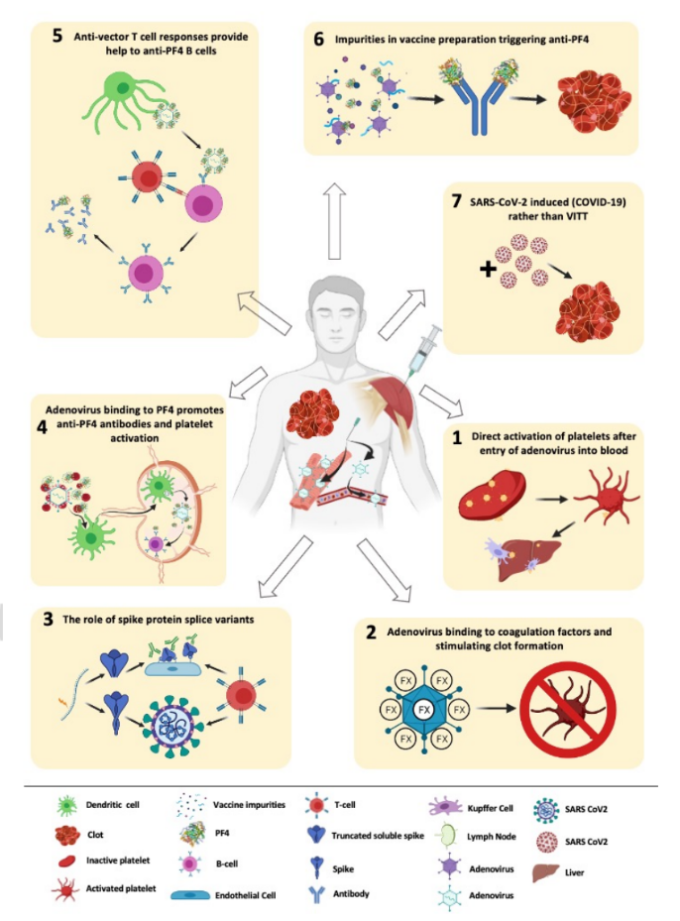
VITTを支える主要なメカニズムと下流のメカニズムは現在のところ理解されていないが、この副作用がアデノウイルスベースの製剤で明らかに観察されるという事実は、慎重な検討と特定の調査を必要とする。ここでは、アデノウイルスによるVITTの誘発に関連して、潜在的な「スモーキングガン」について議論する。図1では、提案されているメカニズムを説明している。
1- アデノウイルスの血中への侵入に伴う血小板の直接的な活性化?
少量のアデノウイルスが、注射による毛細血管の損傷や、ワクチン接種によって引き起こされた炎症状態による血管の漏出によって血流に入る可能性がある。CARは,ChAdOx1とAd26の両方に対する付着受容体であり[42],血小板の表面にも発現していることが示されている[35, 38, 43]。αVβ3やその他のインテグリンは,アデノウイルスが付着できる主要な二次細胞侵入受容体であり,血小板表面にも存在する[84]。同様に、表面の糖鎖は強い負電荷を持ち、アデノウイルスの血小板表面への局在化を受動的に促進する可能性がある[85]。アデノウイルスの結合は,血小板の活性化,血小板-白血球の凝集体形成,内皮の活性化を促すことが示されている。したがって、血栓の形成にアデノウイルスの血小板への直接結合が関与していることを示す強力な状況証拠であると結論づけたいところである。しかし、アデノウイルスが血小板に結合すると、その血小板は肝臓のクッパー細胞によって除去されることが知られている[86]。このことは、ワクチンで投与された同等量の体重よりも7000倍以上多い量のアデノウイルスを静脈内投与したマウスの研究で、血小板減少症を引き起こすことが観察されている[35, 38]。血中にかなりの量のアデノウイルスが含まれていたにもかかわらず,これらの動物には血栓が生じなかったことに注目すべきである.アカゲザルを用いて行われた別の研究でも,血栓症ではなく血小板減少症が観察され,アデノウイルス療法により血栓形成時間が長くなったことが指摘されている[32, 87]。
2- アデノウイルスが凝固因子に結合して血栓形成を促進する?
それにもかかわらず、もし血小板に直接結合することで血小板が活性化され、血栓促進環境が引き起こされるのであれば、これまで報告されてきたように数日から数週間後ではなく、ワクチン接種後すぐに患者が発生することが予想される。ChAdOx1 nCoV-19やAd26.COV2.Sのような複製不能なアデノウイルスは、アデノウイルスと結合した血小板と同様に、速やかに体外に排出されることがよく知られている[35]。これまでに報告された最も早いVITTイベントは、ワクチン接種後5日目であった。そのため、現在入手可能な証拠からは、VITTを直接説明することはできない。
3-「ワクチンによるCOVID-19の模倣」-スパイクタンパクのスプライスバリアントの役割?
Ad5のような特定のアデノウイルスが凝固第X因子(FX)に結合することはよく知られている[73-75]。これにより、ヘパラン硫酸プロテオグリカンへの結合を介したアデノウイルス感染の代替メカニズムが促進されることが示されている[74-76]。これまでに発表されていないデータ(補足図1)によると、アデノウイルスと強く結合しているにもかかわらず、FXは活性化していない。また、d26はFXと結合せず、ChAdOx1はアデノウイルス/FX結合の鍵となる残基を共有しておらず[74, 77, 88]、したがってFXを封じ込める可能性は低いことが以前に示されている。また、上述したように、血液中のアデノウイルスの存在によって引き起こされるVITTのメカニズムは、ワクチン接種後5日以上経過してからではなく、ワクチン接種後すぐに現れると考えられる。
最近、代替スプライシングによって微量のスパイク・スプライス・変異体が生成され、その結果、C末端が欠失したmRNAが生じることが提案された。これらのC末端が欠失したmRNAが翻訳されると、可溶性の代替スパイクアイソフォームが細胞外に分泌され、血流に流出する可能性がある[89]。代替スプライシングはDNAに特異的な現象であることから、導入遺伝子をDNAとしてコード化したアデノウイルスベクターワクチンでVITTが観察され、脂質ベクターmRNAワクチンでは観察されない理由について、別の説明がなされている。このモデルでは、内皮細胞上でACE2と結合したスパイクタンパクが血管の炎症や損傷を引き起こし、その結果、血小板が活性化され、VITTに特徴的な血栓イベントやPF4の放出が始まると著者らは提案している[90]。著者らはこの効果を「Vaccine Induced COVID-19 Mimicry」と呼んでいる。mRNAベースのワクチンは、定義上、スプライシングを必要としないため、この副作用が、mRNAベースのワクチンではなく、アデノウイルスベクターによって特異的に媒介される理由を説明することができる。しかし、ChAdOx1 nCoV-19を感染させたA549およびMRC-5肺細胞のトランスクリプトームを評価した以前の研究では、このような転写物の検出可能なレベルは示されておらず、この代替転写物が機能的な分泌タンパク質に翻訳されるかどうかはまだ明らかになっていない[91]。この提案されたメカニズムは、SARS-CoV-2の遊離スパイクタンパクを静脈内投与するか、または可溶性スパイクタンパクのアイソフォームのみを発現するように設計されたウイルスベクターをIM投与することで、マウスモデルで容易に検証することができ、そのような治療によってヒトACE2トランスジェニック動物にVITT様症候群が生じるかどうかを評価することができる。この提案されたメカニズムは、VITTの誘発に見られた遅延の一部を説明しているかもしれない。なぜなら、ワクチン接種によってスパイクタンパクと想定される可溶性変異体が最大量生成され始めるまでに24〜48時間かかるからである。おそらく、残りの遅延は、研究の著者が提案しているように、可溶性スパイクが細胞表面に十分な抗スパイク抗体と遭遇し、抗体依存性細胞傷害(ADCC)を引き起こすのに十分な時間提示されることが稀であることによって説明されるかもしれない[89]。さらなる研究では、このようなC末端切断スパイクタンパク質が、ACE2発現細胞の表面にどのくらいの時間付着していられるのか、また、どのくらいの割合で内在化または分解されるのかを評価する必要がある。細胞表面での半減期が短ければ、病原性のあるADCC反応が起こる可能性は低くなる。このメカニズムは、VITT患者が既存の抗スパイク抗体を持っていることを前提としており、早ければワクチン接種後5日でADCCを引き起こすことができる。なぜなら、既存のBメモリー細胞がなければ、新規の抗スパイク抗体を作るのに時間がかかるからである[92]。しかし、先に述べたように、以前の研究では、ワクチンを導入した細胞から可溶性SARS-CoV-2スパイクが転写されることを実証できなかった[91]。また、このメカニズムは、検査を受けたすべてのVITT患者が抗PF4抗体を発現している理由を説明できない[5]。最後に、もしこのメカニズムが血液凝固を誘発するのであれば、危険因子を必要とせず、どのような人にも同じように起こる可能性があるため、観察されているよりも一般的であると予想される。
www.researchsquare.com/article/rs-558954/v1
4- アデノウイルスがPF4に結合することで、抗PF4抗体の置き忘れが起こり、(ヘパリンとは無関係に)血小板の活性化につながるのか?
VITTを発症している患者は、有意な抗PF4反応も示しているようなので、PF4とChAdOx1/Ad26との間に相互作用があるかどうかを調べることが、明らかな出発点となるであろう。それによって、誤った抗PF4反応が引き起こされる可能性がある。実際、そのようなメカニズムはGreinacherらによって提案されており、彼らの最近のTEM実験はChAdOx1とPF4の間の直接的な相互作用を示唆している[91]。さらに最近では、BakerらがChAdOx1ウイルスカプシドの約4オングストローム分解能の構造をプレプリントし、計算機シミュレーションを用いてChAdOx1ヘクソンタンパク質間の4量体PF4の結合を推定的に示した[65]。著者らは、ウイルスが単球に取り込まれてリンパ節に運ばれる際に、ChAdOx1のカプシドがPF4を保持していることを示唆している。彼らは、アデノウイルスとPF4の複合体がリンパ節に放出されると、PF4に対する既存のメモリーB細胞の増殖を刺激する可能性を示唆している。
これらの強力な抗体が十分な力価で放出されると、以前に示されたように、リガンドに依存しない方法でPF4を凝集させることができる[9]。これらのIgG/PF4複合体は、FcγRIIaに結合し、AHITと同様のメカニズムで血小板の活性化および血液凝固カスケードを刺激する可能性がある[3]。この考えを裏付けるように、VITT患者には、ヘパリンに依存しない強い抗PF4抗体が認められることが知られている[5]。アデノウイルスとの結合によって運ばれた場合、B細胞の刺激時には、ヘパリンなどのポリアニオンは存在しない。したがって、刺激された唯一の記憶B細胞は、観察されたように、ヘパリンに依存しないであろう。さらに、このメカニズムは、既知の現象である抗PF4抗体の存在を前提としている。この提案は、VITTのタイミングを説明するものでもあり、抗原曝露後5日目は二次抗体反応の時間枠内であることから、まだ検証されていない。なぜVITTは1回目の投与後にのみ発生し、2回目の投与後には発生しないのか?さらに、アデノウイルスのカプシドとPF4との間の明確な関連性は、表面プラズモン共鳴や顕微鏡検査によって、まだ決定的には確立されていない。最後に、アデノウイルスとPF4の複合体がリンパ節に運ばれ、記憶B細胞の増殖と二次免疫を刺激することを証明するには、さらなる実験が必要である。
5- 抗ベクターT細胞反応は役割を果たしているか?
ChAdOx1とAd26は、地域社会での血清有病率が非常に低いことから選択された。しかし、過去のアデノウイルス感染に対する既存の交差反応性T細胞応答が、PF4-アデノウイルス複合体の形成後の抗PF4応答の生成においてB細胞を助ける可能性がある。このようなヘルパー機能を果たすためには、これらのT細胞反応はCD4+でなければならない。実際、E種チンパンジーアデノウイルス63(ChAd63)に対するCD4+T細胞は、マラリアワクチン候補としてのChAd63の臨床評価中に、ワクチン接種前の低い頻度で測定され、ワクチン接種によって増強された[94]。HITに関する研究では、HIT患者においてPF4-ヘパリン複合体に対するT細胞が測定されたり[95]、マウスのHITにおいてPF4/ヘパリン特異的抗体の生成にCD4+T細胞が必要であることが示されたりして、T細胞がこのようなヘルパー的役割を果たす可能性が示唆されている[96]。
また、IL-10を産生する制御性T細胞が、マウスのHITにおけるPF4/ヘパリン特異的抗体反応を抑制することが実証されていることから、ワクチン接種によって誘発される強い炎症性T細胞反応は、VITTにおける抗PF4抗体反応を有利にする可能性がある[97]。ヒトのHITは、T依存性およびT非依存性の両方の抗体産生経路の特徴を持つことが研究で示唆されており[98, 99]、VITTにおけるT細胞の役割はまだ解明されていない。今後の研究では、ChAdOx1に対するT細胞反応を調べることを目的とすべきである。すなわち、他のアデノウイルス感染症からの交差反応性T細胞反応が地域社会にどの程度存在するかを調べ、ワクチン接種によって増強されるかどうかを調べ、VITTにどのように貢献するかを評価することが必要である。後者については、VITT患者のワクチン接種前のPBMCがないことが問題となる。重要なのは、Tヘルパーの貢献のタイミングがVITTの発症と一致することであり、既存の抗ベクターT細胞が、抗PF4抗体の生成においてB細胞を早期に助けることができる。抗原特異的T細胞の集団の拡大も、ワクチン接種後7日以内に測定されている[100]。しかし、VITTにおける抗ベクターT細胞の潜在的な役割は、なぜVITTが最初のワクチン接種後に主に発生するのかを説明するものではない。
6- ワクチン製剤中の不純物?
また、ワクチン製剤中のヒトタンパク質の不純物が自己抗体を誘発する可能性があるという命題もある。ChAdOx1 nCov-19の生化学的およびプロテオミクス的分析では、ヒトおよび熱ショックタンパク質や細胞骨格タンパク質などの非構造的なウイルスタンパク質の両方が検出された[100]。この提案は、アデノウイルスが製剤中の約50%のヒトタンパク質のアジュバントとして働き、アデノウイルス製造過程で混入したHEK293細胞由来のヒト膜タンパク質に対する自己抗体が原因となっている可能性を示唆している。したがって、VITTが観察される頻度の違いは、問題となっている調製物の相対的な純度に関連している可能性があると考えられる。最近の研究では、SARS-CoV-2感染自体が宿主に多様な機能的自己抗体を誘発することが示されているが[101]、その臨床的意味合いは不明である。
VITTでは、血小板活性化の原因はPF4/IgG複合体であると考えられている。
理論的には、十分な量の自己抗体があれば、循環しているどのような自己抗体でも活性化できる。血栓塞栓症は、COVID-19ワクチン接種の極めて稀な副作用のままである。将来的には、SARS-CoV-2感染による自己抗体の産生とワクチン接種による自己抗体をプロファイリングし、自己抗体の存在と血栓塞栓症との関連性を明らかにすることが重要だ。
7- VITTではなく、SARS-CoV-2の誘導(COVID-19)?
VITT患者の中には、アデノウイルスベクターワクチン投与直後にSARS-CoV-2に感染し、VITTの免疫血栓症は非典型的なCOVID-19免疫血栓症であるという可能性はないのか?この説は現在のところ証拠がなく、やや遠い可能性であるが、議論する価値はあると思う。SARS-CoV-2感染症とVITTはともに、いくつかの共通する特徴があり、いくつかの違いもあるようだ(表1)。両者とも、血小板の活性化、血小板減少症(VITTではより重症)血栓症を特徴としており、少なくともCOVID-19患者の一部ではPF4抗体が存在する。VITTは通常のCOVID-19よりも強い症状を示する。血小板減少症はCOVID-19において様々なレベルで記録されており、重度の血小板減少症は病気の重症度と死亡率のマーカーと考えられてた[102, 46]。COVID-19誘導性凝固障害(CAC)という概念は、COVID-19における主に凝固促進状態の病理と診断を理解するのに役立ったが[103-105]、病理学的な焦点は、血栓症の引き金となる主に血小板の活性化ではなく、トロンビンの生成にあった。しかし、おそらくCOVIDの血栓症は、主に血小板の活性化が引き金となり、それがトロンビンの生成を促すのではないであろうか。SARS-CoV-2スパイクタンパクが血小板上のACE2受容体に結合する可能性はあるが、血小板がACE2受容体を持っているかどうかは議論の余地がある[106]。また、アデノウイルスがそのRGDドメインを介してαIIbβ3に結合する可能性もある。スパイクタンパク質に対する抗体は,COVID-19患者の血小板の活性化をFcγRIIA依存的に誘導することができ[107],COVID-19血漿でこれをブロックすると,試験管内試験でのこの活性化が阻止された[108]。活性化された血小板はADPとPF4を放出し、COVID-19患者では微小なものとなる[2]。VITT患者は、ヘパリン投与歴がないにもかかわらず、全員が抗PF4抗体を持っていることがわかっている[109, 110]。また、健常者の0.3~5%が抗PF4抗体を持っていることもわかっている。COVID-19の患者では、高レベルのPF4と抗PF4抗体が報告されている[111]。HITとVITTの両方に対する重要な治療法は、FcγRIIAの阻害剤として知られるIgG(IVIg)の静脈内投与である。PCR検査では、すべてのVITT患者ではないが、多くの患者でSARS CoV2感染が陰性であった。VITTがCOVID-19の非典型であるかどうかは、さらなる研究が必要である。
結語
VITT現象の基礎となる一次および下流のメカニズムは、まだ完全には解明されていない。ここでは、アデノウイルスによるVITTの誘発に関連する潜在的なメカニズムについて議論し、批評した。VITTの直接的な発症機序を特定することはまだ不可能であるが、アデノウイルスの免疫原性、血小板や他の宿主蛋白との相互作用、PF4や血小板活性化の役割などについて知られている証拠を探索することは価値があると思われる。VITTの原因となりうるこれらの「スモーキングガン」案を図1にまとめた。このように、VITTのメカニズムを明らかにすることは困難であるが、我々は、VITTのメカニズムを解明するための手がかりを提供し、未解決の問題を明らかにすることを試みた。VITTの病態モデルを確立するためには、これらの問題を早急に解明することが必要である。また、アデノウイルスワクチンの安全性を向上させるために、どのような方法でワクチンを開発・改良すればよいのかについても情報を提供することができる。