Contents
pubmed.ncbi.nlm.nih.gov/31812948
Therapeutic potential of intranasal photobiomodulation therapy for neurological and neuropsychiatric disorders: a narrative review
Rev Neurosci.Author manuscript; available in PMC 2021 Apr 28.
Rev Neurosci.2020 Apr 28; 31(3):269-286.
Farzad Salehpour, *Sevda Gholipour-Khalili,Fereshteh Farajdokht,Farzin Kamari,Tomasz Walski,Michael R. Hamblin,Joseph O. DiDuro,a,*andPaoloCassanoa
GPT-4+Alzhacker
メカニズム
- i-PBMTは、鼻孔から照射するため、血管を穿刺する必要がなく、末梢静脈レーザー照射と同等の効果が期待できる。
- 鼻の奥へのPBMTは、前頭前野や前頭眼窩の腹内側部分に光を届ける有効な方法となる可能性がある。
- 鼻腔内照射による血球や成分を介した全身作用が、観察された神経治療効果に寄与していると考えられる。
- 血液PBMTによって、循環血小板ミトコンドリアの照射が行われることで、全身治療で見られるオフターゲット効果またはアブスコパル効果を説明できる可能性があり、特にうつ病を改善するための可能性がある。
代謝活性
- i-PBMTは、活性酸素種を逆説的に活用し、マクロファージ/ミクログリアの分極状態をM2表現型に変化させ、組織の回復に関連する抗炎症メディエーターを放出することで、遠隔神経保護作用を持つ可能性がある。
- 810nmのt-PBMTは、神経新生を刺激する可能性がある。
- PBMTの適用は、動物モデルおよびヒトで研究され、脳代謝活性および血流の改善、神経新生およびシナプス形成の刺激、神経伝達物質の影響、および抗炎症および抗酸化シグナル伝達経路による神経保護を提供できることを示している。
利点
- i-PBMTは、低コストで痛みを伴わない技術であり、訓練を受けた医療従事者を必要とせず、被験者が自宅で簡単に適用できるため、患者の快適性とコンプライアンスを高めるのに役立つ。
- i-PBMT装置は、一般に入手可能で、赤色ダイオードと近赤外線ダイオードを備え、それぞれ600-680nmと800-850nmの波長域で発光する。
- i-PBMTは、静脈内血液照射アプローチと同等の治療結果を与える可能性があり、非侵襲的で比較的安価な性質を持つ。
疾患への適応
- 鼻孔型i-PBMT装置は、レーザーや発光ダイオード(LED)を使用して、軽度認知障害、アルツハイマー病、パーキンソン病、脳血管障害、うつ病、不安症、不眠症などの脳疾患の治療に応用できる。
- 鼻腔内に810nm LED光を照射することで、認知機能、ワーキングメモリー、注意、実行領域、嗅覚障害の改善が見られる可能性がある。
- i-PBMTは、低酸素虚血性脳障害や神経変性疾患、神経精神疾患の治療に有効な可能性があり、うつ病患者の治療にも役立つ可能性がある。
- Xuら(2002b)による研究では、赤色レーザーを用いたi-PBMTがAD患者の認知・記憶機能の改善に効果があることが報告されている。
アルツハイマー病
- Limらは、1日1回、1年間、810nm LEDを使用したi-PBMTを行うことで、アルツハイマー病患者の認知・記憶機能が有意に改善したと報告している。
- 5人の認知症患者において、経頭蓋+経鼻のPBMTを3カ月間行うことで認知機能が有意に向上したことが報告されている。
- PBMTを同時に6日/週、2週間適用した結果、アルツハイマー病患者の認知機能が著しく改善し、脳波信号の絶対パワーの全体的な増加を伴ったことが報告されている。
- Chao(2019)による研究では、Vielight Neuro Gammaデバイスを適用することで、認知症またはADと診断された4人の患者の認知機能および行動機能が改善されたことが報告されている。
- PBMTは脳灌流を増加させ、デフォルトモードネットワーク(DMN)内の後帯状皮質と外側頭頂部のノード間の接続を増加させることが示された。
要旨
光バイオモジュレーション療法(PBMT)の神経細胞刺激への応用は、様々な動物モデルやヒトで研究されており、脳代謝活性や血流を改善し、抗炎症や抗酸化経路を介して神経保護を提供することが示されている。
近年、経鼻PBMT(i-PBMT)は、脳疾患の治療法として魅力的で可能性のある方法となっている。ここでは、脳への効果的な全身照射や直接照射のために、鼻孔を利用した携帯型方法と埋め込み型の深鼻方法を含む、さまざまな鼻腔内光照射アプローチの概要を説明する。
鼻孔型i-PBMT装置は、レーザーまたは発光ダイオード(LED)を使用し、単独または経頭蓋装置(後者は頭皮に直接照射)と組み合わせて、軽度認知障害、アルツハイマー病、パーキンソン病、脳血管障害、うつ病、不安症、不眠症などのさまざまな脳疾患の治療に応用することができる。
鼻孔から照射するi-PBMTは、血液レオロジーや脳血流を改善するため、血管を穿刺する必要がなく、末梢静脈レーザー照射と同等の効果が期待できることが実証されている。
これまで、PBMTの光源を鼻の奥に埋め込む研究は臨床では行われていなかったが、シミュレーションの結果、篩骨板や蝶形骨洞を介した鼻の奥へのPBMTは、前頭前野や前頭眼窩の腹内側部分に光を届ける有効な方法となる可能性が示唆された。
安価なLEDアプリケータを用いた家庭用i-PBMTは、神経リハビリテーションの新しいアプローチとして可能性がある。偽薬や経頭蓋PBMTを用いた比較研究も必要である。
キーワード
アルツハイマー病(AD)、血液照射、脳機能、篩骨板、うつ病、鼻腔内光バイオモジュレーション、発光ダイオード(LED)、鼻腔、蝶形骨洞
ヘモレオロジー(英: hemorheology) または 血液レオロジー (英: blood rheology)とは、血液とその構成要素(血漿や血球など)の流体としての性質を研究するレオロジーの一分野である。血液の適切な組織灌流は、血液の流動学的性質が適正な範囲内にあることにより得られる。これら流動学的性質の変動は疾患の病態生理において重要な役割を果たしている[1]。
血液の粘度を決定する要因は、血漿の粘度、ヘマトクリット、そして赤血球の力学的性質である。赤血球は、その変形能(英語版)と凝集能(英語版)の観点から,力学的に特有の振る舞いを示すことで知られている[2]。そのため、血液は非ニュートン流体として振る舞う。[R]
はじめに
以前は低レベルレーザー/光療法として知られていた光バイオモジュレーション療法(PBMT)は、赤から近赤外(NIR)スペクトル(600~1100nm)の光子による組織の照射に基づく有望なモダリティであり、レーザーや発光ダイオード(LED)を含むさまざまな光源が適用できる(Zeen et al., 2018)。PBMTは、創傷治癒、痛みや炎症、糖尿病性潰瘍、血液疾患、筋骨格系合併症、冠動脈疾患だけでなく、組織の修復や再生など、さまざまな病状の治療に広く用いられている(Chung et al., 2012;Arany et al., 2014)。さらに、PBMTは、神経外傷、神経変性、神経精神疾患から健常者の脳機能の強化まで、脳への幅広い応用のために着実に関心を高めている(Salehpour et al., 2018b;CaldieraroとCassano. 2019;Chan et al., 2019)。
脳PBMTは、中枢神経系(CNS)疾患の管理において、潜在的に有効な治療技術として浮上している(Fitzgerald et al., 2013)。様々な脳の状態に対するPBMTの適用は、異なる動物モデルおよびヒトで研究され、全体的な結果は、脳代謝活性および血流の改善、神経新生およびシナプス形成の刺激、神経伝達物質の影響、および抗炎症および抗酸化シグナル伝達経路による神経保護を提供できることを示している(Grillo et al., 2013;Hamblin, 2016;Hennessy and Hamblin, 2016;Salehpour et al, 2018b).現在までのところ、このモダリティについて、文献上、重篤な副作用は報告されていないが、黄斑病変(目の網膜の中心部である黄斑に生じる病変)のリスクがあるため、レーザー機器には注意が必要である。経頭蓋(Michalikova et al., 2008;Naeser et al., 2014;Thunshelle and Hamblin, 2016;Chang et al., 2018;Salehpour et al., 2018b)、鼻内(Pitzschke et al., 2015;Saltmarche et al., 2017)、耳内(Sun et al. 2016)、口腔内(Burchman, 2011;Pitzschke et al., 2015)、血管内アプローチ(Maksimovich, 2004)などが、脳PBMTにおける光を届ける非侵襲的ルートの可能性として文献で提案された。また、最近では、パーキンソン病(PD)の齧歯類および霊長類モデルにおいて、より侵襲的な頭蓋内脳PBMTの実現可能性と安全性が実証された(El Massri et al., 2017)。経頭蓋PBMT(t-PBMT)法では、光が大脳皮質に到達するまで、赤色/赤外光子は、頭皮、頭蓋骨、骨膜、髄膜、硬膜下空間、くも膜、くも膜下空間、および梨状体を含む複数の種類の頭部組織をそれぞれ伝染しなければならない(Netter,2017)。このアプローチでは、前述の層を通る光の伝染率が低いため、頭皮レベルの入射光のうち実際に皮質表面に到達するのはごく一部である(Salehpour et al., 2018a)。これまで経頭蓋アプローチは、脳PBMT研究のための最も一般的に研究された方法であったことは注目に値するが(Salehpour et al., 2018b)、脳の深い構造(大脳辺縁系や脳幹など)への生体刺激/治療光量の送達に対するその効率性は依然として課題である(Hamblin. 2016)。また、脳組織を通過する光の伝染率が指数関数的に減衰するため、重なり合う表層組織を過剰に照射することなく、生体刺激性の光量をより深い領域に届けることはできないと考えられる(Caldieraro and Cassano, 2019)。
近年、t-PBMTの限界の一部を克服し、脳の前頭前野と一部の辺縁系構造に効果的な照射を行うための代替手段として、鼻腔内PBMT(i-PBMT)が提案された(Pitzschke et al., 2015;Cassano et al., 2019)。i-PBMT は、レーザー/LEDを備えた小型携帯プローブ1〜2本を鼻孔に挿入して治療するという、鼻を介したアプローチである。鼻孔ベースのi-PBMTを繰り返し適用することで、脳梗塞(Xiao et al., 2005)、軽度外傷性脳損傷(TBI)(Bogdanova et al. 2017)、軽度認知障害(MCI)(Salehpour et al., 2019)、アルツハイマー病(AD)(Saltmarche et al., 2017;Chao, 2019)、PD(Li et al., 1999b)、鬱と不安(Caldieraro et al., 2018)、統合失調症(Liao, 2000)、不眠(Exu et al., 2001;Saltmarche et al., 2017)。鼻孔からの鼻腔内照射による血球や成分を介した全身作用が、観察された神経治療効果に寄与していると考えられる(Hennessy and Hamblin, 2016)。鼻腔周辺の組織には豊富な毛細血管があり、血流は比較的遅い。i-PBMTは様々な病状において、血液レオロジー改善(Liu et al., 2012)、血液粘性低下(Liu et al., 2012)、血液凝固状態改善(Gao et al., 2008)が示されている。また、ヘモレオロジーと認知機能(Elwood et al., 2001)や気分状態(Gao et al., 2004)との関連性が研究で示されている。血液照射メカニズムを介したi-PBMTの全身的な効果は、最終的に脳の神経保護効果ももたらす可能性が示唆された(Xiao et al., 2005;Hennessy and Hamblin, 2016;Caldieraro et al., 2018)。鼻腔内血液照射は、静脈内または血管内レーザー治療と同様の神経学的結果をもたらすことが研究で示されている(Jing, 1999;Dou et al., 2003)。血管内レーザー照射は、脳梗塞患者の局所脳血流(CBF)と脳機能を改善することが示されている(Song-Lin, 1997;Xiao et al., 2001)。したがって、これらの証拠から、血液成分や血管内皮の照射が、経鼻法で誘発される全身効果に関与している可能性が示唆される(Xiao et al., 2005;Va, 2015)。
携帯可能な鼻腔内アプリケーターの他に、深部CNS構造に十分な光エネルギーを供給する技術として、深部鼻腔に埋め込まれた光源を用いたi-PBMTが最近示唆された(DiMauro et al., 2014、2018;Pitzschke et al., 2015;Cassano et al., 2019)。篩骨篩板は赤色/近赤色光に対して実質的に伝染性であるため、治療用光子束はこのルートを通じて脳の前頭前野(PFC)に容易に到達できるという仮定がある(Cassano et al., 2019)。直近では、モンテカルロシミュレーションモデリングにより、篩状板に隣接するLED光源の配置は、Fp1-Fpz-Fp2点[脳波(EEG)系]における頭部上の光源の経頭蓋配置と比較して、脳室内側PFC(vmPFC)および脳室内側軌道前頭皮質(vmOFC)領域に達する最高のフルエンス値をもたらすことが示されている(Cassano et al., 2019)。また、篩板付近の光を鼻腔内に配置することで、光プローブを鼻の穴や鼻の中程の位置に配置した場合と比較して、海馬や扁桃体への優先的な光照射につながると考えられる(Cassano et al., 2019)。さらに、光源を蝶形骨洞に配置した場合、黒質pars compacta(SNpc)領域の経蝶形骨洞照明が達成可能であることが実験的に証明された(Pitzschke et al., 2015)。
鼻腔内光バイオモジュレーション療法
鼻孔からの鼻腔内光バイオモジュレーション療法
鼻腔送達は、鼻の問題(喘息、風邪、咳、副鼻腔炎など)の治療のための治療薬を送達するための有望な経路として認識されている(Marianecci et al., 2017)。さらに、鼻は脳への直接の経路として機能するので、鼻腔投与は外因性治療分子をCNSに送達するための効率的かつ非侵襲的な選択肢となる(Frey、1991)。鼻腔内の上皮組織は、比較的血管が多い(図1)。近年、全身循環を経由して脳に入るための全身治療薬の送達に鼻腔ルートが注目されている(Jiang et al., 2015)。鼻孔アプローチを用いたi-PBMTは、小型レーザーダイオードまたはLEDを鼻に片側/両側からクリップするシンプルなプロセスである(図2)。i-PBMTは、低コストで痛みを伴わない技術であり、訓練を受けた医療従事者を必要とせず、被験者が自宅で簡単に適用できるため、患者の快適性とコンプライアンスを高めるのに役立つ。さらに、市販の携帯型i-PBMT装置は小型のバッテリーで動作し、充電も可能であるため、この技術は自己適用型の治療法として適している。これらの装置は一般に入手可能で、赤色ダイオードと近赤外線ダイオードを備え、それぞれ600-680nmと800-850nmの波長域で発光する。このタイプのアプリケーターは、一般に、治療時間の選択、連続照射またはパルス照射モードの選択が可能である。i-PBMTでは、パルス波(PW)モード照射にいくつかの利点がある。第一に、鼻腔や組織に直接接触する光源は過度の加温を引き起こす可能性があるため、PWは一時停止して組織を冷却させることにより、照射に伴う熱を軽減できる。第二に、最近の知見により、10,40,100Hzなどの特定の光周波数の有益な神経生物学的効果が明らかになった(Salehpour et al., 2018b)。10-Hz PWでのPBMTは、認知や気分の問題を抱える患者において神経治療効果があることが示されている(Morries et al., 2015;Berman et al., 2017;Saltmarche et al., 2017)。第3に、40Hzのパルスレートは脳のガンマ波を増強する可能性があり、可視スペクトルによる同様の増強が実証され、ADの動物モデルにおいてアミロイドβ(Aβ)レベルおよびタウのリン酸化を減少させることが示された(Iaccarino et al., 2016)。40HzのPWモードに特化したポータブルi-PBMTデバイスは、AD患者の集中力と認知機能の改善(Chao, 2019)、および健常者の神経振動の変調(Zomorrodi et al, 2019)のためにテストされた。第4に、60Hz周波数の深部脳刺激で治療したパーキンソン病患者は、嚥下と運動症状の有意な改善を示した(Xie et al., 2015)。60Hz PWでのi-PBMTは、臨床研究において神経変性疾患に対してさらに検討されるべきである。
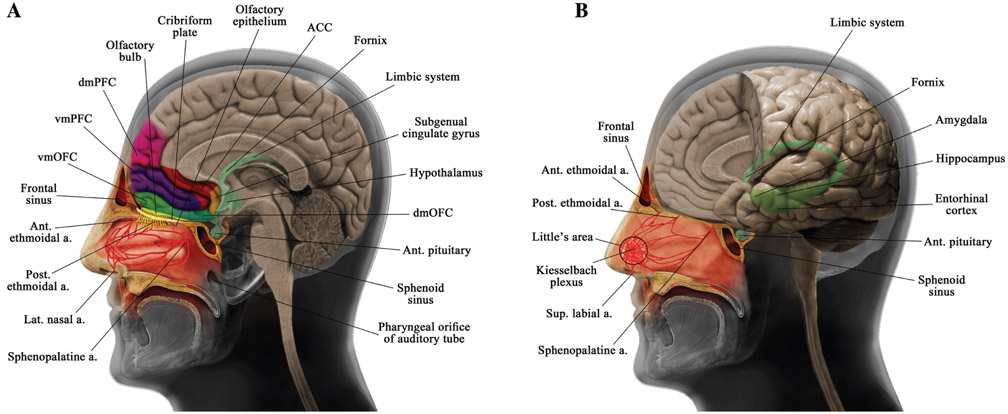
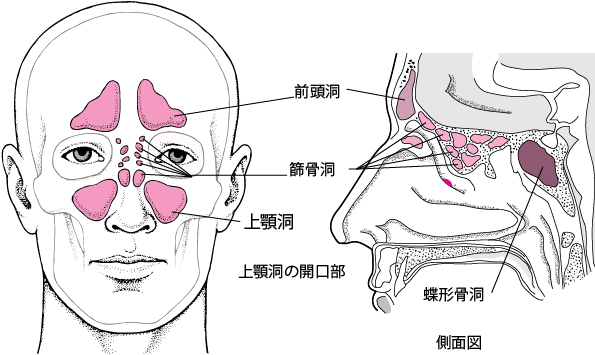
図1:鼻と大脳の解剖学的構造を模式的に表現している。
(A)鼻腔、側鼻血流、篩骨板、前頭洞・蝶形骨洞、前頭前野構造、下前頭帯状回などの解剖学的構造。(B)鼻中隔血液供給と一部の大脳辺縁系構造の解剖学的構造。ACCは前帯状皮質、ant.は前、a.は動脈、dmOFCは背内側眼窩前頭皮質、dmPFCは背内側前頭前皮質、lat.は外側、postは後、sup.は上、vmOFCは内側眼窩前頭皮質、vmPFCは内側前頭前皮質。
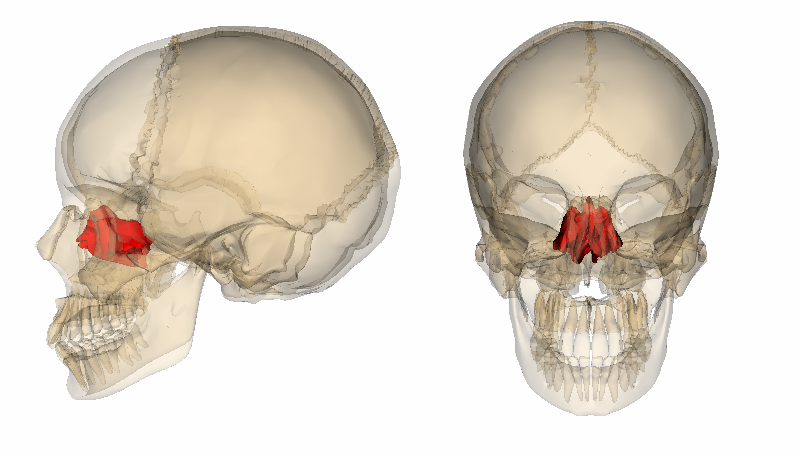
図2:鼻腔内フォトバイオモジュレーション療法を実現するための光照射のためのさまざまなアプローチ
鼻腔内光バイオモジュレーション療法は、(A)鼻孔に装着する携帯型アプリケーター、または(B)篩骨板、(C)前頭洞、(D)蝶形骨洞に埋め込む光源を用いて行うことができる。
市販されている携帯型装置は、光源を鼻孔にクリップで固定することができる。光源が鼻の内側の先端にあるため、この技術で照射された光は、鼻の粘膜や周辺組織で大部分が表面的に吸収されると予想される(図2)。810nmの光を用いたシミュレーション研究(Cassano et al., 2019)により、CNS構造のうちvmPFCとvmOFCが最も光を受けることが示されているが、それでもこの照射方法による一次光子のごく一部(~0.001%)しか照射されないと考えられる。つまり、市販のデバイスを用いたピーク光量では、vmPFCとvmOFCには0.014J/cm2と0.025J/cm2しか到達しない。さらにシミュレーションを行ったところ、扁桃体や海馬での光束は、vmPFCやvmOFCの光束よりも2桁ほど低いことが判明した。まとめると、これらの知見は、脳構造、特に辺縁系構造への光の送達に対する鼻孔ベースのi-PBMTの不十分さを示している(Cassano et al., 2019)。
血球または血液成分の照射を介した鼻孔ベースのi-PBMTの全身作用は、この介入の作用メカニズムの可能性として示唆された(Xiao et al., 2005;Hamblin, 2016;Hennessy and Hamblin, 2016;Caldieraro et al, 2018).非侵襲的で比較的安価な性質を考慮すると、i-PBMTは、静脈内血液照射アプローチと同じ治療結果を与える可能性がある(Xiao et al., 2005)。例えば、鼻腔内レーザー照射は、脳梗塞患者の局所CBFと脳機能の改善において、血管内血液照射と同等の効果があることが実証された(Xiao et al., 2005)。最近では、10日間の遠隔プレコンディショニングPBMT(670nm, 4.5 J/cm2;背部および後肢に照射)により、細胞シグナル伝達および移動(CXCR4+幹細胞およびアディポサイトカインシグナルを含む)、酸化ストレス応答経路、血液脳関門の調節のアップレギュレーションなど脳内の様々な分子経路の調節を通じて、マウスのメチル-4-フェニル-1,2,3,6-テトラヒドロピリジンに起因する神経病理から保護した(Ganeshan et al. 2019).これは、血液が鼻孔ベースのi-PBMTの脳保護効果を担う重要なメカニズムである可能性を示すさらなる証拠である。
血液の直接照射に関して、鼻腔は内頚動脈と外頚動脈によって豊富な動脈血が供給されている(図1)。解剖学的には、内頸動脈の枝には前・後篩骨動脈がある。篩骨動脈は、篩骨板を通って鼻腔内に下降する眼動脈の枝で、鼻中隔上部と鼻の側壁に供給している。外頸動脈の枝は、蝶形骨動脈、大口蓋動脈、上唇動脈、および側鼻動脈からなる。上顎動脈の終末枝である口蓋垂動脈は、口蓋垂孔から入り、中隔と側壁のかなりの部分を供給する後鼻腔の主動脈である。顔面動脈の上唇側枝は、鼻の前部と鼻中隔に供給している。さらに、鼻前庭は外側鼻動脈から血液を得る(Moore et al., 1999;MacArthur and McGarry, 2017)。さらに、これらの動脈は、主に鼻の前方部、キセルバッハ神経叢を形成する領域で、互いに吻合している。キセルバッハ神経叢は、鼻中隔の前下方四分円、中隔軟骨の上にある吻合に富む血管領域で、上記の動脈がすべて吻合している。鼻の静脈は動脈に続いて翼状神経叢、海綿静脈洞、眼静脈に排出される(Ritter, 1970;Koh et al., 2000;Rajagopal and Paul, 2005)。
鼻孔を利用した血液i-PBMTは、酸素供給を改善し、脳を含む様々な組織のアデノシン三リン酸(ATP)レベルの上昇につながることが知られている。可視光だけでなくNIR光を用いて血液に吸収されたPBMTは、ヘモグロビンリガンド複合体[例えばO2、二酸化炭素、一酸化窒素(NO)]の部分光化学解離をもたらす(Komorowska et al., 2002;Vladimirov et al., 2004;Lohr et al., 2009;Walski et al., 2015)。オキシヘモグロビンの光誘起光解離の結果は、血液毛細血管における動脈酸素飽和度(SpO2)の低下に続いて、局所組織酸素化の著しい富化である(Asimov et al., 2007;Yesman et al., 2016;Gisbrecht et al., 2017)。また、ヘモグロビンが660nmの光子を吸収し、血中リンパ球に対するレーザー照射の効果を増幅できることを示す証拠もある(Stadler et al., 2000)。さらに、微小循環に影響を与える最も重要な因子の一つであるNOの少量の放出は、血管拡張を高め、結果として灌流を改善し、組織への酸素供給の改善に寄与する。このことは、鼻孔を用いたi-PBMが、低酸素虚血性脳障害や神経変性疾患、神経精神疾患の治療に有効な方法である可能性を示唆している。実際、うつ病患者では、内皮からのNOの産生が低下している(Chrapko et al., 2006)。同様に、高血圧は内皮細胞の酸化ストレスを誘発し、NOのバイオアベイラビリティを低下させ、その後、認知機能を損なう(Bomboi et al., 2010)。鼻孔を用いたi-PBMTは、内皮または血小板のいずれかからのNO放出を調節し、ひいては上記の疾患における脳血管循環を改善する可能性がある。一方、血液PBMTの全身への影響は、赤血球(RBC)の膜特性のコンフォメーション変化の結果である可能性がある。赤色/近赤外光の吸収は水素結合を擾乱し、その結果、膜界面における水分子の崩壊と解離の増加をもたらす(Natzle et al., 1981;Natzle and Moore、1985;Szymborska-Małek et al. 2018)、赤血球膜タンパク質の構造変化や脂質二重膜の流動性を誘導し、赤血球の膜イオンポンプの活性を変調させる(Komorowska et al., 2002;Kujawa et al., 2004;Chludzińska et al., 2005;Walski et al., 2015)。これは、ひいては、赤血球の変形性、ATP含量の改善、および浸透圧特性の正常化をもたらす(Itoh et al., 1996;Walski et al., 2014;Wang et al., 2016)。さらに、膜の動電位が上昇することで、凝集物が減少し、循環が改善されることで、血液レオロジーの改善に直接寄与する可能性がある。凝集は、赤血球がルーローを形成し、コインの積み重ねに似ていて毛細血管の流れを物理的に妨害する(Komorowska et al., 2001;Mi et al., 2004;Chludzińska et al., 2005)。赤血球が810nmのレーザーを吸収すると、ATPase活性が上昇し、赤血球膜タンパク質が変化することが報告されている(Kujawa et al., 2004)。赤血球膜の変質は、PBMT後の血液粘度や循環の長期的な改善のメカニズムであると考えられている(Komorowska et al., 2002;Kujawa et al., 2004;Walski et al., 2015)。
ヘモグロビンは、他のメタロポルフィリンと同様に、可視のフェムト秒パルスレーザー光で励起されると蛍光を発することが知られている。Zhengら(2011)の研究では、600~750nmの波長域の光をテストし、励起波長が700nm以下のときに最も高いヘモグロビン蛍光が放出された。また、赤血球からは青色波長のバイオフォトンがバイオルミネッセンスとして放出された。赤色光を用いた血液PBMTでも、ヘモグロビンからの青色光の生物発光が誘導され、その結果、最近Sternら(2018)が示したように、血流が著しく増加し、流動媒介拡張が改善し、循環NOやニトロソ化合物を放出する可能性があると考えられる。
組織酸素化の変化や赤血球構造の改変について述べたことに加え、血球の照射を介した鼻孔を用いたi-PBMTの全身的効果は、止血調節のメカニズムに直接関係していると思われる。一方では、異なるアゴニストに対する血小板の感受性の可逆的な抑制、およびPBMTの用量依存的なアラキドン酸カスケードの酵素活性の低下が報告され(Brill et al., 2000;Rola et al., 2017;Drohomirecka et al., 2018)、PBMTが病態下でアポトーシスを受けている血小板を防止して寿命を延ばすことができるという結論に至る(Yang et al., 2016;Zhang et al., 2016,2018).うつ病患者の血小板では、ミトコンドリア呼吸数とATPレベルが低下していることがエビデンスとして示されている(Hroudová et al., 2013)。細胞エネルギー代謝の増加を介したPBMTの中心的なメカニズムを考慮すると、鼻腔内ルートによる循環血小板ミトコンドリアの照射は、全身治療で見られるオフターゲット効果またはアブスコパル効果を説明できる可能性があり、特にうつ病を改善するための可能性もある(Sommer and Trelles, 2014)。
免疫細胞に関する幅広い研究により、赤色/近赤外光への組織の直接曝露は、多形核白血球の標的炎症部位への流入を減少させ、したがって酸化バーストを減少させることが実証されている(de Lima et al., 2011;Oliveira et al., 2014;Walski et al., 2018)。鼻孔ベースのi-PBMTの血液を介した遠隔神経保護作用は、逆説的に活性酸素種(ROS)形成の調節に関連している可能性がある(Karu et al., 2005)。活性酸素は、シグナル伝達経路や遺伝子発現の調節に重要な役割を担っている。ROSの役割は、マクロファージの極性をM2表現型に再プログラミングし、組織の回復に関連する抗炎症メディエーターを放出するのに重要である(Zhang et al., 2013;Cheon et al., 2017)。このメカニズムは、脊髄損傷ラットモデルにおいて、810nm PBMTがマクロファージ/ミクログリアの分極状態をM2表現型に変化させ、インターロイキン(IL)-4やIL-13などの抗炎症性サイトカインの発現を上昇させるが(Song et al., 2017)、マクロファージの代替活性化をもたらす炎症性IL-6の抑制(Birnes et al., 2005)ことを示した過去の報告と一致する。
血液成分への全身的な影響の他に、嗅神経と球、嗅内皮、自律神経系、リンパ系に影響を与えるなど、i-PBMTを媒介する可能性のある経路がいくつか提案された(Liu et al., 2007,2010)。鼻骨骨髄の間葉系幹細胞/マローストローマ細胞(MSC)の全身的な活性化(Liu et al., 2012)および鼻粘膜の嗅覚被膜細胞(幹細胞の別のタイプ)(Hennessy and Hamblin. 2016)が可能な経路として示唆された。
鼻腔内からの光バイオモジュレーション治療、鼻粘膜下腔からの光バイオモジュレーション治療
上記のように、鼻孔ベースのポータブルアプリケーターの使用は、脳深部構造への光エネルギーのごくわずかな量しか提供しないようである(Cassano et al., 2019)。さらに、経頭蓋法に関しては、頭蓋骨を通る限られた光の伝染が、皮質下ニューロンを刺激するt-PBMTの大きな障害として残っている。1064nmのレーザー光のうち、ヒトの眼窩上前頭骨を通過できるのはわずか2%と報告されている(Barrett and Gonzalez-Lima, 2013)。また、633nmのLED光は0.5%、830nmのLED光は2.1%が前頭骨1cmとその上の組織を伝染することが、死体モデルで示された(Jagdeo et al.)また、高出力レーザー装置からの810nmの光の2.9%が、3cmの頭皮、頭蓋骨、脳組織を伝染することが示された(Henderson and Morries, 2015)。これらの測定結果を踏まえると、光束の大幅な減衰により、頭蓋内光量が不足し、それに伴い皮質下灰白質への光刺激が不十分になると考えられる。
最近、携帯型装置や経頭蓋照射法の限界を克服するために、埋め込み型i-PBMT装置が提案・記載された。移植可能な鼻腔内光デバイスを使用すれば、長期的な治療プロトコルを必要とする患者の頻繁な治療訪問は不要になるであろう。この後者の方法は、局所麻酔と外来手術しか必要とせず、粘膜下LEDを留置(除去も含む)することができる(Cassanoら、私信)。しかし、小型化されたLEDの粘膜下配置は、篩骨板に相対的に近接しているだけであるため、潜在的に制限されている。
篩骨板は、脳と鼻腔を隔てている篩骨(しこつ)の一部である(図1)。前頭蓋窩と鼻腔の間に位置し、Crista galliから蝶形骨面まで前後方向に伸びている。厚さ約1mmの篩骨板は、PFCの下に位置し、鼻腔の屋根を形成している。表面の約半分は非常に小さな穴が開いており、嗅覚神経の繊維が出入りする際の支えとなっている(Erdem et al., 2004)。嗅球は、鼻腔の上、篩骨板の上面、前頭葉基底部の下面にある脳の一部である(Masurkar and Chen, 2009)。嗅覚機能障害は、MCI、認知症、PD、PDの精神神経系合併症など、いくつかの神経変性疾患の発生リスクを予測する(Wilson et al., 2010)。哺乳類の成体では、神経新生は嗅球と海馬の歯状回でのみ起こり、ヒトでは海馬でのみ起こると考えられている(Bergmann et al., 2015)。810nmのt-PBMTは、マウスTBIモデルにおいて歯状回と脳室下帯の神経新生を著しく刺激し、移動する神経前駆細胞をアップレギュレートすることが示された(Xuan et al., 2014)。現在までのところ、PBMT後に嗅球での神経新生の誘導を実証した研究はまだないが、この部位に直接照射することで、神経幹細胞を活性化する可能性がある。
ミトコンドリア複合体IV[シトクロムcオキシダーゼ(CCO)]は、赤色/近赤外光子の初期吸収の主要部位である(Karu, 2010)。CCOによる光吸収は、ATP産生の増加、NOの調節、組織の酸素化と血流の増加をもたらすと考えられている(de Freitas andHamblin, 2016)。光ファイバー技術で照射される650nmと850nmの波長は、鼻腔を深く伝染する可能性がある(Zubia and Arrue, 2001)。青と緑のスペクトル(400~540nm)の可視光線は、人間の頭蓋骨を0.1%未満しか伝染せず、すべての介在組織を考慮すると、脳への伝染率ははるかに低くなると予想される(Litscher and Litscher, 2013)。したがって、これらの波長は一般的にヒトのt-PBMTには適さないと考えられている。しかし、i-PBMTに青または緑のダイオードを適用することは、その有益な生物学的効果のために代替オプションとなり得る。532nmのレーザーは、軟組織への浸透深度がわずか0.8mmである(Te Alexis, 2006)。532nmのレーザー光源を篩骨板の近くに埋め込めば、緑色の光が篩骨板内の神経線維組織(厚さ1mm)を十分に照射できると想像される。しかし、嗅球全体(厚さ3mm)をこの波長で十分に照射できるかは疑問である。532nmのグリーンレーザーは、ミトコンドリア複合体III(シトクロムb、c1、c)の活性を調節することにより、試験管内試験でATPレベルおよび細胞増殖を増加させる可能性があることが研究で示されている(Fukuzaki et al., 2013)。また、532nmレーザーの照射は、GABA作動性神経幹/前駆細胞のマウス大脳新皮質の深層への移動を促進することが示されている(Fukuzaki et al., 2015)。さらに、420nmの青色光は、ミトコンドリア複合体I(NADH-dehydrogenase)の調節を通じて、おそらくATP合成を効果的に増加させることが示唆された(Karu, 1988)。

前述のように、篩骨板には非常に小さな孔が存在するため、篩骨板に近接した光源から照射された光子のうち、異常に大きな部分が嗅神経線維や嗅球、PFCに直接届く可能性がある(図2)。PFCは、視床、基底核、視床下部、扁桃体、海馬など、記憶、感覚、感情に関わる大脳の構造とよくつながっている。vmPFCは、大脳半球の背内側PFCより下側に位置し、腹側・内側ともにPFCの全領域を指し、脳梁の玄武部よりほぼ下に位置する(Nitter, 2017)(図1)。vmPFC内には、解剖学的および/または機能的に特化した小領域があり、その機能領域と関連している。前/前庭vmPFCと腹側線条体は意思決定に、後/後庭vmPFCと扁桃体は情動に、前/前庭vmPFCと背内側PFC、前楔、側頭頭頂皮質は社会認知に関わる(Myers-Shulz and Koenigs, 2012;Roy et al, 2012)。実際、vmPFCの前部/前庭亜領域は報酬の価値などのポジティブバランスに関連し、後部/前庭亜領域は脅威や恐怖などのネガティブバランスに関連する(Hiser and Koenigs, 2018)。OFCは、眼球が位置する眼窩の真上にある前頭葉の腹面にあり、後方には前頭極から島皮質まで、腹側には内側壁の吻溝から腹側凸部まで伸びて脳の前頭底を形成している。OFCは、扁桃体、側頭連合野、視覚系、味覚、嗅覚、体性感覚野、視床内側背側核、視床下部から投射を受けている(Rudebeck et al., 2013)。OFCは、学習(報酬と罰)、感情制御、および感情誘導行動、意思決定、および社会的・感情的処理に関与する(Rolls and Grabenhorst, 2008;Clark et al., 2018)。
嗅上皮は、鼻孔の上下7cmほどの鼻腔を覆う特殊な上皮組織である。上皮層の厚さは約60μmで、鼻腔と脳を隔てる篩骨板によって規定されている。鼻の中で篩状板と密着していることから、i-PBMTプローブを埋め込む場所として提案される可能性がある。この上皮には嗅覚に関わる敏感な細胞が存在するため(Choi and Goldstein, 2018)、この組織を光プローブの埋め込み場所として使用する際には注意が必要であることは非常に重要である。埋め込み型光デバイスが篩骨板のレベルに位置する場合、嗅球とvmPFCを効果的に照射することができる(図2)。死体-頭部を用いた研究では、赤色/近赤外光の鼻腔内照射により、OFCの前内側および後内側部分を潜在的に照射できることが示されている(DiMauro et al., 2018)。また、モンテカルロシミュレーションにより、光源を篩骨板に近接して配置した場合、vmPFCへのエネルギー堆積は、光源を鼻の中や鼻孔にそれぞれ移植した場合に比べて46倍および658倍大きいことが示されている(Cassano et al., 2019)。さらに、光源を篩骨板に配置すると、背外側PFCと比較して、vmPFCとvmOFCに対する送達光フルエンスが(少なくとも2桁)高くなった。また、扁桃体や海馬などの辺縁系構造は、鼻の穴に配置された光源からごくわずかな光エネルギーしか受けないが、鼻の真ん中と篩状板の両方の位置では、前述の領域に対して、わずかに高い光の堆積が可能だが、それでもまったく不十分(一次光子の0.01%)だということも示唆した(Cassano et al., 2019).
蝶形骨洞からの鼻腔内光バイオモジュレーション療法
移植可能な光ファイバーは、鼻腔を通して進められ、蝶形骨洞に配置され得る(DiMauro et al., 2008、2014、2018;Pfleiderer et al., 2017)(図2)。例えば、携帯型レーザー/LED光源に接続された光ファイバの先端を挿入し、留置デバイスとして、内視鏡による直接可視化下で蝶形骨に配置することができる(DiMauro et al., 2008)。しかし、この手順は、アクセス性が悪く、非常に壊れやすい骨構造にデバイスを配置するために、全身麻酔下で複雑な外科的鼻[耳、鼻、喉(ENT)]手術を必要とする。蝶形骨洞は、蝶形骨の本体内にある一対の空間で、その前壁の蝶形骨洞凹部を介して鼻腔の屋根に開いている(Wiebracht and Zimmer, 2014)(図1)。上方に篩骨洞屋根、海綿静脈洞、視神経、嗅神経、トルコ鞍があり、下方に鼻腔、前方に鼻腔と後頭骨気房、後方に中頭蓋窩の内容物、後方に海綿静脈洞と頭蓋腔がある(ブドゥら, 2013).
また、蝶形骨洞は、重要な大脳辺縁系構造(下垂体、扁桃体、視床下部、海馬など)に隣接している(図1)。下垂体は、視床下部の最下部(脳の下)から下垂体茎または内槽によって吊り下げられている。下垂体は蝶形骨の下垂体窩に位置し、トルコ鞍に囲まれている(Amar and Weiss, 2003)。下垂体は、他のほとんどのホルモン分泌腺の活動を制御しているため、体のマスター腺であると考えられている。扁桃体は、脳の側頭葉の深部と内側にあり、海馬の前方に位置している。扁桃体は蝶形骨洞の外側で、やや後方に位置している。扁桃体は、視床背内側、視床網様体核、視床下部、三叉神経核、顔面神経、尾状核、腹側被蓋野、後背側被蓋野などいくつかの構造物に投射し、さまざまな行動機能に影響を与えることができる(Glor, 1978)。扁桃体は、恐怖、不安、攻撃性などの情動反応の処理、記憶、表情の知覚、意思決定などに関与する(Sah et al.)視床下部は、第3脳室の両側で下垂体に隣接し、蝶形骨洞の真上でやや後方に位置している。視床下部は、脳幹および網様体、扁桃体および中隔を含む大脳辺縁系構造、および自律神経系の領域と相互接続している(Freeman. 2003;Parent and Perkins、2018)。視床下部は、内分泌、体温、食物・水分摂取、生殖・性行動、概日リズム、疲労、睡眠、情動反応、記憶機能の調節に関与している(Parent and Perkins, 2018)。海馬は、大脳皮質の下の側頭葉に位置するパラ海馬回内部の灰白質組織からなる凸状構造で、側脳室下角の内側壁を形成している。また、海馬の最前部は蝶形骨洞の上方と後方に伸びている(Netter, 2017)。海馬は、学習、記憶(特に長期記憶)空間ナビゲーション、視床下部機能の調節、感情など、いくつかの高次認知機能を媒介する(Anand and Dhikav, 2012;Insausti and Amaral, 2012)。
蝶形骨洞は、大脳辺縁系構造に治療量の光を供給できる移植光源の位置として利用できる可能性があると考えられる(DiMauro et al., 2014)(図2)。Pitzschkeら(2015)は、ヒトの死体でSNpcへの十分な照射を実現するために、経蝶形骨アプローチからの光照射と光子分布の可能性を実験的に検証する努力をした。彼らは、光ファイバーを用いた光拡散器を671nmと808nmの異なる波長を発するレーザーダイオードに結合し、プローブを鼻腔内に導入し、内視鏡ガイド下でSNpcに向かって蝶形骨洞に設置した。彼らの測定によると、光ファイバーが発する671nmの光の0.03%、808nmの光の0.36%がSNpcに到達できた(Pitzschke et al., 2015)。十分なパワーを持つ光源を使用すれば、これらの割合の光がSNpcの標的組織に十分な光刺激フルエンスを提供できる可能性がある。SNpcは、大脳基底核回路への主要な出力である。SNpcのドパミン作動性ニューロンは、黒質経路を通じて背側線条体に、また、基底核系の外側および内側淡蒼球、SNpr、視床下核に投射する(Lavoie et al., 1989;Hajos and Greenfield,1994;Clug et al, 2004)。SNは報酬追求、運動計画、運動において重要な役割を果たす(Delong et al., 1983;Ilango et al., 2014)。経蝶形骨膜照明を用いると、一次光エネルギーの妥当な割合が、SNpcに到達する前に、下垂体、そしておそらく扁桃体、視床下部、海馬の前部にも堆積する可能性があると考えられる。
脳疾患に対する鼻腔内光バイオモジュレーション療法
i-PBMTは1998年に中国の研究者によって導入され、頭痛に悩む患者に対する鼻腔内赤色レーザー照射の治療効果に関する最初の証拠を報告した(Li et al., 1998a、b)。脳に対するi-PBMTの臨床研究のほとんどは、中国とロシアで実施された(Liu et al.)従来、i-PBMTは、MCI(Jin et al., 2000)、AD(Xu et al., 2002b)、PD(Li et al.,1999a-c;Xu et al., 2003;Zhao et al., 2003)、脳血栓症(Li et al. 1999a)、脳血管障害(Jianbo et al., 1999)、脳卒中後うつ病(Xu et al., 2002a)、不眠症(Xu et al., 2001,2002c)などがあり、全体的に臨床成績は有望と思われる。i-PBMTは、ほとんどの研究が中国語で発表されたため(ここ数年まで)、北米やヨーロッパ諸国では一般に知られていない(Jiao et al., 2006)。最近、PBMTのための光の経鼻照射は、代替/補完的アプローチの可能性として欧米の研究者の間で注目されており、単独または経頭蓋アプローチ(ヘッドピースプローブまたはライトヘルメットを使用)と同時に適用されるのが一般的である。ここでは、脳関連疾患におけるi-PBMTの臨床応用について、最新のエビデンスをレビューし、要約することにする。
神経変性疾患
軽度認知障害
最近、Salehpourら(2019)は、MCI患者において、経頭蓋+経鼻PBMTを1カ月間行ったところ、認知機能低下と嗅覚機能障害が急速に回復したことを報告した。MCIは、記憶や実行能力を含む認知能力のわずかな(しかし顕著で測定可能な)低下と定義される(Ritchie and Touchon, 2000)。彼らの研究(Salehpour et al., 2019)では、ライトヘルメットとともに、左鼻孔に鼻腔内装置を設置し、10.65J/cm2フルエンスの810nm LED光を10Hz PWモードで鼻腔から毎日2回照射した。認知機能の向上は、モントリオール認知評価で測定された実行機能/視空間能力、数学的能力、オリエンテーションの改善によって観察された。また、ワーキングメモリー質問票による評価では、ワーキングメモリー、注意、実行領域の有意な改善がみられた。さらに、アルバータ臭覚検査とピーナッツバター臭覚検査のデータから、嗅覚障害の完全な回復が確認された。
アルツハイマー病
Xuら(2002b)は、633nmの赤色レーザーを用いたi-PBMTが、AD患者のMini-Mental State Examination(MMSE)およびWechsler Memory Scale(WMS)で測定される認知機能を改善することを示した。さらに最近、カナダのLew Limの研究グループが、経頭蓋および/または経鼻PBMTを用いたAD治療で躍進した。最初の報告(Lim, 2014)では、Limは、1日1回、1年間、シングルモダリティのi-PBMT(810nm LED、10Hz PW)を行うことで、MMSEで測定した2人のアルツハイマー病患者の認知・記憶機能が有意に改善したと報告している。最近のケースシリーズ(Saltmarche et al., 2017)では、5人の軽度から中等度の認知症患者において、経頭蓋+経鼻のPBMTを3カ月間行うことで認知機能が有意に向上したことを明らかにしている。彼らはウェアラブルな経頭蓋デバイスとともに、鼻腔内LEDアプリケーター(810nm、10Hz PW)を1日1回左鼻孔に適用し、鼻腔内に13.8J/cm2のフルエンスを供給した。MMSEとアルツハイマー病評価尺度(ADAS-cog)で評価される認知能力の改善のほか、睡眠の質の向上、不安、怒りの爆発、徘徊のレベルの低下も観察された。別の研究(Zomorrodi et al., 2017)では、経頭蓋および経鼻PBMT(810nm、40Hz PW)を同時に6日/週、2週間適用した結果、MMSEおよびADAS-cog尺度ならびにAD Cooperative Study-Activities of Daily Living Scaleで評価したアルツハイマー病患者の認知機能が著しく改善したと報告した。また、これらの急速な認知機能の向上は、すべての脳振動にわたる脳波信号の絶対パワーの全体的な増加を伴っていた。同様に、最も新しい研究で、Chao(2019)はまた、認知症またはADと診断された4人の患者にVielight Neuro Gammaデバイスを適用した。経頭蓋ヘッドセットとともに、鼻腔内LEDアプリケーター(810nm、40Hz PW、15J/cm2)を左鼻孔に3日/週、12週間自宅で投与した。ADAS-cogおよびneuropsychiatric inventoryのスコアによると、認知機能および行動機能は改善された。さらに、画像データに基づいて、マルチモダリティPBMTは脳灌流を増加させ、デフォルトモードネットワーク(DMN)内の後帯状皮質と外側頭頂部のノード間の接続を増加させた(Chao, 2019)。AD患者を対象とした神経画像研究では、安静時機能的結合度MRIにおいて、DMNの機能的結合度の低下が一貫して示されている(Greicius et al., 2004)。したがって、t-PBMTを用いてアルツハイマー病患者のDMNの機能的結合を改善することは、非常に重要であると考えられる。Saltmarcheら(2017)、Chao(2019)、Salehpourら(2019)が行った研究では、片側(片鼻)の治療であるため、鼻腔、嗅覚系、およびおそらくCNS構造の片側が鼻内装置によって優先的に照射されたことを明記する必要がある。この種の研究では、治療の均一化のためにi-PBMTデバイスの両側適用が推奨される。
パーキンソン病
中国の研究者の中には、パーキンソン病患者に対するi-PBMTの神経治療的役割の可能性を検証した者もいる。最初の報告では、Liら(1999b)は、i-PBMT(633nmレーザー、3.5-5.5mW、30分)を1日1回、10日間行ったところ、血清コレシストキニン-オクタペプチド値が有意に減少し、Webster Scaleスコアで測定した患者の60%(43人中26人)がPD症状の改善を伴うことを示した。同様に、上記と同じ治療パラメータを用いた場合(Li et al., 1999b;Zhao et al., 2003)には、患者の89%(36人中31人)においてPD症状の軽減が報告された。これらの患者のうち、28%は有意な改善を示し、58%は緩やかな改善であった。また、Xuら(2003)は、i-PBMT(633nmレーザー、3.5-4.5mW、30分)を1日1回、20日間行ったところ、66%の患者(47人中31人)において、PD症状の改善を伴うマロンアルデヒドの減少、スーパーオキシダーゼディスムターゼおよびメラトニン濃度の上昇が見られたことを示した。
外傷性脳障害(Traumatic Brain Insults
外傷性脳損傷
Douら(2003)は、脳梗塞・TBI患者50名に10日間にわたり経鼻プローブ(650nmレーザー、2.4mW、30分)を投与し、Fugl Meyer Movement ScaleとBarthel Index(日常生活動作)のスコアが有意に低下することを明らかにした。また、脳病変や浮腫の減少とともに、コレステロール、トリグリセリド、低密度リポ蛋白、赤血球沈降速度、ヘマトクリットの測定値が有意に減少した。PFCと前帯状回は、前頭葉の中で主にTBIの際に損傷を受けやすい2つの領域であることに注意する必要がある。嗅球と嗅覚路の損傷は、TBIにおける腹側前頭葉の損傷とともに併発することもある(Levin et al., 1985;Cicerone and Tanenbaum、1997)。さらに、軽度TBIの退役軍人8人を対象とした無作為化二重盲検偽薬対照パイロット試験研究において。Bogdanovaら(2017)は、経頭蓋LEDヘルメットと経鼻LEDアプリケーターを2日/週、8週間にわたり併用することで、治療後1週間時点での注意力と実行機能、睡眠の質が有意に改善されたと報告している。
虚血性脳損傷
Xiaoら(2005)は,脳梗塞患者21名を対象に、single photon emission computed tomography cerebral perfusion imaging法を用いて、i-PBMTの脳機能および血流に対する即時有益効果を報告した。その結果、650nmレーザー(3.5-4mW、15分/ノストリル)を用いたi-PBMTの単回施術により、局所および全身のCBFが有意に改善することがわかった。PDを伴う脳梗塞患者の1人のデータによると、i-PBMTの30分の適用で、左側頭葉と基底核領域の血液供給と機能が増加した(Xiao et al., 2005)。また、鼻腔内レーザー照射(650nm、8.38mW/cm2,30分)は、脳梗塞患者の血液や血漿の粘度、赤血球の凝集、血中脂質を改善することが示されている(Liu et al., 2012)。
精神神経疾患と不眠症
うつ病・不安症
より最近では、Caldieraroら(2018)が、大うつ病と不安症の患者における長期PBMTの全体的な治療効果を報告した。最初の22カ月間、シングルモダリティのi-PBM(810nm LED、10-Hz PW)を両鼻孔に適用し、鼻孔あたり10.65J/cm2のフルエンスを提供した。i-PBMTの実施頻度を週2回から毎日、さらに1日2回と徐々に増やしていくと、不安症状は着実に後退し、不安症状質問票のスコアは約3倍減少した。しかし、i-PBMTだけでは、その後9カ月間、830nmの経頭蓋レーザー装置を額に追加照射するまで、抑うつ症状の軽減は見られなかった。彼らの推測によると、血球を介したi-PBMTの全身作用が、観察された抗不安作用に寄与している可能性がある(Caldieraro et al., 2018)。
不眠症
睡眠障害におけるPBMTの治療応用については、新たなエビデンスが得られている。全身治療器を用いた赤色光照射(658nm、30J/cm2)の2週間プログラムは、健康な成人の睡眠の質と血清メラトニン濃度を改善することが示されている(Zhao et al., 2012)。睡眠障害は、TBI患者に観察される最も一般的な副作用である。TBI患者におけるt-PBMTの適用に関する研究では、多くの患者から睡眠の改善が報告されている(Naeser et al., 2011、2014;Morries et al., 2015)。経頭蓋装置と鼻腔内携帯アプリケータを用いた複合PBMTアプローチも、AD(Saltmarche et al., 2017)とTBI(Bogdanova et al., 2017)と診断された患者において、より良い睡眠をもたらした。個人の報告によると、眠気は10Hzの経鼻ポータブル機器の使用後によく見られる副作用であり、おそらく光のパルスレートが脳のアルファ波(8~12Hz)を誘導し、同時に神経細胞刺激も生じるためである(Salehpour et al., 2019)。さらに、中国からのいくつかの研究では、不眠症患者の睡眠の質に対するシングルモダリティi-PBMT(632.8nm)の治療効果が実証された(Xu et al., 2001,2002c;Chen and Cheng, 2004)。睡眠改善に対するPBMTの作用機序は未だ不明な点が多いが、血清メラトニン濃度の上昇を介した概日リズムの調節(Xu et al., 2001;Liu et al., 2010;Zhao et al., 2012)および血液循環系を介した全身の恒常性反応の刺激(Moshkovska and Mayberry. 2005)が可能な機序経路として仮定された。
結論と今後の方向性
i-PBMTに関する文献を総合的に検討した結果、i-PBMの使用に関する科学的根拠が限られていることから、この方法の臨床使用に関する承認された適応症がまだ存在しないことは驚くには値しないだろう。
しかし、鼻孔に装着するi-PBMT装置は、現在、ウェルネス用(疾患別適応なし)として市場に出回っている。これらの装置は非常に便利で、鼻の穴に簡単にクリップで留めることができ、赤色光と近赤外光を自己投与するための、携帯可能で使いやすい家庭用装置である。また、t-PBMT用として市場に出回っている他の機器と比較すると、比較的安価である。赤色光と近赤外光のユーザーにとって理想的な最初のステップであり、特に、光バイオモジュレーションの全身的な効果を利用して健康になることに関心のあるユーザーにとっては、理想的な装置といえる。鼻孔を使ったi-PBMTの神経治療効果に関わる作用は、まだ解明され始めたばかりである。血球や成分を介した全身的な効果が、最も可能性の高いメカニズムである。鼻腔内の赤色/近赤外光照射によって鼻動脈で誘導されるNOの放出は、血小板凝集と白血球の接着を抑制することによって微小血管の循環を増加させると考えられる。また、鼻孔を用いたi-PBMTは、血液レオロジーと局所血中酸素飽和度を改善し、最終的に脳循環と脳機能の強化につながると考えられる。嗅神経や球、内皮、自律神経系、リンパ系への影響など、いくつかの追加経路の可能性を検討した結果、嗅神経や球、内皮、自律神経系、リンパ系への影響も考えられる。さらに、鼻骨骨髄に存在するMSCや鼻粘膜に存在する嗅覚包皮細胞の全身的な活性化も推測される。神経変性疾患の脅威に対抗し、精神神経疾患の障害負担を軽減するために、脳の健康を増進・維持する必要性に対する社会的認識が高まっているため、ウェルネスのための鼻腔内PBMTは多くの人にとって魅力的であるはずだ。ただし、いくつかの全身的な効果が想定されているが、それが心身の健康や脳疾患の予防につながるという確証はまだない。鼻孔を使ったi-PBMTは非常に便利で直感的に使用できるため、脳疾患にPBMTを使用する際の最初の介入として理想的である。この臨床使用は適応外であり、患者が承認された介入に反応しないか耐えられないか、承認された介入を拒否する場合、またはエビデンスに基づく介入が存在しない場合にのみ考慮されるべきである。鼻孔内i-PBMTの欠点と限界は、脳へのごくわずかな光の沈着を示した線量測定研究に基づいて、脳の直接的な神経調節が期待されないことである。
i-PBMTのための留置器に関しては、現在の技術的進歩に基づき、第一に区別する必要がある。蝶形骨洞や篩骨板隣接の粘膜下腔に留置するような、最も未来的なi-PBMTの介入は現実的ではない。実際、どちらも現在のところ実現不可能である。LEDデバイスを鼻の奥または鼻の天井に挿入するために必要となる外科的介入は、ミリメートル単位で薄く、曲線的で硬い鼻腔によって制限され、骨構造の外科的解体を行わない限り、現在の外科的ツールでは禁止されるものである。鼻の骨の構造は非常に薄く、またミリ単位の薄さであり、その空間は非常に血管が多いため、大量の出血、嗅覚神経の損傷、脳脊髄液の漏れ、脳構造の損傷(例:下垂体)の可能性がある。したがって、深部i-PBMTのこれらの未来的な応用が、現在、法外であることは理解できる。したがって、深鼻i-PBMTがvmPFCおよびvmOFC領域、さらには理論的には大脳辺縁系に優れた光照射を提供するという主張は、まだ極めて推測的である。
これに対して、鼻腔内やt-PBMと比較して、鼻中粘膜下i-PBMT装置や前頭洞(図2)i-PBMT装置の留置が現実的で、いくつかの利点がある。最も重要なことは、これらの留置型デバイスは、中隔形成術と同等の低侵襲な耳鼻咽喉科手術が必要であるため、外来日帰り手術で設置することができることである。vmPFCとvmOFCへのNIR光の照射は、t-PBMTで達成される蒸着と同等であり、前頭極に近接した皮膚に外部光源を設置するのと同等であるが、i-PBMT留置装置はt-PBMTと比較して潜在的に有利である。実際、精神神経科や神経リハビリ科のPBMTクリニックで適応外使用されていることから、t-PBMTのいくつかの限界がすでに確認されている。第一に、t-PBMTは、レーザー光を照射するためにオフィスでの診察か、LED機器を用いた自己管理が必要である。どちらのシナリオも時間がかかり、LED機器を用いた自宅での自己管理でさえ、神経治療効果を得るために1日最大60分のセッションが必要となる(家庭用のt-PBMT LED機器の多くは低照度であるため)。t-PBMTで必要とされるこの時間的余裕は、まだ高い機能を持つ患者にとって法外なものである。中鼻や前頭洞に留置するi-PBMTであれば、治療がプログラムされ、ユーザーのルーチンを妨げることなく自動的に行われるため、この制限を回避することができる。第二に、認知障害や身体障害のある患者の場合、t-PBMTは、たとえ自宅であっても、家族または他の介護者による配置と光照射の監視のための支援を必要とする。このような介護者の負担は、通常、発達が遅れている患者や認知症の患者の介護に追われているが、i-PBMT装置を留置することで相殺することができるだろう。第三に、脳の状態を「読み」、脳に「書き」、脳機能をサポートする適切な刺激で応答できる新世代のスマート・ニューロモジュレーターが開発されている。t-PBMTは、脳活動センサーと脳への赤色/近赤外線刺激を統合したこの新世代の閉ループデバイスにとって直接的かつ最も論理的なモダリティである。しかし、i-PBMT留置デバイスは、t-PBMTが現実的でない場合や患者の意識的な努力を必要とする場合に、光の照射などのリアルタイムで自動化された介入を可能にするため、さらなる機会を提供する。これには、中毒性物質への突然の欲求や、自傷行為や自殺への衝動の発生といった重大なシナリオが含まれる可能性がある。注目すべきは、t-PBMTに対するi-PBMTの前述の利点にもかかわらず、2つの様式が脳障害に対して同等の治療効果を有するかどうかはまだ実証されていないことである;NIRのいくつかの推定作用機構はt-PBMTにのみ適用されるかもしれない(Herisson et al., 2018)。
全体として、ウェルネスのための鼻腔内PBMTは利用可能であるが、脳の健康を達成または維持するためのその有効性はまだ証明されていない。粘膜下および前頭部留置型i-PBMTは、新規の神経治療モダリティとしての可能性があるが、いずれの機器も市場で入手できず、その使用を支持する科学的根拠もない。深鼻(篩骨板または蝶形骨洞)留置型i-PBMTは、現在の技術や外科的処置では実現不可能であり、まだ推測の域を出ない。
謝辞
利益相反の声明 F.S.は、Niraxx Light Therapeutics Inc.の科学諮問委員会およびコンサルタント、ProNeuroLIGHT LLCのコンサルタントを務めている。T.W.は、欧州連合のHorizon 2020研究・革新プログラム、マリー・スクウォドフスカ・キュリー助成契約番号713690、アイルランド科学財団(SFI)および欧州地域開発基金(助成番号13/RC/2073)から支援を受けた。P.C.の給与は、ハーバード大学精神科(Dupont-Warren FellowshipおよびLivingston Award)、Brain and Behavior Research Foundation(NARSAD Young Investigator Award)、Photothera Inc.のunrestricted grantから支援を受けている。TEVA社から薬剤の寄付を受けた。Pharmacia-Upjohnから旅費の払い戻しを受けた。P.C.は、ヤンセン・リサーチ・アンド・ディベロップメント社から相談料を受け取っている。P.C.は、精神医学における近赤外線の使用に関連する仮特許を申請した。フォトメデックス社は、臨床試験用に4台の装置を提供した。P.C.は、1.Litecure Inc.から大うつ病性障害の治療のための経頭蓋光バイオモジュレーションに関する研究を実施するための無制限の資金提供を受け、2.Cerebral Sciencesから全般性不安障害の治療のための経頭蓋光バイオモジュレーションに関する研究を実施するための無制限の資金提供を受け、3.Niraxx Light Therapeutics Inc.の共同創業者、取締役会メンバーおよびコンサルタント、近赤外光に基づく新しい治療法の開発に焦点を当てた会社である。M.R.H.は、米国NIHグラントR01AI050875およびR21AI121700の支援を受けている。M.R.H.は、以下の科学諮問委員会のメンバーである:Transdermal Cap Inc.(米国オハイオ州クリーブランド)、Photothera Inc.(米国カリフォルニア州カールスバッド)、BeWell Global Inc.(香港ワンチャイ)、Hologenix Inc.(米国カリフォルニア州サンタモニカ)、LumiThera、Inc、米国ワシントン州ポールスボ)、Vielight(カナダオンタリオ州トロント)、Bright Photomedicine(ブラジルサンパウロ)、Quantum Dynamics LLC(米国マサチューセッツ州ケンブリッジ)、Global Photon Inc(米国テキサス州ビーケーブ)、Medical Coherence(米国マサチューセッツ州ボストン)、NeuroThera(米国デリー州ニューアーク)、JOOVV Inc、AIRx Medical, Inc., Pleasanton, CA, USA; FIR Industries, Inc., Ramsey, NJ, USA; UVLRx Therapeutics, Oldsmar, FL, USA; Ultralux UV Inc., Lansing, MI, USA; Illumiheal&Petthera, Shoreline, WA, USA; MB Laser Therapy, Houston, TX, USA.M.R.H.は、以下の企業でコンサルタントを務めている:レキシントン社(米国フロリダ州ボカラトン)、ウシオ電機株式会社(日本)、メルクKGaA社(ドイツ、ダルムシュタット)、フィリップスエレクトロニクスネダーランドB.V.、ジョンソン&ジョンソン社(米国フィラデルフィア)、サノフィ・アベンティスドイツ社(ドイツ、フランクフルト)など。M.R.H.は、Global Photon Inc.(米国テキサス州ビーケイブ)およびMitonix(米国デラウェア州ニューアーク)の株主である。J.O.D.はProNeuroLIGHT LLC, Kerrville, TX, USAの有料ビジネスコンサルタントであった。他の著者は、開示すべき利益相反はない。