Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7544731/
Biochem Pharmacol.2021 Jan;183: 114278.
2020年10月9日オンライン公開doi:10.1016/j.bcp.2020.114278
pmcid: pmc7544731
概要
重曹と酢は何世代にもわたって家庭薬として使われてきた。そして今日、重曹、レモン汁、リンゴ酢が癌からCOVID-19まであらゆるものの奇跡の治療法であるという主張をマウスでクリックするだけで理解できるようになったのである。このようなまやかしの主張にもかかわらず、酸塩基平衡の制御の治療的価値は議論の余地がなく、便秘、てんかん、代謝性アシドーシス、消化性潰瘍に対する食品医薬品局承認の治療法の基礎となるものである。
このレビューでは、局所的および全身的な酸塩基平衡の乱れに対処することの現在および将来の治療価値を支持する証拠を提示し、そのうちのいくつかは実際に重曹(重炭酸ナトリウム)の投与を伴うものである。
さらに、酸塩基平衡に対する医薬品の副作用や、酸塩基状態が医薬品の薬物動態学的特性に及ぼす影響についても論じている。また、麻酔科、感染症科、腫瘍科、歯科、外科などの臨床専門分野にも関連する情報を提供している。
キーワード pH、重炭酸、プロトン、乳酸、トランスポーター
1.はじめに
体内のほぼすべての生理過程が正常に機能するかどうかは、適切な酸塩基平衡の維持に依存している。細胞内pHと間質pHの値は、動脈血pHの値に強く依存し、正常な生理的条件下では7.35から7.45の範囲にある。pHが正常範囲から逸脱すると、pH依存性の酵素や膜輸送タンパク質が正常に働かなくなり、代謝経路に悪影響を及ぼす可能性がある。酸血症は、動脈血管拡張、インスリン抵抗性、免疫機能の低下、神経細胞の興奮性低下など、様々な障害を引き起こす可能性があり、動脈のpHが7.35より低くなると定義されている。また、アルカリ性貧血(動脈血度が7.45以上)は、心筋の血流低下や痙攣など、さまざまな障害を引き起こす可能性がある。従って、血中pHの値を厳密に管理することが必要である。
酸塩基平衡異常に対する治療法は新しいものではない。下痢による血清アルカリの喪失を補うためにコレラ患者に炭酸ナトリウム(Na2CO3)を注入した記録が1830年代にあり[1]、制酸剤(Brioschi®)としての炭酸水素ナトリウム(NaHCO3)の商業生産は明らかに1880年代にまでさかのぼることができる。それ以来、数十年にわたる研究の進歩により、健康や病気における酸塩基平衡の重要性が広く認識されるようになった。この研究は、現在、医学の進歩に刺激され、効果的な形で結実しつつある。その一方で、代替医療関係者の中には、逸話や限られた試験結果をもとに、重曹などの家庭用酸や塩基の奇跡的な特性について、どこにでもあるようなクリックベイトの見出しをつけ、場合によっては、こうした情報の隠蔽を陰謀説として宣伝しているところもある。
本総説の最初の主要なセクション(2酸塩基平衡)では、体が酸塩基平衡を達成するために、酸と塩基の存在量と分布をどのように制御しているかについて論じる。強力なCO2/HCO3緩衝システムの重要性、過剰な酸と塩基を排泄する肺と腎臓の重要な機能、膜輸送タンパク質と炭酸脱水酵素が酸と塩基の局所再分配に果たす役割、そしてこれらのプロセスを制御するために利用できる薬物について説明する。第2部(全身性酸塩基平衡異常)では、細胞外のCO2およびHCO3レベルの乱れによって引き起こされる一般的な酸塩基平衡異常の原因と結果、およびその原因に関する知見がどのように治療戦略に反映されているかについて論じている。3番目と4番目の主要なセクション(4臓器系による応用と5臨床専門分野によるその他の応用)では、酸塩基平衡補正療法の現在および将来の有用性を示す試験管内試験、生体内試験、臨床研究からの豊富な情報をまとめている。各臓器系や臨床の専門分野ごとに、正常な酸塩基平衡の基本的な生理学的側面、全身および局所的な酸塩基平衡の乱れがもたらす病的結果、さらに酸塩基平衡の回復(またはその作用の利用)に基づく矯正療法の考察を適宜述べている。最後の第5章(pH依存の薬物療法)では、酸塩基化学が薬物動態学的特性にどのように影響するか、またこの現象が治療介入の最適化にどのように有利に働くかを論じている。
このレビューでは、数多くの基礎科学的知見を臨床治療につなげる過程にある、新興でダイナミックな研究分野に焦点を当てた。これらの知見は、健康のほぼすべての側面に関連しているように思われる。いわゆる「製薬業界の敵」である炭酸ナトリウムを動物モデルや限定的な臨床試験で疾患の兆候を改善することに成功したという多くの報告を含め、酸塩基平衡の制御を中心に開発された幅広い治療パラダイムに注目する。健康と病気における酸塩基平衡の役割の研究は、避妊ジェルや胃酸抑制剤のようなFDA認可の医薬品をいくつか生み出す結果となったが、NaHCO3自体の臨床効果に関する無作為試験の系統的レビューは、その結論において慎重である傾向にある。
読者への注意事項
私たち著者は基礎科学者であり、このレビューが診断や治療のガイドとなることは意図していない。多くの場合、研究方法や被験者の属性に一貫性がないため、結果に関する確固とした結論を導き出すことは困難である。このような理由から、動物モデルや限られた試験で得られた治療効果を、一般的な臨床的有用性の評価に外挿することも不可能である。しかし、可能性を報告する以上、肯定的な結果を差し引いてはいない。最後に、このNarrative Reviewの対象は非常に広く、文献も膨大であることに留意されたい。このため、文書を簡略化し、さらに読み進める手がかりとするために、主要文献の代わりにレビューを引用することが多い。このような理由で、引用が漏れてしまった著者の方々には、あらかじめお詫び述べる。
2.酸塩基の恒常性
2.1.CO2/HCO3-バッファーシステム
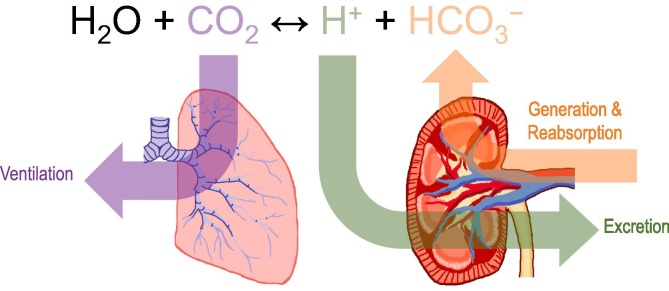
食事と代謝によって引き起こされる約40〜70mEq H+/日の酸負荷(純内生酸産生:NEAP[2],[3])に直面して血液pHを維持するには、強固な恒常性維持機構が必要である。血中pHの調節、ひいては細胞外液組成全体の調節は、(i)血中重炭酸濃度([HCO3-])を制御する尿路系と、(ii)二酸化炭素分圧(pCO2、図1参照)を制御する神経-呼吸器系の相互作用に依存している。腎臓は、HCO3-を生成し、循環に預け、ろ過された血漿からHCO3-を循環に戻すという役割を担っている(図2参照)。肺は二酸化炭素を吐き出し、呼吸駆動は化学物質感受性の神経回路によって制御されている[4]。第三の防御機構は、pHの変化を最小限にする傾向があり、細胞外液のコンパートメントに存在する多数の緩衝系によって提供されるものである。これらの緩衝系の中で最も強力なのは、CO2/HCO3-緩衝系で、その有効性は、身体がCO2に対して開放系として振る舞い、そこからCO2が抜け出ることによってもたらされる[5]。CO2/HCO3-バッファシステムの特徴は、CO2とHCO3の相互変換を表す二段階反応のうち、最初の反応(CO2+H2O⇌H2CO3⇌HCO3-+H+)は、炭酸脱水酵素(CA)により触媒されない限り、非常に遅い反応である。従って、効率的な緩衝作用にはCAの存在が必要である。
図1 全身的な酸塩基の恒常性
身体は開放性のCO2/HCO3-緩衝系として振る舞うため、血液/細胞外pHを狭い生理的範囲に維持することは、尿酸分泌を調節して血液[HCO3-]を制御する腎臓と、換気を調節して血液pCO2を制御する肺の二つの独立した作用に依存している。
図2 腎臓におけるH+とHCO3-の取り扱いの簡略化した模式図
血漿は腎臓の血液から各ネフロンの糸球体でろ過される(パネルA)。近位尿細管(パネルB)および集合管(パネルC)の上皮細胞により酸が濾過液中に分泌され、新しいHCO3-が生成され、循環中の酸により滴定されたものと交換するために、循環中に吸収される。尿細管内腔では、分泌されたH+がNH3やリン酸などの非HCO3-緩衝液で滴定されると、排泄されることがある。分泌されたH+が近位尿細管内腔でろ過されたHCO3-と反応すると(CAIVによって触媒される)、CO2は近位尿細管細胞に入り、H+とHCO3-に再び変換される(CAIIによって)。この場合、H+は排泄されず、HCO3-は再吸収されたとみなされる。ろ過されたHCO3-は事実上尿中に排泄されず、排泄されるH+の量は体の酸負荷によって変化する。NHE3。Na+/H+交換体3、CAIV:炭酸脱水酵素IV、CAII:炭酸脱水酵素II、NBCe1:電気陰性Na+/HCO3-共輸送担体。なお、腎近位尿細管におけるNBCe1の化学量論はまだ確立されていないため[43]、NBCe1が運ぶHCO3-イオンの数を「n」で示した;AE1:Cl-/HCO3-exchanger 1.
Henderson-Hasselbalch方程式[6]は、[HCO3-]とpCO2がどのようにpHを決定するかを記述している。
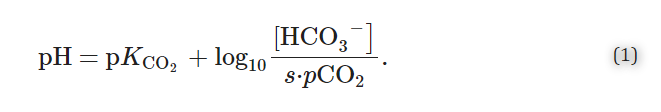
ここでpK CO2=-log10(K CO2)である。である。K CO2はCO2/HCO3-緩衝系の平衡定数でありsはCO2の溶解度係数である。37℃ではpK CO2は6.1でありsは0.03である。式(1)は、pHが[HCO3-]:pCO2の比に依存することを示している。
米国国立衛生研究所によると、[HCO3-]の基準範囲は 22-26mEq/Lであり、pCO2の基準範囲は 35-45mmHgである[7]。しかし、診断、病気に対する感受性、治療に対する反応性に影響を与えうる個人差があることを認識することが重要である。例えば、ある研究では、[HCO3-]の基準範囲は性別や民族によって異なることが示唆されており、(i)男性では上限値も下限値も高く、(ii)白人と比較してアジア人と認識される個人では下限値が高く、(iii)白人と比較して黒人と認識される個人では上上限値が高いと報告されている[8].これらの特定の観察結果の実際の結果を示すデータは現在のところ不足しているが、少数民族の間で酸塩基関連の健康格差があることが明確に示されており[9],[10],[11],[12]、動物モデルの研究では、女性と比較して男性における酸塩基処理の生理的な違いが報告されている[13]。血清[HCO3-]の加齢に伴う変化の報告はあるが、おそらくサブグループの影響により、その相関が正なのか負なのか[14]に関して、驚くほどコンセンサスが得られていない。
細胞外pH(pHe)が細胞内pH(pHi)に影響を与える程度は、細胞が発現する酸排出性または酸負荷性の膜輸送タンパク質の相補性に依存する[15]。一般に、細胞はアシドーシスに対する防御として、これらのタンパク質の配列を発現している。これらのタンパク質の保護的役割は、様々な種類の細胞において、細胞の生存[16],[17],増殖[18],および移動[19]に重要である。これらのタンパク質の作用は、酸や塩基の伝染を可能にすることでpHeの変化に対して細胞を敏感にしたり、pHiを維持するために酸や塩基を除去または放散することでpHeの変化に対する防御を助けることができる。以下、これらのタンパク質の概要を説明する。
2.2.酸塩基平衡のエージェントとその遮断剤
このセクションでは、今回のレビューに関連する酸塩基トランスポーター(ABT)または炭酸脱水酵素の主要なクラスのそれぞれについて、性質、分子作用、臨床的に重要なブロッカーについて簡単に説明する。2.2.1,2.2.2,2.2.3,2.2.4,2.2.5,2.2.6,2.2.7,2.2.8で述べた各クラスのタンパク質の例を図3に示した。また、この原稿で引用しているタンパク質の命名法および略語を定めておく。モデル系でABTを阻害するのに有用な化合物(例えば、陰イオン輸送阻害剤DIDS)の多くは、標的治療用としては十分に特異的でないため、ここでは、特定の用途で食品医薬品局(FDA)から承認されている薬剤、現在臨床試験中の薬剤、あるいは臨床試験に失敗した薬剤で他の環境での再利用が可能な少数の化合物に限定して考察することにする。その他の実験的化合物については、3,4,5で説明している。特定のタンパク質の分布、生理学および病態生理学における役割、治療上の関連性については、3,4,5で後述する。
図3 酸塩基処理タンパク質の様々なクラスの例
パネルAは、「v型」H+-ATPase、細胞膜Ca2+-ATPase(PMCA)、H+/K+-ATPaseを示したものである。この3つのトランスポーターはすべてH+ポンプである。パネルBはNa+/H+交換体NHE1である。パネルCは、H+結合型溶質トランスポーターの一部である。具体的には、H+結合乳酸トランスポーターMCT1とMCT4、H+結合オリゴペプチドトランスポーターPeptT1、興奮性アミノ酸トランスポーターEAAT1が示されている。パネルDは、電位依存性H+チャネルHV1、オトペトリン1(OTOP1)、電位非依存性H+伝導体SLC4A11などのH+チャネルの例である。パネルEは、HCO3-伝染性アニオンチャネルの例として嚢胞性線維症膜貫通制御因子CFTRを示す。パネルFは、電気陰性Na+/3HCO3-共輸送体NBCe1、電気陰性Na+/HCO3-共輸送体NBCn1、電気陰性Na+駆動Cl-/HCO3-交換体NDCBEなどのNa+結合HCO3–輸送体ファミリーのメンバーである。NBCe1は通常、1Na+:2HCO3-の化学量論で酸の押し出し機として働くことに注意。例外は腎近位尿細管で、NBCe1は1Na+:3HCO3-の化学量論と推定される酸ローダーとして動作する[43]。パネルGはCl-/HCO3-交換体AE1である。パネルHはグリコシルフォスファチジルイノシトール(GPI)アンカーを持つ細胞外アイソフォームCAIV、細胞質アイソフォームCAII、膜貫通アイソフォームCAIXなどの炭酸脱水酵素ファミリー(CAs)のメンバーを示している。
2.2.1. H+ポンプ
ヘテロ二量体の「胃」H+/K+-ATPase(ATP4AとATP4Bはその2つのサブユニットをコードする[20])と腎臓に発現する多サブユニットの「v型」H+-ATPase(ATP6V0A4とATP6V1B1はそのサブユニットのうちの2つをコードする[21])は、いずれもATP加水分解エネルギーを使ってH+を押し出している。一方、様々な興奮性細胞に発現している細胞膜Ca2+-ATPase(PMCA、ATP2B1)は、ATPを利用してCa2+を押し出し、酸負荷のCa2+/H+交換活性を媒介する[22]。このグループに関連する最も重要な医薬品のクラスは、プロトンポンプ阻害剤(PPI)である。FDAが承認したエソメプラゾール(NEXIUM®)のようなベンズイミダゾール誘導体は、経口投与すると、胃酸による消化性潰瘍などの病態に対する治療としてH+/K+-ATPaseを標的とする[23](セクション4.7を参照)。
2.2.2. Na+/H+交換体
Na+/H+交換体ファミリー(NHE,SLC9A1-9[24])の9つのメンバーのうち5つがこの総説で言及されている。これらのうち、4つのNHE(NHE1,NHE2,NHE3,NHE8)は細胞膜に発現し、Na+/K+-ATPaseによる内向きのNa+勾配を利用して酸の排出を媒介する。一方、NHE6は、エンドソーム膜に発現している。エンドソーム内部は「v型」H+-ATPaseによって酸性化されているが、NHE6の働きによってH+が押し出され、コンパートメントの過酸化が防がれている[25]。FDA承認のアミロリドのようなピラジノイルグアニジン誘導体は、不完全なNHE特異性を示し、降圧利尿剤としての治療的有用性は、主に腎集合管の上皮性Na+チャネルENaCの遮断によるものである[26]。ベンゾイルグアニジン誘導体の阻害剤カリポライドは、NHE1に対してより高い特異性を示し、心臓保護薬として第III相臨床試験を開始した。しかし、いくつかの肯定的なレトロスペクティブな知見にもかかわらず、血小板におけるNHE1阻害の影響と考えられる血栓塞栓性脳卒中による死亡率の増加により、この薬剤は失敗した[27],[28](セクション4.4参照)。テナパノール(IBSRELA®)は、便秘を伴う過敏性腸症候群の治療薬としてFDAに承認されたNHE3阻害剤である[29](セクション4.8を参照)。
2.2.3. H+結合型溶質トランスポーター
モノカルボン酸トランスポーターファミリー(MCTs,SLC16A1-14[30])の14メンバーのうち4メンバーはH+結合乳酸トランスポーター(MCT1-4)である。MCT1とMCT4は腫瘍に発現しているため、主に治療薬として注目されている。例えば、広く発現しているアイソフォームであるMCT1はH+/Lac-の輸入を仲介し、がん細胞やアストロサイトのような解糖系(すなわち乳酸産生)の細胞に多く発現しているMCT4はH+/Lac-輸出を仲介する[31]。他のいくつかの溶質キャリアファミリーのメンバーも、SLC15ファミリーのH+結合オリゴペプチド輸送体(例えば、PeptT1[32])やSLC1ファミリーのH+結合神経伝達物質輸送体(例えば、興奮性アミノ酸輸送体EAAT1[33])などの基質とH+を共輸送している。MCT1阻害剤であるAZD3965[34]は、現在、癌治療における有効性について第I相臨床試験中である(ClinicalTrials.gov Identifier:).
2.2.4. H+チャンネル
H+を伝導する膜タンパク質はいくつか存在するが、タンパク質配列に明らかな共通性はない。1つのグループはH+選択的チャネルとして働き、電位依存性H+チャネルHV1(HVCN1[35])と電位非依存性H+伝導体SLC4A11[36]とOtopetrin 1(OTOP1[37])が含まれている。いずれも膜貫通型の電気化学的勾配を下るH+の移動を許容するが、ゲーティングの制御がそれぞれ異なる。HV1は勾配がH+の流出に有利なときのみ開き、SLC4A11はH+の流入に有利である(特にpHiが高いとき[38]、おそらくpHiを守るため)、そしてOTOP1もH+の流入を好む(特に低いpHeで、おそらくその感覚的役割と一致する)。酸性条件下では、TRPV1(transient receptor potential cation channel subfamily V member 1)もまた、重要ではあるが非正規の、酸負荷H+コンダクタンスを媒介することができる[39]。TRPV1アゴニストのH+コンダクタンスへの影響は未検証であるが、このクラスのタンパク質を阻害するためのFDAの承認は、私たちは知らない。
2.2.5. HCO3-伝染性アニオンチャネル
HCO3-特異的なイオンチャネルについての記述はないが、いくつかのアニオンチャンネルは重要なHCO3-伝染性を持っている。HCO3の電気化学的勾配は通常HCO3の流出に有利である。これらのチャネルには、cystic fibrosis transmembrane regulator(CFTR[40]),Ca2+-activated Cl–channel Anoctamin 1(ANO1[41]),同様にGABA-およびグリシン活性化Cl–チャネル(GABRおよびGLRファミリー[42])が含まれる。イバカフトール(KALYDECO®、CFTRチャネルの開口確率を増加させる)、またはイバカフトールとCFTRフォールディング・シャペロン薬であるエレキサカフトール/ルマカフトール/テザカフトールの1つ以上を含むカクテル(例:ORKAMBI®、SYMDEKO®、TRIKAFTA®)などの薬剤は、特定の欠損CFTRチャネルを回復させることによって嚢胞性線維症(CF)の治療に適応されている。ivacaftorとtezacaftorは、いずれもΔ508-CFTR変異株のHCO3-伝染性をレスキューしている。実際、救出された変異株は、野生型CFTRよりも大きなHCO3-:Cl-伝染率比を有しており、これは治療上価値があると考えられる。CFTRを介したHCO3-分泌の重要性については、セクション4.3呼吸器系、セクション4.8下部消化器系、セクション4.9泌尿器系で述べている)。
2.2.6. Na+結合型HCO3-トランスポーター
SLC4ファミリーの10個のメンバーのうち5個は、何らかの形でNa+結合HCO3-輸送を媒介する[43]。NBCe1とNBCe2(SLC4A4とSLC4A5)は電気化学的なNa+/2HCO3-共輸送体で、電気化学的な勾配によって、酸排出器または酸負荷器として作用することがある。例えば、NBCe1は腎近位尿細管上皮ではHCO3-を排出し、膵管上皮ではHCO3-を流入させる。残りの3つはすべて酸の押し出し役である。NBCn1(SLC4A7)は電気陰性Na+-HCO3-共輸送体で、NDCBE(SLC4A8)は電気陰性Na+駆動のCl-/HCO3-交換体である。NBCn2/NCBE(SLC4A10)は、両方の作用が可能であることが記述されている。私たちは、このクラスのタンパク質を阻害するためのFDAの承認や、このクラスのタンパク質に特異的な薬剤を知らない。しかし、-非ステロイド性抗炎症薬のテニダップは、腎臓と肝臓の毒性のために関節リウマチの治療のための臨床試験に失敗したが、NBCe1とNBCe2の有効なブロッカーであることに私たちは注目する[44]、[45]。
2.2.7. Cl-/HCO3-交換体
SLC4ファミリーの10種類のタンパク質のうち3種類(AE1,AE2,AE3,SLC4A1-3)は電気陰性Cl-/HCO3-交換を仲介し[43]、アニオン交換タンパク質のSLC26ファミリーの11種類のうち7種類がそうだ[46].後者のうち3つは、このレビューで特に重要なものである。これらは、「腺腫でダウンレギュレートされる」タンパク質DRA(SLC26A3)、ペンドリン(SLC26A4)、そして「膵臓アニオントランスポーター」タンパク質PAT1(SLC26A6)で、これらのタンパク質は、膵臓のアニオン輸送体である。いずれの場合も、一般的な生理的条件下ではHCO3–の流出が有利である。例外はあるものの、一般的にSLC4は上皮細胞の基底側膜を越えて間質液にHCO3-を押し出し、細胞をアルカリ性から保護し、一方SLC26は頂膜を越えてHCO3-の分泌を媒介する。テニダップ(前節で言及)はDRAの遮断薬であるが、このクラスのタンパク質を調節するためのFDAの承認は知らない[47]。
2.2.8. 炭酸脱水酵素
14種類の哺乳類CA(CA1-CA14)には、細胞質型、ミトコンドリア型、膜貫通型、膜結合型、分泌型のアイソフォームがある[48](※1).すべてのCAは、CO2とH2OをHCO3-とH+に変換し、その方向は勾配に依存し、H+のバッファリングを強化し、細胞膜を横切るCO2の拡散を促進する[49]。このレビューに最も関連する5つのCAは、ユビキタスな細胞質アイソフォームCAII,骨格筋細胞質アイソフォームCAIII,グリコシルホスファチジルイノシトール(GPI)-アンカー細胞外アイソフォームCAIV,および2つの膜横断アイソフォームCAIXとCAXIIで、これらのCAは細胞外にも活性があると考えられている。アセタゾラミド(ACZ、DIAMOX®)は、てんかんおよび緑内障の治療(4.1、4.2参照)、ならびに鬱血性心不全または薬剤性浮腫の治療としての利尿の誘導に適応を持つFDA承認の多数のCA阻害薬の一つである[50](セクション4.9参照)。
3.全身性酸塩基平衡障害
3.1.四つの古典的/単純な酸塩基平衡の乱れ
式(1)と図4から、pCO2が一定であれば、(i)細胞外の[HCO3-]が低下すると血液のpHは低下し、(ii)細胞外の[HCO3-]が上昇すると血液のpHは上昇することがわかる。この2つのケースは、それぞれ代謝性アシドーシス(MAc)、代謝性アルカローシス(MAlk)の状態を表している。また、式(1)は、細胞外pCO2の減少(ケース’i’)または細胞外pCO2の増加(ケース’ii’)によって、pHが正常な生理的値へ戻ることを示している。このように[HCO3-]:pCO2比を代償的に正常化してpHを回復させることは、MAcおよびMAlkに対する神経-呼吸器系の生理的反応を説明するものである。さらに、式(1)と図4から、[HCO3-]が一定であれば、③細胞外pCO2が上昇すると血液pHが低下し、④細胞外pCO2が低下すると血液pHが上昇することがわかる。この2つのケースは、それぞれ呼吸性アシドーシス(RAc)、呼吸性アルカローシス(RAlk)の状態を表している。この場合も、式(1)は、細胞外[HCO3-]の増加(ケースiii)または減少(ケースiv)により、pHが正常値に戻ることを示しており、RAcおよびRAlkに対する尿路系の代償性生理反応を説明している。MAc、MAlk、RAc、RAlkは、通常、4つの古典的/単純な酸塩基平衡異常と呼ばれる。
図4 4つの古典的な全身性の酸塩基平衡障害
[HCO3-]とpCO2の変化は、ともにpHの異常を引き起こす可能性がある。代謝性のpH異常は、[HCO3-]:pCO2比を正常化するために換気量を変えることによって補正することができる。呼吸器系のpH異常は、腎臓からの酸の排泄速度を変えることで補正することができる。
呼吸器系の代償は通常、代謝異常の出現から1時間以内と極めて急速に起こり、12〜36時間以内に完全に解消される。一方、呼吸器系障害に対する代謝反応は、泌尿器系の酸塩基処理機構のリモデリングを必要とするため、よりゆっくりと起こり、完全に解決するのに数日かかることもある。酸塩基平衡異常に対する最も迅速な反応、つまり私たちの体の最初の防御ラインは、化学的緩衝作用であり、これは通常数分以内に起こる。
以下の4つのサブセクションで、4つの全身性酸塩基平衡異常の原因、結果、治療パラダイムについて概説する。これらの考察のいくつかは、局所的な酸塩基平衡異常の解決にも関連しており、4と5で再確認する。これらの障害を単独で、あるいは組み合わせて、より完全で臨床的な展望を得るには、参考文献[51]を参照されたい。
3.2.代謝性アシドーシス
3.2.1. 原因と結果
MAcは、呼吸性アルカローシスに応答した[HCO3-]の生理的、代償的低下ではなく、[HCO3-]の一次病的欠損による酸血症と定義されている[52]-。身体は血漿pHの酸性シフトに対して、短期的にはCO2を低下させる呼吸駆動を増加させ、長期的には腎臓のH+排泄/HCO3-生成を増加させることによって対抗することができる。しかし、これらの代償系に欠陥があったり、圧倒されたりすると、MAcが生じる。例えば、MAcは食事、慢性腎臓病、糖尿病(糖尿病性ケトアシドーシス)に起因し、急性心筋梗塞(乳酸アシドーシス)、腎酸塩基トランスポーターの変異(腎尿細管アシドーシス、セクション4.9参照)、化合物の中毒(例えば、アスピリン)、下痢(HCO3-が多い分泌物の喪失)にも続く場合がある[53],[54],[55],[56],[57].臨床症状は、基礎となる原因によって異なるが、一般に脱力感、吐き気、皮膚の紅潮などがある[58]。これから見るように、慢性的なMAcは長期的な健康に深刻な影響を及ぼす。
3.2.2. 治療パラダイム
MAcが糖尿病や下痢のような他の障害に続発する場合、根本的な障害の治療が最終目標である。しかし、MAcを短期間で改善したい場合、あるいは酸塩基の恒常性維持機構に主な欠陥がある場合には、血漿pHを正常化することによってMAcに対処する「アルカリ療法」が典型的な治療方針である。これは、2つのメカニズムによって達成される。
3.2.2.1. ベースロードの増加
最も単純なパラダイムはHCO3-塩の投与である。血漿[HCO3-]の直接的な上昇は静脈内または腹膜透析によって達成される。胃の壁細胞が中和された胃酸と入れ替わるときに、新しいHCO3-を生成し、それが循環に吸収される[59](図9も参照してほしい)。しかし、HCO3-の投与にはいくつかの注意点がある[60]。1つの注意点は対アニオン(通常Na+またはK+)が体液貯留またはK+不均衡の原因となる可能性があることである。2つ目の注意点は、この治療法は急速にCO2を発生させる可能性があることである。経口投与の場合、これは腹部膨満感や胃破裂として現れることがある。一方、静脈内投与の場合、CO2は肺で効果的に除去されないと、細胞に入り込み、逆説的に細胞内を酸性化させることがある。第三の注意点は、投与量が十分に秤量されていない場合、pHオーバーシュート(すなわち、それ自身のpH障害を引き起こす過剰補償)が起こりうるということである。しかしながら、実際にはNaHCO3投与に関連する副作用の発現は予断を許さない[61],[62]。Na2CO3やCaCO3のようなアルカリを静脈内投与するための代替手段は、中和されたH+あたりのCO2生成量が少なく、浸透圧ストレスが少ない[63]。CarbicarbはNaHCO3とNa2CO3の混合物で、細胞内酸性化を引き起こさない[64],[65].クエン酸塩は肝臓でクエン酸がHCO3に変換されるため、より穏やかで間接的なHCO3上昇の手段を提供する。THAM(トリスヒドロキシメチルアミノメタン、別名トリス塩基、別名トロメタミン、別名トロメタモール)のような代替緩衝剤はCO2を生成せずにH+を結合し、プロトン化した生成物は腎臓で容易に除去される[66]。さらに、THAMの一定割合は生理的pHで非帯電であるため、細胞伝染性があり、細胞内アシドーシスに対抗することができる。他のHCO3–置換塩基には、乳酸塩および酢酸塩が含まれる[67],[68]。最後に、潜在的な副作用は、緩衝剤の静脈内カクテルの一部として低用量の緩衝剤を投与することによって改善することができる。例えば、トライボナットは、NaHCO3、Na2HPO4、および酢酸ナトリウムを含む混合物である[60]、[67]。この混合液には、リン酸塩が含まれているため、MAcに関連する低リン酸血症に対抗できるという利点もある。
図9 胃酸逆流症を治療するための胃のH+/K+/-ATPaseを標的とした治療法
プロトンポンプ阻害剤は、CaCO3などの制酸剤で胃酸を中和する代わりに、胃酸分泌を抑制する目的で広く使用されている。AE2: Cl-/HCO3-交換体2。
3.2.2.2. 酸負荷の低減
食餌性酸負荷は血清HCO3の低下と関連しており[2],[69],[70]、したがって、例えば、超低蛋白[71]またはその他の「アルカリ性」食を遵守することにより、MACの食餌性補正が可能である[72]。チアジド系利尿薬であるヒドロクロロチアジドは、腎集合管からのH+分泌を増加させ、MAcに対するNaHCO3との補助療法として使用されている[73]。利尿剤としてのその役割は、NaHCO3治療に伴うNa+負荷の排泄を補助することでもある。ベリマーは、経口投与されるH+結合ポリマーであり、慢性腎臓病の文脈におけるMACの治療のために、執筆時点で第III相臨床試験が行われている(ClinicalTrials.gov Identifier:).胃内でH+を結合し、最終的に便中に排泄される[59],[74],[75]。さらに、ベベルイマーによる胃のpHの上昇は、頭頂細胞にHCO3-を循環に沈着させ、摂食に伴うアルカリ性の潮流を模倣するよう促す。MAcに対抗するもう一つのアプローチは、ピルビン酸投与またはジクロロ酢酸(DCA)を用いたピルビン酸脱水素酵素の刺激による代謝的手段によって、細胞のH+消費を増加(および/または乳酸生成を減少)することである[76],[77].
3.3.代謝性アルカローシス
3.3.1. 原因と結果
MAlkは、一次的なHCO3-の過剰によって引き起こされるアルカリ血症と定義されている。MAlkは、体積減少または高アルドステロン症(腎のH+分泌を促進)、嘔吐(胃酸を排出し、アルカリ性の潮流を刺激)、またはこれらの反応を模倣する特定の医薬品(ループ利尿薬、制酸剤)の使用に続いて起こることがある。臨床症状には、錯乱およびテタニーが含まれることがある[58]。MAlkはまた、遺伝的な原因を持つこともある。例えば、リドル症候群は、上皮性Na+チャネルENaCの過活動と関連しており、その作用により腎臓のH+分泌が促進される[78]。
3.3.2. 治療パラダイム
基礎疾患の治療以外に、CA阻害剤ACZ(それ自体がMAcをもたらす)[79]、HClの静脈内注入[80]、または(MAlkが胃酸の喪失に続く場合)アルカリ潮を防ぐためのH2受容体作動薬の使用[81]により、MAlkの修正が達成されている(4.7.2項を参照)。
3.4.呼吸性アシドーシス
3.4.1. 原因と結果
RAcは、安静時および海面下での血漿中pCO2が45mmHgを超える酸血症と定義されている[82]。これは通常、CO2除去速度とCO2生成速度との間のミスマッチを引き起こす換気システムの崩壊があり、その結果、血液中にCO2が蓄積する(すなわちCO2貯留)場合に発生する。この障害は、(i)代謝的に生成されたCO2を除去する肺の機能不全(すなわち換気の低下)、(ii)組織から肺へのCO2輸送の欠陥、および/または(iii)CO2の過剰生産によって引き起こされる可能性がある。換気の減少は、呼吸中枢の抑制(例えば、鎮静剤の過剰投与または脳損傷による)、気道閉塞(例えば、吐物の吸引または喉頭痙攣による)、神経筋障害(例えば、ギランバレー症候群による)または胸部の拘束性欠損(例えば、横隔膜の機能低下による)[83]から生じる可能性がある。過炭酸につながるCO2輸送の欠陥はあまり一般的ではなく、通常は、例えば、心停止または肺塞栓症に反応して肺灌流が低下した結果である。CO2の過剰産生がRAcの唯一の原因であることはまれである。実際、通常の状況下では、身体は過剰なCO2を除去し、過炭酸を防ぐために換気を適切に増加させることによって、CO2産生の増加に対応する。肺がCO2産生の増加に対応できない状況は、機械的換気を行っている患者や呼吸予備能が低下している患者で起こりうる[82]。実際、治療上の理由から、人工呼吸中の患者はしばしば意図的に「寛容な過炭酸」の状態に維持される(セクション5.2参照)。代謝障害に関しては、RAcは急性または慢性のいずれにもなりうる。急性RAcはpCO2が非常に急速に上昇し、腎臓がHCO3産生を十分に増加させることができず、短時間で補うことができない場合に起こる。したがって、腎臓による補償はごくわずかなものにとどまる。一方、慢性的なRAc(慢性閉塞性肺疾患、COPDなど)の長い時間では、腎臓は酸排泄とHCO3-産生の増加により酸塩基平衡を回復することができる[84]。
3.4.2. 治療パラダイム
治療は通常、根本的な原因を取り除くことと、適切な肺胞換気を回復することに向けられるが、これは機械換気または陽圧換気を伴う気管内挿管によって達成できる[85]。室温で呼吸している患者の肺胞ガスでは、pCO2とpO2の合計は一定でなければならないため、過炭酸は低酸素血症につながり、この状態は過炭酸による結果よりもはるかに危険である[83]。したがって、急性期RAcの管理は、しばしば十分な酸素供給を確保することにも向けられる。O2投与は、特にCOPD患者では、CO2貯留を増加させる可能性があるため、慎重に行わなければならない[82]。慢性腎臓病における高炭酸ガス血症の補正は、通常ゆっくりと行われる。これは、pCO2の急激な減少が、[HCO3-]を増加させる腎補償により、オーバーシュート・アルカローシスにつながる可能性があるからだ。中枢神経系(CNS)では、脳脊髄液(CSF)の急激なアルカリ化により、痙攣や昏睡を引き起こすことさえある[82]。
RAcにおけるアルカリ療法の使用は議論の余地があり、急性高炭酸ガス症とMAcを併発している患者にのみ適応される[86]。NaHCO3の投与は、CO2産生を増加させ、肺胞換気を低下させ、さらにCNSに逆説的アシドーシスを引き起こす可能性があるため禁忌とされる。MAcについて述べたように、RAcのpHを補正するには、NaHCO3単独よりもCO2を多く発生させないCarbicarbのようなアルカリ変法(セクション3.2.2参照)が望ましいと思われる。COPD患者では、CA阻害剤ACZが、酸素化を改善し、CO2貯留を減少させ、おそらく人工呼吸の必要性をなくすために、呼吸を刺激するために使用されることがある[87]。しかし、CAはどこにでも存在するため、ACZの阻害作用は様々な組織に影響を与え、肺疾患患者に悪影響を及ぼす可能性がある。このため、呼吸刺激剤としてのACZの役割は、特に、高炭酸状態を伴うか伴わない重度のCOPD患者において、議論の余地がある[87]。最後に、CO2は、体外式CO2除去(ECCO2R)装置を使用して血液から脱ガスするか[88]、低い[HCO3-]を有する透析液を使用して透析により低下させることができる[89]。
3.5.呼吸器アルカローシス
3.5.1. 原因と結果
RAlkとは、安静時および海面下での血漿中pCO2が35mmHg未満のアルカリ性貧血を指す[82]。換気システムが適切に働かず、肺胞換気の増加および/またはCO2産生の減少が起こり、その結果、血中のCO2が枯渇した場合に発生する。過換気は、呼吸中枢の刺激(例えば、薬物またはCNSの障害による)、低酸素血症または組織の低酸素(例えば、高地による)、または肺疾患(例えば、肺炎)から生じることがある。CO2産生の低下は、基礎代謝量の低下(低体温症など)や身体活動(筋麻痺など)の結果として生じることがある。臨床症状には、呼吸の速さやめまいが含まれることがある[58]。通常、生命を脅かすものではないと考えられているが、重度のRAlkは、脳、肺、心臓に深刻な影響を与える可能性がある。最後に、閉経後の女性を対象とした研究で、ホルモン補充療法がRAlkを引き起こした[90]。
3.5.2. 治療パラダイム
治療は、通常、基礎疾患を改善することに向けられる。脳や肺の再灌流障害を引き起こす危険性があるため、重度のRAlkを急激に改善することは避けるべきであろう。ACZは、尿中のHCO3排泄を促進し、pHを代償的に低下させるため、高所での過呼吸(急性高山病:AMS)に伴うRAlkの予防と治療に使用されている[91]。
4.臓器別アプリケーション
4.1.中枢神経系
4.1.1. 酸塩基平衡の重要性
神経細胞の活動は、局所的な酸塩基平衡に対して大きな挑戦となる。神経伝達物質で満たされた小胞はH+をシナプス間隙に放出し[92]、[93](H+それ自体が神経伝達物質とみなされることもある[94])、興奮性アミノ酸トランスポーターEAAT1などのH+結合神経伝達物質トランスポーターによってシナプス間隙から除去される。神経細胞およびアストロサイトのGABA活性化陰イオンチャンネルは HCO3を放出し[95],[96]、神経細胞の-PMCA-のCa2+/H+交換活性は、活動電位の後に細胞内Ca2+を回復する際に細胞外pHの上昇を引き起こす[97]。神経細胞の集中的な発火による酸負荷は、pHiの低下をもたらし、神経細胞の活動を抑制する。これは、ASIC1a(Acid-sensing ion channel 1a)およびNMDA(N-methyl-D-aspartate)受容体などのpH感受性チャネルへの効果により過剰な発火を防ぐメカニズムである[98],[99],[100].逆に、アルカローシスは、神経細胞の活動の増加と発作に関連している[101]。神経細胞やアストロサイトはpHの恒常性を維持するために多数のABTやCAを発現しており、その破壊の影響によりその重要性が強調されている[102]。例えば、AE3やNBCn2の遺伝子破壊はてんかんと関連しているが[103],[104],そのメカニズムは、AE3が酸ローダー,NBCn2が酸エクストルーダーであり、神経細胞のpHiが興奮性に影響を与えることと単純には関係なく、それらの欠損の結果は、当該神経細胞が興奮性か抑制性かに依存すると思われる。いくつかのABTやCAは脈絡叢上皮に発現し、その作用により髄液の分泌を支えている。げっ歯類におけるこれらのトランスポーター(例えば、NBCn2、NBCe2)の遺伝的切除は、脳室液量の減少に関連しており[105]、一方、CAの薬理的阻害は頭蓋内圧の減少をもたらす[106]。しかし、これらの変化が髄液のpHの低下を伴うかどうかは不明である。
pHを決定する役割の他に、HCO3-は神経細胞の可塑性に重要な役割を果たす。なぜなら、Cl-とHCO3-の膜貫通勾配がGABA活性化チャネルの反転電位を決定し、結果としてGABA作動性シグナルが脱分極で興奮性か過分極で抑制性かを決めるからだ[107].これらの勾配の変化は、2つの点で重要である。第一に、中枢神経系の成熟に伴う勾配の発達的変化は、抑制性GABAシグナルへの切り替えを促進する[108]。第二に、活動依存的な勾配の変化は、興奮性GABAシグナルへの病的な切り替えを促進することによって、てんかんの病態生理に寄与している[107]。AE3やNDCBEなどの神経性Cl-HCO3-交換体は、これらの勾配の状態に寄与していると思われる[109]。最後に、エンドソームのNHE6の変異は知的障害を引き起こし、シナプスのリモデリングの欠陥と関連している[110]。
アシドーシスは、他にも多くの結果をもたらす。例えば脳卒中では、乳酸アシドーシスは虚血性障害と関連している[111]。タンパク質凝集性の神経変性疾患では、酸性pHがアルツハイマー病のアミロイドタンパク質の凝集を促進する[112]。アルツハイマー病の主要な遺伝的危険因子は、NHE6のエピジェネティックなダウンレギュレーションを引き起こすアポリポプロテインEの対立遺伝子変異ApoE4の発生である[113]。エンドソームからNHE6が失われると、異常な酸性化が起こり、アミロイド沈着物のクリアランスに欠陥が生じる[113]。脳の酸塩基状態は、精神衛生にも影響を及ぼす(セクション5.1精神衛生を参照)。網膜におけるpHの役割については、後のセクションで検討する(セクション4.2「感覚器」を参照)。
4.1.2. 酸塩基平衡の治療的関連性
pHと神経細胞の興奮性の間のリンクは、過呼吸性アシドーシスを誘発するための5%CO2吸入の抗痙攣値で利用されている[114]。過炭酸はまた、カスパーゼおよび他の細胞毒性活性を阻害することにより、脳卒中において神経保護的な役割を果たし[115]、再灌流中にも[116]、そのような役割を果たす。CA阻害剤は、てんかんの補助療法として使用されており[117]、神経因性疼痛[118]、アルツハイマー病[119]、認知障害の治療への応用も期待されている[120]。しかし、MAcは全身性CA阻害の副作用である[121]。ABT-nullマウスのいくつかの系統における痙攣閾値の低下は、ABTが抗痙攣治療のターゲットになりうることを示唆している。しかし、少なくともNBCn2-nullマウスの場合、発作閾値の低下は神経細胞の興奮性の低下を意味しないという観察から、注意が必要であることが示された[122]。CSF分泌におけるABTとCAの役割は、特発性頭蓋内圧亢進症(IIH)において頭蓋内圧を下げるために、これらのタンパク質をターゲットにする可能性を示唆している。IIH患者に対するCA阻害剤の使用は、症状の緩和をもたらすが、その作用機序は不明である[123]。
神経変性疾患の治療法に関しては、ヒストン脱アセチル化酵素阻害剤が、NHE6をエピジェネティックな拘束から解放し、ApoE4マウスのアミロイド蛋白質処理を回復させる可能性を示している[113]。アルツハイマー病におけるアミロイド沈着を逆転させる可能性が提案されているもう一つの戦略は、脳のpHを上げることである[112]。
末梢神経系をターゲットにした治療法については、次のセクションで説明する。
4.2.感覚器系
4.2.1. 酸塩基平衡の重要性
4.2.1.1. 視力
ほとんどの眼球組織は、体液とpHのバランスを維持する目的で、1つ以上のABTまたはCAを発現している。おそらく最も治療しやすい組織は毛様体であり、CAIIと様々なABTを用い、HCO3-を含む房水を前房に分泌する[124],[125](図 5)。この液体は、代謝廃棄物を洗い流すために角膜間質に漏れ、NBCe1、MCT1、およびH+チャネルSLC4A11を含む同様のABTsを発現する角膜内皮細胞によって前室に戻される[126],[127]。最後に、体液は海綿状網膜を経由して前房から排出される。NBCe1に変異を持つ個体は、角膜、水晶体、その他の場所での液体/pH不均衡に関連したバンド角膜症、緑内障、白内障、角膜浮腫を持つ[128]。SLC4A11に変異がある個体も角膜浮腫を示す[146]。ABTsとHCO3-は、NBCn1変異と進行性杆体-円錐ジストロフィーとの間のリンク[132]、またはNBCe2とMCTsの発現不全マウスにおける網膜変性によって示唆されるように、網膜機能にも重要である[129],[130],[131].
図5 炭酸脱水酵素をターゲットにした緑内障の治療法
緑内障は、眼圧の上昇によって引き起こされる網膜変性症である。アセタゾラミド(ACZ)などのCA阻害剤を含む点眼薬は、毛様体内のCAを標的として、房水の産生を抑え、眼圧を低下させる。毛様体は、ギャップジャンクションで結合された2つの細胞層からなる複雑な上皮組織である。間質液から前眼房に、水に続いてNaClを移動させるために、様々なABTやその他のトランスポーターが必要である。NHE1:Na+/H+交換体1、AE2:Cl-/HCO3-交換体2、CAII:炭酸脱水酵素II、CAIV:炭酸脱水酵素IV、NBCe1:電気陰性Na+/HCO3-共トランスポーター。
4.2.1.2. 聴力と平衡感覚
難聴は、pendrin(Pendred症候群[135])、H+/K+-ATPase(遠位尿細管アシドーシス[136])、SLC4A11(Harboyan症候群[137])などのABTの欠陥に関連したいくつかの全身性疾患の症状である。これらのABTはすべて内耳で発現しており、内耳液のpHと内耳電位の維持に役立っている[138]。ヒトとの相関はまだ報告されていないが、進行性の難聴はNBCn2-nullマウスの特徴でもある[139]。H+チャネルOTOP1と陰イオン交換体pendrinを破壊したマウスでは、平衡感覚維持に不可欠なCaCO3結晶(耳小骨)の奇形が見られる[140],[141]。
4.2.1.3. 味覚
内耳での役割に加え、OTOP1は酸味の感覚にも必要である[37]。
4.2.1.4. 痛覚
一般に、注射剤のpHは、注射部位の痛みを避けるために生理的pHに近づけることが推奨されているが、ある種の緩衝剤を含むと痛みが増すことがある(そのため、アダリムバブ、別名ヒュミラの新しいクエン酸フリー製剤)[142]。低pHeは、侵害受容ニューロンにおけるTRPV1チャネルの活性化に対する効果により、疼痛感覚を悪化させる。さらに、酸性条件下でのこれらのチャネルの活性化は、TRPV1を介したH+コンダクタンスによって部分的に媒介される神経細胞のpHiの低下と関連している[39]。クリスチャンソン症候群の子供の痛覚の喪失は、NHE6の喪失と関連している[143]。
4.2.2. 酸塩基平衡の治療的関連性
4.2.2.1. 視力
CA阻害剤を点眼することで、房水の産生を抑えることができるため、緑内障の治療に長い間用いられてきたが、その局所的な眼科的使用でさえ、一部の傾向のある人では、全身性MACの副作用を引き起こすことが報告されている[144],[145]。変異したミスフォールドSLC4A11の発現に起因する角膜浮腫は、低分子のフォールディングシャペロンによって修正することが可能である可能性がある[146]。NHE1ブロッカーは、糖尿病性白内障形成と網膜症のラットモデルにおいて細胞保護的である[147]。過呼吸は、中枢神経系の他の場所と同様に、網膜の虚血再灌流障害に対して保護的である[148](セクション4.1参照)。
4.2.2.2. 聴力と平衡感覚
NaHCO3溶液は、硬くなった耳垢を軟らかくして分散させるのに有用である[149]。しかしながら、私たちは、内リンパまたはオストコーニアの正しい生成に必要な酸塩基平衡を回復することを特に目標とした治療法について知らない。関連した話題として、酸塩基平衡に関係する点耳薬の副作用がある。外耳道感染症の治療に用いられるいくつかの点耳薬に含まれる酢酸は、酢酸が丸窓を越えて内耳に移動し、内リンパおよびペリリンパのpHだけでなく、(おそらくNa+/K+-ATPaseの酸阻害によって)内耳電位を低下させるため、耳毒性を示す場合がある[150].
4.2.2.3. 味覚
私たちは、この分野におけるOTOP1調節の有用性を示す実証を知らないが、苦味感覚を媒介するタンパク質の阻害剤が苦味のマスク着用に用いられており、OTOP1阻害剤が酸味のマスク着用や酸味のある薬物の嗜好性の向上に有用である可能性を示唆している[151],[152]。
4.2.2.4. 痛覚
アジュバントであるNaHCO3はリドカイン注射液のpHを上昇させ、ある研究ではリドカイン注射に伴う痛みの知覚を低下させたが、効果のメカニズムは不明である[153]。5.2節(麻酔学)も参照のこと。
4.3.呼吸器系
4.3.1. 酸塩基平衡の重要性
RAc[4]とボーア効果(セクション4.4「循環系」参照)に反応してCO2を吐き出す呼吸駆動が増加することに加え、pHと呼吸の間の最も注目すべき関連性は、CFTRの役割に関連するものである。CFTRの欠陥は、通常、このチャネルが仲介するCl-とHCO3-の分泌が、体内の水分分泌を促進するメカニズムの基本部分であるため、破壊的なものである[154](図6)。CFに関連する死亡の大部分は、呼吸不全が原因である[155]。肺では、液体分泌は、ガス交換のために湿った表面を提供し、粘液を液化し、吸い込んだ粒子と病原体を喉に向かって洗い流すために必要である(mucociliary clearance)。陰イオン分泌の一般的な重要性に加えて、CFTRを介したHCO3-分泌は、気道表面液(ASL)のpHホメオスタシスにおいてさらなる役割を果たす;HCO3-は粘液の展開と水和に役立ち[156]、気道pHを守ることによって、気道細菌に対する健全な局所免疫応答を促進すると仮定されてきた[157]、[158]。HCO3-分泌は、上皮のH+分泌によって調節され、これは多くの酸排出トランスポーターによって媒介される[159](図 6)。気道の酸性化は、喘息や結核の患者と同様にCF患者の特徴であり[160]、気道病原体や気道上皮による乳酸生成により悪化する[161]。
図6 肺の体液分泌を促進する
嚢胞性線維症の膜貫通型調節因子CFTRは、気道表面へのHCO3-含有液の移動を促進し、粘膜繊毛運動と肺の健康を促進する。ルマカフトール/アイバカフトールなどの薬剤は、ミスフォールドしたCFTR分子を正常に機能させることにより、一部の嚢胞性線維症(CF)患者においてこの機能を回復させることができる。pHに基づく代替戦略は、多くのH+分泌酸塩基輸送体の遮断など、CFの補助的治療法として提案されている。Hv1:電位依存性H+チャネル;MCT2:モカルボン酸トランスポーター2;CAII:炭酸脱水酵素II.
4.3.2. 酸塩基平衡の治療的関連性
新しい個別化CF治療法は、体液分泌を回復するために欠陥CFTRの刺激に焦点を当てているが[162](例:lumacaftor/ivacaftor、セクション2.2.7参照)、特定のCF遺伝子型を持つ個人を対象としており、代替一般治療法がまだ必要である。ASL pHの補正に焦点を当てた戦略には、NaHCO3[163]、[164]、THAM[165]などのネブライザーによる吸入や、H+/K+-ATPase阻害剤による気道H+分泌の阻害などがある[166].これらの戦略はすべてASL pHの改善につながり、いくつかは粘液粘度および/または病原体クリアランスも改善する。In vitroの研究では、MCT2阻害は、上皮のH+分泌を減少させることにより、CF患者のASL pHを保護する可能性もあることが示唆されている[161]。CFの気道上皮によるHCO3-分泌のための新しく記述された副細胞経路もまた、治療的調節が可能であるかもしれない[167]。
4.4.循環器系
4.4.1. 酸塩基平衡の重要性
4.4.1.1. 心臓
MAcは心筋収縮力の低下と関連している。この現象は、心筋細胞におけるCa2+の取り扱いを制御するチャネルやトランスポーターのpH依存性や、Ca2+に対する収縮装置の反応性に対するアシドーシスの減衰効果など、多様なメカニズム的要素によって説明される[168]。アシドーシスによって心拍数が低下するかどうかは、アシドーシスが交感神経副腎系に及ぼす複雑な影響のため、予測することは困難である[169].虚血後の心筋梗塞における細胞内アシドーシスは、再灌流中にNBCやNHEのような酸排出物質の作用によって打ち消される[170].しかしながら、付随するNa+負荷は3Na+/2Ca2+交換体の作用を逆転させるのに十分であり、[Ca2+]iを上昇させて心室性不整脈への感受性を高める[171],[172].逆説的ではあるが、NBCe1機能の喪失は、NBCn1およびNHE1によって媒介される代償的な酸放出がHCO3-当量あたり2倍のNa+負荷を課すため、Ca2+過剰負荷にもなり得る;自発性高血圧ラットにおける心筋細胞の肥大を促進するメカニズムとして提案されている[173].CA活性もまた肥大促進的である[174].一方、酸負荷陰イオン交換体AE3の作用は、肥大に対して保護的であると考えられている[175]。最後に、ミトコンドリアにおけるNHE1の作用は、病気の心臓におけるミトコンドリアの損傷に寄与することが提案されている[176]。
4.4.1.2. 血管系
一般的に、アシドーシスは動脈血管を拡張させ、末梢抵抗を低下させるが、静脈は収縮することがある[169].したがって、多くの血圧の形質がABT遺伝子の多型と関連していることは、おそらく驚くことではない[177]。少なくとも動脈の血管反応のレベルでは、NBCとNHEは正常な血管平滑筋の収縮力と血管拡張剤に対する感受性に必要である[177]。しかし、血圧は血管反応だけでは決まらない複雑な形質であり、これらの連関の説明は単純ではない。もう一つの重要な点は、MAcが血管の石灰化の進行を抑制することである[178]。
4.4.1.3. 赤血球
ボーア効果とは、pHとpCO2がヘモグロビンの酸素運搬能力に及ぼす影響について述べたものである。全身の毛細血管において、代謝によって生じたCO2は赤血球に入り、CAIIの作用によってHCO3-とH+に加水分解される。そして、新たに生成されたHCO3-はAE1によって押し出され、赤血球のpHiの低下を引き起こし、ボーア効果を説明しながら、Hb-O2結合親和力を低下させてHbから組織へのO2放出を促す(図7A).肺毛細血管では、逆のプロセスが起こる。ここでは、CO2が排出されると赤血球のpHiが上昇し、それによってHbへのO2結合が促進される(図7B)。このように、アシドーシスは組織へのO2供給を促進するが、肺でのO2負荷を減少させる[169]。pHとガス交換の間のこの関係は、赤血球中のヘモグロビン調節分子である2,3-DPG(ジホスホグリセリン酸)の含有量によって一部感応され、それ自体がpH依存性のパラメーターである;慢性アシドーシスによって2,3-DPGレベルはO2放出を促進して増加する[179].
図7 ボーア効果
Cl-/HCO3-交換体AE1と細胞質炭酸脱水酵素II(CAII)の作用は、ヘモグロビンのO2に対する親和力のpH依存性(ボーア効果)により、全身毛細血管のO2放出(パネルA)と肺毛細血管のCO2放出を促進する。
4.4.2. 酸塩基平衡の治療的関連性
4.4.2.1. 心臓
マウス心筋細胞における骨格筋CAIIIの外因性発現はpHiの防御を増強し、MAc中の心機能を維持する[180]。NaHCO3は、心停止時および長時間の心肺蘇生中の乳酸アシドーシスに対抗するために用いられるが、既存のMACまたは高カリウム血症(アシドーシスは細胞のK+放出を促進する)を正常化する価値を除けば、この治療により予後が改善するという有力なデータはない[181],[182],[183].NHE1遮断薬は、再灌流傷害における心臓保護剤として有望であり[184]、おそらく細胞膜とミトコンドリアのNHE1の両方を標的にして作用する[185],[186]。NHE1遮断薬カリポライドは、臨床試験で重篤な副作用を引き起こしたが(セクション2.2.2参照)、代替アプローチが利用可能である。例えば、NHE1発現を低下させるマイクロRNAは、長時間の小胞体ストレス時のアポトーシスから心筋細胞を保護する[187]。さらに、NBCをブロックする抗体や薬剤も、虚血再灌流傷害の動物モデルにおいて心臓保護特性を実証している[188],[189].酸排出因子の遮断が心臓保護的であるのと同様に、酸負荷因子AE3の刺激もまた心臓保護的である。これは、伝統的な漢方薬として使用されている生薬から抽出した配糖体のサザンカサポニン[190]を用いて、細胞モデルで達成されている。
4.4.2.2. 血管系
私たちは、血管系を直接標的とした酸塩基に基づく血圧治療法の報告を知らないが、うっ血性心不全における血圧低下のための利尿薬に関する議論は、セクション4.9「泌尿器系」に記載されている。アルカリを含む治療法の中には、血管の石灰化の進行を促進するものがあり[191]、一方、CAブロッカーACZの使用は、おそらくpHの低下により、石灰化疾患において治療価値がある[178],[192]。
4.4.2.3. 赤血球
ある研究では、うっ血性心不全におけるNaHCO3の使用に注意を促している。なぜなら、適応的に上昇した2,3-DPGレベルに直面して、pHが急激に上昇すると、Hb-O2親和力の不適応な上昇と心筋虚血のリスクを招く可能性があるからだ[193]。
4.5.筋肉系
4.5.1. 酸塩基平衡の重要性
骨格筋において、激しい運動中の乳酸の蓄積は、筋力低下や自己限定的な疲労と相関している。しかし、これらの症状に対する乳酸アシドーシスの寄与は、かつて考えられていたほど直接的でも主要でもないかもしれない[194],[195]。全身性アシドーシスは、神経筋駆動の変化[196]および/または乳酸排出の駆動力低下[197]を介して筋力低下に寄与している可能性がある。いずれにせよ、アシドーシスは筋タンパク質の分解を促進する[198]。推定される食事性酸負荷が高いことは、日本の高齢女性における虚弱と関連している[199]。乳酸アシドーシスからの回復は、MCTs、NBCs、NHEsによって媒介され[200]、一方CAIIIは特に筋疲労からの防御に役割を果たすことが示されている[201]。
4.5.2. 酸塩基平衡の治療的関連性
多くの研究が運動パフォーマンスを向上させるためにNaHCO3が有用であることを示唆している。例えば、NaHCO3溶液の経口摂取によるMAlkの誘導は、限られた試験において、運動持久力の向上[202]と努力の知覚の低減[203]を示すことが示されている。しかしながら、この分野のより広い視野に立つと、pHと運動パフォーマンスを関連付ける試験の結果は、一貫性のない方法論とサブグループ効果により、結論が出ていないと考えられる[204],[205]。また、競技の観点からNaHCO3投与によって得られる競技上の利益は、膨満感などの胃腸の副作用によって相殺される可能性があることも示唆されている[206]。競技場から離れると、HCO3-投与または食事による酸負荷の軽減は、高齢者の筋肉量を維持する上で価値がある可能性がある[207]、[208]。
4.6.骨格系
4.6.1. 酸塩基平衡の重要性
食事性酸による脱灰を受ける歯のエナメル質の場合に明らかなように、ミネラル化した材料は酸によって侵食される(セクション5.4口腔衛生を参照)。しかし、アシドーシスは、骨芽細胞の抑制、骨吸収破骨細胞の活性化[209]、ホルモン軸への影響[198],[210]によっても骨の成長を阻害する(内分泌系に対するpHの影響についてはセクション4.11も参照のこと)。したがって、血清[HCO3-]は骨密度(BMD)と正の相関があり[211]、血清副甲状腺ホルモン(骨吸収を促進する)のレベルと負の相関がある[212]。局所レベルでは、骨リモデリングのプロセス、およびホルモンによる骨からのCa2+およびPiの動員は、破骨細胞が骨表面上にH+を分泌することを必要とする。破骨細胞は、細胞内にH+とHCO3-を生成するCAII、骨表面にH+を分泌するアピカルv型H+-ATPase、HCO3-を輸出してH+分泌中の破骨細胞のpHiをアルカリ性から守るベースサイドAE2を持っている(図8)。v型ATPaseとCAIIの変異は破骨細胞による骨吸収を阻害し、ヒトでは骨密度の増加や骨粗鬆症と関連している[213],[214].
図8 骨リモデリングにおける酸塩基トランスポーターと炭酸脱水酵素(CA)の役割
破骨細胞は、骨の成長/リモデリング時や、ホルモンによるミネラル化したCa2+とリン酸の放出要求に応じて、ミネラルを再吸収するために骨表面上に酸を分泌する。閉経後の女性において、緑内障の治療に用いられるCA阻害剤の標的外骨量減少作用が示唆された報告もある。NHE1:Na+/H+交換体1、AE2:Cl-/HCO3-交換体2、CAII:炭酸脱水酵素II、NBCn1:電気陰性Na+/HCO3-共輸送体。
4.6.2. 酸塩基平衡の治療的関連性
破骨細胞の酸塩基調節蛋白質は薬剤による調節が可能であり、その遮断は骨粗鬆症の予防になるはずだ。例えば、AE2欠損マウスや牛では骨量が増加していることから、AE2は骨量を増加させる有用なターゲットであると考えられる(文献215参照)。CAIIについては、緑内障治療のためにCA阻害剤を慢性的に使用している閉経後の女性において、偶然にも骨温存効果が認められた研究がある[216]。別の研究では、逆説的ではあるが、治療上価値のある、硬化性骨異形成を有する3人の小児におけるCA阻害のBMD低下効果が示された。これらの小児では、破骨細胞はすでに欠損しているため、CA阻害の主な効果は、骨吸収を促進する慢性的なMACの誘導である[217]。PPIの骨粗鬆症治療への有用性は、腸のCa2+吸収に悪影響を及ぼすため、否定的である[218].実際、いくつかの研究では、PPIの使用が骨折しやすさや低いBMDと関連している(参考文献[219]、[220]に総説あり)。これらの副作用のため、PPIは制酸剤として服用するグループもあり、慎重に使用されている[219],[220](次のセクションも参照のこと)。
4.7.上部消化器系
4.7.1. 酸塩基平衡の重要性
このシステムにおける酸塩基の健康への影響は、唾液中のHCO3-エナメル質の防御(セクション5.4口腔衛生で説明)、胃酸分泌、Helicobacter pyloriによる消化性潰瘍の3つが主なものとなっている。胃酸は、消化酵素を活性化し、下流の分泌プロセスを刺激し、摂取した病原体を死滅させるために必要である。胃酸は、破骨細胞(前のセクションで述べた)と同様の輸送機序を用いて、壁細胞から分泌される。したがって、頂膜を介した酸の分泌は、H+/K+-ATPaseによって媒介され、AE2(摂食に関連するアルカリ潮[59]、[221]、図9参照)を介してHCO3-が血漿中に押し出されることによってバランスが保たれている。胃の上皮は、粘液の裏打ちによって酸による損傷から保護されている。病原性細菌H.pyloriは、H+ゲートの尿素チャネルを介して環境から尿素を取り込み、アンモニア(NH3)に変換して、直近の環境の酸を中和できるため、胃酸中で生存できる[222]。粘液層付近では、この作用により、ピロリ菌は粘液のpHを上昇させ、粘弾性を低下させ、細菌の浸潤を促進し、最終的に炎症、潰瘍形成[223]および胃癌のリスク[224]を引き起こす。もうひとつの疾患である胃食道逆流症は、胃酸の食道への逆流によって引き起こされ、胸焼けを引き起こし、重症の場合は食道の損傷につながる可能性がある。唾液中のHCO3-は、胃酸を中和することにより、食道の酸防御に重要な役割を果たしている[225],[226],[227]。逆に、食道上皮におけるNHE1の作用は、おそらく間接的にプロアポトーシス経路を刺激することによって、障害を悪化させる可能性がある[229]。
4.7.2. 酸塩基平衡の治療的関連性
逆流性食道炎は、制酸剤によって胃酸を中和することで症状が緩和される。制酸剤は、簡単に言えば重炭酸塩や炭酸塩(例えば、TUMS®は炭酸カルシウム)であり、この重炭酸塩や炭酸カルシウムを摂取することで、逆流性食道炎は緩和される。しかし、牛乳と炭酸カルシウムの投与に基づく消化性潰瘍に対する初期の制酸療法は、現代においても自己治療を行っている人々に観察され、MAlkと高カルシウム血症を特徴とするいわゆる「牛乳-アルカリ症候群」という有害な結果をもたらす[230],[231].胃酸を低下させる代替アプローチは、H+分泌を刺激するシグナル伝達経路を弱めるPPIまたはH2-受容体作動薬を使用することである。さらに、H2アゴニストは、食道のNHE1の活性を治療的に低下させる[232]。市販薬の中には、これらの薬と制酸剤を組み合わせて、それぞれの投与量を減らし、鼓腸(胃内二酸化炭素の発生による)および骨粗鬆症(腸内Ca2+再吸収の慢性阻害による、セクション4.6参照)といったそれぞれの副作用を最小限に抑えるものがある。ベベリマーのような経口投与の酸キレート剤も、胃酸pHを上昇させるが[233]、胸焼けの治療法としては試験されていない。Ae2欠損マウスの無胃酸表現型は、AE2阻害が治療標的として可能性があることを示唆している[234]。PPIと抗生物質の併用は、H.pylori感染症の治療に用いられている。胃のpHを上げると細菌の成長が速くなり、分裂している細菌に作用する抗生物質の効果が増強されると提案されている[235]。ピロリ菌のウレアーゼとH+ゲート尿素トランスポーターの阻害剤は、他の潜在的な治療法であり、現在も開発中である[236]。
4.8.下部消化器系
4.8.1. 酸塩基平衡の重要性
膵外分泌液は、十二指腸に流入する胃液(チャイム)を中和するのに不可欠なHCO3を豊富に含む液体を分泌している。膵液のアルカリ性pHは、アミラーゼやリパーゼなどの消化酵素を、分泌された液が十二指腸内腔でチャイムにより中和されるまで不活性状態に保ち、膵管へのダメージを防ぐ役割を担っている。CFでは、十二指腸過酸も膵酵素を不活性状態にするが、チュームによる中和がなければ、十二指腸内で活性化もしないため、脂質などの栄養の吸収不良につながる[237]。
腸内では、胃の運動を促進するために、HCO3を含む液体が分泌される。この液体が糞便中に失われると、かなりの酸負荷となる。その結果、CFTRの変異は腸閉塞を引き起こし[238]、分泌性の下痢はMAcを引き起こす可能性がある[239]。分泌過程のバランスをとるために、NHE3とSLC26A3は一緒になって体液の再吸収を促進する(図10)。したがって、腸内毒素原性細菌(大腸菌やC.difficile)による腸管NHE3のダウンレギュレーション、NHE3やSLC26A3の不活性化遺伝子の欠陥は、すべて分泌過多や下痢と関連している[240],[241],[242],[243].腸内細菌叢に関して、腸内pHは腸内細菌叢の構成に影響を与え、また影響を受ける可能性がある[244]。栄養を吸収する腸が不十分な人(短腸症候群)では、吸収されない炭水化物が乳酸産生菌の増殖を促進し、d-乳酸アシドーシスにつながる可能性がある[245]。最後に、多くの栄養素の吸収は、H+結合ABT(例えば、SLC15ファミリーのH+結合オリゴペプチド輸送体[246])の作用に依存し、その結果、H+結合栄養吸収中に上皮pHを維持するためにNBCe1などの酸押出機の存在が必要となる。実際、NBCe1欠損マウスは栄養吸収に欠陥があり、これは一般的に成長しないことの一因となっている[247]。
図10 腸管酸塩基トランスポーターを標的とした便秘治療
腸の体液吸収は、Na+/H+交換体3(NHE3)とCl-/HCO3-交換体(SLC26A3)の複合作用によって促進され、NaCl、ひいては水の純吸収を行う。いずれかを阻害し、腸管内腔からの水分吸収を抑えることは、便秘を伴う過敏性腸症候群の治療法として有用である。Ivacaftorは、腸液分泌を回復させることにより、嚢胞性線維症にも同様に有用である。CFTR: cystic fibrosis transmembrane regulator;CAII: carbonic anhydrase II;AE2: Cl-/HCO3-exchanger 2;NBCe1: electrogenic Na+/HCO3-cotransporter;NBCn1: electroneutral Na+/HCO3-cotransporter.
4.8.2. 酸塩基平衡の治療的関連性
NHE3(テナパノール)およびSLC26A3(4,8-ジメチルクマリン製剤「DRAinh-A250」)の低分子阻害剤の腸液吸収を減少させる能力は、便秘を伴う過敏性腸症候群の治療およびCFにおける便秘の緩和のための貴重な治療となる[248],[249].CFTR補正薬であるivacaftorは、CF患者において、腸内のHCO3-分泌と栄養吸収を改善する[250]。抗便秘薬であるリナクロチド(リンゼス®:グアニル酸シクラーゼC受容体アゴニスト)の作用様式は、cGMPを介したNHE3の減少を促進し[251]、CFTR活性を活性化することによって、両方のパラダイムを包含している[252]。
4.9.泌尿器系
4.9.1. 酸塩基平衡の重要性
4.9.1.1. ネフロン機能
腎臓は全身のpHバランスに不可欠である(セクション2「酸塩基平衡」参照)。HCO3-を生成し、糸球体濾過液からHCO3-を再吸収して尿中の損失を防ぎ、H+をNH4+またはリン酸などの滴定酸の形で排泄するのは腎臓である[253](図 2)。従って、腎臓の輸送機構の欠陥がMAcをもたらすことは、驚くことではない。これらの酸性化疾患は、後天的なものと遺伝的なものがある。ファンコニ症候群は近位尿細管の変性であり、腎尿細管性アシドーシス(RTA[254])は、NBCe1(II型近位RTA:pRTA)、H+-ATPaseまたはAE1(I型遠位RTA:dRTA)、CAII(III型RTA)または低アルドステロン症によるH+分泌障害(IV型dRTA)といった酸塩基トランスポーターの変異によって生じ得るものである。慢性腎臓病(CKD)もまたMAcと関連しており[255]、MAc自体がCKDの進行を促進する(下記参照)。
MAlkは CF患者に共通する所見である。CFモデルマウスは、腎臓のHCO3分泌陰イオン交換体pendrinのダウンレギュレーションと、おそらくCFTRを介した直接のHCO3分泌の喪失により、野生型マウスよりもHCO3負荷に対する防御能力が低下している[256]。
同時に、酸塩基の状態は、腎臓の機能に大きな影響を与える。腎臓が酸負荷の急性増量に反応して酸排泄を増加させるさまざまなメカニズム(例えば、アンモニア生成およびアシドーシスに対する腎内分泌反応)は、慢性MACでは不適応となり、炎症および線維化を引き起こす可能性がある[257]。低血清[HCO3-]が、成人と小児の両方において慢性腎臓病の高いリスクと関連していることは、おそらく偶然ではないだろう[258]、[259]。ネフロンによる酸/塩基および塩/水の取り扱いの統合に伴い、腎臓の病態がさらに追加される。例えば、近位尿細管(例えば、容積収縮)または集合管(例えば、リドル症候群における上皮性Na+チャネルENaCの過活動)によるナトリウム再吸収の増加の状態および条件は、MAlk(セクション3.3代謝性アルカローシス参照)になる一方で、高カリウム血症はMAcを引き起こしうる[260]。
4.9.1.2. 石の形成
尿pHは、炎症や閉塞性腎障害の原因となる結石の形成に影響を与える可能性がある。尿中pHが高いとシュウ酸カルシウムまたはリン酸カルシウムの結晶が形成され、尿中pHが低いと尿酸の結晶化が促進される[261]。尿pHは、尿路病原性細菌によって変化させることができる。ウレアーゼを発現する細菌はNH3を生成し、尿のpHを大幅に上昇させ、ストルバイト結晶やアパタイト結晶の沈着を促進する[262]。尿路結石形成の結果だけでなく、これらの結晶の沈着は、留置カテーテルの包埋や閉塞を引き起こすことがある[263]。胃における別の細菌、H.pyloriの病原性作用もまた、ウレアーゼ作用に依存することは興味深い(セクション4.7参照)。
4.9.2. 酸塩基平衡の治療的関連性
4.9.2.1. ネフロン機能
多くの研究が、機能不全の腎臓の機能を維持し、CKDの進行を遅らせるためにMAcを補正することの価値を指摘している[264],[265],[266]。(セクション3.2.2)でアルカリ療法を中心とした補正戦略について概説したが、緊急時の予防的価値もある。NaHCO3の注入は、外傷性横紋筋融解症(クラッシュ損傷による)から生じる腎障害に対して保護的であり、MACの発症を防ぎ、ミオグロビンの腎毒性を和らげる[267],[268].
治療法に関連するもう一つの考慮点は、多くの薬剤が、腎毒性[269]または偶発的に腎臓の酸排泄能力を阻害するために、代謝性酸塩基障害を引き起こすことである[55].例えば、利尿剤として使用されるACZのようなCA阻害剤は、体液の再吸収を妨害する能力により、MAcも引き起こす[270]。一方、ループ利尿剤の使用は、MAlkを引き起こす可能性がある[271]。もう1つの例はペニシリン系抗生物質で、集合管内腔で有意な非再吸収アニオンとして作用し、K+およびH+の過剰分泌を促進し、低カリウム血症とMAlkを引き起こす[272],[273].
最後に、このセクションのために、CFTR回復薬カクテルルマカフトール/アイバカフトール(ORKAMBI®)の治療により、CF腎臓の過剰なHCO3-分泌能力が回復する[274]。
4.9.2.2. 石の形成
クエン酸塩と低いpHはともに、カルシウム沈殿物の形成を抑制する[275]。したがって、尿中pHを低下させながら尿中クエン酸塩を上昇させるレモン汁の摂取は、腎結石およびカテーテル閉塞性沈着物の形成傾向を低下させる[276]。クエン酸塩の栄養補給も、尿pHの上昇をもたらすにもかかわらず、それに伴う尿中クエン酸の上昇によって結晶核形成のpHがさらに高いpH値に上昇するため、この目的には有効である[277],[278].尿中pHはまた、後述するように薬物排泄に重要な影響を及ぼすことがある(セクション6.5を参照)。
4.10.生殖システム
4.10.1. 酸塩基平衡の重要性
この時点で、ABTが生命の維持に必要であることを示す十分な証拠を提示したが、今度は、ABTが新しい生命を生み出すのにも必要であることを見てみよう。男性の生殖管では、精巣上体の尾部にある透明細胞によるH+の分泌は、精子を貯蔵するために内腔のpHを酸性に保つのに必要である[279]。精巣上体の長さに沿ったHCO3-の分泌は、射精前に精子を機能的に活性化し[280]、酸性膣環境(後述)による不活性化を防ぐのに必要である。実際、低レベルのHCO3-は精子の運動性の低下と関連している[281]。女性の生殖管では、子宮内膜上皮細胞はさらに精子の受精能形成と受精に必要なHCO3–を含んだ液体を分泌する[282]。さらに、子宮周期の分泌期は卵管内腔のpHの劇的な上昇と関連しており、排卵時に粘液を薄くして精子の移動性を促進し[283]、卵を取り囲むコロナ細胞の分散を促進して受精を可能にするのに十分なレベルのHCO3-と対応している[284]。HCO3-は、可溶性アデニルシクラーゼを刺激してcAMPを生成し、必要なシグナル伝達カスケードを開始する能力により、先体反応の必要条件とさえなっている[285]。最後に、受精が起こると、子宮液の酸性化は、胚の着床に必要な前提条件である[287]。例えば、AE2,SLC26A3,CFTR,NHE8の欠損は、いずれも雄マウスの不妊症や生殖能力の低下と関連している[282],[288],[289],[290]。先に述べた膣の酸性pHは、乳酸菌の代謝活性によって引き起こされ、性感染症の病原体から防御する役割を果たす。細菌性膣炎における酸性の喪失は、性感染症による感染の可能性の増大と関連している[291]。
最終的な生殖の成功に関して、母体と胎児の酸塩基平衡は周産期の転帰を決定する重要な要素である[292]。例えば、閉塞性分娩は、間欠的な低酸素症や乳酸アシドーシスにより予後不良となる[293]。
4.10.2. 酸塩基平衡の治療的関連性
膣内が酸性になると精子の運動性が低下する傾向があるため、NaHCO3による膣洗浄を行うと受胎率が向上する[294],[295]。逆に、膣内酸性化は避妊および予防になる。レモン汁の殺精子作用は古くから評価されている[296]。Phexxi™(旧名:ACIDFORM:[297])は、一連の酸性避妊用ジェルの中で最も新しいものである。Phexxi™は、乳酸、クエン酸、および酒石酸カリウムの膣内適用ゲルで、FDAによって妊娠を防ぐよう指示されている[298]。代替品である「BufferGel」は、同じ目的のために酸性ポリマーを利用している[291]。膣のpHを下げることで、これらの製品は殺菌効果も付与している。最後に、ABTを標的とする薬剤の中には、生殖能力を阻害するものがある。例えば、CA阻害剤は、コロナ細胞の分散を妨げ[299]、PPIは精子の運動性を阻害する[300]。
最後に、出産に関しては、閉塞性分娩の転帰を改善するための方策として、周術期のNaHCO3注入が提案されている[293]。
4.11.内分泌系とメタボリズム
4.11.1. 酸塩基平衡の重要性
酸や塩基を消費したり生成したりする代謝反応の多くは、病気ではMAcになることがある。肝臓は、乳酸の消費(乳酸アシドーシスに対抗)、アルブミンの生成(弱酸:低アルブミン血症はMAlkに関連)、ケト酸の生成(糖尿病性ケトアシドーシスに寄与)により、酸塩基平衡に重要な貢献をしている[301]。さらに、酸塩基の状態は、いくつかの重要な代謝経路を構成する酵素の活性に影響を与える。例えば、アシドーシスは、解糖[302]および脂肪分解[303]を阻害するが、糖新生[304],[305]は刺激する。アシドーシスおよびアルカローシスは、ともに膵島からのグルコース刺激インスリン放出を低下させる[306]、(ii)血漿中のHCO3-含有量はインスリン溶解度と相関する[307]、(iii)アシドーシスはインスリン感受性低下と関連している[308]、[309]。この後者の観察は、インスリンとその受容体の間の相互作用のpH感受性の一部によるもので、pH〜8.0で最も強い結合を示すベル型のpH依存性である[310]。実際、インスリンはABTの作用にも影響を与えることができる。例えば、インスリンは腎臓のNBCe1活性を促進する。2型糖尿病では、NBCe1のアップレギュレーションによって引き起こされる腎臓の水分吸収の病的な増加が、高血圧に寄与すると考えられている[311]。
酸塩基平衡に影響を与える他のホルモンとしては、セクレチン(十二指腸酸性に反応して膵臓のHCO3-分泌を増加させる[312])、アンジオテンシンIIおよびアルドステロン(アシドーシスで腎の酸排泄を増加させる[84],[313])、副甲状腺ホルモン(アシドーシスで腎酸排泄と尿中リン酸緩衝体排泄を増加させる[212])が挙げられる。興味深いことに、甘草は、その成分化合物の1つ(グリチルリチン酸)が間接的にアルドステロン受容体の過剰刺激を引き起こすため、MAlkを引き起こすことがある[314]。アシドーシスでそのレベルが病的に変化するホルモンには、アルドステロンおよびエンドセリン(増加[315]、[316])、コルチゾン(増加[317])、およびIGF-1(減少[318])が含まれる。
低酸素および酸性腫瘍環境におけるがん細胞の代謝的リプログラミングについては、後のセクションでさらに論じる(セクション5.6「腫瘍」参照)。心臓機能、筋肉量、骨成長の内分泌および代謝的側面におけるpHの影響と治療との関連性は、以前のセクション(4.4,4.5,4.6)で述べたとおりである。
4.11.2. 酸塩基平衡の治療的関連性
食事性酸負荷とインスリン感受性の発達との関連から、食事管理は2型糖尿病の発症率を下げるための魅力的なターゲットとなっているが、有効性に関する圧倒的な証拠は今のところない[308]。インスリン溶解度のpH依存性のため、投与されたインスリンの溶解時間は、DKAの糖尿病患者の血漿では、それ以外の正常血漿よりも遅く、インスリン-重炭酸塩併用療法が有用であることを額面通りに示唆している[319].しかし、実際にはこのような治療は限られた価値しかなく、小児では脳浮腫の発生に関連している[320]。薬物の溶解度に対するpHの影響については、セクション6.2でより詳細に議論している。
4.12.免疫システム
4.12.1. 酸塩基平衡の重要性
pHは免疫反応のあらゆる局面で役割を担っている。まず、広く適用できる効果を列挙する。(i)好中球の拡がり(毛細血管の接着と血管外に出るために重要な形態的変化)の際に細胞骨格の再配列を促進する細胞質のアルカリ化にはNHE1の作用が必要である[321]-(ii)。(ii)炎症部位は、侵入した細菌や好中球の代謝活動により通常酸性であり、炎症性サイトカインの産生を促進する環境である[322](セクション4.3も参照)。(iii)細菌の殺傷時には、ファゴソームへのH+の流出が、細胞毒性を持つスーパーオキシドアニオンを生成する呼吸バースト時の電荷補償に必要である。この作用は、電位依存性H+チャネルHV1によって媒介される[323]。(iv)生成されたスーパーオキシドの一部は、細胞毒性を有する次亜塩素酸(HOCl)に変換され、好中球の細胞質内に拡散して戻ることができるようになる。このように、ファゴソームのHV1の働きは、細胞膜のNHE1の働きと合わせて、NADPH酸化酵素活性を低下させるアシドーシスから好中球細胞質を防御する[321],[324],[325].
個々の免疫細胞のpH感受性は試験管内試験でよく知られているが(例えば、アシドーシスは白血球と好中球の移動性を低下させる[326]、補体の活性化を促進する[327]、炎症性メディエーターの発現を調節する[326])、これらの効果には多くの微妙な点が存在する。例えば、アシドーシスのタイプ、細胞のタイプ、細胞の活性化状態、および食細胞活性対移動への影響は、全て所定の細胞タイプによって媒介される免疫反応に対する酸塩基の乱れの効果に影響を与える可能性がある[328]。したがって、例えば、アシドーシスは、好中球[329]と白血球[330]による細菌殺傷を促進するが、マクロファージ[331]による殺傷は促進しない。一連の協調的なメカニズムを解明するのは難しいが、一般に、全身性アシドーシスは免疫機能の低下と関連している[328],[332],[333]。
pHと免疫反応の乱れとの関連は、次のような例で示される。酸負荷タンパク質AE2の一塩基多型は、原発性胆汁性胆管炎の進行に関連している。そのメカニズムは、細胞傷害性T細胞からAE2を失うとpHiが上昇し、細胞の増殖、活性化、生存が促進され、傷ついた肝細胞に対する自己免疫反応が増幅されるというAe2ヌルマウスの研究により示唆されている。さらに、IV型dRTAは、因果関係は不明であるが、全身性エリテマトーデスに関連している[334],[335].
4.12.2. 酸塩基平衡の治療的関連性
病的な免疫反応を抑制するために、いくつかのパラダイムが提案されている。ラットのNaHCO3経口投与は抗炎症反応を刺激し、この効果は関節リウマチのような自己免疫疾患における組織損傷を防ぐために利用される可能性がある[336]。マウスを用いたある予備研究では、NaHCO3の経口投与がピーナッツアレルギーの抑制に有用であることまで示唆されている[337]。薬理学的な側面では、MCT1阻害剤は、T細胞活性化中の乳酸の処理を妨害することにより、免疫抑制剤として作用する[338].最後に、NHE1阻害剤であるカリポライドは、メカニズムは不明であるが、ラットの熱傷に対する全身的な免疫反応を抑制する[339]。
一方,酸塩基平衡の知識は、免疫反応を促進するために利用することができる。AE2を阻害して細胞傷害性T細胞応答を強くすることは、慢性感染症の治療に有用であることが示唆されている[333]。がん免疫療法におけるpHの役割に関する考察は、セクション5.6に記載されている。
5.その他のアプリケーション(専門分野別
5.1.メンタルヘルス
5.1.1. 酸塩基平衡の重要性
神経細胞活動はpHに依存しており(セクション4.1参照)、酸塩基平衡の作用が行動や神経精神疾患の進行に影響を与えるという新たな証拠が得られてきている。CO2の吸入は(ニューロンの興奮性に対する一般的な減衰作用にもかかわらず、セクション4.1.2を参照)不安とパニックを引き起こし、CO2の影響はパニック障害を持つ個人において悪化する[340]。マウスを用いた研究では、脳内pHの低下がストレス、恐怖、社会的行動を司る脳領域で酸感知イオンチャネルASIC1aの作用を誘発することが示されている[341],[342]。マウスにおける恐怖に関連した凍結行動の獲得は、ASIC1aの過剰発現によって増強され[343]、ASIC1aの破壊によって減弱された[342]。ヒトにおいても、脳内pHの低下は統合失調症、双極性障害、自閉症スペクトラム障害と関連している[344]。ある研究では、高い食事性酸負荷が幼児の感情的問題や多動性の発生と相関することまで示唆しているが、行動が食習慣に影響することを否定できないため、因果関係は確立できなかった[345]。ABTと精神神経疾患との関連性に関しては、SLC4A4は、特に双極性障害に伴う自殺念慮と完了のバイオマーカー(特定の一塩基多型の発生率とマイクロアレイで決定される発現の低下の両方)である[346]。関連性のメカニズムの詳細は不明であるが、脳のpHを制御するNBCe1の役割が関係していると思われる。おそらく、全身的な酸塩基平衡に影響を及ぼすため[347]、酸を排泄する能力と典型的に相関するCKDにおける推定糸球体濾過量が、抑うつ症状および自殺念慮と逆相関していることも関連性がある[348]。
5.1.2. 酸塩基平衡の治療的関連性
CO2吸入に対する不安反応は、パニック障害の治療効果を追跡するのに有用な臨床試験である[349]。この反応自体はACZによって鎮めることができるが[350]、これはあくまでもパニック障害のモデルであるため、実際のパニック障害の治療にCAブロッカーを使用することは不明である。以上のASIC1a欠損マウスの研究から、ASIC1aの阻害がパニック障害の治療となる可能性が示唆された。SLC4A4と自殺の関連については、NBCe1活性の調節がうつ病にどのように影響するかは不明であるが、バイオマーカーの検出は高リスク者の特定に役立ち、それによって治療戦略に反映されるかもしれない[346]。最後に、抗精神病薬は乳酸アシドーシスを引き起こし、統合失調症患者の脳のpH低下の一因となる可能性が示唆されている[351].
5.2.麻酔科学
5.2.1. 酸塩基平衡の重要性
先に述べたように、血漿pHはCO2を排出するための十分な換気に依存するため、機械的換気は呼吸器系の酸塩基性障害を誘発する可能性がある。このセクションで考慮すべきもう一つの重要な点は、麻酔薬の生物学的利用能が酸塩基状態に影響される可能性があるということである。
5.2.2. 酸塩基平衡の治療的関連性
機械的換気を行う場合、酸塩基平衡に関連する2つの重要な考慮事項を挙げる必要がある。第一は、低流量麻酔システムまたは閉回路再呼吸システムで、呼気麻酔ガス混合物を戻す場合である。これらのシステムでは、再循環された空気からCO2を除去しなければならない。この目的のために、CO2を吸着するためのCO2スクラバーが使用される。典型的なスクラバーは、炭酸と反応して不溶性のCaCO3沈殿物を形成するNaOHとCa(OH)2の混合物であるソーダライムである(他の多くの技術が利用できるが[352],[353],節3.4.2も参照のこと)。多くのCO2スクラバーは麻酔ガスと望ましくない反応を起こし、一酸化炭素のような毒素を生成する可能性があるため、技術の選択は重要である[354]。第二に、急性呼吸窮迫症候群やCOPDの患者など、低タイドロ量換気が適応となる患者について検討する。このような患者は、肺への機械的ストレスを防ぐために、意図的に低換気量にすることができる。こうして、患者は「容認性過呼吸」と呼ばれる代償性RACの状態に維持される。重症患者のような状況下では、この高炭酸状態が抗炎症作用により保護的になることがある[355](セクション4.12免疫系も参照)。
酸塩基平衡の懸念は、吸入麻酔薬に限られたものではない。静脈内投与される麻酔薬プロポフォールの長期点滴は、重篤な乳酸アシドーシスを引き起こす可能性がある[356]。一般に薬物の薬物動態に及ぼすpHの影響については、セクション6で説明する。
5.3.外科手術
5.3.1. 酸塩基平衡の重要性
周術期の介入は、酸塩基の恒常性を乱し、予後に悪い影響を与える可能性がある。術後MACは、よく説明されているが、灌流不足の組織における乳酸蓄積や、輸液によるHCO3含有血漿の希釈/置換による高クロレミア性アシドーシスなどの問題に関連する複雑な現象である[357],[358],[359],[360].術前アシドーシスもまた報告されており、ストレスおよび絶食と関連している[357].術後のMAlkもまた、一般外科手術の後に報告されており、クエン酸緩衝血漿の注入と関連している[361],[362]。術後MAlkは、経鼻胃管吸引による胃酸の除去に関連している。術後MAc[363]およびMAlk[361]のいずれとも予後不良であるが、これは普遍的な所見ではない[357]。
関連するテーマとして、輸血用保存血液の有用性は、保存細胞による嫌気性代謝に伴う低pHを含む多くの保存上の病変によって損なわれる可能性がある[364],[365]。最後に、酸性の組織環境は自然な創傷治癒を促進するように見えるが、アルカリ性のpHは皮膚移植の成功を促進する[366]。
5.3.2. 酸塩基平衡の治療的関連性
輸液の化学的性質を変えることは、術後の酸塩基平衡障害に対処するための明らかな戦略である。術後のMAcに特異的に関連して、ジクロロ酢酸処置は、転帰への影響は観察されなかったものの、肝移植後の乳酸の病的上昇を和らげた[367]。MAcに対する他の治療法については、セクション3.2.2で考察されている。MAlkに対する治療法については、セクション3.3.2で議論されている。最後に、マウスを用いた研究で、保存血液のpHを上げると輸血後の赤血球の生存率が高まることが示唆されている[368]。創傷治癒のpH依存性は、創傷や移植片のpHを治療的に維持することで治癒が促進されることを示唆している[366]。
5.4.口腔衛生
5.4.1. 酸塩基平衡の重要性
HCO3は、刺激された唾液中の主要な緩衝剤であり[369]、酸性の飲食物および口腔内の好酸性細菌が糖から生成する酸に対して、口腔内のpHを防御する。酸による防御は、エナメル質を浸食から保護し、口腔内pHは、健全な口腔内マイクロバイオームの重要な決定因子でもある。唾液量およびpHが低いと、一般的に病原性および虫歯菌の存在を助長する(例えば、[370]、[371])。結果として、低い唾液pH、[HCO3-]、および/または緩衝能は、虫歯形成の予測因子となる[372]、[373]、[374]。唾液pHは、頭頸部がんの化学療法を受けている患者[370]、コカイン使用者[375]、またはタバコ喫煙者[376]など、多くのグループで低下している。唾液pHの低下は、CF[377]、シェーグレン症候群[378]、若年性特発性関節炎[379]などの疾患を有する個人においても報告されている。これらの症例では、代償因子が作用している可能性があるため、すべての研究が歯の健康に大きな影響を与えることを報告しているわけではない[379]。ABTsとCAは、エナメル質の形成だけでなく、唾液分泌においても重要な役割を果たす[312]、[380]。例えば、歯列の欠損はNBCe1突然変異を持つ一部の人の特徴であり[381]、酸血症の二次的な結果ではないようである[382]。
5.4.2. 酸塩基平衡の治療的関連性
唾液のpHは口腔内の健康状態にとって有用なバイオマーカーであり[383]、口腔衛生における重曹の有用性は、1911年という非常に古い時代に初めて示唆された[384]。重曹を洗口液[385]、粘着性スプレー[386]または無糖ガム[387]として摂取すると、唾液のpHが上昇し、場合によっては好酸性菌のコロニー形成を低下させることがある。白血病の化学療法を受けている患者において、NaHCO3洗口液の使用は口内炎への感受性を低下させた[388]。喫煙者では、同様の処置により炎症性バイオマーカーであるIL-1βのレベルが低下した[376]。NaHCO3を含有する歯磨剤は、プラークpHの中和[389]、プラーク除去の促進[390]、およびう蝕形成の抑制[391]に有効であることが示されている。また、修復歯科で用いられるpH安定化樹脂は、OH-の放出によって有用なう蝕防止剤となることが示唆されている[392]。最後に、食事の糖分摂取量を減らすことは、好酸性細菌によって引き起こされる酸性化を制限するため、口腔内のpHにも有益である。したがって、無糖ガムは、唾液分泌の刺激によるプラークpHの上昇効果を増強する[393]。
5.5.感染症
5.5.1. 酸塩基平衡の重要性
これまでにも、酸塩基に関連した医療微生物学の様々な側面を扱ってきた(4.3,4.7,4.8,4.10,4.12,5.4の項を参照)。ここでは、インフルエンザとマラリアを例にとって、ウイルスと寄生虫に限定して考察する。
5.5.1.1. インフルエンザ
ウイルス感染により、感染細胞の解糖速度の上昇と、感染細胞のエンドソームからのH+の放出(ウイルスのM2 H+チャネル経由)により、細胞内が酸性化する。これらのメカニズムは、いずれもウイルスの複製をサポートするために必要である。感染細胞は、増加した酸負荷に対してpHiを防御するためにH+を放出し、それに伴って細胞表面のpHeが酸性化する[394].
5.5.1.2. マラリア
マラリアのライフサイクルとその病的影響には、酸塩基に関連した複数の側面がある。まず、蚊はCO2に誘引され、またCO2によって人間の臭いに感作される[395]。第二に、マラリア感染の赤血球期には、原虫が赤血球に侵入する必要がある。原虫が宿主細胞の認識と侵入のために利用する表面抗原の1つがAE1-glycophorin A複合体である。その結果,Ae1欠損マウスは、赤血球の形態異常を引き起こすAE1欠損者(South East Asian Ovalocytosis,SAO)と同様に、感染に対して免疫がある[396]。最後に、マラリア感染は、MACなどの多くの代謝障害を引き起こし、一部は、微小血管の閉塞による組織の低酸素および高乳酸血症に追随する。MAcは、感染者における致死的転帰の強力な予後因子である[398],[399].
5.5.2. 酸塩基平衡の治療的関連性
5.5.2.1. インフルエンザ
M2 H+チャネルブロッカーは、現在利用可能な抗ウイルス治療に耐性を持つインフルエンザ株をターゲットにする可能性がある[400]。一方、PPIの使用は、通常ウイルス粒子を破壊する胃酸を中和することにより、胃腸管におけるウイルス感染に対する感受性を高める可能性がある[401]。
5.5.2.2. Malaria
マラリアにおける乳酸アシドーシスは、ジクロロ酢酸処理によって改善することができる[402]。SAOを持つ個体のマラリア耐性は、SAOの血液を輸血することが、薬剤耐性原虫に感染した個体に対する有用な治療法である可能性を示唆している[403]。最後に、寄生虫自身のABTは抗マラリア作用のターゲットになる可能性がある[404]。
5.6.オンコロジー
5.6.1. 酸塩基平衡の重要性
癌細胞の急速な増殖は、酸素の存在下でも好気性代謝から嫌気性代謝に移行するWarburg効果(「好気性解糖」としても知られる)と関連している[405],[406]。この状態では、細胞はグルコースの取り込み速度を上げることでATP産生を増加させ、その結果、乳酸とH+の産生を増加させる。代謝速度が速いため、このような細胞は正常細胞よりもはるかに低いpHiを持つ傾向がある。しかし、癌細胞は、H+の除去を促進するNBCe1、NBCn1、NHE1、H+-ATPase、MCT4などの酸分泌ABTと、CO2の除去を促進する細胞外CA(CAIX、CAXII)のアップレギュレーションによって、pHiを正常に近い状態に保つことができる[407],[408],[409],[410],[411](図11)。アクアポリン(AQP)は、CO2の膜貫通移動の導管として機能し[412],腫瘍の増殖や生存を促進するが、CO2の除去促進が病態の重要な部分を占めていることは明らかではない[407],[413],[414].癌細胞株で示されたように[415]、アシドーシスはまた、TCAサイクル(H+の押出のためのATP生産を促進する)およびペントースリン酸経路(活性酸素に対抗するためのNADPH生産を促進し、細胞の生存を促進する)の駆動力を増大させることができる[415]。これらのプロセスの複合作用は、局所pHeの劇的な減少をもたらす。このような変化により、がん細胞は隣接する非がん細胞に打ち勝ち、身体の他の部位に動員され拡散することができる。細胞外マトリックスの酸依存性リモデリング[416]と抗腫瘍免疫反応の抑制[417]により、転移と腫瘍の生存がさらに促進される(セクション4.12免疫系も参照)。早期乳癌生存者のコホートにおいて、内因性酸純生産量の多さが乳癌再発の死亡率の高さと関連していることは注目に値する[418]。さらに、メラノーマ細胞の酸処理により、より浸潤性の高い表現型が選択され[419]、様々なABTやCAのアップレギュレーションの程度が予後不良因子となり得る(例えば、[420],[421],[422])。
図11 癌における酸塩基輸送体(ABT)と炭酸脱水酵素(CA)の役割
多くの酸塩基処理タンパク質が、急速に増殖する腫瘍細胞で発現上昇し、代謝酸の処理を助け、その周辺の非腫瘍細胞に不利な酸性の微小環境を作り出している。これらのABTやCAのほとんどは、体内の他の場所で十分発現しているため、開発中の治療法は、モノカルボン酸トランスポーターMCT4やCAIXなど、低酸素腫瘍環境で優先的に発現する稀な標的をブロックすることに重点を置いている。その他のアプローチとしては、腫瘍の酸性環境を利用して、化学療法薬の標的送達を行うことである(セクション6.6参照)。NBCe1:電気陰性Na+/HCO3-共輸送体;NBCn1:電気中性Na+/HCO3-共輸送体;NHE1: Na+/H+交換体1;pHe:細胞外pH.を表す。
5.6.2. 酸塩基平衡の治療的関連性
癌における酸塩基平衡の重要性から、腫瘍のpHを標的とすることは、価値ある補助療法となり得ることが示唆されている。以下に述べる3つの主な治療法がある。(i)がん細胞のpHiを守る能力を阻害する、(ii)がん細胞が酸性の細胞外環境を作り出す能力を阻害する、(iii)酸性の腫瘍微小環境における免疫反応を強化する。
5.6.2.1. pHiの防御を妨害する
癌細胞によるpHiの防御をブロックすることは、酸を押し出すABTやCAを阻害することで達成できる[410],[423]。これらのアプローチの価値は、NBCn1-nullマウスにおける腫瘍増殖の遅延[424]から-PPIのアジュバント使用による良好な臨床結果[425]までを報告する様々な研究において証明されている。しかしながら、臨床試験からの報告は現在まばらである。これらのタンパク質はすべての器官系において生理的に重要であるため、副作用の可能性を考慮し、CAIXのような(低酸素に反応して)癌細胞で特異的に発現が増加し、他の場所では豊富に発現していないタンパク質を阻害することに注目が集まっている[426]。もう一つのアプローチであるブロッカーのコンビナトリアル使用は、それぞれの投与量を少なくすることができるため、非腫瘍細胞への望ましくない影響を少なくすることができる。それぞれ異なるABT/CAを標的とする5つの化合物を組み合わせて使用すると、マウスにおける脳腫瘍の細胞内酸性化を抑制し、腫瘍細胞におけるプロアポトーシスマーカーであるカスパーゼ3の活性化を、非腫瘍細胞にはほとんど悪影響を与えず、効果的に抑制できることが明らかになった[427]。興味深いことに、このようなアプローチの効力は、これらの解糖系腫瘍細胞における酸負荷を増加させるグルコース負荷によって増強される[428]。最後に、異なるABT/CAsが異なる腫瘍タイプでアップレギュレートされるため、一般的なアプローチも検討する価値がある。例えば、ABTやCAを特異的に標的とすることが知られていないサリノマイシンなどの多くの抗癌剤も、細胞の酸性化を促進する[423]。
5.6.2.2. 細胞外酸性化の妨害
細胞外酸性化の妨害が食事によって達成されるかもしれないことを示唆する逸話的証拠もある[429]。実際、NaHCO3の経口補給は腫瘍のpHeを上昇させ、マウスにおける転移を阻害することができるが[430]、全体的な結果は複雑であり、最近のある研究では、そのような治療が相反して腫瘍増殖を促進する可能性が示唆されている[431]。しかし、腫瘍供給動脈のカテーテルを介して肝腫瘍に直接供給される化学療法剤(TILA-TACE:targeting intra-tumoral lactic acidosis withtrans-arterialchemoembolization)に補助的にNaHCO3を追加すると、著しく治療成績を改善した[432].要するに、そのような食事と一般的な健康との関連[433]および特定の化学療法薬の安全性を高めるアルカリ化の役割[434]を除いて、食事の酸負荷の低下が転帰を改善することを示すデータは現在不十分である。酸性腫瘍の微小環境はまた、セクション6.6で論じるように、局所的な薬物送達を促進するために利用することができる。
5.6.2.3. 抗腫瘍免疫反応の増強
酸性腫瘍の微小環境は抗炎症性T細胞応答を促進するが(セクション5.6.1参照),AE2の欠失は炎症性T細胞応答を促進する(セクション4.12.1参照).したがって、T細胞AE2の阻害は、細胞傷害性免疫応答を増強するための貴重なパラダイムとなる可能性がある[435]。また、T細胞AE2の阻害は、細胞傷害性免疫応答を増強するための貴重なパラダイムとなり得る。
6.薬物療法におけるpH依存性の側面
6.1.はじめに
このセクションでは、薬物の薬物動態学的特性に対するpHの影響に焦点を当てる。また、特に酸塩基平衡異常と関連する疾患において、これらのpH関連特性をどのように治療に生かすことができるかを検討する。経口ドラッグデリバリーは、薬物を投与するための最も一般的で便利な方法であり、薬物はその標的へ直接到達するか、あるいは循環中に吸収されて意図した標的へ到達することができる。したがって、経口ドラッグデリバリーは、私たちの議論のパラダイムとして機能する。しかし、これらの概念は、ネブライザーの吸入や皮下、筋肉内、静脈内への注射など、他の非経口的な薬物送達方法にも関連するものである。
消化管(GI)pHは、溶解度、溶解速度、安定性、吸収性など様々な特性に影響を及ぼすため、経口薬物のバイオアベイラビリティを決定する主要な要因の1つである。pHはGI管に沿って劇的に変化する[436],[437],[438]。胃の〜1.5から始まり、十二指腸で〜6.0に上昇し、回腸末端で〜7.4に達し、結腸で〜6.7に再び低下する[438]。さらに、これらの値は年齢、食物の有無、疾患、また他の薬物の併用によっても変化することが考えられる[439],[440],[441],[442]。最後に、バイオアベイラビリティに対するpHの影響は、pHが乱れた状態では、過少投与または過剰投与になる可能性があることに留意されたい。
6.2.薬物の溶解度と溶出性に及ぼすpHの影響
ほとんどの薬物は弱酸性・弱塩基性である。薬物のイオン化定数(pKa)と薬物がさらされる環境のpH(以下、環境pH)の関係は、水性区画における薬物の溶解度と溶解速度の重要な決定要因である[443].この関係は、薬物のイオン化形態(すなわち荷電形態)の濃度(I)に対する組合わせ形態(すなわち非荷電形態)の濃度(U)の比率を決定し、Henderson-Hasselbalch方程式で記述される。
弱酸性の薬物(HA、HA⇌A-+H+)の場合、Henderson-Hasselbalchの式は次のようになる。
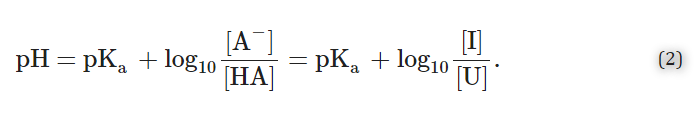
式(2)を並べ替えると、組合わせ型とイオン化型の比率は

したがって、式(3)によれば
- 1.pH<pKa(すなわち、10pKa-pH>1)の場合、組合わせ型U(すなわち、酸性中性型HA)が優勢である。
- 2.pH>pKa(すなわち、10pKa-pH<1)ならば、イオン化形態I(すなわち、共役弱塩基A-)が優勢である。
同様に、弱塩基性薬物(B、BH+)の場合⇌B+H+)の場合、Henderson-Hasselbalch式は次のようになる。
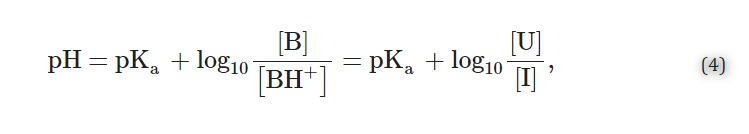
と

さて、式(5)によると。
- 3.pH<pKa(すなわち、10pH-pKa<1)の場合、イオン化形態I(すなわち、酸性の共役弱塩基BH+)が優勢になる。
- 4.pH>pKa(すなわち10pKa-pH>1)であれば、組合せた形U(すなわちBの塩基性中性)が優先される。
このように、イオン化体Iはユニオン化体よりも水溶性が高いため(イオン化体Iと水分子の双極子との間の溶解性が良いため)、弱酸性薬物は高いpHで溶解性が高く、弱塩基性薬物は低いpHで溶解性が高くなるのだ。つまり、弱酸性の薬物は腸で溶けやすく、弱塩基性の薬物は胃で溶けやすい傾向がある。薬物の溶解度はpH依存性であるため、薬物の溶解プロファイル(すなわち、固体薬物が溶液に溶解する過程)もpH依存性である可能性がある[440],[443].薬物の溶解度および溶出は、(i)薬物のpKaを変化させる化学的誘導体化、(ii)遊離の酸または塩基としてではなくイオン形態(塩として)の薬物の投与、または(iii)薬物のpKaとより適合する酸または塩基のアジュバンド使用による環境pHの変化、などいくつかの技術によって強化することができる[444]、[445]、[446]。場合によっては、半減期を延長するために、非経口投与される薬物の溶解度および溶出度を低下させることが望ましいことがある。
次節で述べるように、薬物のpKaと環境pHが薬物のイオン化に与える影響は、薬物の吸収と分布に重要な影響を及ぼす。
6.3.薬物の吸収・分布に及ぼすpHの影響
水系溶媒への溶解度の他に、薬物のイオン化状態は、脂質相への溶解度に影響を与え(例えば、薬物のpKaは、薬物の極性を増加させ、したがって薬物の親油性を減少させるために変更することができる)、したがって、細胞膜を伝染する能力に影響を与えることができる[444],[447]。
受動拡散(すなわち膜貫通濃度勾配が駆動力)が膜を越えて薬物が移動するメカニズムであり、電荷を持たないイオンだけが膜を越えて自由に拡散できると仮定すると、薬物のpKaと環境pHが薬物の吸収と体腔間の分布に及ぼす重要性を説明するために、再びHenderson-Hasselbalch式に注目することができる。上記のポイント1)によれば、Henderson-Hasselbalchの式は、弱酸は酸性環境(例えば、胃の中)で吸収される傾向があることを予測していることに注目されたい。同様に、上記4)によれば、Henderson-Hasselbalchの式は、弱い塩基は塩基性環境(例えば、小腸)で吸収される傾向があることを予測している。
1957年、Shoreと共同研究者は、様々な弱酸性および塩基性薬物の静脈内投与による胃液分泌に及ぼすpKaとpHの影響を説明するために、pH partition hypothesis(1940年にJacobsによって初めて提唱された[448])を提案した[449].彼らの実験結果は、pHの異なる2つの区画(すなわち胃内腔と血液)を隔てるリポイド障壁(すなわち胃粘膜)を越えて薬物が吸収されるという彼らの理論モデルで説明でき、平衡状態にあると仮定した組合された形態にのみ伝染性があることが示された。彼らは、式(3)、(5)を出発点として以下に説明するように、薬物がコンパートメント(胃管と血液)間を移動する程度は、薬物のpKaの値と2つのコンパートメントの環境pH値に依存することを見いだした。
6.3.1. 弱酸性の薬剤の場合
血中薬物濃度([TA]Bl=[HA]Bl+[A-]Bl=[U]Bl+[I]Bl)と消化管薬物濃度([TA]GI=[HA]GI+[A-]GI=[U]GI+[I]GI)の比[I]Bl)と消化管内の薬物濃度の総和([TA]GI=[HA]GI+[A-]GI=[U]GI+[I]GI)の比は
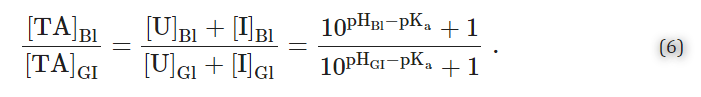
図12Aは、仮想的な弱酸性薬物(pKa=3.4)のGI管(例えば、仮想的なpHGI=1.4の胃)と血液(pHBl=7.4)の間の分布を示したものである。なお、これらの数値は説明のためのものであり、計算を容易にするために選んだものである。この例では、平衡状態において、比[TA]Bl/[TA]GI=(107.4-3.4+1)/(101.4-3.4+1)≅104であることが示されている。このように、pHパーティション仮説は、弱酸性の薬物はより塩基性の区画でより濃縮される(「イオントラップ」)ことを示唆している。つまり、アスピリン(pKa=3.5)のような弱酸性の薬物は、胃から効果的に吸収される可能性があるということである。
図12 薬物分布におけるpHとpKaの影響
pHの異なる2つの水性コンパートメント(GI管はpH=1.4、血液はpH=7.4)間での仮想的な弱酸性薬物(pKa=3.4,panel’A’)と仮想的な弱塩基性薬物(pKa=8.4,panel’B’)の理論的分布。結合型U(パネルAではHA、パネルBではB)のみが膜を通過でき、Uは細胞膜上で平衡化されると仮定すると、パネルAは弱酸性の薬物がアルカリ性区画でより濃縮されることを示している。この結果は、弱酸性の薬物がより酸性の区画からより塩基性の区画へ吸収される傾向があることを示唆している(青い矢印)。パネル’B’は、弱塩基性薬物が酸性区画でより濃縮されることを示しており、弱塩基性薬物が酸性区画では吸収が悪いことを示している(青い矢印)。弱塩基性薬物は実際、胃からの吸収が悪い。GI:消化管、Bl:血液。(この図の凡例における色の参照についての解釈は、読者はこの論文のウェブ版を参照されたい)。
6.3.2. 弱塩基性薬剤の場合
血中薬物濃度([TB]Bl=[B]Bl+[BH+]Bl=[U]Bl+[I]Bl)と消化管薬物濃度([TB]GI=[B]GI+[BH+]GI=[U]GI+[I]GI)の比[I]Bl)と消化管内の薬物の総濃度([TB]GI=[B]GI+[BH+]GI=[U]GI+[I]GI)の比は、以下のとおりである。
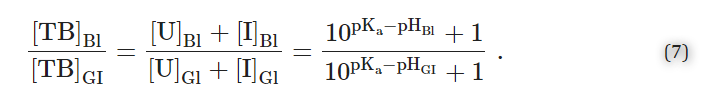
図12Bは、GI管(例えば、pHGI=1.4の仮想的な胃)と血液(pHBl=7.4)の間の仮想的な弱塩基性薬物(pKa=8.4)の分布を示す図である。なお、これらの数値は説明のためのものであり、計算を容易にするために選んだものである。この例から、平衡状態では、比[TB]Bl/[TB]GI=(108.4-7.4+1)/(108.4-1.4+1)≅10-6であることがわかる。このように、pHパーティション仮説は、弱塩基性薬物がより酸性の区画でより濃縮されることを示唆している。つまり、弱塩基性薬物(例えば、プロプラノロール)は胃から吸収されにくく、小腸でより大きく吸収されるはずであるとモデルは予測する(例えば、,pH=6.4)で吸収され、比[TB]Bl/[TB]GI=(108.4-7.4+1)/(108.4-6.4+1)≅0.1であることが示されている。実際には、弱塩基性薬物には別の投与経路が望ましい場合がある。
実際には、pHパーティション仮説は薬物吸収に対する他の実質的な影響を無視しているため、このモデルにはいくつかの限界がある。例えば、このような動的な系では平衡の仮定は非現実的である。さらに、弱酸性の薬物であっても、小腸は内腔表面積が大きいので、実質的に吸収される可能性がある[450]。最後に、pH-partition仮説は、薬物が上皮層を越えて移動するメカニズムについては考慮していない。現在では、電荷を持つ薬物と持たない薬物の吸収と排泄には、経細胞的経路と傍細胞的経路の両方が重要な役割を果たすことが分かっている[451].体内での経細胞的薬物輸送に寄与する低特異性膜トランスポータータンパク質には、有機アニオントランスポーター(OAT)、有機カチオントランスポーター(OCT)、いくつかのMCT、およびP糖タンパク質トランスポーター(P-gp)などのABCトランスポータースーパーファミリーのメンバーなどがある[452],[453],[454],[455],[456].場合によっては、トランスポーター自体がpH感受性であったり、酸や塩基の輸送に結合していたりすることもある。
このような配慮の重要性は、PPI服用者や無胃酸症の患者など、胃のpHが異常に高い個人における弱塩基性薬剤の吸収低下によって例証される[457]。例えば、pH3未満でのみ溶解する弱塩基性抗真菌剤ケトコナゾールの溶解および吸収速度は、酸性の炭酸飲料の同時投与により促進されることがある[457]。バクテリアによる薬物の吸収に関連しているが、NaHCO3のアジュバント使用は、バクテリアからの抗生物質の流出を促すプロトン運動力を妨害することにより、抗生物質の試験管内試験での効力を高めるという例もある[458]。
6.5節で述べるように、薬物の溶解度と経上皮移動の考慮は、腎臓による薬物の尿中への排泄にも影響を与える。
6.4.薬物の安定性に及ぼすpHの影響
経口投与用の薬剤を開発する場合、胃の不利な酸性環境を考慮することが重要である。胃の酸性環境は、薬剤が吸収のために小腸に到達する前に不安定になり、急速に分解される可能性があるからだ。これは、錠剤のコーティングに使用されるポリマーがpHの影響を受けやすいために起こり得ることである。このため、経口薬物送達用のキャリアは、pH感受性と酸性環境での耐久性がテストされる。あるpH値以上でしか溶解しない耐酸性ポリマーは、腸溶性または胃溶性コーティングとして用いられることがある[459],[460],[461],[462].これは、例えば、インスリンの経口投与の場合である[463]、[464]。
6.5.薬物の排泄に及ぼすpHの影響
pHパーティション仮説は、尿のpHが薬物の腎排泄にどのように影響するかを理解するための理論的枠組みを提供する。尿の酸性化は弱塩基性薬物の排泄を促進し(吸収が減少するため)、尿のアルカリ性化は弱酸性薬物の排泄を促進する。たとえば、塩化アンモニウムの投与による尿の酸性化は、弱塩基性薬物であるアンフェタミンの排泄を増加させ[465]、一方、NaHCO3の静脈内投与による尿のアルカリ化は、サリチル酸(すなわち、アスピリン)などの酸性薬物の排泄を促進し、アスピリン中毒などの薬物中毒の管理に役立つ[465]、[466]、[467]。先に考察したように、パーティショニングは薬物分布の1つの側面に過ぎない。多くのOATsとOCTs[468]はネフロン上皮に発現しており、その作用は、薬物を尿中に排泄するために管周囲毛細管からネフロン内腔に送り出すため、また利尿剤(例えば、フロセミド)をネフロン内腔の治療目標に送達するために不可欠である。ネフロン内腔への直接分泌が必要な理由は、多くの薬剤が循環血液中でアルブミンと実質的に結合しており、糸球体でネフロン内腔に効果的に濾過されないからだ。
6.6.標的薬物送達のためのpHを利用する
酸は、胃のような酸性環境や腫瘍のような病的な酸性微小環境での薬物放出に利用することができる。開発中の一例は、アジュバントであるNaHCO3を薬物とともに含む胃浮遊性マトリックス錠で、胃酸との反応によりCO2を生成し、剤形を胃内で浮遊させ、長期間の放出を可能にするものである[469]。もう一つの例は、酸性の腫瘍環境においてのみ細胞毒性化学療法剤を放出することができるミセルのようなpH感受性のあるビヒクルの使用である[470]。同様に、中性pHで実施された試験管内試験スクリーニングで同定された抗癌剤の有用性と、酸性腫瘍微小環境における生体内試験でのその価値との間の不一致が示唆するように[471]、一部の薬剤は循環では不活性であり、酸性環境に到達するまで活性化しない可能性もある。
7.結論
ABTやCAは様々な病態で主要な役割を果たし、潜在的な治療標的の数々を提供するが、その多くは現在、特異的あるいは安全な薬剤を欠いている。エピジェネティック・モジュレーターやその他の遺伝学的ツールを用いてそれらの発現を変化させることは、未開拓の研究分野である。多様な酸障害に対する多くの治療パラダイムの中で、NaHCO3投与が共通していることは興味深いことである。その安価で入手しやすいことから、「製薬業界の敵」と呼ばれている。しかし、多くの限定的な試験で期待されているにもかかわらず、多くの分野でその幅広い有効性を支持する確実な証拠は現在のところない。これはおそらく、サブグループ効果に対する理解の欠如や、試験間の標準化の欠如が原因であろう。しかし、pHバランスの治療上の重要性に関する研究は依然として活発であり、今後数年間でより多くの効果的な治療法を提供することが期待される。
競合する利害関係の宣言
著者らは、この論文で報告された研究に影響を及ぼすと思われる既知の競合する金銭的利益や個人的関係がないことを宣言する。
謝辞
BNQとMDPの研究は、National Institute of Health(NIH) grant R01-EY028580の支援を受けている。ROの研究は、NIH補助金K01-DK107787の支援を受けている。