Contents
The Neurological Complexities and Prognosis of COVID-19
www.ncbi.nlm.nih.gov/pmc/articles/PMC7522181/
要旨
SARS-CoV-2に関連したいくつかの神経学的症状や合併症が、よく知られた呼吸器病理学的症状とともに報告されている。SARS-CoV-2の世界的な活発な感染とその原因不明の特徴により、パンデミックが発生している。2019年12月に中国・武漢から急速に出現して以来、いくつかの研究でCOVID-19の中枢神経系およびPSNへの影響とその意味合いが報告されている。
この包括的なレビュー論文は、COVID-19に関連する中枢神経系と末梢神経系の複合体に焦点を当てた症例報告、症例シリーズ、メタアナリシス、コホート研究、レトロスペクティブ研究、およびナラティブレビューで構成されている。著者らは200以上の論文を検索し、中枢神経系および末梢神経系に影響を及ぼすCOVID-19の神経学的複雑性に関連する52の論文を文献レビューの一部として使用した。
COVID-19患者に認められた主な中枢神経系の症状は頭痛とめまいであり、最も一般的な中枢神経系の症状は嗅覚と味覚の変化であった。PCRでSARS-CoV-2と確認された患者における頭痛・めまい、脳内出血、急性出血性壊死性脳症、髄膜炎・脳炎、脳症、脳血管イベント、化学感覚障害、ギラン・バレー症候群、急性横隔膜炎・急性壊死性骨髄炎の症例も報告されている。また,小児多系統炎症性症候群(PIMS)を発症したPCR確定SARS-CoV-2患者では,神経学的症状の新規発症が認められた。
この包括的なレビュー記事は、臨床医や研究者がCOVID-19に関連する神経学的症状や合併症についての情報を得て、あらゆる年齢層の患者を対象にこれらの症状を治療するための計画を立てるのに役立つであろう。しかし、SARS-CoV2関連の神経学的影響が一次感染によるものなのか、本レビューで議論されている可能性のあるメカニズムに対する二次的反応によるものなのかは不明である。
序論
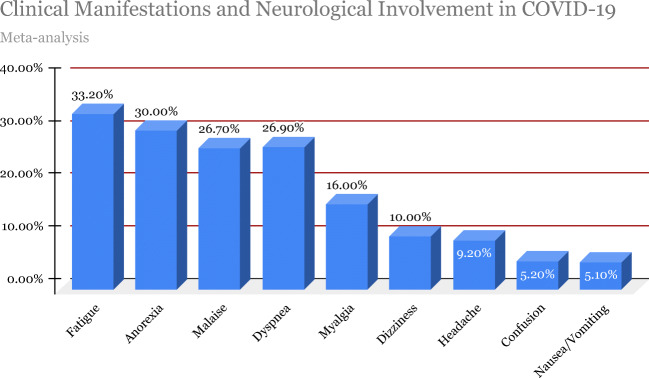
COVID-19は 2019年12月に中国・武漢で最初の症例が報告されて以来、急速に台頭しているRNAウイルスである[1, 2]。2020年3月11日、世界保健機関(WHO)はCOVID-19を200カ国以上に影響を及ぼす世界的なパンデミックと宣言した[1,2]。最初に一般の人々に暴露された時点では新しいウイルスであったため、病気のメカニズムや病態生理についてはほとんど知られていなかったため、COVID-19の発生はすぐに世界的に広がり 2020年3月までにパンデミックにつながった。2020年8月23日現在、世界では現在までに23,057,288人以上の確定症例と800,906人以上の死亡が確認されている[3]。肺および心血管系の合併症はSARS-CoV-2の研究の主役であるが、肺外症例の増加とCOVID-19患者にみられる神経学的な複雑性に注意することは極めて重要である。このウイルスは、既存の健康状態を持つ免疫不全患者に深刻な影響を与え、管理上のさらなる課題と死亡リスクの増加に貢献している[4]。図11は 2020年5月3日までに実施された41の発表研究から、約4700人のSARS-CoV-2患者の臨床症状と神経学的関与の証拠について、システマティックレビューおよびメタアナリシス研究[5]から得られたデータを示している。この包括的なレビューは、文献報告に基づいて、SARS-CoV-2の中枢神経系および神経系の神経学的症状や合併症の可能性のあるメカニズムを特定し、理解することを目的としている。
図1 COVID-19の臨床症状と神経学的関与
方法論
本レビューの著者は 2020年2月から 2020年7月までに発表された関連研究を入手するために、PubMed、Google Scholar、Pubmed Centralなどの電子データベースを用いて徹底的な文献検索を行った。論文の選択は、「コロナウイルス」「COVID-19」「SARS-CoV-2」「メカニズム」「病態」「神経学的顕在化」「神経学的合併症」「中枢神経系症状」「末梢神経系症状」「神経学的徴候・症状」「脳血管障害」「脳症」「ウイルス性脳炎」「髄膜炎」「系統的文献レビュー」「文献レビュー」などのキーワードに依存した。COVID-19に関連する中枢神経系(中枢神経系)および末梢神経系(末梢神経系)の症状や合併症に焦点を当てたレトロスペクティブ研究、症例報告、メタアナリシス、症例シリーズ、ナラティブレビューを網羅した。その後、論文は研究対象への適用性に基づいて分析され、組み込まれた。
COVID-19の神経学的症状と合併症の有無
考えられるメカニズム
COVID-19のほとんどの症例は主に肺合併症を呈しているが、驚くべき数の神経学的合併症が報告されている[4]。COVID-19とその神経学的症状に関する文献分析は、中枢神経系(中枢神経系)末梢神経系(末梢神経系)および筋骨格系におけるそれらの関連症状について報告され、分析されている[1, 4]。COVID-19に感染している間、体は低酸素、炎症、および高凝固状態にある;これらは神経学的および脳血管イベントの可能性のあるメカニズムである[6-8]。重症COVID-19患者はまた、ICU管理を必要とする重篤な肺合併症による間接的な神経学的症状を示すことがある[7]。
低酸素症
COVID-19による重度の呼吸窮迫や肺炎から生じる低酸素は、主に様々な生理的・代償的変化を経て脳に影響を与え、神経学的な症状や病理学的な結果を逐次的にもたらす [2]。低酸素作用は代謝性アシドーシスを引き起こし、さらに乳酸の細胞内蓄積を引き起こし、フリーラジカルを増加させ、神経細胞のATP産生を低下させる[6]。血中酸素の減少は頭蓋内血管の拡張を引き起こし、神経細胞の腫脹、間質性脳浮腫、および損傷をもたらす神経細胞組織液組成の透過性を増加させる [2, 6]。
免疫介在性応答
COVID-19に感染した体内の免疫介在機能は、ウイルスに対する免疫原性反応をもたらし、自傷行為を引き起こす[6]。これは、感染が体内で有意な反応を発生させ、リンパ球、マクロファージ、インターフェロン、インターロイキン、ケモカインなどの炎症性細胞およびサイトカインを増加させるサイトカインストームを産生することを伴う[2, 5, 6, 9]。この圧倒的なサイトカインストーム反応は、最終的に末梢臓器の損傷をもたらし、多臓器不全、神経学的徴候や症状、および死亡率を引き起こす [2, 6]。COVID-19患者はしばしばWBC、好中球、およびCRPが増加しており、これは高血圧や糖尿病などの併存疾患を持つ患者に脳血管イベントの重大なリスクをもたらしている[6]。
高凝固性
COVID-19患者の血液学的プロファイルは、d-ダイマー、フィブリノーゲン、PTの延長、抗トロンビンレベルの低下を伴う高凝固状態を証明している[10-12]。Wangら[11]が実施した症例シリーズ研究では、血栓症の複雑性をまとめたCOVID-19患者の3例が報告され、組織プラスミノーゲンアクチベーター(tPA)で管理された場合に一過性の症状改善を示した。さらに、COVID-19患者の呼吸不全は、剖検報告書に微小血栓を示し、急性呼吸窮迫症候群(ARDS)の典型的な所見ではなく、原血栓性閉塞性の病因が確認された[11]。この症例シリーズでは、死亡に至った症例の71.4%が国際血栓症・血栓止血学会(ISTH)の播種性血管内凝固(DIC)基準を満たしていたことも報告されている[11]。COVID-19のプロトロンボティクスの複雑性は、DICを発症する可能性のある患者の閉塞性脳血管イベントに寄与している可能性がある[11,12]。抗凝固薬治療は、COVID-19関連凝固症において静脈血栓塞栓症のリスクを減少させ、予後を改善することが示されている[13,14]。
アンジオテンシン変換酵素II
SARS-CoV-2 ウイルスは、主に肺胞細胞内に存在するアンジオテンシン変換酵素(ACE)II 受容体を介して細胞内に侵入する;この受容体はまた、消化管、心臓、および脳の血管内皮細胞の肺外にも存在し、血流を調節する血管収縮剤として機能する [15,16]。ウイルスはACE II受容体を介して脳に侵入し、血管内の血流と調節に障害をもたらし、動脈の破裂を引き起こす可能性がある[15,17]。ACE IIは、強力な血管収縮因子0であるアンジオテンシンII(Ang II)を調節し、血管拡張作用を発揮する内皮および血管保護作用を有する[6, 18]。COVID-19感染はACE II受容体の発現を低下させ、血管保護作用を低下させる可能性がある[6, 18]。COVID-19に感染した被験者は、肺損傷の重症度およびウイルス負荷と正の相関を示すAng IIレベルの上昇を示した。Ang IIはさらに炎症性免疫応答を刺激し、アテローム性動脈硬化に寄与している[6, 15]。
トランスシナプス伝達
SARS-CoV2の中枢神経系への侵入に関するデータの進展は、類似のCoVについても報告されており、シナプスを介したトランスシナプス転移[16,19]を示唆している;中枢神経系への侵入はシナプスによってさらに中枢神経系に転移する[16]。SARS-CoV34またはMERS-CoV13を発症したマウスを用いて行われた予備的な試験では、ウイルスは嗅神経から篩状板やエツモイド骨を介して侵入し、脳幹や視床などの中枢神経系に局在する可能性が示された[16, 17]。肺外中枢神経系感染はマウスで記録された死亡率の重要な構成要素であることも指摘されている[16]。
中枢神経系関連の症状
COVID-19患者における中枢神経系(中枢神経系)関連の発生は、頭痛、めまい、痙攣、意識低下、運動失調、脳血管事故(虚血性または出血性)せん妄、急性壊死性脳症(ANE)急性脳炎、および/または髄膜炎である[1,8,20]。これらの徴候や症状の中で、頭痛とめまいが最も優勢な中枢神経系の症状であった [1]。
頭痛とめまい
2020年1月1日から 2020年2月23日までに実施されたCOVID-19の臨床、検査、画像診断の特徴に関するメタアナリシスでは、頭痛が中枢神経系症状の優勢であり、平均有病率は8%であったと報告されている[21]。
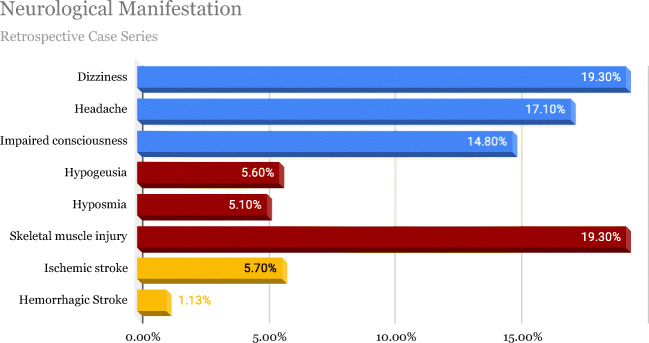
2020年1月16日から 2020年2月18日まで中国の武漢で実施されたレトロスペクティブな観察的症例シリーズでは、患者の36.4%が神経学的症状を呈しており、そのうち24.8%が中枢神経系症状、8.9%が末梢神経系症状であり、重度の呼吸器疾患を有する患者に多くみられたと報告されている[22]。中枢神経系症状群では、めまいが16.8%、頭痛が13.1%であった[22]。この研究ではまた、神経学的症状を呈した被験者は平均年齢52.7歳の高齢者であり、主に高血圧などの併存疾患を有すると結論づけている[22]。図22は 2020年1月16日から 2020年2月19日までに中国・武漢で行われた214人の患者から得られたこのレトロスペクティブで観察的な症例シリーズから得られたデータを示している[22]。
図2 神経学的症状
COVID-19を確認した1099例の別の症例シリーズ研究では、13.6%が頭痛を報告し、14.9%が筋肉痛を報告した[7]。頭痛は低酸素に二次的に起因し、脳血管系への血流低下を引き起こし、炎症性メディエーターやサイトカインに対する身体の反応を引き起こすと考えられている[17]。
Wang and Leiら[5]は、COVID-19に関連する神経学的症状に関する41以上の発表論文から、4700人近い被験者を対象としたシステマティックレビューとメタアナリシスを実施した。代表的な症状としては、疲労(33.2%)食欲不振(30.0%)倦怠感(26.7%)呼吸困難・息切れ(26.9%)筋肉痛(16.0%)めまい(10.0%)頭痛(9.2%)錯乱(5.2%)および吐き気・嘔吐(5.1%)が挙げられる[5]。図22は 2020年5月3日までに実施された41件の発表研究から、約4700人のSARS-CoV-2患者の臨床症状と神経学的関与の証拠について、このシステマティックレビューおよびメタアナリシス研究から得られたデータを表示している。
脳血管イベント
イタリアのCOVID-19患者に焦点を当てた研究では、感染が確認された患者が入院し、静脈血栓塞栓症予防薬が投与されたにもかかわらず、虚血性脳卒中が2.5%増加したことが示された[4]。また、中国では感染が確認されて集中治療室に入院したCOVID-19患者では虚血性脳卒中が5%増加し、オランダでは3.7%増加していた[4]。さらに、COVID-19に感染した若年者では虚血性脳卒中の兆候がみられた[4]。最後に、感染症や高凝固状態など、高齢の患者におけるあらゆる併存疾患は、虚血性脳卒中のリスクを増加させる可能性がある[4]。
SARS-CoV2は内皮細胞上のACE2受容体に結合して大規模な炎症反応を引き起こし、血管収縮を増大させ、末梢臓器の損傷と脳卒中を引き起こすことが明らかになっている;ACE2組換え療法はCOVID-19に関連した脳卒中の潜在的な治療法である[9]。
Brüggemannらによる症例報告[23]では、COVID-19が陽性であった59歳の男性患者の動脈血栓塞栓および静脈血栓塞栓イベントが報告されている。この患者は末梢動脈疾患の既往歴があり、肺症状(呼吸困難、胸痛、咳)発熱、頻脈、頭痛を伴ってEDに来院した[23]。頻脈、胸痛、d-dimerの上昇の徴候から肺塞栓症(PE)の疑いが高いため、CT肺血管造影(CT-pulmonary angiography: CTPA)がオーダーされたが、これは除外され、さらに画像検査でCOVID-19肺炎の印象が示された[23]。COVID-19はRT-PCRで確認された [23]。5日目には、患者は脳卒中様症状を発症しており、CTによる脳の画像診断では結論が出なかったにもかかわらず、血流および血管量の記録により確認された。さらなる管理として、治療にはアルテプラゼ、予防にはクロピドグレルとナドロパリン(LMWH)が用いられた [23]。治療にもかかわらず、7日目に多発性肺塞栓症が発症し、入院中に3回目のCTPAで確認された [23]。この患者は、PEのためにティンザパリン(LMWH)でさらに治療的に管理された [23]。
脳症
COVID-19の故人113人の臨床的特徴について、中国・武漢で1月13日から 2020年2月12日までに実施されたレトロスペクティブな症例シリーズでは、意識障害(22%)や低酸素性脳症(20%)などの中枢神経系症状が報告されている[24]。この研究では、死亡した被験者の年齢は中央値68歳で、慢性高血圧(48%)および他の心血管疾患(14%)の併存疾患を有していた [24]。
Filatovら[25]は、COVID-19に関連した脳症の症例を報告した。対象者は、最近ヨーロッパから米国に渡航した74歳の男性であった[25]。患者は当初、咳と発熱を訴えてEDに来院し、COPD、心房細動、および脳卒中の既往歴を有していた [25]。退院前に患者はCOPDの増悪を経験しており、それに応じて管理されていた [25]。初期症状が悪化して入院に至った;再入院時に頭痛と精神状態の変化という新たな中枢神経系の症状が認められた [25]。溶連菌性肺炎とインフルエンザの検査では結論が得られず、CXR検査では地上硝子体混濁が認められ、COVID-19肺炎と一致していた [25]。被験者の神経学的経過は重度に進行し、言語コミュニケーションの障害と命令に従うことができない状態になった [25]。患者はSARS-CoV-2陽性であった [25]。CTスキャンによる脳画像診断では、左後大脳動脈の脳卒中の既往歴と一致しており、急性期の変化は認められなかった [25]。脳波の読影は脳症と一致しており、びまん性の徐波と焦点性の徐波を示していた[25]。肺の状態も悪化し、ICUへの入院と挿管を促した [25]。症状の管理には、ヒドロキシクロロキン、抗ウイルス薬、抗生物質が含まれていた [25]。脳症の治療は主に支持療法であり、大多数の被験者は全回復または部分的に回復している [8]。
髄膜炎/脳炎
2020年2月下旬にCOVID-19関連髄膜炎の最初の症例が報告された[26]。この患者は、発熱、疲労、頭痛、咽頭痛などの進行性のインフルエンザ様症状を有していた[26]。検査結果が陰性であったにもかかわらず、この患者はインフルエンザと診断され、治療を受けた。9日目までに、意識変化と全身性けいれんを呈して病院に運ばれた [26]。この患者はまた、鼻腔硬直を呈していた。鼻咽頭スワブでは好ましくない結果が得られたが、脳脊髄液のRT-PCR検査ではCOVID-19が陽性であった [7]。脳画像の印象では、海馬領域と右中隔葉の脳炎の特徴が示された [7, 26]。髄液スクリーニングでは単純ヘルペスウイルスや水痘帯状疱疹抗体は検出されなかった[26]。COVID-19によって引き起こされる神経学的症状は、どの年齢層にも影響を及ぼす可能性がある。SARS-COV2感染は、免疫系に障害を与え、ウイルスの神経栄養能力を高めるいくつかのサイトカインの発現をもたらすことがパターンとして示されている[27]。伴う症状にはせん妄、精神病、およびミオクローヌスが含まれる;レベチラセタムおよびクロナゼパムが、付随するミオクローヌスの治療に使用されることがある[8]。ハロペリドール、次いでリスペリドンが精神病の改善を示している。[8]
急性出血性壊死性脳症
中枢神経系に関与するもう一つの合併症は急性壊死性脳症(ANE)であり、これはサイトカインストームによって引き起こされるまれな疾患であり、ウイルスの侵入を伴わずに血液脳関門が破壊される [7, 28]。重度のCOVID-19症例の中には、サイトカインストーム症候群、ひいてはANEを呈した患者もいた [7]。ANEは主に小児患者に影響を与えるが、COVID-19の成人患者にも症例が認められている[28]。頭部の非造影CT(コンピュータ断層撮影)では、視床、大脳白質、脳幹、小脳に感染領域を有する対称性の多焦点性病変が認められた [28]。ANEの病態生理はよく理解されておらず、免疫グロブリン(IVIG)の静脈内投与やステロイドによる治療が可能である[28]。
Poyiadjiらが行った症例研究[29]では、50代後半の女性患者に急性出血性壊死性脳症(ANE)を発症した症例が報告されている。初期症状は発熱、咳、精神状態の変化(AMS)を含み、インフルエンザ検査では陰性であった[29]。陰性の後、SARS-CoV-2 の鼻咽頭スワブの投与が必要とされ、RT-PCR による診断が確認された [29]。HSV、VZV、ウェストナイルなどのウイルス検体に対する脳脊髄液のさらなる検査では、結論は得られなかった。SARS-CoV-2の脳脊髄液分析は完了しなかった [29]。脳画像検査では非造影頭部CTとMRIが施行され、CTでは内側視床の両側内側に対称性の減弱を示し、MRIではその領域内の出血性リム増強病変と側頭葉を呈した[29]。この患者はさらにIVIGで治療・管理された[29]。
脳内出血
COVID-19患者における脳内出血の病態は、SARS-CoV-2が内皮細胞上のACE2受容体に結合することによって最もよく理解されている。この結合はACE2受容体の破壊をもたらし、血液脳関門の完全性を根本的に損ない、ウイルスが中枢神経系に侵入することを可能にする [7, 30]。さらに、ACE2受容体の発現低下はレニン・アンジオテンシン系(RAS)に悪影響を与え、中枢神経系および末梢神経系系の調節を複雑にし、血圧の調節に影響を与え、潜在的に脳内出血を引き起こす可能性がある[7, 30]。
Sharifi-Razavらによる症例報告[15]は、COVID-19が確認された患者の脳内出血の相関関係をまとめたものである。79歳の男性が意識消失を訴えてEDに来院し、COVID-19陽性と診断された[15]。脳のCTスキャンで脳室内出血とくも膜下出血が確認された [15]。高血圧や抗凝固療法など、脳内出血の素因となる基礎疾患はなかった [15]。COVID-19に感染した患者では、大血管閉塞や梗塞、静脈血栓塞栓症、炎症マーカーの上昇、脳を含む臓器不全を伴う重度の全身性炎症の報告が驚くべき割合で発生している[31]。医師は、血栓症のリスクと出血のリスクを考慮して抗凝固療法の投与を決定しなければならない[31]。
Bengerらが実施したレトロスペクティブな症例シリーズ[30]では 2020年2月1日から 2020年5月14日までの間にキングス・カレッジ病院でCOVID-19に関連した5例のICHが報告されている。5人の被験者全員が鼻咽頭スワブを採取し、RT-PCRでSARS-CoV-2を確認した。患者の年齢は41~64歳で、4人は高血圧を中心とした基礎疾患を有していた[30]。すべての患者で、SARS-CoV-2 の最初の診断から ICH 発症までの期間は中央値で 32 日間であった [30]。また、4名の患者ではICH発症前に多臓器に浸潤していた [30]。これらの患者はICUで管理され、リハビリテーションのために脳卒中ユニットに移された[30]。
末梢神経系関連の症状
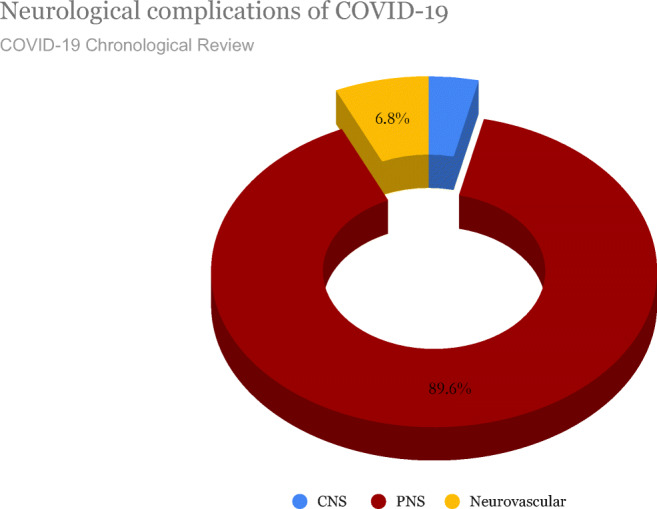
末梢神経系(末梢神経系)に関与するCOVID-19患者における合併症には、無感覚、意識障害、ギラン・バレ症候群(GBS)急性骨髄炎、骨格筋損傷、血球貪食性リンパ組織球症(HLH)および/またはミラー・フィッシャー症候群が含まれる [4,8,22]。図33は、41の論文の時系列レビューから得たSARS-CoV-2確定症例630例の中枢神経系および神経系に影響を及ぼす神経学的症状を示している[32]。630例のうち、23例(3.6%)が脳炎、脳症、および脊髄炎を含む中枢神経系に関連した症状を発症した [32]。合計564人(89.6%)が無神経症、ギラン・バレー症候群、頭蓋神経麻痺、ミラー・フィッシャー症候群などの中枢神経系症状を発症した。43人(6.8%)が神経血管症状(脳卒中)を発症した [32]。末梢神経系症状のある被験者の合計549人(87%)が嗅覚の変化(無嗅覚/嗅覚過敏症)を経験した [32]。
図3 COVID-19患者で観察された中枢神経系、末梢神経系、神経血管合併症の割合
化学感覚障害
末梢神経系の徴候や症状のうち、化学感覚障害である無嗅覚(嗅覚障害)と加齢臭(味覚障害)が最も優勢な末梢神経系症状であった[1, 22]。無嗅覚は、嗅神経の炎症により毛様受容体細胞が劣化することで起こると考えられている[17]。味覚の変化(低味覚/ageusia)は、舌上に発現しているACE2受容体が大きく、ウイルスからの結合後に味覚受容体にダメージを与えることに起因すると考えられている[17]。
COVID-19感染が確認された630人を対象とした研究では、564人(89.6%)が無神経症、ギラン・バレー症候群、頭蓋神経麻痺、ミラー・フィッシャー症候群などの末梢神経系関連症状を発症した [32]。これらの末梢神経系合併症を有する患者のうち、449人(87%)の患者が経験した唯一の症状は、無嗅覚(嗅覚の喪失)または低嗅覚(嗅覚の低下)であった [32]。嗅覚および味覚の変化を発症した被験者の大部分は、生命を脅かすような肺または他の神経学的特徴を伴わない孤立した症状であったため、入院を必要としなかった[32]。図33は 2020年2月から 2020年5月までに神経学的合併症を発症したCOVID-19患者630例の確認された41件の論文の時系列レビューから得られたデータを示し 2020年7月1日にここに報告する[32]。
Ganeらによる症例報告では、先行症状も随伴症状もなく72時間にわたって突然出現した無呼吸症を発症した48歳男性が報告されている[33]。この患者は医療従事者であり、基礎疾患を有していることは知られていなかった [33]。患者は2日後にRT-PCR検査でSARS-CoV-2陽性と判定された [33]。患者は6日後も肺または他の肺外関連の症状がなく、徐々に回復すると予想されていた [33]。著者らはこの症例を「孤立性突然発症性無呼吸症(ISOA)」と呼んでいる[33]。
においや味覚に影響を与える末梢神経系症状は世界的に頻繁に報告されており、専門家協会であるAmerican Academy of Otolaryngology-Head and Neck Surgery(AAO-HNS)は、これらの徴候や症状をSARS-CoV-2感染の可能性のスクリーニングに用いることを推奨している[7]。
ギランバレー症候群
2020年1月23日にCOVID-19関連GBSの最初の症例が記録された[34]。61歳の女性が下肢に進行性の両側性脱力症を呈した[34]。この患者は中国の武漢に旅行しており、その4日前に帰国していた;神経疾患の経過は徐々に悪化しており、神経伝導検査を行ったところ、脱髄性神経障害をさらに支持し、GBSの診断とIVIGによる治療を示唆していた[35]。最近中国の武漢に旅行した後に呼吸器症状を発症したため、SARS-CoV-2のRT-PCR検査を行ったところ、陽性であった [34]。
最近の中国の研究では、COVID-19症状の発症後に神経症状を発症した5人の患者でGBSが報告された [7]。呼吸不全のために機械的換気を必要とする重篤な疾患経過が報告されている[7]。さらに、何人かの患者が、ウイルスや細菌による呼吸器感染や消化管感染の後に現れる対称性上行性麻痺(GBS)の徴候を示している[32]。COVID-19感染が確認された患者では、COVID-19への暴露後5~14日後に対称性上行性麻痺を呈し、症状を呈し、数人の患者では呼吸不全を来した[32]。IVIGによる治療はGBS症状の解消に成功したが、呼吸不全の患者はIVIG治療に反応せず、予後が悪かった [35]。
急性横紋性骨髄炎|急性壊死性骨髄炎
COVID-19に関連した急性横隔膜炎および急性壊死性骨髄炎の病因として提案されているのは、サイトカインストームによるものである可能性が高いと考えられている[36]。
Munzら[37]が行ったCOVID-19に関連した急性横隔膜炎の症例研究が報告されている。この病院では、60歳の患者が呼吸器疾患を呈し、RT-PCR検査でSARS-CoV2口咽頭スワブが陽性であることが確認され、支持療法で管理された[37]。退院後3日後に進行性の神経学的障害が発現した;症状には膀胱機能障害および両側部の下肢障害が含まれていた [37]。数日後、症状は上部運動ニューロン病変症状(痙性麻痺、Babinski陽性)へと進行した[37]。脊椎画像検査では急性横隔膜炎を示す印象が示され、フォローアップMRIで確認された[37]。急性横隔膜炎の患者は、脊髄の腫脹の可能性があり、T2シーケンス上では脊髄中央部の領域に影響を及ぼし、コントラストの増強が変化することがある。この症例報告では、メチルプレドニゾロンによる治療後に病状が著しく改善した[37]。
Sotocaらによる症例報告[36]では、咳と発熱の8日後に神経学的症状を呈した69歳の女性患者が報告されている。症状には、頸部の疼痛、バランス障害、脱力感、左手のしびれが含まれていた [36]。入院時の神経学的検査では、上部運動ニューロン病変(UMN)が認められた [36]。自己免疫、ビタミン、感染症などの診断検査では、原因は不明であった [36]。MRIによる脳画像検査では変化は認められなかったが、脊髄画像検査では、髄質からC7までのT2強調のびまん性パッチ状の増強病変が印象的であり、急性横隔膜炎を示唆した[36]。この患者は、鼻咽頭スワブのRT-PCRによりCOVID-19が確認された [36]。患者は当初、メチルプレドニゾロンの静脈内投与で管理されていたが、5日目までに症状が徐々に悪化した [36]。びまん性のパッチ状の増強性病変がC7からT6へと進行し、新たに脊髄のT1中心壊死が発生した[36]。血漿交換療法を追加することで管理がさらに強化され、症状は徐々に改善していった [36]。
骨格筋の損傷
COVID-19感染に関連した筋骨格系の合併症は、骨格筋損傷および筋痛の証拠を示している[20]。COVID-19患者における筋痛の驚くべき増加がパンデミックしており、感染の重症度に直接関係している[39]。Hanらによる研究[40]では、22~70歳の成人患者の52%(13/25)が筋痛と疲労の症状を報告しており、成人で最も優勢な症状であることがデータから示唆された。25人の成人患者のうち、9人(36%)が基礎疾患である糖尿病を有し、7人(28%)が高血圧症を有していた[40]。さらに、COVID-19の重症および軽症の感染症では、患者はクレアチニンキナーゼ(CK)の高値を呈していた[20]。さらに、治療を受けたCOVID-19患者では、その後のウイルス負荷の低下とともに、筋肉痛の症状緩和がみられた[39]。
小児における神経学的症状
小児多系統炎症性症候群
Abdel-Mananらが行った症例シリーズ[41]では、小児におけるCOVID-19小児多系統炎症性症候群(PIMS)に関連した神経学的症状が報告されている。この症例シリーズには、脳画像検査により、脳梁状髄質脾臓に変化が観察された4人の被験者が含まれていた[41]。この患者はまた、SARS-CoV-2 PIMSの管理のためにICUへの入院を促した。被験者は、鼻咽頭スワブからのCOVID-19のRT-PCRが確認された18歳未満、またはSARS-CoV-2のIgG陽性で 2020年3月1日から 2020年5月8日までの間に神経学的症状を呈した場合に研究に含まれた[41]。神経学的症状の発症は、神経障害の基礎疾患の既往歴や以前の症状がなかったため、4人の被験者にとっては新たなものであった[41]。神経学的症状には、頭痛、筋力低下、反射神経の低下が含まれていた[41]。脳症や脳幹・小脳形質などのより重篤な症状も観察された。興味深いことに、4人の患者はすべて、疾患の経過および研究期間中、肺に関連する徴候および症状を示さなかった[41]。4人の被験者全員が神経学的に症状の改善を示し、2人は完全に回復した[41]。
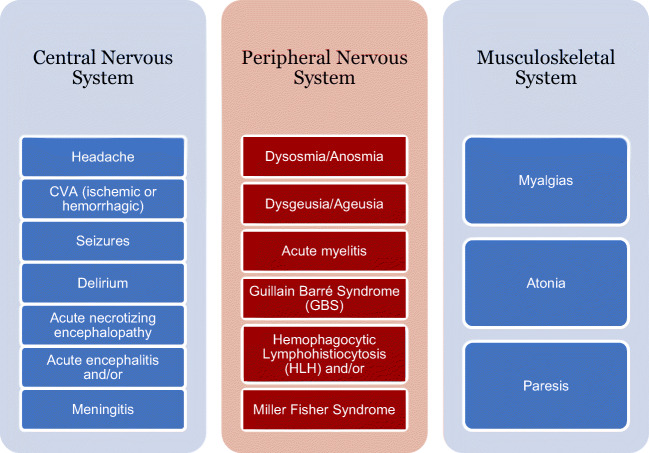
図44は、COVID-19患者で報告されたすべての神経学的合併症を示している。回復したCOVID-19患者において、これらの病態生理的症状が長期的な神経学的合併症を有するかどうかを評価することが重要であろう。
図4 COVID-19患者で報告された神経学的合併症の概要
議論
COVID-19は、β-コロナウイルス科(コロナウイルス)の7番目に新しく加わったウイルスであり、エンベロープされた一本鎖のポジティブセンスRNAウイルスである。中枢神経系の神経障害を引き起こすメカニズムは多岐にわたっている [7]。中枢神経系および末梢神経系の損傷を引き起こすのに関与する多様なメカニズムにもかかわらず、COVID-19の最も同定可能な病態生理学は、ACE2受容体の直接的な破壊、サイトカイン誘発性傷害、低酸素症、および高凝固性を含む[6, 7]。
COVID-19は炎症反応を引き起こすと考えられており、血液脳関門を弱め、ウイルスが中枢神経系に侵入することを可能にしている;脈絡叢の血液-脳脊髄液関門もまた、この炎症反応の間に弱められる [5];これは内皮細胞のACE2受容体の破壊を介して達成される [5, 9, 16, 17, 42]。ACE2受容体の発現は、心臓、腎臓、小腸、精巣、脳、および肺でも認められている;発現のレベルは部位によって異なる [18, 19, 43]。COVID-19の内皮細胞への結合は、TNF-α、およびインターロイキン6(IL-6)などの炎症性メディエーターの増加を引き起こす大規模な炎症反応を誘導する[44]。IL-6はCRP、アミロイド、フィブリノーゲンなどの急性期反応物質を合成する。フィブリノーゲンのレベルの上昇は、体内での高凝固状態を誘発する。ACE2受容体は肺上皮組織に存在するため、COVID19患者では明らかに肺胞の直接的な損傷により低酸素状態が観察される[18, 42]。COVID-19の中枢神経系への侵入には、血行性の伝播と逆行性の伝播という2つの経路があると推定されている[9]。脳内出血は、SARS-CoV2がACE2受容体に結合してACE2受容体の発現を低下させ、その結果、バリアが弱まり、血圧の調節に影響を与えることによると考えられる[7]。それにもかかわらず、SARS-CoV-2の逆行は嗅覚管を介した逆行であり、味覚や嗅覚の変化として現れる化学感覚障害の原因であると考えられている[9, 44-46]。
SARS-CoV-2の予後予測値とバイオマーカー、および中枢神経系および神経系への影響は、年齢、併存疾患、免疫力、および疾患の重症度によって被験者によって異なる。SARS-CoV-2は炎症反応の過剰活性化、高凝固性の亢進、抗凝固性プロセスの低下を介してそのメカニズムを発揮するため、炎症性マーカーおよび凝固検査は予後を予測する可能性がある[47]。Liuらが行った研究[47]では、従来の血液学的解析で凝固パラメーターを検討した結果が報告されている;プロトロンビン時間、フィブリン分解産物(FDP)d-ダイマー(DD)は、COVID-19が確認されたICU対象者の死亡率が上昇した人の予後を予測するバイオマーカーとして機能した。この研究ではまた、アンチトロンビンIII(ATIII)がICU患者の生存率増加のバイオマーカーとして報告されており、PT、DD、FDP、ATIIIが予後予測因子であると結論づけられている[47]。
炎症性マーカーであるインターロイキン-6とC反応性タンパク質の予後予測値は、COVID-19の疾患重症度についての洞察を提供する可能性もある[48]。Liuらが実施したCOVID-19確定症例140例を対象としたレトロスペクティブ研究[48]では、被験者の血清中のインターロイキン-6(67.9%)およびC反応性蛋白(65.0%)の値が上昇しており、炎症性マーカーの値は疾患の重症度と相関しており、それぞれ32.1pg/mLおよび41.8mg/Lを超える値は、より重篤な疾患状態を示していることが示された。インターロイキン-6およびC反応性蛋白は、COVID-19患者における炎症反応の悪化および高凝固性の主役であると予測されているため、患者の予後を予測するための個々の決定因子として利用される可能性がある [48]。
高凝固性から生じる可能性のある神経学的合併症のうち、脳血管疾患、虚血性脳卒中、および出血性脳卒中は依然として重大な懸念事項である。適時の管理は生存率を高め、長期的な影響を減少させる良好な予後をもたらす可能性がある[10]。Wangらによって報告された症例シリーズ [11] では、組織プラスミノーゲンアクチベーター(tPA)による治療を受けた患者に一過性の改善がみられたが、治療を中止すると治療効果は薄れていくことが示されている。以前の研究に基づき、COVID-19は血小板および凝固カスケードを活性化することが理解されている[9]。したがって、高凝固性の結果として神経血管疾患を発症した場合の予後は、速やかに投与される血栓溶解療法に大きく依存しており、深く考慮されるべきである[9]。
Carfìらによる研究[49]では、平均年齢56.5歳の少数の被験者で持続的な神経学的症状が報告されている。疲労(53.1%)呼吸困難(43.4%)関節痛(27.3%)胸痛(21.7%)が一般的に報告されているが、神経学的症状の長期予後を示唆する研究は限られている[49]。高齢者患者の44.1%がQOLの低下を報告しており、これが中枢神経系関連の目的によるものか末梢神経系関連の目的によるものかは確認されていない[49]。長期予後に関しては、この脆弱な集団においてCOVID-19の副作用が長引くことで合併症が生じる可能性があるという仮説が立てられる[49]。SARS-CoV-2パンデミックの長期予後を決定するためには、プロスペクティブな追跡分析調査が極めて重要である[8]。
世界の死亡者数と比較したCOVID-19の症例数は、このウイルスに感染した患者の大多数が病気から回復することを反映している[50]。しかし、COVID-19の死亡者数が著しく多いことは懸念材料である。臨床検査で見られる主要なバイオマーカーを評価することで、発症後に起こりうる潜在的な合併症を予知することができ、予後と転帰を予測することができる[50]。リンパ球数の減少、好中球対リンパ球比(NLR)の著しい増加、血小板数の減少、d-ダイマー、PT、LDH、ALT、およびASTの増加は、予後不良を反映しており、疾患の重症度および死亡率の増加につながる可能性がある[50]。
神経変性疾患は、典型的には60歳以降に発症する症状の遅発性である。SARS-CoV-2が神経変性疾患の進行、重症度、または早期発症と関連しているかどうかを予測するには、現時点では時期尚早である。COVID-19とこの年齢層の神経細胞の複雑性との関連性を系統的に検討した結果、中枢神経系に侵入したウイルス粒子が、感受性の高い個体で発生する炎症過程に相加的な影響を与える可能性があるという仮説が立てられた。アルツハイマー病やパーキンソン病などの神経変性疾患とCOVID-19との間に関連性があるかどうかについては、さらなる研究が必要である。
制限事項
この文献レビューでは、COVID-19の神経学的症状と合併症に焦点を当てており、複数の併存疾患を持つ患者ではCOVID-19の予後が悪いこと、情報の多くが症例報告に基づいているため患者報告数が少ないこと、バイアスがかかる可能性があることなど、いくつかの制限がある。神経学的症状が一次感染として発生しているのか、それとも全身的な原因による二次的な特徴として発生しているのか、あまり明確ではない。COVID-19に関する研究が急速に台頭しているため、既存の知見をさらに裏付けるためには、より多くのデータが必要である。
結論
この論文では、著者らは200以上の論文の文献レビューを行い、COVID-19に関連する中枢神経系および末梢神経系に関連する症状および合併症の52論文を使用した。この文献レビューでは、複数の研究がCOVID-19患者における神経学的所見の存在を確認しており、一般的な症状としては、頭痛、めまい、味覚・嗅覚の変化、脳症、脳炎、GBS、脳血管疾患、および素因のある患者における骨格筋損傷などが挙げられる。これは衰弱性のために生活の質に影響を与え、死亡率の大きなリスクを伴う。
基礎となる健康状態のある患者は、合併症のない患者に比べて SARS-CoV-2 に感染しやすく、高血圧患者は神経学的症状を発症しやすいことが示されている。COVID-19に感染して神経学的症状を示した患者集団の中で、小児もまた症状が発現しやすいことが示された。小児の治療成績は、高齢者集団と比較して、回復の点で非常に有望であった。実際、小児は基礎となる併存疾患をほとんど持たず、神経学的症状が発現している間は肺症状を発症しなかった。神経学的発現はPIMSの二次的なものであった可能性がある。COVID-19パンデミックが進行し、肺外症例および神経学的症例が増加していることから、疾患発現、治療、および転帰をよりよく理解するためには、さらなる研究および発表された論文が非常に重要である。COVID-19および神経学的症状および合併症に関する系統的な文献レビューを通して、兆候および症状が主にアンジオテンシン変換酵素(ACE)IIを介してCOVID-19が中枢神経系に侵入したことによるものなのか、あるいは低酸素、高凝固性、または全身性炎症反応に続く事象によるものなのかは完全には明らかになっていない[32]。
COVID-19は世界中の個人に影響を及ぼしており、この衰弱性ウイルスの急速な広がりを制御するために、世界的な公衆衛生対策が求められている。COVID-19のさらなる拡散を防ぐために予防措置をとることは、集団的な義務である。隔離、検疫、フェイスマスクの着用、手洗い、社会的距離を置くことによる疾病予防は、コミュニティ内でのCOVID-19の拡散を防ぐために不可欠な公衆衛生対策である。
